-
Medical journals
- Career
Doporučené léčebné postupy pro psoriatickou artritidu
Authors: J. Štolfa; J. Vencovský; K. Pavelka
Authors‘ workplace: Revmatologický ústav Praha
Published in: Čes. Revmatol., 24, 2016, No. 4, p. 142-152.
Category: Recomendation
Overview
Od publikace posledních doporučení pro léčbu a sledování psoriatické artritidy Českou revmatologickou společností v r. 2011 uplynulo 5 let [1]. Od té doby došlo k rychlému vývoji nových poznatků o všech aspektech psoriatické nemoci, zejména pokud jde o extraartikulární manifestace (entezitidy, daktylitidy) a o komorbidity (zejména metabolický syndrom a kardiovaskulární onemocnění). S určitým zpožděním proti revmatoidní artritidě se pozornost soustředila i na novou strategii léčby se zaměřením na časné zahájení léčby a stanovení léčebného cíle. Současně probíhá intenzivní výzkum nových biologických originálních léků (boDMARDs) s jiným mechanismem účinku než inhibice TNFα (inhibitory p40 podjednotky IL-12/23-ustekinumab a inhibitorů IL-17-secukinumab, ixekizumab), malých molekul pro perorální použití (inhibitor fosfodiesterázy 4-apremilast, inhibitor JAK – tofacitinib) a v neposlední řadě přicházejí na trh i biosimilární biologické léky (bsDMARDs). To vyvolalo nutnost aktualizovat v návaznosti na podobnu aktualizaci EULAR i Doporučení České revmatologické společnosti.
Klíčová slova:
Psoriatická artritida, entezitida, daktylitida, léčebná doporučení, strategie léčby, indexy aktivity, léčba k cíli, biologická léčba PsA, časná léčbaÚvod
Psoriatická artritida (PsA) je onemocnění, které zahrnuje více klinických manifestací než jen postižení kloubů (artritida) a kůže (psoriáza). Týká se to entezí (entezitida), difúzního zánětu celého prstu (daktylitida) a axiálního skeletu sakroiliitida/spondylitida). Proto se v poslední době hovoří o „psoriatické nemoci“ (spíše než jen o „psoriatické artritidě“). V souvislosti s touto heterogenitou byla v r. 2012 publikována nová klasifikační kritéria CASPAR (ClASsification criteria for Psoriatic ARthritis) (Tabulka 1) umožňující stanovení diagnózy jak časné, tak etablované psoriatické artritidy s vysokou specificitou a senzitivitou [2].
V popředí zájmu revmatologů v současné době je nová strategie léčby a hodnocení aktivity onemocnění, resp. odpovědi na léčbu. Nová strategie léčby se zaměřuje (podobně jako u revmatoidní artritidy – RA) jednak na stanovení léčebného cíle (a jeho důsledné sledování), jednak na včasné zahájení léčby. Studie, které by potvrdily přínos této strategie u psoriatické artritidy, nebyly dosud soustavně prováděny vzhledem k heterogenitě klinických manifestací onemocnění a absenci definovaného léčebného cíle. Ze zkušenosti s revmatoidní artritidou (RA) ale víme, že přísné sledování léčebné odpovědi se zaměřením na dosažení předem definovaného cíle vede k lepším výsledkům klinickým i radiografickým ve srovnání se standardním postupem [3]. Nicméně i u psoriatické artritidy jsou data, která prokazují, že potlačení zánětu vede k lepším dlouhodobým výsledkům [4]. Časné zahájení léčby má rovněž oporu v klinických studiích [5].
V poslední době se jako léčebný cíl prosazuje dosažení tzv. „minimální aktivity onemocnění“ (MiDA – minimal disease activity). Tento cíl zahrnuje více klinických manifestací psoriatické artritidy, lépe řečeno „psoriatické nemoci“, a hodnotí onemocnění komplexně [6]. Zahrnuje kromě kloubních parametrů (počet oteklých kloubů z 66 – POK66 a počet bolestivých kloubů z 68 – PBK68) i hodnocení onemocnění pacientem (kloubní bolest na vizuální analogové škále 100 mm – PP100 mm a globální hodnocení onemocnění pacientem – PG100 mm) a dále počet míst s entezitidou, povrch kůže postižený lupénkou (BSA) a funkční postižení dle HAQ – Health Assessement Questionaire – tab. 2. Tento ukazatel byl validizován v několika studiích [7; 8].
Oba principy strategické léčby PsA (časné zahájení a léčba k cíli) byly recentně ověřeny v první klinické studii toho druhu – TICOPA [9]. Jde o otevřenou, multicentrickou randomizovanou studii u pacientů s časnou psoriatickou artritidou (< 24 měsíců trvání symptomů), která zahrnovala 206 pacientů, z nichž bylo 101 zařazeno náhodně do skupiny s intenzifikovaným režimem (cíl: dosažení MiDA, kontroly po 4 týdnech, eskalace léčby, pokud nebylo dosaženo předdefinovaného cíle) a 105 pacientů se standardním režimem (standardní léčba dle zvážení revmatologa, kontroly po 12 týdnech), v trvání 48 týdnů. Primárně sledovaným parametrem bylo dosažení odpovědi dle ACR20 ve 48. týdnu, vedlejšími sledovanými parametry bylo dosažení léčebné odpovědi dle ACR50, ACR70, PASI75, modifikované rentgenové skóre dle Sharp-van der Heijde ve 48. týdnu a další parametry, jako entezitidy, daktylitidy, pacientské dotazníky a kvalita života.
Pravděpodobnost dosažení odpovědi dle ACR20 byla významně vyšší ve skupině s intenzifikovaným režimem (OR = 1,91, 95%CI 1,03–3,55, p = 0,0392). Ještě vyšší byla pravděpodobnost dosažení odpovědi dle ACR50 (OR = 2,36, 95%CI 1,25–4,47, p = 0,008) a dle ACR70 (OR = 2,64, 95%CI 1,32–5,26, p = 0,0058). Podobně byla významně vyšší pravděpodobnost dosažení PASI75 ve skupině s intenzifikovaným režimem (OR = 2,92, 95%CI 1,51–5,65 p = 0,0015). Změna celkového vdH-S skóre byla minimální a nelišila se v obou skupinách. V ostatních parametrech se obě skupiny významně nelišily, s výjimkou daktylitid, u kterých byl medián zlepšení paradoxně vyšší ve skupině se standardním režimem.
Problémem hodnocení aktivity psoriatické artritidy bylo dosud chybění numerického ukazatele aktivity (obdobně jako DAS28 u RA). V poslední době bylo navrženo několik takových systémů hodnocení, mezi nimi DAPsA (Disease Activity Index for Psoriatic Arthritis). Systém hodnocení aktivity dle DAPsA vyniká svou jednoduchostí a byl v r. 2015 pro PsA validizován [10]. Je konstruován jako prostý součet 5 parametrů: počet oteklých kloubů, počet bolestivých kloubů, hodnocení bolesti pacientem na 10 cm vizuální analogové škále (VAS10 cm), globální hodnocení pacientem na VAS10cm a hodnota CRP. Současně byly definovány kritické hodnoty, dle kterých lze definovat remisi (REM), nízkou aktivitu (low disease aktivity – LDA), střední aktivitu (moderate disease aktivity – MoDA) a vysokou aktivitu (high disease aktivity – HDA). V tomto případě je cílem léčby takto definovaná remise, nebo alespoň nízká aktivita (LDA). Při nedostupnosti laboratorního vyšetření (CRP) lze použít „klinické varianty“ DAPsA – cDAPsA, která vynechává hodnotu CRP. V tom případě se kritické hodnoty pro střední a vysokou aktivitu snižují o 1 jednotku. Tento systém hodnocení aktivity umožňuje i kvantifikaci léčebné odpovědi na malou, střední a velkou – tab. 3. Takto definovaná kritéria odpovědi na léčbu jsou ale vhodná spíše pro farmakologické studie než pro klinickou praxi, protože, alespoň analogií s RA, výsledné funkční postižení a rentgenová progrese závisí spíše s úrovní dosažené aktivity, než s velikostí odpovědi [11; 12].
Table 3. 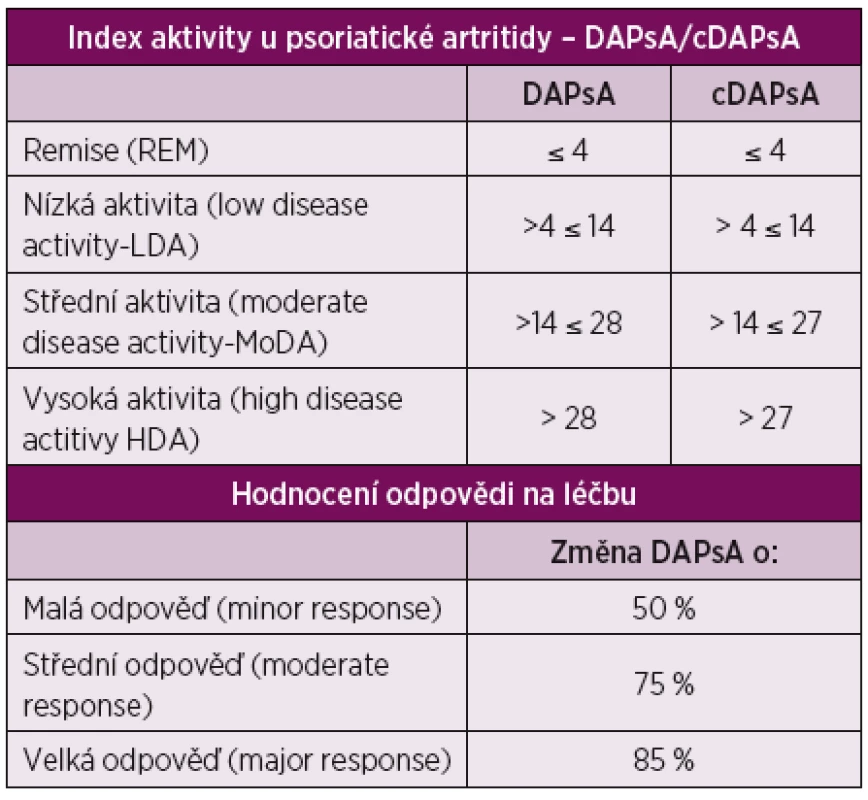
Hodnota DAPsA: součet 5 parametrů: počet oteklých kloubů, počet bolestivých kloubů, hodnocení bolesti pacientem na (VAS10cm), globální hodnocení pacientem na VAS10cm a hodnota CRP. Hodnota cDAPsA: DAPsA bez CRP Vývoj doporučení pro léčbu PsA
Ve snaze poskytnout revmatologům návody pro léčbu a sledování psoriatické artritidy jsou jak na národní úrovni (Česká revmatologická společnost – ČRS), tak na mezinárodní úrovni (Evropská liga proti revmatismu – EULAR, resp. Skupina pro výzkum a hodnocení psoriázy a psoriatické artritidy – GRAPPA) pravidelně vydávána „Doporučení pro léčbu a sledování psoriatické artritidy“.
Skupina GRAPPA publikovala po extenzivním studiu literatury, diskusích expertů a konečném konsenzu doporučení pro hodnocení a léčbu jednotlivých manifestací „psoriatické nemoci“ v r. 2009 [13]. Paralelně s vývojem doporučení GRAPPA vytvořila pracovní skupina Evropské ligy proti revmatismu (EULAR) vlastní doporučení pro sledování a farmakologickou léčbu psoriatické artritidy, která byla publikována v r. 2012 [14].
V posledních letech došlo k rychlému, až překotnému vývoji nových poznatků o všech aspektech psoriatické nemoci, zejména pokud jde o extraartikulární manifestace (entezitidy, daktylitidy), o komorbidity (zejména metabolický syndrom a kardiovaskulární onemocnění). S určitým zpožděním proti revmatoidní artritidě se pozornost soustředila i na novou strategii léčby se zaměřením na časné zahájení léčby a stanovení léčebného cíle. Současně probíhá intenzivní výzkum nových biologických originálních léků (boDMARDs) s jiným mechanismem účinku než inhibice TNFα (inhibitory p40 podjednotky IL-12/23 - ustekinumab a inhibitorů IL-17 - secukinumab, ixekizumab), malých molekul pro perorální použití (inhibitor fosfodiesterázy - 4 apremilast, inhibitor JAK – tofacitinib) a v neposlední řadě přicházejí na trh i biosimilární biologické léky (bsDMARDs).
Na tento vývoj reagovala skupina EULAR aktualizací svých doporučení, která byla po rozsáhlé literární rešerši a diskusích v odborných skupinách publikována v r. 2015 [15]. Podobně byla aktualizována a následně publikována doporučení skupiny GRAPPA v r. 2016 [16].
Na národní úrovni byla takové doporučení poprvé publikována v r. 2005 [17]. Druhá verze „doporučení“ byla publikována až v r. 2011 [1]. V souhlasu s tímto vývojem rozhodla se ČRS rovněž aktualizovat svoje „Doporučení“. Tato doporučení vycházejí z poslední aktualizace EULAR a zohledňují současně i praxi v České republice a vlastní zkušenosti.
Obecné principy nových doporučení EULAR
Nová doporučení EULAR jsou opět rozdělena na 5 obecných principů („overarching principles“) a 10 doporučení.
V obecných principech se zdůrazňuje mj.:
- Sdílení rozhodnutí o léčbě s pacientem. To znamená diskutovat s pacientem cíle léčby, plán dalšího postupu a zejména vysvětlit pacientovi důvody navrženého postupu. Tyto úvahy by měly být dokumentovány. Rozhodnutí o léčebném postupu musí vycházet z poznatků o účinnosti a bezpečnosti léčby a nově i z nákladů takového léčebného postupu.
- Na této obecné úrovni se zdůrazňuje nutnost odstranění projevů zánětu jako podklad pro dosažení léčebného cíle (ty jsou rozvedeny v doporučení č. 1).
- Nově se do rozhodovacího algoritmu zařazují i komorbidity, které jsou u PsA časté. Zejména jde o metabolický syndrom a kardiovaskulární onemocnění, která se zdají být u pacientů s PsA častější [18; 19].
Nová doporučení EULAR
1. doporučení
Cílem léčby by mělo být dosažení remise onemocnění, nebo alternativně dosažení „minimální aktivity onemocnění“ (MiDA), resp. „nízké aktivity onemocnění“ (LDA) pravidelným sledováním a adekvátní úpravou terapie.
Komentář:
- Remise je zde definována jako nepřítomnost klinických a laboratorních známek zánětu. Současně je předpokladem i nepřítomnost entezitid/daktylitid. Nepřítomnost známek zánětu nemusí nutně reflektovat kvalitu života, neboť ta je mimo kloubních symptomů ovlivňována i reziduálním funkčním omezením, únavou, kožním postižením, emočním stavem, případně sociálními problémy. Některé z těchto „reziduálních“ symptomů nemusí být ovlivnitelné farmakoterapií
- Faktory asociované s častějším dosažením remise jsou mladší věk, nižší úroveň funkčního postižení a v některých případech i vyšší hodnota CRP.
- Hodnocení aktivity onemocnění je nyní předmětem zvýšeného zájmu a zaměřuje se jednak na komplexní ukazatele (zde „minimální aktivita onemocnění“ – MiDA), některá se zaměřují pouze na kloubní postižení. V tomto roce byl pro tento účel definován a validizován ukazatel DAPsA – Disease Activity in PSoriatic Arthritis [10] tab. 3.
- Frekvence doporučených kontrol se pohybuje mezi 1–3 měsíci.
2. doporučení
Nesteroidní antirevmatika (NSA) mohou být použita ke zmírnění muskuloskeletálních symptomů
Komentář:
- Toto doporučení konstatuje, že u části pacientů s lehkým kloubním postižením, bez přítomnosti negativních prognostických markerů, mohou být NSA indikována jako lék první volby, pokud není závažné kožní postižení, případně kontraindikace. Efekt léčby (tedy dosažení léčebného cíle) by měl být patrný nejdéle do 3 měsíců od zahájení této léčby.
3. doporučení.
U pacientů s periferní artritidou by mělo být zváženo časné zavedení konvenčního syntetického DMARD (csDMARDs), pokud jsou přítomny negativní prognostické ukazatele (EA manifestace). V přítomnosti závažného kožního postižení by preferovaným csDMARD měl být methotrexát (MTX).
Komentář:
- Periferní artritida zde nahrazuje termín „aktivní onemocnění“ z předchozích doporučení a je zde definována jako přítomnost 1 > bolestivého a oteklého kloubu.
- Časným zavedením se rozumí zavedení léčby nejdéle do 3 měsíců, pokud je onemocnění aktivní.
- Negativními prognostickými ukazateli se rozumí polyartikulární postižení, strukturální poškození kloubu v přítomnosti známek zánětu, elevace reaktantů akutní fáze – FW/CRP, přítomnost relevantních extraartikulárních manifestací, zejména daktylitidy. Přítomnost byť jediného z těchto ukazatelů je důvodem pro časné zavedení csDMARDs, přesto že „okno příležitosti“ u PsA není přesně definované a je v současné době předmětem intenzivního výzkumu.
- Závažným kožním postižením se zde rozumí postižení více než 10 % tělesného povrchu (BSA), případně i menší rozsah při postižení, které významně zhoršuje kvalitu života (postižení obličeje, rukou, či genitální krajiny).
- Doporučená csDMARDs zahrnují na prvním místě methotrexát (zejména při závažném kožním postižení) a dále leflunomid, sulfasalazin a spíše výjimečně (vzhledem k jeho toxicitě) cyklosporin. V úvahu přichází i kombinace csDMARDs, přestože není dostatek dokladů o jejich účinnosti.
4. doporučení.
Lokální injekce glukokortikoidů lze zvážit jako adjuvantní léčbu u psoriatické nemoci, zejména u pacientů s mono/oligoartritidou. Vhodné je jejich použití i u daktylitid (do šlachové pochvy) a u entezitid (např. loket, resp. retrokalkaneární burza u entezitidy Achillovy šlachy). S opatrností mohou být v nejnižší účinné dávce použity i systémové glukokortikoidy.
Komentář:
- Jsou určité obavy z reaktivace psoriázy při užívání systémových glukokortikoidů, zejména při jejich detrakci, nicméně doklady pro to chybí. Dlouhodobé podávání glukokortikoidů ale není vzhledem k jejich nežádoucím účinkům vhodné.
5. doporučení
U pacientů s periferní artritidou a neadekvátní odpovědí na alespoň 1 csDMARD (tj. nebylo dosaženo terapeutického cíle) podávané po dostatečně dlouhou dobu by měla být zahájena biologická léčba (bDMARD), zpravidla anti-TNFα.
Komentář:
- Toto doporučení zohledňuje skutečnost, že od poslední aktualizace „Doporučení“ v r. 2012 byla prokázána v klinických studiích účinnost dalších bDMARDs s odlišným mechanismem účinku. Připouští tedy i použití bDMARD s jiným mechanismem účinku, ale vzhledem k dlouhodobým zkušenostem s inhibitory TNFα a dobrému poměru mezi účinností a bezpečností by měly být biologikem první volby.
- Dostatečně dlouhou dobou podávání DMARD (před konstatováním jejich neúčinnosti) se rozumí obvykle 3–6 měsíců.
- Všechny dostupné inhibitory TNFα prokázaly účinnost na kožní a kloubní postižení včetně prevence rentgenového poškození. Nebyly prokázány rozdíly v účinnosti na kloubní postižení, ale zdá se, že etanercept je méně účinný na kožní postižení.
- Biosimilární biologické léky (bsDMARDs) schválené Evropskou lékovou agenturou se považují za ekvivalentně účinné s originálními biologickými léky (boDMARDs).
- Současné podávání csDMARDs s inhibitory TNFα (TNFi) může být prospěšné s ohledem na setrvání ne léčbě, někdy i s ohledem na míru účinnosti, zejména u monoklonálních protilátek.
Poznámka:
Výjimečné zavedení na biologickou léčbu u velmi aktivních onemocnění i bez předchozího použití csDMARDs bylo z doporučení vypuštěno.
6. doporučení
U pacientů s periferní artritidou a nedostatečnou odpovědí na alespoň 1 csDMARDs, u kterých léčba TNF inhibitory není vhodná, mohou být zvážena biologika s odlišným mechanismem účinku – inhibitory IL-12/23 (ustekinumab), resp. inhibitory IL-17 (aktuálně nejvíce dat pro secukinumab, výhledově ixekizumab).
Komentář:
- Pacienti nevhodní pro léčbu TNFi zahrnují mj. pacienty s komorbiditami, resp. pacienty s anamnézou infekcí.
- Obě biologika prokázala numericky nižší účinnost, u pacientů s předchozí léčbou TNFi (totéž ale platí i pro sekvenční použití TNFi).
- Vzhledem k nedostatečné evidenci o aditivním účinku komedikace csDMARDs s těmito novými biologiky, nemůže být v současné jejich současné podávání doporučeno, i když není nezbytné jejich podávání přerušit. Ani jejich současné podávání není možno považovat za chybu.
7. doporučení
U pacientů s periferní artritidou a nedostatečnou odpovědí na alespoň 1 csDMARDs, u kterých léčba bDMARDs není vhodná, může být zvážena léčba cílenými syntetickými léky – tsDMARDs (např. inhibitorem PDE4 - apremilastem).
Komentář:
- Apremilast prokázal v klinických studiích střední účinnost na kloubní i kožní postižení a na entezitidy.
- Vzhledem k jeho relativně nižší účinnosti, nezanedbatelným nákladům, chybění dat o jeho strukturální účinnosti, ale dobrému celkovému bezpečnostnímu profilu, může být v současné době jeho místo omezeno na pacienty, kteří nedosáhli léčebného cíle při použití csDMARDs a pro které není léčba biologickými DMARDs vhodná (pacienti s komorbiditami, nebo anamnézou infekcí, které kontraindikují použití jakéhokoliv biologického léku).
- V některých případech by mohlo být zváženo jeho použití i v časnějších fázích léčebného algoritmu u pacientů bez negativních prognostických markerů, kteří si výslovně nepřejí parenterálním medikaci.
8. doporučení
U pacientů s aktivní entezitidou a / nebo daktylitidou s nedostatečnou odpovědí na NSA a lokální injekce glukokortikoidů může být zvážena léčba bDMARDs, v současné době TNFi.
Komentář:
- v současnosti chybí data, která by jasně definovala aktivní entezitidu/daktylitidu. Za aktivní nemoc (entezitidu/daktylitidu) se tedy považuje alespoň jedna lokalita, pokud ovlivňuje kvalitu života pacienta.
- bDMARDs mohou být v tomto případě použita i bez předchozího pokusu s csDMARDs.
- Pokud jde o volbu mezi TNFi a bDMARDs cílenými na IL-12/23, nebo IL-17, nelze dát v současné době jednoznačné doporučení, vzhledem k absenci přímých srovnávacích studií. Nicméně na základě současných poznatků se zdá, že všechny tyto preparáty mají obdobný účinek na entezitidy/daktylitidy.
9. doporučení
U pacientů s převažujícím aktivním axiálním postižením, které neodpovídá na léčbu NSA, by měla být zvážena léčba bDMARDs, dle současných znalostí anti-TNFα.
Komentář:
- Aktivním onemocněním se zde rozumí hodnota BASDAI nad 4,0 (VAS 10,0).
- Biologická léčba zde může být zvážena i bez předchozího pokusu s csDMARDs.
- První volbou by měli být inhibitory TNFα. V současné době nemáme dostatek dat o účinnosti ustekinumabu či secukinumabu u ankylozující spondylitidy (AS), tím méně u axiální formy PsA. Tato biologika by tedy mohla být použita výjimečně jako alternativa v případě, že TNFi nemohou být použity.
Poznámka:
Secukinumab byl již schválen pro použití u aktivní ankylozující spondylitidy [20].
10. doporučení
U pacientů, kteří neodpoví adekvátně na jeden biologický lék, by měla být zvážena změna za jiný bDMARD, včetně změny mezi TNFi.
Komentář:
- Ve studiích s ustekinumabem, resp. secukinumabem byla část pacientů (33–60 %) před tím léčena TNFi. Jejich odpověď na tuto léčbu byla ale poněkud nižší než u pacientů, kteří před tím nebyli léčeni biologickou léčbou
- Léčba biologiky s odlišným mechanismem účinku se nezdá být účinnější než jiným TNF inhibitorem.
- Je možná i vícenásobná změna biologika jak v rámci 1 třídy-TNFi, tak biologiky s odlišným mechanismem účinku (secukinumab, ustekinumab), ale nutno počítat s nižší účinností.
Doporučení ČRS 2016
Doporučení vycházejí z poslední aktualizace EULAR a zohledňují současně i praxi v České republice a vlastní zkušenosti.
Cíl léčby:
Primárním cílem léčby je dosažení remise nebo stavu minimální aktivity onemocnění (MiDA). Tento cíl zahrnuje velkou část i extraartikulárních manifestací onemocnění. Alternativně – v případě, že dominantní (nebo jedinou) manifestací je periferní artritida, lze použít hodnocení aktivity dle DAPsA (resp. cDAPsA), v tom případě je cílem opět dosažení remise, nebo stavu nízké aktivity (LDA) – tab. 3.
Intervaly kontrol:
Dle okolností, zpravidla 1–3 měsíce. V případě přetrvávající remise a absenci rentgenového poškození lze interval kontrol prodloužit na 6 mě-síců.
Úrovně léčby:
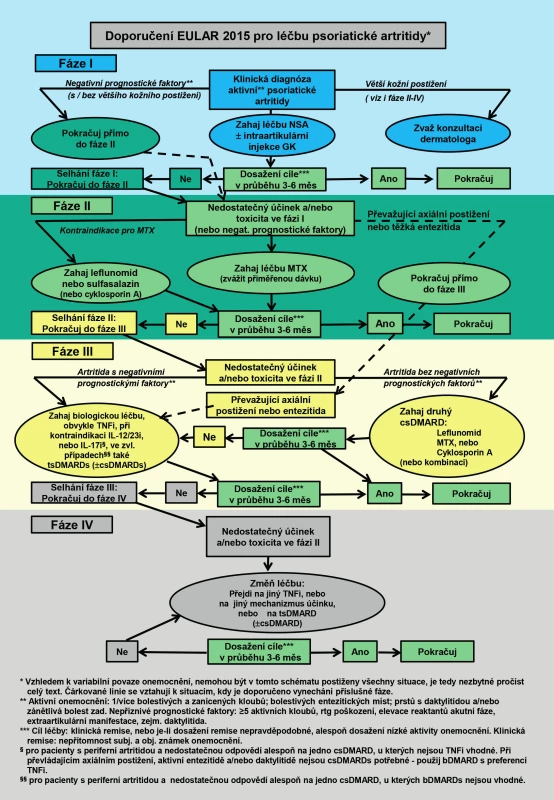
Vychází ze schématu na obr. 1 [15].
Úroveň 1
NSA s intraartikulární aplikací glukokortikoidů (i. a.GK) dle potřeby
- Léčba v této úrovni indikována:
- u lehkých, mono/oligoartikulárních forem, bez přítomnosti negativních prognostických markerů
- Léčebného cíle by mělo být dosaženo do 3–6 měsíců.
- V případě přítomnosti negativních prognostických markerů (polyartikulární postižení, strukturální poškození kloubu v přítomnosti známek zánětu, elevace reaktantů akutní fáze – FW/CRP, přítomnosti relevantních extraartikulárních manifestací, zejména daktylitidy) → Úroveň 2.
- V případě závažné psoriázy (BSA > 10 %), nebo případně i menšího rozsahu postižení v lokalitách, kde významně zhoršuje kvalitu života (postižení obličeje, rukou, či genitální krajiny), by měl být konzultován dermatolog.
Úroveň 2
csDMARDs (methotrexát-MTX / leflunomid-LEF / sulfasalazin-SSZ / cyklosporin-CsA)
- Léčba v této úrovni indikována:
- Pokud nebylo dosaženo léčebného cíle na úrovni 1 během 3–6 měsíců.
- Pokud nebylo dosaženo léčebného cíle prvním csDMARD do 3–6 měsíců a nejsou přítomny negativní prognostické markery, pak pokus s druhým csDMARD / kombinace.
- Lékem první volby je MTX, při kontraindikaci MTX leflunomid, resp. další csDMARDs. Při intoleranci všech csDMARDs možno zvážit apremilast.
- Při těžkém postižení entezí, těžkých daktylitidách, nebo při dominujícím axiálním postižení (tab. 4) → Úroveň 3.
Úroveň 3
bDMARDs – obvykle TNFi, při nevhodnosti (viz Doporučení č. 6 EULAR) či kontraindikaci, inhibitor IL-12/23 (ustekinumab), nebo inhibitor IL-17 (secukinumab) ±csDMARD.
U pacientů, u kterých léčba bDMARDs není vhodná, může být zvážena léčba tsDMARDs (např. inhibitorem PDE4 – apremilastem – viz Doporučení č. 7 EULAR).
- Léčba v této úrovni je indikována:
- Při nedosažení léčebného cíle na úrovni 2 / toxicita.
- Při dominujícím významném axiálním postižení (s výjimkou apremilastu), nebo těžké entezitidě po selhání léčby na úrovni 1 (NSA + i.a.GK), nebo při těžké daktylitidě po selhání léčby csDMARDs (tab. 4).
- Léčebného cíle by mělo být dosaženo do 3–6 měsíců.
Úroveň 4
Změna biologika (switch) za jiný TNFi, nebo biologikum s jiným mechanismem účinku (±csDMARD), nebo tsDMARDs.
- Léčba v této úrovni indikována:
- při nedosažení léčebného cíle 1. bDMARD.
Biologická farmaka schválená pro léčbu psoriatické artritidy:
- inhibitory TNFα
- infliximab
- etanercept
- adalimumab
- golimumab
- certolizumab
- inhibitory IL-12/23 (p40 podjednotky)
- ustekinumab
- inhibitory IL-17
- secukinumab
Cílená syntetická farmaka schválená pro léčbu psoriatické artritidy
- apremilast
Indikace biologické léčby u izolovaných entezitid [zčásti dle 25]
- Entezitida je přítomna minimálně ve 3 různých lokalitách.
- Hodnocené lokality: úpon Achillovy šlachy do patní kosti, úpon patelárního ligamenta do tibie, nebo do dolního pólu pately, úpon šlachy kvadricepsu do horního pólu pately.
- Entezitidy jsou přítomny v některé z uvedených lokalit opakovaně (minimálně při dvou následných vizitách v odstupu 3 měsíců) přes léčbu na úrovni 1 (NSA + lokální instilace glukokortikoidu).
- Entezitidy ovlivňují negativně funkci (HAQ ≥ 0,5).
- Verifikace aktivní entezitidy ultrazvukovým vyšetřením („power Doppler“).
- bDMARDs s doklady o účinnosti u entezitid: TNFi, IL-12/23i (ustekinumab), IL-17i (secukinumab), PDE-4i (apremilast) [16].
Indikace biologické léčby u izolovaných daktylitid [zčásti dle 25]
- Daktylitida je přítomna minimálně na 3 prstech horních/ dolních končetin
- Daktylitidy jsou přítomny opakovaně (minimálně při dvou následných vizitách v odstupu 3 měsíců) přes léčbu na úrovni 1 (NSA + lokální instilace glukokortikoidu), resp. 2 (csDMARDs).
- Daktylitidy ovlivňují negativně funkci (HAQ ≥ 0,5).
- Verifikace aktivní daktylitidy ultrazvukovým vyšetřením („power Doppler“).
- bDMARDs s doklady o účinnosti u daktylitid: TNFi, IL-12/23i (ustekinumab), IL-17i (secukinumab), PDE-4i (apremilast) [16].
Indikace biologické léčby u izolovaných axiálních forem PsA
Pro léčbu těchto forem PsA není v dostupné literatuře dostatek dat. Případná indikace biologické léčby se v těchto případech řídí dle doporučení ČRS pro léčbu ankylozující spondylitidy.
Diskuse
Doporučení ČRS vycházejí z doporučení EULARu z r. 2015 [15]. Tato doporučení shrnují nové poznatky z posledních let se vztahem především k léčebné strategii a novým bDMARDs s odlišným mechanismem účinku (než TNFi). Významné je, že na tvorbě těchto doporučení se kromě revmatologů podíleli i pacienti s psoriatickou artritidou, a to jak v řídící skupině (Steering Group), tak v pracovní skupině (Task Force). Paralelně se skupinou EULARu pracuje na aktualizovaných doporučeních pro léčbu a sledování psoriatické artritidy skupina GRAPPA (Group for Research and Assessment of Psoriasis and Psoriatic Arthritis) [16], která klade poněkud větší důraz na hodnocení kožního postižení na rozdíl od skupiny EULAR, která se více zaměřuje na periferní kloubní postižení. U předložených „Doporučení“ byla hodnocena úroveň evidence (1a–4), úroveň doporučení (A–D) a míra souhlasu (0–10). Úroveň evidence byla vysoká (1b) s výjimkou doporučení 3 – časné zavedení DMARDs u pacientů s negativními prognostickými faktory a doporučení 4 – lokální / systémová léčba glukokortikoidy. Tomu odpovídá i úroveň doporučení, která se pohybuje mezi A až B, s výjimkou doporučení 4 (úroveň doporučení C). Míra souhlasu byla vysoká (> 9), poněkud nižší u doporučení 7, které pojednává o postavení tsDMARDs (apremilast) v armamentáriu farmak pro psoriatickou artritidu. Při hodnocení účinnosti nových farmak (bDMARDs s odlišným mechanismem účinku) konstatují členové pracovní i řídící skupiny, že tato farmaka nejsou numericky účinnější než TNFi, ale že jejich bezpečnost se zdá být větší.
Tato doporučení (EULAR) nejsou myšlena jako striktní návody, jak postupovat u konkrétního pacienta s PsA, ale ponechávají určitou volnost pro národní revmatologické společnosti i ošetřujícího lékaře zvolit jiný přístup, než je zde doporučeno. V české verzi doporučení je blíže rozveden alternativní postup při hodnocení aktivity onemocnění (DAPsA/cDAPsA), a tedy i léčebného cíle, vzhledem k tomu, že naprostá většina pacientů je limitována periferním kloubním postižením, a převažující axiální postižení není časté a pokud je přítomno, je zpravidla mírné. U těžkých forem je vždy třeba zvážit eventuální overlap psoriázy s ankylozující spondylitidou.
Těžká entezitida rovněž není častá, zejména ne jako převažující symptom. Problém je její hodnocení. Hodnocení entezitidy pouze jako přítomnost palpační bolestivosti v definovaných lokalitách je málo specifické a často se překrývá s fibromyalgií. Jsou dva hlavní problémy při hodnocení aktivní entezitidy. Především je to slabá korelace mezi palpační bolestivostí v místě enteze a zobrazovacími metodami vč. ultrazvuku. Nejspolehlivější se zdá být úpon Achillovy šlachy do patní kosti, kde power Dopplerovské vyšetření uspokojivě koreluje s bolestivostí [21]. Druhým problémem je narůstající výskyt degenerativních entezopatií s věkem, zejména na obou epikondylech humeru a na úponu plantární fascie do patní kosti [22]. Proto, má-li být entezitida důvodem pro přechod na vyšší úroveň léčby (tj. úroveň 3 – biologická léčba), měla by být diagnóza entezitidy podpořena adekvátním omezením funkce (např. dle HAQ) a optimálně i zobrazovací metodou (UZ, nebo MRI). Rovněž lokalizace entezitidy není v doporučeních specifikována. Použití nejčastěji užívaného systému hodnocení MASES (Maastricht Ankylosing Spondylitis Enthesitis Score) je poměrně pracné (zahrnuje 13 lokalit, v modifikaci pro PsA 15 lokalit) a zahrnuje místa, často bolestivá i u nezánětlivých onemocnění (epikondyly humeru, oblast pánve a velkých trochanterů). Mimo to nebyl pro PsA validizován. Jednodušší a poměrně specifický je systém hodnocení dle Gladmanové, který zahrnuje na obou stranách rotátorovou manžetu, úpon patelárního ligamenta na tibii a oba úpony na patní kosti (Achillova šlacha a plantární fascie). S výjimkou ramene (rotátorové manžety) ukázaly tyto 3 oblasti dobrou shodu mezi hodnotiteli [23]. Vzhledem k tomu, že úpon Achillovy šlachy do patní kosti je shodně nejčastější lokalitou entezitid, stejně jako oblast kolene (dle the Spondyloarthritis Research Consortium of Canada [24], i dle vlastní zkušenosti), lze doporučit tyto lokality k hodnocení entezitid v rámci těchto doporučení.
Závěr
Tato „Doporučení“ jsou pokusem shrnout poslední poznatky a výsledky práce pracovních skupin EULAR a GRAPPA týkající se klasifikace, strategie léčby a monitorování průběhu léčby psoriatické artritidy. Cílem je poskytnout lékařům zabývajícím se léčbou a sledováním těchto pacientů orientaci v této nyní rychle se vyvíjející oblasti a usnadnit rozhodování o léčebných postupech. Tato „Doporučení“ ale nemohou postihnout všechny specifické rysy průběhu onemocnění u jednotlivých pacientů. Při rozhodování o léčbě konkrétního pacienta bude vždy nutno tato specifika zohlednit. Lze očekávat, že v relativně krátké době dojde k dalšímu vývoji v této oblasti, který si vyžádá aktualizaci těchto doporučení.
Poděkování: Tato práce vznikla za podpory Výzkumných záměrů MZ ČR č. 000 000 23728.
Adresa pro korespondenci:
Jiří Štolfa
Revmatologický ústav
Na Slupi 4
128 50 Praha 2
e–mail: stolfa@revma.cz
Sources
1. Štolfa J, Vencovský J, Pavelka K. Doporučené postupy České revmatologické společnosti pro léčbu psoriatické artritidy. Čes. Revmatol 2011; 19 (No.1): 11–16.
2. Taylor W, Gladman D, Helliwell P, Marchesoni A, Mease P, Mielants H. Classification criteria for psoriatic arthritis: develop-ment of new criteria from a large international study. Arthritis Rheum 2006; 54 : 2665–73.
3. Grigor C, Capell H, Stirling A, et al. Effect of a treatment strategy of tight control for rheumatoid arthritis (the TICORA study): a single-blind randomised controlled trial. Lancet 2004; 364 : 263–69.
4. Chandran V, Schentag CT, Gladman DD. Reappraisal of the effectiveness of methotrexate in psoriatic arthritis: results from a longitudinal observational cohort. J Rheumatol 2008; 35 : 469–71.
5. Haroon M, Gallagher P, Fitzgerald O. Diagnostic delay of more than 6 months contributes to poor radiographic and functional outcome in psoriatic arthritis. Ann Rheum Dis 2014; published online Feb 13. DOI:10.1136/annrheumdis-2013-204858.
6. Coates LC, Fransen J, Helliwell PS. Defining minimal disease activity in psoriatic arthritis: a proposed objective target for treatment. Ann Rheum Dis 2010; 69 : 48–53.
7. Coates LC, Helliwell PS. Validation of minimal disease activity (MDA) criteria for psoriatic arthritis using interventional trial data. Arthritis Care Res 2010; 62 : 965–69.
8. Coates LC, Helliwell PS. Comment on: Efficacy and safety of anti-TNF therapies in psoriatic arthritis: an observational study from the British Society for Rheumatology Biologics Register. Rheumatology 2010; 49 : 1793–94.
9. Coates LC, Moverley AR, McParland L., et al. Effect of tight control of inflammation in early psoriatic arthritis (TICOPA): a UK multicentre, open-label, randomised controlled trial. Published online October 1, 2015 http://dx.doi.org/10.1016/S0140-6736(15)00347-5.
10. Schoels M, Aletaha D, Alasti F, et al. Disease activity in psoriatic arthritis (PsA): defining remission and treatment success using the DAPSA score. Ann Rheum Dis 2015. Published Online First 12 Aug 2015. doi: 10.1136/annrheumdis-2015-207507.
11. Smolen JS, Han C, van der Heijde DM, et al. Radiographic changes in rheumatoid arthritis patients attaining different disease activity states with methotrexate monotherapy and infliximab plus methotrexate: the impacts of remission and tumour necrosis factor blockade. Ann Rheum Dis 2009; 68 : 823–7.
12. Aletaha D, Funovits J, Breedveld FC, et al. Rheumatoid arthritis joint progression in sustained remission is determined by disease activity levels preceding the period of radiographic assessment. Arthritis Rheum 2009; 60 : 1242–9.
13. Ritchlin CT, Kavanaugh A, Gladman DD, et al. Treatment recommendations for psoriatic arthritis. Ann Rheum Dis 2009; 68 : 1387–94.
14. Gossec L, Smolen JS, Gaujoux-Viala C, et al. European League Against Rheumatism recommendations for the management of psoriatic arthritis with pharmacological therapies. Ann Rheum Dis 2012 Jan; 71 : 4–12.
15. Gossec L, Smolen JS, Ramiro S. et al. European League Against Rheumatism (EULAR) recommendations for the management of psoriatic arthritis with pharmacological therapies 2015 update. Ann Rheum Dis 2015; 0 : 1–12.
16. Coates LC, Kavanaugh A, Mease PJ, et al. Group for Research and Assessment of Psoriasis and Psoriatic Arthritis 2015. Treatment Recommendations for Psoriatic Arthritis. Arthritis Rheumatol 2016;68(5):1060-71. doi: 10.1002/art.39573. Epub 2016 Mar 23.
17. Štolfa J, Pavelka K, Vencovský J. Standardní postupy v léčbě psoriatické artritidy. Čes Revmatol 2005; 3 : 97–105.
18. Ogdie A, Schwartzman S, Husni ME. Recognizing and managing comorbidities in psoriatic arthritis. Curr Opin Rheumatol 2015; 27 : 118–26.
19. Di Minno MND, Ambrosino P, Lupoli R, et al. Cardiovascular risk markers in patients with psoriatic arthritis: a meta-analysis of literature studies. Ann Med 2015; 47 : 346–53.
20. Blair HA, Dhillon S. Secukinumab: A review in ankylosing spondylitis. Drugs 2016; 76(10): 1023–30.
21. Ibrahim GH, Groves C, Chandramohan Mm et al. Clinical and ultrasound validation of the Leeds Enthesitis Index in psoriatic arthritis and rheumatoid arthritis. Rheumatol 2011; 731917 [Epub 2011 May 4].
22. Levin D, Nazarian L, Miller T, et al. Lateral epicondylitis of the elbow: US findings. Radiology 2005; 237 : 230–4.
23. Gladman DD, Cook RJ, Schentag C, et al. The clinical assessment of patients with psoriatic arthritis: results of a reliability study of the spondylarthritis research consortium of Canada. J Rheumatol 2004; 31 : 1126–31.
24. Gladman DD, Inman RD, Cook RJ, Maksymowych WP, et al. International spondyloarthritis interobserver reliability exercise – the INSPIRE study: II. Assessment of peripheral joints, enthesitis, and dactylitis. J Rheumatol 2007; 34(8): 1740–5.
25. Mumtaz A, Gallagher P, Kirby B, et al. Development of a preliminary composite disease activity index in psoriatic arthritis. Annals of the Rheumatic Diseases 2011; 70(2): 272–277, 2011.
Labels
Dermatology & STDs Paediatric rheumatology Rheumatology
Article was published inCzech Rheumatology

2016 Issue 4
Most read in this issue- Doporučené léčebné postupy pro psoriatickou artritidu
- Validizace screeningového dotazníku pro přítomnost neuropsychiatrických symptomů u pacientů se systémovým lupusem erythematodem v klinické praxi
- Komorbidity u spondyloartritid
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career