-
Medical journals
- Career
Regulační T-lymfocyty jako nástroj suprese imunitního systému
Authors: J. Bodor; K. Pavelcová; R. Klubal
Authors‘ workplace: Česká genetická banka, spol. s r. o., Praha
Published in: Čes. Revmatol., 21, 2013, No. 4, p. 170-182.
Category: Rewiev
Overview
Regulační T-lymfocyty jsou CD4+ Foxp3+ T-lymfocyty, které in vivo dominantně suprimují imunitní odpověď. Naše snaha porozumět dominantní toleranci navozené v imunitním systému pomocí regulačních T-lymfocytů je příslibem do budoucna při přípravě nových intervenčních terapií u pacientů trpících různými formami alergií a autoimunitních onemocnění jak na buněčné, tak i na molekulární úrovni. Regulační T-lymfocyty jsou rovněž mimořádně efektivní při supresi aloimunity v modelech odvržení štěpu a orgánové transplantace. Tyto nové terapeutické možnosti využití regulačních T-lymfocytů se otevírají na základě jejich intenzivního biologického výzkumu provázeného preklinickým testováním jejich účinků. V tomto přehledu se pokusíme o krátký souhrn nových terapií využívajících imunologických vlastností regulačních T-lymfocytů, jejichž hlavním cílem je maximální benefit při zachování minimálních rizik.
Klíčová slova:
Regulační T-lymfocyty, konvenční CD4+ T-lymfocyty, autoimunita, transplantace, mechanismy suprese regulačními T-lymfocytyÚvod
Znalosti o imunologické toleranci i autoimunitních nemocech se zásadně změnily od roku 1908, kdy Ehrlich razil termín „horror autotoxicus“ (1) (tab. 1). Již v 50. letech minulého století navrhl Burnet na základě své klonální selekční teorie, že autoreaktivní klony jsou deletovány během svého normálního vývoje a tudíž autoimunita je abnormální a zcela výjimečná (2). V té době se rovněž považovalo za možné, že autoreaktivní klony lymfocytů, které unikly deleci, mohou jednoduše ignorovat vlastní antigen (autoantigen), protože k němu nemají dostatečnou reaktivitu, nebo dochází k jejich inaktivaci anergizací v periferii. Později se úsilí předních imunologů, a v neposlední řadě i Milana Haška, soustředilo na rozeznání „vlastního“ od „cizího“ („self vs non-self“ discrimination), což začátkem 60. let umožnilo definici imunologické tolerance (3). Koncem 70. let se již celá řada imunologů soustředila na mechanismus inaktivace autoreaktivních T-lymfocytů prostřednictvím regulačních T-lymfocytů (Treg), které dominantně suprimují T-lymfocyty, zvláště autoreaktivní T-lymfocyty existující v periferii (4). Podle této teorie Treg suprimují autoreaktivní T-lymfocyty, které unikají do periferie navzdory delečnímu mechanismu zodpovědnému za eliminaci většiny autoreaktivních prekurzorů T-lymfocytů v thymu (5). Z dnešního pohledu tedy mohou vznikat některá autoimunitní onemocnění následkem změněné rovnováhy mezi početním zastoupením Treg, respektive autoreaktivních T-lymfocytů, nebo změnou jejich supresivní funkce, eventuelně kombinací obojího.
Od „Horror Autotoxicus“ až k využití Treg pro klinickou transplantaci
Myšlenka suprese imunitní odpovědi T-lymfocyty není pro imunology nová. Gershon a Kondo počátkem 70. let demonstrovali, že T-lymfocyty mohou nejenom zvýšit, ale také snížit imunitní odpověď k exogennímu antigenu (6). Treg byly poprvé popsány v polovině 90. let Shimonem Sakaguchim jako CD4+ T-lymfocyty konstitutivně exprimující interleukin-2 receptor-α (CD25) (7), jejichž vývoj je regulován transkripčním faktorem Foxp3 (8) (tab. 1). Treg jsou přirozeně se vyskytující buňky generované převážně v thymu a byly původně identifikovány jako buňky kontrolující autoreaktivní T-lymfocyty, jejichž ztráta způsobuje vznik autoimunitního onemocnění (7). Toto spojení mezi přirozeně se vyskytujícími Treg a autoimunitními onemocněními podnítilo intenzivní výzkum trvající více než desetiletí, který dokázal, že Treg suprimují nejen autoimunitní odpověď, ale také brání aberantní nebo excesivní imunitní odpovědi k cizorodým antigenům, jako například substancím, které v prostředí vyvolávají alergie, nebo komenzálním mikrobům v případě chronického zánětlivého střevního onemocnění (IBD, inflammatory bowel disease) (9).
Table 1. Od „Horror Autotoxicus“ až k využití regulačních T-lymfocytů (Treg) pro klinickou transplantaci. 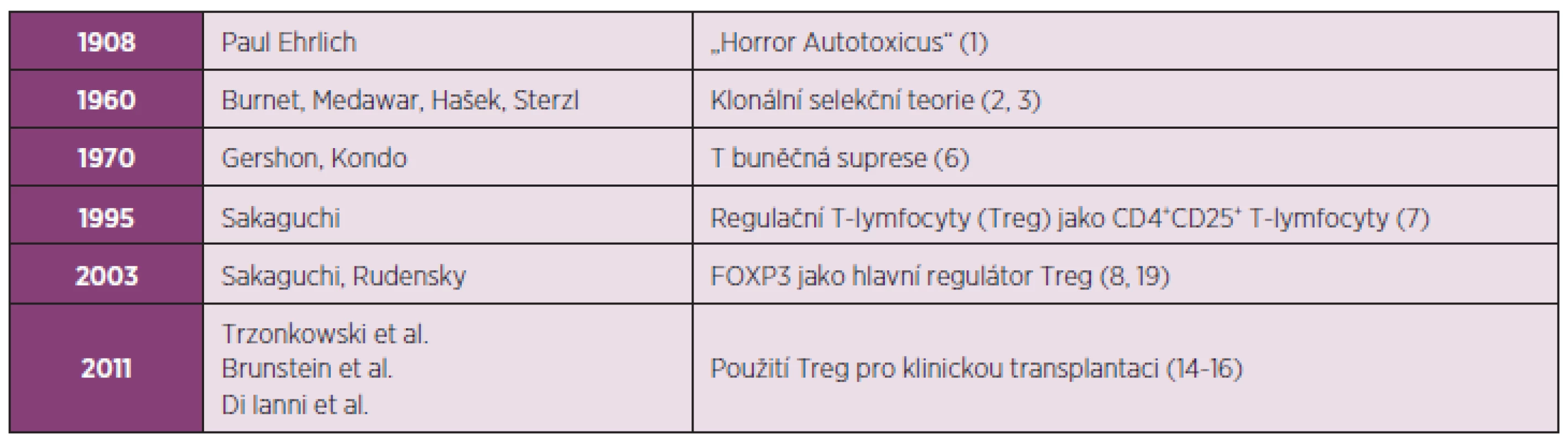
Od dob, kdy Paul Ehrlich razil termín ‘Horror Autotoxicus’ (1908), prošla naše znalost autoimunity zcela zásadními obraty. Poprvé byla tolerance formulována Burnetem, Medawarem, Haškem a Sterzlem v podobě klonální selekční teorie koncem 50. let minulého století (1960). Gershon a Kondo zahrnuli v konceptu tolerance T-lymfocyty až v 70. letech minulého století (1970). Konečně v 90. letech minulého století Sakaguchi a Rudensky definovali Treg jako CD4+CD25+ T lymfocyty (1995), které exprimují Foxp3 (2003) sloužící jako hlavní regulátor vývoje a funkce Treg. V posledním desetiletí dochází k rozhodnému posunu, který je charakterizován snahou o využití Treg v klinické transplantaci (2011). Je známo, že imunitní systém představuje zcela zásadní bariéru při transplantaci buněk i celých orgánů. Na ochranu před rejekcí transplantátu je prozatím nezbytné podávat imunosupresiva. Neustálé zdokonalování imunosupresiv vede k postupnému snižování rizika akutní rejekce, přesto šance dlouhodobého přijetí transplantátu stagnuje kvůli morbiditě a mortalitě způsobené nespecifickou imunosupresí (10). Tradiční přístup k imunosupresi zdůrazňoval především kontrolu efektorových T-lymfocytů. Role Treg při supresi autoimunity je relativně nová a právě Treg poskytly nový pohled na potlačení reakcí probíhajících během alogenní odpovědi. Tento pohled zdůrazňuje roli Treg v průběhu imunosupresivního režimu prostřednictvím tzv. „Treg-centrického“ přístupu, kdy se posiluje role Treg při kontrole aloreaktivních CD4+ T-lymfocytů tak, aby se zvýšilo dlouhodobé přijetí transplantátu (11–13). Na rozdíl od generalizovaného použití imunosupresiv spojeného s nespecifickou imunosupresí mají Treg schopnost dlouhodobého přežití s uchováním dominantní antigen-specifické funkce. Terapeutická infuze Treg má tedy schopnost navodit u pacientů s transplantátem dlouhodobou donor-specifickou toleranci bez negativních následků na imunitní reakce vůči patogenům nebo nádorům (14–16). Výzkum na animálních modelech demonstroval, že Treg mohou léčit řadu autoimunitních onemocnění, jako je diabetes prvního typu (T1D, type 1 diabetes), lupus (SLE, systemic lupus erythematosus), roztroušená skleróza (MS, multiple sclerosis), revmatická artritida (RA, rheumatoid arthritis) nebo autoimunitní gastritida. Terapie využívající Treg může být účinná také při kontrole aloimunity během odvržení štěpu (GvHD, graft-versus-host disease) při transplantaci buněk nebo celých orgánů. Zásadním poznatkem umožňujícím terapii prostřednictvím Treg v humánní medicíně je skutečnost, že Treg si mohou uchovat imunoregulační funkci i v průběhu své expanze ex vivo. Jenom od počátku roku 2011 byly popsány tři klinické studie, které se zabývají účinkem Treg při snížení rizika GvHD (14–16) (tab. 1). Všechny tyto studie prokázaly slibné výsledky týkající se bezpečné aplikace autologně expandovaných Treg. Velký zájem o využití Treg je rovněž při léčbě autoimunitních onemocnění.
V tomto přehledu se budeme přednostně zabývat CD4+ T-lymfocyty, které konstitutivně exprimují Foxp3 a CD25, a nastíníme jimi zprostředkovanou toleranci s důrazem na mechanismy imunitní homeostázy, prostřednictvím kterých tyto lymfocyty kontrolují adaptivní imunitní reakce. Dále se zaměříme na molekulární a buněčné změny probíhající v těchto procesech, které vedou k vývoji autoimunitních onemocnění, a také na využití Treg pro léčbu GvHD a jiných imunologických onemocnění.
Rovnováha mezi Treg a autoreaktivními T-lymfocyty určuje vznik autoimunity
Předěl v našem chápání dominantní tolerance představuje několik zásadních experimentálních pozorování uvedených níže. Předně je to pozorování, že deplece Treg, které reprezentují 5 až 10% CD4+ T-lymfocytů, vede k autoimunitnímu onemocnění u jinak normální myši (7, 9) (obr. 1). U myší mohou být autoimunitní onemocnění způsobena přenosem Treg-depletovaných splenocytů nebo zralých thymocytů z normální dospělé myši, které jsou CD4+CD8- a jsou přeneseny do syngenních recipientů postrádajících T-lymfocyty (22) (obr. 2). To tedy znamená, že thymus dospělého organismu produkuje v určité (byť omezené) míře potenciálně patogenní autoreaktivní T-lymfocyty, stejně jako Treg, a to nehledě na negativní selekci autoreaktivních T-lymfocytů. Vzhledem k tomu, že Treg, obdobně jako autoreaktivní T-lymfocyty, procházejí selekčním procesem v thymu, dosahují obě populace rovnováhy, která je za normálních podmínek charakterizována dominancí Treg. Tyto CD4+ Treg specificky exprimují CD25 a Foxp3, což je transkripční faktor, který je esenciální pro jejich vývoj a funkci (17–19) (obr. 1). Navíc mutace v lidském genu FOXP3 jsou zodpovědné za syndrom IPEX (IPEX, immune dysregulation, polyendocrinopathy, enteropathy, X-linked syndrom), což poskytuje důkaz, že vývojové a funkční anomálie Treg mohou způsobit autoimunitní nemoci, alergie a IBD také u lidí (20, 21) (obr. 2). U člověka se CD4+ CD25+ FoxP3+ Treg vyvíjejí v brzlíku a jsou označovány jako „přirozené“ nebo „thymické“ Treg na rozdíl od Treg vyvíjejících se v periferních lymfatických tkáních, které jsou často Foxp3- a jsou nazývány „adaptivní“ nebo „indukované“ Treg. Několik studií potvrdilo, že CD4+ Foxp3+ buňky mohou být generovány také v periferních lymfatických tkáních z naivních progenitorů, které jsou CD4+ Foxp3-. Předpokládá se, že do indukce exprese Foxp3 v periferii jsou zapojeny dva hlavní faktory – cytokin TGF-β a způsob prezentace antigenu. Heterogenita CD4+ T-lymfocytů Foxp3+ vykazuje potřebu dalšího markeru, aby bylo možné od sebe rozlišit funkční Treg a Foxp3+ naivní buňky, které nejsou Treg. U lidí je možné CD4+ Foxp3+ T-lymfocyty rozdělit do tří podskupin: naivní Treg (CD45RA+Foxp3lo), efektorové Treg (CD45RA-Foxp3hi) a CD45RA-Foxp3lo T-lymfocyty, které nemají supresivní funkci (23).
Image 1. Vývoj Treg v thymu. Vývoj Foxp3<sup>+</sup> thymocytů (Foxp3<sup>+</sup> pre-Treg) zahrnuje v thymu interakce s thymickými stromálními buňkami prostřednictvím různých molekul. Foxp3<sup>-</sup> thymocyty v rané fázi (CD4<sup>+</sup>CD8<sup>+</sup>) nebo v pozdní fázi (CD4<sup>+</sup>) se mohou diferencovat na CD25<sup>+</sup>Foxp3<sup>+</sup> Treg po obdržení signálu, který vzniká interakcemi mezi TCR a major histocompatibility/self-antigen (MHC/autoantigen) komplexy prezentovanými na stromálních buňkách zprostředkovaných dalšími molekulami (např. CD28) a jejich ligandy (např. CD80 a CD86) a humorálními faktory derivovanými ze stromálních buněk (např. cytokiny). Složení Foxp3<sup>+</sup> buněk v každé subpopulaci thymocytů (CD4<sup>+</sup> versus CD8<sup>+</sup>) je zobrazeno v procentech. Za jistých podmínek se mohou CD4<sup>+</sup> non-Treg diferencovat na Foxp3<sup>+</sup> Treg až v periferii (tzv. indukované Treg – není znázorněno). Exprese Foxp3, která určuje diferenciaci thymocytů zodpovídá nejenom za supresivní aktivitu, ale zároveň stabilizuje funkci a fenotyp Treg (např. prostřednictvím exprese CD25). 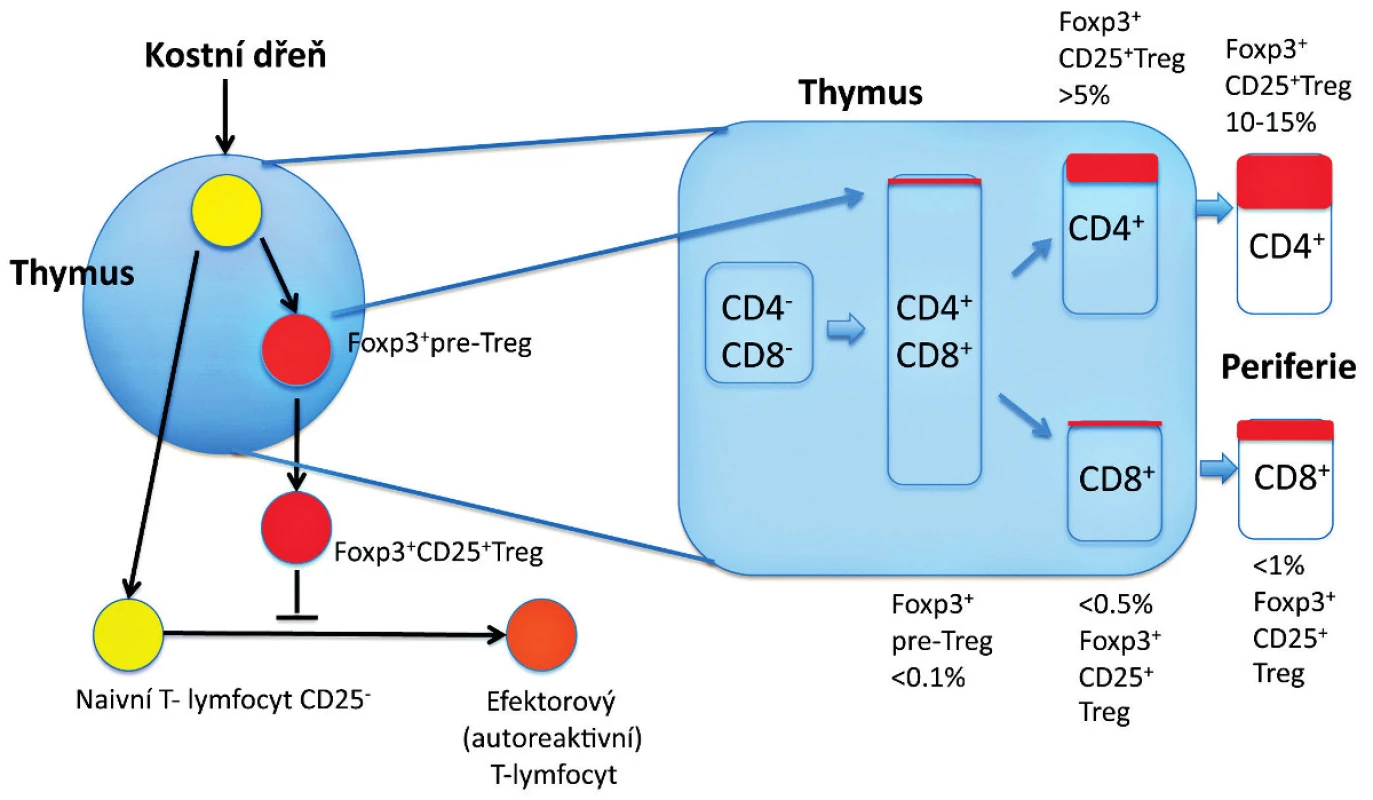
Image 2. Syndrom IPEX a efekt Treg deficience u myší a lidí. T buněčná suspenze připravená z normální myši může být přenesena celá (vlevo nahoře) nebo zbavená Treg (CD4<sup>+</sup>CD25<sup>+</sup> regulačních Foxp3<sup>+</sup> T-lymfocytů) a pak přenesená do syngenní myši bez T buněk (athymické „nahé“ myši) (deplece Treg – vlevo uprostřed). Příjemce pak zůstane zdráv (normální – vlevo nahoře) nebo spontánně vyvine autoimunitní onemocnění nebo IBD a má schopnost odvrhnout nádorové buňky (vlevo uprostřed). Naopak, když jsou Treg z normální myši obohaceny a přeneseny do athymické „nahé“ myši, tak je recipient schopen přijmout alogenní štěp kůže bez rizika odvržení (obohacení Treg – vlevo dole). U lidí jsou mužští potomci postiženi IPEX syndromem (vpravo dole). Matky jsou nositelky heterozygotních defektů v alele FOXP3 genu a jsou imunologicky normální (vpravo nahoře), i když často mají buď redukovaný počet normálních Treg, nebo jsou postiženy mosaicismem normálních Treg a funkčně defektních Treg způsobeným náhodnou inaktivací FOXP3 genu na X chromosomu. Červené a žluté symboly znázorňují intaktní Treg a efektorové (konvenční) CD4<sup>+</sup> T-lymfocyty (Teff). Treg převážně suprimují vývoj efektorových CD4<sup>+</sup> T-lymfocytů z naivních T buněk. 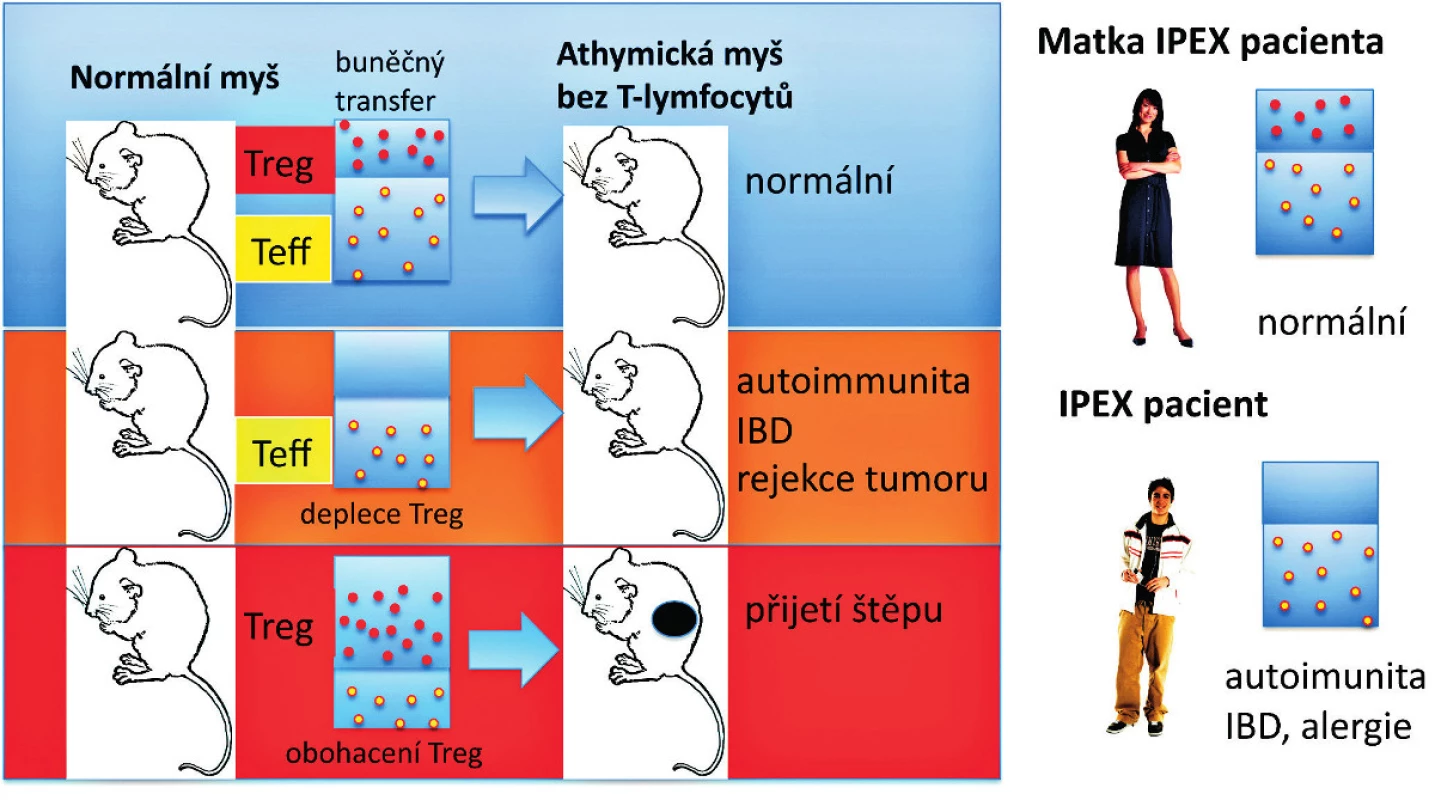
Syndrom IPEX
Více než 90 % pacientů se syndromem IPEX onemocní diabetem prvního typu a přibližně 70 % trpí thyroiditidou (20, 21) (obr. 2). To znamená, že každý jedinec má potenciálně diabetogenní T-lymfocyty navzdory tomu, že T buněčný receptor (TCR, T cell receptor) a efektorová aktivita T-lymfocytů je u různých jedinců odlišná. Z toho vyplývá, že kompletní ablace nebo dysfunkce Treg může vyvolat diabetes prvního typu nezávisle na HLA (HLA, human leukocyte antigen) haplotypu. Navíc autoimunita u IPEX syndromu se vyvíjí již záhy – v některých případech dokonce v děloze. Toto pozorování naznačuje, že autoimunitní onemocnění se mohou vyvinout v aseptickém prostředí jako anomálie v interní regulaci imunitního systému. Stimulace Treg-depletovaných lymfocytů z periferní krve zdravých lidí ukázala existenci T-lymfocytů reaktivních in vitro, například na GAD65 (GAD65, glutamic acid decarboxylase-65), což je cílový autoantigen pro diabetes, rovněž tak na MOG (MOG, myelin oligodendrocyte glycoprotein), na hsp-60 (hsp-60, heat shock protein-60) nebo k NY-ESO peptidu, který je exprimován v řadě tumorů, ale také v normálních varlatech (24-26). Ukázalo se, že zpětné přidání Treg suprimuje proliferaci těchto autoreaktivních T-lymfocytů rozeznávajících cílový autoantigen. Navíc je pozoruhodné, že autoreaktivní T-lymfocyty v normálních jedincích nejsou anergické, jelikož v nepřítomnosti Treg proliferují a produkují IFN-γ in vitro jako odpověď na relevantní antigeny. Značení T-lymfocytů tetramery rozeznávajícími imunodominantní epitopy GAD65 nebo inzulinu prokázalo, že T-lymfocyty u zdravých lidí mají stejně jako u diabetiků srovnatelné imunitní odpovědi in vitro. Nicméně u zdravých jedinců jsou respondující T-lymfocyty většinou naivní (CD45RA+), zatímco u diabetiků jsou to převážně paměťové T-lymfocyty (CD45RA-) (27, 28), což naznačuje, že Treg mohou zabránit T-buněčné diferenciaci a udržet autoreaktivní T-lymfocyty v naivním stavu.
Revmatoidní artritida
Již od počátku 50. let bylo známo, že imunizace zdravých zvířat vlastními antigeny (autoantigeny) emulzifikovanými v kompletním Freundově adjuvans (CFA, complete Freund’s adjuvant) může způsobit autoimunitní poškození celých tkání (29). Tato experimentální autoimunita může vést k poškození jakékoliv tkáně nebo orgánu (například štítné žlázy, mozku, svalu, kloubu, očí, varlat nebo srdce) a byla použita při výzkumu orgánově specifických autoimunitních onemocnění (29). Revmatoidní artritida je autoimunitní onemocnění, které zpravidla postihuje postmenopauzální ženy, i když může postihnout i ženy v reprodukčním věku (30). Důsledkem toho jsou lékaři konfrontováni se složitým rozhodováním ohledně výběru optimálních terapeutických režimů snižujících riziko RA bez ohrožení gravidity (31). Velmi často totiž během gravidity dochází spontánně ke zmírnění symptomů RA - někdy až k jejich úplné remisi. Tento efekt je jenom přechodný a po porodu zpravidla dochází k relapsu (32). Toto pozorování bylo poprvé popsané Henchem v roce 1938 (33) a posloužilo jako zásadní impuls k použití kortikosteroidů jako imunosupresiv při léčbě autoimunitních onemocnění (34). Od té doby byla provedena řada studií jak retrospektivních, tak prospektivních, které potvrdily, že během gravidity skutečně dochází ke zlepšení asi u tří čtvrtin pacientek (32). Navzdory desetiletí trvajícímu výzkumu tohoto zlepšení RA u gravidních žen zůstal jeho mechanismus neobjasněn. Teprve nyní se ukazuje, že jsou to právě Treg, které mohou hrát rozhodující roli během zmírnění symptomů RA u gravidních žen. V průběhu těhotenství totiž dochází k jejich nahromadění v děloze, o kterém se soudí, že slouží k potlačení antifetální imunitní odpovědi (35). Další důkaz antigen specifické suprese Treg pochází ze studií zabývajících se imunitní odpovědí k minoritním transplantačním antigenům v kontextu fetomaternální tolerance (36). Je pozoruhodné, že počet Treg a zlepšení příznaků RA během těhotenství inverzně koreluje s průběhem onemocnění. Tyto výsledky se shodují s výsledky získanými při studiu kolagenem indukované RA u myší, tzv. CIA (CIA, collagen induced arthritis), které potvrzují roli Treg při zlepšení příznaků CIA během gravidity (37). Ukázalo se totiž, že březost zmírňuje CIA u myší a rovněž přenos Treg z březích myší má ochranný efekt.
Genetický základ ovlivňuje citlivost k vyvolání autoimunity
Genetický základ hostitele, zvláště MHC (MHC, major histocompatibility complex) haplotyp, ovlivňuje citlivost k vyvolání autoimunity. Všeobecně lze nemoc vyvolat nejenom použitím CFA, ale také pomocí lipopolysacharidů buď v kombinaci s autoantigenem, nebo opakovanou infuzí dendritických buněk pulzovaných autoantigenem (38–40). V souhrnu tyto poznatky naznačují, že perzistentní prezentace autoantigenu antigen prezentujícími buňkami (APC, antigen presenting cell) – zvláště maturovanými dendritickými buňkami – může aktivovat autoreaktivní lymfocyty, a tak způsobit autoimunitní poškození tkáně (41). Nicméně takové tkáňově specifické poškození je obvykle limitované a dochází k jeho rezoluci například i u velmi citlivých myších kmenů. Navíc se myši, které přežijí akutní autoimunitní proces, často stávají rezistentní k sekundární stimulaci stejným autoantigenem, jak bylo prokázáno na modelech experimentální alergické encefalitidy (EAE, experimental allergic encephalitis), tedy na animálním modelu roztroušené sklerózy (MS, multiple sclerosis) (42). Klíčovou roli při vysvětlení tohoto fenoménu mohou hrát Treg, jelikož imunizace myši s MBP (MBP, myelin basic protein) v CFA expanduje MBP-specifické Foxp3+ Treg v EAE lézích. Deplece Treg před imunizací autoantigenem prohlubuje vývoj autoimunitního onemocnění a deplece Treg před sekundární stimulací vede k porušení rezistence k EAE (43, 44). Je pozoruhodné, že deplece Treg vede k EAE také u rezistentního kmene myší, který jinak po stimulaci MBP nepodléhá autoimunitní reakci (EAE) (45). Na rozdíl od výše popsané autoantigenem vyvolané indukce EAE může deplece Treg sama o sobě způsobit autoimunitní onemocnění v řadě orgánů, přičemž nelze předpovědět, který orgán bude postižen. Lze tedy spekulovat, že autoantigeny prezentované dendritickými buňkami mohou vést k diferenciální aktivaci autoreaktivních CD4+ T lymfocytů versus Treg a že výsledkem této odlišné stimulace je buď navozená tolerance nebo autoimunita.
Mechanismus Treg-mediované suprese
Mechanismus Treg-mediované suprese není dosud objasněn v plné šíři. Jak myší, tak lidské Treg exprimující Foxp3 mají schopnost suprimovat konvenční CD4+ T-lymfocyty mechanismy zavislými na buněčném kontaktu. Tento buněčný kontakt vede k inhibici exprese IL-2 (IL-2, interleukin-2) u konvenčních CD4+ T-lymfocytů, např. prostřednictvím cyklického adenozin monofosfátu (cAMP, cyclic adenosine monophosphate), nebo nepřímou modulací cAMP prostřednictvím ektoenzymů ATPázy (CD39) a ADPázy (CD79 ) – lokalizovaných na povrchu buňky, které mohou sekundárně ovlivňovat aktivitu granzymů a vést tak k apoptóze cílových buněk (46–49). Alternativně mohou Treg suprimovat imunitní odpovědi nepřímými mechanismy humorální suprese – např. sekrecí imunosupresivních cytokinů (jako je IL-10, TFG-β, IL-35) nebo naopak inhibicí produkce proinflamatorních cytokinů jako je IL-2, což je cytokin kritický jak pro expanzi Treg, tak pro řádné fungování konvenčních CD4+ T-lymfocytů (50–52). Je tedy nanejvýš pravděpodobné, že různé způsoby Treg-mediované suprese mohou působit synergicky v závislosti na podmínkách v daném mikroprostředí. Navzdory tomu je ale zřejmé, že patrně existuje centrální mechanismus suprese, který je nejen kontrolován Foxp3, ale také sdílen každým Treg nezávisle na podmínkách a prostředí, a který v zásadě funguje stejně in vitro jako in vivo. Poškození takového centrálního mechanismu by mělo vést k selhání tolerance, tak jak to bylo pozorováno u Foxp3 mutant u myší nebo u Foxp3 mutant u lidí (syndrom IPEX). V současnosti ovšem takový centrální mechanismus není plně charakterizován.
Camp – významná komponenta mechanismu Treg-mediované suprese
Za nejlépe popsaný je považován mechanismus Treg-mediované suprese závislý na buněčném kontaktu, který využívá několik vzájemně se regulujících komponent. Významnou komponentou tohoto mechanismu je cAMP (obr. 3). Ukazuje se totiž, že Treg mohou mít prostřednictvím Foxp3 významně zvýšenou intracelulární koncentraci cAMP (až stonásobně) (47, 48) a že tato molekula je přenesena do cílových CD4+ T-lymfocytů prostřednictvím cAMP gradientu, který je vytvořen mezi Treg a cílovou kontaktní buňkou pomocí membránových pórů (GJICs, gap junction intercellular communications) (47). Dramaticky zvýšená intracelulární koncentrace cAMP v cílové buňce potom vede k cAMP-mediované expresi potentního transkripčního inhibitoru ICER (ICER, inducible cAMP early repressor) (46), jenž je v konvenčních CD4+ T-lymfocytech zodpovědný za inhibici syntézy IL-2. CD4+ T-lymfocyty jsou majoritním producentem IL-2 jenž je rovněž kritický pro supresivní funkci samotných Treg díky jejich konstitutivní expresi IL-2 receptoru (CD25). Tímto vzniká autoregulační mechanismus, během kterého Treg-mediovaná suprese konvenčních CD4+ T-lymfocytů vede k inhibici produkce IL-2, ale zároveň také k oslabení supresivní funkce Treg. Naopak imunitní odpověď provázená zvýšenou produkcí IL-2 funkci Treg posiluje (48). Navíc se zdá, že intracelulární koncentrace cAMP je rovněž ovlivňována jak u Treg, tak u cílových buněk prostřednictvím různých receptorů – například samotným CD4 receptorem (49) nebo CTLA-4 (CTLA-4, cytotoxic T lymphocyte antigen – 4) (53, 54), jenž je dominantním inhibičním koreceptorem T-buněčné proliferace (55).
Image 3. Model Treg-mediované suprese. Transfer cAMP je mediovaný GJIC, jejichž vytvoření v imunologické synapsi na povrchu buňky je zprostředkováno interakcemi s CTLA-4 a jejich B7 ligandy (CD80 a CD86). (A) Treg konstitutivně exprimují CTLA-4, které po aktivaci interaguje s B7 exprimovaným na APC, což vede k akumulaci GJICs v imunologické synapsi. Transfer cAMP posiluje supresivní funkci ICER v buněčném jádře. (B) Interakce CTLA-4 s B7 ligandem exprimovaným na aktivovaných efektorových CD4<sup>+</sup> T-lymfocytech umožňuje transfer cAMP přes GJIC (suprimované T buňky). Transfer cAMP dále amplifikuje expresi CTLA-4, která je mediovaná cAMP. (C) V suprimovaných CD4<sup>+</sup> T-lymfocytech cAMP umožňuje funkci ICER v buněčném jádře, jenž vede k inhibici produkce IL-2, která je limitující pro funkci Treg. 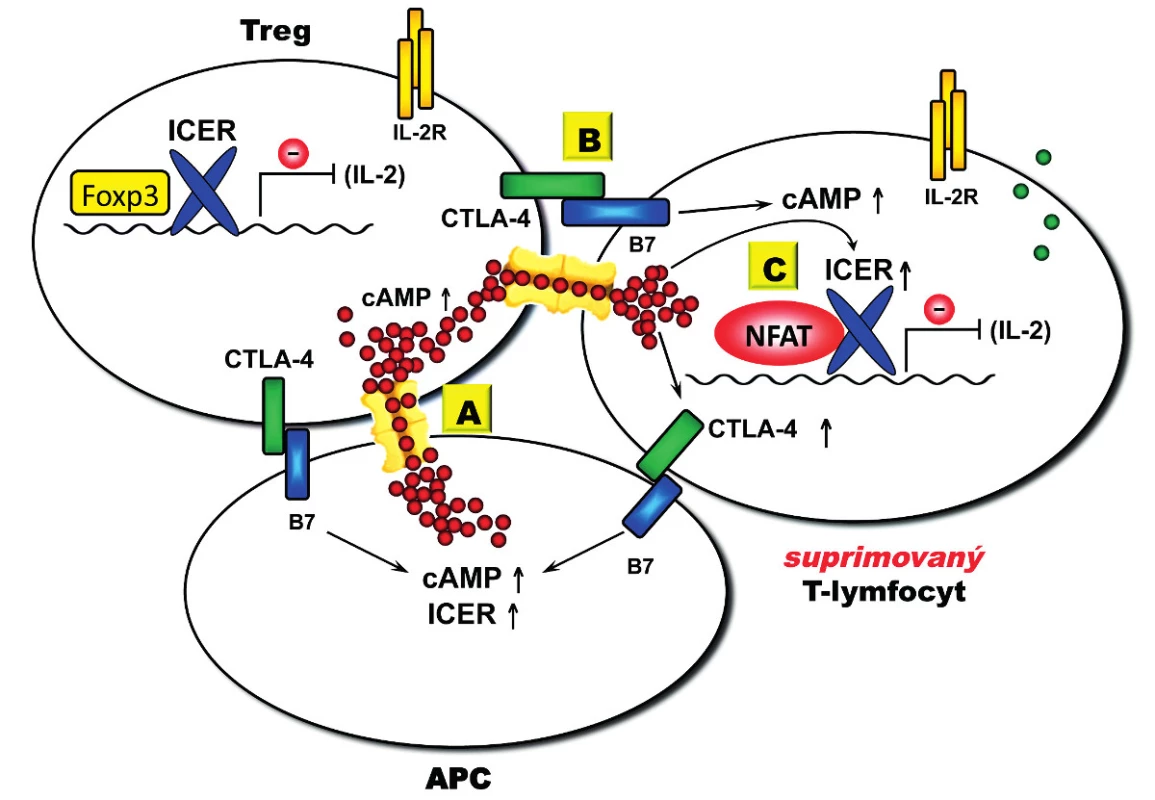
CTLA-4
CTLA-4 receptor vzbudil velkou pozornost, jelikož je konstitutivně exprimován právě u Treg; konvenční CD4+ T-lymfocyty jej exprimují pouze přechodně a po aktivaci, přičemž jeho povrchová exprese vede k inhibici T-buněčné proliferace (53, 54). Navíc se ukázalo, že blokáda CTLA-4 prostřednictvím specifické monoklonální protilátky způsobuje orgánově specifické autoimunitní onemocnění u jinak zdravé myši (53, 54). Na druhé straně druhé blokáda CTLA-4 má také schopnost aktivovat protinádorovou aktivitu T-lymfocytů (55). Tato schopnost byla v humánní medicíně nedávno zohledněna při schvalování specifické monoklonální protilátky blokující CTLA-4 (ipilimumab) pro nádorové indikace (melanom). Je zajímavé, že zvýšená hladina intracelulárního cAMP v konvenčních CD4+ T-lymfocytech vede ke zvýšené povrchové expresi CTLA-4 v suprimovaných T-lymfocytech bez obvyklého požadavku na aktivaci těchto buněk prostřednictvím TCR (56) a má tedy účinek přesně opačný – vede k potenciálnímu udržení Treg-mediované suprese CD4+ T-lymfocytů. Navíc blokáda CTLA-4 vedoucí k neutralizaci Treg-mediované suprese inhibuje supresivní funkci transkripčního represoru ICER v cílových CD4+ T-lymfocytech a vede tak k jeho derepresi a zvýšené produkci IL-2 (57).
Prostaglandin E2
Důležitým příkladem receptorem zprostředkované formace cAMP v indukovaných Treg je syntéza prostaglandinu E2 (PGE2) (58). Bylo prokázáno, že adaptivní Treg exprimují cyklooxygenázu-2 (COX-2), při diferenciaci produkují PGE2 a že signalizace prostřednictvím některého z jeho čtyř receptorů - EP1, EP2, EP3, EP4 – má často protichůdné účinky. EP2 a EP4 se zdají být velmi hojně zastoupeny na pvrchu naivních lymfocytů izolovaných z periferní krve a jsou zvýšeně produkovány po aktivaci. Nedávné studie poskytly významný vhled především popisem specifické signální dráhy u konvenních T-lymfocytů, kde signalizace prostřednictvím EP2 a EP4 se současným zvýšením intracelulární hladiny cAMP vede k aktivaci proteinkinázy A (PKA, protein kinase A) a prostřednictvím EBP50-Ezrin-PAG komplexu vedoucím k fosforylaci C-terminální Src kinázy (Csk, C-terminal Src kinase). Fosforylovaná Csk následně inhibuje fosforylaci komplexu TCR, kterou zprostředkovává Lck, což inhibuje TCR signalizaci a T-buněčnou proliferaci a funkci. Souhrnně tyto výsledky naznačují existenci centrálního mechanismu Treg-mediované suprese, jenž je kromě cAMP závislý na řadě komponent a je i nadále předmětem intenzivního výzkumu.
Mechanismus fetomaternální tolerance
Otázka, jak se plod a placenta vyhnou odvržení imunitním systémem matky, zaměstnávala imunology a reprodukční biology téměř 60 let (59). Až do 90. let minulého století byl mechanismus fetomaternální tolerance vnímán jako analogie s orgánovou transplantací. Tato možnost poněkud ztratila na své atraktivnosti když se zjistilo, že populace leukocytů v děloze těhotné ženy nekoresponduje s populací leukocytů v orgánu po transplantaci. Překvapivě se ukázalo, že proliferační odpověď v děloze těhotné ženy, i když celkem robustní, negeneruje podstatné zvýšení počtu T-lymfocytů (60, 61). V případě CD8+ T-lymfocytů nedochází k expanzi funkčních cytotoxických T-lymfocytů (60). Místo toho jsou CD8+ T-lymfocyty rozeznávající plod z velké většiny deletovány, jak lze ostatně pozorovat u stimulovaných T-lymfocytů v nepřítomnosti kostimulace (60). Je tedy nanejvýš pravděpodobné, že CD4+ T-lymfocyty rozeznávající plod nepodléhají diferenciaci (61). Dendritické buňky nejsou spontánně aktivovány během těhotenství ani ve slezině ani v lymfatických uzlinách (62), což samo o sobě může být považováno za jeden z mechanismů fetomaternální tolerance. Alternativní vysvětlení nepřítomnosti diferencovaných T-lymfocytů je, že T-lymfocyty rozeznávající plod nejsou během těhotenství aktivovány díky dominantní Treg-mediované imunosupresi. K diferenciaci indukovaných Treg dochází po aktivaci TCR v nepřítomnosti kostimulace a jejich vývoj včetně de novo syntézy Foxp3 je usnadněn v přítomnosti TGF-β (TGF-β transforming growth factor -β). Vývoj indukovaných Treg rovněž vyžaduje enhancer CNS1 (CNS1, conserved non-coding sequence 1) umístěný v prvním intronu Foxp3 genu, který je zodpovědný za stabilní expresi Foxp3 (63, 64). Důkazy role indukovaných Treg ve fetomaternální toleranci vycházejí ze dvou nezávislých transgenních myších modelů. V prvním z nich bylo prokázáno, že u samic bez Treg dochází k vysoké incidenci resorpce embryí při gestaci, pokud byly tyto samice kříženy s alogenními samci, ale nikoliv po křížení se syngenními samci (65). V druhém modelu přenos Treg atenuoval spontánní potraty v dobře etablovaném imunitním systému myší březosti (66). Navíc je březost myší asociována se systémovou expanzí totální populace Treg (65). Obdobná pozorování byla popsána i v krvi těhotných žen, avšak tyto údaje nejsou zatím potvrzeny (67, 68). Souhrnně lze říci, že Treg rozeznávající antigen plodu jsou indukovány až během gravidity, jelikož samice myší bez CNS1 enhanceru (CNS1 knock out), které postrádají schopnost tvořit indukované Treg, mají vyšší resorpci embryí po křížení s alogenními samci, než když jsou kříženy se syngenními samci (61). Tyto údaje jasně svědčí o funkční roli indukovaných Treg při navození fetomaternální tolerance.
Treg kontrolují rejekci transplantátu
Předpokládá se, že existují nejméně dva druhy aloreaktivních CD4+ T-lymfocytů (včetně Treg), které závisí na restrikci MHC molekulami II. třídy (MHC class II, major histocompatibility complex class II). Jednak jsou to přímo působící aloreaktivní CD4+ T-lymfocyty, které rozeznávají antigeny donora prezentované MHC class II prostřednictvím svého TCR. Na straně druhé jsou to nepřímo působící aloreaktivní CD4+ T-lymfocyty, které rozeznávají alogenní peptidy prezentované MHC molekulami II. třídy na APC příjemce. Počet přímo působících aloreaktivních CD4+ T-lymfocytů je o několik řádů vyšší než počet CD4+ T-lymfocytů působících nepřímo. Přítomnost aloreaktivních Treg se odvozuje z pozorování, během kterého Treg izolované z naivní myši mohou suprimovat odpovědi k aloantigenům in vitro a rovněž chránit proti GvHD in vivo (69–71). Naopak deplece Treg použitím protilátky proti CD25 v naivních hostitelích před transplantací vede ke zvýšení rejekce transplantátu (72–74). Poslední studie odhaduje počet přímo působících aloreaktivních Treg na více než 10 % (75). Tato data naznačují, že navzdory vysokému počtu Treg je většina alograftů rejekována a tedy Treg přítomné v naivních příjemcích nejsou schopny zabránit akutní rejekci bez protokolu indukujícího toleranci, který expanduje Treg, nebo vede k jejich aktivaci. Stojí za zmínku, že v řadě případů protokoly indukující toleranci expandují Treg s nepřímou specificitou (76–78), což naznačuje, že dlouhodobé přijetí štěpu primárně implikuje Treg působící nepřímo (79–81). Jelikož transplantační tolerance je asociována s donor-specifickou expanzí Treg, lze předpokládat, že infuze dárcovských Treg prodlouží přežití štěpu a navození tolerance. Skutečně tento předpoklad byl potvrzen u řady experimentálních transplantačních modelů (82–84). V těchto studiích donor-specifické Treg byly efektivnější než polyklonální Treg. Většina studií pak použila Treg s přímou specificitou. Dvě studie navíc prokázaly, že kombinační terapie využívající Treg s přímou i nepřímou specificitou jsou účinnější než terapie využívající výlučně Treg s přímou specificitou (85, 86). V protokolech, které indukují toleranci, závisí kombinace imunosupresiv na typu transplantátu. Stejné je to i v protokolech, které byly použity v individuálních transplantačních programech. V některých centrech jsou příjemci ledvin léčeni buď monoklonálními, nebo polyklonálními protilátkami; používá se například alemtuzumab (anti-CD52) anebo anti-thymocytární globulin. Tyto protilátky vedou k významnému snížení počtu leukocytů v periferní krvi a mohou také ovlivnit počet leukocytů v lymfoidních orgánech a vést tak ke generalizované lymfopenii. Nicméně ne všechny populace lymfocytů jsou sníženy stejnou měrou; například paměťové T-lymfocyty nejsou odstraněny po podání alemtuzumabu (87, 88). Repopulace leukocytů je odstartována vzniklou leukopenií a různé subpopulace leukocytů expandují diferenciálně. Je zajímavé, že za těchto okolností může vzniknout situace, kdy Treg expandují preferenčně a převáží početně i funkčně nad aloreaktivními CD4+ T-lymfocyty (89), příkladem je expanze Treg anti-thymocytárním globulinem (90). Nezávisle na použití protilátek depletujících leukocyty jsou příjemcům transplantátu rovněž podávána imunosupresiva, která inhibují kalcineurin, například tacrolimus anebo cyclosporine A, ale také antiproliferativní agens, například mycophenolate mofetil. Některým recipientům transplantátu je podáván rapamycin, což je imunosupresivum, které inhibuje mTOR (mTOR, mammalian target of rapamycin), jenž má prokazatelný účinek na tvorbu Treg a je schopen podpořit jejich funkci in vivo (91). Jiný přístup využívající IL-2 v kombinaci s rapamycinem vede k dalšímu zlepšení funkce Treg zvláště při léčbě akutní GvHD (92). Terapie nízkými dávkami IL-2 byla rovněž úspěšně použita při léčbě pacientů s chronickou GvHD a vedla k více než pětinásobnému zvýšení počtu Treg (93). Je zajímavé, že nízké dávky IL-2 expandují Treg, aniž by ovlivnily funkci konvenčních CD4+ T-lymfocytů. Zda bude podobná strategie aplikovatelná pro transplantaci celých orgánů není zatím jasné.
Závěr
Foxp3+ Treg lymfocyty spojují systém centrální a periferní tolerance, jelikož jsou stejně jako autoreaktivní CD4+ T-lymfocyty předmětem společné selekce v thymu navzdory tomu, že po selekci Treg dominantně kontrolují autoreaktivní CD4+ T-lymfocyty v periferii. Tato dynamická rovnováha je udržována po antigenní stimulaci obou populací nejspíše prostřednictvím komplexního a dosud ne zcela objasněného, mechanismu. Navíc genetické anomálie anebo variace ovlivňující finální rovnováhu mezi oběma populacemi mohou vést k predispozici k autoimunitním onemocněním. Pokračující výzkum Treg je tak příslibem do budoucna pro vývoj specifických a bezpečných terapií, které by mohly v dohledné době vyléčit různá autoimunitní onemocnění a poskytnout dlouhodobé řešení pro zvládnutí imunologie transplantací.
Adresa pro korespondenci:
RNDr. Josef Bodor, CSc.
Česká genetická banka, spol. s r.o.
Mezi Vodami 205/29
143 00 Praha 4
Tel. 270 003 568
Fax: 225 152 036
E-mail: josef.bodor@genetickabanka.cz
Sources
1. Ehrlich P. Collected papers of Paul Ehrlich – vol. 2. New York: Pergamon 1957.
2. Burnet FM. The Clonal Selection Theory of Acquired Immunity. Cambridge: Cambridge University Press 1959.
3. Ivanyi J. Milan Hasek and the discovery of immunological tolerance. Nat Rev Immunol 2003; 3 : 591–597.
4. Nossal GJ. Clonal anergy of B cells: a flexible, reversible, and quantitative concept. J Exp Med 1996; 183 : 1953–56.
5. Sakaguchi S, Wing K, Miyara M. Regulatory T cells – a brief history and perspective. Eur J Immunol 2007; (Suppl. 1) 37: S116–123.
6. Gershon RK, Kondo K. Cell interactions in the induction of tolerance: the role of thymic lymphocytes. Immunology 1970; 18 : 723–737.
7. Sakaguchi S, Sakaguchi N, Asano M, Itoh M, Toda M. Immunologic self-tolerance maintained by activated T cells expressing IL-2 receptor alpha-chains (CD25): Breakdown of a single mechanism of self-tolerance causes various autoimmune diseases. J Immunol 1995; 155 : 1151–1164.
8. Hori S, Nomura T, Sakaguchi S. Control of regulatory T cell development by the transcription factor Foxp3. Science 2003; 299 : 1057–1061.
9. Singh B, Read S, Asseman C et al. Control of intestinal inflammation by regulatory T cells. Immunol Rev 2001; 182 : 190–200.
10. Feng S. Long-term management of immunosuppression after pediatric liver transplantation: is minimization or withdrawal desirable or possible or both? Curr Opin Organ Transplant 2008; 13 : 506–512.
11. Wood KJ, Sakaguchi S. Regulatory T cells in transplantation tolerance. Nat Rev Immunol 2003; 3 : 199–210.
12. Bluestone JA, Tang Q. Therapeutic vaccination using CD4+CD25+ antigen-specific regulatory T cells Proc Natl Acad Sci USA 01 2004; (Suppl 2): 14622–14626.
13. Waldmann H, Adams E, Fairchild P, Cobbold S. Regulation and privilege in transplantation tolerance. J Clin Immunol 2008; 28 : 716–725.
14. Trzonkowski P, Bieniaszewska M, Juscinska J, Dobyszuk A, Krzystyniak A, Marek N, et al. First-in-man clinical results of the treatment of patients with graft versus host disease with human ex vivo expanded CD4+CD25+CD127 - T regulatory cells. Clin Immunol 2009; 133 : 22–26.
15. Brunstein CG, Miller JS, Cao Q, McKen DH., Hippen KL, et al. Infusion of ex vivo expanded T regulatory cells in adults transplanted with umbilical cord blood: safety profile and detection kinetics. Blood 2010; 117 : 1061–1070.
16. Di Ianni M, Falzetti F, Carrotti A, Terenzi A, Castellino F, Bonifacio E, et al. Tregs prevent GvHD and promote immune reconstitution in HLA-haploidentical transplantation. Blood 2011; 117 : 3921–3928.
17. Hori S, Nomura T, Sakaguchi S. Control of regulatory T cell development by the transcription factor Foxp3. Science 2001; 299 : 1057–1061.
18. Khattri R., Cox T, Yasako S, Ramsdell F. An essential role for Scurfin in CD4+CD25+ T regulatory T cells. Nat Immunol 2003; 4 : 337–342.
19. Fontenot JD, Gavin MA, Rudensky AY. Foxp3 programs the development and function of CD4+CD25+ regulatory T cells. Nat Immunol 2003; 4 : 330–336.
20. Gambieri E, Torgerson T, Ochs H. Immune dysregulation, polyendocrinopathy, enteropathy, and X-linked inheritance (IPEX), a syndrome of systemic immunity caused by mutations of FOXP3, a critical regulator of T-cell homeostasis. Curr Opin Rheumatol 2003; 15 : 430–435.
21. Wildin RS, Smyk-Pearson S, Filipovich AH. Clinical and molecular features of the immunodysregulation, polyendocrinopathy, enteropathy, X-linked (IPEX) syndrome. J Med Genet 2002; 39 : 537–545.
22. Itoh M, Takahashi T, Sakaguchi N, Kuniyasu Y, Shimizu J, Otsuka F, et al. Thymus and autoimmunity: production of CD25+CD4+ naturally anergic and suppressive T cells as a key function of the thymus in maintaining immunologic tolerance. J Immunol 1999; 162 : 5317–5326.
23. Miyara M, Yoshioka Y, Kitoh A, et al. Functional delineation and differentiation dynamics of human CD4+ T cells expressing the FoxP3 transcription factor. Immunity 2009; 30 : 899–911.
24. Danke NA, Koelle DM, Yee C, et al Autoreactive T cells in healthy individuals. J Immunol 2004; 172 : 5967–5972.
25. Wing K, Lindgren S, Kollberg G, et al. CD4 T cell activation by myelin oligodendrocyte glycoprotein is suppressed by adult but not cord blood CD25+ T cells. Eur J Immunol 2003; 33 : 579–587.
26. Gnjatic S, Altorki NK, Tang DN, et al. NY-ESO-1 DNA vaccine induces T-cell responses that are suppressed by regulatory T cells. Clin Cancer Res 2009; 15 : 2130–2139.
27. Danke NA, Yang J, Greenbaum C, Kwok WW. Comparative study of GAD65-specific CD4+ T cells in healthy and type 1 diabetic subjects. J Autoimmun 2005; 25 : 303-311.
28. Yang J, Danke N, Roti M, et al. CD4+ T cells from type 1 diabetic and healthy subjects exhibit different thresholds of activation to a naturally processed proinsulin epitope. J Autoimmun 2008; 31 : 30–41.
29. Baxter AG. The origin and application of experimental autoimmune encephalomyelitis. Nat Rev Immunol 2007; 7 : 904–912.
30. Scott DL, Wolfe F, Huizinga TW. Rheumatoid Arthritis. Lancet 2010; 376 : 1094–1108.
31. Partlett R, Roussou E. The treatment of rheumatoid arthritis during pregnancy. Rheumatol Intl 2011; 31 : 445–449.
32. de Man YA, Dolhain RJ, van de Geijn FE, et al. Disease activity of rheumatoid arthritis during pregnancy: results from a nationwide prospective study. Arthritis Rheum 2008; 59 : 1241–1248.
33. Hench PS. The ameliorating effect of pregnancy on chronic atrophic (infectious rheumatoid) arthritis, fibrosis, and intermittent hydrarthrosis. Mayo Clin Proc 1938; 13 : 161–167.
34. Golding A, Hague UJ, Giles JT. Rheumatoid arthritis and reproduction. Rheum Dis Clin North Am 2007; 33 : 319–343.
35. Kallikourdis M, Andersen KG, Welch KA, Betz AG. Alloantigen-enhanced accumulation of CCR5+ ‘effector’ regulatory T cells in the gravid uterus. Proc Natl Acad Sci USA 2007; 104 : 594–599.
36. Kahn DA, Baltimore D. Pregnancy induces a fetal antigen-specific maternal T regulatory cell response that contributes to tolerance. Proc Natl Acad Sci USA 2010; 107 : 9299–9304.
37. Munoz-Suano A, Kallikourdis M, Sarris M, Betz AG. Regulatory T cells protect from autoimmune arthritis during pregnancy. J Autoimmun 2012; 38 : 103–108.
38. Zaccone P, Fehérvári Z, Blanchard L, et al. Autoimmune thyroid disease induced by thyroglobulin and lipopolysaccharide is inhibited by soluble TNF receptor type I. Eur J Immunol 2002; 32 : 1021–1028.
39. Eriksson U, Ricci R, Hunziker L, Kurrer MO, Oudit GY, Watts TH. et al. Dendritic cell-induced autoimmune heart failure requires cooperation between adaptive and innate immunity. Nat Med 2003; 9 : 1484–1490.
40. Watanabe H, Inaba M, Adachi Y, Sugiura K, Hisha H, Iguchi T, et al. Experimental autoimmune thyroiditis induced by thyroglobulin-pulsed dendritic cells. Autoimmunity 1999; 31 : 273–282.
41. Gehring AJ, Rojas RE, Canaday DH, et al. The mycobacterium tuberculosis 19-kilodalton lipoprotein inhibits gamma interferon-regulated HLA-DR and Fc gamma R1 on human macrophages through Toll-like receptor 2. Infect Immun 2003; 71 : 4487–4497.
42. McGeachy MJ, Stephens LA, Anderton SM. Natural recovery and protection from autoimmune encephalomyelitis: contribution of CD4+CD25+ regulatory cells within the central nervous system. J Immunol 2005; 175 : 3025–3032.
43. Kohm AP, Carpenter PA, Anger HA, Miller SD. Cutting edge: CD4+CD25+ regulatory T cells suppress antigen-specific autoreactive immune responses and central nervous system inflammation during active experimental autoimmune encephalomyelitis. J Immunol 2002; 169 : 4712–4716.
44. Morris GP, Yan Y, David CS, Kong YM. H2A - and H2E-derived CD4+CD25+ regulatory T cells: a potential role in reciprocal inhibition by class II genes in autoimmune thyroiditis. J Immunol 2005; 174 : 3111–3116.
45. Reddy J, et al. Myelin proteolipid protein-specific CD4+CD25+ regulatory T cells mediate genetic resistance to experimental autoimmune encephalomyelitis. Proc Natl Acad Sci USA 2004; 101 : 15434–15439.
46. Vaeth M, Gogishvili T, Bopp T, et al. Regulatory T cells facilitate the nuclear accumulation of inducible cAMP early repressor (ICER) and suppress nuclear factor of activated T cell c1 (NFATc1). Proc Natl Acad Sci USA 2011; 108 : 2480–2485.
47. Bopp T, Becker C, Klein M, et al. Cyclic adenosine monophosphate is a key component of regulatory T cell-mediated suppression. J Exp Med 2007; 204 : 1303–1310.
48. Bodor J, Bopp T, Vaeth M, et al. Cyclic AMP underpins suppression by regulatory T cells. Eur J Immunol 2012; 42 : 1375–1384.
49. Becker C, Bopp T, Jonuleit H. Boosting regulatory T cell function by CD4 stimulation enters the clinic. Front Immunol 2012; 3 : 1–9.
50. Shevach EM. Mechanisms of Foxp3+ T regulatory cell-mediated suppression. Immunity 2009; 30 : 636–645.
51. Vignali DAA, Collison LW, Workman CJ. How regulatory T cells work. Nat Rev Immunol 2008; 8 : 523–532.
52. Tang Q, Bluestone J. The Foxp3+ regulatory T cell: jack of all trades, master of regulation. Nat Immunol 2008; 9 : 239–244.
53. Takahashi T, Tagami T, Yamazaki S, et al. Immunologic self-tolerance maintained by CD25+CD4+ regulatory T cells constitutively expressing cytotoxic T lymphocyte-associated antigen 4. J Exp Med 2000; 192 : 303–310.
54. Read S, Malstrom V, Powrie F. Cytotoxic T lymphocyte-associated antigen 4 plays and essential role in the function of CD25+CD4+ regulatory cells that control intestinal inflammation. J Exp Med 2000; 192 : 295–302.
55. Peggs KS, Quezada SA, Chambers CA, et al. Blockade of CTLA-4 on both effector and regulatory T cell compartments contributes to the antitumor activity of anti-CTLA-4 antibodies. J Exp Med 2009; 206 : 1717–1725.
56. Vendetti S, Riccomi A, Sacchi A, et al. Cyclic adenosine 5’-monophosphate and calcium induce CD152 (CTLA-4) up-regulation in resting CD4+ T lymphocytes. J Immunol 2002; 169 : 6231–6235.
57. Bodor J, Fehervari Z, Diamond B, Sakaguchi S. ICER/CREM-mediated transcriptional attenuation of IL-2 and its role in suppression by regulatory T cells. Eur J Immunol 2007; 37 : 884–895.
58. Lone AM, Tasken K. Proinflammatory and immunoregulatory roles of eicosanoids in T cells. Front Immunol 2013; 4 : 1–15.
59. Medawar PB. Some immunological and endocrinological problems raised by the evolution of viviparity in vertebrates. Symp Soc Exp Biol 1953; 7 : 320–338.
60. Erlebacher A, Vencato D, Price KA, et al. Constraints in antigen presentation severely restrict T cell recognition of the allogeneic fetus. J Clin Invest 2007; 117 : 1399–1411.
61. Rowe JH, Ertelt JM, Xin L, Way SS. Pregnancy imprints regulatory memory that sustains anergy to fetal antigen. Nature 2012; 490 : 102–106.
62. Bizargity P, Bonney EA. Dendritic cells, a family portrait at mid-gestation. Immunology 2009; 126 : 565–578.
63. Josefowicz SZ, Lu LF, Rudensky AY. Regulatory T cells: mechanisms of differentiation and function. Annu Rev Immunol 2012; 30 : 531–564.
64. Josefowicz SZ, Niec RE, Kim HY, et al. Extrathymically generated regulatory T cells control mucosal Th2 inflammation. Nature 2012; 482 : 395–399.
65. Aluvihare VR, Kallikourdis M, Betz AG. Regulatory T cells mediate maternal tolerance to the fetus. Nature Immunol 2004; 5 : 266–271.
66. Zenclussen AC, Gerlof K, Zenclussen ML, et al. Regulatory T cells induce a privileged tolerant microenvironment at the fetal-maternal interface. Eur J Immunol 2006; 36 : 82–94.
67. Mjosberg J, Berg G, Jenmalm MC, Ernerudh J. FOXP3+ regulatory T cells and T helper 1, T helper 2 and T helper 17 cells in human early pregnancy decidua. Biol Reprod 2010; 82 : 698–705.
68. Dimova T, Nagaeva O, Stenqvist AC, et al. Maternal Foxp3 expressing CD4+CD25+ and CD4+CD25 - regulatory T cell populations are enriched in human early normal pregnancy decidua: a phenotypic study of paired decidual and peripheral blood samples. Am J Reprod Immunol 2011; 66 (Suppl. 1): 44–56.
69. Davies JD, O'Connor E, Hall D, et al. CD4+CD45RB low-density cells from untreated mice prevent acute allograft reaction. J Immunol 1999; 163 : 5353–5357.
70. Taylor PA, Noelle RJ, Blazar BR. CD4+CD25+ immune regulatory cells are required for induction of tolerance to alloantigen via costimulatory blockade. J Exp Med 2001; 193 : 1311–1318.
71. Earle KE, Tang Q, Zhou X, et al. In vitro expanded human CD4+CD25+ regulatory T cells suppress effector T cell proliferation. Clin Immunol 2005; 115 : 3–9.
72. Cohen JL, Trenado A, Vasey D, Klatzmann D, Salomon BL. CD4+CD25+ immunoregulatory T cells: new therapeutics for graft-versus-host disease. J Exp Med 2002; 196 : 401–406.
73. Benghiat FS, Graca L, Braun MY, Detienne S, Moore F, Buonocore S, et al. Critical Influence of natural regulatory CD25+ T cells on the fate of allografts in the absence of immunosuppression. Transplantation 2005; 79 : 648–654.
74. Bolton EM. Regulatory T cells in transplantation: natural or induced? Transplantation 2005; 79 : 643–645.
75. Lin YJ, Hara H, Tai HC, et al. Suppressive efficacy and proliferative capacity of human regulatory T cells in allogeneic and xenogeneic responses. Transplantation 2008; 86 : 1452–1462.
76. Wise MP, Bemelman F, Cobbold SP, Waldmann H. Linked suppression of skin graft rejection can operate through indirect recognition. J Immunol 1998; 161 : 5813–5816.
77. Ochando JC, Homma C, Yang Y, et al. Alloantigen-presenting plasmacytoid dendritic cells mediate tolerance to vascularized grafts. Nat Immunol 2006; 7 : 652–662.
78. Verginis P, McLaughlin KA, Wucherpfennig KW, et al. Induction of antigen-specific regulatory T cells in wild type mice: visualization and targets of suppression. Proc Natl Acad Sci USA 2008; 105 : 3479–3484.
79. Hara M, Kingsley CI, Niimi M, et al. IL-10 is required for regulatory T cells to mediate tolerance to alloantigens in vivo. J Immunol 2001; 166 : 3789–3796.
80. Yamada A, Chandraker A, Laufer TM, et al. Recipient MHC class II expression is required to achieve long-term survival of murine cardiac allografts after costimulatory blockade. J Immunol 2001; 167 : 5522–5526.
81. Callaghan CJ, Rouhani FJ, Negus MC., et al. Abrogation of antibody-mediated allograft rejection by regulatory CD4 T cells with indirect allospecificity. J Immunol 2007; 178 : 2221–2228.
82. Nadig SN, Wieckekiewicz J, Wu DC, et al. In vivo prevention of transplant arteriosclerosis by ex vivo-expanded human regulatory T cells. Nat Med 2010; 16 : 809–813.
83. Brennan TV, Tang Q, Liu FC, et al. Requirements for prolongation of allograft survival with regulatory T cell infusion in lymphosufficient hosts. J Surg Res 2011; 169: e69–75.
84. Sagoo P, Ali N, Garg G, Nestle FO, et al. Human regulatory T cells with alloantigen specificity are more potent inhibitors of alloimmune skin graft damage than polyclonal regulatory T cells. Sci Transl Med 2011; 3 : 83ra42.
85. Joffre O, Santolaria T, Calise D, et al. Prevention of acute and chronic allograft rejection with CD4+CD25+Foxp3+ regulatory T lymphocytes. Nat Med 2008; 14 : 88–92.
86. Tsang JY, Tanriver Y, Jiang S, et al. Conferring indirect allospecificity on CD4+CD25+ Tregs by TCRT gene transfer favors transplantation tolerance in mice. J Clin Invest 2008; 118 : 3619–3628.
87. Trzonkowski P, Zilvetti M, Friend P, Wood KJ. Recipient memory-like lymphocytes remain unresponsive to graft antigens after CAMPATH-1H induction with reduced maintenance immunosuppression. Transplantation 2006; 82 : 1342–1351.
88. Pearl JP, Parris J, Hale DA., et al. Immunocompetent T-cells with a memory-like phenotype are the dominant cell type following antibody-mediated T-cell depletion. Am J Transplant 2005; 5 : 465–474.
89. Bloom DD, Chang Z, Fechner JH, et al. CD4+CD25+FOXP3+ regulatory T cells increase de novo in kidney transplant patients after immunodepletion with campath-1H. Am J Transplant 2008; 8 : 793–802.
90. Lopez M, Clarkson MR, Albin M, et al. A novel mechanism of action for anti-thymocyte globulin: induction of CD4+CD25+Foxp3+ regulatory T cells. J Am Soc Nephrol 2006; 17 : 2844–2853.
91. Hester J, Schiopu A, Nadig SN, Wood KJ. Low dose of rapamycin treatment increases the ability of human regulatory T cells to inhibit transplant arteriosclerosis in vivo. Am J Transplant 2012; 12 : 2008–2016.
92. Shin HJ, Baker J, Leveson-Gower DB, et al Rapamycin and IL-2 reduce lethal acute graft-versus-host disease associated with increased expansion of donor type CD4+CD25+Foxp3+ regulatory T cells. Blood 2011; 118 : 2342–2350.
93. Koreth J, Matsuoka K, Kim HT, et al. Interleukin-2 and regulatory T cells in graft-versus-host disease. N Engl J Med 2011; 365 : 2055–2066.
Labels
Dermatology & STDs Paediatric rheumatology Rheumatology
Article was published inCzech Rheumatology

2013 Issue 4
Most read in this issue- Revmatická polymyalgie – je účinná biologická léčba?
- Regulační T-lymfocyty jako nástroj suprese imunitního systému
- Biosimilars – současné poznatky o jejich zaměnitelnosti
- Cirkulující protein tepelného šoku 90 (HSP90) u pacientů s revmatoidní artritidou a axiální spondyloartritidou
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

