-
Medical journals
- Career
Doporučené postupy České revmatologické společnosti pro léčbu psoriatické artritidy
Authors: J. Štolfa; J. Vencovský; K. Pavelka
Authors‘ workplace: Revmatologický ústav Praha
Published in: Čes. Revmatol., 20, 2012, No. 1, p. 13-18.
Category: Recommendations for Treatment
Overview
Psoriatická artritida (PsA) je v současné době nazírána jako komplexní onemocnění s více tkáňovými manifestacemi. Kromě zánětlivého postižení synovialis kloubu nebo šlachové pochvy (synovialitida, tendovaginitida) se na klinickém obrazu podílí i zánět šlachových úponů (entezitida) a komplexní zánětlivé postižení měkkých tkání prstů zahrnující artritidu, tenosynovitidu a podkoží (daktylitida). Postižení kůže je nezbytnou podmínkou diagnózy, ať již je aktuálně přítomná, byla přítomna v minulosti, nebo se vyskytuje v přímém příbuzenstvu. Měli bychom tedy spíše hovořit o „psoriatické nemoci“ než o psoriatické artritidě. Odráží se to ostatně i v nových klasifikačních kritériích pro PsA (CASPAR). Má to své konsekvence i v hodnocení aktivity, které by kromě artritidy mělo hodnotit i ostatní uvedené tkáňové manifestace. Na systému hodnocení aktivity a léčebných doporučení pracují v současné době experti GRAPPA (Group for research and assessment of psoriasis and psoriatic arthritis) a EULAR (European League against Rheumatism). Dosud platná doporučení ČRS (Česká revmatologická společnost) pocházejí z r. 2005. Tyto nové poznatky nás vedly k vytvoření nových doporučení, která vycházejí převážně z doporučení EULAR. Léčba je zde rozdělena do 4 úrovní, zvlášť jsou uvedeny indikace pro zavedení biologické léčby.
Klíčová slova:
psoriatická artritida, klasifikační kritéria, entezitida, daktylitida, léčebná doporučení, kompozitní index aktivity, biologická léčba PsAÚvod
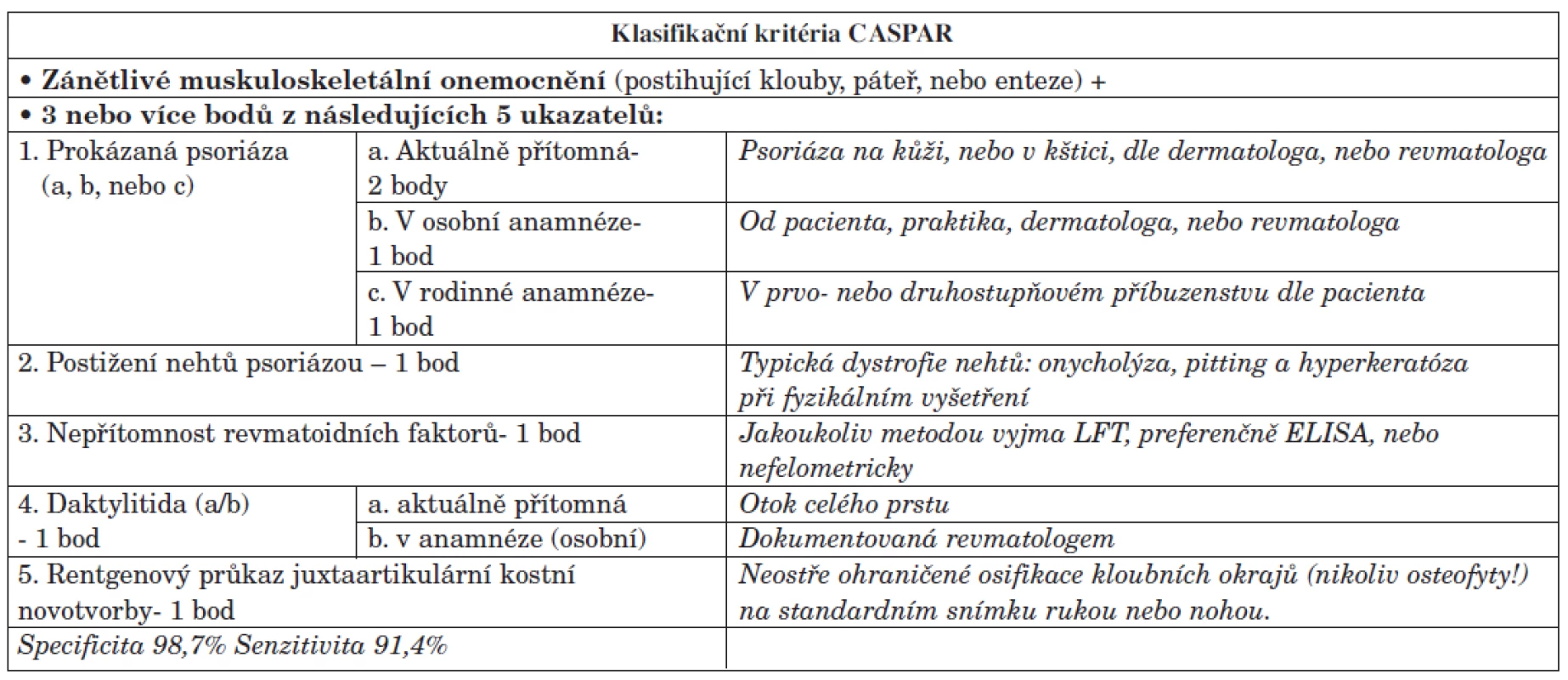
Psoriatická artritida (PsA) je onemocnění, které zahrnuje více klinických manifestací než jen postižení kloubů (artritida) a kůže (psoriáza). Týká se to entezí (entezitida), difuzního zánětu celého prstu (daktylitida) a axiálního skeletu (sakroiliitida/spondylitida). Proto by bylo výstižnější hovořit spíše o “psoriatické nemoci” než jen o “psoriatické artritidě”. V souvislosti s touto heterogenitou vyvstává otázka klasifikačních kritérií pro PsA. Dosud používaná diagnostická kritéria dle Molla Wrighta z r. 1971 (1) nepostihují v plné šíři klinický obraz PsA. Od té doby byla vyvinuta řada dalších klasifikačních kritérií mj. (2; 3) která se však neujala. Nová klasifikační kritéria CASPAR (ClASsification criteria for Psoriatic ARthritis) (tab. 1) umožňují stanovení diagnózy jak časné, tak etablované psoriatické artritidy s vysokou specificitou a senzitivitou (4). Na rozdíl od předchozích postihují i jiné manifestace než artritidu.
Obecné principy sledování a léčby PsA 
Chceme-li tedy hodnotit psoriatickou artritidu komplexně, je třeba do tohoto hodnocení zahrnout nejen artritidu a psoriázu, ale i uvedené další projevy, tj. entezitidy, daktylitidy a axiální postižení.
Po extenzivním studiu literatury, diskuzích expertů a konečném konsenzu publikovala skupina GRAPPA (“Group for Research in Psoriasis and Psoriatic arthritis”) doporučení pro hodnocení a léčbu jednotlivých manifestací “psoriatické nemoci” (5). Tato doporučení byla následně inkorporována do numerického kompozitního indexu, ve snaze vyjádřit komplexně aktivitu všech manifestací “psoriatické nemoci” - CPDAI (“Composite psoriatic disease activity index”) (6; 7). Probíhající diskuze ale poukazuje na obtíže při konstrukci takto vytvořeného jednoduchého sumačního skóre, jehož použití v praxi by mohlo být problematické 8. Paralelně s vývojem doporučení GRAPPA vytvořila pracovní skupina Evropské ligy proti revmatismu (EULAR) vlastní doporučení pro sledování a farmakologickou léčbu psoriatické artritidy, která byla recentně publikována 9. Výsledkem práce této skupiny je 5 obecných principů, 10 doporučení pro sledování a léčbu PsA a algoritmus léčebného postupu, zčásti zohledňující i ostatní klinické manifestace psoriatické artritidy.
Doporučení
- Nesteroidní antirevmatika mohou být použita ke kontrole symptomů jako lék první linie. Ke kontrole symptomů může být použito i prostých analgetik.
- Pacienti s aktivním onemocněním (definice zdola) a s přítomností nepříznivých prognostických ukazatelů (zejm. polyartritida, strukturální kloubní poškození, elevace reaktantů akutní fáze - FW, CRP a s klinicky významnými extraartikulárními manifestacemi) by měli být zavedeni na léčbu DMARD (metotrexát - MTX, leflunomid a sulfasalazin - SSZ), nejlépe již v časných fázích onemocnění.
- Pacienti s aktivní artritidou a současně s klinicky významnou psoriázou by měli být léčeni farmaky, která současně příznivě ovlivňují i kožní syndrom (např. MTX, leflunomid, cyklosporin A).
- Lokální injekce glukokortikoidů jsou významnou adjuvantní léčbou u psoriatické nemoci. Systémové podávání glukokortikoidů v nejnižší účinné dávce může být použito s opatrností.
- U pacientů s aktivní artritidou a neadekvátní odpovědí na 1 syntetické DMARD by měla být zavedena biologická léčba anti-TNFα.
- U pacientů s aktivní entezitidou a / nebo daktylitidou s neadekvátní odpovědí na NSA a lokální injekce glukokortikoidu může být zvážena léčba anti-TNF.
- U pacientů s převažujícím aktivním axiálním postižením, které neodpovídá na léčbu NSA by měla být zvážena léčba anti-TNFα.
- Léčba inhibitory TNFα může být výjimečně použita bez předchozího selhání DMARDs v případě velmi aktivního onemocnění (polyartritida s více aktivními klouby, strukturální kloubní poškození v přítomnosti známek zánětu a/ nebo s klinicky významnými extraartikulárními manifestacemi, zejména s extenzivním kožním postižením).
- U pacientů, kteří neodpovídají adekvátně na jeden inhibitor TNFα by měla být zvážena změna za jiný preparát anti-TNFα.
- Při volbě / úpravě léčby by měly být zváženy i jiné faktory než je aktivita onemocnění, jako komorbidity a bezpečnost léčby.
Doporučené postupy ČRS pro léčbu psoriatické artritidy
Dosud platná doporučení ČRS (Česká revmatologická společnost) pocházejí z r. 2005 (10). Tyto nové poznatky nás vedly k vytvoření nových doporučení, která vycházejí převážně z doporučení EULAR (9).
V současné době nelze pominout skutečnost, že PsA je onemocnění postihující mimo periferní klouby i enteze, měkké tkáně celého prstu (daktylitidy) a axiální skelet (pomineme-li extraskeletální manifestace). Proto existují tendence zahrnout do léčebných doporučení i tyto extraartikulární manifestace, což činí každý léčebný algoritmus složitějším. Je snaha, zejména ze strany GRAPPA konstruovat numericky vyjádřený kompozitní index jako obdobu DAS28 u revmatoidní artritidy (6; 7). Vzhledem ke komplikovanosti tohoto systému hodnocení, které zahrnuje i hodnocení kožního syndromu pomocí PASI (Psoriasis Area and Severity Index) jsme se přidrželi návrhu EULAR.
Pro diagnózu “psoriatické nemoci” bude vzhledem k heterogenitě projevů PsA použito nových klasifikačních kritérií CASPAR (4), tab. 1.
V našem systému je farmakoterapie rozdělena do 4 úrovní (tab. 2), každá úroveň pak podle přítomnosti či nepřítomnosti určitého znaku na podskupinu a, resp. b (např. v úrovni I je to tíže kožního syndromu, v úrovni II nepřítomnost či přítomnost kontraindikací k metotrexátu a v úrovni III je to přítomnost či nepřítomnost nepříznivých prognostických markerů). Úroveň IV se týká změny preparátu při neúčinnosti v monoterapii, nebo v kombinaci s „chorobu modifikujícími farmaky“ -DMARDs („disease modifying antirheumatic drugs“).
Table 2. 
Legenda: DMARD: disease modyfying anti-rheumatic drug, DAKT/ENT/AX: daktylitida, nebo entezitida, nebo axiální postižení, MDA: Minimal disease aktivity – Tab. 3, MTX: metotrexát, SSZ: sulfasalazin, CsA: cyklosporin A, GK: glukokortikoidy Současně tato doporučení zavádějí princip terapie zaměřené k určenému cíli („targeted therapy“). Léčebný cíl u PsA není zatím možno vyjádřit numericky tak jako u RA (DAS28). Za cíl tedy byla zvolena buď remise, nebo alespoň dosažení tzv. „minimální aktivity onemocnění“ (MDA –„minimal disease activity „) tab. 3 (11). Tato kritéria zahrnují nově i entezitidy. Ukazatele humorální aktivity (CRP) byly vypuštěny vzhledem k tomu že jsou často normální i u klinicky aktivních onemocnění. Bylo zahrnuto i funkční hledisko (HAQ). Použití MDA jako terapeutického cíle má i určitou prognostickou hodnotu vzhledem k tomu, že pacienti, kteří dosáhli tohoto stavu mají menší pravděpodobnost rentgenové progrese (12).
NSA - Úroveň I
Jsou lékem první volby u aktivní PsA – tab. 4. Není nezbytné podávat NSA paušálně všem pacientům, v některých případech lze vystačit s prostými analgetiky, někteří pacienti nevyžadují žádnou symptomatickou terapii. Koxiby jsou v této indikaci stejně účinné jako neselektivní NSA.
Glukokortikoidy (GK) – Úroveň I-IV
Intraartikulární aplikace GK je užitečná u lokalizovaných forem (oligo/monoartritida, entezitida, daktylitida) a u akutních vzplanutí jinak dobře kontrolovaných polyartikulárních forem. V případě daktylitid se glukokortikoid aplikuje do šlachové pochvy, případně do okolí šlachy).
Systémové podávání GK je spojeno s rizikem vzplanutí kožního syndromu při pokusu o jejich detrakci, i když pro to není opora v klinických studiích. Současně chybí doklady o účinnosti GK u psoriatické artritidy. Přesto v registrech pacientů s PsA užívá značná část pacientů systémové GK (např. v německém registru 30% pacientů). Podle současného názoru expertů by měly být GK užity se zvláštní opatrností zejména u pacientů s těžkou, nebo rozsáhlou psoriázou a / nebo u těch, bez současného podávání DMARDs.
DMARDs - Úroveň IIa;b/IIIa
Jsou indikovány tam, kde nebylo dosaženo léčebného cíle postupem na úrovni I (NSA; GK). Lékem 1. volby je při nepřítomnosti kontraindikací či intolerance metotrexát (úroveň IIa). Alternativou jsou leflunomid, sulfasalazin, nebo cyklosporin A. Jsou určité doklady o příznivém ovlivnění kloubního syndromu i pro zlato a azathioprin, úroveň důkazů účinnosti je ale nízká (13).
Obecně je předpokladem pro zavedení DMARDs nedosažení léčebného cíle léčbou v úrovni I (NSA, lokální instilace glukokortikoidu). V přítomnosti negativních prognostických markerů – tab. 5, nebo závažného kožního syndromu – tab. 6 je možné tuto úroveň vynechat a zavést léčbu DMARDs ihned.
Dávka MTX se pohybuje od 10 mg do 25 mg/týden v kombinaci s kyselinou listovou v dávce 5 až 10 mg / týden. Dávka MTX by měla být dostatečná, minimální léčebná dávka se zdá být 15 mg/týden (14).
Účinnost syntetických DMARDs nebyla prokázána pro entezitidy a axiální postižení.
Ovlivnění rentgenové progrese pro DMARDs nebylo testováno (cyklosporin, leflunomid), nebo nebylo prokázáno (MTX, sulfasalazin, zlato, azathioprin).
Biologická léčba (anti-TNF) - Úroveň IIIb:
Obecně je biologická léčba anti-TNF indikována v případě selhání léčby nižší úrovní tedy zpravidla syntetickými DMARDs v průběhu 3–6 měsíců (dle farmakodynamického profilu léku). Selháním léčby se rozumí nedosažení léčebného cíle, tj. remise, nebo stavu „minimální aktivity (MDA). Výjimečně může být anti-TNF lékem 1. volby (bez požadavku předchozího selhání léčby syntetickým DMARD). Důvodem pro tento postup může být přítomnost negativních prognostických faktorů - tabulka 5, zejména v přítomnosti těžkého kožního syndromu, nebo závažných extraartikulárních manifestací, kontraindikace všech syntetických DMARDs, případně nutnosti rychlého nástupu účinku u profesně vysoce angažovaných osob (9).
Nebyly prokázány rozdíly v účinnosti mezi jednotlivými inhibitory TNFα (TNFi), i když studie srovnávající jednotlivé preparáty přímo chybí. Nejsou žádné doklady o vyšší účinnosti TNFi v kombinaci se syntetickými DMARDs ve srovnání s TNFi v monoterapii. TNFi jsou účinné i u entezitid a daktylitid. U těchto pacientů může být léčba TNFi indikována i bez předchozího léčebného pokusu syntetickými DMARDs, vzhledem k tomu, že chybí doklady o jejich účinnosti v těchto situacích (13). Předpokladem pro takový postup je ale selhání nespecifické protizánětlivé léčby (NSA) a alespoň 2 lokálních injekcí glukokortikoidu a přetrvávající těžká entezitida / daktylitida. V současné době není shoda v definici závažné / těžké entezitidy / daktylitidy. Pro potřebu těchto „doporučení“ definujeme závažnou / těžkou daktylitidu jako přítomnost 3 míst s entezitidou, resp. 3 prstů postižených daktylitidou a významné funkční omezení – tab. 7 (6).
U pacientů s predominantním aktivním postižením axiálního skeletu je indikována biologická léčba bez předchozího pokusu se syntetickým DMARD. Aktivním axiálním postižením se zde rozumí hodnota BASDAI > 40 mm (VAS 100 mm) a hodnota ASQoL (Ankylosing Spondylitis Quality of Life) > 6 - tab. 7.
Změna za jiný TNFi (TNF inhibitor) - úroveň IV.
Evidence o účinnosti změny TNFi tam, kde selhala léčba prvním TNFi pochází pouze z observačních studií (15;16), resp. je extrapolována ze studií u RA. Randomizovaná studie, která by porovnala změnu jednotlivých TNFi v současné době není k dispozici.
Zvlášť je uveden postup při indikaci biologické léčby – tab. 8.
Závěr
Tato „Doporučení“ jsou pokusem shrnout poslední poznatky a výsledky práce pracovních skupin GRAPPA a EULAR týkající se klasifikace, monitorování průběhu a léčby psoriatické artritidy. Cílem je poskytnout lékařům zabývajícím se léčbou a sledováním těchto pacientů orientaci v této nyní rychle se vyvíjející oblasti a usnadnit rozhodování o léčebných postupech. Tato „Doporučení“ ale nemohou postihnout všechny specifické rysy průběhu onemocnění u jednotlivých pacientů. Při rozhodování o léčbě konkrétního pacienta bude vždy nutné tato specifika zohlednit. Lze očekávat, že v relativně krátké době dojde k dalšímu vývoji v této oblasti, který si vyžádá aktualizaci těchto doporučení.
Poděkování: Tato práce vznikla za podpory Výzkumných záměrů MZ ČR č. 000 000 23728
MUDr. Jiří Štolfa
Revmatologický ústav
Na Slupi 4
128 50 Praha 2
Sources
1. Wright V, Moll JM. Psoriatic arthritis. Bull Rheum Dis 1971;21 : 627-32.
2. Helliwell PS, Taylor WJ. Classification and diagnostic criteria for psoriatic arthritis. Ann Rheum Dis 2005;64 Suppl 2:ii3-8.
3. Fournie B, Crognier L, Arnaud C, et al. Proposed classification criteria of psoriatic arthritis. A preliminary study in 260 patients. Rev Rhum Engl Ed 1999;66 : 446-56.
4. Taylor W, Gladman D, Helliwell P, Marchesoni A, Mease P, Mielants H. Classification criteria for psoriatic arthritis: development of new criteria from a large international study. Arthritis Rheum 2006; 54 : 2665-73.
5. Ritchlin CT, Kavanaugh A, Gladman DD, et al. Treatment recommendations for psoriatic arthritis. Ann Rheum Dis 2009;68 : 1387-94.
6. Mumtaz A, Gallagher P, Kirby B, et al. Development of a preliminary composite disease activity index in psoriatic arthritis. Ann Rheum Dis 2011; 70 : 272-7. Erratum in: Ann Rheum Dis 2011;70(4):716.
7. Mumtaz A, FitzGerald O. Application of GRAPPA psoriatic artritis treatment recommendations in clinical practice. Curr Rheumatol Rep 2010;12 : 264-71.
8. Coates LC, Mumtaz A, Helliwell PS, et al. Development of a disease Severity and responder index for psoriatic arthritis (PsA)-report of the OMERACT 10 PsA special intrest group. J Rheumatol 2011;38 : 1496-501.
9. Gossec L, Smolen JS, Gaujoux-Viala C, et al. European League Against Rheumatism recommendations for the management of psoriatic arthritis with pharmacological therapies. Ann Rheum Dis 2012 Jan;71 : 4-12.
10. Štolfa J, Pavelka K, Vencovský J. Standardní postupy v léčbě psoriatické artritidy. Čes Revmatol 2005; 3 : 97-105.
11. Coates LC, Cook R, Lee KA, Chandran V, Gladman DD. Frequency, predictors, and prognosis of sustained minimal disease activity in an observational psoriatic arthritis cohort. Arthritis Care Res (Hoboken) 2010 ;62 : 970-6.
12. Coates LC, Helliwell PS. Validation of minimal disease activity Criteria for psoriatic arthritis using international trial data. Arthritis Care Research 2010; 965-969.
13. Ash Z, Gaujoux-Viala C, Gossec L, et al. A systematic literature review of conventional and biologic drug therapies for the treatment of psoriatic arthritis: current evidence informing the EULAR recommendations for the management of Psoriatic arthritis. Ann Rheum Dis 2011; [Epub ahead of print].
14. Ceponis A, Kavanaugh A. Use of methotrexate in patients with psoriatic arthritis. Clin Exp Rheumatol 2010; 28 (Suppl. 61):S132-S137.
15. Gomez –Reino J, Carmona L. Switching TNF antagonists in patientes with chronic arthritis:an observational study od 488 patients over a four-year period. Arthritis Res Ther 2006;8:R29.
16. Saad A, Ashcroft DM, Watson KD, et al. Persistence with anti-tumour necrosis factor therapies in patients with psoriatic arthritis: observational study from the British Society of Rheumatology Biologic register. Arthritis Res Ther 2009;11:R52.
Labels
Dermatology & STDs Paediatric rheumatology Rheumatology
Article was published inCzech Rheumatology

2012 Issue 1-
All articles in this issue
- Doporučení České revmatologické společnosti pro léčbu ankylozující spondylitidy
- Doporučené postupy České revmatologické společnosti pro léčbu psoriatické artritidy
- Přesná diagnostika jednotlivých forem renální osteopatie v rámci minerálové a kostní nemoci při chronickém onemocnění ledvin
- Zkrácený referát: Imunogenetické a hormonální predispoziční markery systémových revmatických onemocnění, zejména systémového lupusu erythematodu
- Czech Rheumatology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Doporučení České revmatologické společnosti pro léčbu ankylozující spondylitidy
- Přesná diagnostika jednotlivých forem renální osteopatie v rámci minerálové a kostní nemoci při chronickém onemocnění ledvin
- Doporučené postupy České revmatologické společnosti pro léčbu psoriatické artritidy
- Zkrácený referát: Imunogenetické a hormonální predispoziční markery systémových revmatických onemocnění, zejména systémového lupusu erythematodu
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career