-
Medical journals
- Career
Anti-PM-Scl protilátky u myositid
Authors: L. Pleštilová 1,2; J. Vencovský 1
Authors‘ workplace: Revmatologický ústav, Praha 1; 6. ročník, 3. lékařská fakulta, Univerzita Karlova, Praha 2
Published in: Čes. Revmatol., 17, 2009, No. 4, p. 200-204.
Category: Overview Reports
Overview
Anti-PM-Scl protilátky se nejčastěji vyskytují u pacientů s překryvným syndromem polymyositidy a systémové sklerózy (31%), vzácněji při samotné myositidě (8–11%), nebo systémové skleróze (2%). Jejich průkaz bývá spojen s lepší prognózou onemocnění, které obvykle dobře reaguje na léčbu nízkými až středními dávkami glukokortikoidů. PM-Scl autoantigenem je “lidský exozóm”, makromolekulární komplex 11–16 polypeptidů, který se v buněčném jadérku účastní štěpení prekurzorové rRNA a v cytoplazmě pomáhá degradovat zralou mRNA. Primární protilátková reakce proti PM-Scl komplexu je namířena proti PM-Scl-100 proteinu, jehož hlavním epitopem je PM1-α peptid.
Klíčová slova:
myositida, systémová skleróza, exozóm, anti-PM-Scl, PM1-αÚvod
Myositidy jsou získaná zánětlivá onemocnění příčně pruhovaných svalů. Projevují se svalovou slabostí, zvýšenou hladinou svalových enzymů a charakteristickými elektromyografickými změnami. V biopsii svalové tkáně je obvykle zjištěn mononukleární zánětlivý infiltrát (1). Základní klinická klasifikace rozlišuje dermatomyositidu (DM), polymyositidu (PM), myositidu s inkluzními tělísky (IBM), juvenilní dermatomyositidu a PM/DM asociovanou s malignitou nebo s jinou chorobou pojivové tkáně (2).
Nejčastější je asociace PM/DM se systémovou sklerózou (Scl). Anglický termín „overlap syndrome“ popisuje podle některých autorů prostou asociaci PM/DM s další nemocí pojivové tkáně, podle jiných jde o sdílení některých klinických znaků (sklerotické ztluštění dermis, hypomotilita jícnu, mikroangiopatie) možné pouze mezi DM a Scl (3).
Imunopatogeneze myositid
Dermatomyositida je převážně protilátkově zprostředkované onemocnění, předpokládá se existence humorální imunity namířené proti endotelu endomysiálních kapilár, které aktivují komplement. Útočné složky komplementu (membránu atakující komplex – MAC) se poté ukládají ve svalových kapilárách. Zbývající kapiláry se kompenzatorně dilatují, přesto dochází k perifascikulární atrofii svalových vláken. Aktivace komplementu vede zároveň k uvolnění cytokinů zvyšujících expresi adhezivních molekul (VCAM-1, ICAM-1) endotelovými buňkami. Do perimysia a endomysia pak mohou vstoupit CD4+ T buňky a makrofágy (2, 3).
Polymyositida je převážně buněčně zprostředkovaná, v endomysiu se nacházejí klonálně expandované CD8+ T buňky pronikající do non-nekrotických svalových vláken. T lymfocyty se na myocyty váží přes četné MHC molekuly I. třídy, které jinak zdravý sval exprimuje zcela minimálně (3).
V infiltrátu u myositidy s inkluzními tělísky také převládají CD8+ T buňky, ale vzhledem k existenci inkluzních tělísek, chybějící reakci na léčbu glukokortikoidy a k vyššímu věku nemocných se předpokládá degenerativní etiologie se sekundární imunitní reakcí (2).
Autoprotilátky u myositid
Dle citlivosti použitých metod lze autoprotilátky prokázat u 56 % až 80 % pacientů s idiopatickou zánětlivou myopatií (1, 4). K autoprotilátkám specifickým pro myositidu patří anti-Jo-1 (15–25 %) a jiné antisyntetázové protilátky (např. anti-PL-7, anti-PL-12, anti-KS, anti-OJ) (3–5 %), anti-Mi-2 (6–14 %) a anti-SRP (2–5 %) (1, 4).
Jo-1 autoantigen je histidyl-tRNA syntetáza, Mi-2 autoantigen se účastní remodelace chromatinu a tím spolureguluje transkripci a SRP (signal recognition particle) způsobuje kotranslační translokaci proteinů na membránu ER (1).
Autoprotilátky asociované s myositidou se vyskytují i u dalších revmatických nemocí bez systémových známek myositidy. Jsou to anti-Ro52 (25-30%), anti-Ro60 (4–11 %), anti-La (5–14 %), anti-U1 RNP (6–15 %), anti-Mas (2 %), anti-PM-Scl a další (1,4).
Autoantigen Ro52 (SSA) je zřejmě E3 ubiquitinová ligáza zapojená do transkripce RNA a tvorby IL-2 (5). Autoantigeny Ro60 a La jsou součástí Ro-ribonukleoproteinového komplexu (RNP), který se účastní transkripce RNA. Přesná funkce tohoto komplexu zůstává nejasná, uvažuje se o úloze chaperonu pro RNA, kontrole kvality transkriptů a ochraně transkriptů před 3ę-exonukleolytickou degradací (6). Autoantigen U1 RNP se nachází v buněčném jádře a je zapojen do štěpení pre-mRNA. Mas je protein vázající t-RNA (1) a autoantigen PM-Scl bude podrobněji probrán v dalším textu.
K některým autoprotilátkám se váží určité klinické příznaky, například anti-Jo-1 bývají častěji spojené s intersticiální plicní fibrózou. Pomocí autoprotilátek lze také předvídat odpověď na léčbu. Anti-Ro pozitivní pacienti dobře odpovídají na samotný prednison, zatímco u anti-Jo1 pozitivních pacientů bývá většinou nutné podávat další imunosupresiva (např. azathioprin, methotrexat) (4,7).
Anti-PM-Sclprotilátky
Anti-PM/Scl protilátky se vyskytují u 31 % pacientů s překryvným syndromem polymyositidy a systémové sklerózy. U pacientů se samotnou polymyositidou jsou anti-PM-Scl protilátky přítomné v 8%, u pacientů s dermatomyositidou v 11 % a u pacientů se systémovou sklerózou ve 2 %. Výjimečně byly anti-PM-Scl protilátky zachyceny u pacientů s myositidou s inkluzními tělísky, Sjőgrenovým syndromem, SLE a se získanou hemofilií (8).
Nejčastější symptomy asociované s anti-PM-Scl protilátkami jsou myositida, Raynaudův fenomén a artritida (tab. 1). Pacienti s anti-PM-Scl protilátkami obvykle dobře reagují na léčbu nízkými až středními dávkami glukokortikoidů (8, 10).
Anti-PM/Scl protilátky častěji vznikají u lidí s určitými alelami MHC (HLA-DRB1*0301, HLA-DQA1*0501, HLA-DQB1*02), zatímco jiné MHC alely působí proti jejich vzniku protektivně (HLA-DRB1*15/*16, HLA-DQA1*0101). Je možné, že HLA polymorfismus způsobuje různost imunitní odpovědi subjektů na podněty z okolí, snad se liší i mechanismus vzniku protilátek u jednotlivých HLA haplotypů (11). K této domněnce přispívá i pozorování u 275 japonských pacientů se systémovou sklerózou, u kterých nebyly anti-PM-Scl protilátky nalezeny vůbec (8). V Japonsku je naopak nejčastější protilátkou při překryvném syndromu mezi PM a Scl protilátka anti-Ku (12).
PM-Scl autoantigen
PM-Scl autoantigen je makromolekulární komplex 11 až 16 polypeptidů s molekulárními hmotnostmi v rozmezí 20 až 110 kDa (obr. 1) (13). Analogické komplexy byly nalezeny u kvasinek Saccharomyces cerevisiae a u E. coli a pojmenovány „exozóm“ (14).
Jádrový komplex exozómu je tvořen devíti proteiny. Vypadá jako prsten ze šesti proteinů s RNázovou aktivitou (PM-Scl-75, hRrp42, hRrp46, hRrp41, hMtr3, OIP2), na kterých leží tři proteiny schopné vázat RNA (hRrp4, hCsl4, hRrp40) (obr. 1).
Image 1. PM-Scl komplex (lidský exozóm) je tvořen prstencem ze šesti proteinů s RNázovou aktivitou (PM-Scl-75, hRrp42, hRrp46, hRrp41, hMtr3, OIP2), na kterých leží tři proteiny schopné vázat RNA (hRrp4, hCsl4, hRrp40).K jádrovému komplexu exozómu se mohou připojovat další proteiny, např. PMScl100 (upraveno dle (8)). 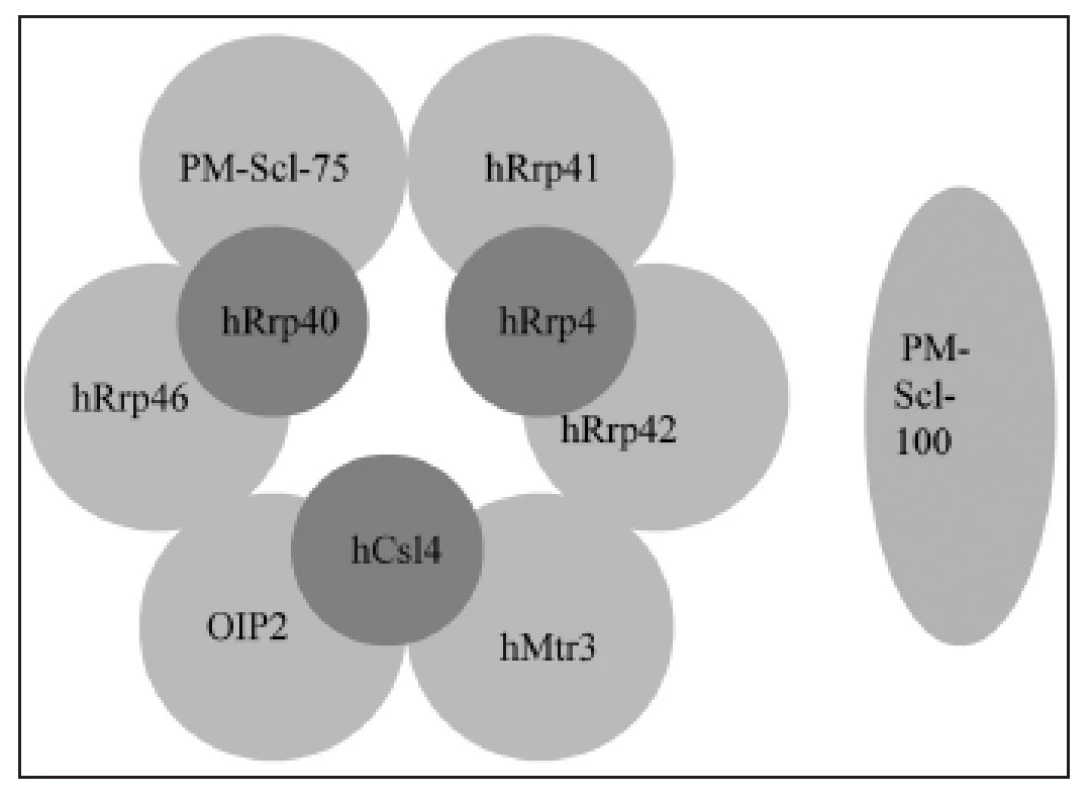
Při určitých buněčných dějích nebo v určité lokalizaci se k jádrovému komplexu exozómu váže ještě několik dalších proteinů, například PM-Scl-100 v buněčném jadérku (8).
Funkce lidského exozómu
Zdá se, že existují dva různé typy exozómů s odlišnou strukturou, umístěním v buňce a funkcí.
První typ se nachází v buněčném jadérku, méně již v jádře, a jednou z jeho složek je PM-Scl-100. V jadérku se formují ribozómy z jednotlivých rRNA (5S, 5,8S, 18S, 25S) a proteinů. Tři z těchto rRNA jsou transkribovány jako 35S prekurzorová rRNA, kterou exozóm pomáhá rozštěpit na jednotlivé dílky. Přes úpravu malé jaderné RNA (small nuclear RNA – snRNA) pomáhá jaderný exozóm štěpit i prekurzorovou mRNA.
Druhý typ exozómu se nachází v cytoplazmě, je vzácnější a chybí mu PM-Scl-100 protein. Účastní se degradace zralé cytoplazmatické mRNA (14).
Antigenicita jednotlivých složek exozómu
Jednotlivé proteiny lidského exozómu jsou různě silným terčem protilátkové odpovědi. Proti PM-Scl-100 proteinu tvoří protilátky téměř všichni anti-PM-Scl pozitivní pacienti. Na PM-Scl-75 protein reaguje 50–60 % anti-PM-Scl pozitivních pacientů, ale jeho nová izoforma PM/Scl-75c je antigenicitou srovnatelná s PM-Scl-100. Proti ostatním složkám exozómu je reaktivita nižší, pacienti, kteří na ně reagují, reagují vždy i na PM-Scl-100 nebo na PM-Scl-75 (tab. 2) (13).
Table 1. Antigenicita jednotlivých proteinů lidského exozómu (data převzata z (8)). 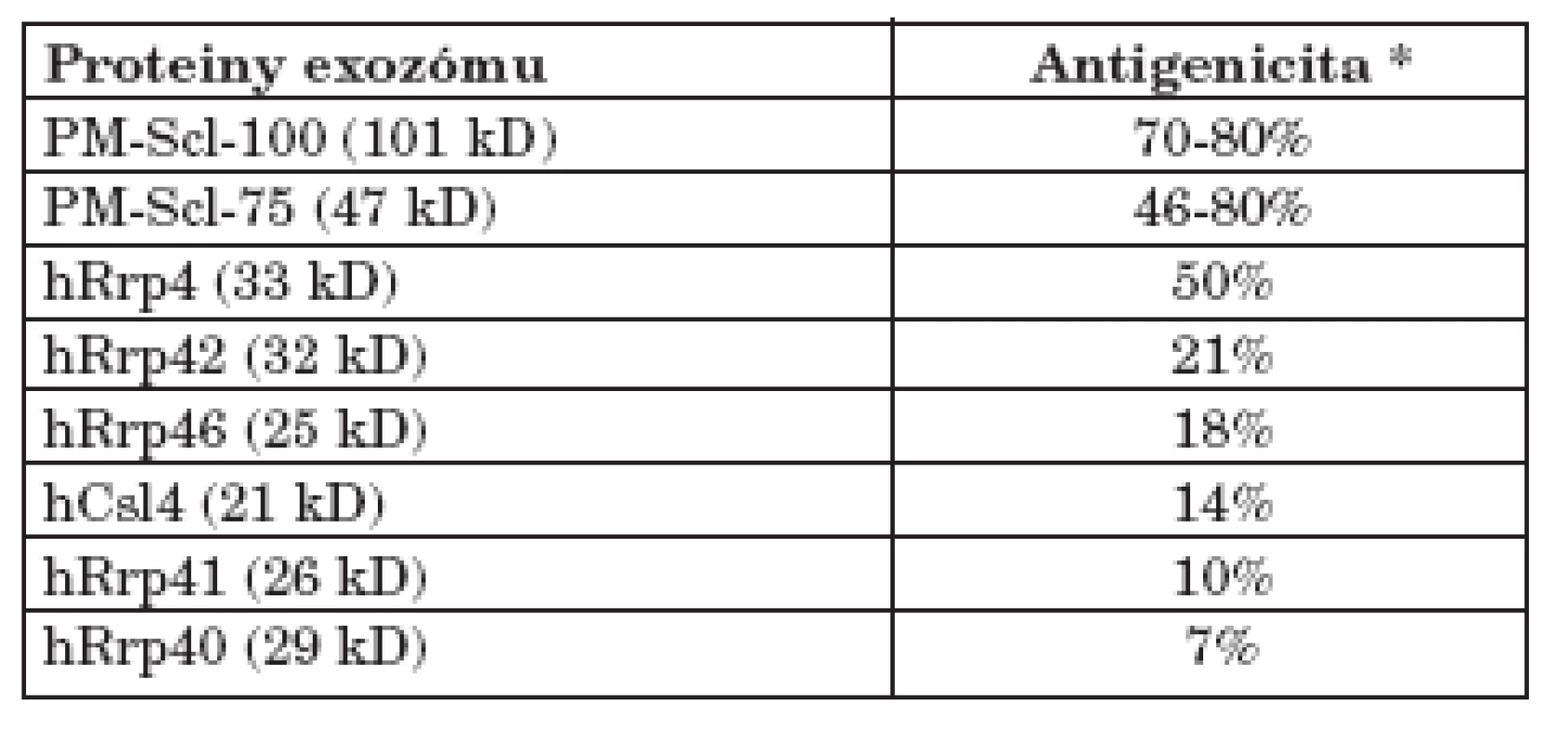
Jedno z možných vysvětlení nabízí teorie šíření epitopů („epitope spreading”), kdy by PM-Scl-100 byl prvotním autoantigenem a imunitní odpověď by se postupně rozšiřovala na další součásti exozómu (15). To je ostatně poměrně častý jev a projevuje se podobně v případě anti-nRNP/Sm a anti Ro/La protilátek, protože peptidy jsou umístěny na společné struktuře. Autoantigenem se PM-Scl-100 stane nejspíše modifikací (fosforylace, defosforylace, štěpení kaspázami) v umírající buňce. Modifikovaný antigen může být translokován na buněčný povrch, uniknout do intersticia nebo je se zbytky mrtvých buněk fagocytován antigen prezentujícími buňkami, které jej přes MHC II vystaví T buňkám (16).
Table 2. Nejčastější klinické projevy překryvného syndromu spojené s přítomností anti-PM-Scl protilátek (9). 
Metody užívané k průkazu anti-PM-Scl protilátek
Pro průkaz anti-PM-Scl protilátek byly používány různé metody: nepřímá imunofluorescence na Hep-2 buňkách (obr. 2), imunodifuze s extraktem z telecích brzlíků, imunoblot s extrahovatelnými jadernými antigeny (detekce anti-PM-Scl Ig touto metodou je obtížná pro slabou reaktivitu) a imunoprecipitace z extraktu radioaktivně značených buněk.
Image 2. Anti-Pm-Scl produkují homogenní jadérkovou fluorescenci na Hep-2 buňkách při nepřímé imunofluorescenci. Mírnou jemně granulární fluorescenci vykazuje také jádro. V dělících se buňkách jsou v metafázi chromozomy negativní a nebarví se ani NOR (nucleolar organising region), na rozdíl chomáčkovité nebo skvrnité nukleolární fluorescence způsobené protilátkami proti fibrilarinu či RNA polymeráze, kde bývají další doprovodné změny v dělících se buňkách. Obr. 3. Reaktivita na PM1-α (a) a na PM-Scl-100 (b) u pacientů s polymyositidou (PM), systémovou sklerózou (Scl) a s překryvným syndromem PM/Scl (data převzata z (6, 17)). revma 4 zlom 14.1.2010 9:25 Str. 202 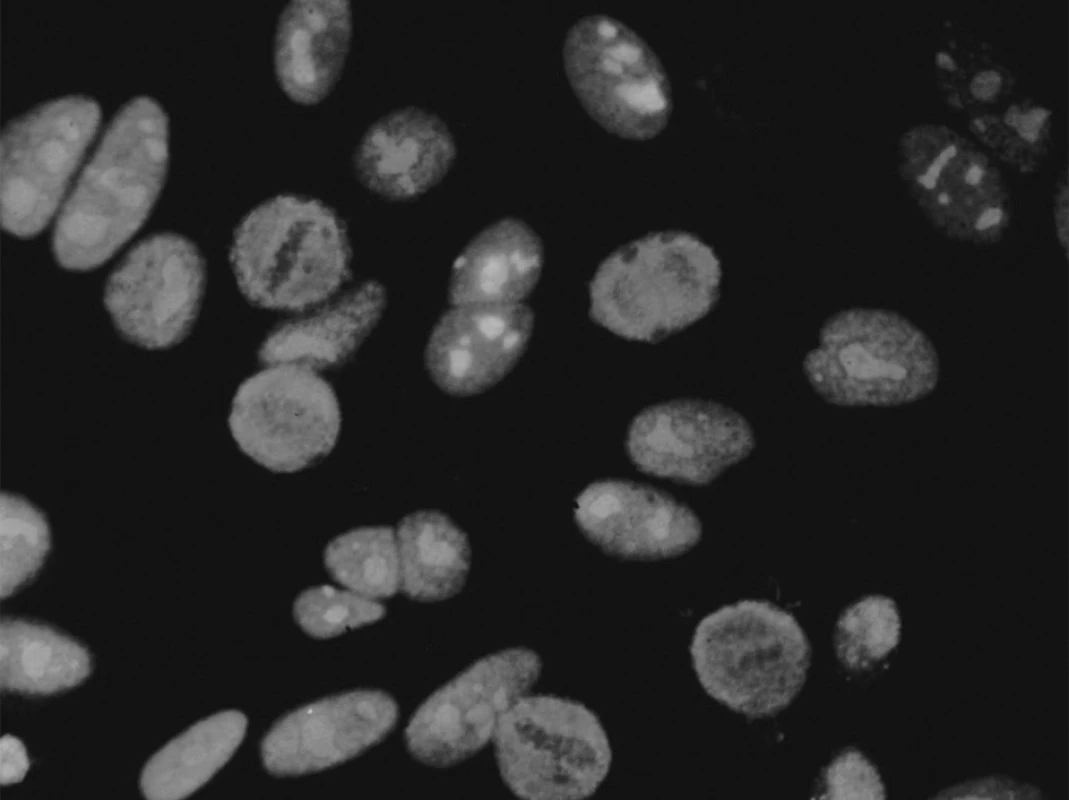
Dnes se pro diagnostiku anti-PM-Scl protilátek nejčastěji používají metody ELISA s rekombinantním PM-Scl proteinem exprimovaným E. coli nebo buňkami hmyzu, enzymový line-blot assay, případně další assaye (imunodot, ALBIA, proteinový čip) (8, 10).
Obecně se soudí, že pro ELISu je ideálním antigenem krátký syntetický peptid – nejlépe hlavní epitop, který je možno syntetizovat nezávisle na biologických systémech a jehož kvalita proto nekolísá. Krátký peptid snižuje pravděpodobnost nespecifických interakcí mezi složkami séra a proteinem, v dlouhém proteinu se epitop může někdy „schovat“. Při malé velikosti jamek používaných při metodě ELISA může být podstatná i vysoká koncentrace epitopů na plochu, jíž lze s krátkými peptidy dosáhnout (10, 14).
PM1-α epitop
Snahou tedy bylo nalézt hlavní epitop u nejčastějšího antigenního terče lidského exozómu - PM-Scl-100 proteinu.
Testování odpovědí anti-PM-Scl pozitivních sér na fragmenty rekombinantního PM-Scl-100 proteinu určilo polohu hlavního epitopu v N-terminální třetině PM-Scl-100 proteinu (AK 231-245). Mutační analýza poté odhalila aminokyseliny 234, 237, 240 a 241 jako nejdůležitější vazebná místa protilátek. Hlavní epitop byl pojmenován “PM1-α” podle sekundární struktury α-helixu, kterou zaujímá. Sekvence aminokyselin PM1-α peptidu je LDVPPALADFIHQQR (13, 17, 18).
Anti-PM1-α protilátky
Protilátky proti epitopu PM1-a byly metodou ELISA prokázány u 7,5 % pacientů s polymyositidou, 13,2 % pacientů se systémovou sklerózou, u 55 % pacientů s PM/Scl překryvným syndromem a u 1,7 % kontrol (obr. 3a) (10).
Reaktivita na PM1-α je tedy vyšší než na PM-Scl-100, kdy odpovídá 8 % pacientů s myositidou, 3 % pacientů se systémovou sklerózou a 24 % pacientů s překryvným syndromem PM/Scl (obr. 3b) (17).
Image 3. Reaktivita na PM1-α (a) a na PM-Scl-100 (b) u pacientů s polymyositidou (PM), systémovou sklerózou (Scl) a s překryvným syndromem PM/Scl (data převzata z (6, 17)). 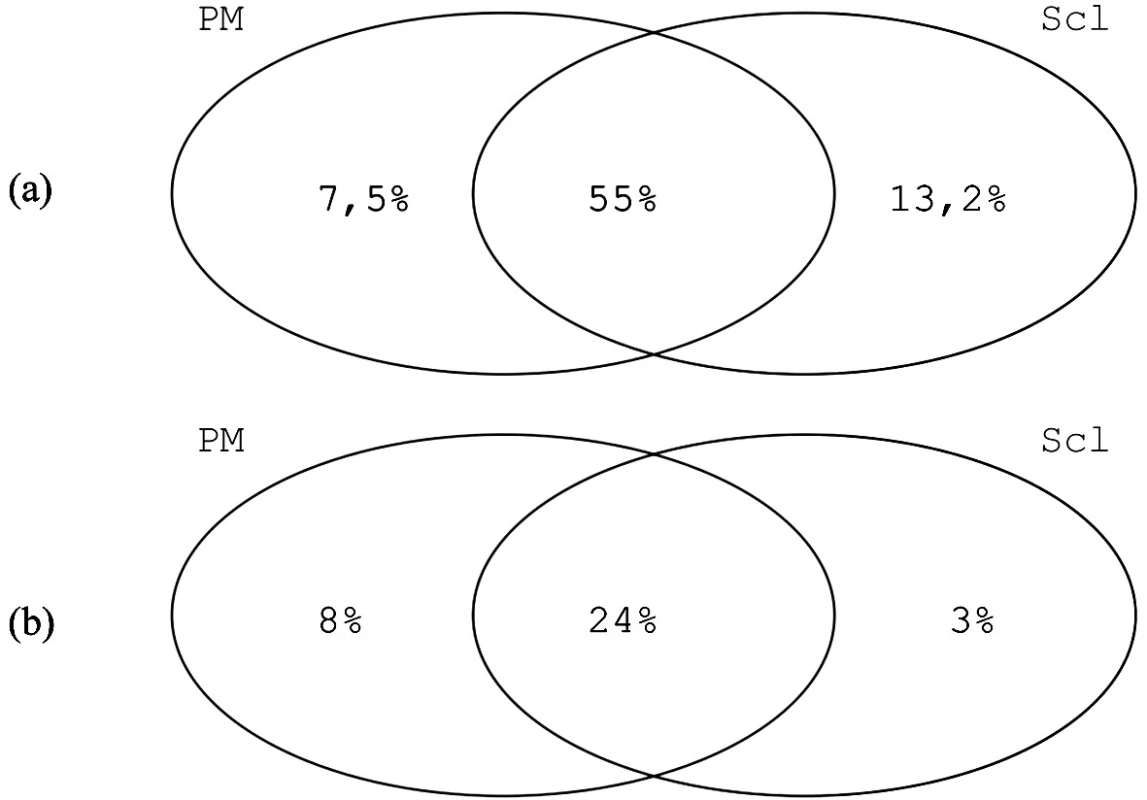
Zajímavý je nerovnoměrný nárůst odpovědí mezi jednotlivými skupinami pacientů při použití PM-Scl-100 proteinu a PM1-α peptidu. Zatímco pacienti s PM-Scl překryvným syndromem reagují na PM1-α přibližně dvakrát častěji než na PM-Scl-100 (24 % ➝ 55 %) a pacienti se systémovou sklerózou dokonce čtyřikrát častěji (3 % ➝ 13,2 %), u pacientů s polymyositidou vidíme mírný pokles odpovědí (8% ➝ 7,5 %) (obr. 3). Zdá se, že anti-PM-1-α protilátky se vyskytují častěji u nemocných, kteří mají nějaké známky sklerodermie.
Michal Mahler et al. testovali 81 vzorků (pacienti s PM, DM, Scl, PM/Scl, melanomem a kontroly) na přítomnost protilátek proti rekombinantním PM-Scl proteinům a proti PM1-α peptidu. Všechna séra reagující s PM-Scl-100 nebo s PM-Scl-75 reagovala i s PM1-α. Ve skupině pacientů s překryvným syndromem PM/Scl (n = 32) reagovalo 27,8 % vzorků s PM1-α peptidem, aniž by byla prokázána reakce s jakýmkoliv z rekombinantních proteinů. V několika případech byla zjištěna přítomnost anti-PM1-α protilátek u pacientů s HCV, SLE nebo s maligním melanomem (13).
Je PM-Scl-75 hlavním antigenem u Scl?
Zcela nově se objevil názor, že u pacientů se systémovou sklerózou je hlavním autoantigenem protein PM-Scl-75. Hanke et al. testovali 280 sér pacientů se systémovou sklerózou plus různé kontroly na přítomnost anti-PM-Scl-100 a anti-PM-Scl-75 protilátek metodou LIA (line immunoblot assay) a v jejich souboru tvořilo anti-PM-Scl-75 protilátky 10,4 % pacientů se systémovou sklerózou, zatímco anti-PM-Scl-100 protilátky pouze 7,1 % pacientů.
Prevalence jednotlivých protilátek se navíc lišila podle druhu nemoci. Pacienti s difuzní sklerodermií tvořili v 19,8 % anti-PM-Scl protilátky, a to převážně proti PM-Scl-75 proteinu. U pacientů s překryvným syndromem byl výskyt anti-PM-Scl protilátek zaznamenán v 17,6 %, a to proti PM-Scl-100 i PM-Scl-75 proteinu. U pacientů s limitovanou systémovou sklerózou byly anti-PM-Scl protilátky nalezeny pouze ve 3,5 %.
Hanke et al. tedy soudí, že při testování pouze na přítomnost anti-PM-Scl-100 protilátek by velká část pacientů se systémovou sklerózou zůstala nepoznána (19). Mahler však poukazuje na metodické nepřesnosti studie, například na nevhodně zvolené parametry svalového postižení (CK a svalová atrofie namísto EMG a biopsie) a na nedostatečný popis použitého rekombinantního PM-Scl-100 antigenu (20).
Závěr
Anti-PM-Scl protilátky jsou charakteristickým sérologickým znakem pacientů s PM/Scl překryvným syndromem.
Anti-PM-Scl pozitivní pacienti mají oproti dalším pacientům s myositidou nebo se systémovou sklerózou lepší prognózu a obvykle dobře reagují na léčbu nízkými až středními dávkami kortikosteroidů.
Primární protilátková reakce proti lidskému exozómu je namířena proti PM-Scl-100 antigenu, jehož hlavním epitopem je PM1-α. Zdá se, že ELISA s tímto peptidem je zatím nejcitlivější metodou pro stanovení anti-PM-Scl protilátek. Toto vyšetření je užitečné při diagnostice myositid, může pomoci při výběru vhodné léčby a při odhadu prognózy. Úloha anti-PM-Scl protilátek v imunopatogenezi myositid však zatím zůstává neznámá.
Práce byla podpořena výzkumnými záměry Ministerstva zdravotnictví ČR č. 00000023728..
Prof. MUDr. J. Vencovský
Revmatologický ústav
Na Slupi 4
128 50 Praha 2
Sources
1. Brouwer R, Hengstman GJ, Vree Egberts W, Ehrfeld H, Bozic B, Ghirardello A, et al. Autoantibody profiles in the sera of European patients with myositis. Ann Rheum Dis 2001;60 : 116-23.
2. Vencovský J. Diferenciální diagnostika a léčba idiopatických zánětlivých myopatií. Interní medicína pro praxi 2005;11 : 480-483
3. Dalakas MC, Hohlfeld R. Polymyositis and dermatomyositis. Lancet 2003;362(9388):971-82.
4. Koenig M, Fritzler MJ, Targoff IN, Troyanov Y, Senécal JL. Heterogeneity of autoantibodies in 100 patients with autoimmune myositis: insights into clinical features and outcomes. Arthritis Res Ther 2007;9:R78.
5. Wada K, Kamitani T. Autoantigen Ro52 is an E3 ubiquitin ligase. Biochem Biophys Res Commun 2006;339 : 415-21.
6. Belisova A, Semrad K, Mayer O, Kocian G, Waigmann E, Schroeder R, et al. RNA chaperone activity of protein components of human Ro RNPs. RNA 2005;11 : 1084-94.31.
7. Seiberlich B, Hunzelmann N, Roers A, Weber M , Schulze-Lohoff E. Das Jo-1-Syndrom und seine klinischen Manifestationen. Medizinische Klinik 2005;100 : 137-142
8. Mahler M, Raijmakers R. Novel aspects of autoantibodies to the PM/Scl complex: clinical, genetic and diagnostic insights. Autoimmun Rev 2007;6 : 432-7.
9. Marguerie C, Bunn CC, Copier J, Bernstein RM, Gilroy JM, Black CM, et al. The clinical and immunogenetic features of patients with autoantibodies to the nucleolar antigen PM-Scl. Medicine (Baltimore) 1992;71 : 327-36.
10. Mahler M, Fritzler MJ. PM1-Alpha ELISA: the assay of choice for the detection of anti-PM/Scl autoantibodies? Autoimmun Rev 2009;8 : 373-8.
11. O‘Hanlon TP, Carrick DM, Targoff IN, Arnett FC, Reveille JD, Carrington M, et al. Immunogenetic risk and protective factors for the idiopathic inflammatory myopathies: distinct HLA-A, -B, -Cw, -DRB1, and -DQA1 allelic profiles distinguish European American patients with different myositis autoantibodies. Medicine (Baltimore) 2006;85 : 111-27.
12. Jury EC, D‘Cruz D, Morrow WJ. Autoantibodies and overlap syndromes in autoimmune rheumatic disease. J Clin Pathol 2001;54 : 340-7.
13. Mahler M, Raijmakers R, Dähnrich C, Blüthner M, Fritzler MJ. Clinical evaluation of autoantibodies to a novel PM/Scl peptide antigen. Arthritis Res Ther 2005;7:R704-13.
14. Brouwer R, Pruijn GJ, van Venrooij WJ. The human exosome: an autoantigenic complex of exoribonucleases in myositis and scleroderma. Arthritis Res 2001;3 : 102-6.
15. Brouwer R, Vree Egberts WT, Hengstman GJ, Raijmakers R, van Engelen BG, Seelig HP, et al. Autoantibodies directed to novel components of the PM/Scl complex, the human exosome. Arthritis Res 2002;4 : 134-8.
16. Rodenburg RJ, Raats JM, Pruijn GJ, van Venrooij WJ. Cell death: a trigger of autoimmunity? Bioessays 2000;22 (7):627-36.
17. Mahler M, Blüthner M, Pollard KM. Advances in B-cell epitope analysis of autoantigens in connective tissue diseases. Clin Immunol 2003;107(2):65-79.
18. Blüthner M, Mahler M, Müller DB, Dünzl H, Bautz FA. Identification of an alpha-helical epitope region on the PM/Scl-100 autoantigen with structural homology to a region on the heterochromatin p25beta autoantigen using immobilized overlapping synthetic peptides. J Mol Med 2000;78(1):47-54.
19. Hanke K, Brückner CS, Dähnrich C, Huscher D, Komorowski L, Meyer W, et al. Antibodies against PM/Scl-75 and PM/Scl-100 are independent markers for different subsets of systemic sclerosis patients. Arthritis Res Ther 2009;11(1):R22.
20. Mahler M, Fritzler MJ. The changing landscape of the clinical value of the PM/Scl autoantibody system. Arthritis Res Ther 2009;11(2):106.
Labels
Dermatology & STDs Paediatric rheumatology Rheumatology
Article was published inCzech Rheumatology

2009 Issue 4-
All articles in this issue
- Sérová hladina kyseliny hyaluronové – prediktivní biomarker rentgenové progrese osteoartrózy kloubů rukou
- Leflunomid v současném algoritmu léčby revmatoidní artritidy
- Anti-PM-Scl protilátky u myositid
- Proteíny tepelného šoku – dôležitá súčasť imunitnej odpovede
- Masivní gastrointestinální krvácení u pacientky s Wegenerovou granulomatózou – kazuistika
- Czech Rheumatology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Anti-PM-Scl protilátky u myositid
- Proteíny tepelného šoku – dôležitá súčasť imunitnej odpovede
- Leflunomid v současném algoritmu léčby revmatoidní artritidy
- Sérová hladina kyseliny hyaluronové – prediktivní biomarker rentgenové progrese osteoartrózy kloubů rukou
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

