-
Medical journals
- Career
Cytokiny BAFF (B-cell activating factor) a APRIL (a proliferation-inducing ligand) a jejich role u autoimunitních onemocnění
Authors: O. Kryštůfková
Authors‘ workplace: Revmatologický ústav, Praha
Published in: Čes. Revmatol., 16, 2008, No. 1, p. 9-15.
Category: Overview Reports
Overview
B-lymfocyty hrají významnou úlohu v patogenezi autoimunitních onemocnění a jsou cílovými buňkami při léčbě rezistentních forem systémových revmatických onemocnění (SRO). Cytokin BAFF (B-cell activating factor) podporuje maturaci a přežití různých diferenciačních stadií B-lymfocytů včetně autoreaktivních klonů. Funkce BAFF jsou komplexní, vzhledem k tomu že má tři receptory z nichž dva sdílí s dalším ligandem zvaným APRIL (a proliferation-inducing ligand). Jsou to BAFF-R (BAFF receptor), BCMA (B-cell maturation antigen) a TACI (transmembrane activator and calcium monulator and cyclophilin ligand interactor) a exprimují se diferencovaně v různých stadiích maturace B-buněk. O biologickém významnu BAFF a APRIL v patogeneze SRO svědčí skutečnost, že byly prokázány vysoké hladiny těchto cytokinů v séru a exprese v postižených orgánech u nemocných s různými systémovými revmatickými onemocněními, jako jsou primární Sjögrenův syndrom, systémový lupus erythematodes, revmatoidní artritida, systémová sklerodermie nebo dermatomyozitida/polymyozitida. Abnormální hladiny BAFF korelovaly s aktivitou onemocnění, nebo s pozitivitou autoprotilátek, či s jejich titrem. Na podkladě těchto zjištění a zkušeností s neutralizací BAFF pomocí protilátek či receptorů u myších modelů autoimunitních chorob se tento cytokin stal potenciálním terapeutickým cílem. Blok BAFF může být výhodnější oproti navození deplece B-lymfocytů protilátkami proti molekule CD20 (např. rituximab), která se nenachází na povrchu všech diferenciačních stadií B-lymfocytů. Bylo zjištěno, že léčba rituximabem vede k elevaci hladin BAFF v séru, což by mohlo vést k proliferaci autoreaktivních klonů během repopulace B-buněk. V současné době jsou úspěšně testovány v klinických studiích monoklonální protilátka proti BAFF – belimumab a rekombinantní receptory TACI fúzovaný Ig – atacicept a BAFF-R-Ig (BR3-Fc).
Klíčová slova:
BAFF, APRIL, BAFF receptor, BCMA, TACI, systémová revmatická onemocněníÚvod
B-lymfocyty hrají významnou úlohu v patogenezi autoimunitních onemocnění nejen jako prekurzory plazmatických buněk, které tvoří autoprotilátky, ale také jako buňky regulující imunitní odpověď. B-lymfocyty indukují diferenciaci a aktivaci T-lymfocytů tak, že jim předkládají antigen v kontextu HLA molekul a jsou zároveň i zdrojem kostimulačních signálů (např. CD40) a prozánětlivých cytokinů. Ovlivňují organogenezi sekundárních lymfatických orgánů, indukují diferenciaci folikulárních dendritických buněk (FDC) a aktivují DC prezentující antigen a další zánětlivé buňky. B-lymfocyty také selektivně migrují do cílových orgánů (například revmatoidní synovie nebo slinné žlázy u Sjögrenova syndromu), kde se nacházejí ve formě difuzních infiltrátů, shluků s T lymfocyty až struktur, které připomínají germinální centra. V posledních letech jsou intenzivně studovány cytokiny BAFF a APRIL, které působí anti-apoptoticky na různá diferenciační stadia B-lymfocytů a hrají tak důležitou roli v patogenezi auto-imunitních onemocnění.
BAFF a APRIL, jejich charakteristika a exprese
Cytokin BAFF (B-cell activating factor), také známý jako B-lymphocyte stimulator (BLys), je klíčovým faktorem v modulaci B-buněčné tolerance a homeostázy. Na zvířecím modelu bylo prokázáno, že při chybění BAFF dochází k těžké deficienci B-lymfocytů. Naopak, transgenní myši s nadměrnou tvorbou BAFF mají zvýšené počty B-buněk a lupus-like syndrom (1). Funkce BAFF jsou však komplexní, vzhledem k tomu že má tři receptory (obr. 1), z nichž dva sdílí s dalším ligandem zvaným APRIL (a proliferation-inducing ligand) (2). BAFF i APRIL jsou členy TNF (tumor nekrotizující faktor) rodiny (3). Podobně jako další TNF ligandy, je BAFF transmembránovým proteinem II. typu a je též sekretován po odštěpení z bu-něčné membrány ve formě rozpustného homotriméru nebo polyméru. APRIL existuje jen v rozpustné formě (4).
Image 1. Interakce a exprese ligandů a receptorů systému BAFF/APRIL (Upraveno podle (60)). V horní části jsou zobrazeny ligandy: Zleva doprava: heterotriméry BAFF /APRIL (6), heterotrimér s BAFF (značky znázorňují nemožnost odštěpení biologicky aktivního ligandu) (5), APRIL (odštěpen z Golgiho aparátu a uvolňovaný jako rozpustný ligand) (61), fusovaný protein TWE-PRIL (7) a homotrimér BAFF (2). Krátká varianta APRIL (poslední vpravo). Typy buněk, které tvoří BAFF a APRIL jsou znázorněny v obdélnících se šipkou. Ve spodní části jsou zobrazeny receptory: Zleva doprava: Heparin sulfátové proeoglykany (HSPG), TACI, BCMA a BAFF-receptor (BAFF-R) (25). Plné čáry zobrazují silné vazby, tečkovaná čára znamená slabou interakci, a přerušované čáry ukazují interakce které byly prokázány pouze nepřímo. Pod každým receptorem jsou vyjmenované typy buněk, které exprimují uvedené receptory. Zkratky: APRIL, a proliferation-inducing ligand; BAFF, B-cell activating factor; BAFF-R, BAFF receptor; BCMA, B-cell maturation antigen; BLys, B-lymphocyte stimulator; HSPG, Heparin sulfátové proeoglykany, TWEAK, Tumor necrosis factor-like weak inducer of apoptosis; TACI, transmembrane activator and calcium monulator and cyclophilin ligand interactor. 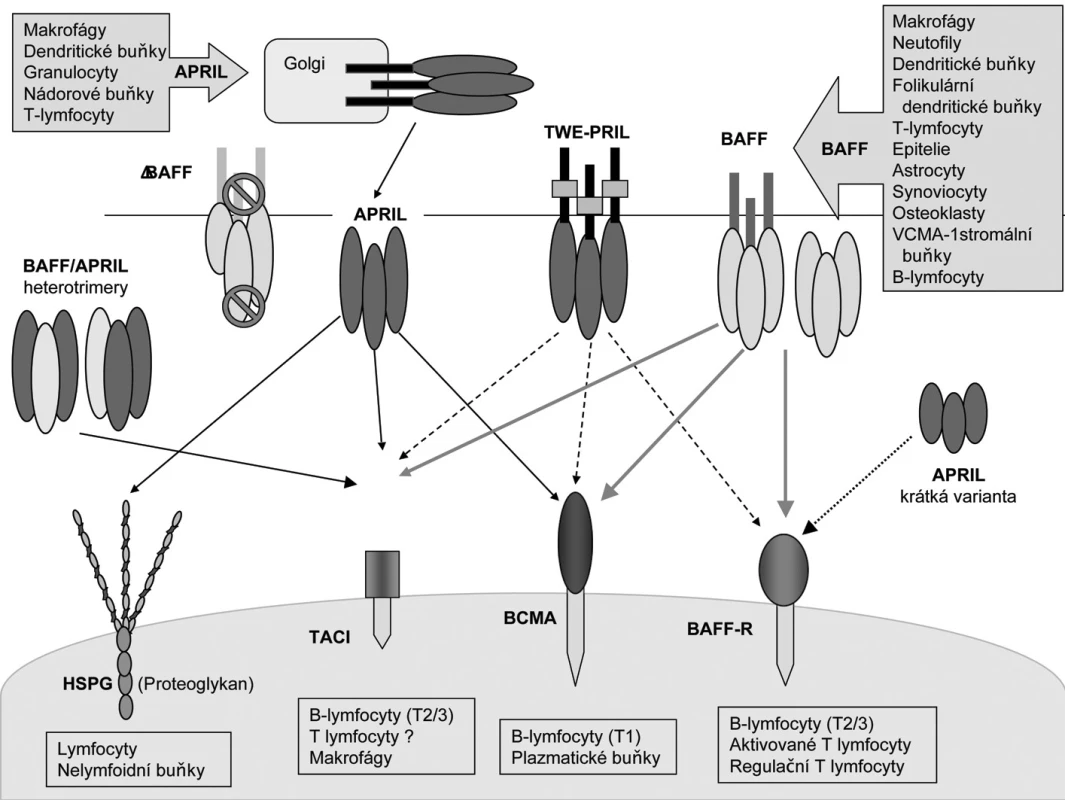
Sestřihová varianta, BAFF, zůstává vázána na buněčné membráně, není biologicky aktivní a naopak působí jako negativní regulátor funkce BAFF tak, že tvoří heterotrimér s jeho plnou (full-length) verzí (5).
Existuje také heterotrimerická forma APRIL a BAFF (BAFF/APRIL) (6) a hybridní moleku - la extracelulární domény APRIL s intracelulární doménou TWEAK (Tumor necrosis factor-like weak inducer of apoptosis) TWE-PRIL (TNFSF12) (7). Jejich biologická aktivita je ještě předmětem výzkumu.
BAFF i APRIL jsou exprimovány monocyty, makrofágy a dendritickými buňkami (DC) a v me-nší míře i T-buňkami (2, 8-10). Dalším zdrojem jsou folikulární DC (11). Bylo zjištěno, že BAFF je tvořen také buňkami nelymfoidního původu a to epiteliemi dýchacích cest a slinných žlaz (12, 13), synoviálními fibroblasty (14), astrocyty (15), VCAM-1 pozitivními buňkami stromatu kostní dřeně (16) a osteoklasty (17). Osteoklasty produkují také APRIL.
Tvorba BAFF i APRIL je stimulovatelná a to v makrofázích, neutrofilech a dendritických buňkách vlivem interferonů (IFN)α, IFNγ, interleukinu-10 (IL-10), faktoru stimulujícího kolonie granulocytů a makrofágů (GM-CSF), CD40 ligandu (CD40L), lipopolysacharidu a peptidoglykanů (18, 19).
Receptory pro BAFF a APRIL
BAFF má tři různé receptory a ty jsou jsou exprimovány na B-lymfocytech (obr. 1) (2). Jsou to: BAFF-R (BAFF receptor nebo-li BR3; TNFRSF13c), BCMA (B-cell maturation antigen; TNFRSF17) a TACI (transmembrane activator and calcium monulator and cyclophilin ligand interactor; TNFRSF13b). Tyto receptory se exprimují diferencovaně v různých stadiích maturace B-buněk. BAFF-R a TACI jsou přítomny v časnějších stadiích diferenciace B-lymfocytů (obr. 2) a to v první fázi přechodného stadia (transitional typ; nebo-li T1,2) a dále zralými B-lymfocyty. BAFF-R předává signál pro přežití a TACI působí jako negativní regulátor. BCMA je exprimován během terminální diferenciace do plazmablastů a plazmatických buněk (20, 21). Byl nalezen také na B-buňkách germinálních center tonzil (20, 22, 23). BAFF-R a TACI jsou důležité pro indukci izotypového přesmyku do IgG a IgA a TACI do IgA. TACI je navíc přítomen intracelulárně v makrofázích a po aktivaci migruje na jejich povrch (24). Exprese BAFF-R je stimulována vazbou specifického antigenu na B-buněčný receptor (BCR) zralých buněk a je přítomen na paměťových (resting memory) B-lymfocytech. BAFF-R je navíc exprimován také aktivovanými T-lymfocyty a T-regulačními buňkami (Treg) (25).
Image 2. Potenciální funkce receptorů pro BAFF a APRIL u různých stadií vývoje B-lymfocytů. (Upraveno podle: BAFF, APRIL and their receptors: structure, function and signaling. Semin Immunol. 2006:263-75 a BAFF, APRIL and human B cell disorders. Semin Immunol 2006:305-17). Během vývoje jsou B-lymfocyty závislé na signalizaci zprostředkované receptory pro BAFF a APRIL, které jsou diferencovaně exprimované v jednotlivých diferenciačních stadiích. V časných stadiích maturace (od nezralých B-lymfocytů přez přechodná stadia T1,2 až po naivní zralé B-lymfocyty) předává BAFF-R signál pro přežití a TACI působí jako negativní regulátor. BAFF-R je potřebný také pro tvorbu B-lymfocytů marginální zóny a expresi CD21. Během terminální diferenciace je pak přežití B-lymfocytů závislé na signálu zprostředkovaném BCMA. BAFF-R a TACI jsou důležité pro indukci izotypového přesmyku do IgG a IgE a TACI do IgA. Zkratky: BAFF-R, BAFF receptor; BCMA, B-cell maturation antigen; Bly (B), B-lymfocyt; LL PC, Long lived plasma cell; mB, memory B-lymfocyt; MZB, marginal zone B lymphocyte; PC, Plasma cell; PBL, Plasmablast; T, T-lymfocyt; TACI, transmembrane activator and calcium monulator and cyclophilin ligand interactor; T1,2 transitional B-lymphocyte. 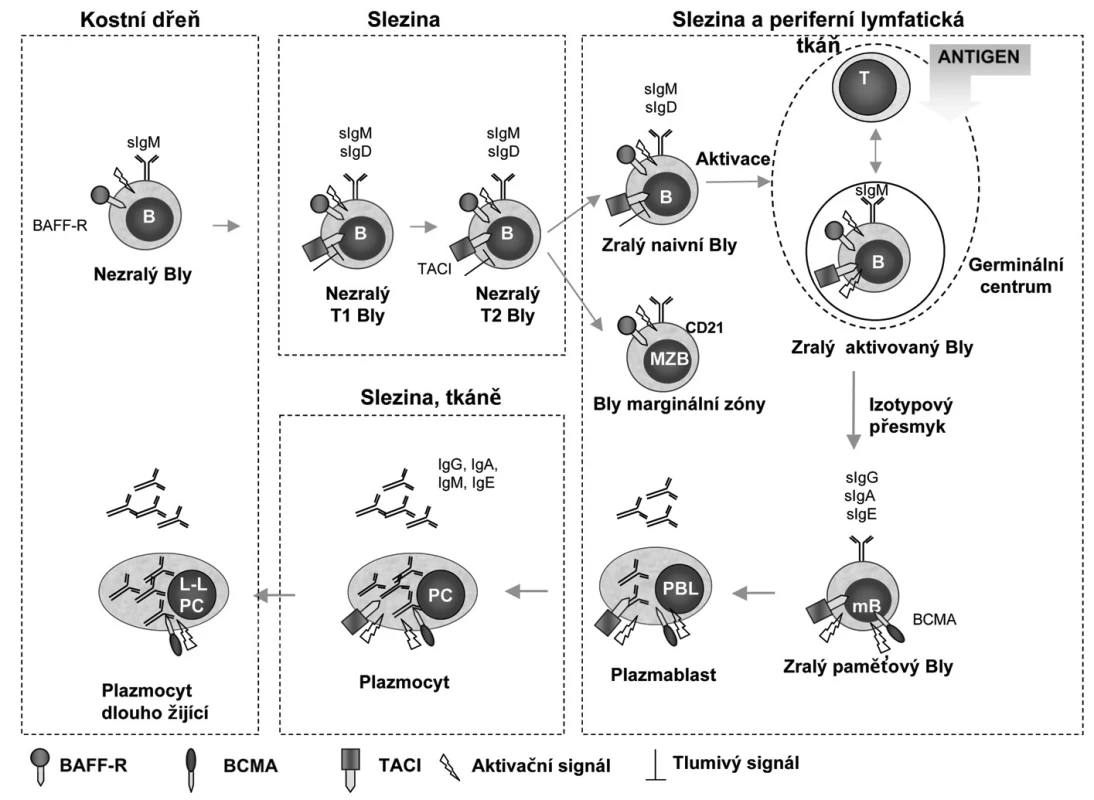
BAFF se váže specificky na BAFF-R a sdílí BCMA a TACI s cytokinem APRIL (2, 26). Ten se navíc váže na povrchové proteoglykany buněk lymfoidního i nelymfoidního původu (25).
Funkce BAFF, APRIL a jejich receptorů
Nejprve bylo zjištěno in vitro, že BAFF působí specificky přežití T2 přechodného stadia vyzrávání B-buněk při maturaci ve slezině (2). To bylo potvrzeno na zvířecím modelu tak, že BAFF-deficitní zvířata měla poruchu diferenciace B-lymfocytů z přechodného stadia T1 do stadia T2 (2). B-lymfocyty v tom-to stadiu procházejí tzv. negativní selekcí na podkladě specificity B-buněčného receptoru (BCR). Ty B-lymfocyty, jejichž BCR rozpoznávají vlastní antigeny, hynou apoptózou. Vysoké hladiny BAFF působí proti tomuto me-chanismu a je tak umožněna proliferace autoreaktivních klonů B-lymfocytů (27). U BAFF transgenních myší, byla nadprodukce BAFF sdružena s autoimunitními projevy. Toto je také důležitý patogenetický mechanismus autoimunitních onemocnění u lidí.
APRIL není nezbytný pro normální vývoj B-lymfocytů. Zdá se, že se uplatní spíše v mechanismu izotypového přesmyku do IgA (9). Biologická funkce smíšených molekul BAFF/APRIL a TWE-PRIL není zcela jasná.
BAFF-R je klíčovým receptorem, který zprostředkovává výše popsaný anti-apoptotický signál cytokinu BAFF v populaci naivních B-lymfocytů (2, 18, 28). Podobný, ale méně významný efekt má vazba BCMA, ten je však důležitý pro tvorbu zralých, dlouho žijících B-lymfocytů. TACI naopak zprostředkovává negativní regulaci aktivace a klonální expanze B-lymfocytů. TACI-deficitní zvířata mají vysoké počty B lymfocytů a autoimunitní fenotyp, podobný SLE a také lymfatické nádory (28). Vazba TACI snižuje proliferační odpověď na stimulaci lipopolisacharidem a anti-CD40L a zvyšuje apoptózu. Není však jasné do jaké míry je tato informace přenositelná do lidského systému, neboť mutace TACI u lidí byla spojena s imunodeficientním stavem typu běžné variabilní imunodeficience (29). Receptor TACI může vazbou BAFF snížit jeho dostupnost pro BAFF-R s dopadem na optimální vývoj B-lymfocytů. Receptory TACI a BCMA váží také cytokin APRIL.
BAFF a APRIL u nemocných s autoimunitními chorobami
U myších modelů SLE a kolagenem indukované artritidy byly nalezeny vysoké hladiny BAFF v séru a v cílových orgánech (30, 31). V lidském systému byly popsány vysoké hladiny BAFF a APRIL v séru a exprese v postižených orgánech u nemocných s různými systémovými revmatickými onemocněními (tab. 1) jako jsou primární Sjögrenův syndrom (SjS), systémový lupus erythematodes (SLE), revmatoidní artritida (RA), systémová sklerodermie (SSc) nebo dermatomyozitida/polymyozitida (odesláno do tisku).
Table 1. Úloha BAFF a APRIL v patogenezi autoimunitních onemocnění. 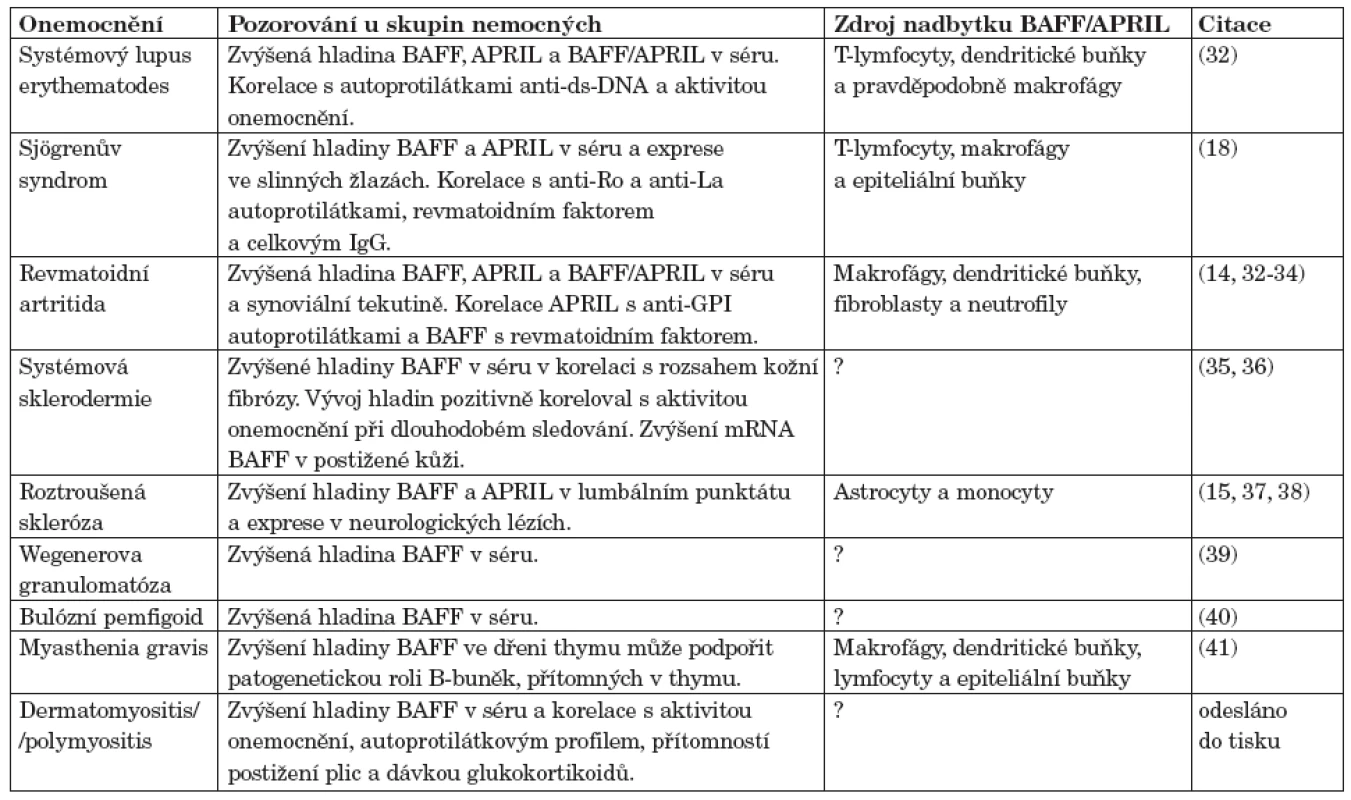
Zkratky: BAFF, B-cell activating factor; APRIL, a proliferation-inducing ligand; BAFF/APRIL, heterotrimér APRIL a BAFF Abnormální hladiny BAFF navíc korelovaly s aktivitou onemocnění, nebo s pozitivitou auto-protilátek (např. u SjS s anti-Ro52 (20, 26)) ve srovnání s nemocnými, kteří tyto autoprotilátky neměli, či s jejich titrem (anti-ds-DNA u SLE, revmatoidní faktor u RA a protilátky proti histonům u SSc (33, 36, 42, 43)). To ukazuje na významnou roli BAFF a APRIL v patogeneze autoimunitních onemocnění. Byl nalezen polymorfismus genu pro BAFF, který může regulovat expresi BAFF (44, 45). Ale asociace tohoto polymorfismu s autoimunitními onemocněními nebyla prokázána. Je spíše pravděpodobné, že dysregulace exprese BAFF je způsobena jinými faktory (genetickými, prostředí) které ovlivňují senzitivitu buněk produkujících BAFF. Naopak polymorfismus genu pro APRIL byl asociován se SLE v japonské populaci (46).
Velmi pravděpodobným místním induktorem tvorby BAFF je IFNα, který byl nalezen například ve slinných žlázách nemocných s primárním SjS (13) a svalových biopsiích nemocných s dermatomyozitidou a polymyozitidou. Hlavním zdrojem IFNα v postižených orgánech jsou nejspíše plazmacytoidní dendritické buňky, které byly nalezeny v kožních biopsiích pacientů s dermatomyozitidou (47) a v biopsiích svalů nemocných s polymyozitidou a dermatomyozitidou (48–50) a v cílových tkáních dalších SRO.
BAFF jako cílová molekula v terapii SRO
Na podkladě zkušeností s neutralizací BAFF pomocí TACI-Ig a BAFF-R-Ig u myších modelů SLE (51) a dalších autoimunitních chorob a díky korelaci hladin BAFF s aktivitou onemocnění a autoprotilátkami u systémových revmatických onemocnění, se tento cytokin stal potenciálním terapeutickým cílem (přehled Sutherland et al.) (52).
Blok BAFF může být výhodnější oproti navození deplece B-lymfocytů protilátkami proti molekule CD20 (například rituximab) (32). Jednak CD20 se nenachází na povrchu B - lymfocytů v určitých diferenciačních stadiích, jako například plazmatické buňky, které však exprimují receptor BCMA, který váže BAFF. Navíc bylo zjištěno, že léčba rituximabem vedla k elevaci hladin BAFF v séru (53, 54), což by mohlo vést k proliferaci autoreaktivních klonů během repopulace B-buněk.
Klinické studie a vývoj nových inhibitorů BAFF a APRIL
V současné době jsou intenzivně vyvíjeny a testovány přípravky blokující BAFF a APRIL (tab. 2). Human Genome Sciences / GlaxoSmithKline testuje humanizovanou monoklonální protilátku proti BAFF – belimumab (LymphoStat-B) (55). Nedávno byly ukončeny studie fáze II testující účinnost a bezpečnost terapie u SLE a RA a studie fáze III u pacientů se SLE byly zahájeny v roce 2007. U SLE došlo k významnému snížení aktivity klinické i laboratorní, k redukci protilátek proti ds-DNA, zvýšení C4 složky komplementu a prodloužení doby remise. Tyto účinky byly provázeny signifikantním snížením B-buněčných subpopulací včetně celkových CD19+ B lymfocytů, CD20+/CD69+ aktivovaných B-buněk, CD20+/-/CD27- naivních B-lymfocytů a CD20+/ /CD138+ plazmacytoidních buněk. V prodloužené fázi studie byla prokázána setrvalá účinnost a bezpečnost léčby do 72. týdne a zlepšení kvality života. U nemocných s RA došlo k signifikantní odpovědi podle kritérií ACR u skupiny séropozitivních nemocných ale ne u pacientů bez RF. Spolu s redukcí aktivity onemocnění, došlo ke snížení hladin RF i anti-CCP autoprotilátek. Genentech / Biogen Idec a ZymoGenetics / Merc Serono v současné době testují receptory fúzované s Ig a to BAFF-R-Ig (BR3-Fc) (56) a TACI-Ig (atacicept) (57). Atacicept byl testován pro terapii SLE a RA ve studiích fáze Ib a studie fáze II u RA probíhají. Vzhledem k diferencované expresi receptorů pro BAFF a APRIL, jejich agonisté a anatagonisté mohou cíleným ovlivněním receptorů dovolit zásah do jednotlivých maturačních stadií, spíše než blok jejich ligandů. Agonisté TACI, mohou být například užitečné při supresi aktivních autoimunitních klonů B-lymfocytů bez blokády vlastních hladin BAFF a APRIL, což může udržet normální imunitní funkce.
Table 2. Přehled současných a potenciálních antagonistů BAFF/APRIL. 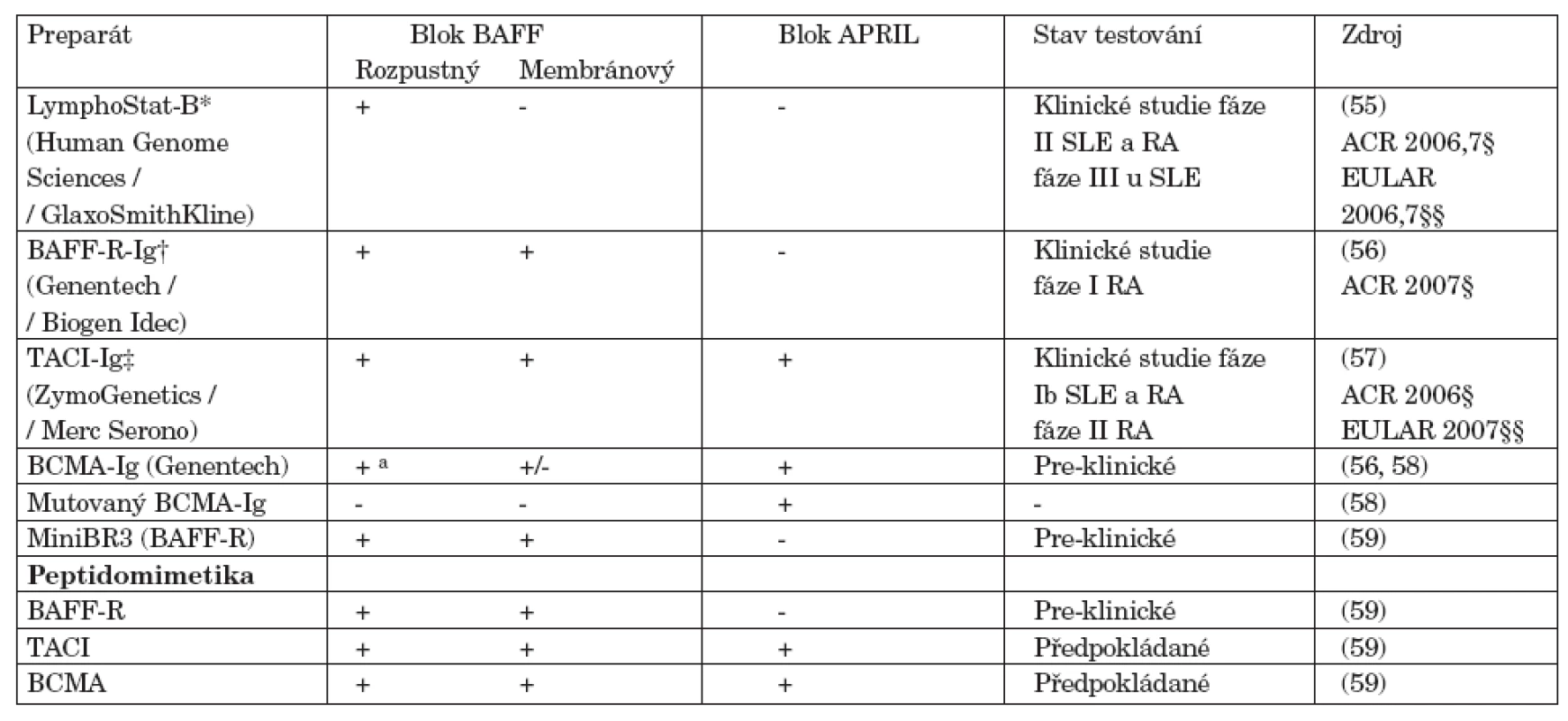
a nízká afinita pro BAFF Zkratky: BAFF-R BAFF, receptor; BCMA, B-cell maturation antigen; SLE, systémový lupus erythematodes; RA, revmatoidní artritida; TACI, transmembrane activator and calcium monulator and cyclophilin ligand interactor Odkazy: * www.hgsi.com/products/LSB.html, † www.biogen.com/site/025.html, ‡ www.zymogenetics.com/clinical/TACI-Ig.html, § http://www.abstractsonline.com/viewer, §§ http://www.abstracts2view.com/eular/ Závěr
Objev BAFF a APRIL posunul naše porozumění podílu antiapoptotických mechanismů na vývoji B-lymfocytů, B-buněčné toleranci i vzniku malignit. Porucha jejich regulace je úzce asociovaná s rozvojem autoimunitních onemocnění. Aktuální výsledky klinických studií s inhibitory BAFF potvrdily význam tohoto systému v patogeneze autoimunitních onemocnění a jistě povedou k vývoji nových léčiv a k dalšímu porozumění patogenetické role B-lymfocytů u systémových revmatických onemocnění. Bližší pochopení diferencovaného biologického mechanismu působení BAFF a APRIL a jejich receptorů BAFF-R, TACI a BCMA otvírá další možnosti v cílené, účinné a bezpečné terapii autoimunitních onemocnění.
Podpořeno výzkumným záměrem MZČR 0002372801
MUDr. Olga Kryštůfková
Revmatologický ústav
Na Slupi 4
120 00 Praha 2
e-mail: krys@revma.cz
Sources
1. Mackay F, Woodcock SA, Lawton P, et al. Mice transgenic for BAFF develop lymphocytic disorders along with autoimmune manifestations. J Exp Med 1999; 190 : 1697–1710.
2. Mackay F, Schneider P, Rennert P, Browning J. BAFF AND APRIL: a tutorial on B cell survival. Annu Rev Immunol 2003; 21 : 231–264.
3. Bodmer JL, Schneider P,Tschopp J. The molecular architecture of the TNF superfamily. Trends Biochem Sci 2002; 27 : 19–26.
4. Lopez-Fraga M, Fernandez R, Albar JP, Hahne M. Biologically active APRIL is secreted following intracellular processing in the Golgi apparatus by furin convertase. EMBO Rep 2001; 2 : 945–951.
5. Gavin AL, Ait-Azzouzene D, Ware CF, Nemazee D. DeltaBAFF, an alternate splice isoform that regulates receptor binding and biopresentation of the B cell survival cytokine, BAFF. J Biol Chem 2003; 278 : 38220–38228.
6. Roschke V, Sosnovtseva S, Ward CD, et al. BLyS and APRIL form biologically active heterotrimers that are expressed in patients with systemic immune-based rheumatic diseases. J Immunol 2002; 169 : 4314–4321.
7. Pradet-Balade B, Medema JP, Lopez-Fraga M, et al. An endogenous hybrid mRNA encodes TWE-PRIL, a functional cell surface TWEAK-APRIL fusion protein. Embo J 2002; 21 : 5711–5720.
8. Hahne M, Kataoka T, Schroter M, et al. APRIL, a new ligand of the tumor necrosis factor family, stimulates tumor cell growth. J Exp Med 1998; 188 : 1185–1190.
9. Litinskiy MB, Nardelli B, Hilbert DM, et al. DCs induce CD40-independent immunoglobulin class switching through BLyS and APRIL. Nat Immunol 2002; 3 : 822–829
10. Nardelli B, Belvedere O, Roschke V, et al. Synthesis and release of B-lymphocyte stimulator from myeloid cells. Blood 2001; 97 : 198–204.
11. Munoz-Fernandez R, Blanco FJ, Frecha C, et al. Follicular dendritic cells are related to bone marrow stromal cell progenitors and to myofibroblasts. J Immunol 2006; 177 : 280–289.
12. Kato A, Truong-Tran AQ, Scott AL, Matsumoto K, Schleimer RP. Airway epithelial cells produce B cell-activating factor of TNF family by an IFN-beta-dependent mechanism. J Immunol 2006; 177 : 7164–7172.
13. Ittah M, Miceli-Richard C, Eric Gottenberg J, et al. B cell-activating factor of the tumor necrosis factor family (BAFF) is expressed under stimulation by interferon in salivary gland epithelial cells in primary Sjogren’s syndrome. Arthritis Res Ther 2006; 8: R51.
14. Ohata J, Zvaifler NJ, Nishio M, et al. Fibroblast-like synoviocytes of mesenchymal origin express functional B cell-activating factor of the TNF family in response to proinflammatory cytokines. J Immunol 2005; 174 : 864–870.
15. Krumbholz M, Theil D, Derfuss T, et al. BAFF is produced by astrocytes and up-regulated in multiple sclerosis lesions and primary central nervous system lymphoma. J Exp Med 2005; 201 : 195–200.
16. Schaumann DH, Tuischer J, Ebell W, Manz RA, Lauster R. VCAM-1-positive stromal cells from human bone marrow producing cytokines for B lineage progenitors and for plasma cells: SDF-1, flt3L, and BAFF. Mol Immunol 2007; 44 : 1606–1612.
17. Abe M, Kido S, Hiasa M, et al. BAFF and APRIL as osteoclast-derived survival factors for myeloma cells: a rationale for TACI-Fc treatment in patients with multiple myeloma. Leukemia 2006; 20 : 1313-1315.
18. Mackay F, Sierro F, Grey ST,Gordon TP. The BAFF/APRIL system: an important player in systemic rheumatic diseases. Curr Dir Autoimmun 2005; 8 : 243–265.
19. Moon EY, Lee JH, Oh SY, et al. Reactive oxygen species augment B-cell-activating factor expression. Free Radic Biol Med 2006; 40 : 2103–2111.
20. Avery DT, Kalled SL, Ellyard JI, et al. BAFF selectively enhances the survival of plasmablasts generated from human memory B cells. J Clin Invest 2003; 112 : 286–297.
21. O’Connor BP, Raman VS, Erickson LD, et al. BCMA is essential for the survival of long-lived bone marrow plasma cells. J Exp Med 2004; 199 : 91–98.
22. Klein B, Tarte K, Jourdan M, et al. Survival and proliferation factors of normal and malignant plasma cells. Int J Hematol 2003; 78 : 106–113.
23. Ng LG, Sutherland AP, Newton R, et al. B cell-activating factor belonging to the TNF family (BAFF)-R is the principal BAFF receptor facilitating BAFF costimulation of circulating T and B cells. J Immunol 2004; 173 : 807–817.
24. Chang SK, Arendt BK, Darce JR, Wu X, Jelinek DF. A role for BLyS in the activation of innate immune cells. Blood 2006; 108 : 2687–2694.
25. Mackay F, Leung H. The role of the BAFF/APRIL system on T cell function. Semin Immunol 2006; 18 : 284–289.
26. Schneider P. The role of APRIL and BAFF in lymphocyte activation. Curr Opin Immunol 2005; 17 : 282–289.
27. Thien M, Phan TG, Gardam S, et al. Excess BAFF rescues self-reactive B cells from peripheral deletion and allows them to enter forbidden follicular and marginal zone niches. Immunity 2004; 20 : 785–798.
28. Kalled SL, Ambrose C,Hsu YM. The biochemistry and biology of BAFF, APRIL and their receptors. Curr Dir Autoimmun 2005; 8 : 206–242.
29. Castigli E,Geha RS. TACI, isotype switching, CVID and IgAD. Immunol Res 2007; 38 : 102–111.
30. Gross JA, Johnston J, Mudri S, et al. TACI and BCMA are receptors for a TNF homologue implicated in B-cell autoimmune disease. Nature 2000; 404 : 995–999.
31. Zhang M, Ko KH, Lam QL, et al. Expression and function of TNF family member B cell-activating factor in the development of autoimmune arthritis. Int Immunol 2005; 17 : 1081–1092.
32. Stohl W. BlySfulness does not equal blissfulness in systemic lupus erythematosus: a therapeutic role for BLyS antagonists. Curr Dir Autoimmun 2005; 8 : 289–304.
33. Pers JO, Daridon C, Devauchelle V, et al. BAFF overexpression is associated with autoantibody production in autoimmune diseases. Ann N Y Acad Sci 2005; 1050 : 34–39.
34. Schaller M, Stohl W, Tan SM, et al. Raised levels of anti-glucose-6-phosphate isomerase IgG in serum and synovial fluid from patients with inflammatory arthritis. Ann Rheum Dis 2005; 64 : 743–749.
35. Matsushita T, Hasegawa M, Matsushita Y, et al. Elevated serum BAFF levels in patients with localized scleroderma in contrast to other organ-specific autoimmune diseases. Exp Dermatol 2007; 16 : 87–93.
36. Matsushita T, Hasegawa M, Yanaba K, et al. Elevated serum BAFF levels in patients with systemic sclerosis: enhanced BAFF signaling in systemic sclerosis B lymphocytes. Arthritis Rheum 2006; 54 : 192–201.
37. Thangarajh M, Masterman T, Hillert J, Moerk S, Jonsson R. A proliferation-inducing ligand (APRIL) is expressed by astrocytes and is increased in multiple sclerosis. Scand J Immunol 2007; 65 : 92–98.
38. Thangarajh M, Masterman T, Rot U, et al. Increased levels of APRIL (a proliferation-inducing ligand) mRNA in multiple sclerosis. J Neuroimmunol 2005; 167 : 210–214
39. Krumbholz M, Specks U, Wick M, et al. BAFF is elevated in serum of patients with Wegener’s granulomatosis. J Autoimmun 2005; 25 : 298–302.
40. Asashima N, Fujimoto M, Watanabe R, et al. Serum levels of BAFF are increased in bullous pemphigoid but not in pemphigus vulgaris. Br J Dermatol 2006; 155 : 330–336.
41. Thangarajh M, Masterman T, Helgeland L, et al. The thymus is a source of B-cell-survival factors-APRIL and BAFF-in myasthenia gravis. J Neuroimmunol 2006; 178 : 161–166.
42. Cheema GS, Roschke V, Hilbert DM, Stohl W. Elevated serum B lymphocyte stimulator levels in patients with systemic immune-based rheumatic diseases. Arthritis Rheum 2001; 44 : 1313–1319.
43. Stohl W, Metyas S, Tan SM, et al. B lymphocyte stimulator overexpression in patients with systemic lupus erythematosus: longitudinal observations. Arthritis Rheum 2003; 48 : 3475–3486.
44. Jiang Y, Ohtsuji M, Abe M, et al. Polymorphism and chromosomal mapping of the mouse gene for B-cell activating factor belonging to the tumor necrosis factor family (Baff) and association with the autoimmune phenotype. Immunogenetics 2001; 53 : 810–813.
45. Kawasaki A, Tsuchiya N, Fukazawa T, Hashimoto H,Tokunaga K. Analysis on the association of human BLYS (BAFF, TNFSF13B) polymorphisms with systemic lupus erythematosus and rheumatoid arthritis. Genes Immun 2002; 3 : 424–429.
46. Koyama T, Tsukamoto H, Masumoto K, et al. A novel polymorphism of the human APRIL gene is associated with systemic lupus erythematosus. Rheumatology (Oxford) 2003; 42 : 980–985.
47. Wenzel J, Schmidt R, Proelss J, et al. Type I interferon-associated skin recruitment of CXCR3+ lymphocytes in dermatomyositis. Clin Exp Dermatol 2006; 31 : 576–582.
48. Eloranta M-L, Barbasso Helmers S, Ulfgren A-K, et al. A possible mechanism for endogenous activation of the type I interferon system in myositis patients with anti–Jo-1 or anti–Ro52/Anti–Ro60 autoantibodies. Arthritis Rheum 2007; 56 : 3112-24.
49. Greenberg SA, Pinkus JL, Pinkus GS, et al. Interferon-alpha/beta-mediated innate immune mechanisms in dermatomyositis. Ann Neurol 2005; 57 : 664–678.
50. Greenberg SA, Pinkus GS, Amato AA, Pinkus JL. Myeloid dendritic cells in inclusion-body myositis and polymyositis. Muscle Nerve 2007; 35 : 17–23.
51. Ramanujam M, Davidson A. The current status of targeting BAFF/BLyS for autoimmune diseases. Arthritis Res Ther 2004; 6 : 197–202.
52. Sutherland AP, Mackay F,Mackay CR. Targeting BAFF: immunomodulation for autoimmune diseases and lymphomas. Pharmacol Ther 2006; 112 : 774–786.
53. Vallerskog T, Heimburger M, Gunnarsson I, et al. Differential effects on BAFF and APRIL levels in rituximab-treated patients with systemic lupus erythematosus and rheumatoid arthritis. Arthritis Res Ther 2006; 8: R167.
54. Lavie F, Miceli-Richard C, Ittah M, et al. Increase of B cell-activating factor of the TNF family (BAFF) after rituximab treatment: insights into a new regulating system of BAFF production. Ann Rheum Dis 2007; 66 : 700–703.
55. Baker KP, Edwards BM, Main SH, et al. Generation and characterization of LymphoStat-B, a human monoclonal antibody that antagonizes the bioactivities of B lymphocyte stimulator. Arthritis Rheum 2003; 48 : 3253–3265.
56. Pelletier M, Thompson JS, Qian F, et al. Comparison of soluble decoy IgG fusion proteins of BAFF-R and BCMA as antagonists for BAFF. J Biol Chem 2003; 278 : 33127–33133.
57. Gross JA, Dillon SR, Mudri S, et al. TACI-Ig neutralizes molecules critical for B cell development and autoimmune disease. impaired B cell maturation in mice lacking BLyS. Immunity 2001; 15 : 289–302.
58. Patel DR, Wallweber HJ, Yin J, et al. Engineering an APRIL-specific B cell maturation antigen. J Biol Chem 2004; 279 : 16727–16735.
59. Kayagaki N, Yan M, Seshasayee D, et al. BAFF/BLyS receptor 3 binds the B cell survival factor BAFF ligand through a discrete surface loop and promotes processing of NF-kappaB2. Immunity 2002; 17 : 515–524.
60. Mackay F, Silveira PA,Brink R. B cells and the BAFF/APRIL axis: fast-forward on autoimmunity and signaling. Curr Opin Immunol 2007; 19 : 327–336.
61. Dillon SR, Gross JA, Ansell SM, Novak AJ. An APRIL to remember: novel TNF ligands as therapeutic targets. Nat Rev Drug Discov 2006; 5 : 235–246.
Labels
Dermatology & STDs Paediatric rheumatology Rheumatology
Article was published inCzech Rheumatology

2008 Issue 1-
All articles in this issue
- Vliv pohybové terapie na pohyblivost páteře a subjektivní vnímání bolesti u jedinců s ankylozující spondylitidou
- Cytokiny BAFF (B-cell activating factor) a APRIL (a proliferation-inducing ligand) a jejich role u autoimunitních onemocnění
- Protilátky proti složkám komplementového systému a systémový lupus erythematodes
- Idiopatická retroperitoneální fibróza: Méně častá příčina bolestí dolní části zad. Použití tamoxifenu v terapii onemocnění
- Gitelmanův syndrom s chondrokalcinózou v dospělosti - kazuistika
- Czech Rheumatology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Protilátky proti složkám komplementového systému a systémový lupus erythematodes
- Idiopatická retroperitoneální fibróza: Méně častá příčina bolestí dolní části zad. Použití tamoxifenu v terapii onemocnění
- Vliv pohybové terapie na pohyblivost páteře a subjektivní vnímání bolesti u jedinců s ankylozující spondylitidou
- Cytokiny BAFF (B-cell activating factor) a APRIL (a proliferation-inducing ligand) a jejich role u autoimunitních onemocnění
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

