-
Medical journals
- Career
Obezita a snížení plodnosti mužů
Authors: M. Škurla; R. Rybář
Authors‘ workplace: Centrum asistované reprodukce Sanus Jihlava, MUDr. V. Šilhan
Published in: Ceska Gynekol 2018; 83(3): 212-217
Overview
Cíl studie:
Popis vztahu mezi nadměrnou hmotností muže a snížením jeho reprodukčního potenciálu.
Typ studie:
Přehledový článek.
Název a sídlo pracoviště:
Centrum asistované reprodukce Sanus Jihlava.
Metodika:
Přibližně u 15 % párů je snaha o dosažení těhotenství neúspěšná. Při posuzování možných příčin tohoto stavu je nezbytné myslet i na možný vliv nadváhy, respektive obezity u žen i mužů. Ke snížení reprodukčního potenciálu obézních mužů dochází v důsledku změny hladin hormonů regulujících spermatogenezi působením zvýšené teploty v oblasti varlat, vlivem enviromentálních toxinů kumulovaných v tukové tkáni, zvýšenou mírou oxidativního stresu, ale také v důsledku zvýšeného výskytu poruch erekce. Pravděpodobnost vzniku těhotenství je snížena i v případě realizace metod asistované reprodukce.
Závěr:
Obezita, respektive nadváha, způsobuje u mužů snížení plodnosti a často významně prodlužuje dobu potřebnou k dosažení gravidity. Před zahájením léčby neplodnosti posuzujeme všechny možnosti jak zvýšit reprodukční potenciál mužů s nadváhou. Významné snížení hmotnosti u obézních mužů vede k úpravě hormonálních hladin a ve většině případů ke zlepšení parametrů spermiogramu se zvýšením šancí na dosažení gravidity.
Klíčová slova:
body mass index, mužská obezita, neplodnost, spermiogram
ÚVOD
V důsledku nevhodných stravovacích návyků, nadměrného příjmu potravin bohatých na tuky a glycidy, ale také z důvodu nedostačného energetického výdeje je dnes ve světě nadváha, respektive obezita, jedním z hlavních problémů ovlivňujích zdraví lidí. Prevalence nadváhy se od roku 1980 zdvojnásobila a v současnosti tímto stavem podle údajů světové zdravotnické organizace trpí téměř dvě miliardy lidí. Při odhalování etiologie neplodnosti je nezbytné myslet i na možný podíl nadváhy na neúspěšné snaze o početí. V případě, že se neplodný pár rozhodne podstoupit léčbu, je nezbytné do diagnostického protokolu zahrnout i posouzení možného vlivu nadměrné hmotnosti na pravděpodobnost dosažení gravidity a informovat pacienta, že nadváha obecně snižuje praděpodobnost otěhotnění, a to i po realizaci metod asistované reprodukce.
U žen jsou to často poruchy cyklu, anovulace, ale také změny produkce pohlavních hormonů, co snižuje pravděpodobnost otěhotnění. Se zvýšením tělesné hmotnosti se zvyšuje riziko potratu po spontánním otěhotnění, ale také po IVF, a to i v případě využití darovaných oocytů. U mužů je souvislost mezi nadměrnou hmotností a sníženou plodností prozkoumána prozatím méně detailně. Nicméně na mnoha studiích byly prokázany různé mechanismy, kterými je při nadváze ovlivněna plodnost muže. V důsledku jejich působení dochází pak zejména k vývoji relativního hyperestrogenního hypogonadotropního hypogonadismu, změnám v základních parametrech spermiogramu, v integritě chromatinu spermií [34, 35], změnám již na úrovni zárodečných buněk v semenotvorných kanálcích, ale také k častějšímu výskytu erektilní dysfunkce u obézních mužů. Důkazy o negativním vlivu obezity na plodnost mužů vycházejí ze studií analyzujích vztah mezi body mass indexem (BMI) a fertilitou a také ze srovnání výsledků spermiogramu u obézních mužů a mužů s normální hmotností.
PATOFYZIOLOGICKÉ MECHANISMY
Hormonální změny
U obézních mužů prokazatelný pokles hladiny androgenů, volného i vázaného testosteronu má multifaktoriální základ a vede ke snížení reprodukčního potenciálu (obr. 1). Hladiny cirkulujícího estradiolu narůstají v důsledku zvýšené proměny testikulárních i andrenálních androgenů působením aromatáz. Jako klíčový se jeví aromatáza cytochrom P450 enzym a jeho zvýšená aktivita v tukové tkáni [38]. Nasadíme li do léčby neplodnosti v takovém případě inhibitor aromatázy (Letrozol), hladiny cirkulujícího testosteronu stoupají a estradiol naopak klesá. Jedním z klíčových mechanismů zhoršené spermatogeneze v důsledku snížené hladiny testosteronu je pravděpodobně narušení vazby Sertoliho buněk na vyvíjející se spermie a snížení jejich koncentrace v ejakulátu v důsledku jejich retence a zvýšené fagocytózy [26].
Image 1. Mechanismy snížení reprodukčního potenciálu u obézních mužů 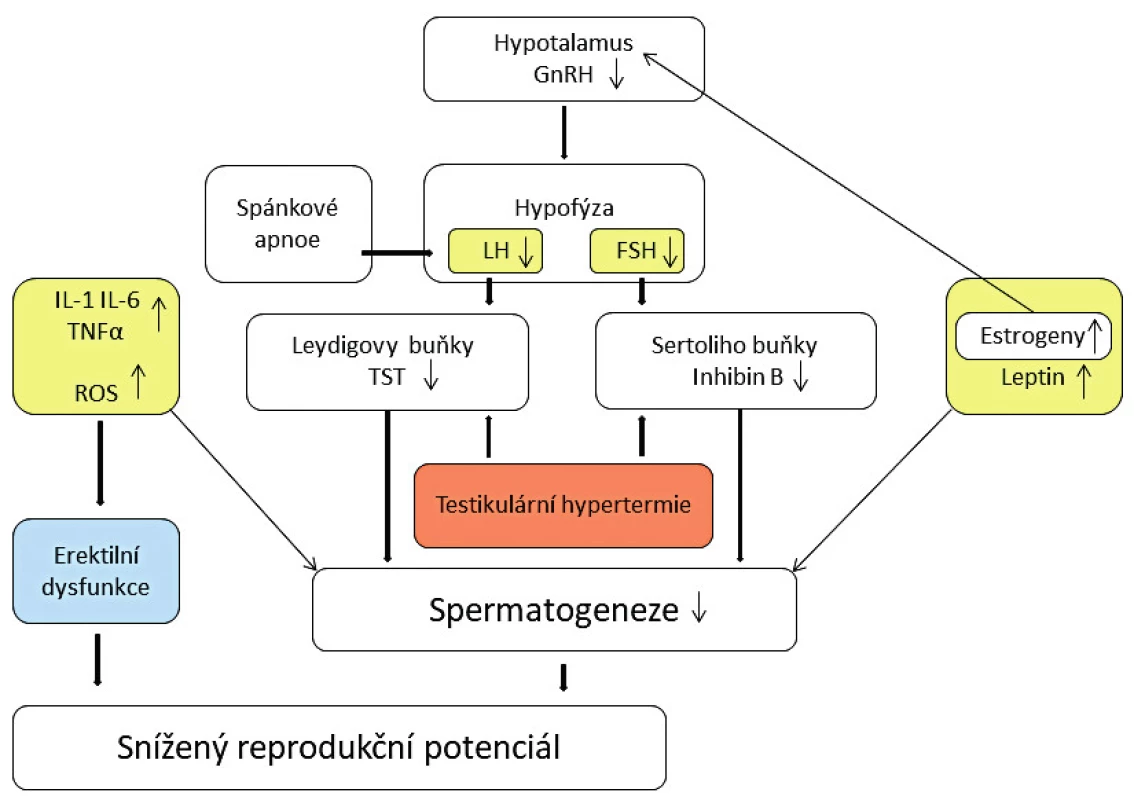
Zvýšená hladina estradiolu má za následek snížení produkce FSH (folikulostimulační hormon) a LH (luteinizační hormon) v hypofýze, navození hypogonadotropního stavu, a tedy následně další snížení hladin androgenů v důsledku jejich snížené produkce ve varlatech. Nicméně, pokud jde o změny hladiny LH, nejsou závěry různých studií jednoznačné. Vyšší hladina volného estradiolu vzniká také v důsledku snížené produkce globulinu vázajícího sexuální hormony (SHBG) v játrech. Snížení hladiny SHBG souvisí s hyperinzulinémií a zvýšenou rezistencí vůči inzulinu, obvyklými při obezitě. Nižší hladiny SHBG vážou méně testosteronu, a tedy jeho volná forma by měla v oběhu relativně stoupat. Je však prokázáno, že jeho množství v séru u obézních mužů je nižší. To je nejpravděpodobněji způsobené vysokou hladinou volného estradiolu, jeho působením na produkci gonadoliberinů v hypotalamu a následným snížením produkce gonadotropinů a testosteronu, jak již bylo zmíněno. Předpokládá se, že zvýšená hladina estrogenů má i přímý negativní efekt na spermatogenezi [20].
Inhibin B
Je produkován v Sertoliho buňkách, má přímý efekt na hypofýzu a za normálních okolností zvýšení jeho hladiny snižuje produkci FSH a současně stimulaci produkce testosteronu v Leydigových buňkách. Překvapivě však nízká hladina inhibinu B nezpůsobuje kompenzační zvýšení produkce FSH u obézních můžů [14]. Podobnou situaci pozorujeme u obézních mužů s nízkými hladinami testosteronu a očekávaným zvýšením hladiny FSH a LH. Hladina inhibinu B je prokazatelně snížená velmi pravděpodobně v souvislosti se supresivním efektem zvýšené hladiny estrogenů. Inhibin B je nejpřesnějším markerem normální spermatogeneze a snížení jeho hladiny je asociováno s dysfunkcí semenotvorných tubulů. Aggerholm prokázal snížení hladiny o 25–32 % u obézních mužů ve srovnání s kontrolní skupinou [2].
Leptin
Leptin je produkován zejména adipocyty v bílé tukové tkáni a hraje důležitou roli při regulaci výdeje energie, tělesné hmotnosti a objemu tělesného tuku. Mezi další potvrzené funkce patří regulace neuroendokrinního systému, hematopoezy, angiogeneze, nástupu puberty a zasahuje také do funkce reprodukčního systému [24]. Byla potvrzena jeho produkce také v žaludku, kosterních svalech a placentě. Jeho hladiny pozitivně korelují s hodnotami BMI a objemem celkových tělesných zásob tuku. Mechanismem navýšení hladiny u pacientů s nadváhou je velmi pravděpodobně vývoj určitého stupně rezistence vůči endogennímu leptinu [10]. Leptin a jeho receptory byly detekovány v semenotvorných kanálcích, v seminální plazmě, na spermiích a na Sertoliho i Leydigových buňkách.
Zvýšená hladina leptinu negativně ovlivňuje syntézu testosteronu v Leydigových buňkách prostřednictvím inhibice konverze 17-hydroxyprosteronu [39]. Je zajímavé, že spermie jsou také schopny produkovat leptin, a byla vyslovena hypotéza, že je přímo odpovědný za autoregulaci energetického statusu spermie [3]. V této souvislosti lze zmínit, že na povrchu spermií byly prokázány i receptory inzulinu, a lze přepokládat, že inzulin působí v tomto smyslu také jako metabolický regulátor [4]. Zvýšená hladina leptinu pozitivně koreluje s abnormální morfologií spermií a negativně koreluje s hodnotami koncentrace spermií, jejich motilitou a hladinou testosteronu [22]. Menší studie zahrnující 42 obézních mužů prokázala snížení koncentrace a motility a současně zvýšenou fragmentaci DNA spermií při zvýšené hladině leptinu [28]. Předpokládá se, že po snížení hladiny leptinu v souvislosti s významným úbytkem hmotnosti dochází k odeznění jeho supresivního efektu na osu hypotalamus-hypofýza-testes a k postupnému návratu k normálnímu nálezu ve spermiogramu.
Adipokiny a cytokiny
Prozánětlivé cytokiny, zejména IL-1, IL-6 a TNFα, snižují schopnost spermií proniknout do oocytů [18]. Koncentrace těchto cytokinů jsou zvýšeny u obézních mužů [16] a jsou produkovány ve zvýšené míře v bílé tukové tkáni. Zvýšené hladiny cytokinů zasahují reprodukční systém na různých úrovních a ovlivňují negativně steroidogenezi i spermatogenezi. Zvýšená hladina IL-6 a TNFα může také způsobit erektilní dysfunkci prostřednictvím narušení endotelu, a to mechanismem zvýšení oxidativního stresu a snížením produkce oxidu dusnatého. Zvýšená hladina IL-6 je spojována také se vznikem rezistence vůči působení LH v Leydigových buňkách a následnou supresí steroidogeneze [7]. Adipokinin rezistin je u mužů s nadváhou také zvýšen a je spojován s vývojem inzulinové rezistence a navazujícím poklesem SHBG. Zvýšení hladiny inzulinu má přímý negativní efekt na spermatogenezi a způsobuje také poškození mitochondriální a nukleární DNA spermií [1].
Hypertermie v oblasti varlat, environmentální toxiny a oxidativní stres
V důsledku zmnožení tuku v oblasti stehen, v suprapubické oblasti i v oblasti skrota dochází ke zvýšení teploty v oblasti varlat. Pro normální spermatogenezi je podmínkou, aby byla teplota ve varlatech minimálně o dva stupně nižší. I mírné zvýšení teploty nad fyziologické hranice snižuje výrazně koncentraci spermií [21]. Dalším možným negativním efektem je usazování a zvýšená koncentrace environmentálních toxinů ve skrotálním tuku a jejich přímý negativní efekt na spermatogenezi. Tyto toxiny hromadící se v tukové tkáni obecně působí také jako endokrinní dysruptory a narušují normální reprodukční hormonální profil [31]. Dále snižují produkci spermií a reprodukční potenciál mužů s nadváhou, a to v i případě, že se nepotvrdí přítomnost toxinů přímo ve skrotální tukové tkáni [2].
Mnoho studií potvrdilo vztah mezi obezitou, zvýšenou hladinou inzulinu a dyslipidémií na jedné straně a zvýšenou mírou oxidativního stresu na straně druhé [11]. Reaktivní formy kyslíku (reactive oxygen species, ROS) vznikají jako vedlejší produkt normálního metabolismu kyslíku. Působením různých negativních vlivů prostředí však jejich hladiny v organismu stoupají. Jedním z efektů je snížení fertility. ROS jsou nezávislým markerem mužského faktoru infertility a vedou k poškození DNA spermií a integrity jejich plazmatické membrány.
Spánkové apnoe
Již Boyar a kol. v roce 1974 prokázali zvýšení produkce testosteronu během spánku u chlapců v pubertě [8]. Spánkové apnoe spojené s hypoxií je častěji diagnostikováno u obézních mužů a mužů s diabetem 2. typu. Dochází zde k narušení spánkového vzestupu LH a testosteronu a následkem je zhoršení parametrů spermiogramu a snížení reprodukčního potenciálu. Spánkové apnoe je rizikovým faktorem pro vývoj hypogonadismu, sexuální dysfunkce a potenciálně může vést ke snížení fertility.
Genetické faktory a transgenerační přenos
Mohou genetické abnormality nezávisle od ostatních faktorů způsobit nadváhu a snížení plodnosti? V této souvislosti je možné mluvit o syndromech, jako je Laurencův-Moonův-Bardetův-Biedelův, Praderův-Williho, Klinefelterův i jiných, kde je mechanismus vzniku obezity a neplodnosti do značné míry známý, ale je současně dobré zmínit, že není příliš známý způsob, jakým působí méně závažné genetické mutace a jak intenzivně se u nich projeví jak změny hmotnosti, tak plodnosti. Odhalení těchto mechanismů pravděpodobně přispěje také k vysvětlení, proč u některých obézních můžů dochází ke snížení plodnosti, a u jiných tomu tak není. V tomto ohledu platí, že pokud se spojuje obezita s prokazatelně nižší hladinou testosteronu, znamená tato situace i snížení fertility [32].
O zvýšení pravděpodobnosti výskytu obezity také u potomstva obézních rodičů, respektive prarodičů, se uvažuje už poměrně dlouho. Je prokázán vztah mezi hyperglykémií u ženy v průběhu těhotenství nebo laktace a zvýšenou pravděpodobností vývoje nadváhy a diabetu u potomstva. V poslední době se intenzivně zkoumá, jakou roli sehrává RNA ve zralých spermiích při zvýšení pravdědobnosti výskytu obezity u potomstva mužů s nadváhou v čase koncepce. Li a kol. [29] prokázali, že obezita mužů ovlivňuje metabolický profil jejich potomstva a že obézní muži budou mít se zvýšenou pravděpodobností obézní děti.
SPERMIOGRAM A SNÍŽENÍ PRAVDĚPODOBNOSTI POČETÍ
Bylo již jasně prokázáno, že poruchy energetického metabolismu a obzláště rozvinutá obezita mají dopad na plodnost. Nicméně v dosavadních klinických studiích a metaanalýzách prozatím nebylo dosaženo konsenzu ohledně toho, jaké změny v kvalitě spermií vlivem obezity nastávají. Již zvýšení BMI nad 25 kg/m2 je u mužů spojeno se snížením fertility a prodloužením času, který je potřebný k dosažení těhotenství. Dánská studie z roku 2007 analyzuje výsledky u 47 835 párů. Zvýšení BMI u mužů bylo asociováno se snížením fertility (čas k dosažení gravidity více než 12 měsíců) a poměrem šancí (odds ratio - OR) 1,53 (95% interval spolehlivosti CI 1,32–1,77) ve skupině mužů s BMI nad 30 kg/m2 a dalším negativním posunem na hodnotu 2,75 (2,27–3,30) v případě, že žena byla také obézní [21]. Další studie zkoumá výsledky 1558 sledovaných mužů a srovnává skupinu s normálním BMI a s BMI nad 25 kg/m2. Ve skupině mužů s nadváhou prokazuje snížení celkového počtu spermií o 24 % a současně v této skupině potvrzuje signifikantní snížení testosteronu, SHBG, inhibinu B a FSH [23]. Obézní muži mají třikrát větší pravděpodobnost snížení koncentrace spermií pod 20 mil./ml než muži s normální hmotností [19].
Názory na vztah mezi snížením pohyblivosti spermií a zvýšeným BMI se rozcházejí. Negativní korelaci prokázali Fejes a kol. [15], na druhé straně Jensen a kol. [23] tento vztah neprokazují. Mechanismem způsobujícím snížení pohyblivosti je pravděpodobně narušení funkce mitochondrií a snížení produkce energie potřebné k pohybu. V tomto ohledu byla potvrzena negativní role zvýšení hladiny ROS. Při srovnávání výsledků DNA fragmentačního indexu spermií (DFI) závěry potvrzují, že zvýšená hmotnost signifikatně zhoršuje hodnoty tohoto parametru [27] a současně byl potvrzen vztah mezi patologickou hodnotou DFI u mužů a zvýšením incidence potratů [17]. Signifikatně zvýšené procento DNA fragmentací bylo prokázáno také ve skupině mužů s diabetem 2. typu [1]. Většina studií ale neprokazuje zhoršení morfologie spermií u obézních mužů [23].
VÝSLEDKY IVF
Významný podíl důkazů o vztahu mezi sníženou fertilizační schopností spermií a obezitou mužů plyne z analýz výsledků metod in vitro fertilizace (IVF). Colaci a kol. analyzovali data z léčby 114 párů ve 172 léčebných cyklech. Zjistili snížení pravděpodobnosti potvrzení biochemické gravidity, klinické gravidity i pravděpodobnosti narození zdravého dítěte na embryotransfer u neplodných párů, kde byla potvrzena nadváha nebo obezita u mužů. Ve skupině párů podstupujících IVF ICSI (intracytoplazmatickou injekci spermie do oocytu), kde muž byl obézní, se potvrdila snížená pravděpodobnost narození zdravého dítěte s OR 0,83 (95% interval spolehlivosti CI, 0,40–1,74) pro BMI 25,0–29,99 kg/m2 a 0,72 (0,28–1,72) pro BMI 30,0–34,99 kg/m2 [9].
Další práce autorů Bakos a kol. analyzovala vztah mezi zvýšeným BMI u mužů, zhoršeným vývojem embrya a snížením pravděpodobnosti narození zdravého dítěte. Studie sledovala 305 párů podstupujících IVF cyklus s věkem ženy do 38 let. Páry byly podle hmotnosti partnera rozděleny do čtyř kategorií: normální hmotnost, nadváha, obezita a extrémní obezita s BMI 35 a více kg/m2. Ve všech skupinách byl průměrný počet transferovaných embryí 1,1. Koncentrace spermií u mužů s normální hmotností byla signifikatně vyšší než v ostatních skupinách. Progresivní motilita byla snížena pouze ve skupině extrémně obézních mužů. Procento vývoje v expandované blastocysty ukazovalo jasnou sestupnou tendenci v úspěšnosti mezi jednotlivými skupinami (17,9 % ± 3,3 %, 15,2 % ± 2,2 %, 10,7 % ± 2,9 %, 8,5 % ± 4,2 %). Podobnou tendenci vykazovala pravděpodobnost porodu živého dítěte na odběr oocytů (41,3 %, 26,4 %, 22,6 %, 12,12 %) [5].
Je nezbytné analyzovat v dalších multicentrických studiích dopad obezity mužů na úspěšnost léčby neplodnosti a dále zkoumat míru pozitivních změn po snížení hmotnosti mužů s nadváhou nebo obezitou.
LÉČBA OBEZITY
Typické změny potvrzené u obézních mužů (vzestup hladiny estrogenů, pokles hladin gonadotropinů a testosteronu a další) vyžadují odlišný přístup k léčbě neplodnosti. Prvním krokem je doporučení snížit hmotnost, a to zejména nízkokalorickou dietou a cvičením. Kaukua a kol. prokázali u skupiny mužů, kteří podstoupili čtyřměsíční program na snížení hmotnosti, zvýšení hladiny SHBG a testosteronu a současně pokles sérových hladin inzulinu a leptinu [25]. Další studie potvrdila zvýšení hladin testosteronu u mužů s obezitou a obstrukčním spánkovým apnoe po snížení hmotnosti [36]. Na druhou stranu studie zkoumající menší soubor 20 mužů s extrémní obezitou podstupující v první fázy čtyřměsíční redukční program s cvičením a následně bariarický chirurgický výkon sice potvrdila signifikantní úbytek hmotnosti a BMI společně s úpravou hormonálních parametrů a zlepšením sexuálních funkcí, ale nedošlo k úpravě parametrů spermiogramu [33].
Bypass, respektive bandáž žaludku, je vysoce účinným způsobem léčby obezity. Bastounis a kol. u pacientů, kteří podstoupili vertikální bandáž žaludku, povrdil signifikatní snížení hladin estrogenů a zvýšení hladin SHBG, FSH a testosteronu [6]. Po bariatrických operacích a následném extrémním úbytku hmotnosti byla však také potvrzena sekundární sterilita způsobená azoospermií [13]. Vzniká pravděpodobně v souvislosti s výraznou nutriční dysbalancí a toxickým inzultem plynoucím z extrémního úbytku hmotnosti. Bariatrická léčba tedy může při drastickém úbytku hmotnosti působit negativně na reprodukční potenciál v prvních měsících po operačním výkonu. Pozdější zlepšení nálezu s odstupem 24 měsíců potvrzuje například studie autorů Sermondale a kol. [37].
Léčba hormonální dysbalance je možná také s využitím lidského choriového gonadotropinu (HCG). Vzhledem k tomu, že obsazuje stejné receptory jako LH, stimuluje Leydigovy buňky k produkci testosteronu a může zlepšovat parametry spermiogramu. Inhibitory aromatázy jsou jednou z novějších možností léčby. Interferují s aromatáza p450 enzymem a snižují produkci estrogenů v tukové tkáni. Léčba Letrozolem normalizovala hladiny testosteronu u obézních mužů sledovaných v několika studiích [12, 30].
ZÁVĚR
Prevalence nadváhy/obezity v populaci stoupá. Její negativní efekt na plodnost žen i mužů byl prokázán v mnoha multicentrických studiích. Nicméně zejména u mužů platí, že prozatím neznáme dostatečně přesně mechanismy, jakými dochází ke snížení jejich reprodukčního potenciálu. Platí však zřejmé a potvrzené souvislosti mezi vyšší hmotností mužů, změnami v hormonálních hladinách, zhoršením parametrů spermiogramu, nižším fertilizačním potenciálem spermií a sníženou šancí na dosažení těhotenství. Již potvrzené patofyziologické mechanismy, způsobující snížení plodnosti u obézních mužů, jsou důvodem k dalšímu výzkumu a snaze o odhalení všech souvislostí a možností léčby v této oblasti.
MUDr. Michal Škurla
Vrchlického 59
586 01 Jihlava
e-mail: michal.skurla@sanus.cz
Sources
1. Agbaje, IM., Rogers, DA., McVicar, DM., et al. Insulin dependant diabetes mellitus: Imlication for male reproductive function. Hum Reprod, 2007, 22, 7, p. 1871–1877.
2. Aggerholm, AS., Thulstrup, AM., Toft, G., et al. Is owerweight a risk factor for reduced semen quality and altered serum hormone profile? Fertil Steril, 2008, 90, 3, p. 619–626.
3. Aquilla, S., Gentile, M., Middea, E., et al. Leptin secretion by ejaculated human spermatozoa. Clin Endocrinol Metab, 2005, 90, 8, p. 4753–4761.
4. Aquilla, S., Gentile, M., Middea, E., et al. Autocrine regulation of insulin secretion in human ejaculated spermatozoa. Endocrinology, 2005, 146, 2, p. 552–557.
5. Bakos, HW., Henshaw, RC., Mitchell, M., et al. Paternal body mass index is associated with decreased blastocyst development and reduced live birth rates following assisted reproductive technology. Fertil Steril, 2011, 95, 5, p. 1700–1704.
6. Bastounis, EA., Karayiannakis, AJ., Syrigos, K., et al. Sex hormone changes in morbidly obese pacient after vertical banded gastroplasty. Eur Surg Res, 1998, 30, 1, p. 43–47.
7. Bornstein, SR., Rutkowski, H., Vrezas, I. Cytokines and steroidogenesis. Mol Cell Endokrinol, 2004, 215, 1–2, p. 135–141.
8. Boyar, RM., Kapen, S., Finkelstein, JW. Hypothalamic-pituitary function in diverse hyperpriolactinemic states. J Clin Invest, 1974, 53, 6, p. 1588–1598.
9. Colaci, DS., Afeiche, M., Gaskins, AJ., et al. Men´s body mass index in relation to embryo quality and clinical outcomes in couples undergoing in vitro fertilization. Fertil Steril, 2012, 98, 5, p. 1193–1199.
10. Considine, RV., Sinha, MK., Heiman ML., et al. Serum immunoreactive leptin concentrations in normal weight and obese humans. N Engl J Med, 1996, 334, 5, p. 292–295.
11. Davi, G., Falco, A. Oxidant stress, Inflamation and atherogenesis. Lupus, 2005, 14, p. 760–764.
12. de Boer, H., Verschoor, L., Rulnemans Koetrs, J., et al. Letrozole normalizes serum testosterone in severely obese men with hypogonadotropic hypogonadism. Diabetes Obes Metab, 2005, 7, 3, p. 211–215.
13. di Frega, AS., Dale, B., Di Matteo, L., et al. Secondary male factor infertility after Roux-en Y gastris bypass for morbid obesity: case report. Hum Reprod, 2005, 20, 4, p. 997–998.
14. Du Plessis, S., Cabler, S., McAlister, D., et al. The effect of obesity on sperm disorders and male infertility. Nat Rev Urol, 2010, 7, 3, p. 153–161.
15. Fejes, I., Koloszár, S., Závaczki, Z., et al. Effect of body weight on testosterone/estradiol ratio in oligospermic patient. Arch Androl, 2006, 52, 2, p. 97–102.
16. Franczek, T., Sanocka, D., Kamieniczna, M., et al. Proinflammatory cytokines as an intermediate factor enhancing lipid sperm membrane peroxidation in in vitro conditions. J Androl, 2008, 29, 1, p. 85–92.
17. Gopalkrisnan, K., Padwal, V., Meherji, PK., et al. Poor quality of sperm as it affects reapeated early pregnancy loss. Arch Androl, 2000, 45, 2, p. 111–117.
18. Gruschwitz, MS., Brezinscheck, R., Brezinscheck, HP. Cytokine levels in the seminal plasma of infertile males. J Androl, 1996, 17, 2, p. 158–163.
19. Hammound, AO., Gibson, M., Peterson, CM., et al. Obesity and male reproductive potential. J Androl, 2006, 27, 5, p. 619–626.
20. Heráček J., Sobotka V., Urban, M. Obezita a mužská neplodnost. Čes Gynek, 2012, 77, 5, s. 450–456.
21. Hjollund, NH., Bonde, JP., Jensen, TK., et al. Diurnal scrotal skin temperature and semen quality. The Danish First Pregnancy Planner Study Team. Int J Androl, 2000, 23, 6, p. 309–318.
22. Hofny, ER., Ali, ME., Abdel-Hafez, HZ., et al. Semen parameters and hormonal profile in obese fertile and infertile males. Fertil Steril, 2010, 94, 2, p. 581–584.
23. Jensen, TK., Anderson, A., Jorgensen, N. Body mass index in relation to semen quality and reproductive hormone among 1,558 Danish men. Fertil Steril, 2004, 82, 4, p. 863–870.
24. Jope, T., Lammert, A., Kratzsch, J., et al. Leptin and leptin receptor in human seminal plasma and in human spermatozoa. Int J Androl, 2003, 26, 6, p. 335–341.
25. Kaukua, J., Pekkarinen, T., Sane, T., et al. Sex hormones and sexual function in obese men losing weight. Obes Res, 2003, 11, 6, p. 689–694.
26. Kerr, JB., Millar, M., Maddocks, S., et al. Stage-dependent changes in spermatogenesis and Sertoli cells in relation to the onset of spermatogenic failure following withdrawal of testosterone. Anat Rec, 1993, 235, 4, p. 547–559.
27. Kort, HI., Massey, JB., Elsner, CV., et al. Impact of body mass index values on sperm quantity and quality. J Androl, 2006, 27, 3, p. 450–452.
28. Leisegang, K., Bouic, PJ., Menkveld, R., et al. Obesity is associated with increased seminal insulin and leptin alongside reduced fertility parameters in a controlled male cohort. Reprod Biol Endocrinol, 2014, 12, p. 34.
29. Li, L., Law, C., Lo Conte, R., et al. Intergenerational influences on childhood body mass index, the effect of parental body mass index trajectories. Am J Clin Nutr, 2009, 89, 2, p. 551–557.
30. Loves, S., Rulnemans Koerts, J., de Boer, H., et al. Letrozole once a week normalizes serum testosterone in obesity related male hypogonadism. Eur J Endocrinol, 2008, 158, 5, p. 741–747.
31. Oliva, A., Spira, A., Multigner, L. Contribution of environmental factors to the risk of male infertility. Hum Reprod, 2001, 168, p. 1768–1776.
32. Ramlau-Hansen, C., Thulstrup, A., Nohr, E., et al. Subfecundity in overweight and obese couples. Hum Reprod, 2007, 22, 6, p. 1634–1637.
33. Reis, LO., Zani, EL., Saa, RD., et al. Bariatric surgery does not interfere with sperm quality – preliminary longterm study. Reprod Sci, 2012, 19, 10, p. 1057–1062.
34. Rybář, R., Kopecká, V., Přinosilová, P., et al. Male obesity and age in relationship to semen parameters and sperm chromatin integrity. Andrologia, 2011, 43 ,4, p. 286–291.
35. Rybář R., Rubeš J. Poruchy integrity chromatinu ve spermiích infertilních mužů. Čes Gynek, 2007, 72, 4, s. 287–293.
36. Semple, PA., Graham, A., Malcolm, Y., et al. Hypoxia, depression of testosterone and impotence in Pickwickian syndrome reversed by weight reduction. Br Med J, 1984, 289, 6448, p. 801–802.
37. Sermondale, N., Massin, N., Boitrelle, F., et al. Sperm parameters and male infertility after bariatric surgery: tree case series, Reprod Biomed Online, 2012, 24, 2, p. 206–210.
38. Simpson, ER., Mahendroo, MS., Means, GD., et al. Aromatase cytochrome p450, the enzyme responsible for estrogen biosynthesis. Endocrin Rev, 1994, 15, 3, p. 342–355.
39. Teerds, KJ., De Rooij, DG., Keijer, J. Functional relationship between obesity and male reproduction: from humans to animal models. Hum Reprod Update, 2011, 17, 5, p. 667–683.
Labels
Paediatric gynaecology Gynaecology and obstetrics Reproduction medicine
Article was published inCzech Gynaecology

2018 Issue 3-
All articles in this issue
- Jak dlouho přetrvává léčba mirabegronem u úspěšně léčených pacientů s hyperaktivním močovým měchýřem? Analýza multicentrické studie
- Význam hladin bazického fibroblastového růstového faktoru u pacientek s tumorem ovaria
- Ovlivňuje použití transferového média EmbryoGlue úspěšnost embryotransferu?
- Porovnání incizionální a epidurální analgezie v léčbě pooperační bolesti po císařském řezu
- Hodnocení sestupu a mobility uretrovezikální junkce u žen se stresovou inkontinencí moči – ultrazvuková studie
- Primární maligní melanom pochvy, kazuistika a review z literatury
- Plánovaný domácí porod – Česká republika 2018
- Obezita a snížení plodnosti mužů
- Vakcinace proti HPV a výhled nových možností
- Potenciál survivínu pre liečbu gynekologických tumorových ochorení
- Prolaktin a poruchy reprodukce
- Roboticky asistovaná laparoskopická abdominální cerkláž: dvě kazuistiky
- Czech Gynaecology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Prolaktin a poruchy reprodukce
- Ovlivňuje použití transferového média EmbryoGlue úspěšnost embryotransferu?
- Vakcinace proti HPV a výhled nových možností
- Plánovaný domácí porod – Česká republika 2018
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

