-
Medical journals
- Career
Význam stanovení proteinu p16 v managementu prekanceróz děložního hrdla
: M. Pešek 1; I. Kinkorová 2; R. Ferko 3; A. Ürgeová 1; J. Bouda 1
: Gynekologicko-porodnická klinika LF UK a FN, Plzeň, přednosta doc. MUDr. Z. Novotný, CSc. 1; Bioptická laboratoř Plzeň, s. r. o. 2; Šiklův patologicko-anatomický ústav FN, Plzeň, přednosta prof. MUDr. M. Michal 3
: Ceska Gynekol 2013; 78(2): 195-199
Cíl studie:
Protein p16 je důležitým inhibitorem buněčného cyklu a slibným diagnostickým a prognostickým faktorem u prekanceróz děložního hrdla. Cílem studie je zhodnocení významu imunohistochemického stanovení proteinu p16 v managementu prekanceróz děložního hrdla.Typ studie:
Retrospektivní studie.Název a sídlo pracoviště:
Lékařská fakulta Plzeň, Univerzita Karlova Praha, Gynekologicko-porodnická klinika FN Plzeň.Metodika:
Do studie bylo zařazeno 122 pacientek s kolposkopicky cílenou biopsií (CDB) a následným excizním výkonem na děložním hrdle (LEEP, konizace). U všech pacientek byla nezávisle stanovena exprese p16 pomocí imunohistochemie (IHC). Byla provedena analýza mezi výsledkem histologie z CDB, expresí p16 v CDB a finální histologií z excizního výkonu.Výsledky:
Ve vzorcích z CDB byla u 44 pacientek diagnostikována CIN 1, u 61 pacientek pak CIN 2/3. Ve skupině s CIN 1 bylo 15 vzorků (34,1 %) p16 negativní, 29 vzorků (65,9 %) p16 pozitivní. Ve skupině CIN 1/p16 negativní byla pouze ve dvou vzorcích (13,3 %) stanovena CIN 2/3 v definitivní histologii, zatímco u CIN 1/p16 pozitivních vzorků byla CIN 2/3 v definitivní histologii stanovena v 19 případech (tj. 65,5 %) (statisticky významné, p < 0,05; Wilcoxonův test). V 60 případech CIN 2/3 z CDB bylo (98,4 %) p16 pozitivních a v 57 případech (93,4 %) byla potvrzena diagnóza CIN 2/3 v definitivní histologii.Závěr:
Zjistili jsme, že v souboru 122 pacientek s CDB mělo ve skupině s CIN 1 stanovení p16 lepší prediktivní hodnotu pro definitivní histologii než vlastní histologický výsledek z CDB. Ve skupině CIN 2/3 bylo 98,4% p16 pozitivních, stanovení p16 v této skupině tak nemá prognostický vliv na finální histologii. K potvrzení těchto dat je nutná prospektivní studie.Klíčová slova:
protein p16 – kolposkopicky cílená biopsie – CDB – imunohistochemieÚVOD
Kontrola buněčného cyklu
Buněčné dělení je ovlivňováno a řízeno kontrolními systémy, které koordinují jednotlivé fáze buněčného cyklu.
V buněčném cyklu je proliferační aktivita kontrolována inhibitory, které mohou zastavit cyklus v kontrolních bodech. První kontrolní bod buněčného cyklu je v G1 fázi před vstupem buňky do S fáze. Druhý kontrolní bod je v G2 fázi před zahájením mitózy (M).
Regulace buněčného cyklu je realizována specifickými proteiny. Jde o tzv. cyklin-dependentní kinázy (cdk) a cykliny. Cykliny mohou vytvářet s cdk funkční komplexy. Tyto komplexy jsou schopné fosforylovat příslušné proteiny, což je nezbytné pro progresi buněčného cyklu. V průběhu G1 fáze buněčného cyklu se naváže inaktivní cdk s cyklinem D a vytvoří aktivní komplex cyklin D/cdk, který fosforyluje protein pRb (protein Rb je produktem retinoblastomového genu a je klasickým antionkogenem).
Inaktivace (fosforylace) pRb umožní přechod buněk z G1 fáze do S fáze buněčného cyklu. A naopak – protein pRb v nefosforylované (aktivní) formě ve vazbě s dalším proteinem E2F působí jako supresor buněčného dělení (brání transkripci genů, jejichž produkty jsou potřebné pro průběh S fáze buněčného cyklu).
Účinkem komplexů cyklinu D/cdk4, 6 a cyklinu E/cdk2 dochází k fosforylaci proteinu pRb a transkripční faktor E2F je tímto uvolněn z komplexu s pRb. Volný transkripční faktor E2F aktivuje transkripci genů S fáze buněčného cyklu.
Inhibitory cdk inaktivují komplexy cyklin/cdk a fosforylace pRb je blokována. Mezi nejdůležitější patří p16 gen kódující inhibitor cyklin dependentních kináz 4 a 6 a nachází se na chromozomu 9p21. Tento antionkogen je inaktivován delecemi nebo mutacemi u mnoha lidských malignit [11].
Za fyziologických okolností protein p16 (produkt p16 genu) odbourává komplexy cyklin D/cdk 4, které inaktivují protein pRb fosforylací. Naopak aktivní forma proteinu pRb (tj. nefosforylovaná) inhibuje transkripci proteinu p16. To znamená, že systém pRb/p16 reguluje buněčný cyklus na přechodu z G1 do S fáze [2].
Změny v buněčném cyklu při infekci HPV
Po integraci papillomavirové DNA do genomu hostitelské buňky dochází k interakci virových onkoproteinů E6 a E7 vysoce rizikových HPV typů s produkty (proteiny) onkosupresorových genů – p53 a p105Rb, což následně vede k jejich funkční inaktivaci.
E7 uvolňuje transkripční faktor E2F z vazby na protein pRb a urychluje degradaci proteinu pRb a jemu příbuzných proteinů [9].
Již v roce 1994 byla zaznamenána tehdy nevysvětlitelně nízká hladina komplexů cyklin D/cdk4 v buňkách s mutovaným nebo viry inaktivovaným proteinem pRb [2]. Za důvod snížení hladiny komplexu cyklinu D/cdk4 byla později označena vysoká exprese inhibitoru cyklin dependentních kináz, proteinu p16 v buňkách s inaktivovaným proteinem pRb [10].
Snížení hladin komplexu cyklin D/cdk4 se týkalo zejména HPV transformovaného epitelu, včetně cervikálních dysplazií [8]. Nefunkční protein pRb v těchto lézích umožňuje nekontrolovatelnou proliferaci a není schopen inaktivovat transkripci proteinu p16. V cervikálních prekancerózách a nádorech vyvolaných HPV lze tedy prokázat zvýšenou expresi proteinu p16 [4]. Protein p16 je zodpovědný za snížení hladiny komplexů cyklin D/cdk4, ale funkčně se díky HPV inaktivaci proteinu pRb neuplatní.
Cílem studie je zhodnocení významu imunohistochemického stanovení proteinu p16 v managementu prekanceróz děložního hrdla. V pracích dosud publikovaných v literatuře [5, 6, 7] bylo popsáno, že stanovení p16 zpřesňuje diagnózu stanovovanou běžně ze vzorků barvených hematoxylinem-eozinem a pozitivita p16 může označovat léze s potenciálem progrese do prekancerózy vyššího stupně či invazivního karcinomu.
METODIKA
Do retrospektivní studie bylo zařazeno 122 pacientek s kolposkopicky cílenou biopsií (CDB) a následným excizním výkonem na děložním hrdle (LEEP, konizace). U všech pacientek byla nezávisle stanovena exprese p16 pomocí imunohistochemie (IHC). Byla provedena analýza mezi výsledkem histologie z CDB, expresí p16 v CDB a finální histologií z excizního výkonu.
Materiál z CDB byl fixován v 10% formolu; pro základní barvení hematoxylinem eozinem byly krájeny řezy silné 4 µm, pro imunohistochemické vyšetření s onkoproteinem p16 silné 2 µm.
Imunohistochemické vyšetření bylo prováděno elektronicky nastaveným protokolem v automatu BenchMark Ultra, Ventana/Roche. K vizualizaci reakce byl použit diaminobenzidin tetrahydrochlorid, k dobarvení jader metylenová modř. Použit byl CINtec Histology V-Kit od mtm laboratories AG. Všechna vyšetření měla provedenu vnitřní kontrolu.
Pro pozitivní reakci s p16 byla určující jaderná či jaderná/cytoplazmatická pozitivita; samotná cytoplazmatická pozitivita byla hodnocena jako p16 negativní.
Hodnocení výsledku reakce
Negativní – žádná pozitivita.
Ojediněle pozitivní – slabá pozitivita izolovaných buněk.
Fokálně pozitivní – pozitivita malých skupin buněk, typicky mimo bazální vrstvy epitelu.
Difuzně pozitivní – silná souvislá lineární pozitivita buněk, dále posuzovaná v rozsahu jednotlivých vrstev (třetin) výšky epitelu.
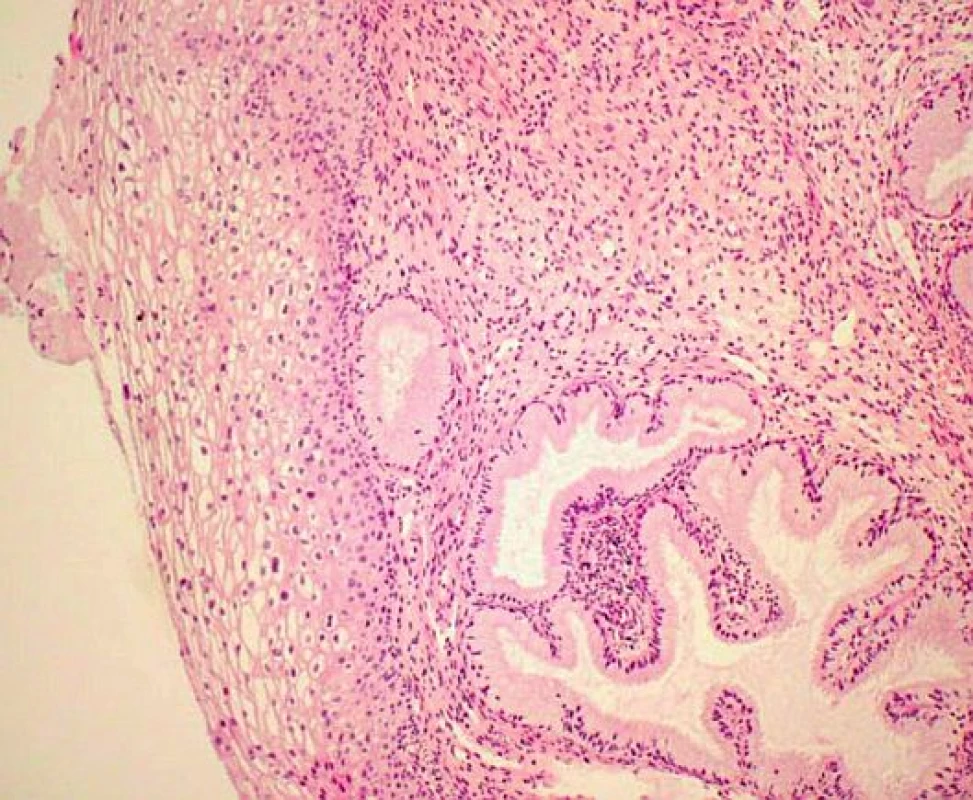
V rámci studie byla hodnocena jako pozitivní pouze difuzní pozitivita (kontinuální barvení bazálních nebo suprabazálních buněk) (obr. 1–6).
1. Normální cervikální epitel (HE – hematoxylin eozin) 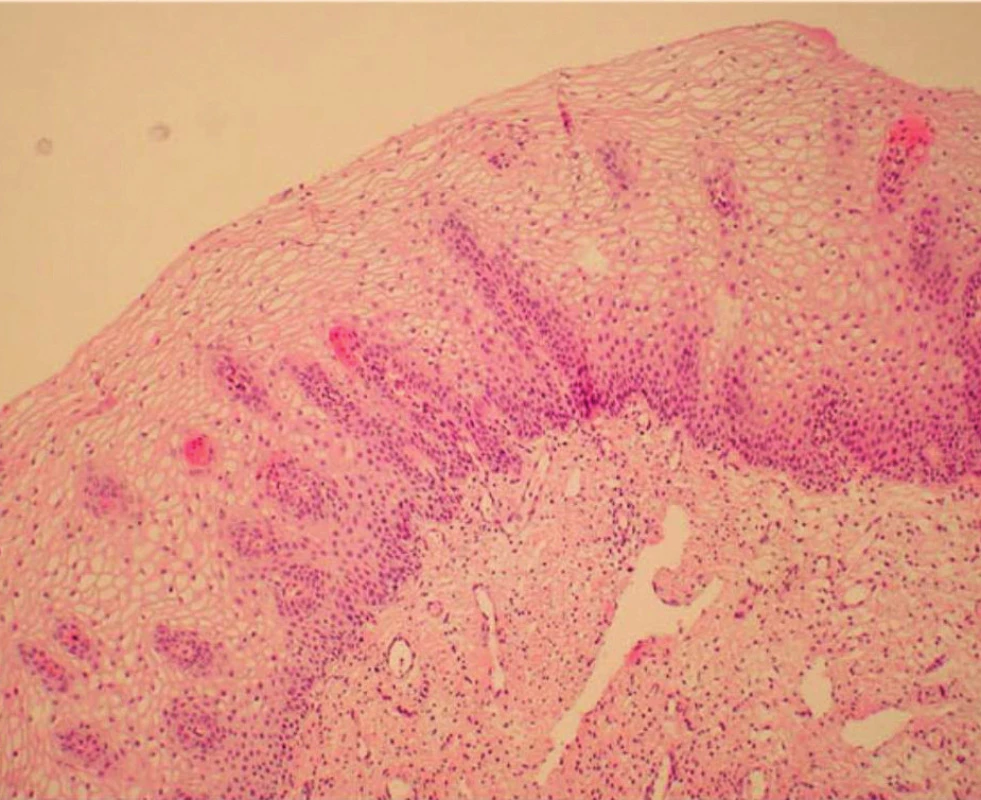
2. Normální cervikální epitel p16 negativní 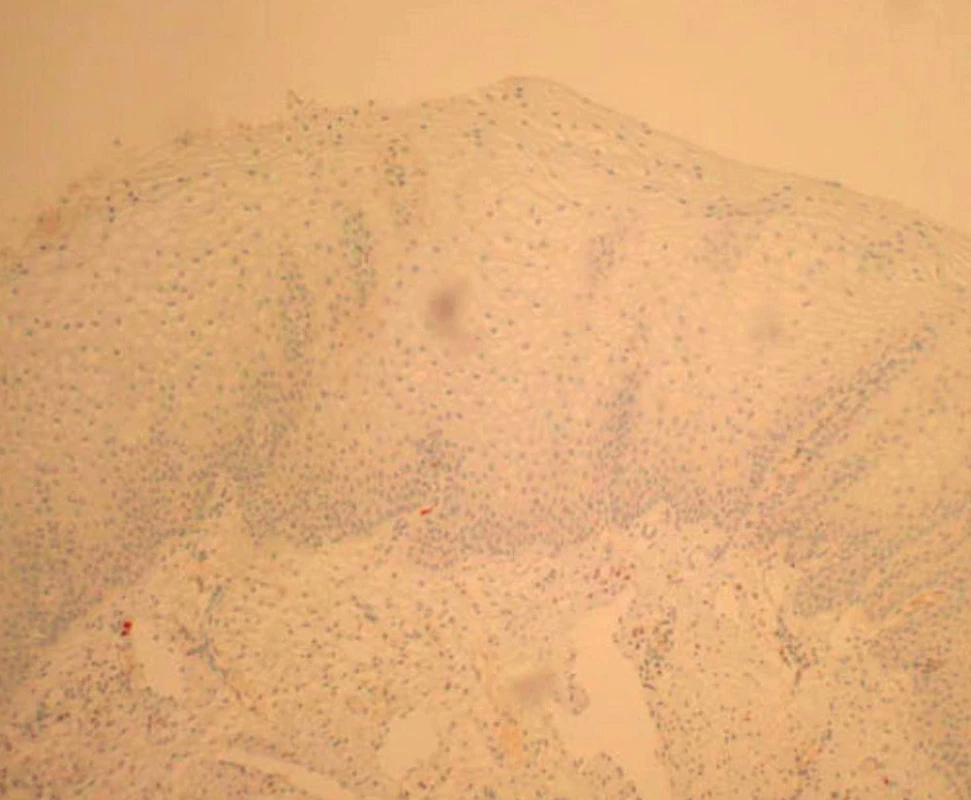
4. PCIN1 – difuzní pozitivita spodní 1/3 cervikálního epitelu 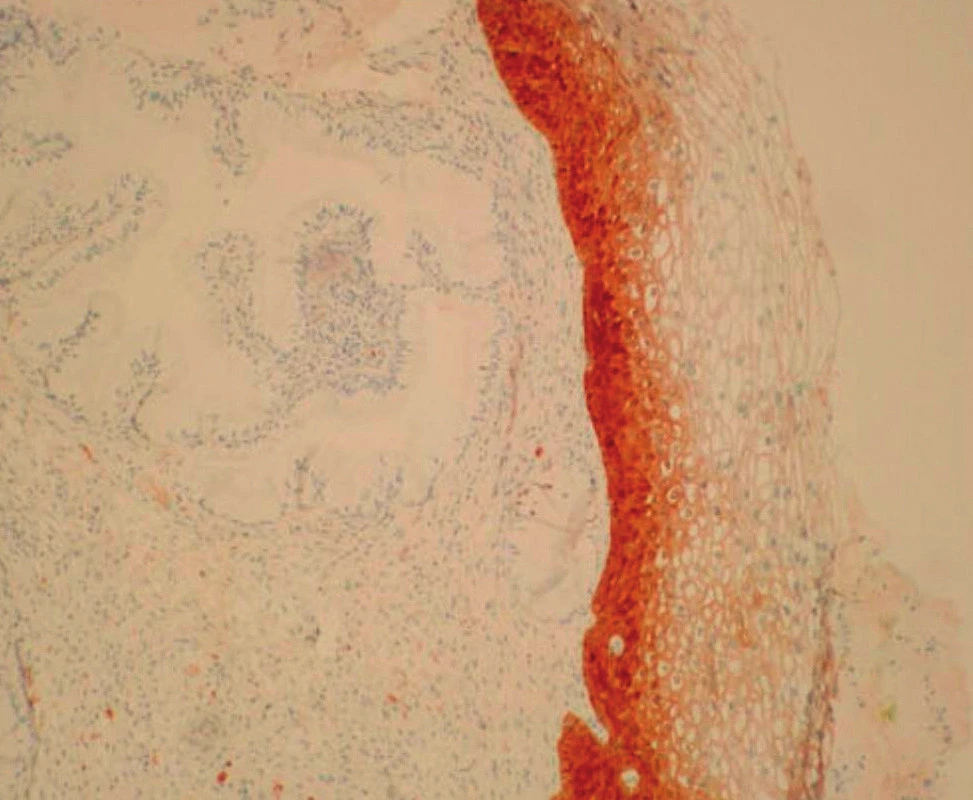
6. CIN3 – difuzní pozitivita p16 v celé tloušťce cervikálního epitelu 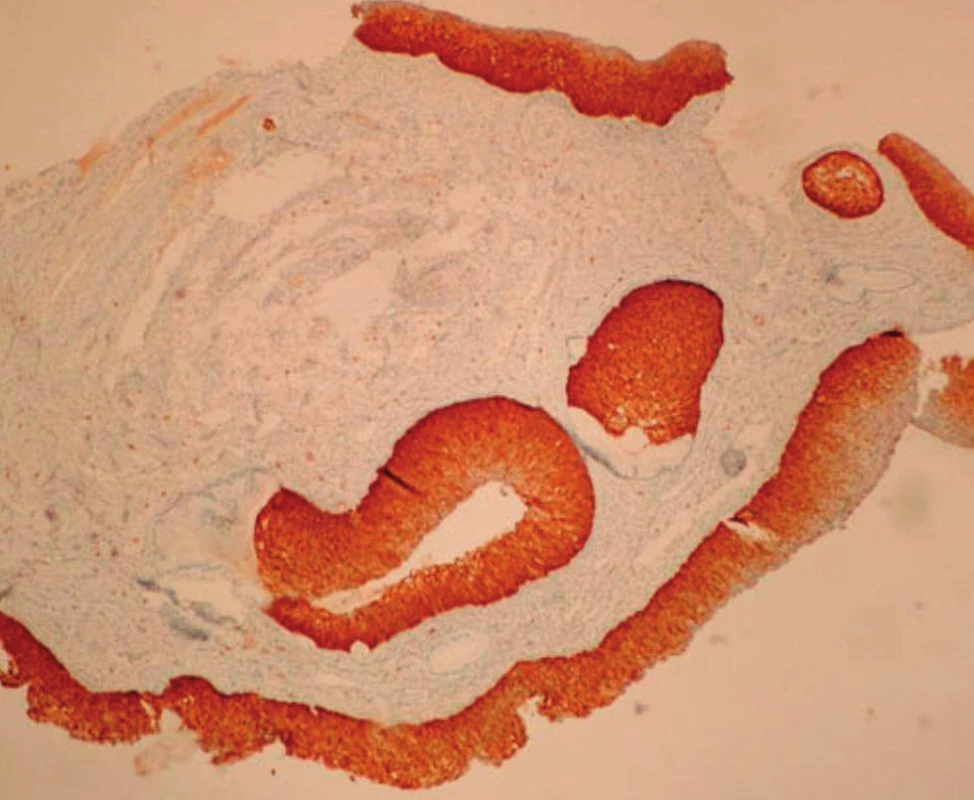
VÝSLEDKY
Výsledky histologie a imunohistochemického stanovení exprese p16 ve vzorcích z CDB a definitivní histologické výsledky z excizního výkonu jsou shrnuty v tabulce 1. Ve vzorcích z CDB byla u 44 pacientek diagnostikována CIN 1, u 61 pacientek pak CIN 2/3. Ve skupině s CIN 1 bylo 15 vzorků (34,1 %) p16 negativní, 29 vzorků (65,9 %) p16 pozitivní. Ve skupině CIN 1/p16 negativní byla pouze ve dvou vzorcích (13,3 %) stanovena CIN 2/3 v definitivní histologii, zatímco u CIN1/p16 pozitivních vzorků byla CIN 2/3 v definitivní histologii stanovena v 19 případech (tj. 65,5 %) (statisticky významné, p < 0,05; Wilcoxonův test). V 60 případech CIN 2/3 z CDB bylo (98,4 %) p16 pozitivních a v 57 případech (93,4 %) byla potvrzena diagnóza CIN 2/3 v definitivní histologii.
1. Výsledky histologie a imunohistochemického stanovení exprese p16 ve vzorcích z CDB a definitivní histologické výsledky z excizního výkonu 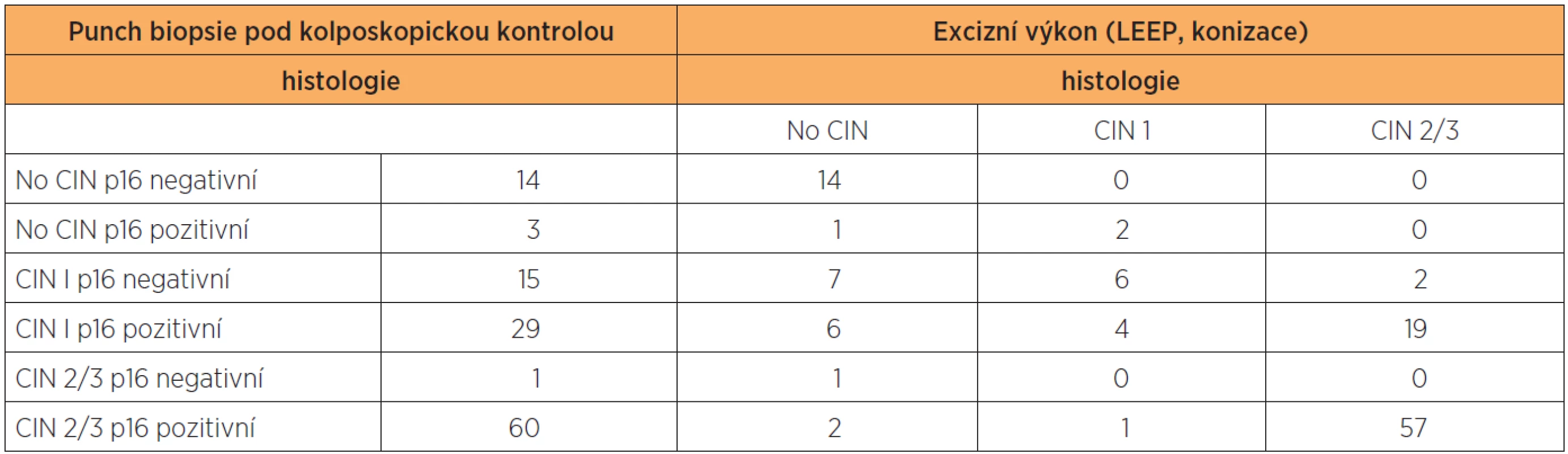
DISKUSE A ZÁVĚR
Je známo, že většina karcinomů děložního hrdla vzniká z cervikální intraepiteliální neoplazie (CIN), ale jen malá část progreduje do invazivního karcinomu. CIN 1 často regreduje, ale asi v 10–15 % případů progreduje do CIN 2/3 [1]. Z těchto důvodů je důležité v managementu pacientek s onemocněním děložního hrdla rozpoznat CIN 1 se sklonem k progresi do vyšších forem CIN [3]. Prediktivní hladina klinických a histologických charakteristik v určení rizika progrese nebo regrese CIN 1 je velmi nízká [12].
Onkoprotein p16 je produktem tumor supresorového genu. Zvýšená produkce proteinu p 16 v buňce napadené HR HPV je reakcí na zvýšenou replikační aktivitu viru. P16 se ve zvýšené míře nachází ve většině high-grade (HG) lézí. Jde o slibný prognostický faktor (biomarker) pro prekancerózy a karcinom děložního hrdla. V kontrastu působí CIN 2/3 pozitivita p16 oproti CIN 1 p16 variabilitě (CIN 1 může být p16 pozitivní, či p16 negativní ). Důležitým faktem je, že pouze difuzní pozitivita (kontinuální barvení bazálních nebo suprabazálních buněk) patrně představuje rizikový faktor v přechodu do HG léze [5]. Stanovení p16 může mít jak význam diagnostický (rozlišení CIN 1 vs. CIN 2/3), tak prognostický, kdy pacientky s CIN1 p16 pozitivním výsledkem z CDB představují skupinu žen se zvýšeným rizikem vývoje CIN2+ [13]. P16 pozitivní CIN 1 jsou pravděpodobně léze v přechodu do CIN 2.
V našem retrospektivním souboru 122 pacientek s CDB a následným excizním výkonem na děložním hrdle jsme zjistili, že ve skupině s CIN 1 v CDB má stanovení p16 lepší prediktivní hodnotu pro definitivní histologii než vlastní histologický výsledek z CDB. Ve skupině CIN 2/3 bylo 98,4 % p16 pozitivních a stanovení p16 v této skupině tak nemá prognostický vliv na finální histologii. K přesné specifikaci zařazení stanovení p16 do diagnostických a léčebných guidelines u prekanceróz děložního hrdla je zapotřebí provedení prospektivních studií na větších souborech pacientek.
MUDr. Martin Pešek
Gynekologicko-porodnická klinika
Fakultní nemocnice
Alej Svobody 80
304 60 Plzeň
Sources
1. American College of Obstetricians and Gynecologists. ACOG practice bulletin no. 66. Management of abnormal cervical cytology and histology. Obstet Gynecol, 2005, 106, p. 645–664.
2. Bates, S., Parry, D., Bonneta, L., et al. Absence of cyclin D/cdk complexes in cells lacking functional retinoblastoma protein. Oncogene, 1994, 9, p. 1633–1640.
3. Del Pino, M., Garcia, S, Fusté, V., et al. Value od p16 as a marker of progression/regression in cervical intraepithelial neoplasia grade 1. Am J Obstet Gynecol, 2009, 201, p. 488.
4. Focchi, GR., Silva, ID., Nogueira-de-Souza, NC., et al. Immunohistochemical expression of p16(INK4A) in normal uterine cervix, nonneoplastic epithelial lesions, and low-grade squamous intraepithelial lesions. J Low Genit Tract Dis, 2007, 11, p. 98–104.
5. Galgano, MT., Kastle, PE., Kristen, A., et al. Using biomarkers as objective standards in the diagnosis of cervical biopsie. Am J Surg Pathol, 2010, 34, p. 1077–1087.
6. Klaes, R., Banner, A., Friedrich, T., et al. P16 INK4a immunohistochemistry improves interobserver agreement in the diagnosis of cervical intraepithelial neoplasia. Am J Surg Pathol, 2002, 26, p. 1389–1399.
7. Liang, J., Mittal, KR., Wei, JJ., et al. Utility of p16INK4a, CEA, Ki 67, P53 and ER/PR in the diferential diagnosis of benign, premalignant and malignant glandular lesions of the uterine cervix. Int J Gynecol Pathol, 2007, 26, p. 71–75.
8. Murény, N., Ring, M., Killalea, AG., et al. P16INK4a as a marker for cervical dyskaryosis: CIN and CGIN in cervical biopsies and ThinPrep smears. J Clin Pathol, 2003, 56, p. 56–63.
9. O´Neill, CJ., McCluggage, WG. P16 expression in the female genital tract and its value in diagnosis. Adv Anat Pathol, 2006, 13, p. 8–15.
10. Queiroz, C., Silva, TC., Alves, VA., et al. P16(INK4a) expression as a potential prognostic marker in cervical pre-neoplastic and neoplastic lesions. Pathol Res Pract, 2006, 202, p. 77–83.
11. Rejtar, A., Vojtěšek, B. Obecná patologie nádorového růstu. 1. ed. Praha: Grada Publishing, 2002, 106–128 s.
12. Schifmann, M., Khan, MJ., Salomon, D., et al. A study of the impact of adding HPV types to cervical cancer screening and triage test. J Natl Cancer Indy, 2005, 97, p. 147–150.
13. Wang, SS., Trunk, M., Schifmann, M., et al. Validation of p16INK4a as a marker of oncogenic human papillomavirus infection in cervical biopsies from a population-based cohort in Costa Rica. Cancer Epidemiol Biomarkers Prev, 2004, 13, p. 355–1360.
Labels
Paediatric gynaecology Gynaecology and obstetrics Reproduction medicine
Article was published inCzech Gynaecology

2013 Issue 2-
All articles in this issue
- Selective progesterone receptor modulators and their therapeutical use
- L-arginin in prevention and treatment of pre-eclampsia
- Systemic enzyme therapy in the treatment of recurrent vulvovaginal candidiasis
- Evaluation of p16 protein in the managementof cervical dysplasia
- Reccurent pregnancy loss – review
- Guideline for prevention of RhD alloimmunizationin RhD negative women
- Pregnancy and multiple sclerosis –outcomes analysis 2003–2011
- Hyperlipidaemia in pregnancy
-
Psychosocial climate in maternity hospitals from the perspective of parturients I.
Results from a national survey on perinatal care satisfactionusing a representative sample of 1195 Czech parturients -
Cancer stem cells and ovarian cancer
Characteristics, importance and potential applicationsin clinical practice - Retroperitoneal lymphangioleiomyomatosis – a case reports
- Transfusion-related acute lung injury (TRALI) – review
- Blockade of calcium channels – a perspectiveof male contraception?
- Atlas of gametes and embryos of several animals and human
- Czech Gynaecology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Transfusion-related acute lung injury (TRALI) – review
- Reccurent pregnancy loss – review
- Evaluation of p16 protein in the managementof cervical dysplasia
- Hyperlipidaemia in pregnancy
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career