-
Medical journals
- Career
Léčivé přípravky s řízeným uvolňováním léčiva pro terapii nespecifických střevních zánětlivých onemocnění z pohledu farmaceutické technologie
Authors: Kateřina Kubová
Authors‘ workplace: Ústav farmaceutické technologie, Farmaceutická fakulta, Masarykova univerzita
Published in: Čes. slov. Farm., 2020; 69, 112-120
Category: Review Articles
Overview
Cílem článku je představit základní design používaných léčivých přípravků s řízeným uvolňováním léčiva pro terapii nespecifických střevních zánětlivých onemocnění a objasnit jejich chování v gastrointestinálním traktu z pohledu farmaceutické technologie. Konkrétně se zaměřuje na přípravky s obsahem 5-aminosalicylové kyseliny (Asacol®, Pentasa®, Salofalk®) a budesonidu (Budenofalk®, Cortiment®, Entocort®). Součástí příspěvku jsou také základní doporučení a praktické informace, která lze využít v klinické praxi.
Klíčová slova:
nespecifické střevní záněty – přívod léčiva do kolonu – zpožděné uvolňování léčiva – pH-dependentní polymery – tablety – pelety – tobolky – granule – matrice – obalování
Úvod
Základem pro popis funkce a chování lékových forem (LF) v gastrointestinálním traktu (GIT) je vysvětlení běžně používaných technologických pojmů. LF lze klasifikovat z několika hledisek. Podle počtu jednotek rozlišujeme jednotkové LF (např. tableta) nebo násobné LF (např. pelety nebo granule s řízeným uvolňováním léčiva). V případě, že jsou takové násobné lékové formy naplněny do tvrdé želatinové nebo hypromelosové (hydroxypropylmethylcelulosa – HPMC) tobolky, stále představují násobnou LF, protože tobolka se po spolknutí v prostředí žaludku rozpouští přibližně do 10 minut1). Z hlediska struktury pak lze LF rozdělit na matricové, zásobníkové nebo kombinované, ve kterých se uplatňují oba přístupy.
Matricový typ LF pracuje jako jeden celek a zajišťuje zpravidla prodloužené uvolňování léčiva po určitý časový interval. Jedná se o homogenní směs léčiva, retardující pomocné látky (PL) a ostatních pomocných látek. Retardující pomocná látka hraje klíčovou úlohu v zajištění prodlouženého uvolňování léčiva (LČ). Jedná se zejména o hydrofilní bobtnající polymery, u kterých využíváme schopnost látky bobtnat a vytvářet na povrchu LF gelovou vrstvu, dále o lipofilní nosné PL (zejména vosky) a nerozpustné polymery (např. deriváty kyseliny methakrylové), které snižují penetraci tekutin v GIT do tablety2). Jako příklad lze uvést např. hydrofilní gelovou matricovou tabletu. Jedná se o jednotkovou LF, která obsahuje hydrofilní bobtnající polymer. Ten vytváří gelovou vrstvu na povrchu tablety, která zajišťuje prodloužené uvolňování léčiva z tablety3).
Rezervoárový (zásobníkový) typ LF je vždy tvořen jádrem s léčivem a polymerním obalem. Podobu zásobníku má např. obalená tableta, obalená peleta nebo obalená granule. Uvolňování léčivé látky podle povahy obalového materiálu probíhá na základě rozpouštění (např. změna rozpustnosti v závislosti na pH), difuze (nerozpustné obaly) nebo osmózy (nerozpustné a polopropustné obaly)4).
Kombinovaný typ LF pak funguje na principu obou výše zmíněných přístupů. Příkladem je matricová tableta obalená funkčním polymerním obalem.
V rámci terapie nespecifických střevních zánětlivých onemocnění se lze na našem trhu setkat s omezenou skupinou léčivých přípravků buď s obsahem 5-aminosalicylové kyseliny (Asacol®, Pentasa®, Salofalk®), nebo budesonidu (Budenofalk®, Cortiment®, Entocort®). Cílem tohoto příspěvku je objasnit základní strukturu LF používaných přípravků, přiblížit její fungovaní v GIT s ohledem na využití v současné farmakoterapii.
Rozdělení přípravků dle LF
Na základě výše uvedeného „technologického minima“ lze rozdělit přípravky pro terapii nespecifických střevních zánětlivých onemocnění dle typu lékové formy. Rozdělení je souhrnně uvedeno v tabulce 1.
Table 1. Rozdělení přípravků pro terapii nespecifických střevních zánětlivých onemocnění dle typu lékové formy 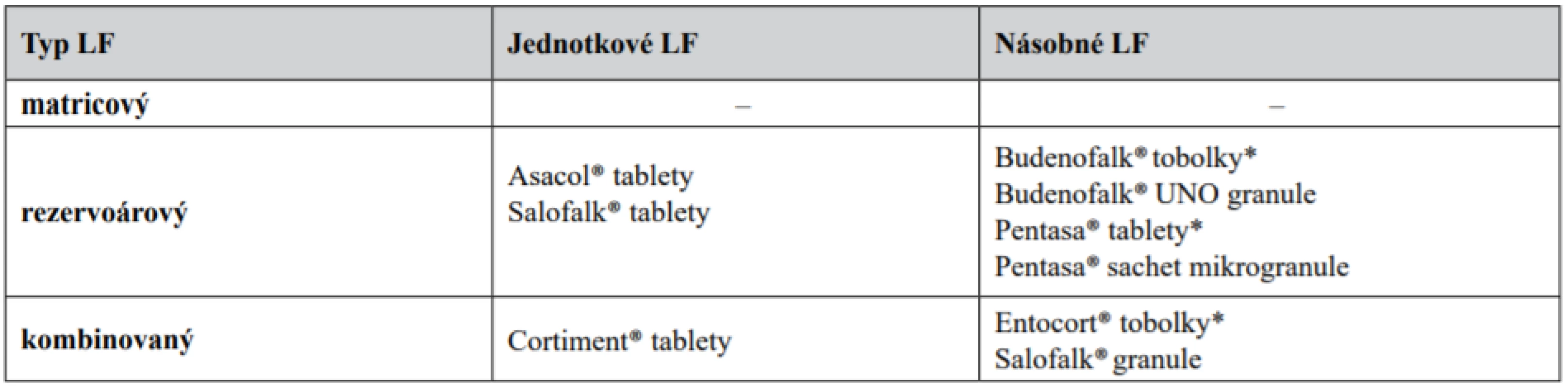
* V žaludku po rozpuštění tobolky nebo rozpadu tablety poskytují násobnou lékovou formu. Z tabulky je jasně patrné, že matricový typ samostatně nelze v současné době využít pro přívod léčiva do distálních částí střeva a všechny používané přípravky jsou opatřeny funkčním obalem, který zajišťuje modifikaci uvolňování léčiva z LF. Pro zajištění prodlouženého uvolňování léčiva po rozpuštění obalu má jádro některých přípravků charakter matrice (Cortiment® tablety, Salofalk® granule). U přípravku Entocort® tobolky se jedná pouze o matricovou vrstvu, která výrazně neovlivňuje uvolňování léčiva (viz dále).
Principy přívodu léčiva do distálních segmentů GIT
Ke směrování léčivých látek do distálních oblastí GIT se dnes využívá několik základních mechanismů5).
Prvním přístupem je využití polymerů, které vykazují rozpustnost závislou na pH. Tento princip využívá fyziologické změny pH při průchodu lékové formy GIT. Přestože v literatuře lze nalézt různé hodnoty pH pro jednotlivé segmenty GIT, lze obecně shrnout, že hodnota pH se v oblasti žaludku pohybuje v poměrně širokém intervalu 1,2–5 (v závislosti na příjmu potravy), v tenkém střevě (duodenum, jejunum a ileum) dochází ke kontinuálnímu nárůstu pH v intervalu 5,5–7,5, který je následován poklesem pH (5,5–6,0) vlivem vzniku kyselých fermentačních produktů bakteriálního osídlení tlustého střeva a postupným nárůstem pH až k hodnotě 8,06, 7). Tyto hodnoty nejsou nijak striktní a intra - i interindividuální variabilita je značná8). U pacientů s nespecifickými střevními zánětlivými onemocněními mohou být hodnoty pH střeva výrazně nižší9). V oblasti LF pro terapii IBD (z ang. Inflammatory Bowel Diseases) jsou k tomuto účelu nejvíce využívány deriváty kyseliny methakrylové známé pod obchodním názvem Eudragit® (výrobce Evonik). Jedná se o nebiodegradovatelné polymery, které nejsou v těle absorbovány a jsou bez metabolizace vyloučeny. V rámci skupiny přípravků používaných pro terapii IBD v ČR jsou využívány Eudragit® L (Lightly soluble), který je rozpustný při pH ˃ 5,5–6,0 (dle typu) a Eudragit® S (Slightly soluble) s rozpustností při pH ˃ 7,0. Tyto polymery jsou využívány ve funkci obalu LF. pH-dependentní obal LF se po dosažení určité hodnoty pH začíná rozpouštět. Reálný počáteční čas uvolňování léčiva z LF je výrazně závislý také na tloušťce naneseného filmu10).
Druhým přístupem je využití zpravidla bobtnajících nebo nerozpustných, ale permeabilních polymerních látek, které vnášejí do LF tzv. časový přístup, neboli jejich použitím léková forma uvolňuje léčivo v určitém časovém intervalu. Výběr vhodného polymeru vychází z času setrvání LF v postižené části GIT. Obecně lze opět shrnout, že LF forma setrvává v závislosti na příjmu potravy v oblasti žaludku 1–5 hodin, v oblasti tenkého střeva 3–4 hodiny a v kolonu 15–72 hodin. I v tomto parametru existuje obrovská variabilita, která je ještě podtržena zvolenou LF11). Relativně konstantní je průchod tenkým střevem, který je srovnatelný u jednotkových i násobných LF12). Do skupiny polymerů využívaných pro tento účel patří např. bobtnající hypromelosa či hyprolosa nebo nerozpustné polymery ethylcelulosa či zástupci skupiny Eudragit®. Do skupiny nerozpustných polymerů typu Eudragit® patří Eudragit® NE (Neutral Ester), Eudragit® RL (Retarding Lightly) a Eudragit® RS (Retarding Strongly)10).
Posledním, novějším přístupem je využití polymerních látek, které odolávají enzymům vyšších segmentů trávicího traktu, ale přitom podléhají štěpení bakteriální mikroflórou obsaženou v kolonu13). Vlivem mikroflóry zde dochází k jejich hydrolýze a redukci. Patří sem např. algináty, amylosa, xylan, inulin, cyklodextrin, dextrany, estery dextranu, chitosan, arabinogalaktan, guar, glukuronát, pektiny, amylopektin, polyaspartam, chondroitin sulfát, kyselina hyaluronová, kolagen atd.14). Tyto polymery mohou vytvářet základ jak matricového systému, tak funkčního obalu LF. Vzhledem ke značné hydrofilitě15) jsou často kombinovány s pH-dependentními polymery16). Zpravidla se uplatňují v léčivých přípravcích s cíleným přívodem do kolonu. Kombinace více přístupů představuje určitou pojistku, že léčivo bude skutečně z LF uvolněno. Pokud selže pH-dependentní přístup u pacienta s IBD, je v „záloze“ selektivní rozštěpení polymeru v tlustém střevě. Využití jednotlivých polymerních látek u přípravků pro terapii nespecifických střevních zánětlivých onemocnění dostupných na českém trhu je uvedeno v tabulce 2.
Table 2. Využití polymerních látek u přípravků pro terapii nespecifických střevních zánětlivých onemocnění 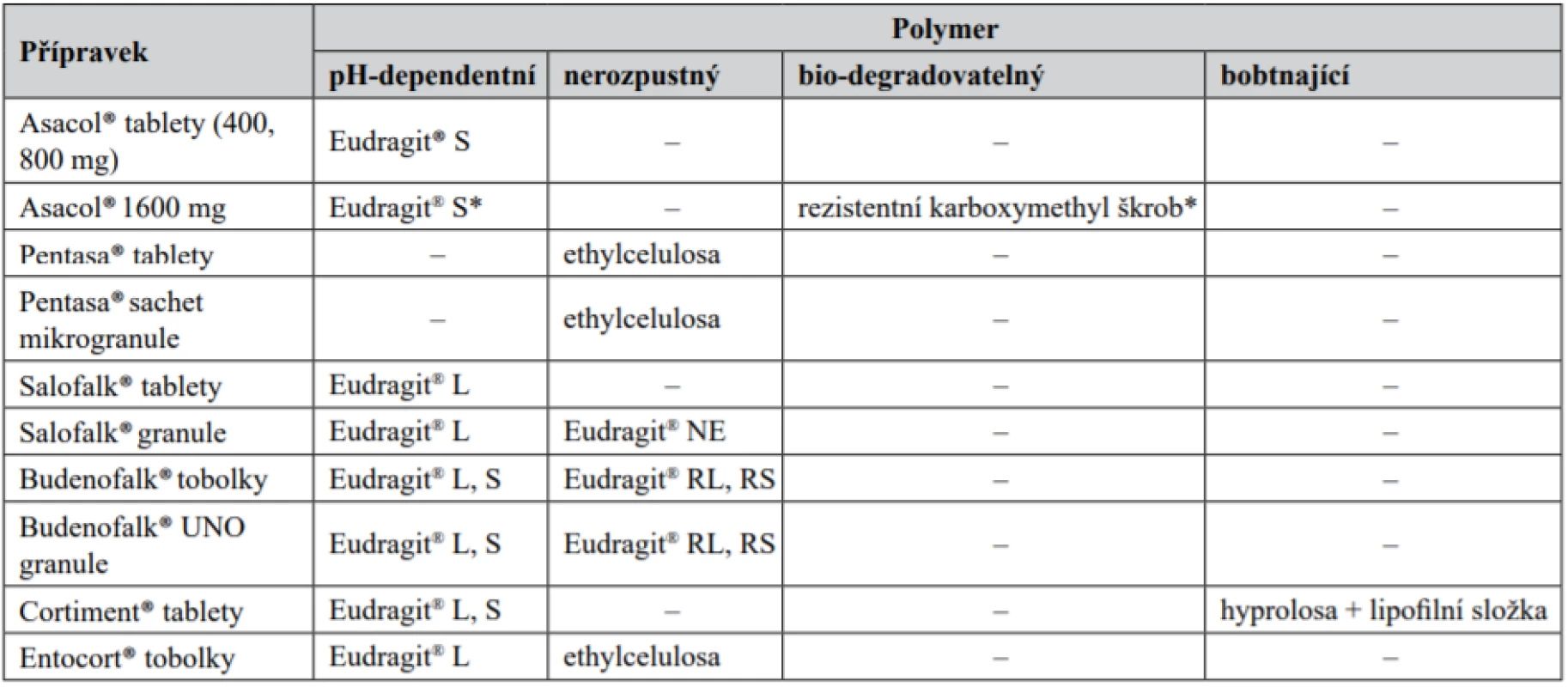
* Polymery jsou kombinovány v patentově chráněném obalu (Phloral®), který je spolu s akcelerační vrstvou označen obchodním názvem Opticore™. Technologický rozbor léčivých přípravků s obsahem kyseliny 5-aminosalicylové
Následující kapitola se zabývá rozborem léčivých přípravků registrovaných v ČR pro terapii IBD s obsahem kyseliny 5-aminosalicylové (5-ASA), a to konkrétně přípravky Asacol®, Pentasa® a Salofalk®.
Přípravek Asacol® 400 mg a 800 mg, enterosolventní tableta (Tillotts Pharma GmbH)
Základní schéma uvádí obrázek 1. Přípravek funguje na principu využití pH-dependentního polymeru Eudragit® S17). Uvolnění 5-ASA nastává okamžitě po částečném nebo celkovém rozpuštění polymerního obalu při pH > 7, které je podpořeno přítomností superdesintegrantu (látka podporující rychlý rozpad tablety) sodné soli karboxymetylškrobu, který je součástí jádra18). V případě, že pacient s IBD nevykazuje pH > 7 v lumen střeva19), léčivo se z LF neuvolní, a pacient tedy není léčen. Vzhledem k rozpustnosti polymerního obalu je vhodnou indikací ulcerózní kolitida s maximální lokalizací v proximální části kolonu. Přípravek se nesmí kousat z důvodu narušení funkce obalu a užívá se vždy na lačno (tedy 1 hodinu před jídlem nebo 2 hodiny po jídle)20).
Image 1. Přípravek Asacol® 400 a 800 mg – enterosolventní tableta 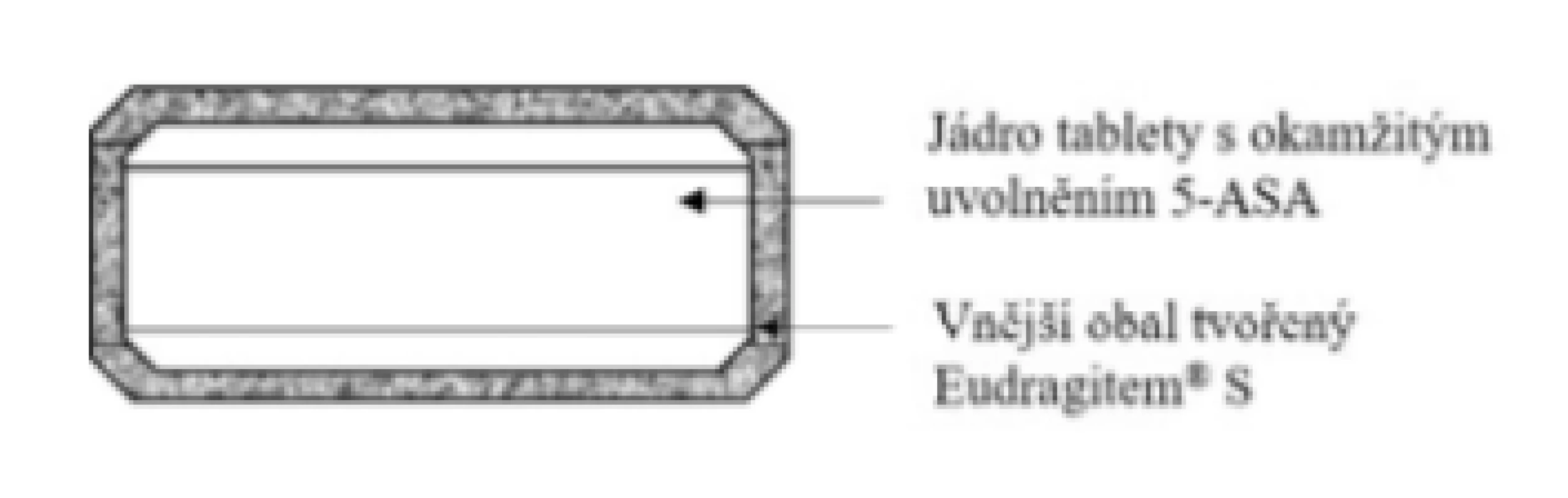
Přípravek Asacol® 1600 mg, tableta s řízeným uvolňováním léčiva (Tillotts Pharma GmbH)
Základní schéma uvádí obrázek 2. Nově registrovaný přípravek pracuje na inovativním principu kombinace pH-dependentního polymeru Eudragitu® S v kombinaci s novějším přístupem využívající štěpení obalových materiálů bakteriálními enzymy produkovanými mikroflórou kolonu21). Jedná se o „vylepšený“, patentově chráněný obalový materiál Phloral® (dle cit.22)). Kombinace představuje pojistku v případě nedostatečné hodnoty pH v GIT u pacientů s nespecifickými střevními záněty23). V případě, že v GIT pacienta nedojde k rozpuštění Eudragitu® S, uvolnění 5-ASA nastane v kolonu díky degradaci polysacharidu, který je součástí vnějšího obalu. Mimo to vnitřní vrstva obalu je tvořena tzv. neutralizovaným Eudragitem® S (pH upraveno na hodnotu 8,0 pufrujícím činidlem KH2PO4), čímž se urychluje jeho rozpouštění24). Izolační vrstva mezi jádrem tablety a obalovými vrstvami je tvořena HPMC. Výhodou přípravku je, že v oblasti kolonu by měla být dostupná celá dávka podaného léčiva v akcelerovaném režimu25). Celá technologie se označuje obchodním názvem Opticore™ (OPTImized COlonic RElease). Vzhledem ke konstrukci LF je jednoznačně vhodnou indikací ulcerózní kolitida. Přípravek se nesmí kousat z důvodu narušení funkce obalu. Tablety se mohou užívat s jídlem i bez něj, což také představuje určitou výhodu26).
Image 2. Přípravek Asacol® 1600 mg – tableta s řízeným uvolňováním léčiva 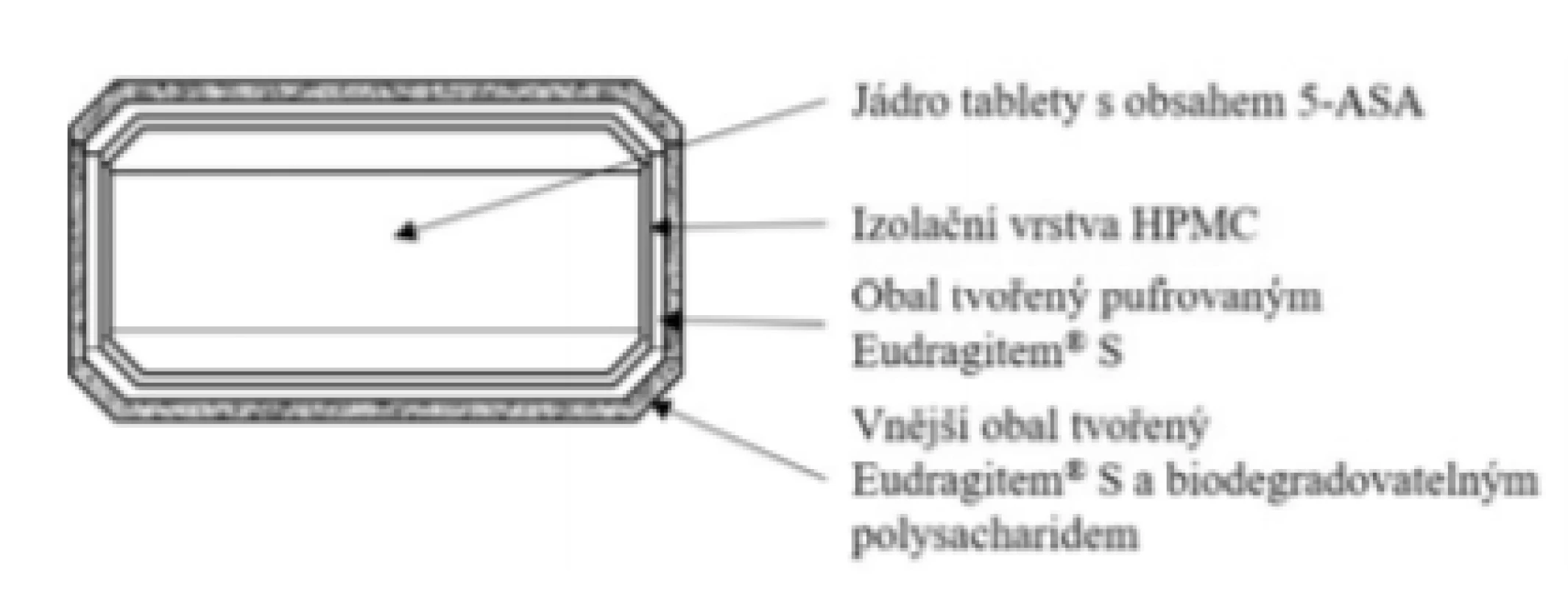
Přípravek Pentasa® Prolong 500 mg a 1 g, tableta s prodlouženým uvolňováním (Ferring GmbH)
Základní schéma uvádí obrázek 3. Tableta je připravena slisováním obalených pelet (sférické částice malých rozměrů) s obsahem 5-ASA. Ta se v žaludku ihned rozpadá na jednotlivé mikropelety (limit pro rozpad tablet je dle Českého lékopisu 2017 15 min). Uvolňování léčiva začíná již v žaludku a přetrvává jak v oblasti tenkého střeva, tak kolonu. Je řízeno nerozpustným obalem z ethylcelulosy27), ale také rozpustností účinné látky, která je závislá na hodnotě pH ve střevním lumen a roste s rostoucím pH28). Zatímco rozpustnost 5-ASA je při pH 6,0 1,2 mg/ml, při pH 7,2 je 5,5 mg/ml29). Je třeba zmínit, že přibližně 60 % 5-ASA je uvolněno v oblasti tenkého střeva, zbývajících 40 % pak v oblasti kolonu30). Vzhledem k profilu uvolňování 5-ASA a z něj vyplývající koncentrace léčiva v jednotlivých segmentech GIT je přípravek vhodný zejména k léčbě Crohnovy choroby. Dle SPC přípravku by se tablety měly polykat nerozkousané, aby nedošlo k poškození řídícího obalu a nejlépe před jídlem, čímž se zamezí většímu uvolnění léčiva v nepostižených částech střeva. Přípravek Pentasa® Prolong se podává nezávisle na jídle v dávce 2–4 g jednotlivě nebo v rozdělených dávkách a nesmí se kousat. Pro usnadnění polknutí se mohou tablety rozptýlit v 50 ml studené vody, zamíchat a ihned vypít31).
Image 3. Přípravek Pentasa® Prolong – tableta s prodlouženým uvolňováním léčiva 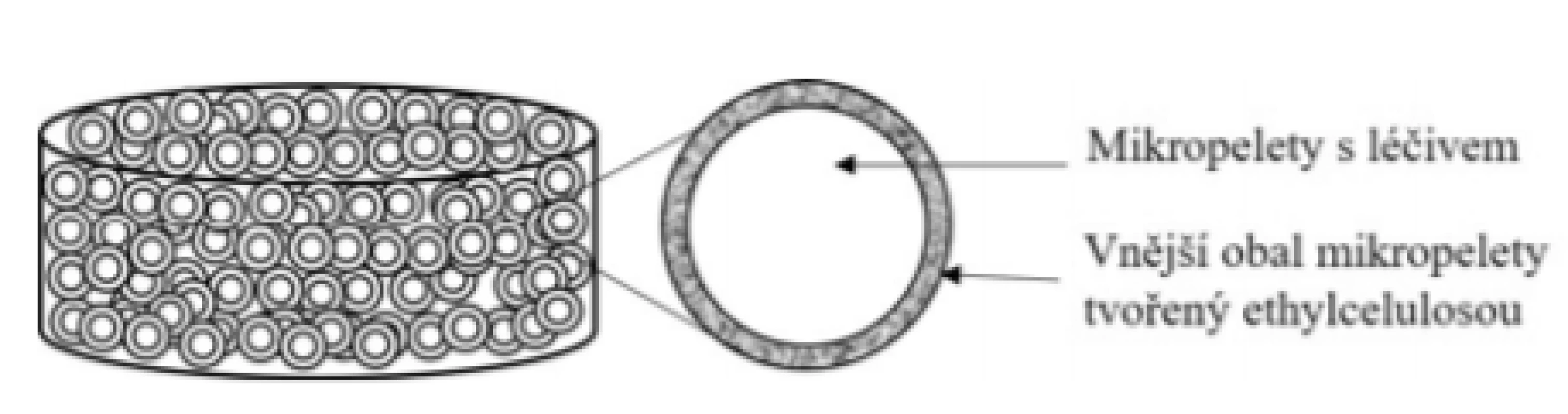
Přípravek Pentasa® sachet 2 g a 4 g, granule s prodlouženým uvolňováním (Ferring GmbH)
Základní schéma uvádí obrázek 4. Přípravek je tvořen obalenými mikrogranulemi (částice malých rozměrů, u kterých není kladen takový důraz na sférický tvar jako u pelet) s obsahem 5-ASA obalenými ethylcelulosovým filmem. Princip uvolňování 5-ASA je srovnatelný s přípravkem Pentasa® Prolong, u kterého dochází k velmi krátkému času zpoždění kvůli rozpadu tablety. Výhodu přípravku lze vidět pouze v aplikační formě u pacientů s potížemi při polykání tablet, kteří zpravidla pro dosažení potřebné dávky polykají více tablet najednou.
Image 4. Přípravek Pentasa® sachet – mikrogranule s prodlouženým uvolňováním léčiva 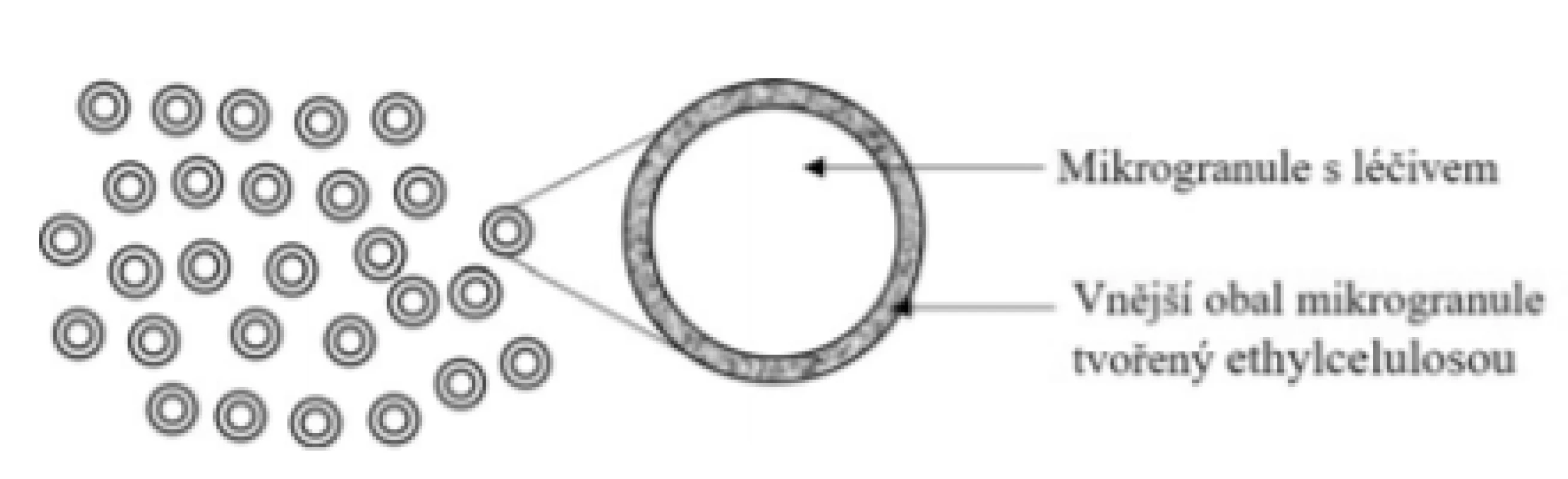
Přípravek Salofalk® 500 mg, enterosolventní tablety (Dr. Falk Pharma GmbH)
Základní schéma uvádí obrázek 5. Tablety jsou potaženy třemi vrstvami enterosolventního polymeru Eudragit® L, který odolává pH žaludku. Následně se tento obal rozpouští při dosažení pH 6,0. Vrstva HPMC pod vnějším obalem nemodifikuje uvolňování léčiva. Léčivo se začíná uvolňovat cca po 15 minutách v tenkém střevě. Celé množství léčiva se uvolní přibližně za 60 minut32, 33). Přípravek je vhodný u Crohnovy choroby postihující větší úsek tenkého střeva a vzestupný tračník. Tablety se užívají nerozkousané a rozděleně ve třech dílčích dávkách, vždy na lačno (pozn. tedy 1 hodinu před jídlem nebo dvě hodiny po jídle)34).
Image 5. Přípravek Salofalk® – enterosolventní tableta 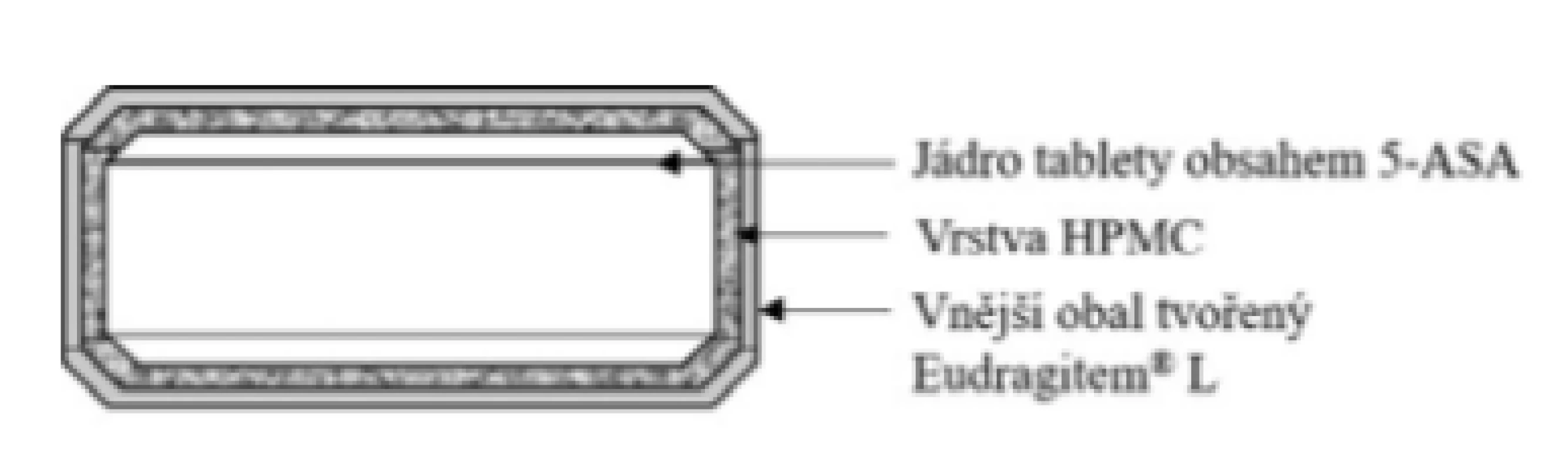
Přípravek Salofalk® 1500 a 3000 mg, enterosolventní granule s prodlouženým uvolňováním (Dr. Falk Pharma GmbH)
Základní schéma uvádí obrázek 6. Přípravek je tvořen matricovými granulemi s obsahem 5-ASA na bázi nerozpustného polymeru Eudragit® NE potaženými vrstvou Eudragit® L 100, který odolává pH žaludku. Následně se tento obal rozpouští při dosažení pH 6,0 a dochází k prodlouženému uvolňování léčiva z matricových granulí. Dle Kruis et al. se uvolní přibližně 80 % léčiva během následujících 3 hodin35). Dle Karkossa et al., který využil nový in vitro prediktivní disoluční model, se léčivo uvolňuje výrazně pomaleji a 80 % se uvolní přibližně po 7 hodinách36). Uvádí také velký vliv interindividuální variability na průběh uvolňování. Dle SPC přípravku se granule nemají rozkousávat, aby nedošlo k poškození polymerního obalu. Neuvádí však nic o vazbě na příjem stravy37). Tak jako jiné přípravky založené na pH-dependentním polymeru by se tyto enterosolventní granule měly podávat na lačno. Je možné jej podat jednou denně nebo rozdělit do tří dílčích dávek. Ve srovnání s tabletou Salofalk® je výhodou možnost jednodávkového podání a výrazně větší povrch, který granule v oblasti střeva pokryjí. Výhodu představuje tento přípravek také pro pacienty s potížemi při polykání tablet. Vzhledem k disolučnímu profilu při použití inovativních in vitro disolučních metod je rozdílné také zacílení přípravku do distálnějších částí GIT. Je vhodný pro léčbu ulcerózní kolitidy, včetně levostranných forem zánětu. Efekt byl zaznamenán i u proktosigmoiditidy38). Dávka 5-ASA dostupná v oblasti kolonu je vyšší než v případě přípravku Pentasa®.
Image 6. Přípravek Salofalk® – enterosolventní granule s prodlouženým uvolňováním léčiva 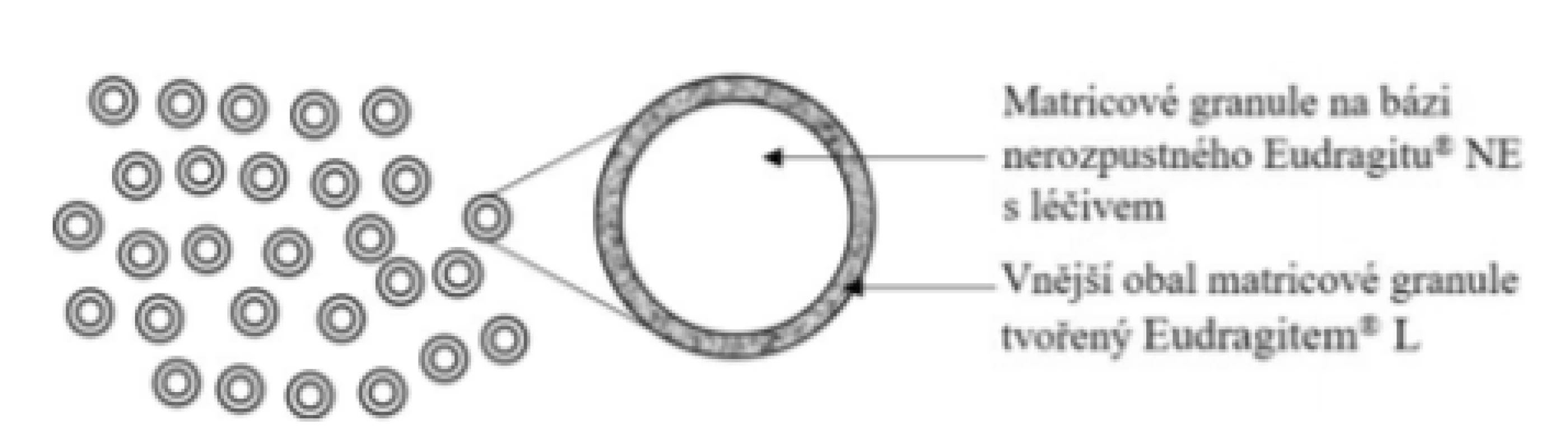
Technologický rozbor léčivých přípravků s obsahem budesonidu
Součástí této kapitoly je rozbor léčivých přípravků registrovaných v ČR pro terapii IBD s obsahem budesonidu. Jedná se o přípravky Budenofalk®, Cortiment® a Entocort®.
Přípravek Budenofalk® 3 mg, enterosolventní tvrdá tobolka (Dr. Falk Pharma GmbH)
Základní schéma uvádí obrázek 7. Uvolňování léčiva není řízeno tobolkou (rozpustí se v žaludku cca za 10 min), ale dvojitě obalenými peletami uvnitř tobolky. Vnitřní obal je tvořen směsí pH-dependentních polymerů Eudragit® L i S a nerozpustného polymeru Eudragit® RS s nízkou permeabilitou. Základem vnějšího obalu je nerozpustný, ale poměrně permeabilní polymer Eudragit® RL39). Obal granulí se začíná rozpouštět dle informací výrobce při pH > 6,440–42). Nicméně přítomnost nerozpustných polymerů způsobuje, že rozpouštění obalů je poměrně pomalé. Dle Goyanese et al. začíná ve střední oblasti jejuna a během 120 minut se uvolní přibližně 80 % léčiva, přičemž v prvních 60 minutách pouze 30 % léčiva43) (tedy více distálně ve srovnání s přípravkem Entocort® – viz dále). Přípravek je vhodný zejména pro terapii Crohnovy choroby postihující ileum a/nebo vzestupný tračník. Nově schválenou indikací je mikroskopická kolitida. Tobolky (zpravidla tři v jedné dávce) se užívají půl hodiny před jídlem a polykají se s dostatečným množstvím tekutiny44).
Image 7. Přípravek Budenofalk® – enterosolventní tvrdá tobolka s obsahem obalených pelet 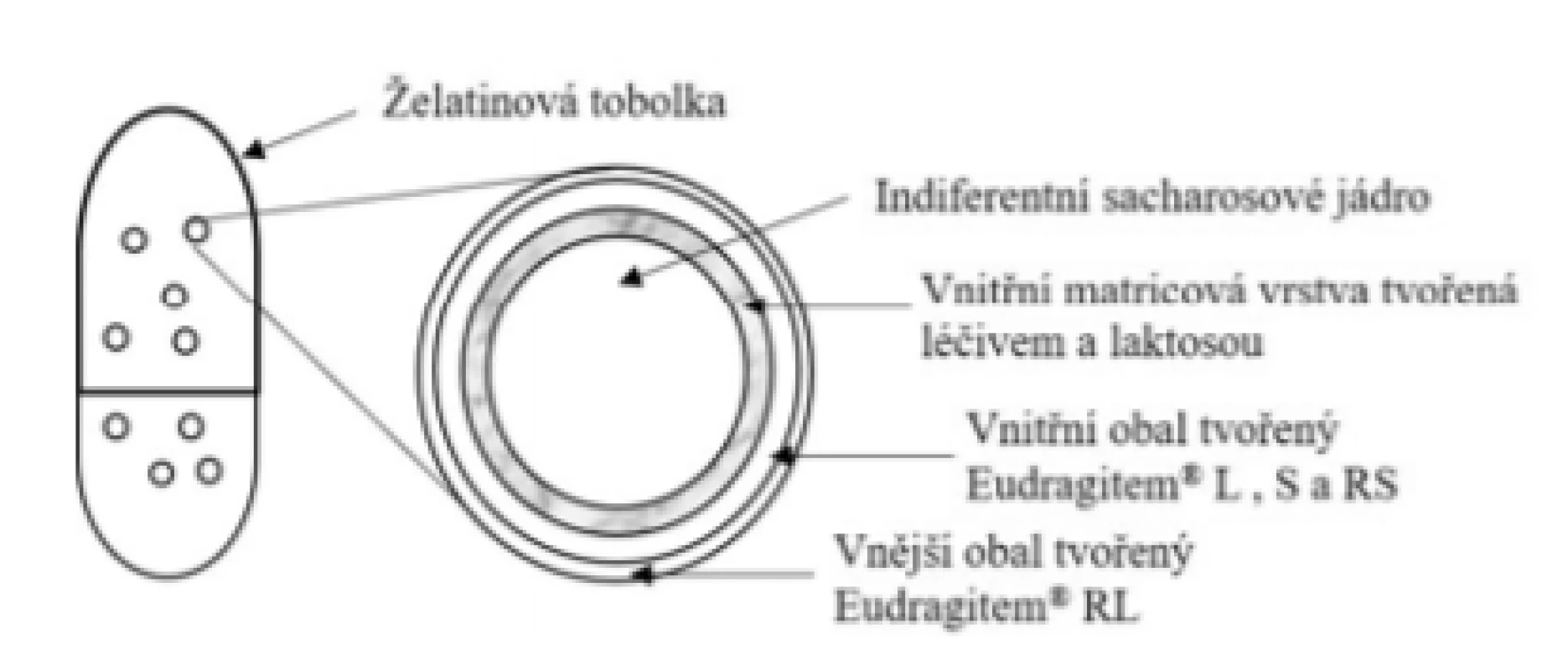
Přípravek Budenofalk® UNO 9 mg, enterosolventní granule (Dr. Falk Pharma GmbH)
Základní schéma uvádí obrázek 8. Princip uvolňování budesonidu je po velmi krátkém čase zpoždění (cca 10 min) srovnatelný s přípravkem Budenofalk® enterosolventní tobolky. Výhodu přípravku lze vidět pouze v aplikační formě u pacientů s potížemi při polykání, kteří zpravidla pro dosažení potřebné dávky polykají více tobolek. Dle SPC se obsah sáčku užívá 30 minut před snídaní. Granule se vkládají na jazyk a polykají celé s dostatečným množstvím tekutiny (např. se sklenicí vody). Granule se nežvýkají ani nedrtí z důvodu porušení funkčního obalu45).
Image 8. Přípravek Budenofalk® UNO – enterosolventní granule 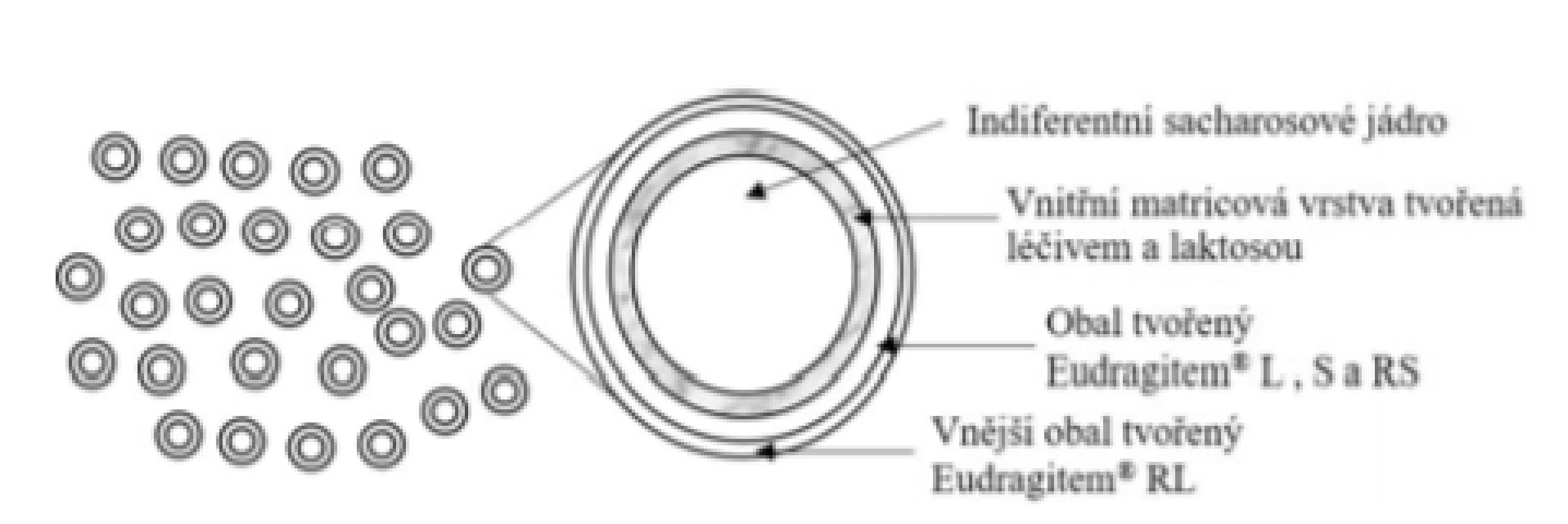
Přípravek Cortiment® 9 mg, tableta s prodlouženým uvolňováním (Ferring GmbH)
Základní schéma uvádí obrázek 9. Jedná se o obalenou tabletu. Použitý obalový materiál je tvořen směsí pH-dependentních polymerů Eudragit® L a S. Jádro tablety je tvořeno lipofilními granulemi na bázi kyseliny stearové a amfifilního lecitinu s obsahem léčiva, které jsou rovnoměrně rozptýleny v bobtnajícím polymeru hyprolose (hydroxypropylcelulosa – HPC). Jádro má matricovou povahu. Tento typ hydrofilně/lipofilní tablety potažené gastrorezistentním obalem se označuje jako tzv. MMX technologie (z ang. Multi-Matrix Technology)46, 47). Obal tablety se dle informací z literatury rozpouští při pH > 748). Dle složení obalu a přítomnosti Eudragit® L lze usuzovat, že reálně bude tato hodnota pH pravděpodobně nižší. Následně vzniká z bobtnajícího polymeru gelová vrstva, která moduluje uvolňování léčiva a tlumí rychlé uvolnění léčiva z granulí. Z tohoto důvodu je uvolňování léčiva z přípravku postupné a relativně rovnoměrné (blízké kinetice tzv. nultého řádu)49). Přípravek je vhodný pro léčbu ulcerózní kolitidy. Prokazuje účinnost i u levostranných forem zánětů. Dle SPC se přípravek podává v dávce jedna tableta ráno s jídlem nebo nalačno50). S jídlem však dochází ke snížení Cmax a prodloužení Tmax51). Tableta se zapije sklenicí vody a nesmí se lámat, drtit nebo žvýkat, protože by mohlo dojít k porušení prodlouženého uvolňování léčiva.
Image 9. Přípravek Cortiment® – tableta s prodlouženým uvolňováním 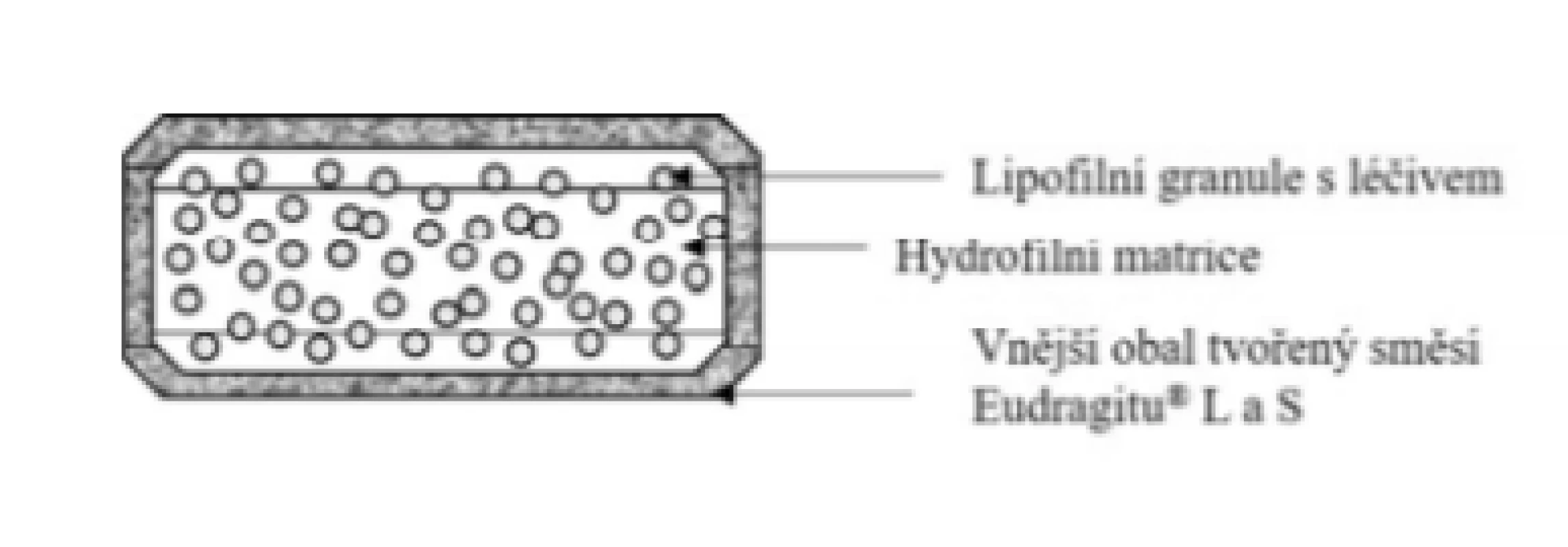
Přípravek Entocort® 3 mg, tvrdé tobolky s řízeným uvolňováním (Tillotts Pharma GmbH)
Základní schéma uvádí obrázek 10. Přípravek je tvořen obalenými granulemi umístěnými do tvrdé želatinové tobolky. Uvolňování léčiva není tedy opět řízeno tobolkou (rozpustí se v žaludku cca za 10 min)52), ale funkčním obalem granulí. Léčivo je součástí potahu spolu s nerozpustným hydrofobním polymerem ethylcelulosou, který je nanesen nástřikem na sacharosové indiferentní jádro. Vnější obal je tvořen pH-dependentním polymerem Eudragit® L. Léčivo se uvolňuje po rozpuštění pH-dependentního obalu granulí při pH > 5,5 (strukturně odlišný od typu s rozpustností při pH > 6,0)53). Následuje prodloužené uvolňování léčiva z ethylcelulosové matrice, které začíná v duodenu kinetikou 1. řádu, je tedy z počátku uvolňováno výrazně rychleji a následně se zpomaluje, čímž se odlišuje od přípravku Budenofalk®. Během prvních 60 minut se uvolní více než 55 % léčiva, 80 % léčiva se pak uvolní za více než 120 minut. Z disolučního chování přípravku lze vyvodit rovnoměrnější a mírně větší pokrytí oblasti tenkého střeva43). Nicméně existuje disoluční model srovnávající Entocort® a Cortiment®, kde se již během 60 minut uvolní přibližně 80 % léčiva49).
Image 10. Přípravek Entocort® – tvrdé tobolky s řízeným uvolňováním léčiva s obsahem obalených granulí 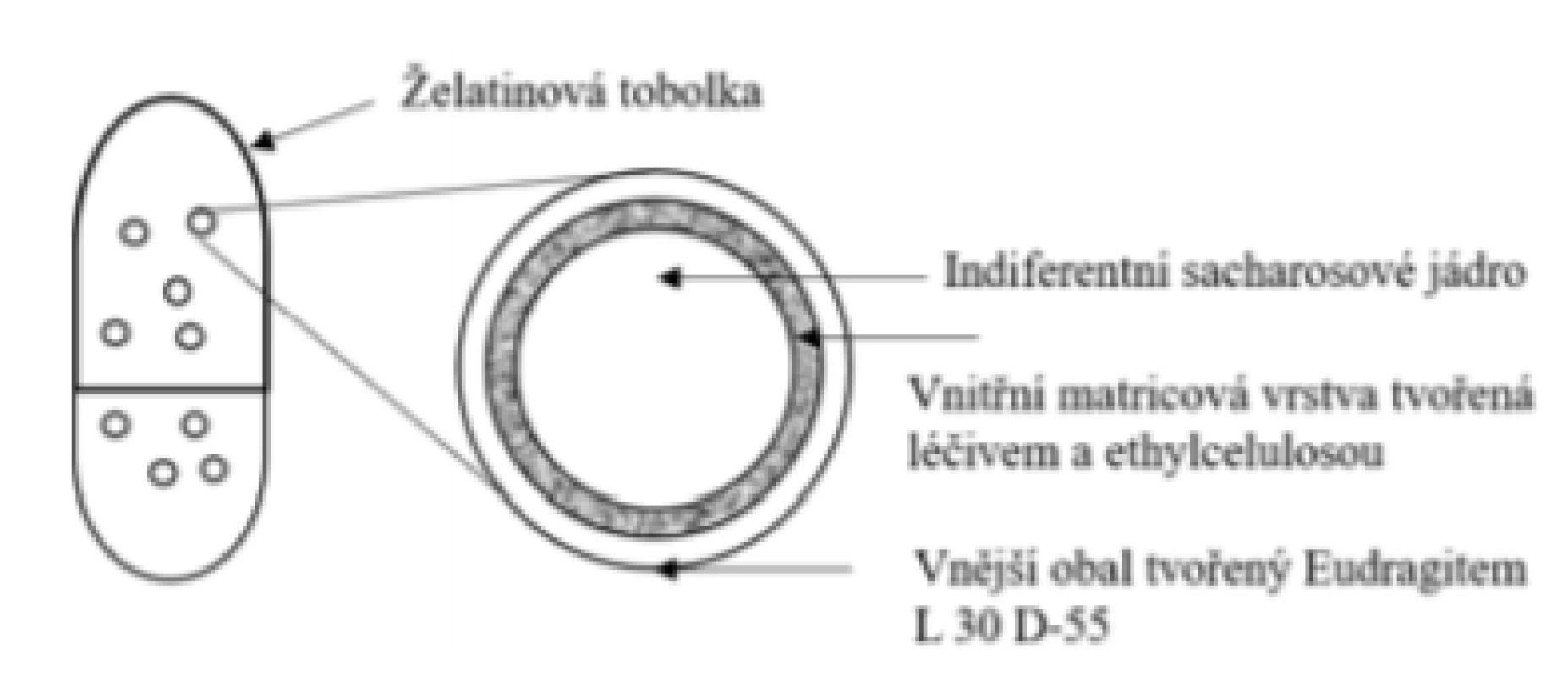
Z disolučního chování přípravku vyplývá, že přípravek je vhodný pro terapii Crohnovy choroby postihující ileum a/nebo vzestupný tračník. Nově schválenou indikací je mikroskopická kolitida. Tobolky by se měly polykat na lačno54).
Praktická doporučení z pohledu farmaceutické technologie
Z hlediska uvedených informací lze definovat základní doporučení a praktické informace a shrnout je do základních bodů:
I. Žádná z uvedených lékových forem se nesmí drtit ani kousat, jelikož by došlo k poškození obalu/ů, a tak k poškození konceptu LF.
II. Přípravky ve formě tobolek (konkrétně Entocort®, Budenofalk®) obsahují obalenou násobnou lékovou formu ve formě obalených granulí nebo pelet, která zajišťuje danou formu řízeného uvolňování. Želatinová tobolka představuje pouze nosič, který definuje dávku a usnadňuje aplikaci. Teoreticky je možné obsah tobolky vysypat a spolknout s dostatečným množstvím tekutiny (viz Budenofalk® UNO).
III. Pentasa® Prolong a Pentasa® sachet: ve smyslu technologie uvolňování se jedná o identické principy a není mezi nimi žádný významný rozdíl.
IV. Naopak Salofalk® tablety a Salofalk® granule vykazují odlišný profil uvolňování léčiva. Přestože oba přípravky začínají uvolňovat 5-ASA při pH > 6, Salofalk® ve formě granulí uvolňuje léčivo výrazně pomaleji ve srovnání s tabletami.
V. Přípravek Asacol® 1600 mg představuje kombinaci pH-dependentního polymeru a biodegradabilního polymeru, který zajišťuje uvolňování 5-ASA i v případě nedostatečné hodnoty pH v GIT u pacientů s IBD, kdy mohou selhávat přípravky založené pouze na pH-dependentních polymerech. Výhodou přípravku je jednorázová dostupnost celé dávky léčiva v oblasti kolonu.
VI. Z pohledu farmaceutické technologie lze rozdělit přípravky z hlediska preference pro jednotlivé typy IBD – Crohnovu chorobu a ulcerózní kolitidu (tab. 3).
VII. V některých zemích jsou dostupné přípravky (Mezavant®, Lialda®) s obsahem 5-ASA v dávce 1,2 g ve formě MMX (technologie viz Cortiment®). Uvolňování je závislé na pH (pH > 6,8), jako je tomu u jiných pH-dependentních přípravků.
VIII. Při výběru vhodného přípravku je důležité zohlednit preference pacienta a podpořit tím jeho compliance. Dle Mackenzie-Smith et al. pacienti s ulcerózní kolitidou obecně preferují spíše tablety (67 %) než granulát (29 %). Dle vnímání gastroenterologů preferují pacienti tablety (49 %) před granuláty (38 %), 13 % pacientů preferenci nemá55). Až 70 % pacientů preferuje dávkování v jedné denní dávce56). Nízká adherence pacienta může vést k vyššímu riziku relapsu onemocnění (dle studie Kane et al. až 5krát vyšší riziko pro ulcerózní kolitidu)57). Současně je třeba brát v potaz i objem účinné látky, jelikož se 5-ASA podává v dávce až 4,8 g. Pacient tedy každodenně užívá vyšší počet tablet nebo polyká velký objem nerozpustného granulátu.
Závěr
Jak je patrné, skupina těchto přípravků je velmi rozmanitá. Zahrnuje různé lékové formy, různé technologie a různé pomocné látky. Tyto parametry se pak v kombinaci odrážejí v chování přípravku v lidském organismu. Je důležité připomenout, že vedle konstituce lékové formy se na výsledném účinku podílí další faktory, jako je compliance pacienta (souvisí s dávkovacím režimem a množstvím podané léčivé látky v dané lékové formě), rozsah a aktivita onemocnění, individuální podmínky GIT atd. Snahou tohoto příspěvku bylo pokusit se o rekonstrukci lékových forem z hlediska znalostí farmaceutické technologie a dostupných informací v dané oblasti a nastínit hlavní parametry pro rozhodování při výběru vhodného léčivého přípravku pro určitý typ a lokalizaci nespecifického střevního zánětlivého onemocnění.
Table 3. Přípravky z hlediska preference z pohledu farmaceutické technologie 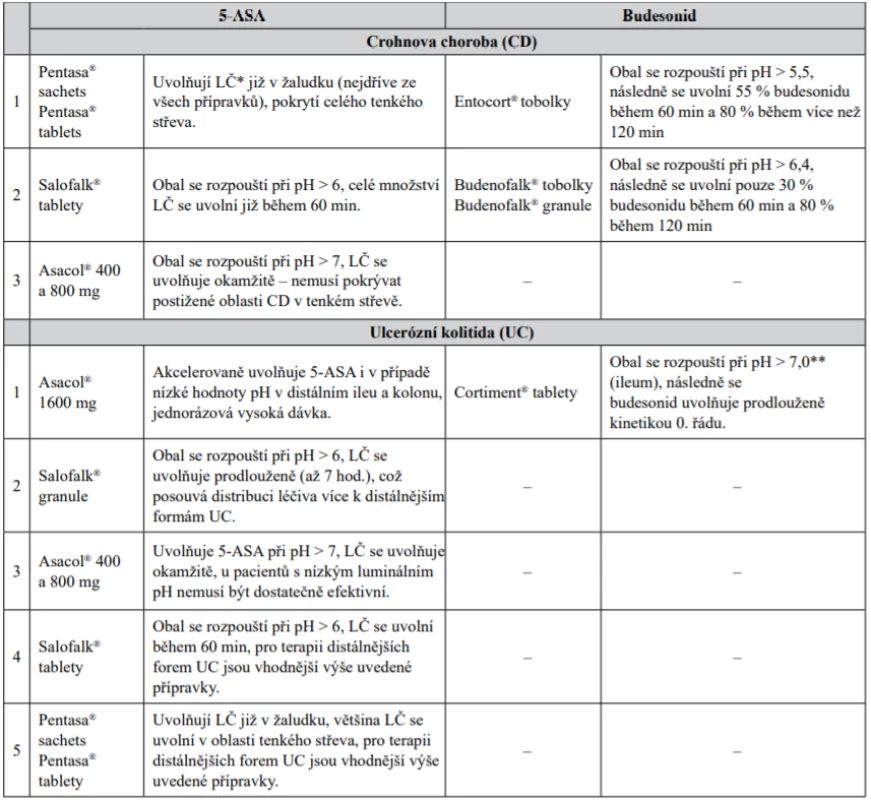
* léčivo
** spíše nižší pH než 7 z hlediska složení obaluStřet zájmů: žádný.
doc. PharmDr. Kateřina Kubová, Ph.D. (∗)
Ústav farmaceutické technologie
Farmaceutická fakulta, Masarykova univerzita
Palackého 1, 612 42 Brno
e-mail: kubovak@pharm.muni.cz
Sources
1. Ludwig A., van Ooteghem M., Delva A. Disintegration of hard gelatin capsules, part 1: Composition and structure of the capsule wall. Pharm. Ind. 1979; 41, 796–798.
2. Dvořáčková K. Principy uvolňování léčiv z perorálních matricových tablet obsahujících hypromelosu. Chem. Listy 2009; 103(1), 66–72.
3. Colombo P., Bettini B., Santi P., Peppas N. A. Swellable matrices for controlled drug delivery: gel-layer behaviour, mechanisms and optimal performance. Pharm. Sci. Tech. Today 2000; 3(6), 198–204.
4. Bruschi M. L. Strategies to modify the drug release from pharmaceutical systems. 1. vydání. Cambridge: Woodhead Publishing 2015.
5. Philip A. K., Philip B. Colon targeted drug delivery systems: a review on primary and novel approaches. Oman Med. J. 2010; 25(2), 79–87.
6. Shimono N., Takatori T., Ueda M., Mori M., Higashi Y., Nakamura Y. Chitosan dispersed system for colon-specific drug delivery. Int. J. Pharm. 2002; 245(1–2), 45–54.
7. Singh B. N. Modified-release solid formulations for colonic delivery. Recent. Pat. Drug Deliv. Formul. 2007; 1, 53–63.
8. Segregur D., Flanagan T., Mann J., Moir A., Karlsson E. M., Hoch M., Carlile D., Sayah-Jeanne S., Dressman J. Impact of acid-reducing agents on gastrointestinal physiology and design of biorelevant dissolution tests to reflect these changes. J. Pharm. Sci. 2019; 108(11), 3461–3477.
9. Nugent S. G. Intestinal luminal pH in inflammatory bowel disease: possible determinants and implications for therapy with aminosalicylates and other drugs. Gut 2020; 48(4), 571–577.
10. Naiserová M., Kubová K., Vysloužil J., Bernatoniene J., Brokalakis I., Vetchý D. (Meth)acrylates copolymers of Eudragit® type in oral tablet technology. Čes. slov. Farm. 2019; 68, 183–197.
11. Maurer J. M., Schellekens R. C., van Rieke H. M., Wanke C., Iordanov V., Stellaard F., Wutzke K. D., Dijkstra G., van der Zee M., Woerdenbag H., Frijlink H. W., Kosterink J. G. Gastrointestinal pH and transit time profiling in healthy volunteers using the intellicap system confirms ileo-colonic release of colopulse tablets. PloS One 2015; 10(7); e0129076. https://dx.plos.org/10.1371/journal.pone.0129076 (12. 8. 2019)
12. Sinha V. R., Kumria R. Microbially triggered drug delivery to the colon. Eur. J. Pharm. Sci. 2003; 18(1), 3–18.
13. Park K., Shalaby W. S., Park H. (eds.) Biodegradation. In: Biodegradable hydrogels for drug delivery, USA: Technomic publishing company 1993; 13–34.
14. Rajpurohit H., Sharma P., Sharma S., Bhandari A. Polymers for colon targeted drug delivery. Indian J. Pharm Sci. 2010; 72(6), 689–696.
15. Freire C., Podczeck F., Veiga F., Sousa J. Starch-based coatings for colon-specific delivery. Part II: Physicochemical properties and in vitro drug release from high amylose maize starch films. Eur. J. Pharm. Biopharm. 2009; 72(3), 587–594.
16. Mohanty, S., Panigrahi A. K. Multiparticulate drug delivery system for colon targeting. Int. J. Pharm. Pharm. Sci. 2015; 7(3), 433–436.
17. Thakral S. N., Thakral N. K., Majumdar D. K. Eudragit®: a technology evaluation. Expert Opin. Drug Del. 2012; 10(1), 131–149.
18. Madu S. J., Azubuike C. P., Okubanjo O., Mohammed A., Emeje O. M. Physicochemical and disintegrant properties of sodium carboxymethyl starch derived from Borassus aethiopum (Arecaceae) shoot. J. Polym. Res. 2018; 5(8), 167.
19. Ibekwe, V. C., Liu F., Fadda H. M., Khela M. K., Evans D. F., Parsons G. E., Basit A. W. An investigation into the in vivo performance variability of pH responsive polymers for ileo‐colonic drug delivery using gamma scintigraphy in humans. J. Pharm. Sci. 2006; 95(12), 2760–2766.
20. SPC Asacol 400, 800 enterosolventní tablety. http://www.sukl.cz/modules/medication/detail.php?code=0203805&tab=texts (12. 8. 2019).
21. Kaur G., Jain S., Tiwary A. Recent approaches for colon drug delivery. Recent. Pat. Drug Deliv. Formul. 2007; 1(3), 222–229.
22. Oral drug delivery technologies. Phloral®. https://healthcare.evonik.com/product/health-care/downloads/evonik-phloral-dual-action-coating-fail-safe-colonic-delivery-factsheet.pdf (12. 10. 2019).
23. Mcconnell E. L., Fadda H. M., Basit A. W. Gut instincts: Explorations in intestinal physiology and drug delivery. Int. J. Pharma. 2008; 364(2), 213–226.
24. Liu F., Moreno P., Basit A. W. A novel double-coating approach for improved pH-triggered delivery to the ileo-colonic region of the gastrointestinal tract. Eur. J. Pharm. Biopharm. 2010; 74(2), 311–315.
25. Varum F., Freire A. C., Bravo R., Buser T., Goutte F., Basit A. W. Opticore: Accelerating drug release in ileo–colonic region of the gastrointestinal tract. Denver: AAPS conference 13.–17. 11. 2016. Poster presentation.
26. SPC Asacol 1600 mg tablety s řízeným uvolňováním. http://www.sukl.cz/modules/medication/detail.php?code=0242525&tab=texts (1. 10. 2019).
27. Karoui S. (ed.) Inflammatory bowel disease – Advances in pathogenesis and management. 1. ed. Rijeka: IntechOpen 2012.
28. Richard J., Benoît J. P. Techniques de l’Ingénieur 2000; 2210, 1–20.
29. Tenjarla S. Dissolution of commercially available mesalamine formulations at various pH levels. Drugs R D. 2015; 15(2), 211–215.
30. Chuong M. C., Christensen J. M., Ayres J. W. New dissolution method for mesalamine tablets and capsules. Dissolution Technologies 2008; 15(3), 7–14. http://www.dissolutiontech.com/DTresour/200808Articles/DT200808_A01.pdf (11. 4. 2020).
31. SPC Pentasa 500 mg Prolong tablety s prodlouženým uvolňováním. http://www.sukl.cz/modules/medication/detail.php?code= 0247411&tab=texts (12. 3. 2020).
32. Gisbert J. P., Gomollon F., Mate J., Pajares J. M. Role of 5‐aminosalicylic acid (5‐ASA) in treatment of inflammatory bowel disease: a systematic review. Dig. Dis. Sci. 2002; 47, 471–488.
33. Wilhelm R., Pröls M., Greinwald R., Nacak T. Optimised high-dose mesalazine-containing tablet. WO2017072050A1. https://patents.google.com/patent/WO2017072050A1/en (30. 10. 2019).
34. SPC Salofalk 500 enterosolventní tablety. http://www.sukl.cz/modules/medication/detail.php?kod=0075567 (9. 9. 2019).
35. Kruis W., Greinwald R., Fingerhut T. In-vitro dissolution testing of 5-aminosalicylic acid release from pH dependent mesalazine formulations. J. Crohns Colitis 2011; 5(5), 499–500.
36. Karkossa F., Klein F. A biopredictive in vitro comparison of oral locally acting mesalazine formulations by a novel dissolution model for assessing intraluminal drug release in individual subjects. J. Pharm. Sci. 2018; 107(6), 1680–1689.
37. SPC Salofalk 500 mg, 1000 mg, 1500 mg, 3000 mg enterosolventní granule s prodlouženým uvolňováním. http://www.sukl.cz/modules/medication/detail.php?code=0195909&tab=texts (23. 10. 2019).
38. Leifeld L., Pfützer R., Morgenstern J., Gibson P. R., Marakhouski Y., Greinwald R., Mueller R., Kruis W. Mesalazine granules are superior to Eudragit‐L‐coated mesalazine tablets for induction of remission in distal ulcerative colitis – a pooled analysis. Aliment. Pharmacol. Ther. 2011; 34, 1115–1122.
39. Gruber P., Lach H. J., Otterbeck N. Budesonide pellets with a controlled release pattern and process for producing them. WO1995008323A1. https://patents.google.com/patent/WO199 5008323A1/en (15. 11. 2019).
40. Villa R., Pedrani M., Ajani M., Fossati L. Controlled release and taste masking oral pharmaceutical composition. US 8293273 B2. https://patents.google.com/patent/US9592203B2/en (3. 12. 2019).
41. Iborra M., Alvarez-Sotomayor D., Nos P. Long-term safety and efficacy of budesonide in the treatment of ulcerative colitis. Clin. Exp. Gastroenterol. 2014; 7, 39–46.
42. Klein S., Stein J., Dressman J. Site-specific delivery of anti-inflammatory drugs in the gastrointestinal tract: an in-vitro release model. J. Pharm. Pharmacol. 2005; 57(6), 709–719.
43. Goyanes A., Hatton G. B., Basit A. W. A dynamic in vitro model to evaluate the intestinal release behaviour of modified-release corticosteroid products. J. Drug Deliv. Sci. Tec. 2015; 25, 36–42.
44. SPC Budenofalk 3 mg enterosolventní tvrdé tobolky. http://www.sukl.cz/modules/medication/detail.php?kod=0064787 (18. 11. 2019).
45. SPC Budenofalk UNO 9 mg enterosolventní granule. http://www.sukl.cz/modules/medication/detail.php?code=0158943&tab=texts (12. 8. 2019).
46. Nardelli S., Pisani L. F., Tontini G. E., Vecchi M. L. MMX® technology and its applications in gastrointestinal diseases. Therap. Adv. Gastroenterol. 2017; 10(7), 545–552.
47. Hillery A. M., Brayden D. J. Oral drug delivery. In: Hillery A. M., Park K. (eds.) Drug Delivery: Fundamentals & Applications, 2nd ed. London: Taylor & Francis Group, LLC 2017; 171–200.
48. Thakral S., Thakral N. K., Majumdar D. K. Eudragit®: a technology evaluation. Expert Opin. Drug Deliv. 2012; 10(1), 131–149.
49. Goyanes A., Chang H., Sedough D., Hatton G. B., Wang J., Buanz A., Gaisford S. Basit A. W. Fabrication of controlled-release budesonide tablets via desktop (FDM) 3D printing. Int. J. Pharm. 2015; 496(2), 414–420.
50. Cortiment 9 mg tableta s prodlouženým uvolňováním. http://www.sukl.cz/modules/medication/detail.php?code=0206462&tab=texts (25. 10. 2019).
51. Brunner M., Ziegler S., di Stefano A. F. D., Dehghanyar P., Kletter K., Tschurlovits M., Villa R., Bozzella R., Celasco G., Moro L., Rusca A., Dudczak R., Müller M. Gastrointestinal transit, release and plasma pharmacokinetics of a new oral budesonide formulation. Br. J. Clin. Pharmacol. 2006; 61(1), 31–38.
52. Stegemann S. Hard gelatin capsules today – and tomorrow. https://pdfs.semanticscholar.org/12d4/148f4e7a261c0d3020c0140f7192ea361706.pdf (20. 11. 2019).
53. Eudragit®. https://healthcare.evonik.com/sites/lists/NC/Documents HC/Evonik–Eudragit_brochure.pdf (11. 10. 2019).
54. SPC Entocort 3 mg tvrdé tobolky s řízeným uvolňováním http://www.sukl.cz/modules/medication/detail.php?code= 0208797&tab=texts (30. 9. 2019).
55. Mackenzie-Smith L., Marchi P., Thorne H., Timeus S., Young R., le Calvé P. Patient preference and physician perceptions of patient preference for oral pharmaceutical formulations: results from a real-life survey. Inflamm. Bowel Dis. 2018; 3(1), 43–51.
56. Keil R., Wasserbauer M., Zádorová Z., Kojecký V., Hlava Š., Šťovíček J., Chudý J., Roznětinská M., Drábek J., Kubišová N., Lochmannová J. Adherence, risk factors of non-adherence and patient’s preferred treatment strategy of mesalazine in ulcerative colitis: multicentric observational study. Scand. J. Gastroenterol. 2018; 53(4), 459–465.
57. Kane S., Huo D., Aikens J., Hanauer S. Medication nonadherence and the outcomes of patients with quiescent ulcerative colitis. Am. J. Med. 2003; 114(1), 39–43.
Labels
Pharmacy Clinical pharmacology
Article was published inCzech and Slovak Pharmacy

2020 Issue 3-
All articles in this issue
- Medicinal products with controlled drug release for local therapy of inflammatory bowel diseases from perspective of pharmaceutical technology
- Metal complexes in medicine and pharmacy – the past and the present III
- Anti-inflammatory potential of composites of yeast glucan particles and geranylated flavonoid diplacone
- Ingavirin might be a promising agent to combat Severe Acute Respiratory Coronavirus 2 (SARS-CoV-2)
- The study of hypoglycemic and hypolipidemic activity of Camelina sativa (L.) Crantz extracts in rats under conditions of high-fructose diet
- A pharmacodynamic study of a new gel containing an extract of Aloe vera and an extract of oak bark for potential treatment of periodontal diseases
- Czech and Slovak Pharmacy
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Medicinal products with controlled drug release for local therapy of inflammatory bowel diseases from perspective of pharmaceutical technology
- Ingavirin might be a promising agent to combat Severe Acute Respiratory Coronavirus 2 (SARS-CoV-2)
- Metal complexes in medicine and pharmacy – the past and the present III
- A pharmacodynamic study of a new gel containing an extract of Aloe vera and an extract of oak bark for potential treatment of periodontal diseases
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

