-
Medical journals
- Career
Kvantitativní měření krevního průtoku magistrálních tepen při operacích mozkových aneuryzmat
Authors: V. Přibáň 1; J. Fiedler 2,3; J. Mraček 1; D. Štěpánek 1
Authors‘ workplace: Neurochirurgické oddělení LF UK a FN Plzeň 1; Neurochirurgické oddělení, Nemocnice České Budějovice a. s. 2; Neurochirurgická klinika LF MU a FN Brno 3
Published in: Cesk Slov Neurol N 2014; 77/110(1): 70-76
Category: Original Paper
Overview
Cíl:
Prezentace vlastních zkušeností s kvantitativním měřením krevního průtoku (flowmetrie) magistrálních tepen při operacích mozkových aneuryzmat.Soubor a metodika:
Intraoperační flowmetrie umožňuje intraoperační kvantitativní stanovení průtoku v měřené cévě v ml/min. V období 1/2011–5/2013 bylo kvantitativní měření krevního průtoku magistrálních tepen při operacích mozkových aneuryzmat provedeno u 23 pacientů. Průměrný věk činil 52,1 let (30–73). V 19 případech se jednalo o incidentální aneuryzmata, ve čtyřech případech bylo přítomno subarachnoidální krvácení (2krát Hunt-Hess I, 2krát Hunt-Hess II). Lokalizace aneuryzmat: aneuryzma střední mozkové tepny 16krát, přední komunikující tepny 4krát, zadní komunikující tepny 2krát a a. pericallosa jednou. Velikost vaku aneuryzmat: malá (do 7 mm) 10, střední (8–14 mm) devět, velká (15–24 mm) tři a gigantické (nad 25 mm) jedno.Výsledky:
Třicetidenní pooperační výsledky: v 21 případech normální nález a ve dvou případech mírný deficit. V souboru nebyla zaznamenána pooperační ischemie. Patologické intraoperační hodnoty krevního průtoku se vyskytly u čtyř pacientů. Ve dvou případech byl příčinou vazospazmus. Normalizace hodnot průtoku nastala po podání papaverinu. Ve dvou případech (8,7 %) byla provedena korekce polohy klipu s následnou normalizací průtoku.Závěr:
Kvantitativní měření krevního průtoku magistrálních tepen přispívá ke zvýšení perioperační bezpečnosti chirurgie mozkových aneuryzmat. Úloha flowmetrie při detekci stenózy/okluze magistrálních tepen je nezastupitelná.Klíčová slova:
mozková aneuryzmata – chirurgická léčba – flowmetrie – ischemieÚvod
Cílem operace mozkových aneuryzmat je kompletní uzavření krčku aneuryzmatu klipem se současným zachováním průtoku krve v magistrálních tepnách, které mají anatomickou souvislost s aneuryzmatem (tj. v tepně mateřské a tepnách odstupujících). Riziko při operaci je v neúplném uzavření aneuryzmatu s možností recidivy krvácení, v okluzi magistrální tepny klipem a v uzávěru nebo poranění perforátorů. Recidivující krvácení z aneuryzmatu je zatíženo vysokou mortalitou/morbiditou. Okluze nebo stenóza mateřské tepny a odstupujících tepen může vyústit v ischemii v odpovídajícím povodí s následným neurologickým deficitem. Okluze perforátorů může postihnout hluboké struktury mozku – vnitřní kapsulu nebo corona radiata, výsledkem může být opět neurologický deficit. Z těchto důvodů jsou během operací aneuryzmat využívány metody, které jsou schopny detekovat potenciální technickou chybu a poskytují šanci na okamžitou nápravu [1]. Rychlé napravení technické chyby je jediná možnost, jak zabránit trvalému neurologickému deficitu. Přes pokroky v mikrochirurgii bylo na základě časných pooperačních angiografických vyšetření prokázáno, že přetrvávající plnění rezidua krčku nebo celého vaku se vyskytuje ve 4–19 % a okluze/stenóza mateřské tepny nebo tepen odstupujících z vaku v 0,3–12 % [2–5]. Při hodnocení úplnosti uzávěru aneuryzmatu se uplatňuje mikrovaskulární dopplerovská ultrasonografie (MDU) [6,7], ICG videoangiografie [8] a ve speciálních situacích intraoperační angiografie (iDSA) [9–12]. Při posouzení stenózy/okluze magistrální tepny nám výše uvedené metody poskytují pouze kvalitativní informaci ve smyslu, zda je krevní tok přítomen, nebo nepřítomen. Hemodynamicky významná stenóza mateřské tepny nebo větvících se tepen v oblasti aneuryzmatu tak nemusí být pomocí iDSA, MDU, či ICG videoangiografií správně zhodnocena. Výsledkem může pak být pooperační neurologický deficit. Kvantitativní zhodnocení průtoku krve v tepnách nám dává pouze intraoperační flowmetrie (Transit-Time Flow Measurement, TTFM). Na podkladě měření toku v tepnách před aplikací a po ní lze predikovat riziko ischemie v teritoriu monitorované tepny [13]. Autoři v textu prezentují vlastní zkušenosti s intraoperační flowmetrií při operacích mozkových aneuryzmat.
Soubor a metodika
Ultrazvuková flowmetrie (Transit-Time Flow Measurement, TTFM)
Vyšetření flowmetrem umožňuje intraoperační kvantitativní stanovení průtoku v měřené cévě v absolutních hodnotách v ml/min (obr. 1). Přístroj je vybaven sadou perivaskulárních průtokových sond o velikosti 1,5–8 mm. Při vlastním vyšetření jsou vybrány sondy tak, aby odpovídaly průsvitu vyšetřovaných intrakraniálních (1,5; 2 a 3 mm) a extrakraniálních tepen (4, 6 a 8 mm). Intrakraniální perivaskulární sondy mají bajonetový tvar a jejich „krček“ lze deformovat podle potřeby tak, aby nastala anatomická kongruence s průběhem měřené tepny (obr. 2). Tělo perivaskulární sondy obsahuje dva ultrazvukové transducery, na konci sondy je umístěn akustický reflektor. Do okénka mezi transducery a reflektorem se umístí céva, která je předmětem měření. Platí přitom pravidlo, že by tepna měla vyplňovat ze 65–100 % otvor (okénko) na konci sondy (obr. 3). Transducery emitují alternativně ve směru a v protisměru toku krve ultrazvukové paprsky proti sobě pod úhlem 45 stupňů. Paprsky jsou po průchodu cévou odráženy zpět akustickým reflektorem k neemitujímu transduceru. TTFM pracuje na principu srovnání tranzitních časů těchto paprsků pronikajících vyšetřovanou cévou v celém jejím průřezu. Tranzitní čas ultrazvukového paprsku je snížen, pokud míří ve směru proudu a naopak zvýšen, když míří proti proudu krve. Integrací rozdílu těchto veličin je určen průtok cévou v mililitrech za minutu [14]. Hodnota takto zjištěného průtoku je nezávislá na úhlu přiložení, průměru cévy, hematokritu či na turbulencích v cévě [15]. Měření se provádí na tepnách nejprve před zaklipováním aneuryzmatu a následně po aplikaci svorky (obr. 4, 5). Perivaskulární sonda adekvátního průsvitu se nejprve zapojí do přístroje – flowmetru. Následně se sonda přiloží na tepnu a operační pole naplní fyziologickým roztokem. Hodnoty průtoku krve jsou průběžně zaznamenávány na displeji přístroje. Po ustálení hodnot je lze v definovaném časovém úseku nahrát a vytisknout. Jsou tak získány hodnoty průměrného, maximálního a minimálního průtoku krve v ml/min a dále pulzatilní index (PI) (obr. 6, 7). Správná metodika vyšetření je rovněž podpořena akustickým signálem. Rozlišujeme měření direktní a indirektní. Příkladem direktního měření je TTFM u aneuryzmatu střední mozkové tepny v typické lokalizaci bifurkace: měří se průtoky krve v obou odstupujících větvích M2 bazálně a následně po zaklipování. Alternativou je měření průtoku na mateřské tepně M1 (opět před zaklipováním a po něm). Měření průtoku krve může být i indirektní. To se provádí v případě rizika manipulace s tepnami blízko vaku. Příkladem je aneuryzma přední komunikující tepny, u kterého aa. pericallosae (A2) jsou v intimním kontaktu s vakem, a případná manipulace s nimi by mohla přinést zvýšené riziko ruptury vaku. Tak tomu je, pokud míří vak mezi vidlici A2 – horní typ aneuryzmatu přední komunikanty. Měří se proto ipsilaterálně dominantní A1 před zaklipováním a po něm se současně dočasně umístěným klipem na kontralaterální A1. V tomto případě tok krve v ipsilaterální A1 reflektuje celkový průtok v obou A2. Průtok krve v měřených tepnách by měl být po zaklipování stejný nebo obvykle o 20–30 % vyšší než iniciálně. Za zvýšení průtoku je odpovědná hyperemie, která je spojena s aplikací dočasných svorek na magistrální tepny během preparace. Podmínkou adekvátního měření jsou stabilní podmínky během anestezie s důrazem na hodnoty krevního tlaku a hladiny CO2.
Image 2. Perivaskulární bajonetovitá mikrosonda. 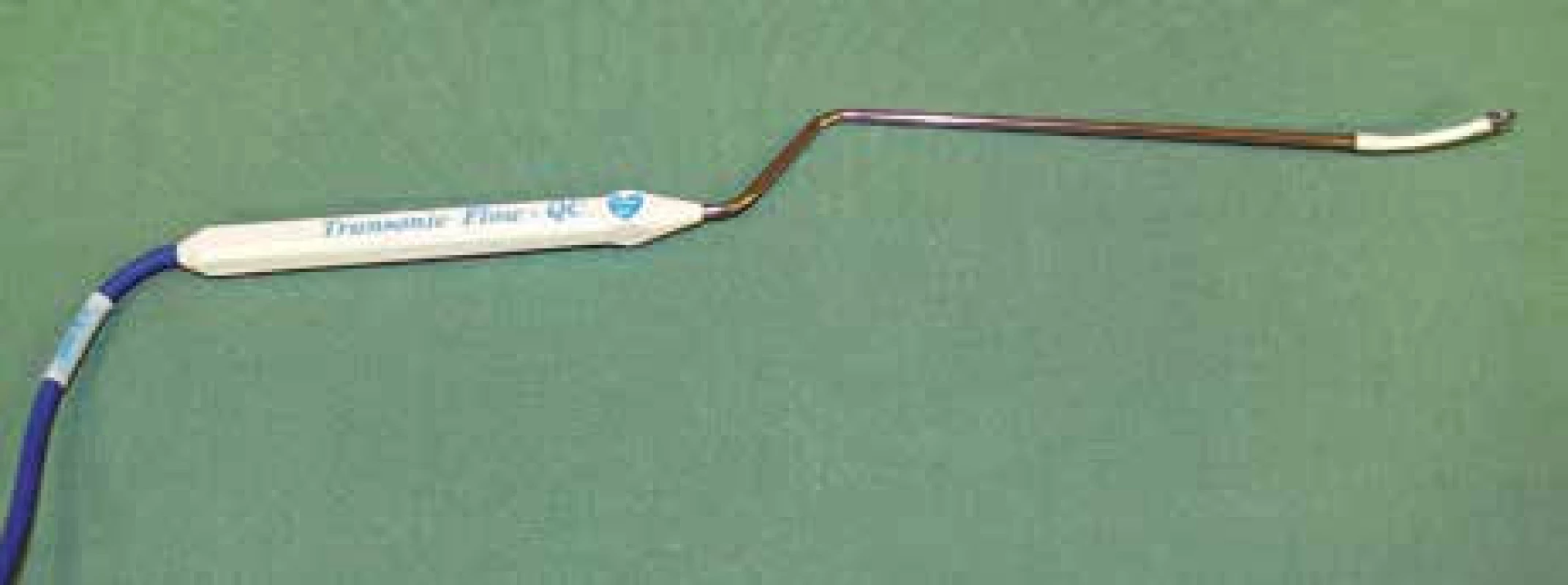
Image 3. Detail konce mikrosondy s tvarovatelným „krkem“ a koncovým okénkem, do kterého je při operaci vložena tepna. 
Image 4. Měření průtoku krve v temporální větvi M2 před zaklipováním aneuryzmatu. 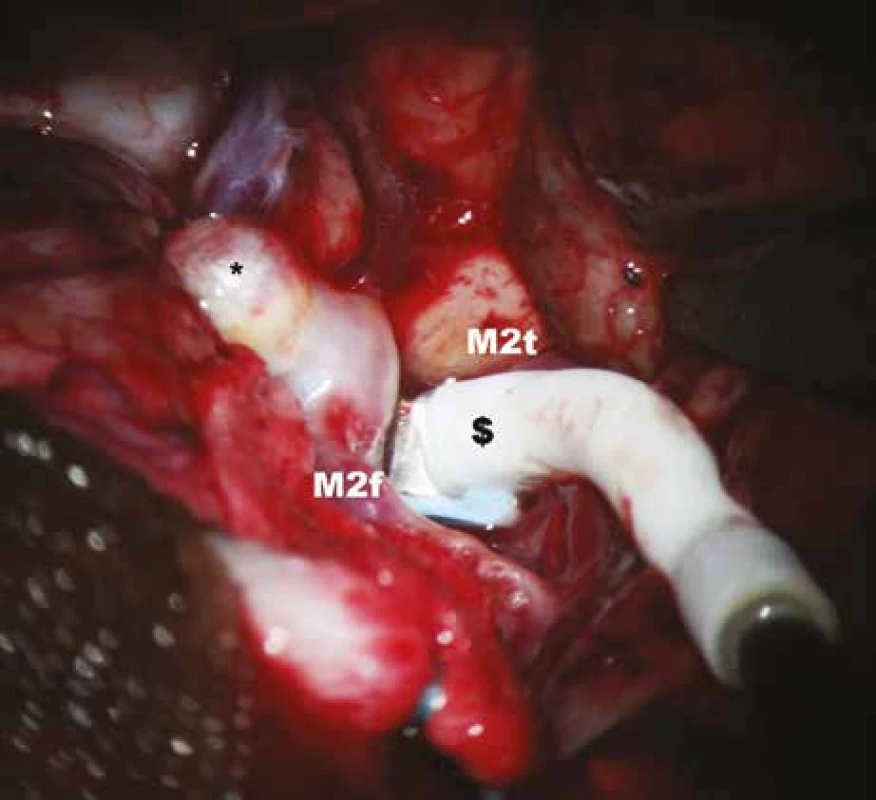
* – aneuryzma, $ – perivaskulární mikrosonda, M2f – frontální větev M2, M2t – temporální větev M2. Image 5. Měření průtoku krve v temporální větvi M2 po zaklipováním aneuryzmatu. 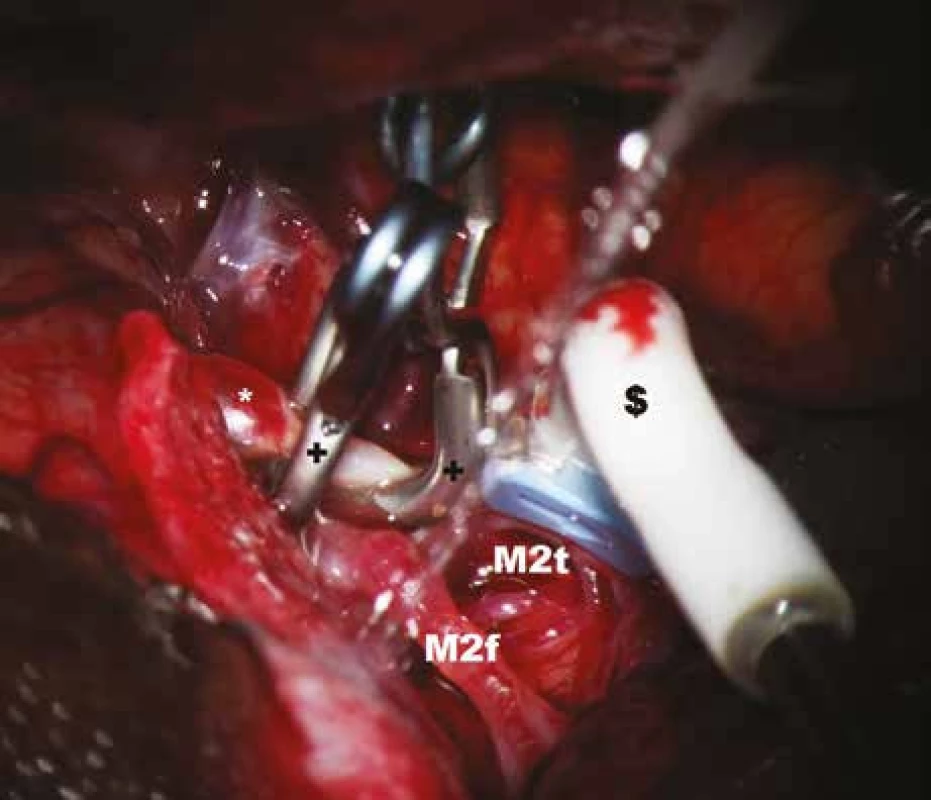
* – aneuryzma, $ – perivaskulární mikrosonda s tvarem krčku, přizpůsobeným průběhu tepny; M2f – frontální větev M2, M2t – temporální větev M2, + – aneuryzmatický klip. Image 6. Záznam krevního průtoku v a. temporalis anterior (ATA) před zaklipováním, zachycen průměrný, maximální, minimální průtok a pulzatilní index. 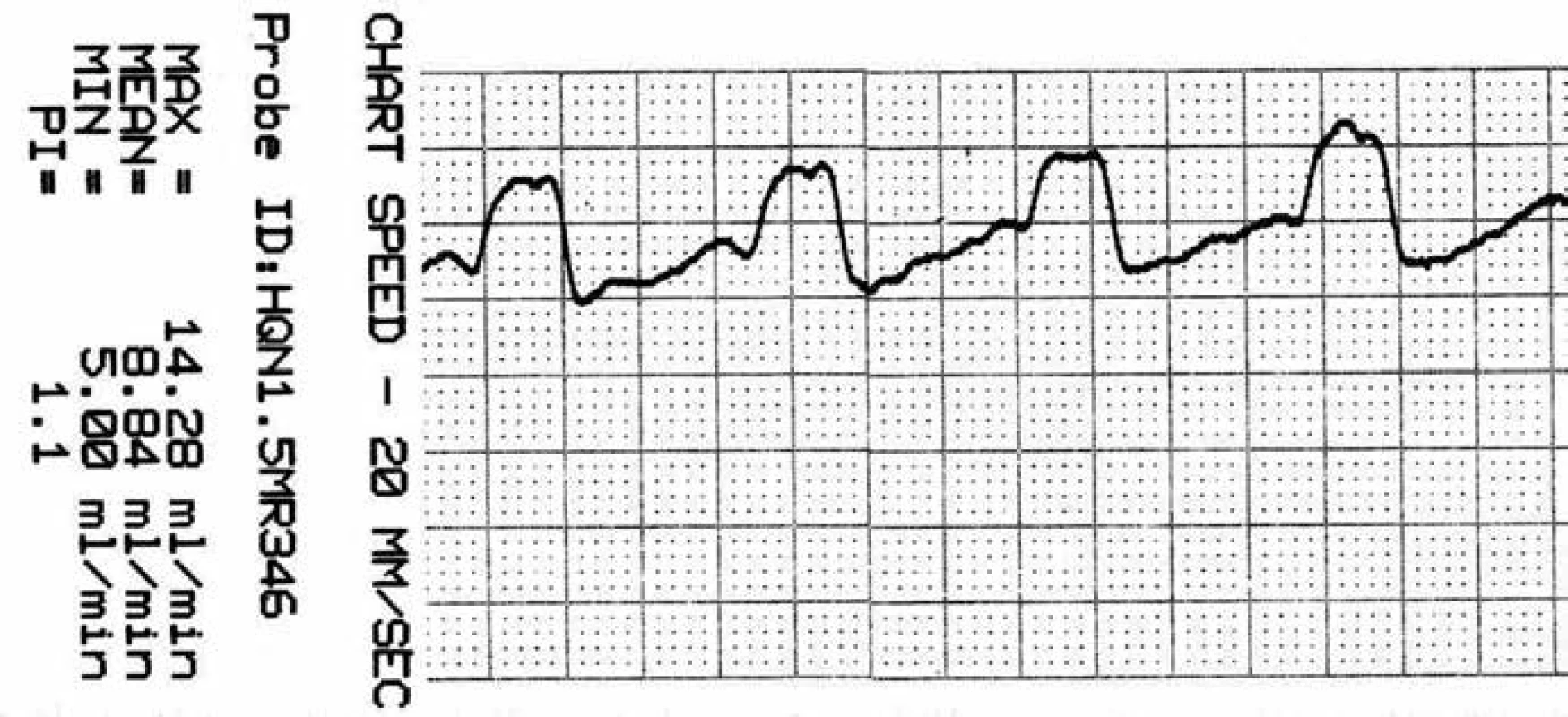
Image 7. Záznam krevního průtoku v ATA po zaklipování. 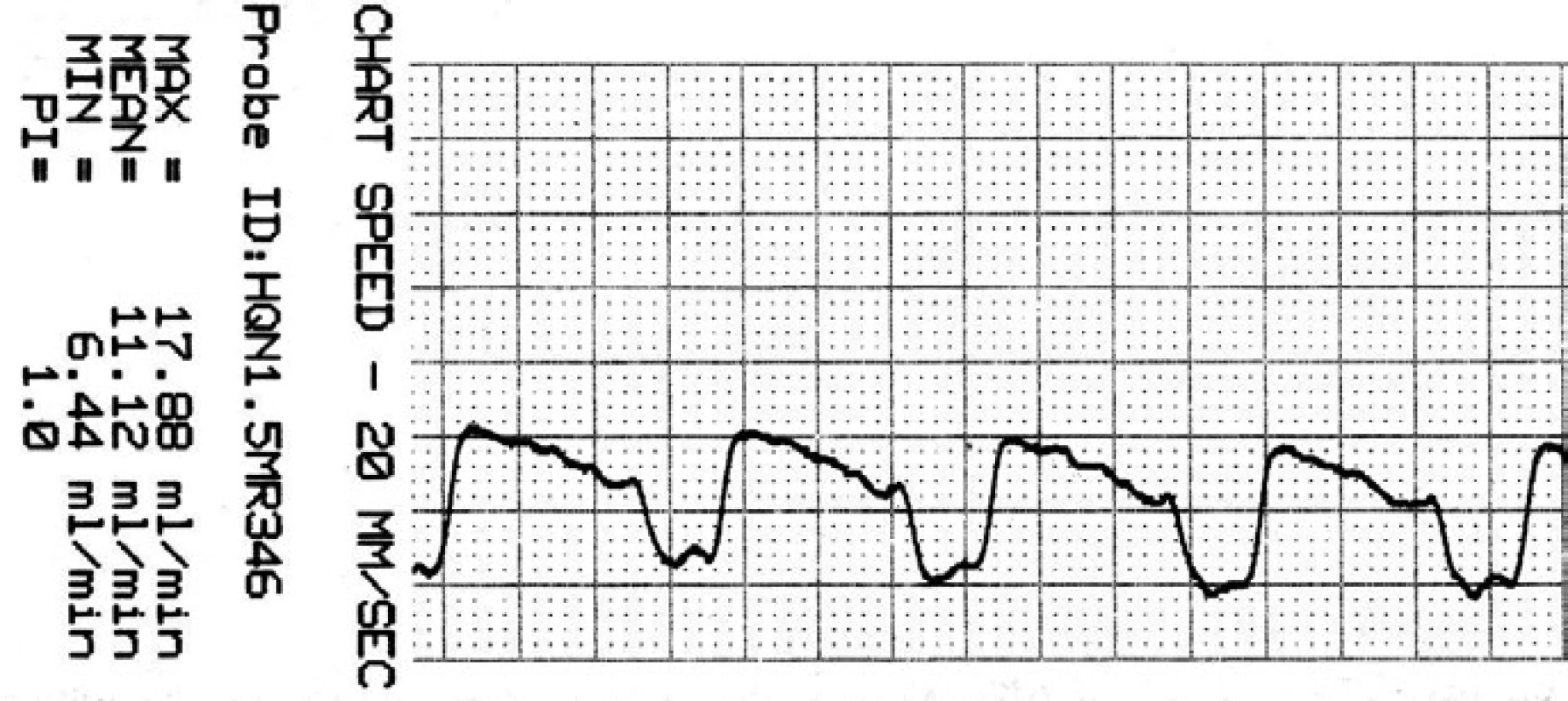
Je přítomna reaktivní hyperperfuze o 25 %. Soubor
V období od ledna 2011 do května 2013 bylo kvantitativní měření krevního průtoku magistrálních tepen při operacích mozkových aneuryzmat provedeno u 23 pacientů. Mužů bylo 12, žen 11. Průměrný věk činil 52,1 let (30–73). U čtyř pacientů bylo přítomno subarachnoidální krvácení (dvakrát Hunt-Hess I, dvakrát Hunt-Hess II) a u dvou pacientů šlo o incidentální aneuryzmata, která byla identifikována při krvácení výdutě z jiné lokalizace. Nejčastější lokalizací bylo aneuryzma střední mozkové tepny (MCA) – 16 pacientů, dále přední komunikující tepny – čtyři pacienti, zadní komunikující tepny – dva pacienti a arteria pericallosa – jeden pacient. U aneuryzmat MCA šlo ve většině případů o typickou lokalizaci bifurkace M1/2. Výjimkou bylo aneuryzma distální v oblasti frontální větve na úrovni M3. Podle velikosti vaku bylo malých aneuryzmat (do 7 mm) 10, středních (8–14 mm) devět; velká aneryzmata (15–24 mm) byla tři a gigantické (nad 25 mm) jedno. Indirektní měření bylo provedeno u pacientů s aneuryzmatem přední komunikující tepny v souladu s výše uvedenou metodikou: byl změřen průtok krve v dominantní prekomunikální přední mozkové tepně (A1) za současné dočasné okluze kontralaterální A1. Měření bylo provedeno před zaklipováním aneuryzmatu a po něm. V ostatních případech bylo provedeno měření direktní. Na počátku jsme u aneuryzmatu a. cerebri media (MCA) jednou monitorovali průtok krve v hlavním kmeni M1 před zaklipováním a po něm. U všech ostatních aneuryzmat MCA jsme měřili průtok krve v obou větvích M2 po odstupu z vaku. Částečné selhání TTFM monitoringu nastalo jednou: měření průtoku v temporální větvi M2 po zaklipování nebylo možné, resp. bylo spojeno s velkým rizikem cévního poranění. Příčinou byla poloha branží klipu, které mechanicky bránily v přístupu sondy k iniciálnímu segmentu temporální větve M2. ICG videoangiografie byla provedena celkem u 11 pacientů, jelikož zpočátku nebyla součástí protokolu. V současné době je její využití paušální.
Výsledky
Shrnutí výsledků je v tab. 1.
Ve čtyřech případech TTFM prokázala patologické hodnoty. Ve dvou případech pak vedla ke korekci chirurgického přístupu.
Případ 1
Pacient PN (50 let) s neprasklým aneuryzmatem MCA. Krevní průtok před zaklipováním byl na frontální větvi M2 (M2f) 22 ml/min s indexem pulzatility 0,7; na temporální větvi M2 (M2t) byl v této fázi průtok 7,1 ml/min s PI 0,7. Asymetrie průsvitu obou tepen korelovala s objemem průtoku jednotlivých větví, tj. průsvit temporální větve M2 byl zásadně menší.
Nálezy průtoku krve po zaklipování aneuryzmatu byly: M2f 22 ml/min (PI 0,6) M2t 1 ml/min. Hodnota v temporální větvi byla jasně patologická, došlo k poklesu průtoku o 86 % ve srovnání se stavem před zaklipováním. Korekce polohy klipu vedla k normalizaci průtoku krve v M2t na 7 ml/min.
Případ 2
Pacient KM (49 let) s neprasklým aneuryzmatem přední komunikující tepny s hypoplastickou levou A1. Indirektní měření průtoku v pravé A1 s dočasnou okluzí levé A1 prokázalo iniciální průtok krve 34 ml/min. Aneuryzma bylo vyřazeno dvěma klipy směřujícími kolmo na sebe, přičemž menší z nich uzavíral drobné reziduum v oblasti krčku vaku. Monitorování po zaklipování prokázalo průtok krve v pravé A1 16 ml/min (snížení o 47 %). Sejmutí miniklipu vedlo k normalizaci průtoku krve na 35 ml/min. Drobné reziduum vaku bylo obaleno vatičkou s cílem vytvoření jizvy coby prevence růstu a ruptury vaku (wrapping).
Případ 3
Pacientka FM (60 let) s neprasklým distálním aneuryzmatem MCA na frontální větvi M3. Iniciální průtok krve byl 8,8 ml/min (PI 0,7). Po zaklipování došlo k poklesu na 2,24 ml/min (snížení průtoku o 75 %). Přítomný vazospazmus na tepně a přesvědčení operatéra o správnosti polohy klipu vedly nikoliv k repozici, nýbrž k lokálnímu podání papaverinu. Během několika minut nastala normalizace toku krve na 10 ml/min (PI 0,5).
Případ 4
Pacientka MŠ (59 let) s dvěma neprasklými aneuryzmaty na a. pericallosa (první na A3 – typická lokalizace v odstupu a. callosomarginalis, druhé distálněji na rozhraní A4/5). Iniciální průtok na A3 byl 19,4 ml/min (PI 0,6), na A4 17,2ml/min (PI 0,9). Po zaklipování aneuryzmat byly toky na A3 18,1, avšak na A4 jen 1,2 ml/min (pokles od 92,5 %). Pro vazospazmus na tepně distálně od prvního klipu byl podán papaverin s normalizací toku na 22,1 ml/min (PI 0,9).
U žádného z našich pacientů jsme nezaznamenali po operaci klinicky ani graficky ischemii v povodí tepen, které byly předmětem zájmu. Ve dvou případech bylo při propuštění mírné postižení (MD, Moderate Disability) – organický psychosyndrom, ostatní pacienti byli dimitováni v dobrém stavu (GR, Good Recovery).
ICG videoangiografie ve dvou případech prokázala reziduální plnění vaku. Po doplnění klipů opakované vyšetření prokázalo vyřazení aneuryzmatu z cirkulace. Ve dvou případech naopak ICG selhala. Jednou po zaklipování nepronikal kontrast do vaku, ačkoliv následná aspirace vaku vedla ke krvácení a nutnosti přidání dalších čtyř klipů. Ve druhém případě ICG prokázala antegrádní plnění větve M2, nicméně průtok při měření TTFM poklesl do patologických hodnot.
Diskuze
Kvantitativnímu měření průtoku krve v magistrálních tepnách v oblasti aneuryzmatu se dlouhodobě věnuje chicagská skupina reprezentovaná F. Charbelem a S. Amin-Hanjani. Charbel et al zavedli využití perivaskulární mikrosondy na principu TTFM s možností měření průtoku krve u tepen o průsvitu 1 mm [16]. Amin-Hanjani et al prokázali, že snížení průtoku krve v tepnách po zaklipování o více než 25 % je spojeno s jasným rizikem ischemie. Pokles o 50 % pak přináší jistotu iktu [17]. K podobným závěrům došli i další autoři [18,19]. Pokles průtoku o 25 % koreluje se zúžením tepny o 80 % původního průsvitu [20]. V sestavě 106 aneuryzmat u 103 pacientů zaznamenali Amin-Hanjani et al redukci průtoku o ≥ 25 % u 31 případů (33,1 %). U 27 pacientů se průtok po repozici klipu normalizoval. U dvou pacientů vznikla trombóza tepny a u šesti případů nastal reverzibilní spazmus. Třikrát stačilo uvolnění excesivní retrakce mozku a došlo k restituci průtoku. Zjevnou výhodou TTFM je okamžitá identifikace a přesná lokalizace okluze/stenózy magistrální tepny s možností včasné nápravy. Nevýhoda TTFM spočívá v nutnosti preparace v oblasti výdutě a magistrálních tepen ve větším rozsahu pro potřeby měření. To je potenciálně spojeno s větším rizikem operace a přináší několikaminutovu časovou prodlevu během výkonu. Obecnou nevýhodou metody pak je nemožnost identifikovat reziduum vaku a dále nelze hodnotit průtok v tepnách pod 1 mm průsvitu, tedy perforátory [17]. Kombinací s dalšími metodami lze tento hendikep překonat.
Nakayama et al využili TTFM celkem u 25 pacientů. Většina z nich podstoupila EC-IC bypass, u čtyř bylo provedeno klipování aneuryzmat. V jednom případě byli autoři nuceni změnit polohu klipu pro snížení průtoku krve v odstupující větvi M2 [21].
Podobně Fagundes-Pereyra et al ocenili TTFM u velkého komplexního aneuryzmatu MCA [22]. Kirk et al využili TTFM při operacích aneuryzmat, AVM, durálních fistulí a EC-IC bypassů. Operace aneuryzmat byly provedeny v 21 případech. Repozici klipu byli autoři nuceni provést třikrát, tedy ve 14 % [23].
V našem souboru jsme zaznamenali patologické hodnoty TTFM u čtyř pacientů (17,4 %), přičemž chirurgicky reagovat jsme byli nuceni dvakrát (8,7 %).
V prvním případě u aneuryzmatu MCA došlo po zaklipování k poklesu průtoku krve v temporální větvi M2 o 86 %, což zásadně převýšilo „iktový práh“ udávaný na 50 %. ICG videoangiografie přitom prokázala antegrádní plnění této větve kontrastem. Při diskrepanci metod jsme respektovali kvantitativní nález TTFM a provedli repozici klipu. Nález dokumentuje spíše limit metody ICG než její selhání. Zároveň je příkladem nezastupitelné role TTFM.
U druhého pacienta se pak podařilo peroperačně identifikovat patologické hodnoty průtoku při indirektním monitoringu pravé A1. Podle literárních zkušeností by se nález projevil ischemií v oblasti přední mozkové tepny. Včasná operační korekce (sejmutí miniklipu) zabránila iktu.
V dvou případech došlo ke snížení průtoku krve po zaklipování na podkladě vazospazmu. S ohledem na příčinu stavu – vazospazmus – se lze domýšlet, že by nález neměl negativní klinické konsekvence. Je pravděpodobné, že by spazmus odezněl dříve, než by mohla nastat ischemie. Jedná se však pochopitelně o spekulaci. Lokální podání papaverinu vedlo k promptní normalizaci průtoku krevního, dokumentovanou TTFM.
Monitoring TTFM (nemožnost bezpečně měřit na odstupové tepně) selhala v našem souboru v jednom případě. Klipy nám zabránily bezpečně přiložit sondu na temporální větev M2. Spolehli jsme se proto na vizuální vjem v kombinaci s ICG videoangiografií.
V našem souboru převažují aneuryzmata incidentální, lokalizovaná dominantně na a. cerebri media. Pacienti operovaní akutně pro subarachnoidální krvácení jsou z poslední doby. Souvisí to s tím, že autoři získali zkušenost s vlastní technikou TTFM a průběžně mohli ocenit její přednosti. V současné době tedy opouštějí selektivní přístup a subarachnoidální krvácení nepovažují za institucionální „exclusion criteria“. Na druhou stranu využití TTFM právě u aneuryzmat MCA považujeme za kruciální. Vzhledem k složité anatomii v této oblasti je známo, že ischemické komplikace v důsledku stenózy/okluze odstupujících tepen jsou častější než jinde v přední cirkulaci Willisova okruhu [24]. TTFM je proto pro nás u aneuryzmat MCA conditio sine qua non.
Ve shodě s Morcosem se domníváme, že kvantitativní flowmetrie a ICG videoangiografie představuje optimální kombinaci metod k eliminaci peroperačních rizik chirurgie aneuryzmat [25]. V naší sestavě u dvou pacientů (8,7 %) ICG videoangiografie dokumentovala průnik kontrastu do vaku po zasvorkování. Další výhoda této metody je možnost zobrazení perforátorů a eventuálního rezidua vaku. Na druhou stranu TTFM má výhodu v schopnosti kvantifikace průtoku krve. Normální nález ICG na magistrálních tepnách ještě nevylučuje patologický pokles průtoku.
Dobré pooperační výsledky našeho souboru mají několik příčin. Za prvé se jedná o selektivní sestavu pacientů s převahou incidentálních aneuryzmat v dobrém předoperačním stavu. Čtyři pacienti se subarachnoidálním krvácením byli také v dobrém stavu před výkonem (vždy Hunt-Hess I nebo II). Jsme nicméně přesvědčeni, že na dobrých výsledcích má spolupodíl monitoring TTFM. Nejméně ve dvou případech přispěla metoda k zabránění vzniku pooperační ischemie v povodí magistrálních tepen.
Závěr
TTFM představuje velmi užitečnou metodu, která přispívá ke zvýšení perioperační bezpečnosti chirurgie mozkových aneuryzmat.
Úloha TTFM při detekci stenózy/okluze magistrálních tepen je nezastupitelná.
Neschopnost TTFM detekovat reziduální vtok krve do vaku a patentnost perforátorů vyžaduje kombinaci s dalšími metodami.
Autoři doporučují na základě vlastních zkušeností kombinaci TTFM a ICG videoangiografie v prevenci peroperačních komplikací chirurgie mozkových aneuryzmat.
Podpořeno MZ ČR-RVO (Fakultní nemocnice Plzeň – PNPl, 00669806).
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
Přijato k recenzi: 30. 7. 2013
Přijato do tisku: 15. 10. 2013
MUDr. Vladimír Přibáň, Ph.D
Neurochirurgické oddělení
LF UK a FN
Alej Svobody 80
304 60 Plzeň
e-mail: v.priban@centrum.cz
Sources
1. Lehecka M, Laakso A, Hernesniemi J. Helsinki Microneurosurgery Basics and Tricks. Helsinki: Druckerei Hohl 2011.
2. Alexander TD, MacDonald RL, Weir B, Kowalczuk A. Intraoperative Angiography in cerebral aneurysms surgery: a prospective study of 100 craniotomies. Neurosurgery 1996; 39(1): 10–18.
3. Drake CG, Allcock JM. Postoperative angiography and the “slipped” clip. J Neurosurg 1973; 39(6): 683–689.
4. Macdonald RL, Wallace MC, Kestle JR. Role of angiography following aneurysm surgery. J Neurosurg 1993; 79(6): 826–832.
5. Rauzinno MJ, Quinn CM, Fischer W jr. Angiography after aneurysm surgery: indications for selective angiography. Surg Neurol 1998; 49(1): 32–41.
6. Bailes JE, Tantuwaya LS, Fukushima T, Schurman GW, Davis D. Intraoperative microvascular Doppler sonography in aneurysm surgery. Neurosurgery 1997; 40(5): 965–972.
7. Neuloh G, Schramm J. Monitoring of motor evoked potentials compared with somatosensory evoked potentials and microvascular Doppler ultrasonography in cerebral aneurysm surgery. J Neurosurg 2004; 100(3): 389–399.
8. Raabe A, Nakaji P, Beck J, Kim LJ, Hsu FP, Kamerman JD et al. Prospective evaluation of surgical microscope-integrated intraoperative near-infrared indocyanine green videoangiography during aneurysm surgery. J Neurosurg 2005; 103(6): 982–989.
9. Martin NA, Bentson J, Vinuela F, Hieshima G, Reicher M, Black K et al. Intraoperative digital subtraction angiography and the surgical treatment of intracranial aneurysms and vascular malformations. J Neurosurg 1990; 73(4): 526–533.
10. Dreyden CP, Moran CJ, Cross DT jr, Sherburn EW, Dacey RG jr. Intracranial anerysms: anatomic factors that predict the usefulness of intraoperative angiography. Radiology 1997; 205(2): 335–339.
11. Origitano TC, Schwartz K, Anderson D, Azar-Kia B, Reichman OH. Optimal clip application and intraoperative angiography for intracranial aneurysms. Surg Neurol 1999; 51(2): 117–128.
12. Katz M, Gologorsky BA, Tsiouris IJ, Wells-Roth D, Mascitelli J, Gobin YP et al. Is routine intraoperative angiography in the surgical treatment of cerebral aneurysms justified? A consecutive series of 147 aneurysms. Neurosurgery 2006; 58(4): 719–727.
13. Amin-Hanjani S, Charbel FT. Flow-assisted surgical technique in cerebrovascular surgery. Surg Neurol 2007; 68 (Suppl 1): S4–S11.
14. Drost CJ. Vessel diameter-independent volume flow measurements using ultrasound. Proc San Diego Biomed Symp 1978; 17 : 299–302.
15. Lundell A, Bergqvist D, Mattsson E, Nilsson B. Volume blood flow measurements with transit time flowmeter: an in vivo and in vitro variability and validation study. Clin Physiol 1993; 13(5): 547–557.
16. Charbel FT, Hoffman WE, Mishra M, Hannigan K, Ausman JI. Role of perivascular ultrasonic micro-flow probe in aneurysm surgery. Neurol Med Chir (Tokyo) 1998; 38 (Suppl): 35–38.
17. Amin-Hanjani S, Meglio G, Gatto R, Bauer A, Charbel FT. The utility of intraoperative blood flow measurement during aneurysm surgery using an ultrasonic perivascular probe. Neurosurgery 2008; 62 (6 Suppl 3): 1346–1353.
18. Eckert B, Thie A, Carvajal M, Groden C, Zeumer H. Predicting hemodynamic ischemia by transcranial Doppler monitoring during therapeutic balloon occlusion test of internal carotid artery. AJNR Am J Neuroradiol 1998; 19(3): 577–582.
19. Jawad K, Miller D, Wyper DJ, Rowan JO. Measurement of CBF and carotid artery pressure compared with cerebral angiography in assessing blood supply after carotid ligation. J Neurosurg 1977; 46(2): 185–196.
20. Spencer MP, Reid JM. Quantitation of carotid stenosis with continuous-wave (C-W) Doppler ultrasound. Stroke 1979; 10(3): 326–330.
21. Nakayama N, Kuroda S, Houkin K, Takikawa S, Abe H. Intraoperative measurement of arterial blood flow using a transit time flowmeter: monitoring of hemodynamic changes during cerebrovascular surgery. Acta Neurochir 2001; 143(1): 17–24.
22. Fagundes-Pereyrea WJ, Hoffman WE, Mishra M, Charbel FT. Clip readjustment in aneurysm surgery after flow evaluation using the ultrasonic perivascular probe. Arq Neuropsiquiatr 2005; 63(2A): 339–344.
23. Kirk HJ, Rao PJ, Seow K, Fuller J, Chandran N, Khurana VG. Intra-operative transit time flowmetry reduces the risk of ischemic neurological deficits in neurosurgery. Br J Neurosurg 2009; 23(1): 40–47.
24. Rinne J, Hernesniemi J, Niskanen M, Vapalahti M. Analysis of 561 patients with 690 middle cerebral artery aneurysms: anatomic and clinical features as correlated to management outcome. Neurosurgery 1995; 8(1): 2–11.
25. Morcos, JJ. Editorial: Indocyanine green videoangiography or intraoperative angiography? J Neurosurg 2013; 118(2): 417–419.
Labels
Paediatric neurology Neurosurgery Neurology
Article was published inCzech and Slovak Neurology and Neurosurgery

2014 Issue 1-
All articles in this issue
- Chirurgická léčba hydrocefalu
- Možnosti pohybových aktivit u pacientů s roztroušenou sklerózou mozkomíšní
- Upozornění na klasifikační, terminologické a obsahové inovace Mezinárodní klasifikace bolestí hlavy (ICHD-3 beta) pro primární bolesti hlavy
- Je dlouhodobá disabilita u roztroušené sklerózy spojena s difuzní mozkovou patologií nezávislou na relapsech?
- Predikce pooperačního stavu u spondylogenní cervikální myelopatie
- Validita Montrealského kognitivního testu pro detekci mírné kognitivní poruchy u Parkinsonovy nemoci
- Hodnocení kvality klinických doporučených postupů České neurologické společnosti ČLS JEP
- Kvantitativní měření krevního průtoku magistrálních tepen při operacích mozkových aneuryzmat
- Mezinárodní standardy pro neurologickou klasifikaci míšního poranění – revize 2013
- Intraspinální juxtaartikulární cysty bederní páteře
- Mikrochirurgická léčba symptomatických pineálních cyst
- Česká verze Autonomic Scale for Outcomes in Parkinson’s Disease (SCOPA-AUT) – dotazníku k hodnocení přítomnosti a závažnosti příznaků autonomních dysfunkcí u pacientů s Parkinsonovou nemocí
- Význam elektromyografie v chirurgické rekonstrukci spasticity horní končetiny
- Parézy hlavových nervů a nekrotizující zánět zevního zvukovodu – dvě kazuistiky
- Úleva od neuropatické bolesti pomocí odvracení pozornosti – kazustika
- Lokální trombolýza u závažné formy trombózy mozkových žil a splavů – dvě kazuistiky
- Stiff‑ person syndrom sdružený s myotonickou dystrofií 2. typu – kazuistika
- Výsledky programu hluboké mozkové stimulace v Olomouci
- Nedostatečná antikoagulační terapie v primární prevenci kardioembolických cévních mozkových příhod – výsledky deskriptivní prevalenční studie
- Czech and Slovak Neurology and Neurosurgery
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Mikrochirurgická léčba symptomatických pineálních cyst
- Chirurgická léčba hydrocefalu
- Stiff‑ person syndrom sdružený s myotonickou dystrofií 2. typu – kazuistika
- Mezinárodní standardy pro neurologickou klasifikaci míšního poranění – revize 2013
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career