-
Medical journals
- Career
Gastrointestinální stromální tumory rekta – hodnocení dat národního registru s ohledem na využití v klinické praxi
Authors: R. Svatoň 1; Z. Kala 1; P. Kysela 1; V. Procházka 1; M. Eid 2; T. Andrašina 3; K. Poredská 4; J. Strenková 5; R. Chloupková 5; L. Kunovsky 1,4
Published in: Klin Onkol 2019; 32(2): 117-123
Category: Original Articles
Overview
Východiska:
Gastrointestinální stromální tumory (GIST) jsou vzácné maligní mezenchymální tumory s incidencí 1/100 000 obyvatel. Představují pouze 5 % gastrointestinálních nádorů. Nejčastěji je nalézáme v žaludku (60–70 %). Do rekta je jich situovaných < 5 %. V případě lokalizovaných, resekabilních tumorů je základem léčby chirurgická resekce. V závislosti na velikosti a lokalizaci tumoru v rektu volíme mezi lokální excizí, resekcí rekta s anastomózou nebo abdominoperitoneální amputací s trvalou stomií. Na rozdíl od karcinomů je metastazování GIST do lymfatických uzlin vzácné, a proto není z onkologického hlediska lymfadenektomie v podobě mezorektální excize vyžadována. Neoadjuvantní léčba s využitím inhibitorů tyrozinkináz (tyrosine kinase inhibitors – TKI) je doporučovaná např. u tumorů větších 5 cm, v případě prorůstaní do okolních orgánů nebo při infiltraci sfinkterů za účelem dosažení resekability a méně mutilujícího či kontinentního zákroku. V případě pozitivní resekční linie se můžeme pokusit o reresekci. Při CD117 pozitivitě lze zvážit adjuvantní léčbu TKI, kterou nasazujeme také po resekcích GIST středního a vysokého rizika maligního chování. U neresekabilních a metastazujících GIST je taktéž indikovaná léčba TKI.
Materiál a metody:
Analýza dat získaných z registru GIST k 1. 1. 2017, kdy do registru přispívalo 10 center z ČR.
Výsledky:
Z analyzovaných 1 095 pacientů byla primární lokalizace GIST v rektu ve 45 případech (4,1 %). Průměrný věk pacientů byl 60 let. V souboru bylo signifikantně více mužů (68,9 %; p = 0,0007) a symptomatických pacientů (62,2 %; p = 0,034). Operaci podstoupilo 82 % pacientů. Z toho lokální excize byla provedena ve 37,8 %, resekce rekta s anastomózou ve 29,7 % a abdominoperineální amputace ve 29,7 %. V souboru bylo nejvíce tumorů velikosti 2–5 cm a necelá polovina vykazovala vysoké riziko maligního chování. Záznam o podání systémové léčby byl u 73 % pacientů. Kompletní remise byla dosažena u 80 % pacientů s GIST rekta. Medián přežití byl 11,3 roku a 5leté přežití je 90,6 %.
Závěr:
Navzdory úspěchům léčby TKI zůstává jedinou potenciálně kurativní metodou u GIST rekta chirurgická R0 resekce. Nejen vzhledem k nízké frekvenci výskytu těchto nádorů je správná diagnostika a léčba náročná. Proto by měli být pacienti s touto problematikou soustředěni do specializovaných center.
Klíčová slova:
gastrointestinální stromální tumor (GIST) – rektum – terapie – resekce
Úvod
Gastrointestinální stromální tumory (GIST) jsou poměrně vzácné nádory řadící se do početné rodiny mezenchymálních nádorů, s incidencí 0,31–1,45 na 100 000 obyvatel [1]. Skutečný výskyt GIST je ale pravděpodobně daleko vyšší. Například analýza resekátů žaludku odebraných pro diagnózu karcinomu prokázala přítomnost mikroskopických GIST až ve 35 % [2]. GIST tvoří asi 2–5 % nádorů gastrointestinálního traktu. Mohou se objevit kdekoliv v průběhu gastrointestinálního traktu (žaludek 60–70 %, tenké střevo 20–25 %, konečník 5 %, jícen 5 %, tlusté střevo 2 %), ale i mimo trávicí trakt [3].
Prekurzorem těchto tumorů je progenitorní kmenová buňka diferencující se směrem ke Cajalovým intersticiálním buňkám, buňkám regulujícím střevní peristaltiku [4].
Jedná se o maligní nádory. Míra rizika maligního chování souvisí s lokalizací, velikostí a mitotickým indexem (MI) – počet mitóz na ploše 5 mm2 [2]. Pětileté přežití pacientů s GIST je ve všech rizikových skupinách 78,3 %, u velmi vysokého rizika poté 71,9 %, u pacientů s nízkým a velmi nízkým rizikem 91,9 % [5].
Obecně lze konstatovat, že GIST rekta vykazují při dané velikosti a MI horší prognózu než GIST daných parametrů v žaludku [6]. Základem úspěšné léčby je multidisciplinární přístup. V rámci obecného terapeutického algoritmu lze GIST rozdělit do čtyř skupin (schéma 1). V případě metastatického, inoperabilního a neresekabilního tumoru je indikovaná léčba inhibitory tyrozinkináz (tyrosine kinase inhibitors – TKI) (s výjimkou průkazu GIST s PDGFRA D842V mutací, které jsou rezistentní k terapii imatinibem). V případě resekabilního tumoru je poté základem léčby chirurgické odstranění – chirurgická R0 resekce.
Schéma 1. Terapeutický algoritmus pro GIST. 
GIST – gastrointestinální stromální tumory, TKI – tyrozinkinázové inhibitory Metodika
K analýze byla využita data z registru GIST spravovaného Institutem biostatistiky a analýz LF MU Brno. Jedná se klinický registr monitorující epidemiologii, léčbu a její výsledky u pacientů s GIST v ČR a SR. Základním kritériem pro zahrnutí pacienta do registru je potvrzená diagnóza GIST. Do registru byli retrospektivně zařazeni pacienti diagnostikovaní od 1. 1. 2000 do spuštění registru 27. 10. 2006 a prospektivně pacienti, kteří byli diagnostikovaní od spuštění registru. Údaje jsou do registru zadávány prostřednictvím online aplikace. Základ databázového systému je založen na modifikované verzi systému TrialDB. Data jsou plně anonymizována, což znemožňuje jakoukoli přímou či nepřímou identifikaci subjektů hodnocení [7,8].
Konkrétně byla vyhodnocována data k 1. 1. 2017 z 10 center z ČR – Fakultní nemocnice v Motole, Masarykův onkologický ústav v Brně, Fakultní nemocnice Hradec Králové, Všeobecná fakultní nemocnice Praha, Fakultní nemocnice Brno, Fakultní nemocnice Olomouc, Nemocnice České Budějovice, Fakultní nemocnice Plzeň, Nemocnice Nový Jičín, Nemocnice Na Homolce.
Z celkového počtu 1 172 pacientů s diagnózou GIST bylo následně analyzováno 1 095 pacientů, u kterých byly údaje v registru kompletní a pravidelně aktualizované. Primární lokalizace v rektu byla stanovena u 45 pacientů.
Výsledky
Ze souboru 1 095 pacientů s diagnózou GIST byl u 45 pacientů GIST lokalizován v rektu (4,1 %) (graf 1). V souboru bylo 14 žen (31,1 %) a 31 mužů (68,9 %; p = 0,0007). Průměrný věk pacientů byl 61 let, (medián 60; 5–95 percentil; 42–80 let) (graf 2).
Graph 1. Lokalizace gastrointestinálního stromálního tumoru. 
Symptomatických bylo 28 pacientů (62,2 %; p = 0,034). Celkem 50 % pacientů uvádělo bolesti břicha, 46,4 % krvácení z konečníku a u 14,3 % byla zaznamenána anémie.
Operaci podstoupilo 37 (82,2 %) pacientů. Lokální excize byla provedena u 14 (37,8 %) pacientů, resekce rekta s anastomózou u 12 (32,4 %) pacientů a abdominoperineální amputace u 11 (29,7 %) pacientů. Celkem 8 pacientů operaci nepodstoupilo, a to v 7 (15,5 %) případech pro pokročilost onemocnění a u 1 pacienta byly důvodem inoperability závažné komorbidity.
Nejvíce tumorů mělo rozměr v intervalu 2–5 cm (graf 3). Nejčastěji šlo o tumory s vysokým rizikem maligního potenciálu (46,7 %) (graf 4).
Graph 3. Velikost primárního nádoru. 
Graph 4. Riziko maligního potenciálu. 
Záznam o podání systémové léčby byl u 33 (73,3 %) pacientů. Konkrétně šlo o imatinib 32× (78 %), sunitinib 5× (12,2 %), nilotinib 2× (4,9 %) a regorafenib 2× (4,9 %).
Kompletní remise byla dosažena u 80 % pacientů s GIST rekta. Z toho u 11 pacientů došlo k 15 relapsům (8 pacientů 1× relaps, 2 pacienti 2× relaps, 1 pacient 4× relaps). V rámci relapsů jich bylo 7 lokálních, 5 vzdálených a 3 kombinované. Medián přežití pacientů byl 11,3 roku a 5leté přežití je 90,6 % (graf 5).
Graph 5. Přežití. 
Přežití pacientů bylo hodnoceno metodikou dle Kaplana-Meiera. Diskuze
Dle literárních údajů je do rekta situovaných < 5 % GIST [3]. V souboru pacientů z registru GIST to bylo 4,1 %. Nejčastěji jsou tyto tumory diagnostikovány kolem 60. roku života a ve dvou třetinách u mužů. Toto potvrzují také data z analyzovaného souboru, v němž bylo signifikantně více mužů (31 vs. 14; p = 0,0007). Klinické projevy korelují s velikostí a lokalizací těchto nádorů. Mohou být akutní (krvácení, obstrukce či perforace) nebo chronické. Asi v pětině případů jde o incidentální nález [5]. V souboru pacientů zařazených do registru GIST bylo symptomatických 68 % pacientů a hlavním projevem byly bolesti břicha (50 %) a krvácení z konečníku (46,4 %).
Prognóza GIST souvisí s velikostí, lokalizací a MI. Jak dokumentuje stratifikační tabulka Miettinena et al (tab. 1), při dané velikosti a MI mají GIST rekta 4–6× horší prognózu než GIST daných parametrů v žaludku [6].
Table 1. Prognóza gastrointestinálních stromálních tumorů dle velikosti, lokalizace a mitotického indexu (upraveno dle Miettinena et al [6]). ![Prognóza gastrointestinálních stromálních tumorů dle velikosti, lokalizace a mitotického indexu (upraveno dle Miettinena
et al [6]).](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image_pdf/b3d2a493f2641ab75285e3cd395e3cfd.jpeg)
* insufi cientní data Dle hodnocení dat z registru GIST spadaly GIST rekta velikostně nejčastěji do intervalu 2–5 cm (37,8 %). Téměř polovina GIST rekta měla vysoké riziko agresivního chování.
Základem diagnostiky GIST rekta je vyšetření per rectum, endoskopické vyšetření doplněné o endoskopickou ultrasonografii a vyšetření magnetickou rezonancí (magnetic resonance imaging – MRI). GIST vidíme jako solidní, dobře ohraničenou masu oválného tvaru rostoucí převážně submukózně (obr. 1, 2).
Image 1. CT vyšetření – gastrointestinální stromální tumor rekta. 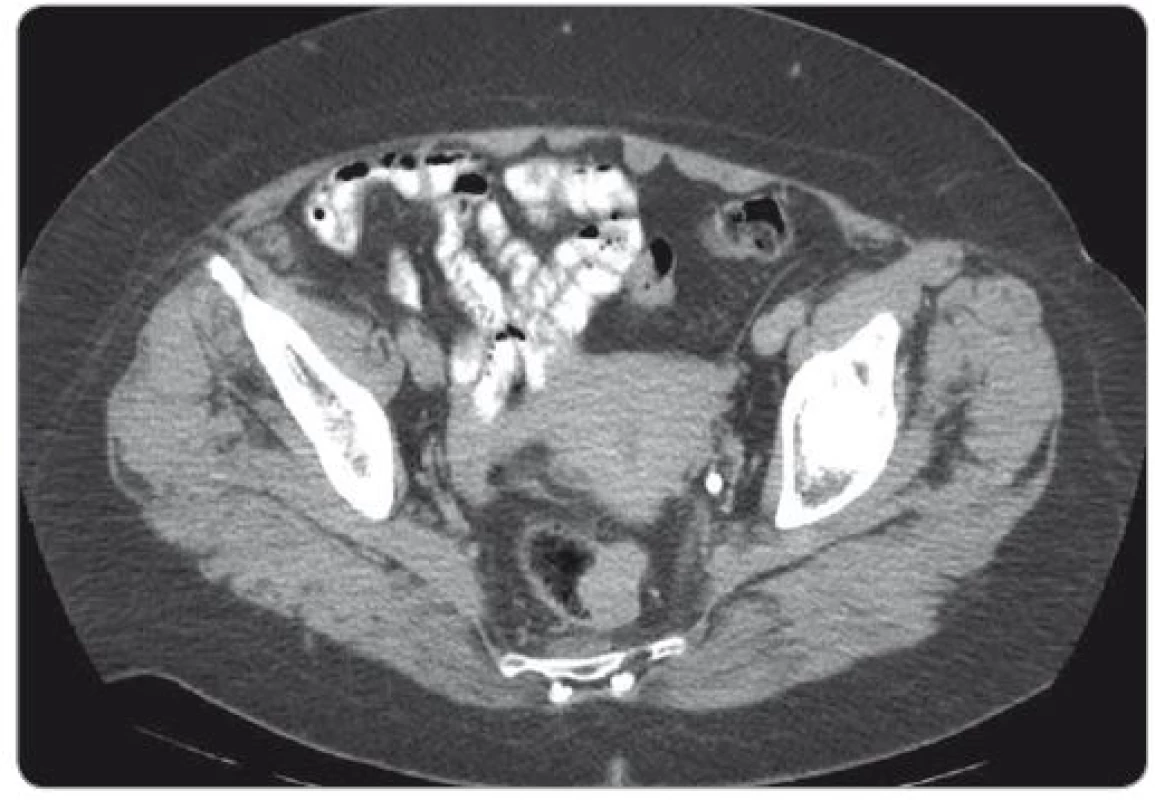
Image 2. MRI vyšetření – gastrointestinální stromální tumor rekta 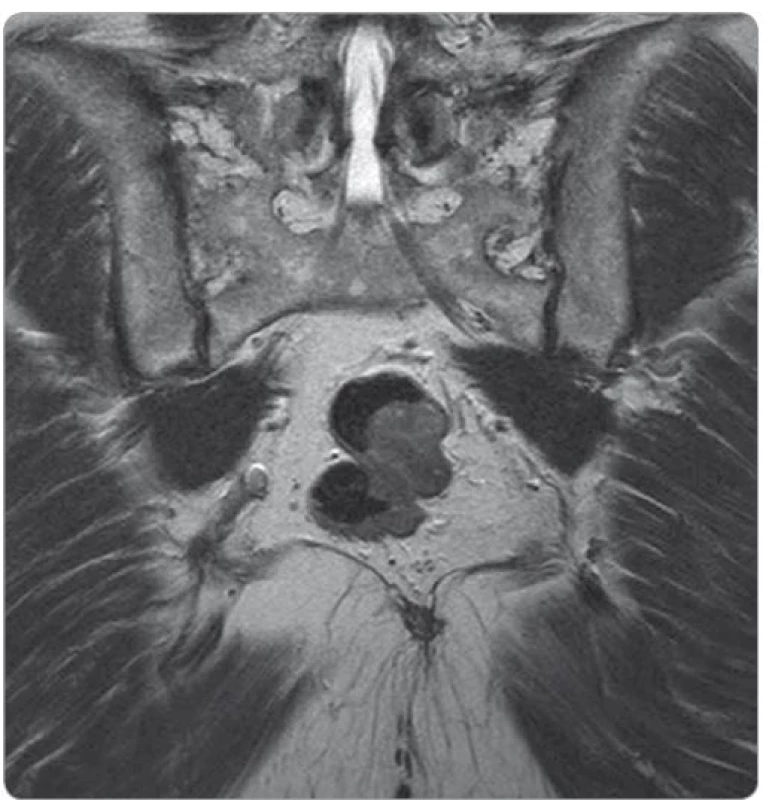
Pozitronová emisní tomografie s využitím fluorodeoxyglukózy dokáže oddiferencovat aktivní tumor od nekrózy nebo inaktivní jizevnaté tkáně, což je užitečné zejména k hodnocení odpovědi na terapii TKI [9].
U GIST rekta je vyžadovaná bioptická verifikace. K potvrzení diagnózy GIST je užíván průkaz exprese receptorové tyrozinkinázy CD117 (KIT) [10]. Negativita tohoto proteinu však tuto diagnózu nevylučuje a je až 5 % [11]. Genetické vyšetření prokazuje u GIST mutace v genech KIT a PDGFRA. Mutační analýza má prognostický význam ve vztahu k odpovědi těchto nádorů na léčbu TKI (např. GIST s mutací PDGFRA D842V je rezistentní na imatinib) [12].
Dosažení optimálních terapeutických výsledků u pacientů s GIST vyžaduje individualizovaný a často multimodální přístup. Léčebná strategie by měla být stanovena na základě konsenzu multioborového týmu, ideálně v centrech zabývajících se touto problematikou.
V případě lokalizovaných, resekabilních tumorů je základem léčby chirurgická resekce. V závislosti na velikosti a lokalizaci tumoru v rektu volíme mezi lokální excizí, resekcí rekta s anastomózou nebo abdominoperineální amputací s trvalou stomií [13]. U resekcí rekta je trendem volit přístup miniinvazivní, tedy laparoskopický, robotický nebo transanální (transanal total mesorectal excision – TaTME). Ne vždy je ale tento přístup pro rozsah a uložení tumoru možný a je nutno přistoupit k operaci klasickým laparotomickým přístupem.
Lokální excize je doporučovaná pouze u menších tumorů do 5 cm. V tomto případě volíme nejčastěji transanální přístup. Používáme při tom speciální instrumentárium a metody jako transanální endoskopická mikrochirurgie (TEM) nebo transanální endoskopická operace (TEO) využívající tzv. operační rektoskop. Další použitelnou metodou je technika transanální minimálně invazivní chirurgie (TAMIS), tedy lokální excize prováděná pomocí laparoskopického instrumentária přes speciální transanálně zavedený port [14–16].
V hodnocené sestavě pacientů podstoupilo operaci 82,2 % pacientů. Nejčastější lokální excize byla provedena v 37,8 %, resekce rekta s anastomózou v 32,4 % a abdominoperineálních amputací s trvalou stomií, tzv. Milesových operací bylo 29,7 %.
Vzhledem k tomu, že GIST patří mezi křehké nádory, je u nich obzvláště příhodná „no touch“ technika operování. Případná ruptura nebo krvácení z nádoru je i při R0 resekci spojená s horší prognózou a s přihlédnutím k molekulárním charakteristikám je zvažována adjuvantní terapie TKI [17].
Metastazování GIST do lymfatických uzlin je vzácné, proto pokud nejsou uzliny makroskopicky postiženy, lymfadenektomii standardně neprovádíme. S tím souvisí také potřeba provádění mezorektálních excizí u rektálních resekcí. V případě GIST rekta, na rozdíl od karcinomů, není z onkologického hlediska mezorektální excize vyžadovaná, přesto je ale doporučovaná. Důvodem je snadnější kontrola a šetření presakrálních nervových pletení, redukce krvácení, jakož i vyšší garance lokoregionální radikality [18].
V individuálních případech, po vzájemném konsenzu multioborového týmu, je možné také nasazení TKI v rámci neoadjuvantní léčby. Například u tumorů > 5 cm, v případě prorůstaní do okolních orgánů nebo při infiltraci sfinkterů za účelem dosažení resekability a méně mutilujícího či kontinentního zákroku [13,19]. Výkon poté provádíme v době maximální odpovědi na TKI po 4–12 měsících léčby. Zatím nejsou dostupná dostatečná data, kolik dnů před operací zastavit podávání TKI, jako bezpečné se ale ukazuje i jen několik dnů [20,21].
V případě pozitivní resekční linie se můžeme pokusit o reresekci, resp. je indikovaná adjuvantní léčba TKI, kterou je doporučované nasadit také po resekcích GIST středního a vysokého rizika maligního chování. U metastatických a neresekabilních GIST rekta je metodou první volby léčba TKI [22]. Význam má poté také provedení metastazektomie nebo některé z ablačních metod [23].
V analyzovaném souboru byla systémová léčba podána u 73 % pacientů. Multimodálním a centralizovaným přístupem bylo dosaženo kompletní remise u 80 % pacientů s 5letým přežitím 90,6 %, což je délka odpovídající horní hranici délky přežívání v recentních zahraničních souborech pacientů s GIST rekta (64,6–91 %) [24–27].
Pacienty po resekci GIST s vysokým rizikem sledujeme v průběhu adjuvantní terapie abdominálním CT/MRI a rektoskopií každých 3–6 měsíců po dobu 3 let (tedy po dobu adjuvance). V následujících 5 letech je doporučováno kontrolní CT/MRI a rektoskopie po 6 měsících a poté 1× ročně v průběhu dalších 5 let. U pacientů po resekci GIST s nízkým rizikem je poté vhodné provedení CT/MRI a rektoskopie každých 6–12 měsíců po dobu 5 let [22].
Závěr
GIST rekta je vzácný nádor s maligním potenciálem. Riziko jeho maligního chování souvisí s velikostí a MI. Obecně jsou GIST rekta považované za rizikovější než GIST v oblasti žaludku nebo duodena. V případě lokalizovaných, resekabilních tumorů je základem léčby chirurgická R0 resekce. Vzhledem k vzácnému metastazování do lymfatických uzlin je možno „onkologicky bezpečně“ provádět také lokální excize. Ruptura tumoru je i při R0 resekci spojená s horší prognózou. Při podezření na GIST je vhodné směrovat pacienty do center zabývajících se touto problematikou. Toto tvrzení podporuje i analýza dat národního registru GIST, do kterého přispívají svými daty centra pro léčbu GIST a je zde dosahováno přežívání na horní hranici délky přežití ve srovnání se zahraničními soubory.
Tato práce byla podpořena grantem MZ ČR – RVO (FNBr, 65269705).
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
MUDr. Lumír Kunovský, Ph.D.
Chirurgická klinika LF MU a FN Brno
Jihlavská 20 625 00 Brno
e-mail: kunovsky.lumir@fnbrno.cz
Obdrženo: 19. 12. 2018
Přijato: 2. 2. 2019
Sources
1. Brabec P, Šufliarsky J, Linke Z et al. A whole population study of gastrointestinal stromal tumors in the Czech Republic and Slovakia. Neoplasma 2009; 56 (5): 459–464.
2. Kawanowa K, Sakuma Y, Sakurai S et al. High incidence of microscopic gastrointestinal stromal tumors in the stomach. Hum Pathol 2006; 37 (12): 1527–1535. doi: 10.1016/j.humpath.2006.07.002.
3. Miettinen M, Lasota J. Gastrointestinal stromal tumors – definition, clinical, histological, immunohistochemical, and molecular genetic features and differential diagnosis. Virchows Arch 2001; 438 (1): 1–12.
4. Sircar K, Hewlett BR, Huizinga JD et al. Interstitial cells of Cajal as precursors of gastrointestinal stromal tumors. Am J Surg Pathol 1999; 23 (4): 377–389.
5. Nilsson B, Bümming P, Meis-Kindblom JM et al. Gastrointestinal stromal tumors: the incidence, prevalence, clinical course, and prognostication in the preimatinib mesylate era–a population-based study in western Sweden. Cancer 2005; 103 (4): 821–829. doi: 10.1002/cncr.20 862.
6. Miettinen M, Lasota J. Gastrointestinal stromal tumors: pathology and prognosis at different sites. Semin Diagn Pathol 2006; 23 (2): 70–83.
7. Jurečková A, Kocáková I, Vyzula R. Klinický registr GIST. Klin onkol 2012; 25 (2): 135–138.
8. Onkologickeregistry.cz. [online]. GIST: O projektu. Dostupné z: http: //gist.registry.cz/index.php.
9. Choi H, Charnsangavej C, Faria SC et al. Correlation of computed tomography and positron emission tomography in patients with metastatic gastrointestinal stromal tumor treated at a single institution with imatinib mesylate: proposal of new computed tomography response criteria. J Clin Oncol 2007; 25 (13): 1753–1759. doi: 10.1200/JCO.2006.07.3049.
10. Rubin BP, Blanke CD, Demetri GD et al. Protocol for the examination of specimens from patients with gastrointestinal stromal tumor. Arch Pathol Lab Med 2010; 134 (2): 165–170. doi: 10.1043/1543-2165-134.2.165.
11. Debiec-Rychter M, Wasag B, Stul M et al. Gastrointestinal stromal tumours (GISTs) negative for KIT (CD117 antigen) immunoreactivity. J Pathol 2004; 202 (4): 430–438. doi: 10.1002/path.1546.
12. Debiec-Rychter M, Sciot R, Le Cesne A et al. KIT mutations and dose selection for imatinib in patients with advanced gastrointestinal stromal tumours. Eur J Cancer 2006; 42 (8): 1093–1103. doi: 10.1016/j.ejca.2006.01.030.
13. Nahas CS, Nahas SC, Marques CF et al. Gastrointestinal stromal tumor of the rectum treated with neoadjuvant Imatinib followed by transanal endoscopic microsurgery. Arq Bras Cir Dig 2015; 28 (1): 87–89. doi: 10.1590/S0102-67202015000100022.
14. Liu H, Yan Z, Liao G et al. Treatment strategy of rectal gastrointestinalstromal tumor (GIST). J Surg Oncol 2014; 109 (7): 708–713. doi: 10.1002/jso.23562.
15. Kala Z, Procházka V, Grolich T et al. Moderní trendy v chirurgii kolorektálního karcinomu aneb co by měl onkolog vědět o práci chirurga. Onkologie 2017; 11 (2): 54–60.
16. Kunovský L, Kala Z, Svatoň R et al. Transanální minimalne invazivní resekce rekta s totalni mezorektalni excizí po endoskopické mukózní resekci. Gastroent Hepatol 2017; 71 (3): 208–214. doi: 10.14735/amgh2017208.
17. Hohenberger P, Ronellenfitsch U, Oladeji O et al. Pattern of recurrence in patients with ruptured primary gastrointestinal stromal tumour. Br J Surg 2010; 97 (12): 1854–1859. doi: 10.1002/bjs.7222.
18. Grassi N, Cipolla C, Torcivia A et al. Gastrointestinal stromal tumour of the rectum: report of a case and review of literature. World J Gastroenterol 2008; 14 (8): 1302–1304.
19. Jakob J, Mussi C, Ronellenfitsch U et al. Gastrointestinal stromal tumor of the rectum: results of surgical and multimodality therapy in the era of imatinib. Ann Surg Oncol 2013; 20 (2): 586–592. doi: 10.1245/s10434-012-2647-1.
20. Fiore M, Palassini E, Fumagalli E et al. Preoperative imatinib mesylate for unresectable or locally advanced primary gastrointestinal stromal tumors (GIST). Eur J Surg Oncol 2009; 35 (7): 739–745. doi: 10.1016/j.ejso.2008.11.005.
21. Hasegawa J, Kanda T, Hirota S et al. Surgical interventions for focal progression of advanced gastrointestinal stromal tumors during imatinib therapy. Int J Clin Oncol 2007; 12 (3): 212–217. doi: 10.1007/s10147-007-0657-y.
22. Casali PG, Abecassis N, Bauer S et al. Gastrointestinal stromal tumours: ESMO-EURACAN clinical practice guidelines fordiagnosis, treatment and follow-up. Ann Oncol 2018; 29 (Suppl 4): iv68–iv78. doi: 10.1093/annonc/mdy095.
23. Avritscher R, Gupta S. Gastrointestinal stromal tumor: role of interventional radiology in diagnosis and treatment. Hematol Oncol Clin North Am 2009; 23 (1): 129–137. doi: 10.1016/j.hoc.2008.11.002.
24. Wu X, Jiang W, Zhang R et al. Clinicopathological analysis of 61 patients with rectal gastrointestinal stromal tumors. Zhonghua Wei Chang Wai Ke Za Zhi 2014; 17 (4): 335–339.
25. Shen C, Chen H, Yin R et al. Clinicopathologic, surgical characteristics and survival outcomes of rectal gastrointestinal stromal tumors. Neoplasma 2015; 62 (4): 610–617. doi: 10.4149/neo_2015_073.
26. Pai VD, Demenezes JL, Patil PS et al. Multimodality therapy of rectal gastrointestinal stromal tumors in the era of imatinib-an Indian series. J Gastrointest Oncol 2016; 7 (2): 262–268. doi: 10.3978/j.issn.2078-6891.2015.088.
27. Cavnar MJ, Wang L, Balachandran VP et al. Rectal gastrointestinal stromal tumor (GIST) in the era of imatinib: organ preservation and improved oncologic outcome. Ann Surg Oncol 2017; 24 (13): 3972–3980. doi: 10.1245/s10434-017-6087-9.
Labels
Paediatric clinical oncology Surgery Clinical oncology
Article was published inClinical Oncology

2019 Issue 2-
All articles in this issue
- Léčba relabující/refrakterní akutní lymfoblastické leukemie dnes a zítra
- Oligometastatický karcinom prostaty
- Chromotripse – rozsáhlé chromozomové přestavby a jejich význam u onkologických onemocnění
- Gastrointestinální stromální tumory rekta – hodnocení dat národního registru s ohledem na využití v klinické praxi
- Gorlinov-Goltzov syndróm
- IgG4 sklerozující cholangitida – zánět imitující nádor hlavy pankreatu a cholangiokarcinom
- Vysoká hladina cirkulujících mikropartikulí u pacientů s BCR/ABL negativními myeloproliferativními chorobami – pilotní studie
- Extrémny prípad syndrómu rastúceho teratómu retroperitonea testikulárneho pôvodu – klinický management a efekt liečby
- Postižení jater po jedné dávce nivolumabu – kazuistika a přehled literatury
- Leptomeningeálne metastázy karcinómu prsníka liečené dvoma líniami intratekálnej chemoterapie – kazuistika
- Mezinárodní klasifikace nemocí pro onkologii integrovaná s histogenetickým modelem melanomu
- Přizpůsobení nutričních intervencí molekulární patofyziologii nádorové kachexie – jak vyřešit dlouhodobý problém
- Clinical Oncology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Chromotripse – rozsáhlé chromozomové přestavby a jejich význam u onkologických onemocnění
- Gorlinov-Goltzov syndróm
- Oligometastatický karcinom prostaty
- Postižení jater po jedné dávce nivolumabu – kazuistika a přehled literatury
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

