-
Medical journals
- Career
Význam signálnej dráhy MITF pri regulácii proliferácie a invazivity malígneho melanómu
Authors: P. Urban; M. Rabajdová; B. Veliká; I. Špaková; B. Bolerázska; M. Mareková
Authors‘ workplace: Ústav lekárskej a klinickej biochémie, LF UPJŠ v Košiciach, Slovenská republika
Published in: Klin Onkol 2016; 29(5): 347-350
Category: Reviews
doi: https://doi.org/10.14735/amko2016347Overview
Východiská:
Malígny melanóm je jedným z najagresívnejších druhov rakoviny. Melanóm primárne vzniká z pigment produkujúcich buniek melanocytov, ktoré sa vyznačujú špecifickými mechanizmami prežívania. Kľúčové postavenie v metabolizme melanómu má transkripčný faktor asociovaný s mikroftalmiou (microphthalmia-associated transcription factor – MITF-M). MITF-M sa zapája do regulácie expresie veľkého počtu génov riadiacich procesy melanogenézy, proliferácie, diferenciácie a prežitia melanocytov. Expresia tohto transkripčného faktora v melanocytoch je aktivovaná niekoľkými signálnymi cestami, pričom blokovanie jeho expresie, alebo funkcie môže znamenať poruchu v regulácii antiapoptotických mechanizmov. MITF-M taktiež ovplyvňuje aktivitu matrixovej metaloproteinázy 14 (matrix metalloproteinase – MMP14), ktorá je zodpovedná za zmenu tvaru melanocytov a za zvýšenie ich pohyblivosti a invazivity. V ľudských melanocytoch s invazívnym fenotypom bola zistená veľmi nízka hladina expresie MITF-M, čo naznačuje že tento transkripčný faktor pôsobí ako supresor metastatického procesu. V rakovinových bunkách s nízkou hladinou expresie cytozolového/nukleárneho β-katenínu, vzniká malé množstvo proteínu MITF-M, ktorý nedokáže inhibovať transkripciu MMP 14. Tento enzým katalyzuje degradáciu laminínu a fibronektínu, čím dochádza k zmene tvaru melanocytov, k zvýšemiu ich pohyblivosti a invazivity.Ciele:
Táto prehľadová práca popisuje regulačnú dráhu aktivácie MITF-M, jeho zapojenie do proliferácie transformovaných melanocytov ako aj jeho úlohu pri zvyšovaní invazivity malígneho melanómu. Detailné pochopenie mechanizmov fungovania signálnej dráhy MITF-M je vysoko aktuálnou témou a môže pomôcť pri vývoji nových tak diagnostických, ako aj terapeutických aplikácií pri liečbe pacientov s malígnym melanómom.Kľúčové slová:
transformácia neoplastických buniek – melanóm – transkripčný faktor MITFÚvod
Malígny melanóm je jedným z najagresívnejších druhov rakoviny. Melanóm primárne vzniká z pigment produkujúcich buniek melanocytov, ktoré sa vyznačujú špecifickými mechanizmami prežívania. Pôsobia hlavne proti viacerým karcinogénnym faktorom, vrátane UV žiarenia a vysoko reaktívnych medziproduktov melanogenézy [1]. Tieto zložité mechanizmy oddiaľujúce bunkovú smrť účinkujú jednak v zdravých melanocytoch ako aj v transformovaných bunkách melanómu. Kľúčové postavenie v metabolizme melanómu má transkripčný faktor asociovaný s mikroftalmiou (microphthalmia associated transcription factor – MITF), ktorý stojí v centre transkripčnej regulácie od embryonálneho vývoja normálnych melanocytov, ich diferenciácie, udržania identity až po prežívanie nielen normálnych, ale aj nádorových melanocytov. V súčasnosti je známych viac ako 40 cieľových génov MITF, ktorých účinky sú častokrát antagonistické [2]. Tento prehľadový článok popisuje regulačnú dráhu aktivácie MITF-M, jeho zapojenie do proliferácie transformovaných melanocytov ako aj jeho úlohu pri zvyšovaní invazivity malígneho melanómu.
Úloha MITF pri vzniku malígneho melanómu
MITF je nukleárny proteín charakteristický pre embryonálny vývoj a postnatálnu životaschopnosť melanocytov. Gén kódujúci tento transkripčný faktor bol lokalizovaný na treťom chromozóme, konkrétne na pozícii 3p14.2-3p14.1 [3]. Proteín MITF existuje celkovo v 12 zostrihových izoformách (označovaných A, B, C, H a M) a každá je exprimovaná zo svojho, tkanivovo špecifického, promótora. Všetky izoformy obsahujú devät exónov a odlišujú sa len prvým exónom, zostrihnutým ku spoločnému druhému exónu. Poloha ostatných exónov je už vo všetkých izoformách rovnaká. Pre melanocyty je špecifická izoforma MITF-M, ktorá je exprimovaná iba v pigmentových a v melanómových bunkách [4]. MITF-M obsahuje viacero špecifických domén (obr. 1) [5]. V centrálnej časti molekuly proteín MITF obsahuje zásaditú oblasť s motívom helix-slučka-helix-leucínový zips (basic helix-loop-helix-leucine zipper – bHLH LZ), ktorá je zodpovedná za väzbu na DNA a dimerizáciu proteínu. MITF-M pozostáva zo 419 aminokyselín a zapája sa do regulácie expresie veľkého počtu génov zapojených do melanogenézy, proliferácie, diferenciácie a prežitia melanocytov.
Image 1. Štruktúra proteínu MITF-M a regulácia jeho aktivity. 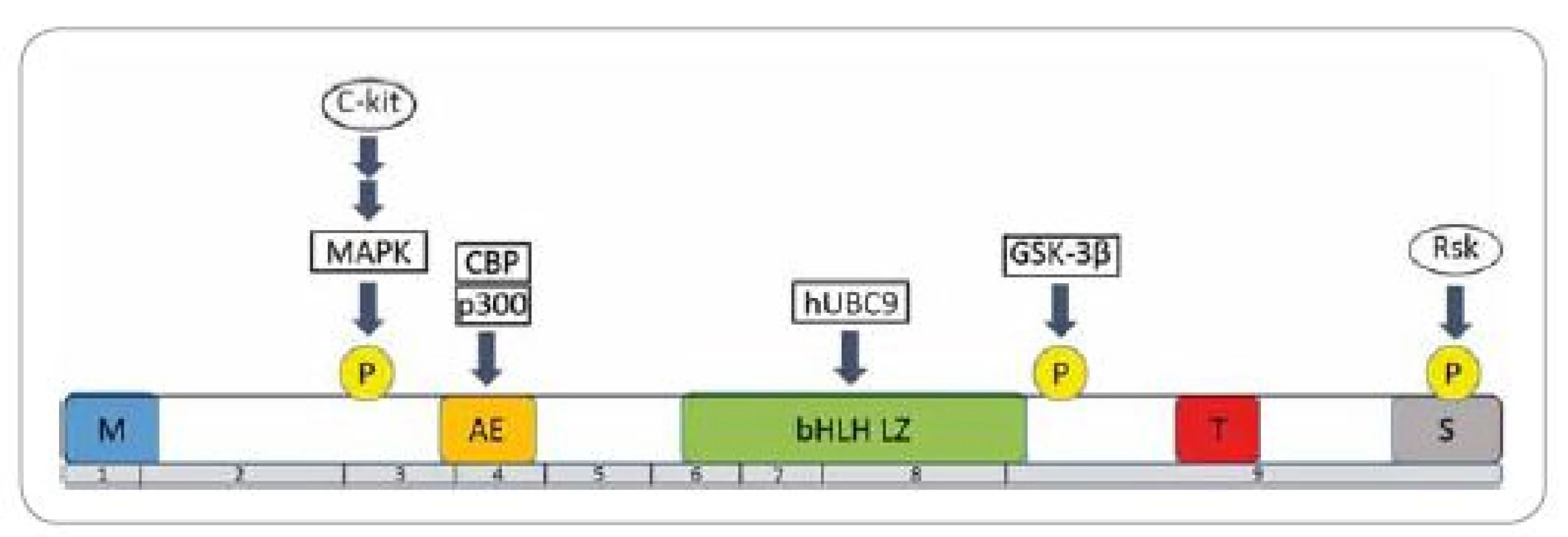
Viaceré signálne proteíny pôsobia priamou fosforyláciou serínových zvyškov na pozícii 73, 298 a 409, čím dochádza k aktivácii MITF-M. Čísla pod štruktúrou popisujú poradie exónov v géne MITF-M. Oblasti M, T, S sú bohaté na metionín, treonín, resp. serín so slabšou transkripčnou aktivitou. Naopak domény AE a pHLH ZL znamenajú transkripčne veľmi aktívne oblasti. Upravené podľa [5]. Priamym cieľom sú gény pre tyrozinázu (tyrosinase – TYR), s tyrozínkinázou asociovaným proteínom 1 (tyrosinase-related protein 1 – TYRP1) a dopachróm tautomerázu (dopachrome tautomerase – DCT), ktoré ovplyvňujú melanogenézu. MITF súčasne ovplyvňuje expresiu génov pre premelanozómový proteín 17 (premelanosome protein 17 – Pmel 17) a osteoartritický proteín 1 (osteoarthritis protein 1 – OA1), čím reguluje transfer melanozómov [6].
Expresia MITF-M v melanocytoch je aktivovaná niekoľkými transkripčnými cestami (napr. cez Pax3 proteín alebo pomocou transkripčného faktora CREB). Tieto transkripčné faktory obsahujú väzbové miesta v blízkosti promótora MITF. Preto sa MITF-M považuje za cieľ pre génovú terapiu, pričom blokovanie expresie alebo funkcie MITF môže znamenať poruchu v regulácii antiapoptotických dráh v melanómových bunkách [7]. Jedným z regulátorov expresie MITF-M je aj receptor pre melanokortín 1 (melanocortin 1 receptor – MC1R). Tento receptor v aktívnom stave vykazuje funkciu G proteínu, ktorý zvyšuje hladinu cyklického adenozínmonofosfátu (cyclic adenosine monophosphate – cAMP). Akumulácia cAMP vedie k aktivácii proteínu viažúceho cAMP odpovedajúceho úseku (cAMP response element-binding protein – CREB), čím sa zvýši expresia MITF-M, čo následne reguluje aktiváciu génov podieľajúcich sa na syntéze melanínu. Plne aktívne alely génu MC1R umožňujú syntézu tmavého pigmentu – eumelanínu, zatiaľ čo alelická varianta s oslabenou aktivitou zodpovedá za tvorbu červeného pigmentu – feomelanínu, ktorý môže mať i fotosenzibilizačné účinky a prispieva k vzniku a vývoju karcinognézy primárneho melanómu [8].
Úloha MITF-M pri regulácii proliferácie
MITF-M taktiež zohráva významnú úlohu pri proliferácii melanocytov [9]. Tento transkripčný faktor je nevyhnutný pre prežívanie a diferenciáciu melanoblastov a melanocytových kmeňových buniek [10]. Prostredníctvom zvýšenej expresie cyklín dependentných inhibítorov p21Cip1 a p16INK4a sa MITF-M zapája do regulácie bunkového cyklu [11]. Zníženie aktivity MITF-M vedie k ukončeniu bunkového cyklu v G1 fáze, reorganizácii aktínového cytoskeletu a k zvýšeniu expresie matrixových metaloproteináz, čo vedie k zvýšeniu invazívneho potenciálu melanocytov. MITF-M preto vystupuje ako regulátor proliferácie a diferenciácie normálnych melanocytov, ktorého aktivita môže byť narušená genetickými aj epigenetickými zmenami, čo môže indukovať malígnu transformáciu. Aktivita MITF-M je taktiež regulovaná mikroprostredím nádoru, ako aj vnútrobunkovou hladinou špecifických miRNA, ktoré znižujú množstvo primárneho transkriptu jeho degradáciou [12]. MITF-M tiež pôsobí ako faktor zabraňujúci starnutiu melanocytov (schéma 1) [13]. Pri inhibícii expresie alebo aktivity MITF-M dochádza k predčasnému starnutiu buniek prostredníctvom zvýšenej aktivity p53. Aktivácia p53 je priamym dôsledkom degradačnej kaskády indukovanej poškodením DNA. Vznikajú rôzne mitotické poruchy, čo vedie k nekróze alebo apoptóze [14].
Schéma 1. Úloha MITF-M pri regulácii starnutia melanocytov. 
Upravené podľa [13]. Predčasné starnutie buniek je charakteristické pre premalígne lézie, ale neobjavuje sa pri léziách malígnych. Z uvedených faktov vyplýva, že sledovanie aktivity a expresie inhibítorov bunkového cyklu (p16INK4a, p21CIP1 a p27KIP1) môže pomôcť pri hľadaní nových vhodných prognostických markerov použiteľných aj na rozlíšenie jednotlivých štádií malígneho melanómu [15].
MITF-M a invazivita nádoru
Nádorovo transformované melanocyty patria medzi extrémne pohyblivé a invazívne bunky. Podobne ako pri iných typoch nádorov sa invazivita zvyšuje prostredníctvom remodelácie extracelulárneho matrixu reguláciou proteázovej aktivity matrixových metaloproteináz (matrix metaloproteinases – MMP) alebo zmenou tvaru buniek [16]. Jednu z hlavných úloh pri zvýšení invazivity melanocytov zohráva aktivácia kanonickej Wnt (wingless/integrated) signálnej dráhy, ktorá využíva k prenosu signálu β-katenín, ktorý sa v bunke podieľa na tvorbe adherentných spojov medzi bunkami a ukotvuje aktínové vlákna cytoskeletu. β-katenín je nevyhnutný pre prežívanie a proliferáciu zdravých melanocytov [17]. Regulácia aktivity tohto proteínu závisí na jeho fosforylácii. Ak je β-katenín fosforylovaný cez kinázu glykogén syntázy-3 β (glycogen synthase kinase-3β – GSK-3β) dochádza k jeho ubikvitinácii a následnej proteazomálnej degradácii. Pri aktivácii signálnej dráhy Wnt však nedochádza k fosforylácii, ale k akumulácii β-katenínu v cytozole. Po dosiahnutí hraničnej koncentrácie sa presúva do jadra, kde aktivuje transkripciu špecifických génov, ako napr. MITF-M [18]. V bunkách metastázujúcich melanocytov bola dokázaná Wnt dráhou indukovaná zvýšená hladina transkripcie MITF-M a jeho cieľových génov [19]. Znižovanie expresie β-katenínu v bunkách melanómu zvyšuje ich invazivitu [20]. V ľudských melanocytoch s invazívnym fenotypom bola zistená veľmi nízka hladina expresie MITF-M, čo naznačuje, že tento transkripčný faktor pôsobí ako supresor metastatického procesu [21]. V rakovinových bunkách s nízkou hladinou expresie cytozolového/nukleárneho β-katenínu vzniká malé množstvo proteínu MITF-M, ktorý nedokáže inhibovať transkripciu MMP 14. Tento enzým katalyzuje degradáciu laminínu a fibronektínu, čím dochádza k zmene tvaru melanocytov, k zvýšemiu ich pohyblivosti a invazivity [22]. MITF-M je teda považovaný za jeden z kľúčových komponentov regulácie tvorby a šírenia metastáz malígneho melanómu.
Záver
Doposiaľ publikované štúdie naznačujú, že aktivácia MITF-M predstavuje jeden zo základaných mechanizmov, ktorý integruje špecifické vnútrobunkové signalizácie podieľajúce sa na bunkovej diferenciácii, proliferácii a prežívaní melanocytov. Syntéza enzýmov a štruktúrnych proteínov zapojených do melanogenézy je koordinovaná už na transkripčnej úrovni. Okrem pigmentácie upravuje aktivácia MITF-M aj proliferáciu a invazívnosť zhubných melanocytov, hlavne reguláciou transkripcie génov zapojených do týchto procesov. Zablokovanie transkripčného faktora MITF-M a niektorých jeho aktivátorov má inhibičné účinky na neotransformáciu melanómových buniek. Tento experimentálny prístup je ešte významnejší vzhľadom na vznik rezistencie pri použití súčasných chemických inhibítorov. Preto je štúdium a detailné porozumenie signálnej dráhe MITF-M vysoko aktuálne a môže prispieť k vývoju nových diagnostických postupov využiteľných následne aj pri monitorovaní pacientov s malígnym melanómom.
Práca bola podporená grantovými projekty VEGA 1/0115/14 a VEGA 1/0873/16.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
prof. Ing. Mária Mareková, CSc.
Ústav lekárskej a klinickej biochémie LF UPJŠ v Košiciach
Trieda SNP 1
040 11 Košice
Slovenská Republika
e-mail: maria.marekova@upjs.sk
Obdržané: 4. 12. 2015
Prijaté: 14. 6. 2016
Sources
1. Su TR, Lin JJ, Tsai CC et al. Inhibition of melanogenesis by gallic acid: possible involvement of the PI3K/Akt, MEK/ERK and Wnt/β-catenin signaling pathways in B16F10 cells. Int J Mol Sci 2013; 14 (10): 20443–20458. doi: 10.3390/ijms141020443.
2. Maddodi N, Jayanthy A, Setaluri V. Shining light on skin pigmentation: the darker and the brighter side of effects of UV radiation. Photochem Photobiol 2012; 88 (5): 1075–1082. doi: 10.1111/j.1751-1097.2012.01138.x.
3. Paillerets BB, Lesueur F, Bertolotto C. A germline oncogenic MITF mutation and tumor susceptibility. Eur J Cell Biol 2014; 93 (1–2): 71–75. doi: 10.1016/j.ejcb.2013.10.002.
4. Hartman ML, Czyz M. Pro-survival role of MITF in melanoma. J Invest Dermatol 2015; 135 (2): 352–358. doi: 10.1038/jid.2014.319.
5. Shibahara S, Takeda K, Yasumoto K et al. Microphthalmia--associated transcription factor (MITF): multiplicity in structure, function, and regulation. J Invest Dermatol Symp Proc 2001; 6 (1): 99–104.
6. Vachtenheim J, Ondrušová L. MITF expression levels in melanoma cells contribute to cell invasion and proliferation. Exp Dermatol 2015; 24 (7): 481–484. doi: 10.1111/exd.12724.
7. Eccles MR, He S, Ahn A et al. MITF and PAX3 play distinct roles in melanoma cell migration; outline of a „genetic switch“ theory involving MITF and PAX3 in proliferative and invasive phenotypes of melanoma. Front Oncol 2013; 11 (3): 229. doi: 10.3389/fonc.2013.00229.
8. Agnarsdottir M, Ponten F, Garno H et al. MITF expression in cutaneous malignant melanoma. J Mol Biomark Diagn 2012; 3 (4): 128. doi: 10.4172/2155-9929.1000128.
9. Steingrimsson E, Copeland NG, Jenkins NA. Melanocytes and the microphthalmia transcription factor network. Annu Rev Genet 2004; 38 : 365–411.
10. Nishimura EK, Granter SR, Fisher DE. Mechanisms of hair graying: incomplete melanocyte stem cell maintenance in the niche. Science 2005; 307 (5710): 720–724.
11. Loercher AE, Tank EM, Delston RB et al. MITF links differentiation with cell cycle arrest in melanocytes by transcriptional activation of INK4A. J Cell Biol 2005; 168 (1): 35–40.
12. Gajos-Michniewicz A, Duechler M, Czyz M. MiRNA in melanoma-derived exosomes. Cancer Lett 2014; 347 (1): 29–37. doi: 10.1016/j.canlet.2014.02.004.
13. Carreira S, Goodall J, Denat L. Mitf regulation of Dia1 controls melanoma proliferation and invasiveness. Genes Dev 2006; 20 (24): 3426–3439.
14. Giuliano S, Ohanna M, Ballotti R et al. Advances in melanoma senescence and potential clinical application. Pigment Cell Melanoma Res 2011; 24 (2): 295–308. doi: 10.1111/j.1755-148X.2010.00820.x.
15. Giuliano S, Cheli Y, Ohanna M. Microphthalmia-associated transcription factor controls the DNA damage response and a lineage-specific senescence program in melanomas. Cancer Res 2010; 70 : 3813–3822. doi: 10.1158/0008-5472.CAN-09-2913.
16. Sabeh F, Shimizu-Hirota R, Weiss SJ. Protease-dependent versus-independent cancer cell invasion programs: three-dimensional amoeboid movement revisited. J Cell Biol 2009; 185 (1): 11–19. doi: 10.1083/jcb.200807195.
17. Hari L, Brault V, Kléber M et al. Lineage-specific requirements of β-catenin in neural crest development. J Cell Biol 2002; 159 (5): 867–880.
18. Zeng X, Huang H, Tamai K et al. Initiation of Wnt signaling: control of wnt coreceptor Lrp6 phosphorylation/activation via frizzled, dishevelled and axin functions. Development 2008; 135 (2): 367–375.
19. Dansky WE, Curley DP, Santhanakrishnan M et al. β-catenin signaling controls metastasis in Braf-activated Pten-deficient melanomas. Cancer Cell 2011; 20 (6): 741–754. doi: 10.1016/j.ccr.2011.10.030.
20. Arozarena I, Bischof H, Gilby D et al. In melanoma, beta-catenin is a suppressor of invasion. Oncogene 2011; 30 (45): 4531–4543. doi: 10.1038/onc.2011.162.
21. Hoeck KS, Eichhoff OM, Schlegel NC et al. In vivo switching of human melanoma cells between proliferative and invasive states. Cancer Res 2008; 68 (3): 650–656. doi: 10.1158/0008-5472.CAN-07-2491.
22. Sahai E, Marshall CJ. Differing modes of tumour cell invasion have distinct requirements for Rho/ROCK signalling and extracellular proteolysis. Nat Cell Biol 2003; 5 (8): 711–719.
Labels
Paediatric clinical oncology Surgery Clinical oncology
Article was published inClinical Oncology

2016 Issue 5-
All articles in this issue
- Význam signálnej dráhy MITF pri regulácii proliferácie a invazivity malígneho melanómu
- Exprese ABC transportérů Pgp, MRP1 a MRP3 u maligních a benigních změn vaječníků
- Kombinovaná léčba recidivujícího maligního schwannomu
- Hypertermická izolovaná perfuze končetin v kombinaci s tasonerminem – technika monitorování úniku perfuzátu
- Glycin-N-metyltransferáza a nádorová onemocnění prostaty
- Prognostické a prediktivní faktory u adenokarcinomu pankreatu
- Léčba relabovaného a refrakterního Hodgkinova lymfomu – doporučení české studijní skupiny Hodgkinův lymfom
- Vliv nutriční podpory s vysokým obsahem bílkovin na výsledky léčby a náklady u pacientů s kolorektálním karcinomem
- Malígny mezotelióm tunica vaginalis testis. Klinicko-patologická analýza dvoch prípadov s prehľadom literatúry
- Sentinel Lymph Node in Thin and Thick Melanoma
- Clinical Oncology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Vliv nutriční podpory s vysokým obsahem bílkovin na výsledky léčby a náklady u pacientů s kolorektálním karcinomem
- Léčba relabovaného a refrakterního Hodgkinova lymfomu – doporučení české studijní skupiny Hodgkinův lymfom
- Kombinovaná léčba recidivujícího maligního schwannomu
- Malígny mezotelióm tunica vaginalis testis. Klinicko-patologická analýza dvoch prípadov s prehľadom literatúry
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

