-
Medical journals
- Career
Imunoterapie u bronchogenního karcinomu a její perspektivy
Authors: L. Koubková
Authors‘ workplace: Pneumologická klinika 2. LF UK a FN v Motole, Praha
Published in: Klin Onkol 2015; 28(Supplementum 4): 77-81
Category: Specials
doi: https://doi.org/10.14735/amko20154S77Overview
který není zaměřený na samotný nádor, ale na imunitní systém. Povrchové antigeny přítomné na nádorových buňkách mohou být efektivním a specifickým léčebným cílem a strategie založená na protilátkách inhibujících kontrolní body imunitní reakce výrazně zlepšuje protinádorovou imunitní odpověď. Monoklonální protilátky blokující CTLA ‑ 4 (cytotoxický T lymfocytární antigen) a receptor PD ‑ 1 (protein programované buněčné smrti) a jeho ligand PD ‑ L1 prokázaly klinickou účinnost a nivolumab (protilátka proti PD ‑ 1) byla schválena ve 2. linii léčby skvamózního nemalobuněčného karcinomu plic.
Klíčová slova:
bronchogenní karcinom – vakcíny – kontrolní body imunitní reakceÚvod
Bronchogenní karcinom je celosvětově onemocněním s vysokou incidencí a je nejčastější příčinou úmrtí ze všech zhoubných nádorů. V roce 2012 byla odhadována celosvětová incidence na 1,82 a mortalita na 1,6 milionu [1]. V době diagnózy se v 75 – 80 % případů jedná o onemocnění lokálně pokročilé či generalizované. Asi 85 % všech plicních karcinomů tvoří nemalobuněčný karcinom plic (non‑small cell lung cancer – NSCLC). Navzdory léčebným snahám, při nepřítomnosti aktivujících EGFR mutací či ALK translokace je při konvenční chemoterapii průměrná doba přežití (overall survival – OS) 8 – 10 měsíců, pětileté OS je odhadováno na 4 %.
Imunoterapie nabízí zcela odlišný způsob léčby nádorového onemocnění, který není zaměřený na samotný nádor, ale na imunitní systém.
Vakcíny
Před několika lety jako možnost protinádorové imunoterapie u NSCLC byly testovány vakcíny. Například studie fáze III MAGRIT byla zaměřena na MAGE ‑ A3 (melanoma ‑ specific antigen A3), ve které byla vakcína podávána pacientům po radikální resekci NSCLC stadia IB, II a IIIA po adjuvantní chemoterapii, jejichž nádor byl MAGE ‑ A3 pozitivní [2]. V 3/ 2014 však bylo oznámeno, že studie nesplnila svůj primární cíl, prodloužení doby bez progrese (progression-free survival – PFS) nemoci v porovnání s placebem, a byla proto ukončena. Ve studii fáze III START dostávali pacienti lipoproteinovou vakcínu L ‑ BLP25 (Tecemotide), která indukuje imunitní odpověď na nádorové buňky exprimující MUC1 (mucinous glycoprotein‑1 antigen) [3]. Vakcína byla podávána po konkomitantní či sekvenční chemoradioterapii, jestliže nebyla prokázána progrese onemocnění. Studie neprokázala signifikantní zlepšení OS, ale léčebný efekt byl patrný v podskupině s konkomitantní chemoradioterapií, kde bylo dosaženo zlepšení OS o 10,2 měsíce. V 9/ 2014 byl vzhledem k negativním výsledkům studie prováděné v Japonsku program vývoje Tecemotidu zastaven.
Neuspokojivé výsledky protinádorových vakcín mají řadu příčin. Jedna z nich je heterogenita cílových antigenů. Imunitní reakce proti jednomu antigenu postihne pouze část buněk.
Stěží mohou ovlivnit nádory pokročilé, imunitou tolerované, s vysoce heterogenní skladbou svých antigenů a obtížným průnikem tak vysokého počtu T buněk do nádoru. Rovněž kontrolní body imunitní reakce mohou inhibovat odpověď T buněk na tyto vakcíny a v budoucnu se může jako výhodná ukázat kombinace těchto dvou léčebných modalit.
Jako další možnost se jeví vakcíny s využitím dendritických buněk zejména v kombinaci s jinou protinádorou léčbou.
Blokáda kontrolních bodů imunitní reakce
S poznáním kontrolních bodů imunitní reakce opět stoupl i zájem o imunoterapii NSCLC (obr. 1). Molekula CTLA ‑ 4 byla identifikována v roce 1987 francouzskými vědci. Jedná se o proteinový receptor na povrchu T buněk. Ale až v roce2010 byly uveřejněny povzbudivé výsledky s anti‑CTLA ‑ 4 protilátkou u metastatického melanomu. Molekula PD ‑ 1 byla popsána japonskými biology počátkem 90. let minulého století. Monoklonální protilátky blokující CTLA ‑ 4 a receptor PD ‑ 1 a jeho ligand PD ‑ L1 prokázaly klinickou účinnost ve studiích časné fáze a nyní probíhá celá řada studií u NSCLC i malobuněčného karcinomu plic (small‑cell lung cancer – SCLC). Nivolumab (protilátka proti PD ‑ 1) byla schválena ve 2. linii léčby skvamózního NSCLC.
Image 1. Kontrolní body imunitní reakce CTLA-4 a PD-1. 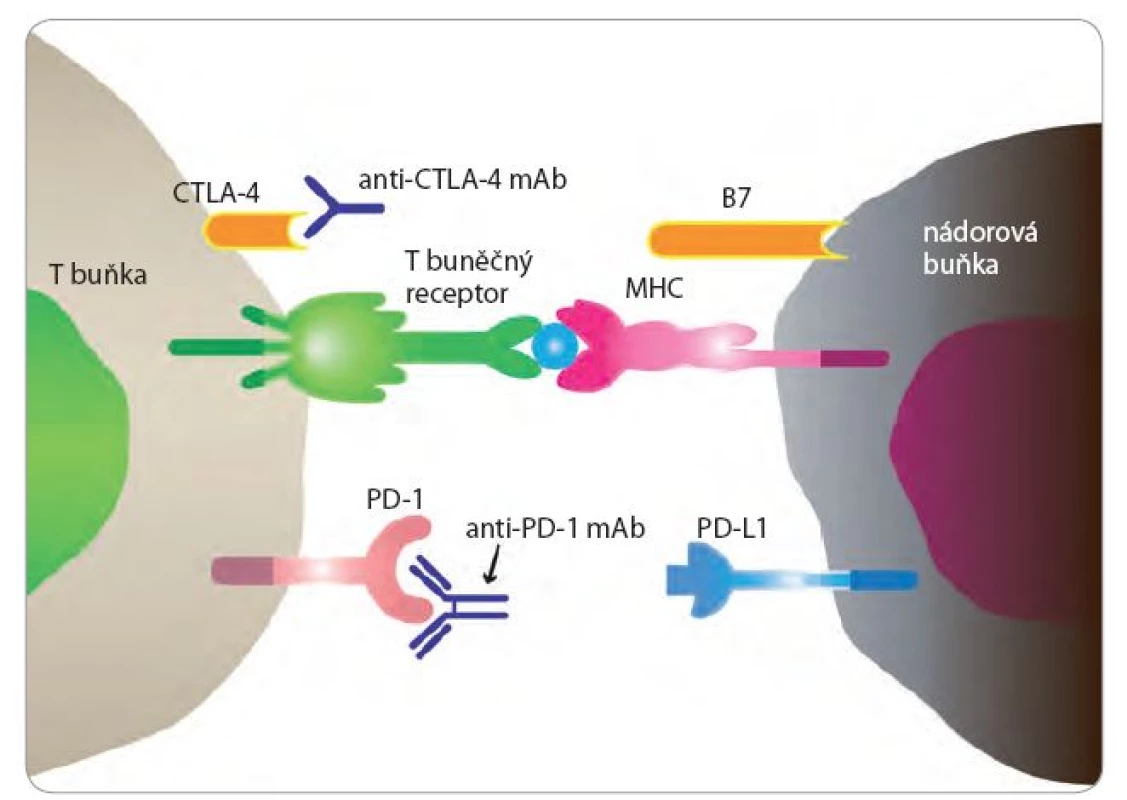
Nivolumab
Nivolumab je plně humanizovaná IgG4monoklonální protilátka proti PD ‑ 1 (obr. 2). V 12/ 2014 byl schválen FDA v USApro léčbu inoperabilního či metastatického melanomu.
Image 2. Mechanizmus účinku nivolumabu. 
Ve studii fáze III CheckMate 017 byl nivolumab vs. docetaxel podáván 272 pacientům s pokročilým skvamózním NSCLC, kteří progredovali po předchozí léčbě platinovým dubletem. Nivolumab byl podáván v dávce 3 mg/ kg každé dva týdny, docetaxel 75 mg/ kg každé tři týdny. Primárním cílem studie bylo OS, sekundárním PFS a objektivní odpověď (objective response rate – ORR), efektivnost PD ‑ L1 exprese (testování PD ‑ L1 však nebylo podmínkou pro zařazení do studie). Studie splnila svůj primární cíl, OS byl statisticky významně lepší v rameni s nivolumabem (9,2 vs. 6,0 měsíce; HR 0,59; 95% CI 0,44 – 0,79; p = 0,00025), rovněž PFS byly lepší v rameni s nivolumabem (HR 0,62), ORR v rameni s nivolumabem byl 20 %, s docetaxelem 9 %. S léčbou spojené nežádoucí účinky stupně 3 – 4 se v rameni s nivolumabem vyskytly v 7 %, s docetaxelem v 55 %, nebylo zaznamenáno žádné úmrtí v souvislosti s léčbou nivolumabem. Exprese PD ‑ L1 nebyla prognostickým ani prediktivním faktorem účinnosti (tab. 1) [4].
Table 1. Studie fáze III CheckMate 017. 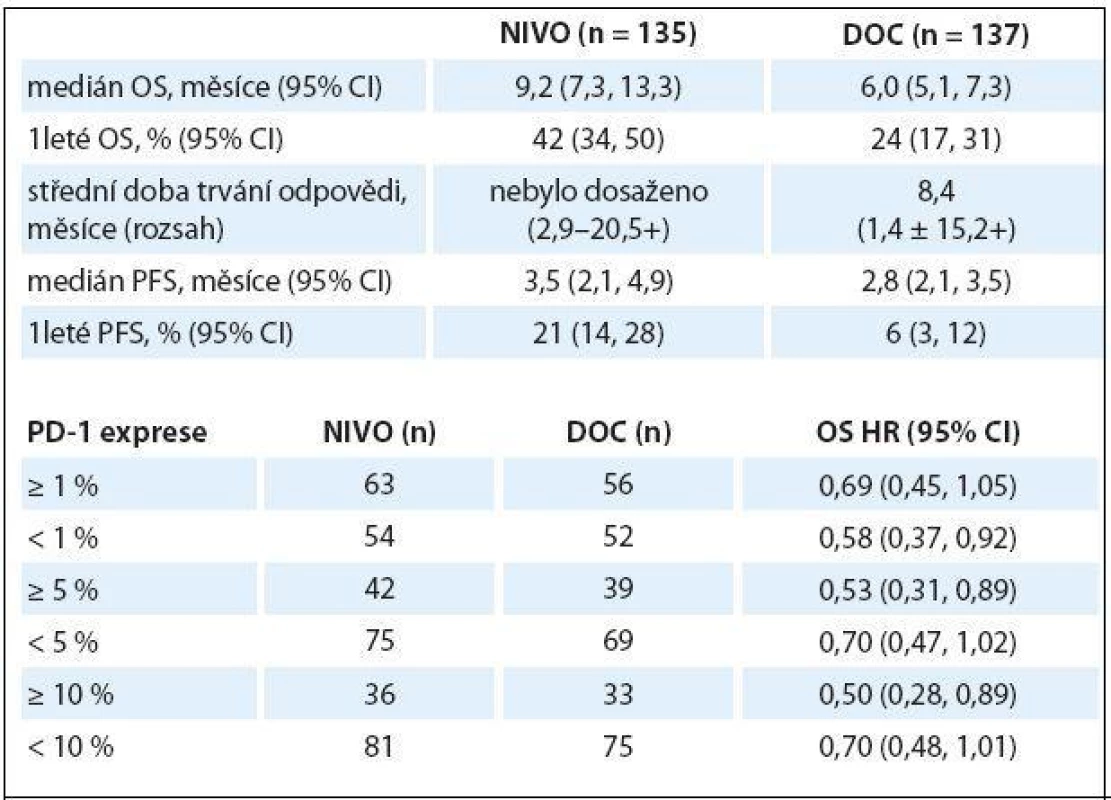
OS – celkové přežití, PFS – přežití bez progrese Na základě výsledku této studie byl nivolumab v 3/ 2015 schválen FDA pro léčbu pokročilého skvamózního NSCLC s progresí po léčbě platinovým dubletem.
Ve studii fáze III CheckMate 057 dostalo 582 pacientů s dříve léčeným pokročilým non-skvamózním NSCLC nivolumab 3 mg/ kg každé dva týdny nebo docetaxel 75 mg/ kg každé tři týdny. Nivolumab prokázal statisticky lepší OS (HR 0,73; 96% CI 0,59, 0,89; p = 0,00155) a ORR (19,2 vs. 12,4 %; p = 0,0235) ve srovnání s docetaxelem. Navíc doba trvání odpovědi byla signifikantně delší v rameni s nivolumabem (17,2 měsíce) než v rameni s docetaxelem (5,6 měsíce). Exprese PD ‑ L1 byla spojena s větší účinností nivolumabu a ukázala se jako jasný prediktivní faktor. S léčbou spojené nežádoucí účinky stupně 3 – 4 se v rameni s nivolumabem vyskytly v 10,5 %, s docetaxelem v 53,7 %, nebylo zaznamenáno žádné úmrtí v souvislosti s léčbou nivolumabem (tab. 2) [5].
Table 2. Studie fáze III CheckMate 057. 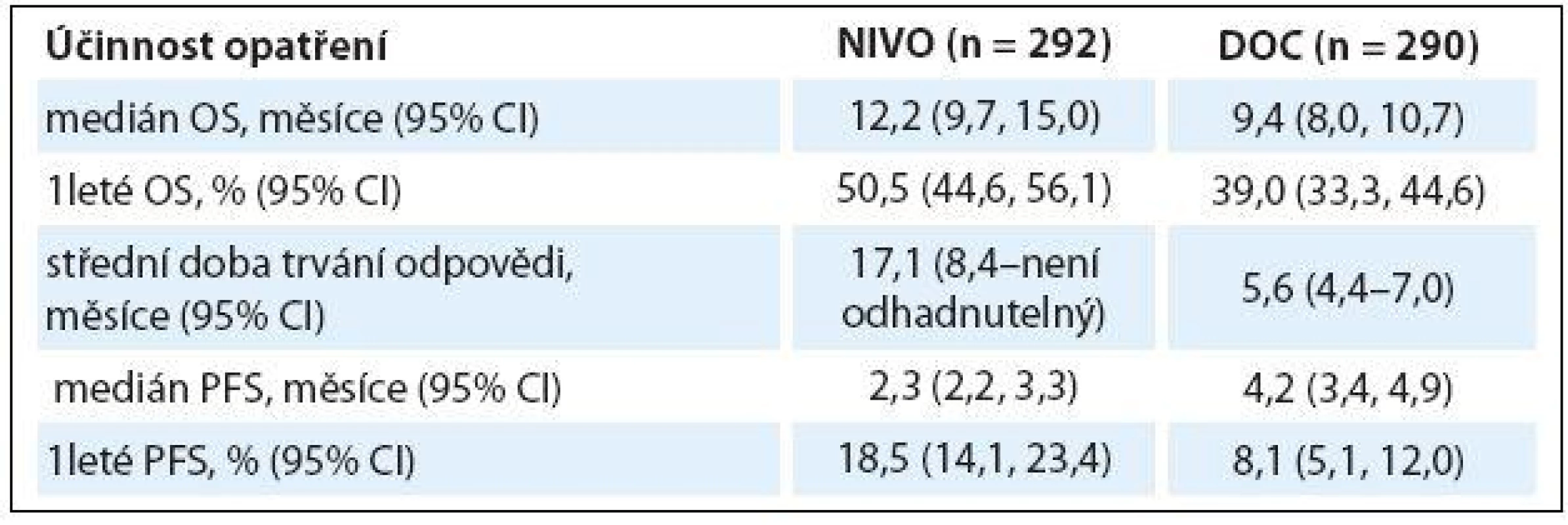
OS – celkové přežití, PFS – přežití bez progrese Na letošním ASCO byla rovněž prezentována studie fáze I hodnotící účinnost a bezpečnost nivolumabu v monoterapii v 1. linii léčby NSCLC stadia IIIB/ IV. Byl podán 52 pacientům se skvamózním i non‑skvamózním NSCLC, ORR byl 23 % (včetně čtyř kompletních odpovědí), medián OS byl 22,6 měsíce. Na léčbu odpověděli pacienti PD ‑ L1 pozitivní i negativní, přičemž ORR byl vyšší u pacientů PD ‑ L1 pozitivních [5]. Probíhá studie fáze III s nivolumabem vs. chemoterapie v 1. linii léčby u NSCLC stadia IV [6].
Ve studii fáze I/ II CA209 - 032 [6] byl nivolumab podán samostatně nebo v kombinaci s ipilimumabem pacientům s recidivujícím SCLC. pacienti nebyli selektováni podle stavu PD ‑ L1. ORR při léčbě nivolumabem byl 15 % a při kombinaci s ipilimumabem 25 %, byly zaznamenány i dlouhodobé odpovědi, léčba byla dobře tolerována. Budou prezentovány aktualizované údaje o bezpečnosti, klinické účinnosti a analýze biomarkerů [7].
Probíhá ještě řada dalších studií s nivolumabem u NSCLC i SCLC.
MK‑ 3475, pembrolizumab
MK ‑ 3475, pembrolizumab, je další plně humanizovaná IgG4 monoklonální protilátka proti PD ‑ 1. V 9/ 2014 byl schválen FDA v USA pro léčbu pokročilého melanomu pod obchodním názvem Keytruda®.
V 4/ 2015 byly publikovány výsledky studie fáze I KEYNOTE ‑ 001. Pembrolizumab v dávce 2 mg nebo 10 mg/ kg každé tři týdny nebo 10 mg/ kg každé tři týdny dostávalo 495 pacientů dříve léčených či bez předchozí léčby. ORR byl 19,4 %, medián OS byl 12 měsíců. Při expresi PD ‑ L1 alespoň 50 % nádorových buněk byl ORR 45,2 %, medián OS nebyl dosažen. Léčba byla dobře tolerovaná, méně než 10 % pacientů mělo s léčbou spojené nežádoucí účinky stupně 3 – 4. Bylo zaznamenáno jedno úmrtí na pneumonitidu [8].
Je ukončen nábor pacientů do studie fáze II/ III se dvěma dávkami MK ‑ 3475 vs. docetaxel u předléčených pacientů s NSCLC, kteří mají prokázanou pozitivitu PD ‑ L1. Probíhají studie fáze III KEYNOTE ‑ 042 a KEYNOTE ‑ 024 porovnávající MK ‑ 3475 s chemoterapií na bázi platiny u dříve neléčených pacientů s pokročilým NSCLC. Probíhají nebo jsou plánované i další studie s léčbou pembrolizumabem v kombinaci s bevacizumabem, inhibitory tyrozinkinázy či ipilimumabem.
Anti‑PD‑ L1 protilátky
MPDL3280A, atezolizumab
MPDL3280A, atezolizumab, je protilátka namířená proti PD ‑ L1. V roce 2013 byly prezentovány výsledky studie fáze I u předléčených pacientů s NSCLC. Výrazně lepší léčebná odpověď byla u pacientů s vysokou expresí PD ‑ L1. Srovnatelné jsou výsledky u skvamózních a non‑skvamózních NSCLC. Na letošním ASCO byla prezentována studie fáze IIPOPLAR porovnávající MPDL3280A s docetaxelem ve 2. a 3. linii léčby. Slibné výsledky korelovaly s PD ‑ L1 expresí na tumor infiltrujících imunitních buňkách a/ nebo nádorových buňkách [9]. Probíhají další studie včetně studií v 1. linii léčby u pacientů s PD ‑ L1 pozitivním lokálně pokročilým nebo metastazujícím NSCLC. V plánu je i hodnocení kombinace s bevacizumabem ve studii fáze I.
MEDI4736
MEDI4736 je další humanizovaná IgG1 protilátka, která se váže na ligand PD ‑ L1. Byla testována ve studii fáze I, probíhají studie fáze II a III, také v kombinaci s tremelimumabem (anti‑CTLA ‑ 4 protilátka), v plánu je zahájení studie s adjuvantním podáním MEDI4736 u kompletně resekovaného NSCLC.
BMS‑ 936559
BMS ‑ 936559 monoklonální protilátka proti PD ‑ L1, která ve studiích fáze I prokázala aktivitu u řady solidních nádorů včetně NSCLC.
Anti‑CTLA‑ 4 protilátky
Ipilimumab
Ipilimumab je humanizovaná IgG1 anti‑-CTLA ‑ 4 monoklonální protilátka, která působí jako selektivní inhibitor CTLA ‑ 4, antigenu asociovaného s cytotoxickými T lymfocyty. Prokázala již svou účinnost u pacientů s pokročilým melanomem (v roce 2011 FDA schválila ipilimumab pro léčbu inoperabilního nebo metastatického melanomu).
Ve studii fáze II u pokročilého NSCLC prokázala zlepšení intervalu PFS při podání s chemoterapií carboplatina + paclitaxel. Očekávají se výsledky studie fáze IIIu pokročilého skvamózního NSCLC porovnávající carboplatinu + paclitaxel + placebo s carboplatinou + paclitaxelem + ipilimumabem. Rovněž probíhá i studie u SCLC.
Tremelimumab
Tremelimumab je humanizovaná IgG2 anti‑CTLA ‑ 4 monoklonální protilátka. V současné době probíhá studie fáze Ib/ IIu pokročilého NSCLC v kombinaci s MEDI4736 (anti‑PD ‑ L1 protilátka) a gefitinibem a také u mezoteliomu pleury.
Diskuze
Výsledky studií ukazují, že imunitní odpověď může být rychlá a dlouhotrvající. Jednou aktivovaná protinádorová imunitní odpověď může mít potenciál dalšího pokračování, což naznačuje, že by nemuselo dojít k rozvoji sekundární rezistence, která je patrná u většiny protinádorové léčby. Ani tato léčba však není vhodná pro všechny pacienty. Ve studiích časné fáze u pacientů těžce předléčených byly zaznamenány odpovědi asi ve 20 %, což jsou povzbudivé výsledky v porovnání s odpovědí na standardní cytotoxickou léčbu u těchto pacientů, u nichž se odpověď pohybuje mezi 5 a 10 %. Rovněž povzbuzující v těchto studiích byla délka trvání odpovědi, která byla u některých pacientů jeden rok i více. Stále není objasněna otázka prediktivních biomarkerů. Míra exprese PD ‑ L1 se zatím jeví jako nejspolehlivější prediktor pro odpověď na léčbu určitými inhibitory. Ukazuje se také, že exprese PD ‑ L1 se může měnit během života nádoru a léčby. Rovněž nejsou známy klinické charakteristiky, které by nám pomohly vybrat vhodnou populaci pacientů pro tuto léčbu, i když odpovědi se zdají být vyšší u kuřáků, u kterých je onemocnění spojeno s vyšším výskytem mutací a vyšším počtem nádorových antigenů, a nádor by tak mohl být lépe rozeznán imunitním systémem.
Při imunoterapii musíme počítat s tím, že nástup účinku může být opožděný, neboť aktivace imunitního systému může trvat řádově týdny až měsíce. Počáteční indukovaná zánětlivá odpověď může vést i k dočasnému zvětšení lézí či k objevení se nových lézí, které mohou později regredovat. To vše je impulzem k tvorbě nových kritérií hodnocení léčebné odpovědi, tzv. imune‑related response kriteria.
Dle publikovaných studií je tato léčba poměrně dobře tolerovaná, nežádoucí účinky bývají nejčastěji lehčího stupně (1 – 2). Nejčastěji se vyskytovala únava, snížení apetitu, průjem, nauzea, zácpa, kašel a dušnost, elevace jaterních enzymů, vyrážka, svědění. Musíme počítat i s výskytem toxicity na autoimunním podkladě, jako je pneumonitida, hepatitida, abnormality funkce štítné žlázy, kolidita. Tyto se však vyskytovaly vzácně. Imunitně zprostředkované nežádoucí účinky odpovídaly na léčbu kortikosteroidy.
Závěr
Ještě před několika lety byla efektivní imunoterapie bronchogenního karcinomu považována za nemožnou. Nyní ji již máme k dispozici a u některých pacientů překonává standardní léčbu jak v efektivnosti, tak v kvalitě jejich života. V 3/ 2015 schválila FDA v USA nivolumab v léčbě 2. linie pokročilého skvamózního karcinomu a v 7/ 2015 byl schválen i v EU. V ČR je nyní dostupný v rámci specifického léčebného programu. Stále však zůstává řada nezodpovězených otázek. Je nutné objasnění prediktivních biomarkerů vedoucích k lepšímu výběru pacientů, kteří budou mít z imunoterapie prospěch. Dále pak otázka správného načasování imunoterapie, kombinace s konvenční léčbou, léčbou cílenou či kombinace jednotlivých imunoterapeutických modalit. Probíhají proto desítky studií, které by v budoucnosti měly pomoci tyto otázky objasnit.
Autorka deklaruje, že v souvislosti s předmětem studie nemá žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
MUDr. Leona Koubková
Pneumologická klinika
2. LF UK a FN v Motole
V Úvalu 84
150 06 Praha 5
e-mail: Leona.Koubkova@fnmotol.cz
Obdrženo: 27. 7. 2015
Přijato: 23. 10. 2015
Sources
1. Ferlay J, Soerjomataram I, Ervik M et al (eds). GLOBOCAN 2012 v1.0, Cancer Incidence and Mortality Worldwide: IARC CancerBase No. 11 [monograph on the Internet]. Lyon: International Agency for Research on Cancer. Available from: http:/ / globocan.iarc.fr.
2. Vansteenkiste J, Zielinski M, Linder A et al. Adjuvant MAGE ‑ A3 immunotherapy in resected non‑small‑cell lung cancer: phase II randomized study results. J Clin Oncol 2013; 31(19): 2396 – 2403. doi: 10.1200/ JCO.2012.43.7103.
3. Butts CA, Socinski MA, Mitchell P et al. START: a phase IIIstudy of L ‑ BLP25 cancer immunotherapy for unresectable stage III non‑small cell lung cancer. J Clin Oncol 2013; 31 (Suppl): abstr. 7500.
4. Spigel DR, Reckamp KL, Rizvi NA et al. A phase III study (CheckMate 017) of nivolumab (NIVO; anti‑programmed death ‑ 1 [PD ‑ 1]) vs docetaxel (DOC) in previously treated advanced or metastatic squamous (SQ) cell non‑small cell lung cancer (NSCLC). J Clin Oncol 2015; 33 (Suppl): abstr. 8009.
5. Paz ‑ Ares L, Horn L, Borghaei H et al. Phase III, randomized trial (CheckMate 057) of nivolumab (NIVO) versus docetaxel (DOC) in advanced non‑squamous cell (non‑SQ) non‑small cell lung cancer (NSCLC). J Clin Oncol 2015; 33 (Suppl): abstr. LBA109.
6. Gettinger SN, Hellmann MD, Shepherd FA et al. First‑line monotherapy with nivolumab (NIVO; anti‑programmed death ‑ 1[PD ‑ 1]) in advanced non‑small cell lung cancer (NSCLC): safety, efficacy and correlation of outcomes with PD ‑ 1 ligand (PD ‑ L1) expression. J Clin Oncol 2015; 33 (Suppl): abstr. 8025.
7. Antonia SJ, Bendell JC, Tailor MH et al. Phase I/ II study of nivolumab with or without ipilimumab for treatment of recurrent small cell lung cancer (SCLC): CA209 - 032. J Clin Oncol 2015; 33 (Suppl): abstr. 7503.
8. Garon EB, Rizvi NA, Hui R et al. KEYNOTE ‑ 001 Investigators. Pembrolizumab for the treatment of non‑small‑cell lung cancer. N Engl J Med 2015; 372(21): 2018 – 2028. doi: 10.1056/ NEJMoa1501824.
9. Spira AI, Park K, Mazières J et al. Efficacy, safety and predictive biomarker results from a randomized phase IIstudy comparing MPDL3280A vs docetaxel in 2L/ 3L NSCLC (POPLAR). J Clin Oncol 2015; 33 (Suppl): abstr. 8010.
Labels
Paediatric clinical oncology Surgery Clinical oncology
Article was published inClinical Oncology

2015 Issue Supplementum 4-
All articles in this issue
- Imunoterapie u bronchogenního karcinomu a její perspektivy
- Immunoscore a jeho prediktivní hodnota u kolorektálního karcinomu
- Imunitní systém u pacientů s nádory hlavy a krku
- Imunoterapie uroteliálního karcinomu močového měchýře – od BCG vakcín k cílené imunoterapii
- Nežádoucí účinky moderní imunoterapie a jejich řešení v klinické praxi
- Terapeutický efekt a tolerance ipilimumabu u metastatického maligního melanomu v dětském věku – kazuistika
- Historie imunoterapie – od Coley toxinů ke kontrolním bodům imunitní reakce
- Protinádorové zbraně imunitního systému
- Úloha regulačních T buněk v protinádorové imunitní odpovědi
- Únikové strategie nádorů pozornosti imunitního systému
- Role imunoterapie v dětské onkologii
- Chimérický antigenní receptor T lymfocytů – genová terapie budoucnosti u nádorových onemocnění?
- Význam imunogenní buněčné smrti v protinádorové imunitě
- Význam imunitního systému a možnosti imunoterapie u maligního melanomu
- Imunoterapie renálního karcinomu
- Význam imunitního systému a možnosti imunoterapie u karcinomu prostaty
- Dosavadní zkušenosti a perspektivy imunoterapie bronchogenního karcinomu
- Clinical Oncology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Nežádoucí účinky moderní imunoterapie a jejich řešení v klinické praxi
- Imunoterapie uroteliálního karcinomu močového měchýře – od BCG vakcín k cílené imunoterapii
- Únikové strategie nádorů pozornosti imunitního systému
- Význam imunogenní buněčné smrti v protinádorové imunitě
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

