-
Medical journals
- Career
Současné možnosti imunoterapie nádorových onemocnění
Authors: P. Otáhal; M. Trněný
Authors‘ workplace: I. interní klinika – klinika hematologie 1. LF UK a VFN v Praze
Published in: Klin Onkol 2015; 28(Supplementum 3): 105-111
doi: https://doi.org/10.14735/amko20153S105Overview
Metody nádorové imunoterapie pronikají po mnoha letech experimentálních výzkumů do klinické praxe. Existuje několik metod, které se ukázaly jako velmi účinné v případech již neléčitelného nádorového onemocnění. Protinádorové protilátky patří mezi základní pilíře nádorové imunoterapie a jsou úspěšně používány řadu let. Novější skupinou jsou imunomodulační protilátky, které mají schopnost prolomit nádorovou toleranci a navodit regresi nádorů prostřednictvím nespecifické aktivace imunitního systému. Bispecifické protilátky aktivující T lymfocyty reprezentují zcela novou třídu protinádorových léčiv, která navodí expanzi T lymfocytů in vivo. Představitel této třídy blinatumomab je v současnosti dostupný k léčbě B lymfoblastové leukemie. V metodách buněčné imunoterapie se ukazuje jako velmi účinná léčba B buněčných lymfoproliferací pomocí geneticky modifikovaných T lymfocytů exprimujících chimérické antigenní receptory. Ačkoliv se jedná o technicky složitou a nákladnou metodu, jde o velmi úspěšný postup, který je schopen navodit remisi i ve zcela beznadějných případech. Cílem tohoto článku je vysvětlit základní principy nádorové imunoterapie a shrnout nejnovější poznatky v této oblasti.
Klíčová slova:
rakovina – lymfomy – imunoterapie – monoklonální protilátky – genová terapieÚvod
Vztah mezi imunitou a nádory je dynamický a komplexní systém. Nádorové buňky jsou charakterizovány přítomností mnoha genetických mutací a dysregulací v epigeneticky řízených genech a produkty těchto změn jsou rozpoznávány imunitním systémem jako cizí antigeny. Nicméně výsledek tohoto dynamického vztahu je paradoxně charakterizován rozvojem tolerance, při které jsou tyto de novo vzniklé nádorové antigeny viděny imunitním systémem jako antigeny tělu vlastní a jakákoliv imunitní odpověď je velmi účinně tlumena [1]. Rostoucí nádory obsahují obvykle relativně velké množství infiltrujících lymfocytů, které nejsou schopny navodit eliminaci nádoru in vivo, ale mimo imunosupresivní a tolerizující prostředí nádorového stromatu jsou plně funkční a schopny cytotoxického účinku, produkce cytokinů a proliferace. To je způsobeno charakteristickými vlastnostmi nádorového mikroprostředí, které vyvolává supresi lymfocytů mnoha mechanizmy a vede k rozvoji tzv. nádorové tolerance [2]. Hlavní mechanizmy, které účinně brání rozpoznání nádorů imunitním systémem, jsou vyvolány nenádorovou populací buněk ze skupiny myeloidních supresorových buněk a přítomností regulačních lymfocytů (CD4+ Treg). Dále řada nádorů přímo exprimuje na svém povrchu ligandy, které se váží na inhibiční receptory na povrchu infiltrujících T lymfocytů (PD ‑ 1, LAG ‑ 3, CTL ‑ 4), a přímo tak navodí jejich supresi. A poslední mechanizmus nádorové tolerance spočívá v produkci inhibičních cytokinů (TGF β, IL‑10) jak přímo nádorovými buňkami, tak nenádorovou populací supresorických buněk. Příkladem, jak alespoň trochu zamezit supresi T lymfocytů v nádorech, je nyní již historická aplikace IL‑2 (Proleukin). Účinnost této léčby je diskutabilní. Používala se v léčbě melanomu a karcinomu ledviny. Podání IL‑2 nespecificky stimulovalo imunitní systém a vyvolalo systémovou zánětlivou odpověď s typickými příznaky (teplota, hypotenze, průjem, zvracení, vyrážka), částečně to vedlo k aktivaci protinádorových T lymfocytů, ale zároveň bohužel došlo ke stimulaci supresorických T lymfocytů [3]. Tato léčba je nyní již překonána a intenzivní výzkum mechanizmů nádorové tolerance přenesl pozornost na více specifické terapeutické cíle a odhalil nové možnosti léčby. Cílem tohoto článku je shrnout postupy protinádorové imunoterapie, které jsou dostupné pacientům v klinických studiích, a porovnat jejich účinnost.
Nádorově specifické protilátky
Monoklonální protilátky mají zásadní dopad na léčbu nádorových onemocnění a jsou označovány jako biologická protinádorová léčiva [4]. Rituximab (Mabthera®, anti‑CD20), trastuzumab (Herceptin®, anti HER2/ neu) a bevacizumab (Avastin®, anti‑VEGEF) jsou jedny z nejprodávanějších protinádorových léčiv. Protinádorové mAb fungují přes naprosto stejné mechanizmy jako přirozené protilátky vznikající např. při virové infekci. Protilátky se naváží variabilní doménou na povrchové antigeny na nádorových buňkách a konstantní doménou aktivují komplement a část lymfocytů označovaných jako NK buňky, což v důsledku vede ke zničení nádorové buňky. Aktivace NK buněk označovaná jako ADCC (antibody dependent cell cytotoxicity) je pravděpodobně hlavní efektorový mechanizmus, alespoň pro rituximab představující jednu z prvních, a přesto stále nejúspěšnějších terapeutických protilátek. Aktivace komplementu pomocí mAb (complement dependent cytotoxicity – CDC) je další mechanizmus v protinádorovém působení protilátek. Je významný zejména u hematologických malignit, protože nádorové buňky jsou vystaveny působení komplementu v krevním řečišti a kostní dřeni. Existuje ale velmi málo důkazů, že efekt CDC má význam u solidních nádorů. Velmi malý efekt má pravděpodobně aktivace receptoru, na který se mAb váže na povrchu nádorových buněk. V současnosti se uplatňuje další generace protilátek, jež mají modifikované vlastnosti. Například ofatumumab [5] je anti‑CD20 mAb, která má větší schopnost navodit CDC v porovnání s rituximabem. Jiný způsob modifikace mAb genetickou modifikací FC oblasti v místě vazby na ADCC naopak může selektivně zvýšit účinnost tohoto mechanizmu, což je příklad anti‑CD20 protilátky obinutuzumab [6]. Účinnost takto modifikovaných protilátek v porovnání s rituximabem však není jednoznačně vyřešena a stále se testuje v řadě klinických studií. První a dosud jediné přímé srovnání dvou anti‑CD20 protilátek obinutuzumabu a rituximabu, v obou případech v kombinaci s chlorambucilem u komorbidních nemocných s chronickou lymfocytární leukemií, ukázalo v tomto případě lepší efektivitu obinutuzumabu [6].
Bispecifické protilátky
Jsou také označovány jako bi ‑ specific T cell engagers (BiTE). Tyto protilátky jsou molekulární nástroje připravené genetickými manipulacemi [7]. Jedná se o protein tvořený dvěma protilátkami s různou specifitou. V případě blinatumomabu první protilátka rozpoznává antigen CD3 na povrchu T lymfocytů a druhá antigen CD19 na povrchu B lymfocytů (obr. 1) [8]. Vazba blinatumomabu na oba antigeny současně spojí efektorový T lymfocyt s maligním B lymfocytem, toto spojení navodí aktivaci T lymfocytu a zabití B lymfocytu. Blinatumomab si můžeme představit jako velmi silné „molekulární lepidlo“, které „slepí“ T lymfocyty s B lymfocyty, má tedy naprosto jiný mechanizmus účinku než běžné terapeutické mAb. Současná vazba na receptor CD3 na T lymfocytech s receptorem CD19 na B lymfocytech navodí mohutnou proliferaci T lymfocytů a takto aktivované T lymfocyty začnou ihned zabíjet všechny B lymfocyty, na které jsou navázány. Blinatumomab je testován v klinické studii na pacientech s refrakterní/ relabující B buněčnou akutní leukemií. Předběžné výsledky ukazují doslova zázračnou účinnost této nové formy terapie [8]. Způsob podání je však velmi specifický – podává se v kontinuální infuzi po dobu čtyř týdnů na jeden cyklus léčby, protože má krátký biologický poločas v důsledku renální eliminace. Pro dostatečnou účinnost je nutné v organizmu udržet dlouhodobě stabilní hladinu, neboť jakmile je blinatumomab eliminován, tak T lymfocyty přestávají reagovat s B lymfocyty a účinek léčby prudce klesá. Nežádoucí účinky (NÚ) této léčby jsou přítomny ve 100 % případů a jenom se liší svojí intenzitou. Bezprostřední NÚ spočívají v tzv. syndromu cytokinové bouře, kdy aktivací T lymfocytů blinatumomabem dojde k náhlému vyplavení prozánětlivých cytokinů (hlavně IL‑6, IL‑10, TNFα, IFNg) s celkovými projevy, jako je horečka, zimnice, bolesti hlavy a projevy neurotoxicity. NÚ mohou progredovat až do rozvoje šokového stavu s respiračním a oběhovým selháním v důsledku poškození cévního endotelu v kapilárách (capillary leak syndrom). Následující nežádoucí účinek je naopak ve své podstatě žádoucí, neboť je projevem mohutného protinádorového působení aktivovaných T lymfocytů. U pacientů s B ‑ ALL je antigen CD19 přítomen jak na maligních blastech, tak i na zdravých B lymfocytech a to vede k eliminaci všech B lymfocytů včetně těch zdravých. Důsledkem léčby je absolutní deplece všech B lymfocytů v těle pacienta s následným rozvojem protilátkového deficitu. Nejedná se však o fatální komplikaci. Protilátkový deficit lze hradit podáváním imunoglobulinů a po ukončení léčby blinatumomabem dojde ke spontánní reparaci B lymfocytů.
Image 1. Protinádorové působení CAR T lymfocytů (A) a blinatumomabu (B). 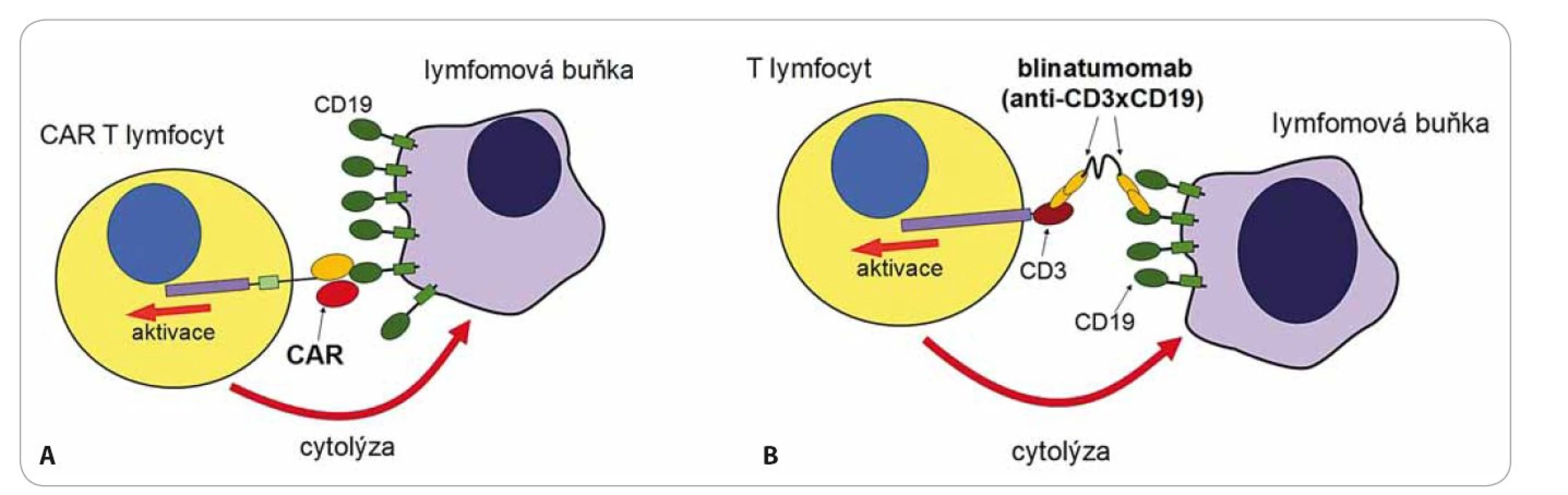
BiTE patří mezi průlomové léky a jejich další rozvoj přinese zásadní léčebné úspěchy v řadě dalších malignit, nejenom B ‑ ALL. Pomocí BiTE lze teoreticky zacílit jakýkoliv nádor, protože princip fungování je univerzální na jakýkoliv povrchový antigen. V tab. 1 jsou u vedeny příklady v současnosti probíhajících klinických studií s BiTE na různé typy nádorů. Kromě již zmíněného blinatumomabu u ALL/ lymfoblastového lymfomu a dalších lymfomů [9] se testuje protilátka AFM13 (CD30xCD16A) u Hodgkinova lymfomu, výsledky zkoušek fáze I ukazují odpověď 11,5 % a stabilizaci onemocnění u 50 % nemocných [10]. Dále je to protilátka CD20 TDB (CD3xCD20) vyvíjená firmou Genentech, která má farmakokinetické vlastnosti podobné klasickým protilátkám a nemusí být podávána kontinuální infuzí jako blinatumomab [11].
Table 1. Bispecifické protilátky testované v klinických studiích [7]. ![Bispecifické protilátky testované v klinických studiích [7].](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/85f34ba7d59d6f3ec34d967bf021e1c0.jpg)
Imunomodulační protilátky
Nádory jsou pro organizmus přirozeně imunogenní. Jednotlivé typy nádorů jsou charakterizovány přítomností několika málo typických antigenů, zároveň ale jsou nádory mezi jedinci velmi heterogenní a obsahují mnoho jedinečných antigenů pocházejících z mutovaných genů. Imunitní odpověď na tyto nádorové antigeny je však tlumena mechanizmy nádorové tolerance, a tak nádory unikají zničení imunitním systémem, přestože jsou účinně rozpoznány. Reaktivita T lymfocytů na antigenní komplexy je výsledkem interakce mnoha povrchových receptorů. Primárně musí dojít k rozpoznání krátkého antigenního peptidu derivovaného z intracelulárních proteinů, který je navázán na molekuly histokompatibilního systému (HLA). Tato interakce je ale modifikována aktivitou mnoha dalších povrchových receptorů obecně nazývaných kostimulační molekuly. Některé z těchto pomocných receptorů jsou aktivační (např. CD28) a některé naopak odpověď lymfocytů tlumí (PD ‑ 1, CTLA ‑ 4). Tlumící receptory lze jednoduše přirovnat k „brzdám”, které tlumí nadbytečnou imunitní odpověď a zamezují vzniku autoimunity (obr. 2, 3). Některé nádory, mezi nimi i krevní, např. Hodgkinův lymfom, vedou k aktivaci těchto inhibičních molekul a navozují útlum cytotoxické reakce a tak se chrání [12]. Nové trendy imunoterapie se soustředily na vývoj metod, které by vypnuly tyto inhibiční receptory a reaktivovaly existující imunitní odpověď proti mnoha nádorovým antigenům současně. Léčba těmito tzv. immune checkpoint inhibitors (ICI) [13] je však charakterizována řadou NÚ, které pramení z navození náhlé a masivní aktivace T lymfocytů s projevy prudké a generalizované autoimunitní reakce (exantém, horečka, hepatotoxicita, kolitida, pneumonitida, hypofizitida). Zejména postižení plic může mít až fatální následky. Charakteristická vlastnost léčby ICI je tzv. nekonvenční odpověď na léčbu, která se liší od běžné odpovědi pozorované po podání klasické chemoterapie. Navození protinádorového účinku vyžaduje aktivaci T lymfocytů, což může u pacientů trvat překvapivě různě dlouhou dobu. Tento mechanizmus může vést k opožděnému nástupu účinku léčby až do období několika týdnů až měsíců po zahájení terapie. V mezidobí byly popsány přechodné progrese nádorů neznamenající nutně selhání léčby. Klinicky testované protilátky se zkoušejí v podstatě na všechny typy nádorových onemocnění.
Image 2. Imunomodulační protilátky. 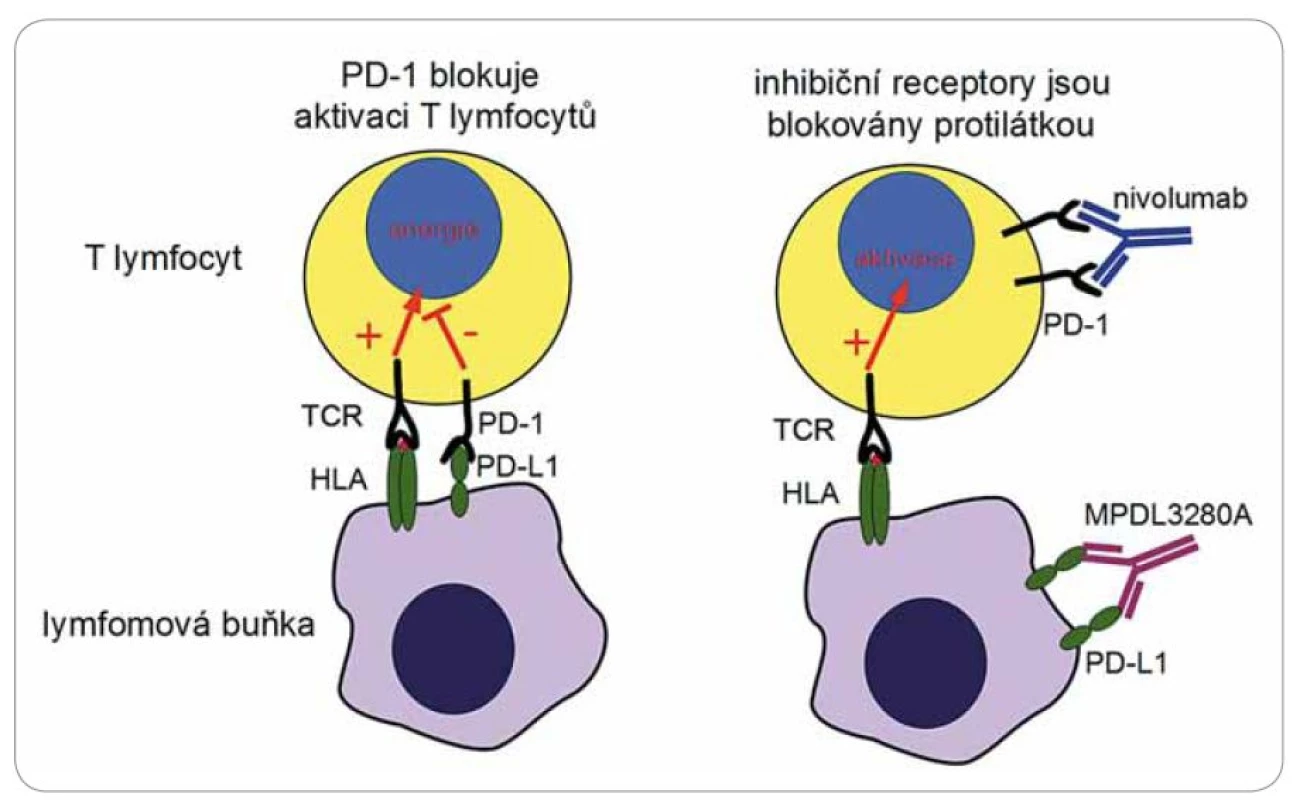
Image 3. Efekt nivolumabu u nemocného s primárně rezistentním Hodgkinovým lymfomem, relapsem dva měsíce po autologní transplantaci, progredující na terapii brentuximabem vedotinem. 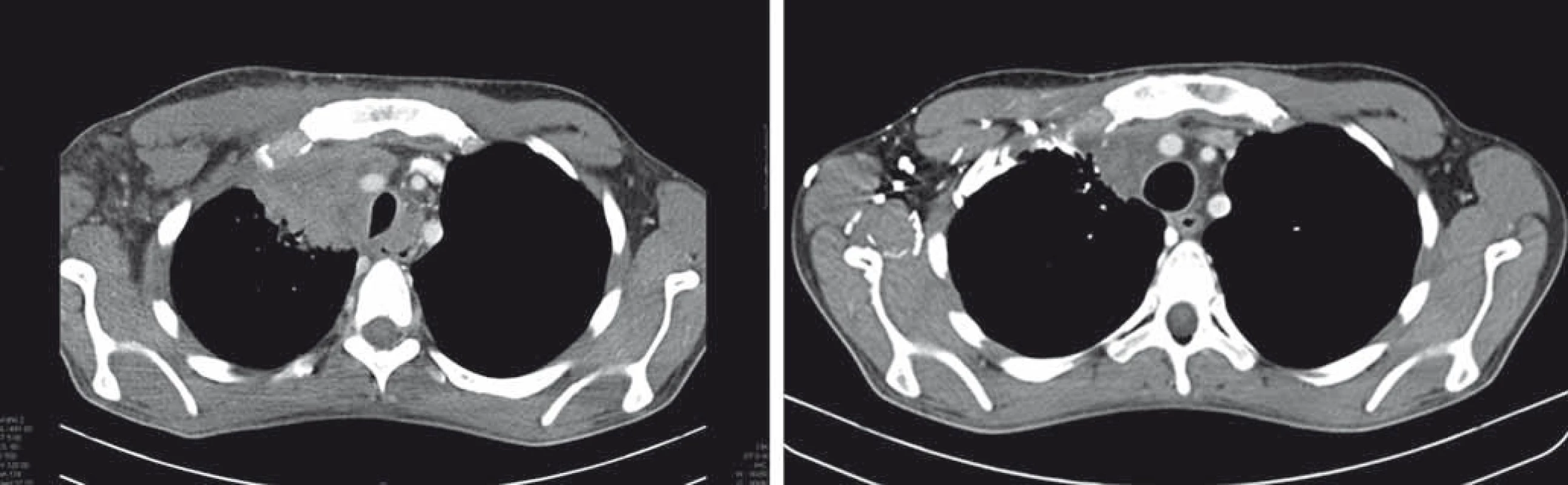
Ipilimumab je mAb blokující receptor CTLA ‑ 4. Po léčbě je popsáno prodloužení OS v řádu několika měsíců u pacientů s melanomem [14] a malobuněčným karcinomem plic. U karcinomu prostaty je efekt ipilimumabu sporný; probíhá studie ipilimumab + vakcína Provenge. Tremelimumab také blokuje CTLA ‑ 4. Ten se naopak ukázal neúčinný na melanom. U části pacientek s karcinomem prsu došlo k dočasnému zastavení progrese onemocnění v řádu měsíců. Dále probíhá klinické testování fáze III u maligního mezoteliomu [15]. Nivolumab blokuje receptor PD-1 a ukázal se velmi účinný u Hodgkinova lymfomu [16]. V této počtem malé studii fáze I dosáhlo odpovědi 87 % těžce předléčených nemocných, kompletních remisí bylo 17 %. Účinnost nivolumabu u karcinomu tlustého střeva, prostaty byla malá. Pembrolizumab je testován rovněž u Hodgkinova lymfomu. Předběžné výsledky hodnocené tři měsíce po zahájení léčby u populace nemocných, kde selhal brentuximab vedotin, ukázaly 53 % celkových odpovědí s 20 % kompletních remisí [17]. Ve velmi zajímavé studii s pidilizumabem v kombinaci s rituximabem u folikulárního lymfomu bylo dosaženo 52 % kompletních remisí a celková odpověď byla zaznamenána u 66 % nemocných [18]. Prováděné sekvenční biopsie před léčbou a v jejím průběhu u části nemocných ukázaly korelaci mezi stupněm T buněčné odpovědi a dobou do progrese. Další cestou je hledání kombinací těchto látek s chemoterapií, radioterapií, jinými imunomodulačními látkami či aktivní imunizací. Příklady testovaných protilátek jsou uvedeny v tab. 2.
Table 2. Přehled testovaných imunomodulačních protilátek. 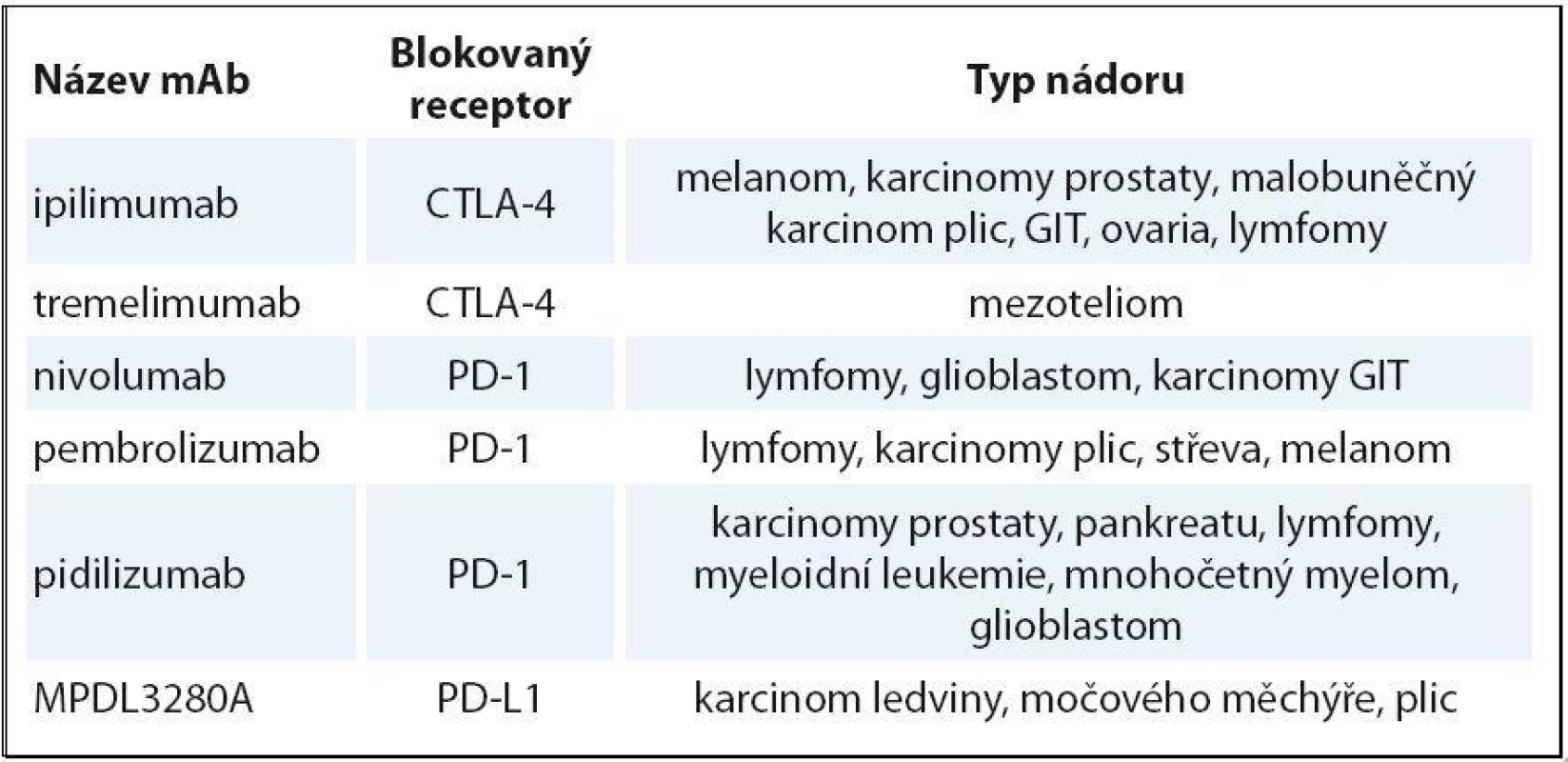
Protinádorové vakcíny a buněčná imunoterapie
První metody nádorové imunoterapie byly založeny na metodách aktivní imunizace (vakcinace) proti nádorům. Využívala se řada postupů – vakcinace pomocí dendritických buněk, mrtvých nádorových buněk, rekombinantně připravených proteinů, rekombinantních virů, či přímo směsí antigenních peptidů. Za dobu testování protinádorových vakcín proběhlo nemalé množství klinických studií a do těchto postupů bylo vkládáno mnoho nadějí. Bohužel výsledky nenaplnily očekávání a tyto postupy se ukázaly jako málo účinné. Příkladem může být vakcína proti karcinomu prostaty Provenge. Jednalo se o individuálně připravenou a pro každého pacienta jedinečnou vakcínu na bázi dendritických buněk. Tato vakcína byla testována ve třech studiích fáze III, které ukázaly benefit na OS v řádu několika měsíců [19]. Následně byla schválena FDA v roce 2010 k léčbě hormonálně rezistentního karcinomu prostaty. Problémem Provenge byl velmi špatný poměr cena ‑ benefit, neboť léčba stála cca 100 000 USD při prodloužení OS o cca čtyři měsíce (dle studií) a poněkud pochybná účinnost [20]. Takto z klinického pohledu limitovaná účinnost zamezila širšímu rozšíření. Vakcína je však stále dostupná a v současnosti probíhá klinická studie kombinace ipilimumab ‑ Provenge. V oblasti lymfomů existuje řada studií testující vakcinační přístup, výsledkem randomizovaných fází III studií bylo buď neprokázání benefitu vakcinace, nebo jen mírný klinický benefit v době trvání odpovědi [21]. Problémem těchto studií obecně je, že byly prováděny ještě před „rituximabovou“ érou. Nedostatečná účinnost protinádorových vakcín spočívá v mechanizmech nádorové tolerance, které zabraňují vzniku dostatečného počtu protinádorových T lymfocytů po imunizaci. Jednou z možností, jak toto obejít, je „vyrobit“ velké množství protinádorových T lymfocytů in vitro a následně je aplikovat pacientovi. Tyto postupy se také testují již dlouhou dobu a přinesly jen o trochu lepší výsledky než vakcinace, tj. byly popsány ojedinělé regrese nádorů – nejčastěji metastázy melanomu. Příčina selhání je opět v nádorové toleranci, protože podané nádorově specifické lymfocyty byly v prostředí nádoru aktivně tlumeny. Poznání těchto příčin neúspěchu vedlo k vývoji nových metod buněčné imunoterapie založených na genetické modifikaci T lymfocytů pomocí vnesení umělých genů, kterými byly T lymfocyty učiněny rezistentními na mechanizmy nádorové tolerance. Jedná se o tzv. CAR (chimérické antigenní receptory) modifikované T lymfocyty [22].
Cytotoxické T lymfocyty rozpoznávají cizí antigeny pomocí povrchového receptoru, který velmi specificky reaguje s hlavními histokompatibilními antigeny (HLA), jež mají na povrchu navázány antigeny ve formě krátkých peptidů. Tato aktivace je velmi komplexní a složitý proces. T lymfocyty musí reagovat s komplexem peptid ‑ HLA s přesně danou afinitou, která závisí na průběhu maturace T lymfocytů v thymu, a každý jedinec má svoje T lymfocyty přesně „vychované” na svoje individuální alely HLA. V protikladu k tomu stojí protilátky, které reagují s antigeny přímočaře a univerzálně, ale nejsou schopny vyvolat tak intenzivní a dlouhotrvající cytotoxickou reakci. Existuje způsob, jak kombinovat jednoduchost rozpoznávání antigenů protilátkami s cytotoxicitou lymfocytů. Spojíme‑li část protilátky reagující s nějakým povrchovým antigenem s intracelulární signalizační částí T receptoru, tak tento umělý receptor (CAR) bude fungovat v principu stejně jako normální T receptor, avšak jeho specifita bude definována protilátkovou částí a nebude omezena variabilitou HLA molekul (obr. 4). Po vnesení tohoto umělého genu do T lymfocytů pacienta a jejich namnožení in vitro získáme ohromný počet cytotoxických T lymfocytů rozpoznávajících námi zvolený povrchový antigen.
Image 4. Schéma chimerického antigenního receptoru. 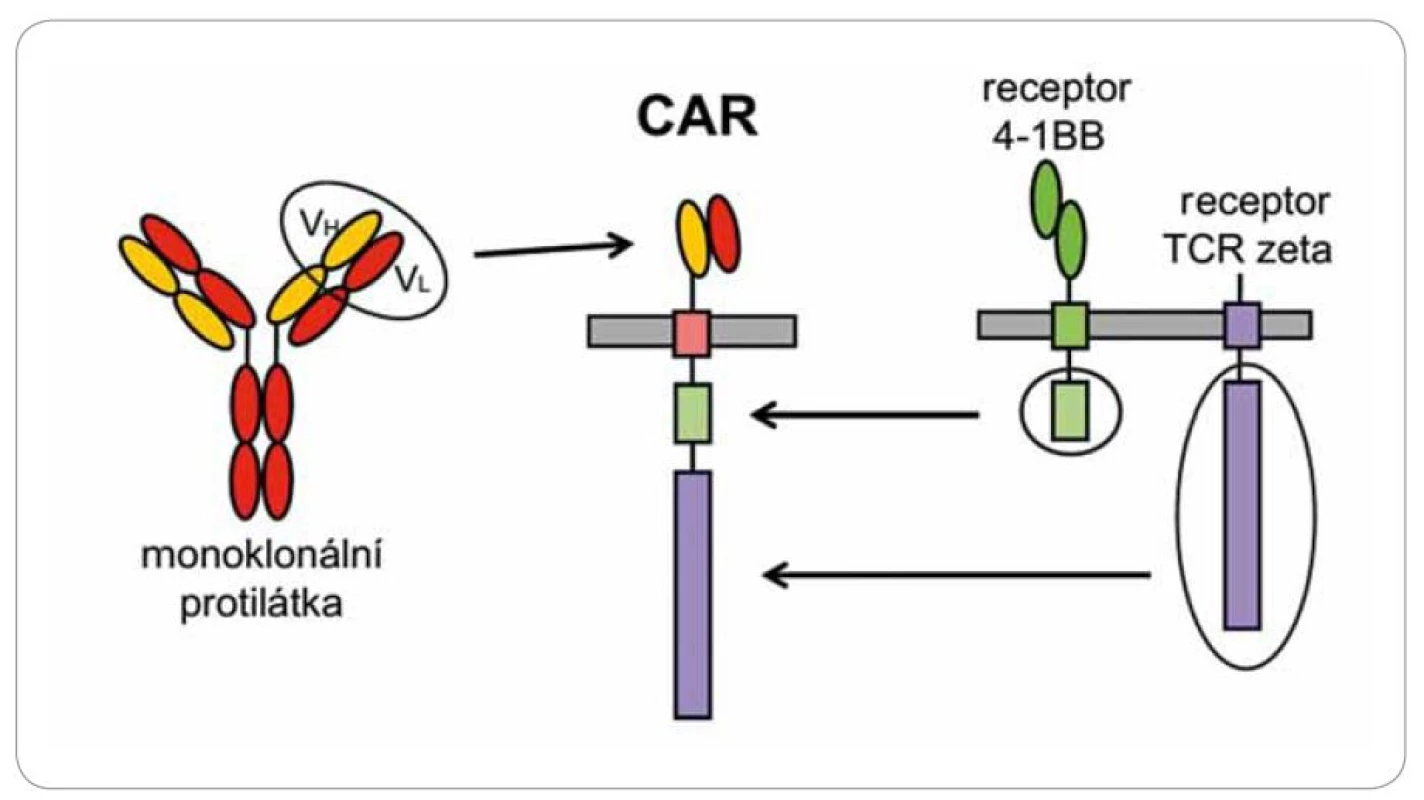
Léčba probíhá v několika fázích. Nejprve jsou pacientům odebrány z krve lymfocyty, ty jsou následně aktivovány in vitro pomocí protilátek stimulujících T receptor a kostimulační molekulu CD28 a pomocí rekombinantního lentivirového virového vektoru je do nich vnesen transgen pro chimérický receptor specifický na antigen CD19. Tento antigen byl zvolen, protože maligní buňky leukemií a lymfomů vycházejících z B lymfocytů si zachovávají expresi liniových antigenů, což je právě povrchová molekula CD19. Aktivované T lymfocyty se expandují v kultivačním médiu po dobu asi 14 dnů, během této krátké doby exponenciálně rostou až na množství řádově 109 – 1010 buněk. Buňky se následně zamrazí a čekají na vhodnou dobu pro podání pacientovi, z jehož krve byly připraveny. Příprava buněk je velmi náročná, protože musí probíhat ve speciálních superčistých laboratořích. Pokud proběhla příprava buněk úspěšně, lze přistoupit k jejich podání pacientovi formou běžné intravenózní infuze. Jakmile CAR T buňky rozpoznají antigen CD19 na povrchu nádorů pomocí chimérického receptoru, spustí se aktivační signály a buňky se velmi těsně přilepí na povrch nádorových buněk, uvolní cytotoxická granula a zabijí je. Zároveň aktivace přes CAR navodí další proliferaci T lymfocytů a vede k ještě větší reakci proti nádoru (obr. 1). Léčba směřovaná na antigen CD19 má závažný, ale nikoliv zásadní nežádoucí účinek – dojde k eliminaci všech buněk exprimujících CD19, tedy i zdravých B lymfocytů stejně jako při při léčbě blinatumomabem.
Léčba pomocí CAR19 specifických T lymfocytů je tedy velmi podobná léčbě blinatumomabem – nežádoucí účinky jsou v podstatě totožné, nicméně účinnost této léčby může být větší. Několik pacientů s B ‑ ALL, kteří progredovali po léčbě blinatumomabem, bylo úspěšně léčeno pomocí CAR T lymfocytů [22]. Na rozdíl od blinatumomabu se CAR buňky podají jenom jednou a pacienti nemusí být několik týdnů napojeni na kontinuální infuzi. Nevyřešena je otázka trvalé deplece B buněk vyvolaná CAR T lymfocyty. To však není tak velký medicínský problém, neboť pacientům lze snadno suplementovat imunoglobuliny a v některých studiích se ukázalo, že CAR T buňky po určité době v řádu měsíců až jednoho roku z organizmu zmizí a následně dojde k reparaci B lymfopoezy.
Výsledky léčby CAR jsou v současnosti nejlepší u nemocných s ALL, následovaných nemocnými s CLL. Efektivita se zatím jeví nejnižší u nemocných s lymfomy, zejména agresivními, i když i zde jsou výsledky u rezistentních lymfomů velmi slibné [22 – 25]. V současnosti se intenzivně hledají způsoby, jak po navození remise onemocnění podané CAR lymfocyty z organizmu odstranit. Například regulovatelnou expresí CAR genu nebo pomocí vnesení sebevražedného genu společně s genem pro CAR, což by umožnilo kontrolovat hlavní NÚ léčby – trvalou depleci B lymfocytů. Výzkum v této oblasti se dnes soustřeďuje na identifikaci nových cílů na ostatních typech hematologických malignit, např. antigen CD123 u akutní myeloidní leukemie [26].
Shrnutí
Imunoterapeutické postupy léčby nádorových onemocnění prodělaly bouřlivý rozvoj. V posledních letech jsme byli svědky nejprve tiché revoluce, která v posledních asi dvou letech doslova mediálně explodovala. Po mnoha letech nic neříkajících a diskutabilních výsledků máme nyní k dispozici několik fungujících léčebných postupů s jednoznačně prokázaným efektem rovnajícím se zázraku. Tato revoluce byla odstartována prvními velmi úspěšnými klinickými studiemi s CAR T lymfocyty u pacientů s beznadějně progredujícími B lymfoproliferacemi. Krátce nato se ukázaly podobně vynikající výsledky léčby s blinatumomabem u pacientů s B ‑ ALL. Další metodou s prokazatelným efektem jsou imunomodulační protilátky, jako je např. léčba nivolumabem u pacientů s Hodgkinovým lymfomem. Nevyřešenou otázkou je, proč vidíme tak dramatický rozdíl v účinnosti imunoterapie v léčbě hematologických malignit v porovnání s nehematologickými nádory. Zatímco efekt léčby B ‑ ALL a B lymfomů pomocí CAR buněk nebo blinatumomabu se rovná naprostému vymizení choroby, v léčbě karcinomů se pohybujeme maximálně v prodloužení OS v řádu měsíců. Úkolem výzkumu tedy bude zejména vyřešit problém nízké účinnosti imunoterapie na nehematologické nádory. Do budoucna lze přesto očekávat, že CAR T buňky, BiTEs a Checkpoint blockage inhibitors se stanou spolu s kinázovými inhibitory poslední linií léčby rezistentních nádorových onemocnění. Cílem tohoto článku není shrnout všechny imunoterapeutické postupy, které kdy byly zkoušeny, ale naopak z mnoha existujících metod zdůraznit ty metody, u nichž byla dokumentována nepochybná účinnost a s kterými se budeme nepochybně v blízké budoucnosti setkávat v klinické praxi (tab. 3).
Práce byla podpořena grantem IGA MZ ČR č. NT/14030-3.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
MUDr. Pavel Otáhal
I. interní klinika – klinika hematologie
1. LF UK a VFN v Praze
U Nemocnice 2
128 08 Praha 2
e-mail: pavel.otahal@vfn.cz
Obdrženo: 23. 9. 2015
Přijato: 27. 9. 2015
Sources
1. Ansell SM. Targeting immune checkpoints in lymphoma. Curr Opin Hematol 2015; 22(4): 337 – 342. doi: 10.1097/ MOH.0000000000000158.
2. Joyce JA, Fearon DT. T cell exclusion, immune privilege, and the tumor microenvironment. Science 2015; 348(6230): 74 – 80. doi: 10.1126/ science.aaa6204.
3. Sim GC, Martin‑Orozco N, Jin L et al. IL‑2 therapy promotes suppressive ICOS+ Treg expansion in melanoma patients. J Clin Invest 2014; 124(1): 99 – 110.
4. Suresh T, Lee LX, Joshi J et al. New antibody approaches to lymphoma therapy. J Hematol Oncol 2014; 7 : 58. doi: 10.1186/ s13045 ‑ 014 ‑ 0058 ‑ 4.
5. van Oers MH et al. Ofatumumab maintenance versus observation in relapsed chronic lymphocytic leukaemia (PROLONG): an open ‑ label, multicentre, randomized phase 3 study. Lancet Oncol 2015.
6. Goede V, Fischer K, Busch R et al. Obinutuzumab plus chlorambucil in patients with CLl and coexisting conditions. N Engl J Med 2014; 370(12): 1101 – 1110. doi: 10.1056/ NEJMoa1313984.
7. Sheridan C. Amgen‘s bispecific antibody puffs across finish line. Nat Biotechnol 2015; 33(3): 219 – 221. doi: 10.1038/ nbt0315 ‑ 219.
8. Topp MS, Gökbuget N, Zugmaier G et al. Phase II trial of the anti‑CD19 bispecific T cell ‑ engager blinatumomab shows hematologic and molecular remissions in patients with relapsed or refractory B ‑ precursor acute lymphoblastic leukemia. J Clin Oncol 2014; 32(36): 4134 – 4140. doi: 10.1200/ JCO.2014.56.3247.
9. Bargou R, Leo E, Zugmaier G et al. Tumor regression in cancer patients by very low doses of a T cell ‑ engaging antibody. Science 2008; 321(5891): 974 – 977. doi: 10.1126/ science.1158545.
10. Rothe A, Sasse S, Topp MS et al. A phase 1 study of the bispecific anti‑CD30/ CD16A antibody construct AFM13 in patients with relapsed or refractory Hodgkin lymphoma. Blood 2015; 125(26): 4024 – 4031. doi: 10.1182/ blood ‑ 2014 ‑ 12 ‑ 614636.
11. Sun Ll, Ellerman D, Mathieu M et al. Anti‑CD20/ CD3 T cell ‑ dependent bispecific antibody for the treatment of B cell malignancies. Sci Transl Med 2015; 7(287): 287ra70. doi: 10.1126/ scitranslmed.aaa4802.
12. Eyre TA, Collins GP. Immune checkpoint inhibition in lymphoid disease. Br J Haematol 2015; 170(3): 291 – 304. doi: 10.1111/ bjh.13397.
13. Mahoney KM, Rennert PD, Freeman GJ. Combination cancer immunotherapy and new immunomodulatory targets. Nat Rev Drug Discov 2015; 14(8): 561 – 584. doi: 10.1038/ nrd4591.
14. Valsecchi ME. Combined nivolumab and ipilimumab or monotherapy in untreated melanoma. N Engl J Med 2015; 373(13): 1270. doi: 10.1056/ NEJMc1509660#SA1.
15. Calabrò L, Morra A, Fonsatti E et al. Efficacy and safety of an intensified schedule of tremelimumab for chemotherapy‑resistant malignant mesothelioma: an open ‑ label, single‑arm, phase 2 study. Lancet Respir Med 2015; 3(4): 301 – 309. doi: 10.1016/ S2213 ‑ 2600(15)00092 ‑ 2.
16. Ansell SM, Lesokhin AM, Borrello I. PD ‑ 1 blockade with nivolumab in relapsed or refractory Hodgkin‘s lymphoma. N Engl J Med 2015; 372(4): 311 – 319. doi: 10.1056/ NEJMoa1411087.
17. Moskowitz CH, Ribrag V, Michot JM et al. PD ‑ 1 Blockade with the monoclonal antibody pembrolizumab (MK ‑ 3475) in patients with classical Hodgkin lymphoma after brentuximab vedotin failure: preliminary results from a phase 1b study (KEYNOTE ‑ 013). Blood 2014; 124(21): 290.
18. Westin JR, Chu F, Zhang M et al. Safety and activity of PD1 blockade by pidilizumab in combination with rituximab in patients with relapsed follicular lymphoma: a single group, open ‑ label, phase 2 trial. Lancet Oncol 2014; 15(1): 69 – 77. doi: 10.1016/ S1470 ‑ 2045(13)70551 ‑ 5.
19. Tanimoto T, Hori A, Kami M. Sipuleucel ‑ T immunotherapy for castration‑resistant prostate cancer. N Engl J Med 2010; 363(20): 1966; author reply 1967 – 1968. doi: 10.1056/ NEJMc1009982#SA1.
20. Huber ML, Haynes L, Parker C et al. Interdisciplinary critique of sipuleucel ‑ T as immunotherapy in castration‑resistant prostate cancer. J Natl Cancer Inst 2012; 104(4): 273 – 279. doi: 10.1093/ jnci/ djr514.
21. Schuster SJ, Neelapu SS, Gause BL et al. Vaccination with patient ‑ specific tumor ‑ derived antigen in first remission improves disease‑free survival in follicular lymphoma. J Clin Oncol 2011; 29(20): 2787 – 2794. doi: 10.1200/ JCO.2010.33.3005.
22. Porter DL, Hwang WT, Frey NV et al. Chimeric antigen receptor T cells persist and induce sustained remissions in relapsed refractory chronic lymphocytic leukemia. Sci Transl Med 2015; 7(303): 303ra139. doi: 10.1126/ scitranslmed.aac5415.
23. Maude SL, Teachey DT1, Porter DL et al. CD19 - targeted chimeric antigen receptor T ‑ cell therapy for acute lymphoblastic leukemia. Blood 2015; 125(26): 4017 – 4023. doi: 10.1182/ blood ‑ 2014 ‑ 12 ‑ 580068.
24. Kochenderfer JN, Dudley ME, Kassim SH et al. Chemotherapy ‑ refractory diffuse large B ‑ cell lymphoma and indolent B ‑ cell malignancies can be effectively treated with autologous T cells expressing an anti‑CD19 chimeric antigen receptor. J Clin Oncol 2015; 33(6): 540 – 549. doi: 10.1200/ JCO.2014.56.2025.
25. Klebanoff CA, Yamamoto TN, Restifo NP. Immunotherapy: treatment of aggressive lymphomas with anti‑CD19 CAR T cells. Nat Rev Clin Oncol 2014; 11(12): 685 – 686. doi: 10.1038/ nrclinonc.2014.190.
26. Mardiros A, Dos Santos C, McDonald T. T cells expressing CD123 - specific chimeric antigen receptors exhibit specific cytolytic effector functions and antitumor effects against human acute myeloid leukemia. Blood 2013; 122(18): 3138 – 3148. doi: 10.1182/ blood ‑ 2012 ‑ 12 ‑ 474056.
Labels
Paediatric clinical oncology Surgery Clinical oncology
Article was published inClinical Oncology

2015 Issue Supplementum 3-
All articles in this issue
- Molekulární prognostické markery chronické lymfocytární leukemie a jejich klinický význam
- Význam minimální zbytkové nemoci u chronické lymfocytární leukemie
- Monoklonální protilátky v léčbě chronické lymfocytární leukemie v roce 2015
- Léčebné možnosti pro nemocné s chronickou lymfocytární leukemií a významnými přidruženými chorobami
- Léčba chronické lymfocytární leukemie s aberací TP53
- Malé molekuly v léčbě chronické lymfocytární leukemie v roce 2015 a v blízké budoucnosti
- Aktuality v podpůrné léčbě chronické lymfocytární leukemie
- Maligní lymfomy − minulost, současnost a budoucnost
- Difuzní velkobuněčný B lymfom – moderní způsoby diagnostiky a molekulárně cílené léčby
- Folikulární lymfom
- Lymfom z plášťových buněk – současný stav poznání a možnosti léčby
- Hodgkinův lymfom – vývoj léčebných přístupů a současné trendy
- Záchranná léčba a role transplantací u lymfomů
- Současné možnosti imunoterapie nádorových onemocnění
- Clinical Oncology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Difuzní velkobuněčný B lymfom – moderní způsoby diagnostiky a molekulárně cílené léčby
- Folikulární lymfom
- Lymfom z plášťových buněk – současný stav poznání a možnosti léčby
- Hodgkinův lymfom – vývoj léčebných přístupů a současné trendy
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career