-
Medical journals
- Career
Vyšetření párů těžkých/ lehkých řetězců imunoglobulinu (Hevylite™ assay) – přínos pro stratifikaci mnohočetného myelomu?
Authors: V. Ščudla 1; P. Lochaman 2; T. Pika 3; J. Zapletalová 4; J. Minařík 3; J. Bačovský 3
Authors‘ workplace: III. interní klinika – nefrologická, revmatologická a endokrinologická LF UP a FN Olomouc 1; Oddělení klinické biochemie, FN Olomouc 2; Hemato‑ onkologická klinika LF UP a FN Olomouc 3; Ústav lékařské biofyziky, LF UP v Olomouci 4
Published in: Klin Onkol 2015; 28(5): 359-369
Category: Original Articles
doi: https://doi.org/10.14735/amko2015359Overview
Východiska:
Cílem bylo srovnání dvou nových stratifikačních modelů mnohočetného myelomu (multiple myeloma – MM), tj. podle Avet ‑ Loisiaua (A ‑ L) a podle Ludwiga (L) založených na indexu HLC ‑ r (poměr sérových hladin involved ‑ HLC/ uninvolved ‑ HLC tj. HLC ‑ κ/ HLC ‑ λ vyšetřených metodou Hevylite™, tj. nefelometrickou/turbidimetrickou technikou s pomocí specifických polyklonálních protilátek na přístroji Binding Site SPAPLUS) a β2 ‑ mikroglobulinu (β2 ‑ M) s vybranými prognostickými faktory (PF) MM a stážovacími systémy dle Durieho ‑ Salmona (D ‑ S) a International Staging System (ISS).Soubor pacientů a metody:
V 132členné sestavě nemocných (94 IgG a 38 IgA typ MM) byl vyšetřen při diagnóze HLC ‑ r, vybrané PF a byla provedena stratifikace souboru podle D ‑ S, ISS, A ‑ L a L.Výsledky:
Na rozdíl od IgA byl u IgG izotypu zjištěn signifikantní vztah HLC ‑ r k stratifikaci dle D ‑ S a ISS s rozdílností podstadií A vs. B dle D ‑ S (p = 0,049) a mezi ISS stadii 1 vs. 3 (p = 0,001). V souboru IgG byl vysoce signifikantní souhrnný vztah hloubky poklesu Hb i albuminu a vzestupu β2 ‑ M k výsledkům stratifikace dle ISS, A ‑ L a L modelu (p < 0,0001), vzestupu LDH v systému dle ISS a A ‑ L a kreatininu dle ISS a L, nikoliv ale vztah stadií vyhodnocených podle kteréhokoliv stratifikačního systému k hodnotám FLC ‑ r (poměr volných lehkých řetězců imunonoglobulinu κ/ λ), trombocytů a Ca. V souboru IgA byl signifikantní souhrnný vztah hloubky poklesu Hb, trombocytů, albuminu a vzestupu β2 ‑ M k výsledkům stratifikace dle ISS, A ‑ L a L, k vzestupu kreatininu v případě ISS, nikoliv ale hodnot FLC ‑ r, Ca a LDH při použití kteréhokoliv stratifikačního modelu. Stupeň korelace vybraných PF, zejména Hb, albuminu a β2 ‑ M, případně i trombocytů, LDH a kreatininu ke stadiím dle ISS a k 1. – 3. rizikové kategorii podle modelu A ‑ L a L byl u IgG vs. IgA izotypu značně proměnlivě rozdílný (p < 0,0001 – 0,030). Stážovací systém dle ISS se vyznačoval proporcionálním zastoupením stadií 1 – 3, zatímco v A ‑ L modelu převažovala u IgG i IgA izotypu riziková kategorie 2, tj. intermediate risk (47,3 a 44,7 %) a v modelu dle L riziková kategorie 3, tj. high‑risk (41,5 a 52,6 %) s nízkým zastoupením kategorie 1, tj. low ‑ risk (23,4 a 10,5 %). McNemar ‑ Bowkerův test symetrie prokázal v obou izotypech MM nejvyšší shodu mezi stratifikací dle D ‑ S a L v kategorii 3, tj. high‑risk (31,9 a 28,9 %) s celkovou shodou pouze v 53,2 a 42,1 % a se signifikantním posunem v případě IgG izotypu (p = 0,036). U IgG i IgA izotypu byla souhrnná shoda v zastoupení kategorií 1 – 3 dle ISS vs. A ‑ L (62,4 a 63,2 %), ale se signifikantním posunem stratifikace (p = 0,002 a 0,028). V případě IgG i IgA izotypu byla úzká shoda mezi modely dle A ‑ L a L (64,5 a 81,6 %) se signifikantně významným vzájemným stratifikačním posunem (p < 0,0001 a 0,030).Závěr:
Nové stratifikační modely MM dle A ‑ L a L jsou snadno prakticky použitelné, podložené úzkým vztahem k stěžejním PF MM, vyžadují ale separátní hodnocení u IgG a IgA izotypu MM. Výběr optimálního modelu pro potřeby klinické praxe vyžaduje validační studii zaměřenou na přežití do progrese a celkové přežívání.Klíčová slova:
mnohočetný myelom – volné lehké řetězce imunoglobulinu – těžké/lehké řetězce imunoglobulinu – prognóza – stratifikaceÚvod
Pokroky v diagnostice a léčbě mnohočetného myelomu (multiple myeloma – MM) přinášejí stále vyšší nároky na precizní stratifikaci, stěžejní východisko individuálně pojaté léčby a odhadu prognózy. Charakteristickým rysem MM je tvorba monoklonálního imunoglobulinu (MIg) myelomovými/ monoklonálními plazmocyty provázená sníženou produkcí normálních/ polyklonálních imunoglobulinů (PIg) normálními plazmocyty [1,2]. Vzhledem k závažným limitacím standardních metod analýzy sérových bílkovin u MM v případě nízké hladiny MIg, IgA izotypu MIg, při změnách objemu plazmy, hematokritu a v důsledku odlišné intenzity katabolizmu jednotlivých tříd Ig byla vyvinuta technika Hevylite™ umožňující s pomocí specifických protilátek proti junkčním epitopům umístěným mezi těžkým a lehkým řetězcem Ig vyšetření párů těžkých/ lehkých řetězců Ig κ a λ (HLC ‑ κ a HLC ‑ λ) [3 – 9]. Hevylite™ turbidimetrická nebo nefelometrická technika umožňuje současné separátní stanovení sérových hladin MIg vytvářeného myelomovými plazmocyty („nádorový“, involved HLC – i ‑ HLC) a PIg („polyklonální/ normální“, uninvolved HLC – u ‑ HLC) stejné třídy produkovaného normálními plazmocyty. Vedle současného stanovení i ‑ HLC a u ‑ HLC izotypů IgG ‑ κ, IgG‑λ nebo IgA ‑ κ a IgA‑λ je v případě MM využíváno rovněž stanovení indexu HLC ‑ r vyjadřujícího vzájemný poměr dominantního i ‑ HLC a alternativního u ‑ HLC [3,4]. Na rozdíl od dosavadních studií využívajících ke stanovení HLC ‑ r vždy poměr HLC ‑ κ/ HLC ‑ λ, což vede v případě i ‑ HLC typu λ k získání velmi nízkých a obtížně interpretovatelných hodnot [3,6], byl v naší studii v případě analýzy vztahu vybraných prognostických ukazatelů MM k výsledkům stratifikace myelomu (kategorie 1 – 3) použit pro výpočet indexu HLC ‑ r v případě izotypu IgG ‑ λ a IgA ‑ λ poměr HLC ‑ λ/ HLC ‑ κ, tj. obdobný princip jako pro výpočet indexu monoklonality sFLC κ/ λ nebo λ/ κ [1,3,4] vedoucí k získání kladných, snadno použitelných hodnot. V posledních čtyřech desetiletích bylo zkoncipováno > 40 stratifikačních systémů rozdělujících nemocné s MM obvykle do tří stadií nebo rizikových skupin s odlišnou prognózou. Standardní stratifikační systémy dle Durieho ‑ Salmona (D ‑ S) a International Staging System (ISS) používané doposud v klinické praxi nejsou optimální, neboť bezprostředně nevyjadřují biologické vlastnosti myelomových buněk a mikroprostředí kostní dřeně (KD) [2,10], zatímco molekulárně‑biologické stratifikační modely založené na cytogenetické analýze a hodnotách cyklinu, tj. systém TC 1 – 5 [11], a na výsledcích genové expresní analýzy [12] se pro vysokou metodickou náročnost v klinické praxi neprosadily. V roce 2009 Avet ‑ Loisiau (A ‑ L) a v roce 2013 Ludwig (L) zkoncipovali nově pojaté třístupňové stratifikační modely založené na hodnotách β2 ‑ M (β2 ‑ mikroglobulin) a indexu HLC ‑ r, vyznačující se v pilotních studiích významným vztahem k přežití bez progrese (progression free survival – PFS) a celkovému přežití (overall survival – OS) [13 – 15].
Náplní sdělení je posouzení vztahu stratifikačních modelů dle A ‑ L a podle Lke klasickým prognostickým faktorům (PF) MM a ke stážovacím systémům dle D ‑ S a ISS [2,10,13 – 16]. Vzhledem k biologické rozdílnosti IgG a IgA izotypu MM, prokázané mj. i v rámci předchozích Hevylite™ studií, byla použita separátní analýza souborů s IgG a IgA izotypem MM [3,17 – 21].
Soubor nemocných a metody
Základem prospektivní studie byla 163členná sestava nemocných s MM splňujících diagnostická kritéria International Myeloma Working Group (IMWG); medián věku byl 68 (29 – 89) let, poměr M/ Ž 0,91 [2,10,22]. Pro nepřítomnost intaktní molekuly MIg (Bence ‑ Jonesův a nesekreční typ MM) a omezené spektrum specifických Hevylite™ souprav (nikoliv pro IgD a biklonální typ MM) bylo z analýzy vyloučeno 31 (19 %) jedinců. Hevylite™ analýza sér zmražených na – 78 °C, deponovaných v biobance Oddělení klinické biochemie a Hemato ‑ onkologické kliniky FN Olomouc, se zaměřila na 132členný soubor složený z 94 nemocných třídy IgG (71,2 %) a 38 nemocných (28,8 %) třídy IgA (poměr κ/ λ 1,9) vyšetřených při diagnóze MM. Koncentrace MIg byla vyšetřena přístrojem Sebia Hydrasy (souprava Sebia Hydragel 30 Protein) s kvantifikací M ‑ gradientu s pomocí skeneru Epson 1680, IFE byla prováděna soupravou Hydragel 4 IF.Hladiny volných lehkých řetězců (FLC) v séru byly vyšetřeny soupravami Freelite SPA Plus κ free (normální rozmezí 3,3 – 19,4 mg/ l) a Freelite SPA Plus λ free (5,7 – 26,3 mg/ l) a vyšetření bylo doplněné výpočtem indexu monoklonality FLC ‑ r (0,26 – 1,65) [3,4]. Koncentrace HLC v séru byla vyšetřena turbidimetrem SPA Plus (the Binding Site) soupravami Hevylite Human s hodnotami normálního rozmezí: IgG ‑ κ 3,84 – 12,07 g/ l, IgG ‑ λ 1,91 – 6,74 g/ l, poměr IgG ‑ κ/ IgG ‑ λ 1,12 – 3,21, IgA ‑ κ 0,57 – 2,08 g/ l, IgA ‑ λ 0,44 – 2,04 g/ l a poměr IgA ‑ κ/ IgA ‑ λ 0,78 – 1,98. Část vzorků vyžadovala vzhledem k vysoké koncentraci HLC převyšující měřicí rozsah přístroje manuální předředění. Sérové hladiny β2 ‑ M byly vyšetřeny metodou ELISA (< 2,3 mg/ l), hodnoty Hb a trombocytů v krvi, Ca, albuminu, kreatininu a LDH v séru byly vyšetřeny standardními postupy. K základní stratifikaci MM byl použit stážovací systém dle D ‑ S a ISS [2,22], ke stratifikaci do rizikových skupin byly použity modely dle A ‑ L a L. Dle A ‑ L se vyznačovala riziková skupina 1 (low ‑ risk) přítomností β2 ‑ M < 3,5 a hodnotou HLC ‑ r v rozmezí 0,01 – 200, skupina 2 (intermediate-risk) buď hodnotou β2 ‑ M ≥ 3,5, nebo HLC ‑ r < 0,01 nebo > 200 a skupina 3 (high‑risk) současnou přítomností hodnoty β2 ‑ M ≥ 3,5 a HLC ‑ r < 0,01 nebo > 200 [13,14,16]. Ve stratifikačním modelu MM dle L se vyznačovala riziková skupina 1 (low ‑ risk) přítomností hodnoty β2 ‑ M < 3,5 a HLC ‑ r v rozmezí 0,022 – 45, riziková kategorie 2 (intermediate-risk) hodnotou β2 ‑ M ≥ 3,5 nebo HLC ‑ r < 0,022 nebo > 45, zatímco riziková kategorie 3 (high‑risk) současnou přítomností hodnot β2 ‑ M ≥ 3,5 a HLC ‑ r << 0,022 nebo > 45 [15]. Nemocní zařazení do studie podepsali informovaný souhlas, design studie byl schválen etickou komisí FN Olomouc.
Získaná data byla analyzována pomocí statistického software SPSS verze 15(SPSS Inc., Chicago, USA). K analýze byl použit test dle Kruskala ‑ Wallise, Mann ‑ Whitneyův post hoc test s Bonferroniho korekcí signifikance na mnohonásobné porovnávání a McNemarův ‑ Bowkerův test symetrie. Normalita dat byla posouzena pomocí Shapiro‑Wilk testu. Všechny testy byly prováděny na hladině signifikance 0,05.
Výsledky
Základní charakteristiky (mediány a rozmezí analyzovaných hodnot) celého 132členného souboru nemocných s MM a dvou podsouborů IgG a IgA jsou shrnuty v tab. 1. Abnormální hodnoty jednotlivých laboratorních parametrů měly v celkové sestavě MM podstatně rozdílné zastoupení: patologické hodnoty indexu HLC ‑ r 98 % a FLC ‑ r 96,2 % souboru, hodnota Hb < 120 g/ l 80,3 % a trombocytů < 150 × 109/ l pouze 19,6 %, hodnota Ca > 2,9 mmol/ l 7,5 %, albuminu < 35 g/ l 47,7 %, β2 ‑ M > 2,3 mg/ l 81 %, LDH > 3,6 µkat/ l 16,6 % a kreatininu séra > 104 µmol/ l 39,3 %. Rozbor vztahu mezi abnormální hodnotou indexu xHLC ‑ r a stupněm pokročilosti MM vyhodnoceném s pomocí stážovacího systému dle D ‑ S a ISS v souboru IgG prokázal na rozdíl od souboru IgA zvyšování hodnot mediánů xHLC ‑ r s pokročilostí nemoci, statistická analýza proto vyzněla u obou izotypů MM zřetelně rozdílně. V IgG souboru byla na rozdíl od souboru IgA zjištěna při souhrnné analýze celé stratifikace metodou dle Kruskala ‑ Wallise statisticky významná rozdílnost hodnot xHLC ‑ r (tab. 2). Hlubší analýza s pomocí U testu dle Mann ‑ Whitneye prokázala signifikantně vyšší hodnoty xHLC ‑ r v podstadiu B vs. A (dle D ‑ S) a při použití stratifikace dle ISS ve stadiu 3 nežli stadiu 1.
Table 1. Základní charakteristiky IgG, IgA a celkového souboru nemocných s MM vyšetřeném při rozpoznání nemoci. 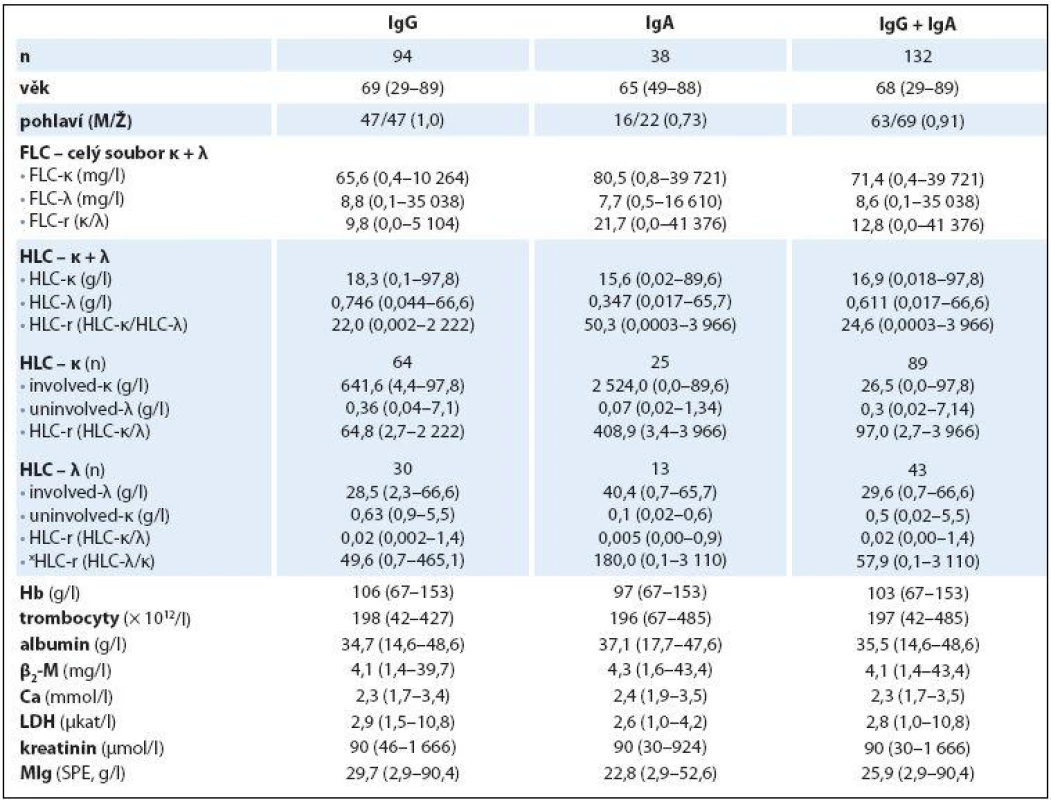
n – počet nemocných, M – muži, Ž – ženy, FLC – volné lehké řetězce, HLC – pár těžkých/lehkých řetězců imunoglobulinu, HLC-r – poměr involved-HLC-κ/uninvolved-HLC-λ, xHLC-r – poměr involved-HLC-λ/uninvolved-HLC-κ, β2-M – β2-mikroglobulin, LDH – laktátdehydrogenáza, MIg – monoklonální imunoglobulin, SPE – elektroforéza séra Table 2. Hodnocení vztahu indexu HLC-r ke stadiím MM 1–3 dle Durieho-Salmona (D-S) a podle International Staging System (ISS). 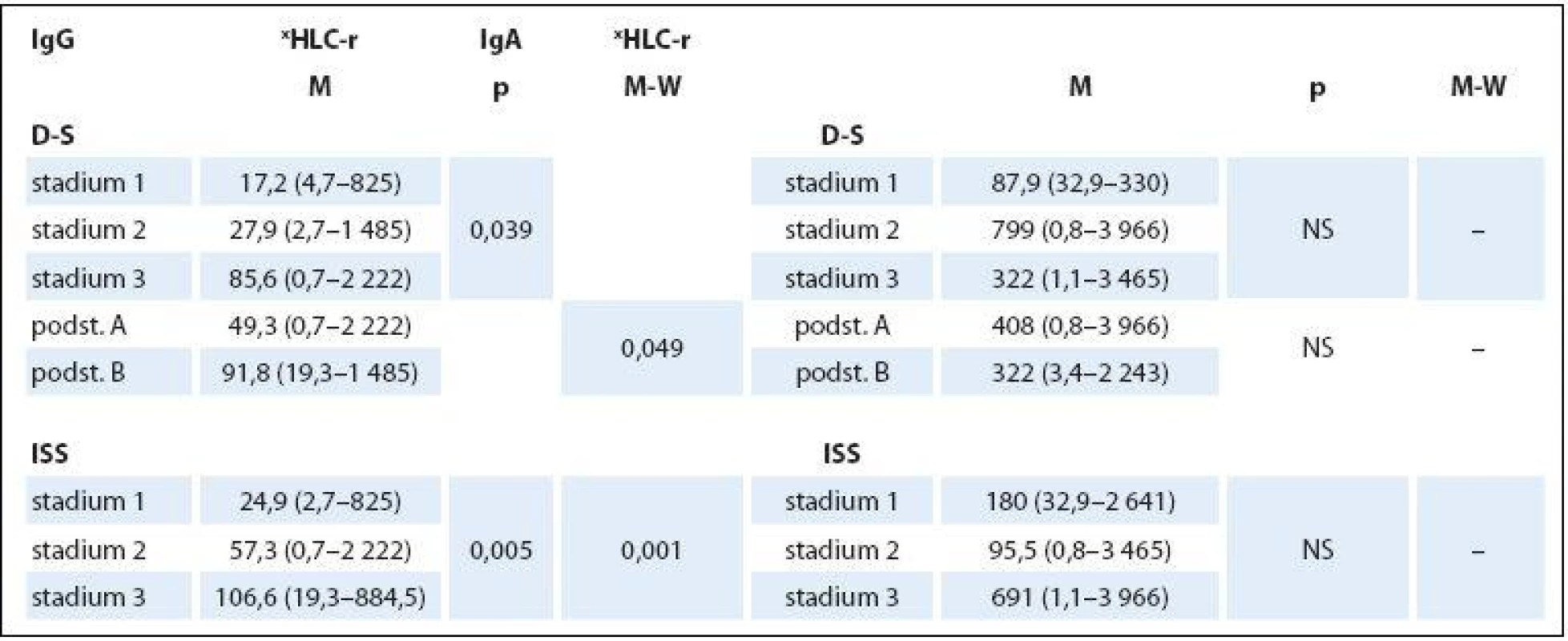
HLC-r – poměr párů těžkých/lehkých řetězců imunoglobulinu κ a λ (HLC-κ/λ), M – medián, D-S – stážovací systém dle Durieho-Salmona, ISS – International Staging System, M-W – test dle Mann-Whitneye, NS – nesignifikantní význam Analýza vztahu hodnot vybraných laboratorních PF k rizikovým skupinám MM 1 – 3 vyhodnocených s pomocí stratifikačního modelu dle A ‑ L, podle L a se standardně zavedeným stážovacím systémem dle ISS prokázala u jednotlivých PF, stratifikačních systémů a izotypů MM rozdílné výsledky (tab. 3). V souboru IgG byla zjištěna při souborné analýze rizikových skupin 1 – 3 s pomocí testu dle Kruskala ‑ Wallise shodně u všech tří stratifikací (ISS, A ‑ L a L) vysoce signifikantní rozdílnost hodnot Hb, albuminu a β2 ‑ M (< 0,0001), signifikantní rozdílnost hodnot LDH při použití systému dle ISS a A ‑ L a kreatininu v případě ISS a L. Vyhodnocení indexu monoklonality FLC ‑ r, počtu trombocytů a hodnot Ca v séru vyznělo nesignifikantně. Hlubší analýza IgG souboru s použitím U post hoc testu dle Mann ‑ Whitneye prokázala různě výraznou signifikantní rozdílnost hodnot Hb mezi všemi stadii (1, 2 a 3) při použití stratifikačního modelu dle ISS, A ‑ L a L a s výjimkou stadií 2 vs. 3 i v případě β2 ‑ M. V případě kreatininu byly významně odlišné hodnoty ve všech stadiích dle ISS, nikoliv ale mezi rizikovými skupinami 2 vs. 3 dle A ‑ L a L. V případě albuminu nebyla v případě stratifikace dle ISS a A ‑ L signifikantní rozdílnost mezi kategoriemi 2 vs. 3, v případě modelu dle L mezi 1 vs. 2. Na rozdíl od stratifikace dle A ‑ L a L byl zaznamenán významný rozdíl hladin LDH mezi stadii 2 vs. 1 a vs. 3 v případě stážování dle ISS, nikoliv ale při vyhodnocení počtu krevních destiček (tab. 4). V souboru IgA byla zjištěna při souborné analýze všech tří stadií/ rizikových skupin s pomocí testu dle Kruskala ‑ Wallise s použitím stratifikace dle ISS, A ‑ L a L signifikantní rozdílnost hodnot Hb, trombocytů, albuminu a β2 ‑ M a v případě ISS i kreatininu, zatímco hodnocení FLC ‑ r, Ca a LDH vyznělo ve všech stratifikacích nevýznamně (tab. 5). Hlubší analýza souboru IgA s použitím U post hoc testu dle Mann ‑ Whit-neye prokázala signifikantně nižší hodnoty Hb při použití ISS stratifikace pouze mezi stadii 1 vs. 3, zatímco v případě aplikace modelu dle A ‑ L v rizikových skupinách 2 a 3 vs. 1, v modelu dle L nižší hodnoty Hb v rizikové skupině 3 vs. 1 i 2 (tab. 6). V případě β2 ‑ M byla rozdílnost hladin s výjimkou rizikových kategorií 2 vs. 3 dle A ‑ L signifikantní mezi všemi kategoriemi dle ISS, A ‑ L a L. V případě počtu krevních destiček a hladiny albuminu byly patrny signifikantně nižší hodnoty v kategoriích 3 vs. 1 dle ISS i A ‑ L a 3 vs. 2 dle L, v případě albuminu navíc i ve stadiu 2 vs. 1 dle ISS a trombocytů ve stadiu 3 vs. 2 dle A ‑ L. V případě kreatininu byla odhalena signifikantně vyšší hodnota ve stadiu 3 vs. 2 a vs. 1 dle ISS. V případě hladin FLC ‑ r, Ca a LDH nebyl zaznamenán v IgA souboru mezi dílčími kategoriemi 1 – 3 vyčleněnými podle ISS, A ‑ L a L žádný signifikantní vztah. Doplňková analýza věnovaná stážovacímu systému dle D ‑ S prokázala v souboru IgG s pomocí Mann ‑ Whitneyho testu signifikantně vyšší hodnoty Hb, albuminu a β2 ‑ M ve stadiích 3 vs. 1 a vs. 2 s absencí rozdílnosti FLC ‑ r, trombocytů, Ca, LDH a kreatininu (tab. 4). V souboru IgA byly shledány s pomocí Mann ‑ Whitneyho testu v případě stratifikace dle D ‑ S signifikantně vyšší hodnoty Hb a nižší β2 ‑ M ve stadiu 1 vs. 2 i 3 a nižší hodnoty albuminu ve stadiu 3 vs. 1, zatímco v případě FLC ‑ r, trombocytů, Ca, LDH a kreatininu nebyly signifikantně významné rozdíly zachyceny (tab. 6).
Table 3. Souborná analýza vztahu vybraných prognostických laboratorních ukazatelů mnohočetného myelomu k stadiím (dle Durieho-Salmona – D-S a International Staging System – ISS) a rizikovým skupinám 1–3 vyhodnoceným podle Avet-Loisiaua (A-L) a Ludwiga (L) s pomocí Kruskalova-Wallisova testu v souboru 94 nemocných s IgG typem myelomu. 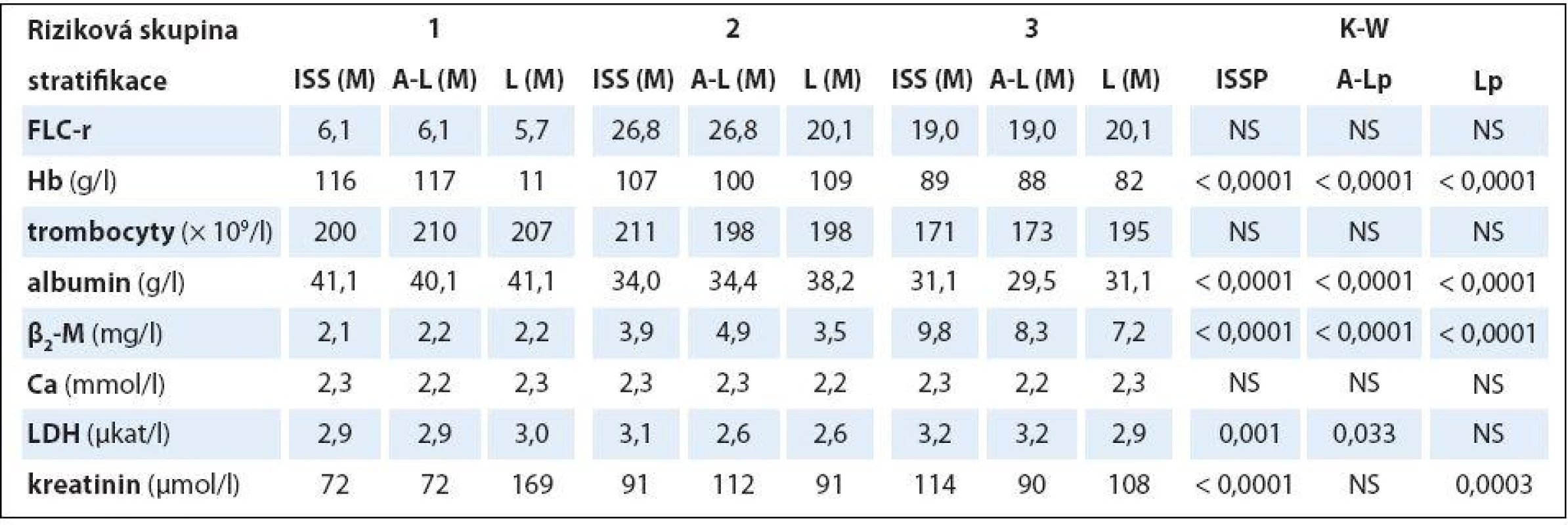
K-W – test dle Kruskala-Wallise, ISS – stážovací systém dle International Staging System, A-L – stratifikace do rizikových skupin dle Avet- -Loisiaua, L – stratifikace dle Ludwiga, FLC-r –index monoklonality vyjadřující poměr sérových hladin volných lehkých řetězců imunoglobulinu κ/λ, Hb – hemoglobin, β2 -M– β2-mikroglobulin, LDH – laktátdehydrogenáza, NS – nesignifikantní význam, M – medián Table 4. Analýza rozdílnosti hodnot vybraných laboratorních ukazatelů mezi jednotlivými klinickými stadii (dle Durieho-Salmona – D-S a International Staging System – ISS) a rizikovými skupinami 1–3 vyhodnocenými podle Avet-Loisiaua (A-L) a Ludwiga (L) s pomocí Mann-Whitneyova post hoc U testu signifikance s Bonferroniho korekcí v souboru 94 nemocných s IgG typem MM. 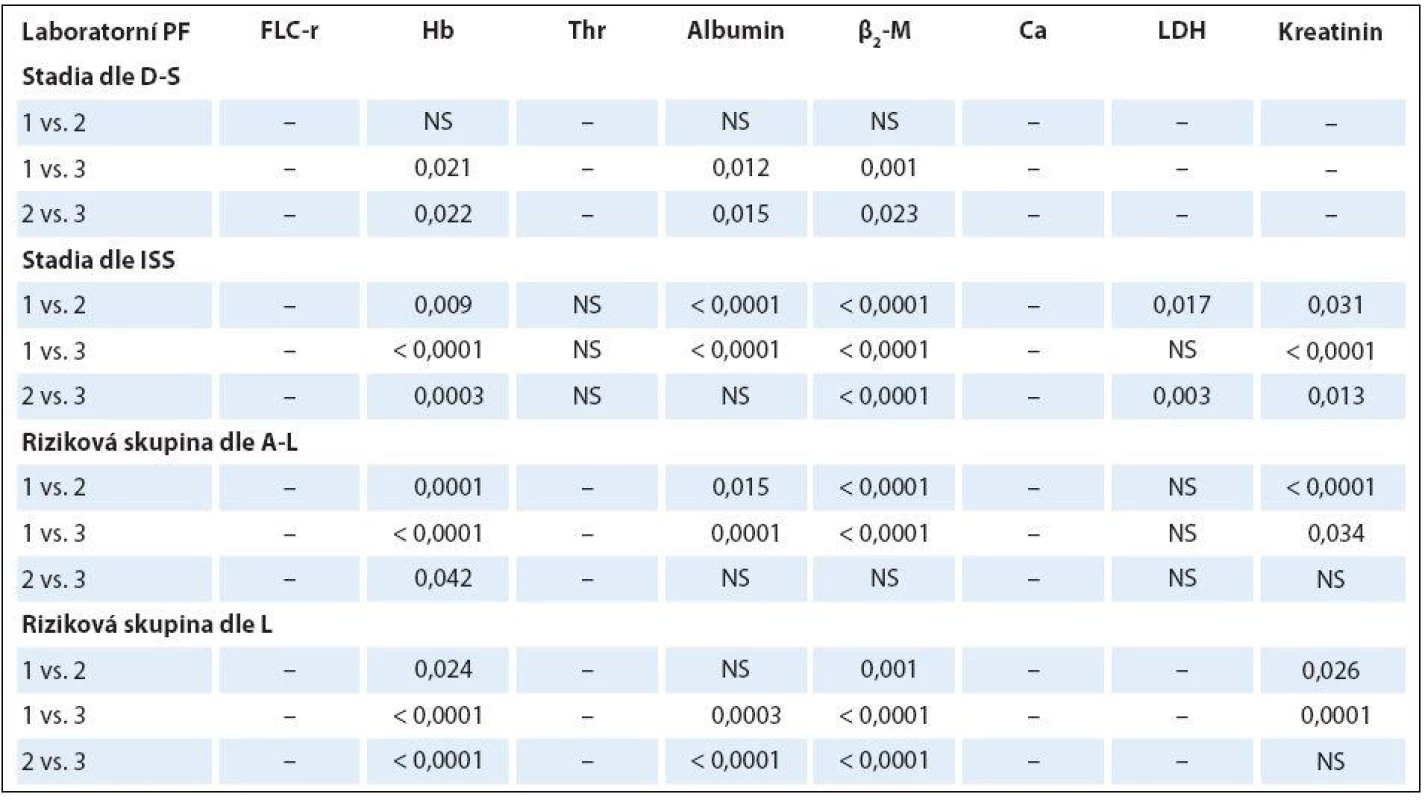
PF – prognostické faktory, D-S – stážovací systém dle Durieho-Salmona, ISS – stážovací systém dle International Staging System, A-L – stratifikace do rizikových skupin dle Avet-Loisiaua, L – stratifikace do rizikových skupin dle Ludwiga, FLC-r – index monoklonality vyjadřující poměr sérových hladin volných lehkých řetězců imunoglobulinu κ/λ, Hb – hemoglobin, Thr – trombocyty, β2-M – β2-mikroglobulin, LDH – laktátdehydrogenáza, NS – nesignifikantní význam Table 5. Souborná analýza vztahu vybraných prognostických laboratorních ukazatelů MM k stadiím (dle Durieho-Salmona – D-S a International Staging System – ISS) a rizikovým skupinám 1–3 vyhodnoceným podle Avet-Lousiaua (A-L) a Ludwiga (L) s pomocí Kruskalova-Wallisova testu v souboru 38 nemocných s IgA typem myelomu. 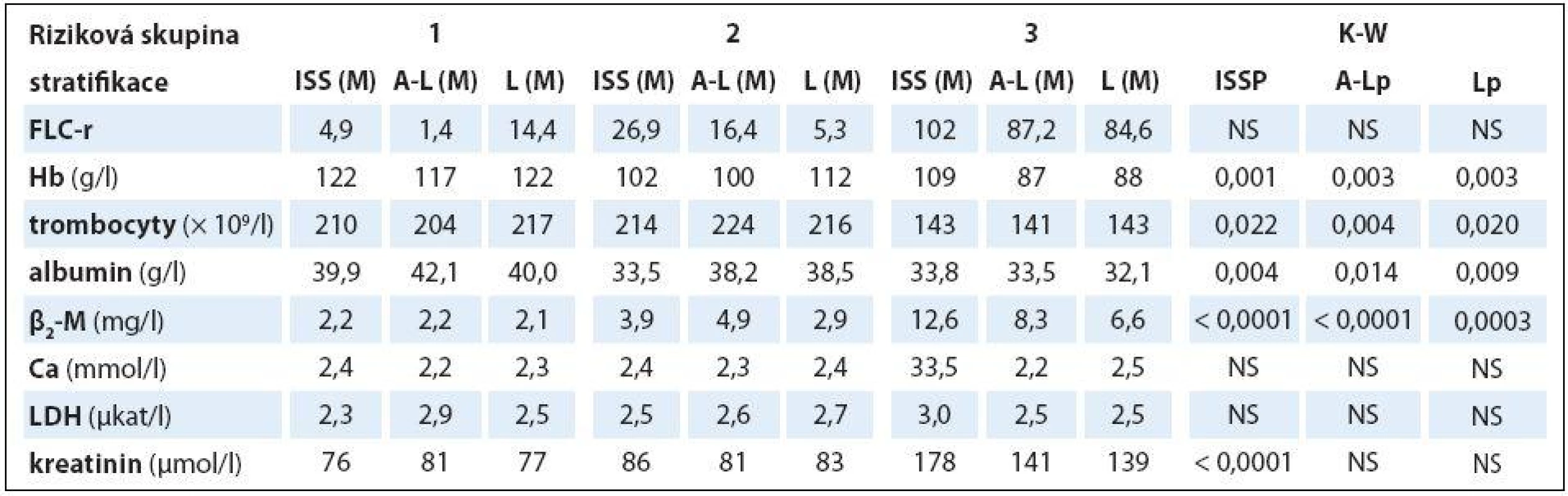
K-W – test dle Kruskala-Wallise, ISS – stážovací systém dle International Staging System, A-L – stratifikace do rizikových skupin dle Avet- -Loisiaua, L – stratifikace dle Ludwiga, FLC-r –index monoklonality vyjadřující poměr sérových hladin volných lehkých řetězců imunoglobulinu κ/λ, Hb – hemoglobin, β2-M – β2-mikroglobulin, LDH – laktátdehydrogenáza, NS – nesignifikantní význam, M – medián Table 6. Analýza rozdílnosti hodnot vybraných laboratorních ukazatelů mezi jednotlivými klinickými stadii (dle Durieho-Salmona – D-S a International Staging System – ISS) a rizikovými skupinami 1–3 vyhodnocenými podle Avet-Loisiaua (A-L)a Ludwiga (L) s pomocí Mann-Whitneyova post hoc U testu signifikance s Bonferroniho korekcí v souboru 38 nemocných s IgA typem MM. 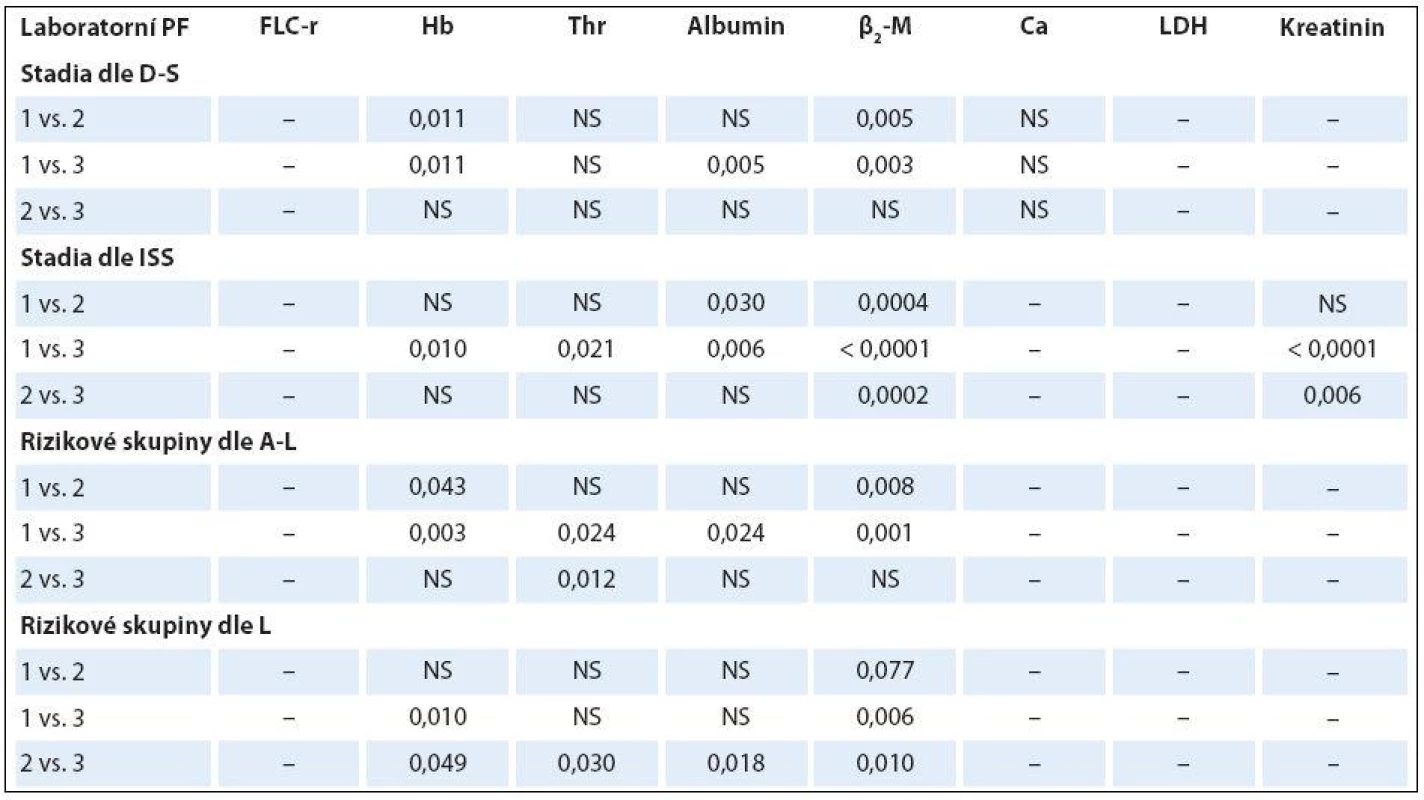
PF – prognostické faktory, D-S – stážovací systém dle Durieho-Salmona, ISS – stážovací systém dle International Staging System, A-L – stratifikace do rizikových skupin dle Avet-Loisiaua, L – stratifikace do rizikových skupin dle Ludwiga, FLC-r – index monoklonality vyjadřující poměr sérových hladin volných lehkých řetězců imunoglobulinu κ/λ, Hb – hemoglobin, Thr – trombocyty, β2-M – β2 -mikroglobulin, LDH – laktátdehydrogenáza, NS – nesignifikantní význam Rozdílné zastoupení klinických stadií 1 – 3 vyhodnocených s pomocí stážovacích systémů dle D ‑ S a ISS a rizikových skupin vyčleněných s pomocí modelů dle A ‑ L a podle L v souborech IgG a IgA vyplývá z grafu 1. Výsledky srovnávací analýzy stratifikace IgG a IgA souborů MM provedené s pomocí McNemar ‑ Bowkerova testu symetrie jsou zachyceny v tab. 7. Srovnáním stratifikačního modelu dle A ‑ L se standardním stážováním dle D ‑ S byla u IgG a IgA typu MM zaznamenána klasifikační shoda v 37,6 a 34,2 %, s ISS v 62,4 a 63,2 % a s modelem dle L v 64,5 a 81,6 %, zatímco v případě stratifikačního modelu dle L s D ‑ S systémem v 53,2 a 42,1 %, s ISS v 55,3 a 50,0 %. Posun do vyššího stadia byl při srovnání stratifikačního modelu dle A ‑ L se stážováním dle D ‑ S v IgG a IgA souboru MM zaznamenán pouze v 6,5 a 26,3 %, s ISS v 7,5 a 26,3 % a s modelem dle L u žádného nemocného, zatímco v případě modelu dle L vůči D ‑ S v 13,8 a 31,6 % oproti ISS v 28,7 a 42,1 % a vůči A ‑ L v 35,5 %. Z tabelárního přehledu (tab. 7) jednoznačně vyplývá, že posun do vyššího stadia byl zaznamenán u IgG a IgA typu MM v případě srovnání systémů D ‑ S vs. A ‑ L (55,9 a 26,3 %) a ISS (30,1 a 10,5 %), systému dle L vs. D ‑ S (33 a 26,3 %) a ISS (16 a 7,9 %). Stratifikační posun byl statisticky vysoce významný v případě IgG typu MM při srovnání systému dle D ‑ S i ISS oproti modelu dle A ‑ L a méně významně D ‑ S vůči modelu dle L, zato stratifikační posun systémů dle ISS vs. L byl nesignifikantní. Stratifikační posun do vyššího stadia zjištěný v případě modelu dle L oproti modelu dle A ‑ L lišících se navzájem odlišnými hodnotami cut-offHLC ‑ r (< 0,022 nebo > 45 vs. < 0,01 nebo > 200) byl vysoce signifikantní v případě IgG (p < 0,0001), méně významný u IgA typu MM (p = 0,030) (tab. 7).
Graph 1. Vztah zastoupení stadií/rizikových kategorií 1–3 vyhodnocených s pomocí čtyř stratifikačních systémů (podle Durieho-Salmona – D-S, International Staging System – ISS, Avet-Loisiaua – A-L a Ludwiga – L) v souborech s MM typu IgG (n = 94) a IgA (n = 38). 
Table 7. Srovnání shodnosti a změny stratifikace MM do kategorií 1–3 s použitím čtyř stratifikačních systémů v souborech IgG a IgA s pomocí McNemar-Bowkerova testu (n = 132). 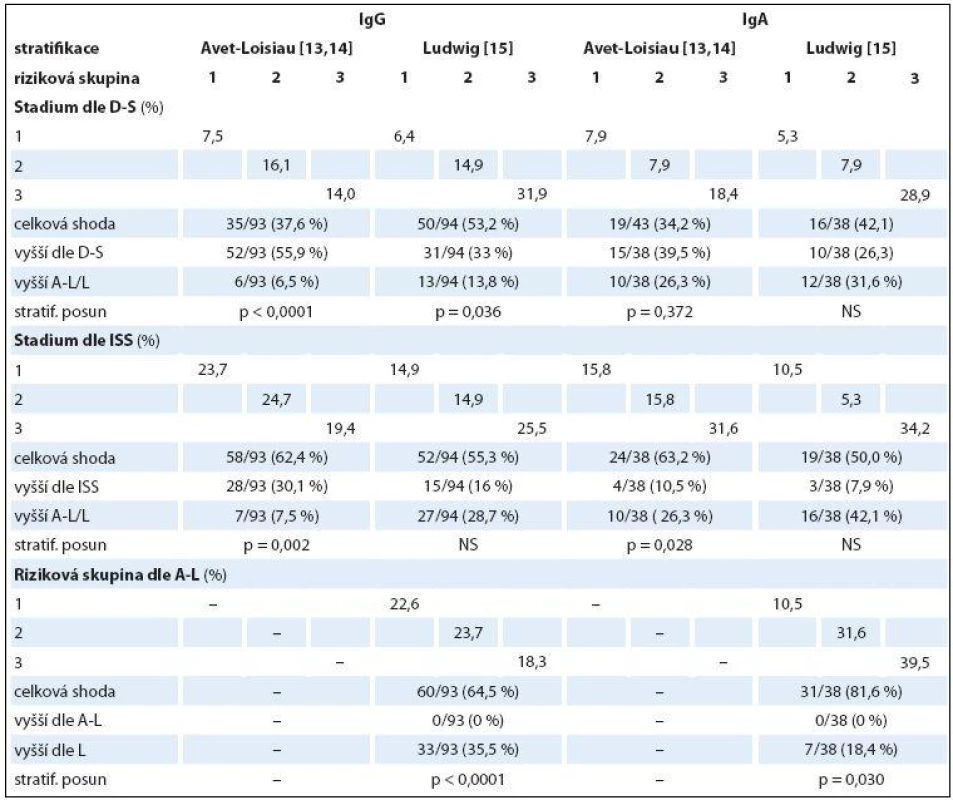
D-S – stážovací systém dle Durie-Salmona, ISS – stážovací systém dle International Staging System, A-L – stratifikační model dle Avet-Loisiau, L – stratifikační model dle Ludwiga, NS – nesignifikantní vztah Diskuze
Index HLC ‑ r vyšetřený pomocí metody Hevylite™ je ve srovnání s hodnotou MIg stanovenou s pomocí elektroforézy séra (SPE) neinvazivním, i když nepřímým ukazatelem výskytu myelomových (monoklonálních) vs. reziduálních normálních (polyklonálních) plazmocytů v KD [3,4]. Vzhledem k eliminaci zkreslení hodnot MIg a albuminu v důsledku změn krevního objemu a hematokritu i variability katabolického poločasu MIg závislého na saturaci neonatálních FcRn je Hevylite™ taktéž citlivější metodou v hodnocení rozsahu nádorové masy nežli SPE [3,4,16,19,20,22 – 26]. Izotypově specifická suprese PIg (u ‑ HLC) nasvědčuje, že v případě IgG izotypu MM „niche“ mikroprostředí KD je selektivně postiženo v důsledku proliferace myelomových buněk secernujících především IgG typ paraproteinu [16]. Statisticky signifikantní, obecně platný vztah výše indexu xHLC ‑ r k stadiím a s rozdílností v podstadiích A vs. B dle D ‑ S a stadií 1 – 3 dle ISS u IgG, nikoliv u IgA typu MM nasvědčuje platnosti vztahu výše indexu xHLC ‑ r k pokročilosti nemoci pouze u IgG izotypu MM. Signifikantní vztah xHLC ‑ r u IgG, nikoliv u IgA typu MM k tíži anémie, hypoalbuminemie a k hladinám β2 ‑ M, byl zaznamenán již v naší předchozí studii [18]. U IgA typu MM se hodnoty indexu xHLC ‑ r nechovaly v stadiích MM vyčleněných s pomocí D ‑ S a ISS konzistentně zřejmě v důsledku biologické odlišnosti IgG a IgA izotypu MM, podložené odlišnou syntézou a katabolizmem obou Ig a albuminu v organizmu [16,27]. Molekuly FcRn ochraňují IgG Ig a albumin před digescí v důsledku interference s recyklací a uvolňováním z povrchu buněk zpět do krevní cirkulace, což vede k prodloužení poločasu života IgG. V případě funkční insuficience FcRn receptorů a/ nebo vysoké koncentrace IgG Ig může být poločas života IgG a albuminu zkrácen až na tři dny, zatímco v případě normální koncentrace IgG Ig v rámci úplné protekce FcRn poločas prodloužen až na cca 21 dnů a v případě velmi nízkých hladin IgG může dosáhnout poločas života v důsledku maximální FcRn protekce až několika týdnů [3,23 – 25]. Vzhledem k tomu, že polyklonální i monoklonální frakce IgG jsou těmito ději postiženy obdobně, nejsou hodnoty HLC ‑ r podstatně ovlivněny a vyjadřují stupeň nádorové produkce přesněji nežli koncentrace M ‑ proteinu vyšetřená SPE [16]. Vzhledem k tomu, že β2 ‑ M je jednou z komponent lehkého řetězce heterodimerické FcRn, je i jeho molekula ovlivněna v procesu recyklace [3,23 – 26]. Biologická variabilita IgG a IgA izotypu Ig byla potvrzena výsledky prognosticky zaměřené studie L prokazující signifikantně významněji spojení mezi supresí u ‑ HLC a délkou OS u IgG nežli u IgA typu MM [19]. Biologickou odlišnost IgG a IgA izotopu HLC demonstruje rovněž prediktivní role zvýšené hodnoty indexu HLC ‑ r k rozvoji maligní transformace MGUS, určená především supresí u ‑ HLC opačného typu (např. supresí IgG ‑ λ u IgG ‑ κ typu MGUS), validní pro IgG, nikoliv pro IgA typ MGUS [28]. Absence predikčního potenciálu u IgA typu MGUS je zřejmě determinována absencí „niche“ efektu specifického pouze pro IgG typ MGUS [28]. Východiskem využití HLC ‑ r jako jednoho z kritérií nově navržených stratifikačních modelů dle A ‑ L a L je zřejmě jeho role markeru imunoparézy s prokázaným vztahem k PFS a OS [3,16,19,29,30]. S pomocí multivariantní Coxovy regresní analýzy bylo zjištěno, že hodnoty HLC ‑ r a β2 ‑ M mají ve srovnání s albuminem, FLC ‑ r a cytogenetickými nálezy typu del 13,t(4;14) a del 17p signifikantně významnější vztah k prognóze MM [14,16]. Vzhledem k tomu, že index HLC ‑ r je prediktorem kratší délky PFS na albuminu a β2 ‑ M, byl použit jako jedno z kritérií u obou nových stratifikačních modelů [3,13,14,16,31].
Nově sestavený stratifikační model vypracovaný A ‑ L [13,14], alternativní k ISS stážovacímu systému a vyznačující se záměnou albuminu za index HLC ‑ r se ve studii Bradwella [16], a to zejména v kategorii high‑risk, projevil prognosticky podstatně silnějším vztahem k PFS [16,32,33]. Dokladem obecné vhodnosti indexu HLC ‑ r pro prognostickou stratifikaci MG je rovněž jeho uplatnění spolu s β2 ‑ M a LDH v třístupňové stratifikaci Waldenströmovy choroby [34,35]. Chybějící signifikance vztahu hodnot indexu FLC ‑ r ke stadiím dle D ‑ S a ISS a zejména k rizikovým skupinám MM vyhodnoceným dle A ‑ L a L založených na hodnotě indexu HLC ‑ r vyplývá z odlišného metabolizmu a kinetiky FLC a HLC, a tím i indexů FLC ‑ r a HLC ‑ r, [15] a z diferentních biologických charakteristik FLC ‑ κ a FLC ‑ λ vyznačujících se odlišným syntetickým i katabolickým poločasem, vedoucím k rozdílnosti jejich přirozených sérových hladin [3,4]. Přestože s narůstající „rizikovostí“ kategorií MM vyhodnocenou podle A ‑ L a L byla v naší analýze IgG a IgA izotypu zřejmá tendence k vzestupu hodnot indexu FLC ‑ r, nedosáhla statistické signifikance.
Dokladem obecně platného biologického zázemí A ‑ L a L stratifikace k rizikovosti MM je většinou signifikantně vyjádřený vztah rizikových kategorií (low ‑ , intermediate ‑ a high‑risk) k laboratorním PF vyznačujícím se úzkým vztahem k náloži nádorové masy, tj. Hb, albuminu a kreatininu u IgG a poněkud méně významně se totéž týká Hb, trombocytů a albuminu v méně početném souboru s IgA izotypem MM. Převážně nesignifikantní vztah Ca a LDH, případně i trombocytů u IgG izotypu je vysvětlitelný nejen jejich přirozeně nižším prognostickým potenciálem, ale i nízkým zastoupením abnormálních hodnot v analyzované sestavě (7,5, 16,6 a 16,6 %), relativizující dosažené výsledky. Vysoká signifikance mezi hladinou β2 ‑ M a rizikovými skupinami dle A ‑ L a L v IgG a IgA souborech MM je logická a vyplývá z okolnosti, že jde o jedno z kritérií obou stratifikačních modelů. Naše zjištění, že oba stratifikační modely založené na indexu HLC ‑ r významně rezonují s klíčovými PF MM (Hb, albumin a kreatinin), je do značné míry kompatibilní se závěry jediné obdobně zkoncipované studie popisující signifikantní vztah vysokých, medián převyšujících hladin IgG, nikoliv IgA i ‑ HLC k tíži anémie (Hb < 100 g/ l), k hodnotám FLC ‑ r a albuminu převyšujícím vypočtený medián i > 50% infiltraci KD a v případě korelace s HLC ‑ r i s hodnotou β2 ‑ M > 3,5 mg/ l [7].
Z porovnání výsledků stratifikace souborů s odlišným izotypem MIg, tj. IgG a IgA s pomocí standardních stážovacích systémů (D ‑ S a ISS) a stratifikačních modelů založených na vyšetření HLC ‑ r (A ‑ L a L) vyplynula značná rozdílnost, patrná zejména v zastoupení stadií 1 a 3. Na rozdíl od vysoce proporciální stratifikace dle ISS s cca 30% zastoupením stadií 1 – 3 se vyznačoval stážovací systém dle D ‑ S dobře známou nerovnoměrností s malým zastoupením nemocných s nízkou (stadium 1) oproti nemocným s velkou nádorovou masou (stadium 3). Ve stratifikaci dle A ‑ L převažovala u IgG i IgA izotypu riziková kategorie 2 (intermediate ‑ risk), zatímco v modelu dle L dominovala kategorie 3 (high‑risk) s nízkým zastoupením kategorie 1 (low ‑ risk).
S pomocí McNemar ‑ Bowkerova testu byla zjištěna u IgG i IgA typu MM nejvyšší shoda mezi stratifikačními modely dle D ‑ S a L v kategorii 3 (high‑risk). Nápadnější shoda v rozprostření všech stadií (1 – 3), resp. rizikových kategorií (low ‑ , intermediate ‑ a high‑risk) byla zjištěna při srovnání stážování dle ISS se stratifikací dle A ‑ L, v menší míře i podle L především v souboru IgG. Při srovnání výsledků stratifikace modelů založených na hodnocení HLC ‑ r bylo zřejmé vyšší zastoupení kategorie 3 (high‑risk) v modelu dle L nežli podle A ‑ L u IgG i IgA typu MM (42 vs. 18 % a 53 vs. 39 %). V obou izotypech MM, zejména ale u IgA typu, byla zjištěna nejužší celková shoda ze všech stratifikací mezi oběma novými modely, tj. podle A ‑ L a L (IgG 64,5, IgA 81,6 %). Nutno připomenout, že kritéria rizikové skupiny 1 (low ‑ risk) v stratifikačním modelu dle A ‑ L i L se vyznačují hodnotou indexu HLC ‑ r, blížící se hodnotám normálního rozmezí a zahrnující převážně nemocné s normální hladinou u ‑ HLC, odpovídající dobrému zastoupení normálních/ polyklonálních plazmocytů a nízké hladině monoklonálního i ‑ HLC jako výrazu relativně nízkého zastoupení monoklonálních/ myelomových buněk [36].
Závěr
Ze studie vyplývá, že oba nově sestavené stratifikační modely MM založené na stanovení poměru párů i ‑ HLC/ u ‑ HLC (HLC ‑ κ/ HLC ‑ λ) imunoglobulinu, tj. HLC ‑ r, jsou snadno prakticky použitelné a podložené signifikantním vztahem ke stěžejním prognostickým ukazatelům MM. Určitým nedostatkem je doposud stále omezená dostupnost Hevylite™ metody v běžné klinické praxi a odlišnost výsledků zjištěná u IgG a IgA izotypu MM omezující jejich univerzální využití a vyvolávající potřebu separátní aplikace. K definitivnímu zhodnocení potenciálního přínosu a výběru jednoho z modelů, tj. podle A ‑ L, nebo L pro klinickou praxi, je nezbytné vyčkání výsledku připravené validační studie zaměřené na ověření pilotně popsaného signifikantního vztahu A ‑ L i L stratifikace k PFS a OS. Příznivou vlastností obou stratifikačních modelů je jejich nepochybná pružnost, umožňující průběžnou aktualizaci „rizikovosti“ nemocných v průběhu nemoci jako východiska případné změny aktuální léčby.
Práce byla podpořena IGA MZ ČR, NT/12451-5.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
prof. MUDr. Vlastimil Ščudla, CSc.
III. interní klinika – nefrologická, revmatologická a endokrinologická
LF UP a FN Olomouc
I. P. Pavlova 6
779 00 Olomouc
e-mail: vlastimil.scudla@fnol.cz
Obdrženo: 16. 6. 2015
Přijato: 25. 6. 2015
Sources
1. Rajkumar SV, Dimopoulos MA, Palumbo A et al. International myeloma working group updated criteria for the diagnosis of multiple myeloma. Lancet Oncol 2014; 15(12): e538 – e548. doi: 10.1016/ S1470 ‑ 2045(14)70442 ‑ 5.
2. Hajek R, Adam Z, Scudla V et al. Guidelines of Czech Myeloma Group 2012: diagnosis and treatment of multiple myeloma. Transf Hematol 2012; 18 : 5 – 89.
3. Bradwell AR. Analysis of immunoglobulin heavy chain/ light chain pairs (HevyliteTM). In: Bradwell AR (ed.). Serum free light chain analysis (plus Hevylite). 6th ed. Birmingham: the Binding Site Ltd 2010 : 301 – 320.
4. Bradwell AR, Harding SJ, Fourrier NJ et al. Assessment of monoclonal gammopathies by nephelometric measurement of individual immunoglobulin κ/ λ ratios. Clin Chem 2009; 55(9): 1646 – 1655. doi: 10.1373/ clinchem.2009.123828.
5. Keren DF. Heavy/ light‑chain analysis of monoclonal gammopathies. Clin Chem 2009; 55(9): 1606 – 1608.
6. Katzmann JA, Kyle RA, Benson J et al. Screening panels for detection of monoclonal gammopathies. Clin Chem 2009; 55(8): 1517 – 1522. doi: 10.1373/ clinchem.2009.126664.
7. Koulieris E, Panayiotidis P, Harding SJ et al. Ratio of involved/ unilvolved immunoglobulin quantification by HevyliteTM assay: clinical and prognostic impact in multiple myeloma. Exp Hematol Oncol 2012; 1 : 9. Available from: http:/ / www.enhoonline.org/ content/ 1/ 1/ 9.
8. The Binding Site Group Ltd. Practical consideration of Hevylite immunoassays. In: The Binding Site Group Ltd. Serum free light chain analysis plus Hevylite. 7th ed. Birmingham: the Binding Site Ltd 2015 : 95 – 121.
9. Vavrova J. Assessment of free light chains and HevyliteTM in monoclonal gammopathies. In: Maisnar V, Tichy M (eds). Monoclonal immunoglobulins – occurrence, significance and possibilities of their detection. 1st ed. Praha: Nucleus Hradec Kralove 2012 : 55 – 60.
10. International Myeloma Working Group. Criteria for the classification of monoclonal gammopathies, multiple myeloma and related disorders: a report of the International Myeloma Working Group. Brit J Haematol 2003; 121(5): 749 – 757.
11. Bergsagel PL, Kuehl WM, Zhan F et al. Cyclin D dysregulation: an early and unifying pathogenetic event in multiple myeloma. Blood 2005; 106(1): 296 – 303.
12. Shaughessy JD Jr, Zhan F, Burington BE et al. A validated gene expression model of high‑risk multiple myeloma is defined by deregulated expression of genes mapping to chromosome 1. Blood 2007; 109(6): 2276 – 2284.
13. Avet ‑ Loiseau H, Harousseau JL, Moreau P et al. Heavy/ light chain specific immunoglobulin ratios at presentation are prognostic for progression free survival in the IFM 2005 – 01 myeloma trial. Blood 2009; 114 : 722: abstr. 1818.
14. Avet ‑ Loiseau H, Mirbahai L,Harousseau JL et al. Serum immunoglobulin heavy/ light chain ratios are independent risk factors for predict progression free survival in multiple myeloma. Haematologica 2010; 95 : 395.
15. Ludwig H, Milosavljevic D, Zojer N et al. Immunoglobulin heavy/ light chain ratios improve paraprotein detection and monitoring, identify residual disease and correlate with survival in multiple myeloma patients. Leukemia 2013; 27(1): 213 – 219. doi: 10.1038/ leu.2012.197.
16. Bradwell AR, Harding S, Fourrier N et al. Prognostic utility of intact immunoglobulin Ig’kappa/ Ig’lambda ratios in multiple myeloma patients. Leukemia 2013; 27(1): 202 – 207. doi: 10.1038/ leu.2012.159.
17. Ščudla V, Lochman P, Pika T et al. Analýza vztahu párů těžkých/ lehkých řetězců imunoglobulinu (HevyliteTM) k výsledkům gelové elektroforézy a nefelometrickému vyšetření proteinů séra při diagnóze mnohočetného myelomu. Čas Lék Čes. In press 2015.
18. Scudla V, Lochman P, Pika T et al. Differences in relationship between immunoglobulin heavy/ light chain pairs (HevyliteTM) and selected laboratory parameters and stratification systems in different immunochemical types of multiple myeloma. Biomedical Papers. In press 2015.
19. Ludwig H, Milosavljevic D, Zojer N et al. Supression of the non‑involved HLC pair correlates with survival in newly diagnosed and relapsed/ refractory patients with myeloma. Congres of European Haematology Association, Milano 2014: abstr. 980.
20. Katzmann JA, Rajkumar SV. A windows into immunoglobulin quantitation and plasma cell disease: antigen epitopes defined by the junction of immunoglobulin heavy and light chains. Leukemia 2013; 27(1): 1 – 2. doi: 10.1038/ leu.2012.201.
21. Greipp PR, San Miguel J, Durie BG et al. International staging system for multiple myeloma. J Clin Oncol 2005; 23(15): 3412 – 3420.
22. Alexanian R. Blood volume in monoclonal gammopathy. Blood 1997; 49(2): 301 – 307.
23. Kim J, Hayton WL, Robinson JM et al. Kinetics of FcRn ‑ mediated recycling of IgG and albumin in human: pathophysiology and therapeutic implications using a simplified mechanism‑based model. Clin Immunol 2007; 122(2): 146 – 155.
24. Akilesh S, Christianson GJ, Roopenian DC et al. Neonatal FcR expression in bone marrow ‑ derived cell functions to protect serum IgG from catabolism. J Immunol 2007; 179(7): 4580 – 4588.
25. Anderson CL, Chandhury C, Kim J et al. Perspective FcRn transports albumin: relevance to immunology and medicine. Trends Immunol 2006; 27(7): 343 – 348.
26. Chandhury C, Brooks C, Carter D et al. Albumin binding to FcRn: distinct from the FcRn ‑ IgG interaction. Biochemistry 2006; 45(15): 4983 – 4990.
27. Pika T, Hermanova Z, Lochman P et al. System HevyLiteTM and IgA monoclonal gammopathy – first experience. Klin Biochem Metab 2011; 19 : 86 – 91.
28. Katzmann JA, Clark R, Kyle RA et al. Supression of uninvolved immunoglobulins defined by heavy/ light chain pair suppression is a risk factor for progression of MGUS. Leukemia 2013; 27(1): 208 – 212. doi: 10.1038/ leu.2012.189.
29. Murillo ‑ Florez I, Andrade ‑ Campos M, Montes ‑ Limon A et al. Predictive value of light and heavy chain analysis in multiple myeloma patients treated with bortezomib. Haematologica 2013; 98 : 1519a.
30. Koulieris E, Maltezas D, Eytychia N et al. Impact of novel M ‑ component based biomarkers on to progression free survival after treatment in intact immunoglobulin multiple myeloma. Blood 2012; 120 : 121.
31. Ludwig H, Faint J, Zojer N et al. Serum heavy/ light chain and free light chain measurements provide prognostic informatic, alow creation of a prognostic model and identify clonal changes (clonal tiding) through the course of multiple myeloma. Blood 2011; 118 : 1244.
32. Avet ‑ Loiseau H, Mirbahai L, Mathiot C et al. Nephelometric assays Ig’kappa and Ig’lambda used for diagnosing and monitoring multiple myeloma. Haematologica 2011; 96 : 393a.
33. Kraj M. Immunoglobulin heavy chain/ light chain pairs (HLC, HevyliteTM) assays for diagnosing and monitoring monoclonal gammopathies. Adv Clin Exp Med 2014; 23(1): 127 – 133.
34. Koulieris MW, Kyrtsonis MC, Maltezas D et al. Quantification of serum IgM ‑ kappa and IgM ‑ lambda in patients with Waldenströms macroglobulinemia (WM) at diagnosis and during disease course. Clinical correlations. Blood 2010; 1116 : 1238.
35. Leleu X, Koulieris E, Maltezas D et al. Novel M ‑ component based biomarkers in Waldenström’s macroglobulinemia. Clin Lymphoma Myeloma Leuk 2011; 11(1): 164 – 167. doi: 10.3816/ CLML.2011.n.039.
36. Lakomy D, Lemaire‑Ewing S, Denimal D et al. Evaluation of the new Hevylite TM IgA assay for the diagnosis and follow‑up of monoclonal gammopathies. Ann Biol Clin 2013; 71(2): 157 – 163. doi: 10.1684/ abc.2013.0805.
Labels
Paediatric clinical oncology Surgery Clinical oncology
Article was published inClinical Oncology

2015 Issue 5-
All articles in this issue
- Vyšetření párů těžkých/ lehkých řetězců imunoglobulinu (Hevylite™ assay) – přínos pro stratifikaci mnohočetného myelomu?
- Metody hodnocení kvality života u žen s karcinomem prsu – přehled a základní charakteristika
- Význam mikroRNA u glioblastomových kmenových buněk
- Chirurgická liečba pľúcnych metastáz kolorektálneho karcinómu – prežívanie a prognostické faktory
- Kombinace systematických terapií s radiací u nemalobuněčného karcinomu plic
- Použití prognostických indexů pro pacienty s mozkovými metastázami v denní radioterapeutické praxi – je jejich složitý výpočet ještě stále problém?
- Zákaz řízení – nový vedlejší účinek chemoterapie
- Clinical Oncology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Metody hodnocení kvality života u žen s karcinomem prsu – přehled a základní charakteristika
- Chirurgická liečba pľúcnych metastáz kolorektálneho karcinómu – prežívanie a prognostické faktory
- Zákaz řízení – nový vedlejší účinek chemoterapie
- Kombinace systematických terapií s radiací u nemalobuněčného karcinomu plic
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

