-
Články
Top novinky
Reklama- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
Top novinky
Reklama- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Top novinky
ReklamaVýznam zobrazení srdce pomocí magnetické rezonance v diagnostice hypertrofické kardiomyopatie
Část II
The role of cardiovascular magnetic resonance imaging in the diagnosis of hypertrophic cardiomyopathy.
Part IIHypertrophic cardiomyopathy is currently understood as a group of diseases with left ventricular hypertrophy, which are not based on adaptive mechanisms. The first part of the review details the possibility of cardiac magnetic resonance in the diagnosis of sarcomeric forms of hypertrophic cardiomyopathy, the second part will focus on the possibilities of distinguishing the sarcomeric forms from their phenocopies.
Key words:
cardiac magnetic resonance – hypertrophic cardiomyopathy – phenocopies
Autoři: Martin Pleva 1,2; Júlia Borová 1; Ilona Plevová 3; Jaroslav Januška 1; Margita Belicová 4
Působiště autorů: Komplexní kardiovaskulární centrum Nemocnice Podlesí a. s., Třinec 1; Vaskulární centrum Vítkovické nemocnice, a. s., Ostrava 2; Ústav ošetřovatelství a porodní asistence LF OU, Ostrava 3; I. interná klinika JLF UK a UNM, Martin, Slovenská republika 4
Vyšlo v časopise: Vnitř Lék 2017; 63(4): 249-253
Kategorie: Přehledné referáty
Souhrn
Hypertrofická kardiomyopatie je v současnosti chápána jako skupina onemocnění s hypertrofií levé komory, která nevznikla na podkladě adaptačních mechanizmů. V 1. části přehledového článku byly podrobně rozebrány možnosti zobrazení srdce pomocí magnetické rezonance v rámci diagnostiky sarkomerické formy hypertrofické kardiomyopatie, 2. část bude věnována možnostem rozlišení sarkomerické formy od jejích fenokopií.
Klíčová slova:
fenokopie – hypertrofická kardiomyopatie – magnetická rezonance srdceÚvod
Hypertrofická kardiomyopatie (HCM) je dle aktuálních doporučených postupů chápána jako skupina onemocnění vedoucích k hypertrofii levé komory (LK) na jiném podkladě, než je adaptace na chronické tlakové či objemové přetížení LK. V širším slova smyslu se zde vyjma sarkomerické formy HCM řadí celá řada dalších onemocnění s naprosto odlišnou etiologií hypertrofie LK (tab. 1). Zatímco u sarkomerické HCM dochází ke ztluštění stěny LK na podkladě hypertrofie kardiomyocytů, jejich dezorganizace a přítomnosti fibrózy, tak např. u amyloidózy je příčinou hypertrofie stěn patologické střádání proteinových vláken v intersticiu. Druhá část přehledového článku se věnuje možnostem zobrazení srdce pomocí magnetické rezonance (CMR) v diferenciální diagnostice hypertrofie LK.
Tab. 1. Etiologie HCM. 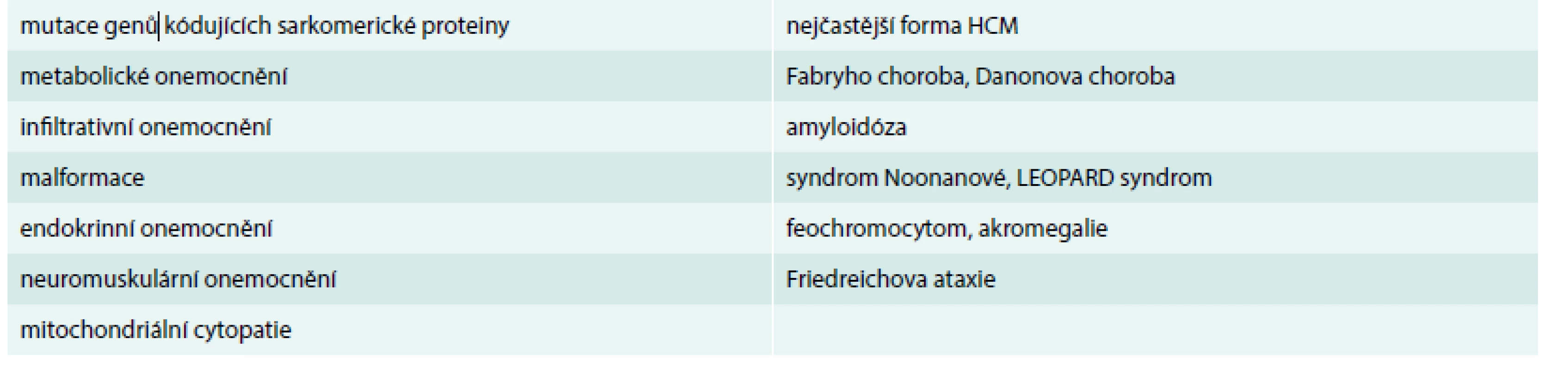
Upraveno podle [1] mutace genů Role CMR v diferenciální diagnostice hypertrofie levé komory
Hypertrofie LK může být adaptační reakcí na dlouhodobou intenzivní fyzickou zátěž (atletické srdce) či na dlouhodobě zvýšený afterload (hypertenze, aortální vady, koarktace aorty). Z definice hypertrofické kardiomyopatie vyplývá, že záchyt hypertrofie stěn LK splňující podmínky uvedené v definici (≥ 15 mm, resp. ≥ 13 mm u přímých příbuzných jedinců s prokázanou HCM: Vnitř Lék 2017; 63(3): 194–198) za nepřítomnosti výše uvedených stavů automaticky vede k diagnóze HCM. Protože je CMR nejpřesnější metodou pro kvantifikaci hypertrofie obou komor, je jedním z důvodů pro využití této metody v klinické praxi verifikace echokardiograficky zjištěné hypertrofie LK u jedinců s dosud negativní kardiální anamnézou. Dále se CMR uplatňuje v diferenciální diagnostice mezi atletickým srdcem a incipientní formou HCM a při podezření na koincidenci hypertenze a některé formy HCM (např. při průkazu hypertrofie neadekvátní tíži a kompenzaci hypertenze). Vyšetření bývá také indikováno s cílem přímo potvrdit některou z forem HCM a jako součást jejich diferenciální diagnostiky.
Atletické srdce
U atletického srdce adaptační hypertrofie zpravidla nepřesahuje 13 mm u mužů a 11 mm u žen, za horní hranici normy je u velmi trénovaných sportovců považována tloušťka stěny LK 15 mm u mužů a 13 mm u žen [2]. Maximum hypertrofie se typicky nachází v bázi mezikomorového septa a u sportovců provádějících vytrvalostní trénink je doprovázena proporcionální dilatací obou komor. Vztahem mezi hypertrofií a velikostí LK se zabývali Petersen et al [3], kteří uvádějí, že poměr maximální hypertrofie stěny LK k indexovanému end-diastolickému objemu LK < 0,15 mm × m2/ml (měřeno pomocí CMR) dosahuje 99% specificity pro diagnostiku atletického srdce [3]. Myokard obou komor je také typicky bez signálových změn v postkontrastních obrazech. CMR lze rovněž využít k potvrzení regrese hypertrofie LK po přerušení tréninku.
Hypertenze
Odlišení pacientů s hypertrofií čistě na podkladě hypertenze od pacientů s koincidencí hypertenze a HCM může být v určitých klinických situacích zcela zásadní, např. při stavech po prodělané synkopě. S ohledem na to, že se pacienti s HCM dožívají i velmi vysokého věku (a s věkem narůstá i prevalence hypertenze), je zřejmé, že část pacientů s HCM bude poprvé echokardiograficky vyšetřena až v době diagnostikované hypertenze. Tomu odpovídají i publikované charakteristiky velkých souborů pacientů s HCM z terciárních center: např. v souboru Rubinshteina et al [4] mělo až 50 % pacientů s HCM současně hypertenzi. Na tuto koincidenci myslíme především tehdy, když zjištěná hypertrofie neodpovídá tíži a kompenzaci hypertenze. CMR umožňuje v některých případech oba stavy rozlišit. Pro HCM svědčí tyto znaky:
- výskyt maxima hypertrofie v jiné lokalitě než v bazální polovině mezikomorového septa (např. apikální forma HCM)
- nekontinuálnost hypertrofie stěn LK
- fokální hypertrofie LK nebo PK (po vyloučení jiných příčin – např. tumor, sarkoidóza)
- reverzní tvar mezikomorového septa
Přítomnost dynamické nitrokomorové obstrukce nebo pozdního sycení (late gadolinium enhancement – LGE) svědčí rovněž spíše pro HCM, ačkoliv oba tyto stavy nejsou pro toto onemocnění zcela specifické. Okrsky fibrózy myokardu se vyskytují i u hypertrofie LK na podkladě hypertenze nebo aortální stenózy, množství LGE ale bývá nižší [5]. Existují však i některé typické obrazy LGE u HCM (viz níže) umožňující téměř s jistotou stanovit např. diagnózu srdeční amyloidózy.
Existuje i snaha definovat „cut-off“ hodnotu tíže hypertrofie u hypertenze podobně, jako je tomu u atletického srdce. Sipola et al [6] srovnávali pacienty s geneticky potvrzenou HCM s pacienty s recentně zjištěnou mírnou nebo středně těžkou hypertenzí. Tloušťka stěn LK ≥ 17 mm dosahovala 90% senzitivity a 93% specificity pro diagnostiku HCM. Sami autoři ale uvádějí, že u pacientů s těžkou (rezistentní) hypertenzí může hypertrofie LK přesahovat i 20 mm.
Odlišení jednotlivých forem hypertrofické kardiomyopatie
CMR může rovněž napomoci odlišit sarkomerickou formu od ostatních příčin HCM. V dospělosti se jedná především o amyloidózu a Fabryho chorobu. Jejich odlišení je zcela zásadní s ohledem na naprosto rozdílný terapeutický přístup. Diferenciální diagnostika jednotlivých forem HCM se opírá především o hodnocení standardních pozdních postkontrastních skenů (LGE), jako další velmi slibná metoda se jeví před a postkontrastní T1 mapping s výpočtem extracelulárního objemu (ECV) myokardu LK. Tato metoda se dostala do popředí zájmu díky technickému rozvoji umožňujícímu validně měřit přímo T1 relaxační čas myokardu (na rozdíl od klasických T1 vážených obrazů, které využívají pouze rozdílů v T1 relaxačním čase jednotlivých tkání k vytvoření jejich obrazu). Nativní (předkontrastní) T1 mapping reflektuje postižení jak kardiomyocytů, tak intersticia a u zdravých jedinců se pohybuje v rozmezí 950 ± 21 ms (pro přístroje o síle 1,5 Tesla) [7]. K jeho zvýšení dochází jak při edému myokardu, tak na podkladě přítomnosti fibrózy či infiltrace amyloidem. Naopak snížení T1 relaxačního času je typické pro postižení srdce při Fabryho chorobě a sideróze [8]. Oproti tomu ECV (frakce) udává podíl extracelulárního objemu k celkovému objemu myokardu LK a její hodnota reflektuje především přítomnost fibrózy či amyloidu (nepoužívá se pro detekci edému). Pro výpočet je nutné měřit T1 relaxační čas myokardu a krve před a 15 min po podání kontrastní látky a také znát aktuální hodnotu hematokritu. Normální hodnota ECV je 0,25 ± 0,04 (1,5 Tesla) [7]. Zvýšení ECV tedy reprezentuje zmnožení extracelulární tkáně a spolu s nativním T1 mappingem se může uplatnit v diferenciální diagnostice příčin hypertrofie LK. Nejvyšších hodnot T1 relaxačního času a ECV dosahují pacienti s amyloidózou, vyšších hodnot pak pacienti se sarkomerickou HCM, hypertenzí a aortální stenózou, naopak nízké hodnoty T1 relaxačního času jsou typické pro hypertrofii způsobenou Fabryho chorobou.
Amyloidóza
Amyloidózy jsou skupinou onemocnění spojených s extracelulárním ukládáním proteinových vláken různého složení, avšak uniformních vlastností, tzv. amyloidu [9]. Jedná se o poměrně vzácné onemocnění s udávanou incidencí 6–10 případů na milion obyvatel [10]. Amyloidózy mohou být geneticky podmíněné nebo získané. V současné době je známo až 36 různých typů proteinů [11], které se mohou ukládat lokálně, mnohem častější je ale jejich systémová forma vyznačující se postižením různých orgánů a tkání dle charakteru daného proteinu. K postižení srdce dochází nejčastěji u systémové AL-amyloidózy (až u 2/3 nemocných), u níž je také nejvýznamnějším prognostickým faktorem a nejčastější příčinou smrti v důsledku elektromechanické disociace nebo maligní komorové arytmie [12]. Dalším typem amyloidóz postihujících srdce je familiární transthyretinová amyloidóza a senilní amyloidóza. Bez ohledu na etiologii vede srdeční amyloidóza ke ztluštění stěn LK a k rozvoji nejprve diastolické a posléze systolické poruše její funkce. CMR podobně jako ECHO prokazuje ztluštění stěn LK s ještě zachovalou nebo již sníženou systolickou funkcí s restriktivním charakterem plnění LK. Obvykle dochází i ke ztluštění stěn PK, stěn síní včetně mezisíňové přepážky a cípů chlopní a často bývá přítomen perikardiální výpotek. V rámci CMR se můžeme vyjma výše uvedeného opřít o průkaz LGE, který je u srdeční amyloidózy velmi častý a reprezentuje intersticiální expanzi amyloidových depozit [13]. Pilotní práci prokazující abnormální kinetiku gadoliniové kontrastní látky v myokardu LK publikovali Maceira et al v roce 2005 [14]. Popsali difuzní subendokardiální pozdní sycení u pacientů s prokázanou srdeční amyloidózou a v následné práci z roku 2008 [15] i prognostický význam rozdílu postkontrastního T1 relaxačního času mezi subepikardiální a subendokardiální vrstvou myokardu LK. Také Vogelsberg et al [16] popsali typický obraz difuzního pozdního sycení myokardu obou komor včetně papilárních svalů, případně i stěn síní, s maximem subendokardiálně (obr. 1). Tento charakteristický obraz dosáhl v jejich souboru 80% senzitivity a 94% specificity pro diagnostiku tohoto onemocnění. V další práci Syed et al [13] na rozsáhlejším souboru pacientů ale zdokumentovali, že vyjma typického obrazu difuzního LGE lze v časných fázích srdeční amyloidózy zobrazit i necharakteristické fokální sycení myokardu LK. Další možnosti CMR v diagnostice srdeční amyloidózy nabízí výše zmiňovaný T1 mapping. Přítomnost amyloidu v intersticiu myokardu vede ke zvýšení T1 relaxačního času a ke zvýšení podílu extracelulárního objemu na celkovém objemu myokardu LK (zvýšení ECV). Jejich zvýšení umožňuje detekovat i časné fáze srdeční amyloidózy u pacientů, u kterých ještě nedošlo k rozvoji hypertrofie LK a u kterých není přítomné LGE [17,18]. Navíc u pacientů s AL-amyloidózou hodnoty T1 relaxačního času > 1 044 ms a ECV > 0,45 predikují jejich horší prognózu [18].
Obr. 1. Postkontrastní T1 vážené obrazy (LGE) v dlouhé ose LK. 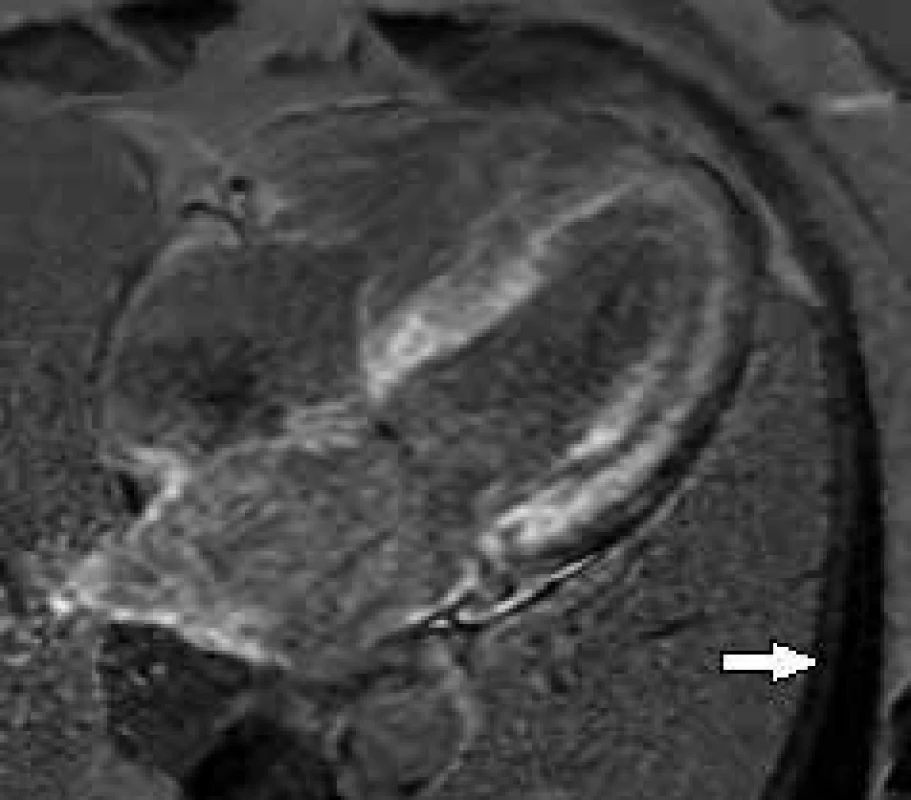
Difuzní sycení stěn obou komor a síní – typický nález u srdeční amyloidózy (pro zdůraznění rozdílu signálových změn myokardu šipkou označen „vynulovaný“ signál nepostiženého kosterního svalu) Fabryho choroba
Fabryho choroba je vzácné dědičné onemocnění patřící mezi lyzosomální choroby ze střádání. Je způsobeno mutací genu pro enzym α-galaktosidázu A umístěného na pohlavním chromozomu X. Následkem mutace dochází k nedostatku enzymu a hromadění globotriaosylceramidu v lyzosomech buněk různých tkání s postižením jejich funkce [19]. Frekvence výskytu choroby se odhaduje na přibližně 1 : 40 000. Nemoc byla dlouho považována za čistě recesivní, díky náhodné inaktivaci chromozomu X se ale choroba může projevit i u heterozygotních žen. Oproti homozygotním mužům má nemoc u žen mírnější průběh a pozdější nástup [20]. Klasická forma Fabryho choroby má řadu extrakardiálních manifestací, u nemocných s částečně zachovalou aktivitou α-galaktosidázy A ale může tato extrakardiální manifestace chybět [20]. Je proto pravděpodobné, že velká část nemocných zůstává neodhalena, neboť výskyt Fabryho choroby u mužů s hypertrofickou kardiomyopatií dle publikovaných prací není zanedbatelný. Sachdev et al [21] prokázali nízkou hladinu α-galaktosidázy A až u 6 % pacientů starších 40 let s nevysvětlitelnou hypertrofií LK. V naší populaci Paleček et al prokázali Fabryho chorobu až u 4 % mužů starších 30 let s náhodně zachycenou nevysvětlitelnou hypertrofií LK ≥ 13 mm [22]. Postižení srdce se u této střádavé choroby projevuje nejčastěji symetrickou hypertrofií LK. Také u Fabryho choroby byl popsán charakteristický MR obraz v pozdních postkontrastních skenech, a to velmi častý nález intramurálního pozdního sycení v bazálním a středním segmentu inferolaterální stěny LK (obr. 2) [23].
Obr. 2. Postkontrastní T1 vážené obrazy (LGE) v krátké ose LK. 
Zobrazeno intramurální pozdní sycení v bázi boční stěny LK u pacienta s prokázanou Fabryho chorobou Práce Deva et al [24] ale prokázala, že i u pacientů s Fabryho chorobou můžeme vidět různé morfologické typy hypertrofie (např. apikální formu hypertrofie nebo reverzní tvar septa) a také různou lokalizaci pozdního sycení. Na základě této studie je zřejmé, že nelze pomocí standardního vyšetřovacího protokolu zcela odlišit Fabryho chorobu od sarkomerické HCM. Zde by do budoucna mohl pomoci standardně prováděný nativní T1 mapping, při němž mají nemocní s Fabryho chorobou díky střádání globotriaosylceramidu v kardiomyocytech nižší hodnotu T1 relaxačního času než zdraví jedinci, na rozdíl od jedinců s jinou etiologií hypertrofie LK [25].
Odlišení chorob napodobujících hypertrofickou kardiomyopatii
Existují onemocnění, která mohou při echokardiografickém vyšetření napodobovat HCM. Jedná se o nemoci vedoucí k fokálnímu ztluštění LK a o stavy imitující apikální formu HCM. Fokální ztluštění stěny LK může být způsobeno sarkoidózou (obr. 3), při níž v úvodní fázi dochází k edému myokardu na podkladě probíhajícího zánětu (nekazeifikujících granulomů) a tumory srdce. Oba stavy lze odlišit od fokální formy HCM na základě signálových změn v před a postkontrastních MR obrazech (přítomna bývá rovněž porucha kinetiky a perfuze). Mezi stavy napodobující apikální formu HCM se řadí nonkompaktní kardiomyopatie s hypertrabekularizací hrotu LK a endomyokardiální fibróza (často s apikálním trombem – obr. 4). Díky lepšímu prostorovému rozlišení a použití kontrastní látky dokáže CMR tato onemocnění jednoznačně rozlišit.
Obr. 3. Postkontrastní T1 vážené obrazy (LGE) v dlouhé ose LK. 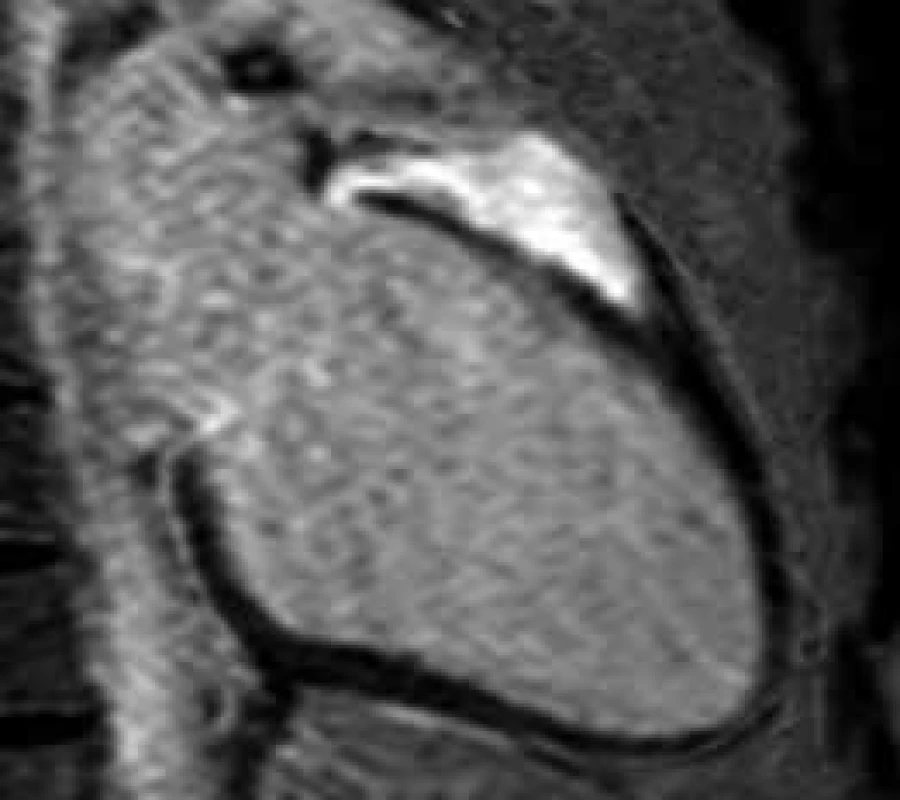
Fokální ztluštění bazálního segmentu přední stěny LK s rozsáhlým pozdním sycením způsobené sarkoidózou Obr. 4. Postkontrastní T1 vážené obrazy (LGE) v dlouhé ose LK. 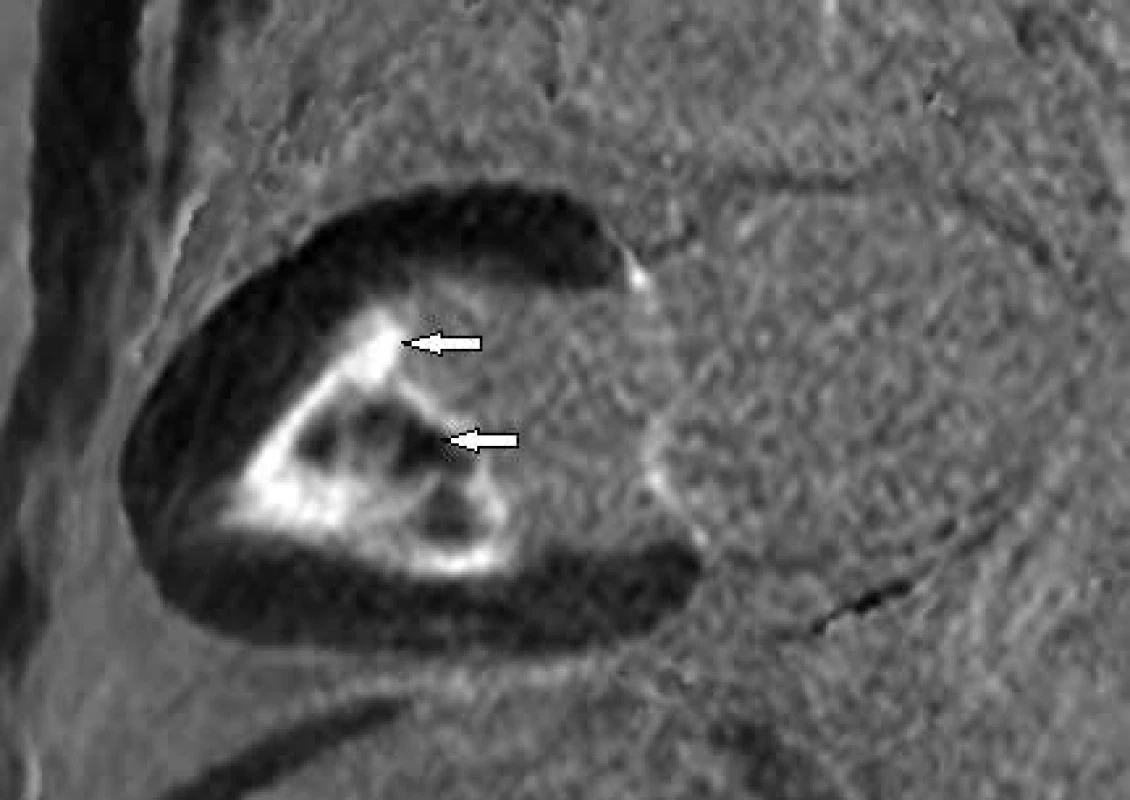
Endomyokardiální fibróza postihující apikální polovinu LK včetně trabekul (horní šipka) s vícečetnými tromby (hyposignální ložiska mezi hypersignálními trabekulami – dolní šipka) Závěr
CMR nabízí řadu nových možností v rámci diagnostiky sarkomerické HCM. Napomáhá odlišit HCM od stavů s hypertrofií na podkladě adaptačních mechanizmů i sarkomerickou HCM od jejích fenokopií. S rozvojem dostupnosti se CMR stává standardní součástí algoritmu vyšetření celé řady kardiomyopatií a spolu s echokardiografií i základním pilířem jejich diagnostiky. Limitací vyšetření ale nadále zůstává jeho vyšší cena, a především přítomnost kontraindikací.
MUDr. Martin Pleva
martin.pleva@vtn.agel.cz
Vaskulární centrum Vítkovické nemocnice, a.s.,
Ostrava
http://nemocnicevitkovice.agel.cz
Doručeno do redakce 5. 11. 2016
Přijato po recenzi 13. 3. 2017
Zdroje
1. Elliott PM, Anastasakis A, Borger MA et al. 2014 ESC Guidelines on diagnosis and management of hypertrophic cardiomyopathy: the Task Force for the Diagnosis and Management of Hypertrophic Cardiomyopathy of the European Society of Cardiology (ESC). Eur Heart J 2014; 35(39):2733–2779. Dostupné z DOI: <http://dx.doi.org/10.1093/eurheartj/ehu284>.
2. Fagard RH. Athlete’s heart or hypertrophic cardiomyopathy. Heart Metab 2012; 56 : 14–19. Dostupné y WWW: <https://www.heartandmetabolism.com/download/56/4.pdf>.
3. Petersen SE, Selvanayagam JB, Francis JM et al. Differentiation of athlete’s heart from pathological forms of cardiac hypertrophy by means of geometric indices derived from cardiovascular magnetic resonance. J Cardiovasc Magn Reson 2005; 7(3): 551–558.
4. Rubinshtein R, Glockner JF, Ommen SR et al. Characteristics and clinical significance of late gadolinium enhancement by contrast-enhanced magnetic resonance imaging in patients with hypertrophic cardiomyopathy. Circ Heart Fail 2010; 3(1): 51–58. Dostupné z DOI: <http://dx.doi.org/10.1161/CIRCHEARTFAILURE.109.854026>.
5. Rudolph A, Abdel-Aty H, Bohl S et al. Noninvasive detection of fibrosis applying contrast-enhanced cardiac magnetic resonance in different forms of left ventricular hypertrophy. Relation to remodeling. J Am Coll Cardiol 2009; 53(3): 284–291. Dostupné z DOI: <http://dx.doi.org/10.1016/j.jacc.2008.08.064>.
6. Sipola P, Magga J, Husso M et al. Cardiac MRI assessed left ventricular hypertrophy in differentiating hypertensive heart disease from hypertrophic cardiomyopathy attributable to a sarcomeric gene mutation. Eur Radiol 2011; 21(7): 1383–1389. Dostupné z DOI: <http://dx.doi.org/10.1007/s00330–011–2065-y>.
7. Dabir D, Child N, Kalra A et al. Reference values for healthy human myocardium using a T1 mapping methodology: results from the International T1 Multicenter cardiovascular magnetic resonance study. J Cardiovasc Magn Reson 2014; 16 : 69. Dostupné z DOI: <http://dx.doi.org/10.1186/s12968–014–0069-x>.
8. Moon JC, Messroghli DR, Kellmanet P et al. Myocardial T1 mapping and extracellular volume quantification: a Society for Cardiovascular Magnetic Resonance (SCMR) and CMR Working Group of the European Society of Cardiology consensus statement. J Cardiovasc Magn Reson 2013; 15 : 92. Dostupné z DOI: <http://dx.doi.org/10.1186/1532–429X-15–92>.
9. Linhartová K. Restriktivní kardiomyopatie. In: Veselka J, Linhartová K, Zemánek D et al. Kardiomyopatie. Galén: Praha 2009 : 57–87. ISBN 978–80–7262–640–3.
10. Banypersad SM, Moon JC, Whelan C et al. Updates in cardiac amyloidosis: a review. J Am Heart Assoc 2012; 1(2): e000364. Dostupné z DOI: <http://dx.doi.org/10.1161/JAHA.111.000364>.
11. Sipe JD, Benson MD, Buxbaum JN et al. Amyloid fibril proteins and amyloidosis: chemical identification and clinical classification International Society of Amyloidosis 2016 Nomenclature Guidelines. Amyloid 2016; 23(4): 209–213.
12. Ščudla V, Pika T, Látalová P et al. Diagnostika a stratifikace systémové AL amyloidózy ve světle „Doporučení České myelomové skupiny 2013“. Klin Biochem Metab 2014; 22(2): 49–60.
13. Syed IS, Glockner JF, Feng DL et al. Role of cardiac magnetic resonance imaging in the detection of cardiac amyloidosis. JACC Cardiovasc Imaging 2010; 3(2): 155–164. Dostupné z DOI: http://dx.doi.org/10.1016/j.jcmg.2009.09.023>.
14. Maceira AM, Joshi J, Prasad SK et al. Cardiovascular magnetic resonance in cardiac amyloidosis. Circulation 2005; 111(2): 186–193.
15. Maceira AM, Prasad SK, Hawkins PN et al. Cardiovascular magnetic resonance and prognosis in cardiac amyloidosis. J Cardiovasc Magn Reson 2008; 10 : 54. Dostupné z DOI: <http://dx.doi.org/10.1186/1532–429X-10–54>.
16. Vogelsberg H, Mahrholdt H, Deluigi CC et al. Cardiovascular magnetic resonance in clinically suspected cardiac amyloidosis noninvasive imaging compared to endomyocardial biopsy. J Am Coll Cardiol 2008; 51(10): 1022–1030. Dostupné z DOI: <http://dx.doi.org/10.1016/j.jacc.2007.10.049>.
17. Karamitsos TD, Piechnik SK, Banypersad SM et al. Noncontrast T1 mapping for the diagnosis of cardiac amyloidosis. JACC Cardiovasc Imaging 2013; 6(4): 488–497. Dostupné z DOI: <http://dx.doi.org/10.1016/j.jcmg.2012.11.013>.
18. Banypersad SM, Fontana M, Maestrini V et al. T1mapping and survival in systemic light-chain amyloidosis. Eur Heart J 2015; 36(4): 244–251. Dostupné z DOI: <http://dx.doi.org/10.1093/eurheartj/ehu444>.
19. Goláň L. Fabryho choroba-lysozomální onemocnění ze střádání s multiorgánovým postižením. Interní Med 2012; 14(10): 378–382.
20. Linhart A, Elliott PM. The heart in Anderson-Fabry disease and other lysosomal storage disorders. Heart 2007; 93(4): 528–535.
21. Sachdev B, Takenaka T, Teraguchi H et al. Prevalence of Anderson-Fabry disease in male patients with late onset hypertrophic cardiomyopathy. Circulation 2002; 105(12): 1407–1411.
22. Paleček T, Honzíková J, Poupětová H et al. Prevalence of Fabry disease in male patients with unexplained left ventricular hypertrophy in primary cardiology practice: prospective Fabry cardiomyopathy screening study (FACSS). J Inherit Metab Dis 2014; 37(3): 455–460.Dostupné z DOI: <http://dx.doi.org/10.1007/s10545–013–9659–2>.
23. De Cobelli F, Esposito A, Belloni E et al. Delayed-enhanced cardiac MRI for differentiation of Fabry’s disease from symmetric hypertrophic cardiomyopathy. AJR Am J Roentgenol 2009; 192(3): W97-W102. Dostupné z DOI: <http://dx.doi.org/10.2214/AJR.08.1201>.
24. Deva DP, Li Q, Ng MY et al. Cardiovascular magnetic resonance demonstration of the spectrum of morphological phenotypes and patterns of myocardial scarring in Anderson-Fabry disease. J Cardiovasc Magn Reson 2016; 18 : 14. Dostupné z DOI: <http://dx.doi.org/10.1186/s12968–016–0233–6>.
25. Sado DM, White SK, Piechnik SK et al. Identification and assessment of Anderson-Fabry disease by cardiovascular magnetic resonance moncontrast myocardial T1 mapping. Circ Cardiovasc Imaging 2013; 6(3): 392–398. Dostupné z DOI: <http://dx.doi.org/10.1161/CIRCIMAGING.112.000070>.
Štítky
Diabetologie Endokrinologie Interní lékařství
Článek Kontroverze okolo QALY
Článek vyšel v časopiseVnitřní lékařství
Nejčtenější tento týden
2017 Číslo 4- Není statin jako statin aneb praktický přehled rozdílů jednotlivých molekul
- Magnosolv a jeho využití v neurologii
- Biomarker NT-proBNP má v praxi široké využití. Usnadněte si jeho vyšetření POCT analyzátorem Afias 1
- Pregabalin je účinné léčivo s příznivým bezpečnostním profilem pro pacienty s neuropatickou bolestí
-
Všechny články tohoto čísla
- Novinky v liečbe srdcového zlyhávania – editorial
- Syndrom diabetické nohy: význam MR spektroskopie lýtkových svalů pro hodnocení končetinové ischemie a efektu revaskularizace
- Kontroverze okolo QALY
-
Význam zobrazení srdce pomocí magnetické rezonance v diagnostice hypertrofické kardiomyopatie
Část II - Novinky v léčbě srdečního selhání
- AT1 blokátory – srovnatelnost kardioprotektivity s inhibitory ACE
- Jak (s)tvořit spolupracujícího pacienta pro antihypertenzní a hypolipidemickou léčbu
- Relabující autoimunitní pankreatitida 1. typu: kazuistika
- Histiocytóza z indeterminovaných buněk – vymizení kožní infiltrace po ozáření elektronovým svazkem a aplikace 2-chlorodeoxyadenozinu: kazuistika
- Antikoagulační terapie dabigatranem vs rivaroxabanem u seniorů ve věku nad 65 let: porovnání dat „head to head“
- Gender and Coronary Artery Disease – a challenge for the 21st century
- Vnitřní lékařství
- Archiv čísel
- Aktuální číslo
- Pouze online
- Informace o časopisu
Nejčtenější v tomto čísle- Relabující autoimunitní pankreatitida 1. typu: kazuistika
- Kontroverze okolo QALY
- Novinky v léčbě srdečního selhání
- AT1 blokátory – srovnatelnost kardioprotektivity s inhibitory ACE
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



