-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Léčba Castlemanovy choroby siltuximabem – popis případu a přehled literatury
Therapy of Castleman’s disease with siltuximab – case report and review of literature
Background: Idiopathic multicentric Castleman disease (iMCD) is characterized by constitutional symptoms, enlarged lymph nodes and laboratory test abnormalities, which are primarily related to the overproduction of interleukin-6 (IL-6). This form (iMCD) was treated earlier with cytostatics used for lymphoma, later with biologic therapy as rituximab, immunodulatory drugs and proteasome inhibitors, and in the last years with an anti-IL-6 antibody, siltuximab. Siltuximab is a human-mouse chimeric immunoglobulin G1k monoclonal antibody against human IL-6 approved in the European Union for the treatment of iMCD. In view of the limited treatment options for iMCD, this case report aimed to evaluate the efficacy and safety of siltuximab in the management of this condition.
Case: We describe a young woman with iMCD diagnosed at the age of 25 years. For first line treatment, rituximab and dexamethasone were used without any cytostatic because the patient wished to give birth to a healthy child in the future. However, the response after this first line therapy was short. In addition, after 3 years from the start of rituximab + dexamethasone therapy, it was necessary to administer treatment for the relapse of iMCD. We decided for siltuximab in this young woman, still aged < 30 years, and started administration of siltuximab in 3-week intervals.
Results: After administration of first two infusions of siltuximab, all inflammatory markers returned to normal value. Moreover, serum hemoglobin and albumin levels as well as C-reactive protein normalized after the first two administrations of siltuximab. The clinical response continue, siltuximab is still administered in 3-week intervals. PET/CT with fluorodeoxyglucose confirmed a very good anatomic and metabolic response to the treatment. Siltuximab demonstrated a favorable safety profile, and the prolonged treatment was well tolerated.
Conclusion: This result is encouraging and demonstrates the potential of siltuximab as treatment of CD. As earlier published, this case confirms that significantly elevated inflammatory markers in a patient with CD predict a good response to siltuximab.
Keywords:
siltuximab – interleukin-6 – idiopathic multicentric Castleman‘s disease
Autoři: Z. Adam 1; D. Zeman 2; A. Chodacki 3; L. Pour 1; T. Horváth 4; P. Benda 4; Z. Adamová 5,6; M. Krejčí 1; M. Tomíška 1; I. Boichuk 1; Z. Král 1
Působiště autorů: Interní hematologická a onkologická klinika LF MU a FN Brno 1; Oddělení klinické biochemie a katedra laboratorních metod, Ústav laboratorní medicíny LF MU a FN Brno 2; PET centrum – nukleární medicína, Masarykova nemocnice, Ústí nad Labem 3; Chirurgická klinika LF MU a FN Brno 4; Chirurgické oddělení, Nemocnice ve Frýdku-Místku 5; Chirurgické oddělení, Vsetínská nemocnice 6
Vyšlo v časopise: Klin Onkol 2023; 36(4): 320-329
Kategorie: Kazuistiky
Souhrn
Východiska: Pro idiopatickou multicentrickou Castlemanovu chorobu (iMCD) jsou charakteristické zánětlivé symptomy, zvětšené lymfatické uzliny a laboratorní parametry odpovídající systémové zánětlivé reakci. To vše je důsledkem zvýšené tvorby interleukinu 6 (IL-6). Pro medikamentózní léčbu se používala chemoterapie s kortikoidy, později biologická léčba (rituximab, imunomodulační léky a inhibitory proteazomu). Nejnovějším lékem registrovaným pro tuto nemoc je protilátka proti IL-6, siltuximab. Siltuximab je humanizovaná chimérická monoklonální protilátka IgG1 proti IL-6, schválená v Evropské unii pro léčbu iMCD. Cílem následujícího popisu případu je zhodnocení účinnost a tolerance siltuximabu.
Případ: Popisujeme ženu, u níž byla diagnóza iMCD stanovena ve věku 25 let. Pro léčbu 1. linie byl zvolen rituximab a dexametazon v počtu osmi aplikací v 2–3týdenních intervalech, bez dalšího cytostatika, protože tato mladá slečna si přála porodit v budoucnu zdravé dítě. Trvání léčebné odpovědi po rituximabu a dexametazonu však bylo krátké. Za 3 roky od zahájení léčby rituximabem a dexametazonem bylo nutné podat další terapii iMCD. Pro léčbu 2. linie jsme zvolili siltuximab, protože pacientka je stále ve věku < 30 let a nechce léčbu cytostatiky z výše uvedeného důvodu.
Výsledky: Po prvních dvou aplikacích siltuximabu se všechny abnormální laboratorní hodnoty vrátily do normy a normalizovaly se také hodnoty hemoglobinu a albuminu, a C-reaktivního proteinu v séru. Při aplikaci siltuximabu v 3týdenních intervalech zůstávají laboratorní parametry pacientky v normě. Dle PET/CT s fluorodeoxyglukózou výrazná, ale inkompletní, regrese, došlo ke zmenšení velikosti nemocí postižených uzlin (anatomická léčebná odpověď) a poklesla v nich akumulace fluorodeoxyglukózy (metabolická léčebná odpověď). Léčebná odpověď přetrvává po celou dobu aplikace siltuximabu, pacientka je v dobré fyzické kondici bez symptomů iMCD. Podávání siltuximabu této mladé ženě probíhalo bez jakýchkoliv nežádoucích účinků.
Závěr: První zkušenost v ČR ukazuje, že siltuximab má přínos pro léčbu iMCD. Popsaný případ potvrzuje dříve publikovanou zkušenost, že výrazně zvýšené markery zánětu jsou prediktivním znakem dobré léčebné odpovědi na siltuximab.
Klíčová slova:
interleukin 6 – siltuximab – idiopatická Castlemanova choroba
Úvod
Castlemanova choroba (Castleman disease – CD) je termín pro nemaligní a neinfekční proces, který může postihnout lymfatickou uzlinu nebo vícečetné uzliny. Při popisu nemoci se používá jak dělení dle lokalizace, tak dělení dle histologie. Unicentrická forma postihuje jednu lymfatickou uzlinu a tvoří jedno ložisko. Multicentrická forma postihuje více lymfatických uzlin ve vícero oblastech. Ne každý případ lze však jasně zařadit do unicentrické, či multicentrické formy, a tak na rozhraní těchto dvou nemocí existuje takzvaná intermediární forma (přechodný typ) neboli též oligocentrická forma, u níž je postiženo více uzlin obvykle v jedné uzlinové oblasti (schéma 1). Histologicky se rozeznává hyalinně vaskulární typ, který obvykle tvoří unicentrickou formu nemoci, a dále plazmocelulární typ, který je typický pro multicentrickou formu nemoci. Na rozdíl od hyalinně vaskulárního typu, který má typickou cibulovitou strukturu a je dobře morfologicky identifikovatelný, plazmocelulární typ nemá žádné typické morfologické znaky a je obtížně odlišitelný od nespecifických zánětlivých změn. Proto je na klinikovi, který indikuje biopsii, aby patologa upozornil na možnost CD ve vzorku. S touto informací se pak patologovi snáze podaří rozpoznat tuto chorobu. Výjimečný je plazmablastický typ, který bývá popisován u forem CD s pozitivním lidským herpesvirem 8 (HHV-8).
Podrobnější informace o morfologii uvádějí Fajgenbaum et al. ve svém článku International evidence – based consensus diagnostic criteria for Castleman disease [1].
Pro léčbu unicentrické i multicentrické formy byla nedávno publikována mezinárodní doporučení [2–4]. Překlad těchto mezinárodních doporučení vyšel nedávno v české odborné literatuře [5–7], ale již dříve byly v naší literatuře publikovány zkušenosti s léčbou této nemoci [8,9]. Pro hodnocení léčebné odpovědi je dnes zásadním přínosem FDG-PET/CT vyšetření a uzliny postižené touto chorobou mají i specifický obraz v CT vyšetření, jak popisují Koukalová et al. [10]. Novým lékem pro tuto chorobu je siltuximab a cílem následujícího textu je podat stručnou zprávu o léčbě první pacientky v ČR tímto lékem a v diskuzi pak rozvést zkušenosti se siltuximabem a upozornit na prediktivní model pro dobrou účinnost siltuximabu.
Schéma 1. Členění Castlemanovy choroby vycházející z počtu patologických ložisek na unicentrickou a multicentrickou formu. Oligocentrická (intermediární) je výjimečná a biologicky se může chovat jako unicentrická anebo jako multicentrická. 
Popis případu
Slečna narozená 1993 byla celý svůj mladý život zdravá, první vážnější infekce se objevila v roce 2014, pásový opar. V létě roku 2017 měla febrilní onemocnění hodnocené jako angína. Dostala antibiotikum. Překvapením při kontrole po prodělané angíně byla vysoká hodnota sedimentace, za první hodinu 97 mm. I při dalších kontrolách zůstávala hodnota sedimentace erytrocytů vysoká, hodnoty za první hodinu se pohybovaly mezi 50–100 mm. Sama pacientka říkala, že potíže necítila, ale pokud byla přinucena změřit si teplotu, tak ta kolem 17. hodiny často přesahovala hodnotu 37 °C. A proto se začala hledat příčina.
Prvotní vyšetření nepřinesla nic patologického, takže se postupně propracovala až k PET/CT vyšetření, při němž byla použita fluorodeoxyglukóza (FDG) jako radiofarmakum. FDG-PET/CT bylo provedeno v Masarykově nemocnici Ústí nad Labem. Do provedení FDG-PET/CT byly známy jenom zvýšené hodnoty laboratorních markerů zánětu, ale FDG-PET/CT zobrazení přineslo zásadní obrat – nález zvětšených uzlin v mediastinu, zvýšeně akumulujících FDG. Bylo pojato podezření na lymfom.
Chirurgické pracoviště se napřed pokusilo získat reprezentativní vzorek na histologické hodnocení mediastinoskopickým přístupem. Ve vzorku odebraném při mediastinoskopii popsali patologové jenom chronické zánětlivé změny v odebrané uzlině. Druhý odběr byl proveden pomocí videoasistované torakoskopie. Ve druhém vzorku již byly nalezeny při morfologickém hodnocení patologické struktury, které vedly ke stanovení diagnózy Castlemanova choroba – plazmocelulární varianta. Histologie byla uzavřena 13. 2. 2018, takže diagnóza byla stanovena v 25 letech věku. 20. února roku 2018 byla pacientka poprvé vyšetřena na našem pracovišti. Laboratorní hodnoty z této návštěvy uvádíme v tab. 1.
Pacientka v té době na otázku, zda má teploty, či ne, odpověděla, že jistě nemá, ale že nemá čas se měřit, protože je plně vytížena v rodinné firmě. Na otázku na noční poty odpověděla, že si jich není vědoma, ale že její pracovní doba v potravinářské firmě začíná po půlnoci, takže nemá čas si takových věcí všímat. Typické B-symptomy prostě nepopsala, což je trochu s podivem, protože pacienti s podobnými hodnotami C-reaktivního proteinu (CRP) obvykle mají i klinické příznaky systémové zánětlivé reakce. Hmotnostní úbytek přiznala, ale ihned doplnila, že si to přála a snažila se svoji hmotnost snížit.
Domníváme se, že slečna příznaky nemoci přehlížela. Lidé obvykle sáhnou po teploměru, až jim zhoršení zdravotního stavu začne omezovat pracovní schopnost. Pokud zvýšená teplota neinterferuje s prací, tak si ji teploměrem neměří a k lékaři nejdou. Při dotazu, zda se musela oblékat tepleji než vrstevníci, připustila, že měla pocit, že je jí chladno, když ostatní si na chlad nestěžují. Pocity chladu (zimomřivost) a potřeba oblékat se tepleji než ostatní jsou typickým příznakem subfebrilií.
Rozsah nemoci jsme odvozovali od popisu FDG-PET/CT vyšetření, které popsalo patologickou masu zvýšeně akumulující FDG v mediastinu subkarinálně, resp. podél pravého hlavního bronchu. Mimo mediastinum nebyly popsány zvýšeně akumulující uzliny patologické velikosti. Šlo tedy o ložisko lokalizované v mediastinu, které však nebylo pro svoji obtížnou přístupnost operačně totálně odstranitelné. V ostatních částech těla byla popsána fyziologická akumulace.
S pacientkou jsme probírali léčbu, jak rozvádíme v diskuzi. Pacientka akcentovala svoje přání být léčena jen takovou léčbou, po níž by v budoucnu mohla počít a porodit zdravé dítě.
A proto jsme se s ní domluvili na léčbě pouze rituximabem a dexametazonem. Rituximab lze v této indikaci podat jen se schválením plátce zdravotní péče, a tak jsme čekali na vyjádření revizních lékařů. Rituximab pro tuto pacientku byl schválen, takže 3. května 2018 jí byla podána první aplikace rituximabu v dávce 800 mg a dexametazonu v dávce 40 mg.
Laboratorní hodnoty před podáním rituximabu uvádí tab. 1. Poslední, osmá aplikace této léčby byla 30. 8. 2018. Intervaly mezi rituximabem a dexametazonem byly 2–3 týdny a byly upravovány dle možností pacientky. První laboratorní kontrola po ukončené léčbě byla v prosinci 2018. Hodnoty jsou uvedeny v tab. 1.
Tab. 1. Vývoj aktivity nemoci. 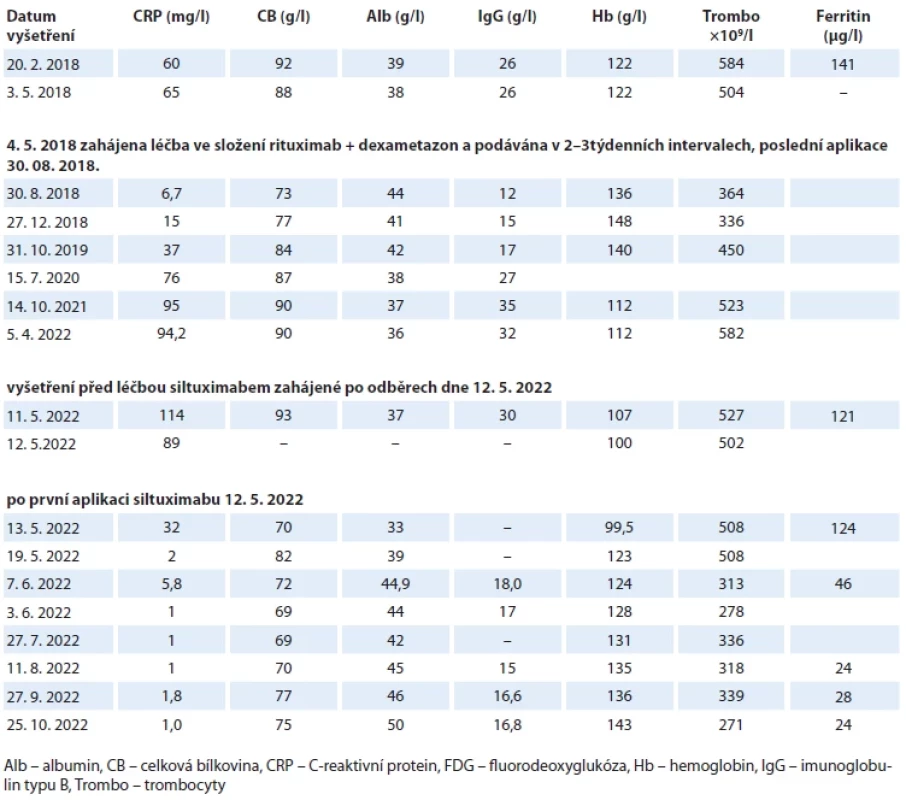
Pokles hodnot CRP, CB, IgG a trombocytů a vzestup Alb a Hb signalizuje léčebnou odpověď a naopak vzestup hodnot CRP, CB, IgG a trombocytů a pokles Alb a Hb signalizuje progresi nemoci. Do 24 hodin po aplikaci siltuximabu poklesla hodnota CRP z 114 na 32 a pak pokračoval další pokles, takže před druhou infuzí pacientka měla hodnotu CRP 2,0 čili v normě, CB s IgG poklesly ze vstupních 93 g/l a 30 g/l na hodnoty 72 g/l a 18 g/l, neboli se normalizovaly. Hodnota ferritinu poklesla a stejně tak se normalizovala hodnota trombocytů, takže po prvních dvou infuzích siltuximabu došlo k normalizaci všech původně vychýlených laboratorních parametrů. Hodnota Hb se zvyšuje pomalu. Po osmi aplikacích provedená FDG-PET/CT popisuje výraznou, ale inkompletní, regresi. Tab. 2. Mezinárodní prognostický index (IPI) pro idiopatickou multicentrickou Castlemanovu chorobu vypracovaný analýzou souboru 148 pacientů a verifi kovaný na souboru 197 pacientů [2]. ![Mezinárodní prognostický index (IPI) pro idiopatickou multicentrickou Castlemanovu chorobu vypracovaný analýzou souboru 148 pacientů a verifi kovaný na souboru 197 pacientů [2].](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/7da627db96257df13ee618bf5e84f50d.png)
Laboratorní monitorování léčebné odpovědi
Účinek rituximabu a dexametazonu byl velmi krátkodobý, nejvyšší hodnota hemoglobinu a albuminu byla dosažena v době podání poslední infuze rituximabu a dexametazonu a pak tyto hodnoty začaly postupně klesat. A naopak se zvyšovaly hodnoty CRP, celkové bílkoviny, imunoglobulinu typu IgG a počet trombocytů. Tento laboratorní vývoj tedy signalizoval velmi krátké trvání léčebné odpovědi a počátek pozvolného zvyšování aktivity byl zřetelný již za 3 měsíce po poslední aplikaci rituximabu a dexametazonu. První kontrola v prosinci 2018 signalizovala počátek recidivy nemoci a parametry v následujících měsících a rocích svědčily pro progresi nemoci.
FDG-PET/CT sledování aktivity nemoci
První FDG-PET/CT vyšetření bylo provedeno v lednu roku 2018 v Masarykově nemocnici v Ústí nad Labem a popisuje pouze hypermetabolizmus fluorodeoxyglukózy v lymfatických uzlinách subkarinálně. Dále uvádí, že ojedinělá uzlina se zvýšeným metabolizmem v pánvi je pravděpodobně nespecifická.
Druhé kontrolní FDG-PET/CT vyšetření bylo provedeno v listopadu 2018, tedy 3 měsíce od ukončení léčby. Lékaři nález shrnuli v závěr, že mírně vyšší konzumace FDG v lymfatických uzlinách mediastina a v pravém plicním hilu svědčí pro reziduální aktivitu nemoci.
Další kontrolní vyšetření proběhlo v dubnu 2021 s tím, že v porovnání s předchozím nálezem se rozsah nemoci zásadně nezměnil, ale zvýšila se metabolická aktivita v ložisku.
Předposlední vyšetření proběhlo 3. 5. 2021. Bylo konstatováno, že při porovnání s předchozími FDG-PET/CT vyšetřeními byla patrna pomalá postupná progrese velikosti ložiska. Drobné popsané uzliny v mediastinu byly sice také v mírné progresi, ale akumulovaly výrazně méně intenzivně než masa subkarinálně, takže možná byly nespecifické.
Poslední vyšetření bylo provedeno 15. 12. 2022 po osmi aplikacích siltuximabu. Přetrvávala zvýšená akumulace FDG v měkkotkáňové formaci v mediastinu svědčící pro reziduální aktivitu onemocnění, tedy pro výraznou, ale inkompletní regresi ve srovnání s obrazem z května roku 2021.
Co zvolit pro léčbu 2. linie?
Při kontrole 14. 10. 2021 bylo již jasné, že nemoc progreduje, a to jak dle laboratorních hodnot, tak dle hodnocení FDG-PET/CT vyšetření, které je uvedeno výše. Velikost v subkarinální oblasti byla popsána jako 48 × 18 × 35 mm a drobné akumulující uzliny popsány v aortopulmonálním okénku a pretracheálně. Ložisko nebylo totálně resekovatelné.
Laboratorní hodnoty z data 14. 10. 2021, kdy jsme se rozhodli pro léčbu relapsu nemoci, uvádí tab. 1.
Nabízeli jsme kombinaci rituximabu s cyklofosfamidem či jiným cytostatikem a s dexametazonem. Tuto léčbu však slečna nechtěla kvůli obavě z negativního působení cyklofosfamidu na možnost pozdější gravidity. Vyjádřila obavy z možného poškození funkce vaječníků a zárodečných buněk podaným cytostatikem, což nešlo vyloučit. O léčbě rituximabem v monoterapii jsme věděli, že efekt je velmi krátkodobý.
Slečna preferovala nitrožilní léčbu siltuximabem, o níž věděla z internetu, a tak jsme napsali žádost revizním lékařům její pojišťovny o schválení léčby siltuximabem a následující den, 15. 10. 2021, ji odeslali.
Dodatečně jsme poslali doplnění žádosti o siltuximab o prediktivní faktory dobré léčebné odpovědi. Dle těchto prediktivních faktorů léčebné odpovědi byla při léčbě siltuximabem léčebná odpověď velmi pravděpodobná.
Nicméně první odpověď plátce zdravotní péče byla negativní, definitivní zamítací stanovisko bylo vypracováno příslušnou komisí 30. 3. 2022 a odesláno žadatelce i na naše pracoviště. Definitivní zamítnutí siltuximabu plátcem zdravotní péče jsme tedy dostali po 6 měsících od rozhodnutí začít léčit.
Po zamítnutí žádosti o siltuximab se pacientka obrátila s prosbou na firmu EUSA Pharma. Tato společnost není pouze distributorem léku Sylvant, ale je hlavně držitelem rozhodnutí o registraci. Slečna prosila firmu o poskytnutí léku pro její léčbu formou daru.
Vzhledem k mladému věku pacientky rozhodl zástupce firmy pro střední Evropu o výjimce a firma EUSA Pharma pacientce lék začala poskytovat. První aplikace byla provedena za hospitalizace 12. května roku 2022. Pacientka snesla první infuzi bez jakékoliv reakce a stejně dobře snáší i další, které již probíhají ambulantně. Léčba je podávána zatím v intervalech 3 týdnů dle SPC a při dobrém efektu zvažujeme prodloužení intervalu. V prosinci 2022, kdy je psán tento popis případu, je slečna zcela bez příznaků nemoci a fyzicky stačí vrstevníkům. V průběhu léčby přibrala na váze 5 kg, takže předchozí úbytek hmotnosti, který vysvětluje svou snahou o zhubnutí, bylo spíše hubnutí v důsledku nemoci a nyní se její hmotnost vrací k původnímu stavu. Pokud se budou parametry nemoci stále zlepšovat, budeme podávat siltuximab v 3týdenních intervalech dle doporučení SPC. Po dosažení stabilních normálních hodnot plánujeme vyzkoušet prodloužení intervalu podávání až na 6 týdnů, což je interval, který byl dle publikovaných studií ještě schopen udržet stav nemoci v remisi.
Diskuze
Vzhledem k tomu, že obecné informace o příznacích této nemoci a její léčbě vyšly v časopisu Vnitřní lékařství [5,6] a nejnovější informace pak v knize Vzácné choroby provázené hypergamaglobulinemií a zánětlivými projevy [7], v tomto textu se soustředíme pouze na informace o léčbě CD siltuximabem. Zde jen připomeneme, že CD se v jednotlivých případech liší mírou agresivity a průběhem nemoci, jak ilustruje prognostický index pro tuto chorobu (tab. 2).
Zkušenosti s tocilizumabem
V literatuře lze nalézt popisy případů s multicentrickou formou CD úspěšně léčených protilátkou proti receptoru interleukinu 6 (IL-6) zvanou tocilizumab. Tato látka je používána hlavně v Asii a Japonsku, jak plyne z citované literatury [11].
Tocilizumab je humanizovaný antagonista receptoru IL-6, který je schopen zablokovat transmembránovou signalizaci, kterou by se normálně IL-6 aktivoval. Tocilizumab snižuje zánětlivou reakci mediovanou signální kaskádou navázanou na receptor IL-6. Je registrován pro léčbu idiopatické multicentrické CD v Japonsku, v jiných zemích je registrován pro léčbu revmatoidní artritidy. Je významným lékem při zvládání syndromu uvolnění cytokinů.
Po léčbě tocilizumabem byla také popsána regrese orgánového poškození při CD, ústup kardiomyopatie nebo zlepšení funkce ledvin [11].
Siltuximab
V Evropské unii je od května roku 2014 registrována pro léčbu multicentrické formy CD protilátka proti IL-6 zvaná siltuximab (Sylvant).
Siltuximab je chimérická IgG1 protilátka, která tvoří komplexy s IL-6, takže brání jeho vazbě na solubilní a membránové receptory. Má registraci pro léčbu idiopatické multicentrické formy CD v USA a v Evropě. Podmínkou pro jeho podání je diagnóza idiopatické formy CD, tedy nepřítomnost infekce HHV-8 a nepřítomnost infekce HIV. Siltuximab tvoří stabilní komplexy s bioaktivními formami IL-6 a brání jeho vazbě na rozpustné i membránové vazebné receptory. Podává se v doporučené dávce 11 mg/kg formou intravenózní infuze 1× za 3 týdny až do případného selhání léčby (anebo nepřijatelné toxicity). Ošetřující lékař si musí být vědom, že přípravek siltuximab může maskovat známky akutního zánětu, vč. potlačení horečky a reaktantů akutní fáze, a naopak může vést ke zvýšení hodnoty triglyceridů a cholesterolu v séru. Proto se požaduje, aby před podáním siltuximabu pacienti vždy měli počet neutrofilů > 1,0×109/l a počet trombocytů > 50×109/l, a při závažné infekci by se léčba siltuximabem měla vždy přerušit.
Klinické studie ověřující účinek siltuximabu u CD
V první studii fáze I bylo léčeno 67 pacientů, z nich 29 bylo léčeno déle než 1 rok. Z 37 hodnocených mělo 32 (86 %) pacientů zlepšen alespoň jeden ze sledovaných parametrů. Celkem 12 z 36 hodnocených mělo léčebnou odpověď dokumentovanou na zobrazovacích vyšetřeních. Kompletní remise (complete remission – CR) byla zaznamenána v jednom případě, parciální remise (PR) v 11 případech. Tato studie byla zaměřena na toleranci a bylo použito různé dávkování, takže počty léčebných odpovědí z této studie nejsou relevantní pro vytvoření představy o účinnosti léku. Závěry této studie fáze I lze interpretovat tak, že lék byl pro část pacientů účinnou léčbou a že je celkem dobře tolerován [12].
V následující fázi II klinického zkoušení bylo 79 pacientů randomizováno v poměru 2 : 1 do skupiny (53 pacientů) dostávající 11 mg/kg siltuximabu 1× za 3 týdny a do skupiny dostávající placebo (26 pacientů). Celkem 18 z 53 (34 %) pacientů dosáhlo trvalé léčebné odpovědi, 1× bylo dosaženo CR a 17× PR, zatímco ve skupině s placebem nedošlo k žádné léčebné odpovědi, které by odpovídala CR nebo PR. PR byla definována nejen vymizením symptomů, ale také zmenšením lymfadenopatie nejméně o 50 %. U dalších 30 pacientů (57 %) byl pozorován ústup symptomů beze změny velikosti lymfadenopatie či hepatosplenomegalie při hodnocení nemoci pomocí zobrazovacích vyšetření [13].
Do prodloužené léčby pak bylo zařazeno 19 pacientů, kteří dostávali siltuximab dlouhodobě, až 7 let. Tato studie prokázala, že pokud po aplikaci siltuximabu dojde k léčebnému efektu, tak tento dlouhodobě přetrvává. Intervaly mezi jednotlivými aplikacemi byly v této studii při dobrém efektu prodlužovány někdy až na 6 týdnů. Nežádoucí účinky byly hodnoceny jako tolerovatelné [14]. Nejčastější nežádoucí účinky byly pruritus (42 %), infekce horního dýchacího traktu (36 %), fatigue (34 %), makulopapulární raš (34 %) a periferní edémy (32 %) [14].
Randomizované srovnání léčby siltuximabu s placebem prokázalo u 53 hodnotitelných pacientů léčených siltuximabem celkem jen 34 % léčebných odpovědí definovaných jako CR či PR, i když ke zlepšení stavu došlo u většího počtu léčených [13].
Siltuximab navodí laboratorní léčebnou odpověď s ústupem příznaků u hodně nemocných, ale jen u části z nich dochází i ke zmenšení postižených uzlin, což je vyžadováno pro naplnění kritérií CR nebo PR u této nemoci.
Siltuximab jako jediný z výše vyjmenovaných léků má registraci pro léčbu CD, ale léčebnou odpověď definovanou jako CR a PR přinesl pouze třetině nemocných, i když ústup symptomů byl pozorován u více pacientů. Další klinické studie prokázaly, že siltuximab u pacientů dříve léčených jinými léky nebo u nově léčených dosahuje shodný počet odpovědí [15].
Menší studie probíhaly i v Evropě, k dispozici je hodnocení italské (9 pacientů) a polské studie (11 pacientů), léčebná odpověď (CR + PR) byla dosažena u 33 % pacientů, tedy podobně jako v registrační studii [16,17].
Prediktivní faktory pro léčebnou odpověď po siltuximabu
Správný lék správnému pacientu je heslo posledních let, a tak je pochopitelné, že na registrační studie navazují další, které se snaží vytipovat prediktivní markery léčebné odpovědi po podání siltuximabu. Již dříve bylo známo, že vysoká hodnota CRP a nízká koncentrace hemoglobinu byly předpokladem dobré léčebné odpovědi na prednison [18].
Analýza léčebných odpovědí byla provedena taktéž u pacientů léčených siltuximabem. Autoři této studie došli k závěru, že dobrou léčenou odpověď lze očekávat u pacientů s výraznou systémovou zánětlivou reakcí, kterou lze laboratorně rozpoznat dle zvýšení následujících markerů: CRP, fibrinogenu, sedimentace erytrocytů (Fahraeus Westergren), zvýšený počet trombocytů, příp. ferritinu, a naopak snížená koncentrace hemoglobinu a albuminu. Tyto laboratorní změny signalizují vysokou pravděpodobnost léčebné odpovědi na siltuximab [19]. V této studii se léčebná odpověď dostavila častěji u pacientů při zvýšení laboratorních markerů korelujících se systémovou zánětlivou reakcí (pokles hemoglobinu, vzestup hodnoty fibrinogenu, CRP a imunoglobulinů) než u pacientů bez laboratorních známek systémové zánětlivé reakce. Byly dosaženy následující výsledky:
15 z 18 pacientů (83 %) mělo léčebnou odpověď a pravděpodobnost léčebné odpovědi > 50 %;
19 z 22 pacientů (86 %) nemělo léčebnou odpověď a mělo pravděpodobnost léčebné odpovědi < 50 %.
V této studii se podařilo dosáhnout 86% pravděpodobnosti rozlišení pacientů reagujících a nereagujících na siltuximab [19]. Rozdíly v laboratorních hodnotách pacientů s léčebnou odpovědí a bez léčebné odpovědi dokumentuje tab. 3.
Snahy o vytipování pacientů, kteří budou s vysokou pravděpodobností hraničící s jistotou mít léčebnou odpověď po siltuximabu, dále pokračují. Novější studie na toto téma použila proteomické vyšetření a vytipovala skupinu pacientů s vysokou pravděpodobností léčebné odpovědi. Cílem těchto výzkumů je přesnější definování podmínek, kdy siltuximab bude dosahovat podstatně vyššího počtu léčebných odpovědí, než bylo v registračních studiích fáze I a II [20,21].
Pozitivní psychické změny v průběhu léčby siltuximabem
Při léčbě siltuximabem proběhla i další sledování, která mimo jiné prokázala zlepšení depresivní nálady a ústup anhedonie (neschopnosti se radovat) vlivem léčby siltuximabem. [22]. Přínos siltuximabu pro léčbu idiopatické formy CD, která je většinou provázena zánětlivými projevy, byl prokázán v četných dalších pracích [23–26].
Tab. 3. Laboratorní hodnoty u pacientů, kteří nereagovali na léčbu siltuximabem, a u pacientů, kteří na tuto léčbu reagovali. Uveden je medián a v závorce pak rozptyl laboratorních hodnot. Pacienti, kteří měli laboratorní hodnoty odpovídající intenzivní zánětlivé reakci, měli vysokou pravděpodobnost léčebné odpovědi na siltuximab [19]. ![Laboratorní hodnoty u pacientů, kteří nereagovali na léčbu siltuximabem, a u pacientů, kteří na tuto léčbu reagovali. Uveden je medián a v závorce pak rozptyl laboratorních hodnot. Pacienti, kteří měli laboratorní hodnoty odpovídající intenzivní zánětlivé reakci, měli vysokou pravděpodobnost léčebné odpovědi na siltuximab [19].](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/d1a8123e4c2102e4f8a6a6dcd77e27fe.png)
Tab. 4. Doporučené léčebné postupy dle „International evidence based consensus treatment guidelines for idiopathic multicentric Castleman disease 2018“ [2]. ![Doporučené léčebné postupy dle „International evidence based consensus treatment guidelines for idiopathic multicentric Castleman disease 2018“ [2].](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/5e05b2fa7ee4aa6e8fe5d5bf2a649875.png)
Schéma 2. Léčba dle mezinárodního doporučení pro léčbu Castlemanovy nemoci [2]. ![Schéma 2. Léčba dle mezinárodního doporučení pro léčbu Castlemanovy nemoci [2].](https://pl-master.mdcdn.cz/media/image/9b075dc58ea34527deecfcf4e7a5876e.png?version=1704785133)
Úspěchy siltuximabu v jiných indikacích
A jak již to většinou bývá, lék, který je cíleně vyvinut pro léčbu určité nemoci, nalézá posléze léčebné použití u dalších chorob. A podobně tomu bude u siltuximabu.
Viera Sandecká zveřejnila článek s názvem Siltuximab a jeho léčebné využití u mnohočetného myelomu [27].
Poměrně hodně publikací popisuje použití siltuximabu při tlumení imunitní reaktivity u těžkých forem koronavirové infekce [28,29]. Léčebný efekt siltuximabu byl popsán v jednom případě Rosaiovy-Dorfmanovy nemoci [30], v případech neinfekční uveitidy [31], a dokonce u tak obtížně léčitelné nemoci, jako je POEMS syndrom [32].
Takže jak to vypadá, siltuximab bude mít časem širší spektrum použití než jen CD.
Nejdůležitějším argumentem pro nasazení léku jsou však údaje o ovlivnění přežití. Zatím byla publikována pouze jedna studie, v níž siltuximab prodloužil bezpříznakové přežití ve srovnání s nejlepší možnou podpůrnou péčí [33]. Siltuximab je v našich rukou novým lékem, ale v medicínské literatuře jsou publikace popisující již 15 let trvající léčbu [34].
Anakinra
Anakinra je monoklonální protilátka proti receptoru pro IL-1. Její biologický poločas je ale jen 4–6 hodin. Siltuximab tlumí chorobu blokádou účinku IL-6. Anakinra tlumí chorobu blokádou aktivity IL-1, takže o jednu úroveň níže než siltuximab. V odborné literatuře není zatím žádná randomizovaná klinická studie analyzující účinek anakinry u CD. K dispozici jsou tři publikace popisující zásadní zlepšení po podání anakinry u pacientů s CD, často již značně předléčených. První popis léčby CD anakinrou je z roku 2008. U tohoto pacienta předcházela léčba chemoterapií a rituximabem, která však nedosáhla léčebné odpovědi. Až podání anakinry vedlo k vymizení příznaků nemoci [34].
V dalším případě byla anakinra s úspěchem použita u ještě více předléčeného pacienta, u něhož předcházela léčba kladribinem, rituximabem, steroidy, etanerceptem (protilátka proti tumor nekrotizujícímu faktoru) a protilátkou proti IL-6, přičemž nemoc byla na vše uvedené refrakterní. Takže klasické léčebné možnosti byly u tohoto pacienta, léčeného v MD Anderson Cancer Center, vyčerpány. Proto byla použita anakinra (100 mg denně), do týdne příznaky vymizely a na kontrolních FDG-PET/CT zobrazeních vymizela lymfadenopatie i zvýšená akumulace FDG v kostní dřeni [35].
Anakinru použili také francouzští autoři u případu CD s anasarkou a trombotickou trombocytopenickou purpurou odpovídající TAFRO syndromu [36].
Podrobnosti o léčbě jsou uvedeny v citovaných léčebných doporučeních [2,3] a z nich pro tuto publikace přebereme v nich uvedená léčebná schémata (tab. 4 a schéma 2). Tyto zkušenosti opravňují k použití anakinry při neúspěchu léčby 1. linie.
Jiné nové alternativy léčby
Idiopatická CD je zřejmě důsledkem nejednoho vyvolávajícího faktoru, a proto se u této choroby uplatňují různé léky. K lékům, jejichž efekt u CD byl potvrzen teprve v posledních letech, patří sirolimus a daratumumab, podávaný v monoterapii či v kombinaci [37–40].
Volba léčby pro naši pacientku
Naše pacientka má plazmocelulární variantu CD. Z hlediska rozšíření nemoci jde o chorobu intermediární, není tedy ani multicentrická, ani dobře lokalizovaná, aby bylo možné ji odstranit jednu provždy operační léčbou, jak v jiném případě popisují např. Penka et al. [41].
Tak jakou léčbu zvolit pro naši pacientku? Operační léčba u ní nebyla možná. Proces sice postihoval pouze mediastinum, ale byl v takové lokalizaci, že nebyl chirurgicky odstranitelný, bylo z něho možno odebrat pouze vzorek pro histologické vyšetření.
U lokalizovaných procesů, které není možné chirurgicky odstranit, lze použít radioterapie. Jenže radioterapie patří mezi léčebné alternativy, které jsou spojené s pozdními nežádoucími účinky. Do ozařovaného pole by se dostala jak štítná žláza, tak srdce a prsa nemocné. A u všech těchto důležitých orgánů, které by byly obsaženy v ozařovacím poli, by se zvýšilo riziko druhých malignit a v případě srdce pak také kardiomyopatie se sníženou ejekční frakcí. A toto riziko je tím závažnější, čím je ozařovaná osoba mladší. Vzhledem k těmto nežádoucím účinkům jsme tedy radioterapii nepoužili.
Z medikamentózní léčby jsme pacientce nabídli léčbu kombinací rituximabu, cyklofosfamidu a dexametazonu. S medikamentózní léčbou pacienta souhlasila, ale pro svůj mladý věk
chtěla takovou léčbu, které by neinterferovala s jejím přáním mít zdravé děti. A cyklofosfamid může poškodit funkci vaječníků i zárodečné buňky.
Pacientů s multicentrickou CD jsme léčili více, ale nikdo z nich nebyl tak mlád. Vždy šlo o starší nemocné, kteří již děti neplánovali.
V tomto případě bylo nutno zvolit takovou léčbu, která nebude mít nežádoucí dopady a umožní pozdější těhotenství. Proto jsme jako léčbu 1. linie zvolili rituximab a dexametazon, zatímco pro léčbu starších pacientů běžně přidáváme cyklofosfamid nebo etoposid, případně kombinaci s IMiDs.
Po léčbě rituximabem a dexametazonem došlo opravdu k velmi rychlému poklesu všech zánětlivých parametrů, ale jak ilustruje tabulka laboratorní parametrů, velmi brzy po ukončení léčby začala v podstatě recidiva nemoci. Po 3 letech od ukončení 1. linie léčby, v druhé polovině roku 2021, jsme při ambulantní kontrole při poklesu hemoglobinu na 112 otevřeli otázku další léčby. Se slečnou jsme probrali všechny léčebné možnosti vč. skutečnosti, že léčba rituximabem měla jen krátkodobý efekt. Z výše uvedených důvodů slečna nechtěla kombinace rituximabu s dalšími léky typu alkylačních cytostatik nebo s etoposidem, takže z neteratogenních možností zbyla možnost podat siltuximab, lék, který má registraci pro léčbu této nemoci, anebo se vrátit k rituximabu s vědomím jeho krátkodobého efektu.
Jak jsme již uvedli, žádost o schválení siltuximabu, který má registraci pro tuto chorobu, byla plátcem zdravotní péče opakovaně zamítnuta, a tak se slečna obrátila s prosbou o darování této léčby přímo na ředitele firmy EUSA Pharma, držitele rozhodnutí o registraci, a ten jí vyhověl.
Léčbu snáší slečna excelentně a vývoj laboratorních ukazatelů nemoci je zachycen v tab. 3. Je z ní vidět, že některé zánětlivé parametry klesají rychle (CRP), jiné pomaleji
(ferritin) a koncentrace hemoglobinu má zatím stále vzestupnou křivku. Podstatné je, že FDG-PET/CT vyšetření provedené po osmi aplikacích siltuximabu prokázalo výraznou, i když inkompletní regresi ve srovnání s FDG-PET/CT zobrazením před zahájením aplikace siltuximabu.
Závěr
CD patří mezi velmi vzácné nemoci, její výskyt snad bude v ČR zdokumentován, pokud se najde dost lékařek a lékařů pro realizaci celostátního registru pro CD a sponzor, který bude platit počítačové experty, kteří budou registr udržovat mnoho let při životě.
Příčinu choroby u HHV-8 negativních pacientů neznáme, a tak není ani s podivem, že její průběh je velmi variabilní, od „flu-like“ průběhu po „sepsis-like“ agresivní formy a jsou zde formy spojené s POEMS syndromem a nově se popisuje CD s rysy TAFRO syndromu, pro nějž je charakteristická nekardiální retence tekutin. Prostě velmi divergentní průběhy. Léčba vychází ze zkušeností získaných formou popisů případů či malých souborů pacientů. První klinické studie u této choroby se začaly organizovat až pro testování léku siltuximab. Na podání siltuximabu ve studiích nereagovali zdaleka všichni pacienti. Analýza prediktivních faktorů prokázala, že vysoký počet léčebných odpovědí je u pacientů s výrazně zvýšenými markery zánětu. Taktéž naše pacientka měla výrazně zvýšené markery zánětu před podáním siltuximabu a její reakce na léčbu byla excelentní, potvrzená nejen laboratorními hodnotami, ale i FDG-PET/CT zobrazením.
Proč je tomu tak? Nabízí se vysvětlení, že IL-6 je motorem CD právě u pacientů s výraznými zánětlivými příznaky, zatímco u pacientů s jasnými projevy této nemoci, ale bez výrazně zvýšených laboratorních markerů zánětu existují ještě další příčiny (motory), které vedou k rozvoji této nemoci [42–44]. Různé patofyziologické cesty vzniku této nemoci zřejmě souvisejí s individuální senzitivitou na tu či onu léčbu a s občasnou přítomností znaků IgG4 related disease či paraneoplastického pemphigu [45–47]. Každopádně naše zkušenost podporuje podávání siltuximabu právě pacientům s výraznou zánětlivou odpovědí a příp. s vysokou hodnotou IL-6.
Dedikace
K podpoře aktivity MZ ČR – RVO (FNBr, 65269705).
Zdroje
1. Fajgenbaum DC, Uldrick TS, Bagg A et al. International, evidence-based consensus diagnostic criteria for HHV--8-negative/idiopathic multicentric Castleman disease. Blood 2017; 129 (12): 1646–1657. doi: 10.1182/blood-2016-10-746933.
2. van Rhee F, Voorhees P, Dispenzieri A et al. International, evidence-based consensus treatment guidelines for idiopathic multicentric Castleman disease. Blood 2018; 132 (20): 2115–2124. doi: 10.1182/blood-2018-07-862334.
3. van Rhee F, Oksenhendler E, Srkalovic G et al. International evidence-based consensus diagnostic and treatment guidelines for unicentric Castleman disease. Blood Adv 2020; 4 (23): 6039–6050. doi: 10.1182/bloodadvances.2020003334.
4. Fajgenbaum DC, vanRhee F, Nabel ChS. HHV-8 negative idiopathic multicentric Castleman disease: novel insight into biology pathogenesis and therapy. Blood 2014; 123 (19): 2924–2933. doi: 10.1182/blood-2013-12-545087.
5. Adam Z, Řehák Z, Adamová Z et al. Unicentric Castlemans disease. Symptoms, diagnostics and therapy. Vnitr Lek 2021; 67 (8): 465–473.
6. Adam Z, Řehák Z, Adamová Z et al. Multicentric Castlemans disease. Symptoms, diagnostics and therapy. Vnitr Lek 2022; 68 (1): 41–53.
7. Adam Z, Pour L, Zeman D et al. Vzácné choroby provázené hypergamaglobulinémií a zánětlivými projevy. Praha: Grada Publishing 2022.
8. Adam Z, Szturz P, Křen L et al. PET-CT documented fast onset of treatment response to cyclophosphamide, thalidomide and dexamethasone in patients with multicentric Castlemans disease. Case description and treatment information overview. Vnitr Lek 2013; 59 (4): 301–312.
9. Adam Z, Pour, L, Krejčí M et al. The effect of lenalidomide on rare blood disorders: Langerhans cell histiocytosis, multicentric Castleman disease, POEMS syndrome, Erdheim-Chester disease and angiomatosis. Vnitr Lek 2012; 58 (11): 856–866.
10. Koukalová R, Selingerová I, Řehák Z et al. FDG-PET/ CT for initial staging and response assessment in Castleman disease – retrospective single-center study of 29 cases. Klin Onkol 2021; 34 (2): 120–127. doi: 10.48095/ccko 2021120.
11. Robey RC, Mletzko S, Colley C et al. The use of monoclonal antibodies to treat Castleman’s disease. Immunotherapy 2014; 6 (2): 211–219. doi: 10.2217/imt.13.167.
12. Kurzrock R, Voorhees PM, Casper C et al. A phase I, open-label study of siltuximab, an anti-IL-6 monoclonal antibody, in patients with B-cell non-Hodgkin lymphoma, multiple myeloma, or Castleman disease. Clin Cancer Res 2013; 19 (13): 3659–3670. doi: 10.1158/1078-0432.CCR-12-3349.
13. Van Rhee F, Wong RS, Munshi N et al. Siltuximab for multicentric Castleman’s disease. A randomized double blind placebo controlled trial. Lancet Oncol 2014; 15 (9): 966–974. doi: 10.1016/S1470-2045 (14) 70319-5.
14. Van Rhee F, Casper C, Voorhees PM et al. A phase 2, open-label multicenter study of long-term safety of siltuximab (an anti-interleukin-6 monoclonal antibody) in patients with multicentric Castleman disease. Oncotarget 2015; 6 (30): 30408–30419. doi: 10.18632/oncotarget.4655.
15. van Rhee F, Rossi JF, Simpson D et al. Newly diagnosed and previously treated multicentric Castleman disease respond equally to siltuximab. Br J Haematol 2021; 192 (1): e28–e31. doi: 10.1111/bjh.17177.
16. Tonialini L, Bonfichi M, Ferrero S et al. Siltuximab in relapsed/refractory multicentric Castleman disease: experience of the Italian NPP program. Hematol Oncol 2018; 36 (4): 689–692. doi: 10.1002/hon.2532.
17. Ostrowska B, Szymczyk A, Olszewska-Szopa M et al. Efficacy of siltuximab in the treatment of idiopathic multicentric Castleman disease, the first Polish, real-world experience with long-term observation. Leuk Lymphoma 2021; 62 (12): 3031–3034. doi: 10.1080/10428194.2021.1941926.
18. Ebisawa K, Shimura A, Honda A et al. Hemoglobin and C-reactive protein levels as predictive factors for long-term successful glucocorticoid treatment for multicentric Castleman‘s disease. Leuk Lymphoma 2021; 62 (3): 614–619. doi: 10.1080/10428194.2020.1834094.
19. Morra DE, Pierson SK, Shilling D et al. Predictors of response to anti-IL6 monoclonal antibody therapy (siltuximab) in idiopathic multicentric Castleman disease: secondary analyses of phase II clinical trial data. Br J Haematol 2019; 184 (2): 232–241. doi: 10.1111/bjh.15588.
20. Pierson SK, Shenoy S, Oromendia AB et al. Discovery and validation of a novel subgroup and therapeutic target in idiopathic multicentric Castleman disease. Blood Adv 2021; 5 (17): 3445–3456. doi: 10.1182/bloodadvances.2020004016.
21. Mukherjee S, Martin R, Sande B et al. Epidemiology and treatment patterns of idiopathic multicentric Castleman disease in the era of IL-6 directed therapy. Blood Adv 2022; 6 (2): 359–367. doi: 10.1182/bloodadvances.2021004441.
22. Sun Y, Wang D, Salvadore G et al. The effects of interleukin-6 neutralizing antibodies on symptoms of depressed mood and anhedonia in patients with rheumatoid arthritis and multicentric Castleman‘s disease. Brain Behav Immun 2017; 66 : 156–164. doi: 10.1016/j.bbi.2017.06.014.
23. Chrysochoou S, Kreft A, Schneider E. Siltuximab-related favorable clinical outcome for a patient suffering from idiopathic multicentric Castleman disease. Case Rep Hematol 2022; 2022 : 1840589. doi: 10.1155/2022/1840589.
24. Mukherjee S, Martin R, Sande B et al. Epidemiology and treatment patterns of idiopathic multicentric Castleman disease in the era of IL-6-directed therapy. Blood Adv 2022; 6 (2): 359–367. doi: 10.1182/bloodadvances.2021004441.
25. Fajgenbaum DC, Wu D, Goodman A et al. Insufficient evidence exists to use histopathologic subtype to guide treatment of idiopathic multicentric Castleman disease. Am J Hematol 2020; 95 (12): 1553–1561. doi: 10.1002/ajh.25992.
26. Williams C, Phillips A, Aggarwal V et al. TAFRO syndrome and elusive diagnosis of idiopathic multicentric Castleman disease treated with empiric anti-interleukin-6 therapy. Case Rep Oncol 2021; 14 (3): 1359–1365. doi: 10.1159/000518079.
27. Sandecká V. Siltuximab a jeho léčebné využití u mnohočetného myelomu. Remedia 2021; 31 (5): 480–485.
28. Meira F, Albiach L, Carbonell C et al. Experience with the use of siltuximab in patients with SARS-CoV-2 infection. Rev Esp Quimioter 2021; 34 (4): 337–341. doi: 10.37201/req/045.2021.
29. Gritti G, Raimondi F, Bottazzi B et al. Siltuximab downregulates interleukin-8 and pentraxin 3 to improve ventilatory status and survival in severe COVID-19. Leukemia 2021; 35 (9): 2710–2714. doi: 10.1038/s41375-021-013 29-8.
30. Lee H, King G, Garg K et al. Successful treatment of disseminated Rosai-Dorfman disease with siltuximab. Haematologica 2018; 103 (7): e325–e328. doi: 10.3324/haematol.2018.188441.
31. Karkhur S, Hasanreisoglu M, Vigil E et al. Interleukin-6 inhibition in the management of non-infectious uveitis and beyond. J Ophthalmic Inflamm Infect 2019; 9 (1): 17. doi: 10.1186/s12348-019-0182-y.
32. Lee YM, Choi YS, Kim JM. POEMS syndrome: presented as idiopathic multicentric Castleman disease of plasma cell variant for eight years and dramatic treatment with siltuximab followed by autologous peripheral blood stem cell transplantation. Diagnostics (Basel) 2022; 12 (4): 998. doi: 10.3390/diagnostics12040998.
33. van Rhee F, Rosenthal A, Kanhai K et al. Siltuximab is associated with improved progression-free survival in idiopathic multicentric Castleman disease. Blood Adv 2022; 6 (16): 4773–4781. doi: 10.1182/bloodadvances.2022007112.
34. Galeotti C, Tran TA, Franchi-Abella S et al. IL-1RA agonist (anakinra) in the treatment of multifocal Castleman disease: case report. J Pediatr Hematol Oncol 2008; 30 (12): 920–924. doi: 10.1097/MPH.0b013e31818ab31f.
35. El-Osta H, Janku F, Kurzrock R. Successful treatment of Castleman‘s disease with interleukin-1 receptor antagonist (Anakinra). Mol Cancer Ther 2010; 9 (6): 1485–1488. doi: 10.1158/1535-7163.MCT-10-0156.
36. Jouvray M, Terriou L, Meignin V et al. Pseudo-adult Still’s disease, anasarca, thrombotic thrombocytopenic purpura and dysautonomia: an atypical presentation of multicentric Castleman’s disease. Discussion of TAFRO syndrome. Rev Med Interne 2016; 37 (1): 53–57. doi: 10.1016/j.revmed.2015.04.006.
37. Rehman MEU, Chattaraj A, Neupane K et al. Efficacy and safety of regimens used for the treatment of multicentric Castleman disease: a systematic review. Eur J Haematol 2022; 109 (4): 309–320. doi: 10.1111/ejh.13823.
38. Bayram E, Pehlivan UA, Fajgenbaum DC et al. Refractory idiopathic multicentric Castleman disease responsive to sirolimus therapy. Am J Hematol 2023; 98 (2): 361–364. doi: 10.1002/ajh.26783.
39. Shi Y, Li J, Zhang L. Daratumumab for the treatment of refractory idiopathic multicentric Castleman disease: a case report. Ann Hematol 2022; 101 (11): 2529–2531. doi: 10.1007/s00277-022-04926-4.
40. Sevindik OG, Mutlu YG, Aydin BB et al. First-line usage of daratumumab, lenalidomide, dexamethasone (DRd) combination in a case of Castleman disease variant of polyneuropathy, organomegaly, endocrinopathy, monoclonal gammopathy, and skin changes syndrome (CD-POEMS). Hemasphere 2022; 6 (7): e728. doi: 10.1097/HS9.0000000000000728.
41. Penka I, Kala Z, Zetelová A et al. Castleman’s disease – surgical treatment, case reports. Rozhl Chir 2016; 95 (12): 457–461.
42. Hoffmann C, Hentrich M, Tiemann M et al. Recent advances in Castleman disease. Oncol Res Treat 2022; 45 (11): 693–704. doi: 10.1159/000526640.
43. Sumiyoshi R, Koga T, Kawakami A. Candidate biomarkers for idiopathic multicentric Castleman disease. J Clin Exp Hematop 2022; 62 (2): 85–90. doi: 10.3960/jslrt.22010.
44. Brandstadter JD, Fajgenbaum DC. How we manage idiopathic multicentric Castleman disease. Clin Adv Hematol Oncol 2022; 20 (9): 564–571.
45. Sasaki T, Akiyama M, Kaneko Y et al. Immunoglobulin G4-related disease and idiopathic multicentric Castleman’s disease: confusable immune-mediated disorders. Rheumatology (Oxford) 2022; 61 (2): 490–501. doi: 10.1093/rheumatology/keab634.
46. Cheng CC, Chen YC, Hsu YH et al. Idiopathic multicentric Castleman disease with strikingly elevated IgG4 concentration in the serum and abundant IgG4-positive cells in the tissue: a case report. Diagnostics (Basel) 2022; 12 (9): 2261. doi: 10.3390/diagnostics12092261.
47. Barry KK, Plumptre I, Bazewicz CG et al. Paraneoplastic pemphigus associated with Castleman disease: a multicenter case series. Pediatr Dermatol 2023; 40 (1): 90–95. doi: 10.1111/pde.15138.Štítky
Dětská onkologie Chirurgie všeobecná Onkologie
Článek vyšel v časopiseKlinická onkologie
Nejčtenější tento týden
2023 Číslo 4- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Nejasný stín na plicích – kazuistika
- Nejlepší kůže je zdravá kůže: 3 úrovně ochrany v moderní péči o stomii
- Jak souvisí postcovidový syndrom s poškozením mozku?
-
Všechny články tohoto čísla
- Pět P tuzemské onkologie – pochvala, podpora, polemika, pochybnosti, poklesky
- Novinky v piatej edícii klasifikácie nádorov semenníkov podľa Svetovej zdravotníckej organizácie
- Volná cirkulující DNA a její potenciál v diagnostice a léčbě maligních lymfomů
- Studie změn KDM1A a VEGF jakožto genů zodpovědných za angiogenezi karcinom prsu
- Neurobiológia mnohopočetného myelómu a jej terapeutické využitie – výsledky pilotnej štúdie s kontrolným ramenom
- Enzalutamid a abirateron v léčbě pacientů s metastatickým kastračně rezistentním karcinomem prostaty po podání chemoterapie
- Jak nám mohou pacienti pomoci být ještě lepšími lékaři – edukační leták „Než půjdu k lékaři“
- Ewingův sarkom močového měchýře – urologická a patologická diferenciální diagnostika a současné terapeutické možnosti
- Léčba Castlemanovy choroby siltuximabem – popis případu a přehled literatury
- Aktuality z odborného tisku
- Nová učebnice ukazuje, jak může obecný paliativní přístup významně zlepšit nemocniční péči o pacienty se závažnými diagnózami i jejich blízké
- Klinická onkologie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Neurobiológia mnohopočetného myelómu a jej terapeutické využitie – výsledky pilotnej štúdie s kontrolným ramenom
- Jak nám mohou pacienti pomoci být ještě lepšími lékaři – edukační leták „Než půjdu k lékaři“
- Ewingův sarkom močového měchýře – urologická a patologická diferenciální diagnostika a současné terapeutické možnosti
- Enzalutamid a abirateron v léčbě pacientů s metastatickým kastračně rezistentním karcinomem prostaty po podání chemoterapie
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



