-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Chirurgická liečba hydrocefalu a jej komplikácie
Complications of surgical treatment of hydrocephalus
Background:
Clinical outcome of children with hydrocephalus is determined by primary brain pathology and, nevertheless, by strategy of surgical treatment and subsequent complications. The aim of this study was to define the postoperative complication´s rate and its possible predictive factors.Methods:
We studied a population of 280 patients and 739 surgical procedures performed at the Department of paediatric surgery, Bratislava, in the years 2005–2012. We assessed the complication rate of external, internal drainage and neuroendoscopy.Results:
We observed a lower complication rate in patients with ventricular reservoir when compared to external ventricular drain (EVD) (3.2% versus 35% revision rate (p<0.001) and 11% versus 10.6 % infection rate (p=0.818) for reservoir and EVD respectively). Conversion to shunt or further neuroendoscopic procedure was needed in 77.3% patients. The EVDs were in situ for a mean time of 21.89 days, and the duration of EVD placement did not significantly influenced the infection rate (p=0.994).
Overall shunt complication rate was 50.4% (33.8% shunt revisions and 9.6% infection rate). Factors associated with higher complication rate were aetiology of hydrocephalus (p= 0.027) and age of child at the surgery <1 year (p=0.004). Overall success rate of endoscopic interventions (n=69) was 66.7%. Ventriculostomy (ETV) success rate was 58.5%. The positive predictive factors of successful ETV were age <1 year (p=0.001) and hydrocephalus without associated intraventricular cyst (p=0.043).Conclusion:
Neonatal ventricular reservoir due to its lower complication rate seems to be optimal for initial treatment of posthaemorrhagic hydrocephalus. The overall complication rate for endoscopic interventions was significantly lower compared to shunts (p=0.017).Key words:
hydrocephalus, surgical treatment, external drainage, shunt, neuroendoscopy
Autoři: D. Dúbravová 1; M. Fuňáková 1; E. Valachovičová 1; D. Šandorová 1; M. Kabát 1; V. Matejčík 2; J. Trnka 1; F. Horn 1
Působiště autorů: Klinika detskej chirurgie LFUK a DFNsP, Bratislavaprednosta doc. MUDr. J. Trnka, CSc. 1; Neurochirurgická klinika LFUK a UNB, Bratislavaprednosta prof. MUDr. J. Šteňo, CSc. 2
Vyšlo v časopise: Čes-slov Pediat 2014; 69 (2): 95-105.
Kategorie: Původní práce
Souhrn
Pozadie:
Prognózu detí s hydrocefalom ovplyvňuje nielen závažnosť základného poškodenia mozgového tkaniva, ale aj stratégia a pooperačné komplikácie chirurgickej liečby. Cieľom práce je zhodnotiť výskyt pooperačných komplikácií a stanoviť prediktívne faktory ich vzniku.Metodika:
Súbor tvorí 280 pacientov s hydrocefalom, u ktorých sme v rokoch 2005–2012 vykonali 739 chirurgických intervencií. Hodnotili sme komplikácie externej drenáže, internej drenáže a neuroendoskopie.Výsledky:
Zaznamenali sme nižšiu mieru komplikácií u pacientov s komorovým rezervoárom v porovnaní s kontinuálnou externou drenážou (EVD) – nutnosť revízie 3,2 % a 35 % (p <0,001); infekcia 11 % a 10,6 % (p = 0,818) pre rezervoár a EVD v tomto poradí. Indikácia permanentnej drenáže u dieťaťa s implantovaným rezervoárom bola stanovená u 77,3 % pacientov. Priemerná dĺžka zavedenia EVD bola 21,89 dňa. Dĺžka zavedenia EVD nemala vplyv na rozvoj infekčných komplikácií (p = 0,994).
Celková miera komplikácií implantovaných shuntov bola 50,4 % (dysfunkcia 33,8 %, infekcia 9,6 %). Faktory predisponujúce k vzniku komplikácií sú etiológia hydrocefalu (p = 0,027) a vek dieťaťa pri operácii <1 rok(p = 0,004). Celková úspešnosť neuroendoskopických intervencií (n = 69) bola 66,7 %. Funkčnú ventrikulostómiu (ETV) sme zrealizovali u 58,5 % pacientov. Pozitívne prediktívne faktory funkčnej ETV sú vek dieťaťa >1 rok (p <0,001) a hydrocefalus bez súčasnej intraventrikulárnej cysty (p = 0,043).Záver:
Neonatálny rezervoár vzhľadom na nižšiu mieru komplikácií považujeme za optimálny v iniciálnej terapii posthemoragického hydrocefalu. Celkový podiel komplikácií pri endoskopických intervenciách bol signifikantne nižší v porovnaní s komplikáciami shuntov (p = 0,017).Kľúčové slová:
hydrocefalus, terapia, externá drenáž, shunt, neuroendoskopiaÚvod
Hydrocefalus v detskom veku má rôznorodú etiológiu, variabilnú klinickú prezentáciu a v súčasnej dobe aj niekoľko možností chirurgického riešenia [1]. U detí sa vyskytuje najmä na vrodenom, posthemoragickom či postinfekčnom podklade alebo v asociácii s inými vrodenými vývojovými chybami (VVCH) [2, 3, 4, 5]. Chirurgická liečba hydrocefalu u detí už nie je iba o záchrane života, ale hlavne o jeho kvalite. Nové zobrazovacie metodiky podstatným spôsobom uľahčili diagnostiku, na druhej strane však odhaľujú i klinicky nemé formy. Základné ciele chirurgickej liečby sú zabezpečenie fyziologického tlaku intrakránia, optimálneho rastu neurokránia a normálneho vývoja dieťaťa [6].
Externá drenáž hydrocefalu s deriváciou likvoru mimo tela pacienta prostredníctvom komorového rezervoára alebo kontinuálnej externej drenáže predstavuje dočasnú formu drenáže. Pri pretrvávajúcej potrebe drenáže likvoru, resp. po preliečení infekcie či hemorágie, je nutné pristúpiť k internalizácii drenáže (ventrikuloperitoneálny, ventrikuloátriálny shunt) alebo k neuroendoskopii (obr. 1, 2) [7].
Obr. 1. Hydrocefalus riešený rezervoárom a ventrikuloperitoneálnym shuntom. Typické zmenšenie objemu komôr. A – CT mozgu pred zavedením VPS s implantovaným komorovým rezervoárom, B – CT mozgu 1 rok po implantácii, C – CT mozgu 2 roky po implantácii VPS. Fig. 1. Hydrocephalus cured with a ventriculoperitoneal shunt. A typical decrease of the chamber volume. A – Brain CT before the introduction of CPS ith implanted ventricular reservoir, B – brain CT one year after the implantation, C – brain CT two years of VPS implantation. 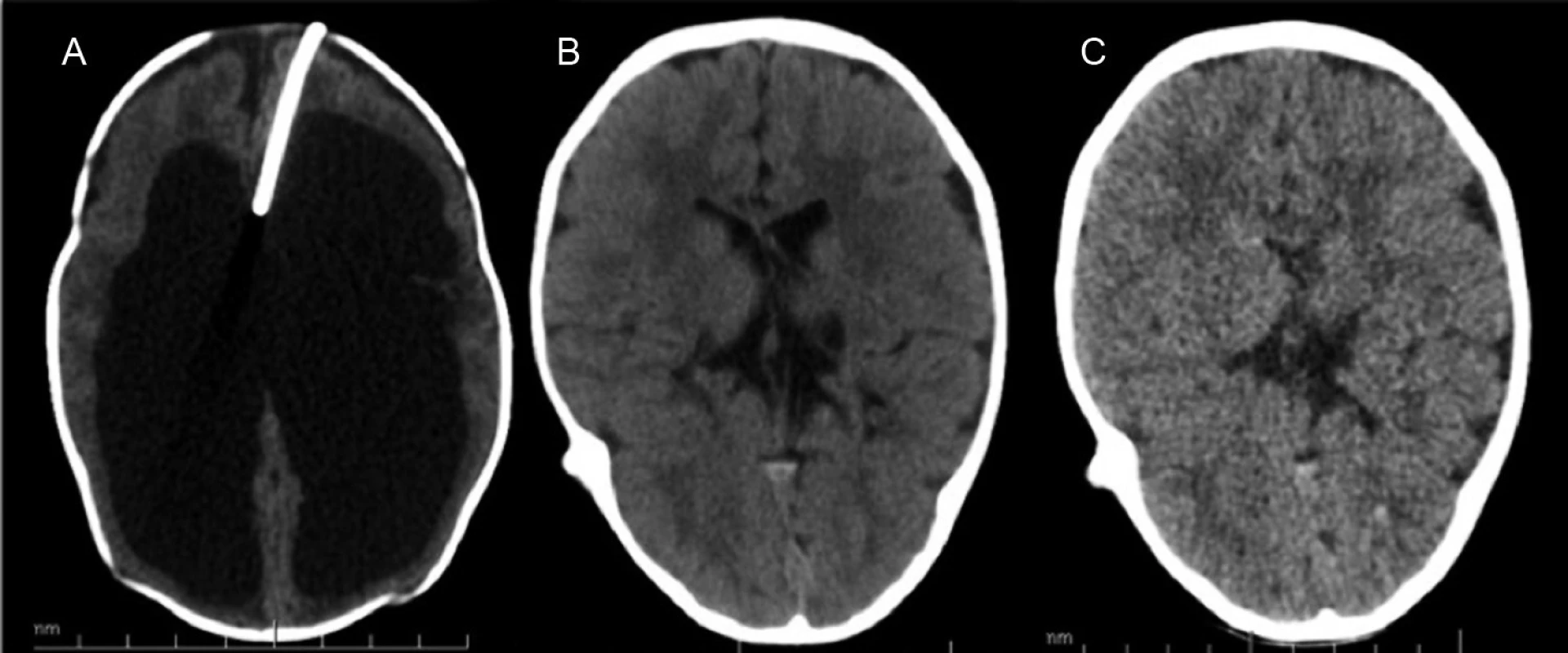
Obr. 2. Magnetická rezonancia pacienta s hydrocefalom riešeným neuroendoskopicky – ETV. A – predoperačné MRI mozgu, B – kontrolné MRI 18 mesiacov po ETV. Fig. 2. Magnetic resonance of a patient with hydrocephalus cured by neuroendoscopy – ETV. A – Preoperative MRI of the brain, B – control MRI 18 months after ETV. 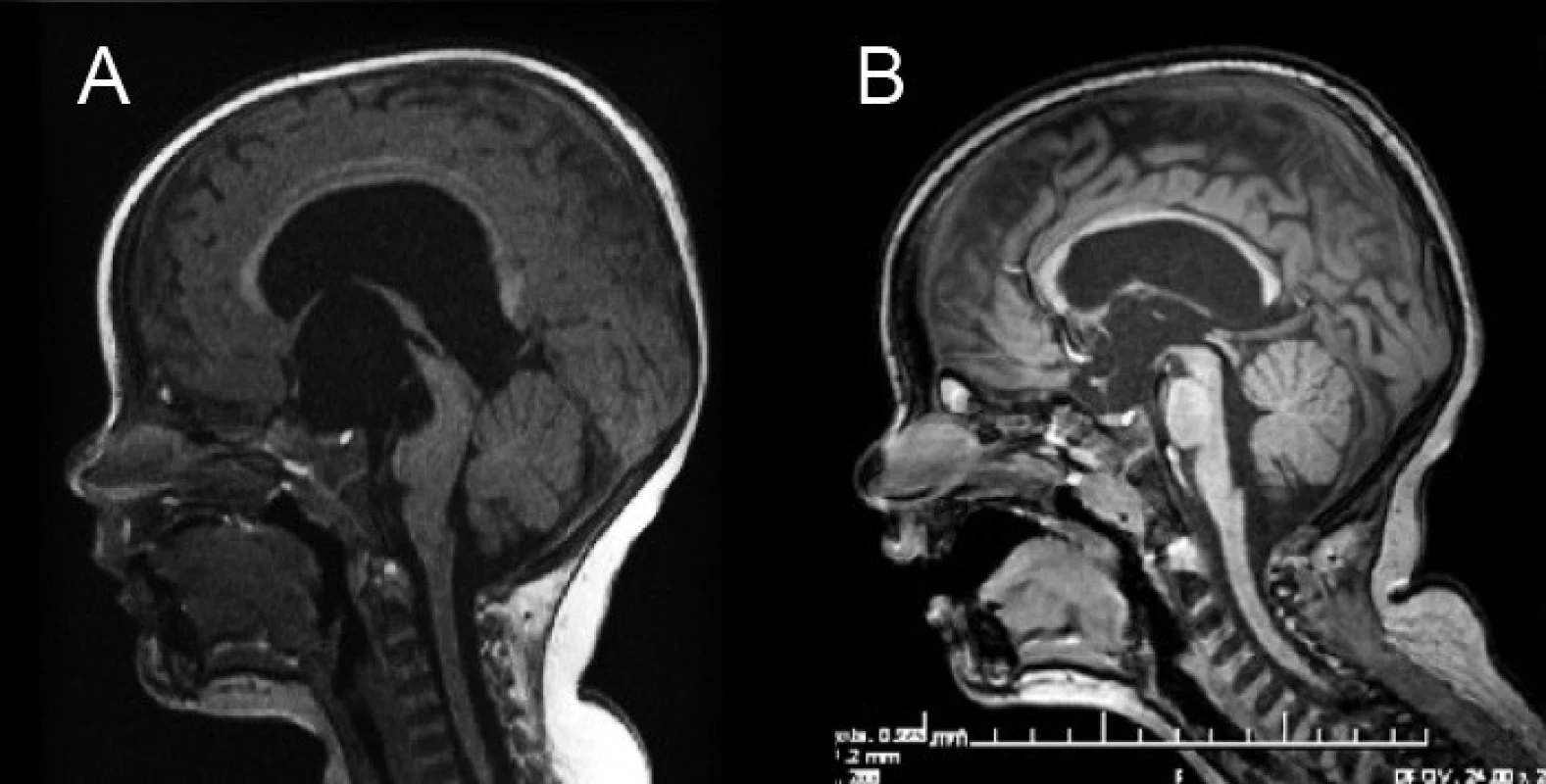
Kombinácia chirurgických postupov (drenážne operácie, endoskopické metódy) je často nevyhnutná, pričom minimalizácia počtu intervencií je pre pacienta benefitom. Komplikácie chirurgickej liečby sa podieľajú na opakovaných intervenciách u pacienta a negatívne ovplyvňujú kvalitu jeho života [8, 9].
V práci sumarizujeme komplikácie chirurgickej terapie hydrocefalu u detí na našom pracovisku v závislosti od etiológie hydrocefalu, veku dieťaťa pri operácii a zvolenej metódy chirurgického riešenia.
Metodika
Populáciu tvorí 739 operácií vykonaných u 280 pacientov s klinickou diagnózou hydrocefalus. Pacienti boli operovaní na Klinike detskej chirurgie v Bratislave v rokoch 2005–2012. Prematúrni novorodenci boli hospitalizovaní na Oddelení patologických novorodencov 1. Detskej kliniky v Bratislave. Priemerný vek pacientov pri operácii bol 58,05 mesiaca (medián 17 mesiacov, minimum 0,01 mesiaca, maximum 220 mesiacov).
Priemerný čas pooperačného sledovania bol 33,4 mesiaca (medián 27,5 mesiaca, minimum 0,01 mesiaca, maximum 94 mesiacov). Sledovanie sme ukončili po dovŕšení 19. roku života.
V sledovanom súbore sme hodnotili etiológiu hydrocefalu, vek pacienta pri operácii, typ chirurgickej intervencie, vznik a charakter pooperačných komplikácií.
Externú drenáž hydrocefalu sme realizovali implantáciou neonatálneho komorového rezervoára alebo kontinuálnej externej drenáže (EVD). Neonatálny rezervoár sme zaviedli najmä u pacientov v novorodeneckom veku za účelom derivácie hemoragického likvoru. U pacientov s implantovaným rezervoárom sme permanentnú drenáž indikovali pri pretrvávajúcej potrebe derivácie likvoru z rezervoára. Timing konverzie dočasnej drenáže na trvalú sme stanovovali individuálne na základe objemu denne derivovaného likvoru; klinického stavu, veku a hmotnosti dieťaťa; optických a biochemických vlastností likvoru. K internalizácii drenáže (ventrikuloperitoneálny/ventrikuloátriálny shunt) sme pristúpili u pacientov so 4-komorovým alebo polycystickým hydrocefalom. V prípade 3-komorového hydrocefalu s dobrými optickými vlastnosťami likvoru sme preferovali endoskopickú intervenciu.
Kontinuálnu externú drenáž s využitím štandardného alebo bactiseal katétra sme indikovali u starších pacientov s nutnosťou externej drenáže likvoru alebo v liečbe neuroinfekcie.
Internú drenáž hydrocefalu sme realizovali s využitím ventrikuloperitoneálneho (VPS) alebo ventrikuloátriálneho (VAS) shuntu. Typ implantovaného VPS/VAS bol zvolený podľa indikácie zo strany pacienta a preferencie operatéra.
Endoskopickú ventrikulostómiu (ETV) sme realizovali 3,5-mm flexibilným endoskopom. Indikáciou ventrikulostómie bola predoperačná verifikácia obštrukčného hydrocefalu na MR/CT s predpokladanou prekážkou v oblasti akveduktu alebo výtoku IV. komory. Kritériom úspešnej ventrikulostómie bola per-operačná verifikácia vytvorenej komunikácie III. komory s interpedunkulárnou/prepontínnou cisternou, stabilizácia ev. redukcia dilatácie komorového systému na zobrazovacích vyšetreniach a absencia symptomatológie intrakraniálnej hypertenzie (ICH) v klinickom i rádiologickom obraze. Pri známkach afunkcie ETV sme pristúpili k zavedeniu ventrikuloperitoneálneho shuntu.
Na štatistickú analýzu dát sme použili neparametrický Mannov-Whitneyho-Wilcoxonov test. Alternatívna hypotéza bola prijatá, ak výsledky boli považované za signifikantné (p ≤0,05). Všetky štatistické dáta sme analyzovali pomocou IBM SPSS statistics 20 pre Mac OS X 10.7.5.
Výsledky
I. Celkové hodnotenie súboru
Etiológiu hydrocefalu a percentuálne zastúpenie v sledovanom súbore znázorňuje graf 1. Populáciu tvorí 40 % pacientov s posthemoragickým hydrocefalom (PHH, n = 112); 22,8 % pacientov s kongenitálnym hydrocefalom (Kong HC, n = 64); 17,5 % pa-cientov s hydrocefalom v dôsledku otvoreného defektu neurálnej rúry (MMC, n = 49); 8,5 % pacientov s hydrocefalom v dôsledku ložiskového benígneho alebo malígneho procesu mozgu (Tumor CNS, n = 24); 6 % pacientov s postinfekčným hydrocefalom (PIH, n = 17) a 1 % pacientov s rozvojom hydrocefalu pri kraniocerebrálnom poranení (Trauma, n = 3).
Graf 1. Etiológia hydrocefalu v sledovanom súbore pacientov (n = 280) a zrealizovaných výkonov (n = 739). 
V hodnotenom súbore zrealizovaných výkonov (n = 739) tvorili 60,2 % operácie aso-ciované s implantáciou alebo revíziou formy internej drenáže (VPS/VAS) (n = 445); 21,9 % zavedenie alebo revízia kontinuálnej externej drenáže (EVD) (n = 162); 9,3 % endoskopické intervencie (n = 69) a 8,5 % implantácia neonatálneho rezervoára (n = 63).
II. Externá drenáž
Neonatálny komorový rezervoár
Populáciu tvorí 53 pacientov, u ktorých sme implantovali 63 komorových rezervoárov. Pri zhodnotení etiológie hydrocefalu 77,4 % (n = 41) tvorili prematúrni novorodenci s posthemoragickým hydrocefalom. Menšie zastúpenie mali pacienti s kongenitálnym hydrocefalom (n = 6), postinfekčným hydrocefalom (n = 2), hydrocefalom asociovaným s MMC (n = 2), s tumorom CNS (n = 1) a iné (n = 1). Dosiahnutý gestačný týždeň (g. t.) pacientov v sledovanom súbore bol v rozmedzí 24.–41. g. t. (priemer 32. g. t., medián 30. g. t.). Priemerný vek pri operácii bol 3,03 mesiaca (medián 1,84 mesiaca), priemerný korigovaný vek pri operácii 1 mesiac (medián 40. g. t.; 0,0 mesiaca).
Permanentné riešenie hydrocefalu bolo indikované u 77,3 % pacientov. U 67,9 % detí (n = 36) bol implantovaný VPS alebo VASa 9,4 % pacientov (n = 5) podstúpilo neuroendoskopickú intervenciu bez nutnosti zavedenia shuntu. Permanentnú chirurgickú liečbu hydrocefalu nevyžadovalo 22,7 % pacientov (n = 12).
Celková miera komplikácií pri implantácii komorového rezervoára bola 15,9 %, z čoho 3,2 % tvorili mechanické komplikácie, 1,6 % rozvoj subdurálneho (SDH) alebo epidurálneho (EDH) hematómu a 11 % infekčné komplikácie.
Po rozdelení pacientov podľa gestačného týždňa sme najlepšiu prognózu pozorovali u pacientov s dosiahnutým 32.–36. g. t. (n = 8); permanentné riešenie sme indikovali u 62,5 % pacientov (25 % ETV a 37,5 % VPS) a nezaznamenali sme žiadne pooperačné komplikácie. U pacientov s dosiahnutým 24.–27. g. t. (n = 13) sa pooperačné komplikácie rozvinuli v 13 % a permanentné riešenie hydrocefalu bolo indikované u 92,3 % pacientov, pričom u všetkých indikovaných pacientov sme pristúpili k internalizácii drenáže. Pacienti s 28.–31. g. t. (n = 16) vyžadovali permanentné riešenie v 75 % (12,5 % ETV a 62,5 % VPS) a miera pooperačných komplikácií bola 9 %. Paradoxne najvyššiu mieru komplikácií (23 %) sme zaznamenali u pacientov s dosiahnutým 37. a vyšším gestačným týždňom. V tejto skupine sme permanentnú drenáž indikovali u 75 % pacientov (6,25 % ETV a 68,75 % VPS).
Korigovaný vek pacienta pri implantácii rezervoára, rovnako ako dosiahnutý gestačný týždeň neovplyvňovali signifikantne následné chirurgické riešenie pacienta, t. j. nutnosť permanentného riešenia hydrocefalu (p = 0,848 a p = 0,249 pre korigovaný vek a g. t. v tomto poradí) alebo rozvoj pooperačných komplikácií (p = 0,848 a p = 0,681 pre korigovaný vek a g. t. v tomto poradí).
Kontinuálna externá drenáž (EVD)
V sledovanom súbore sme hodnotili 162 setov EVD implantovaných alebo revidovaných u 94 pacientov. Priemerný vek pacienta pri operácii bol 52,6 mesiaca (medián 12,5 mesiaca). Dôvodom zavedenia EVD bola v 52 % infekcia, v 28 % potreba drenáže biochemicky a kultivačne negatívneho likvoru (napr. pri peritonitíde, po endoskopickej intervencii a pod.) a v 20 % hemorágia.
Celkom 89,5 % pacientov vyžadovalo po zrušení EVD internalizáciu drenáže formou VPS alebo VAS (n = 85) a 9,5 % pacientov nevyžadovalo ďalšiu chirurgickú intervenciu (n = 9). Jeden pacient bol permanentne riešený neuroendoskopicky (1 %).
Celková miera komplikácií všetkých zavedených setov EVD bola 45,7 %. Najčastejšou komplikáciou bola mechanická dysfunkcia (zmena polohy proximálneho katétra, upchatie systému a pod.), ktorá predstavovala 85 % všetkých komplikácií. Infekčná komplikácia bola prítomná u 10,6 % pacientov a rozvoj EDH/SDH u 1 %.
Priemerná dĺžka implantovaného setu EVD bola 12,82 dňa. Priemerná dĺžka zavedenia EVD u pacienta bola 21,89 dňa. Pri analýze vzťahu dĺžky zavedenia EVD a vzniku infekčných komplikácií sme však nezaznamenali signifikantnú závislosť (p = 0,994) (graf 2).
Graf 2. Vzťah dĺžky zavedenia EVD a výskytu pooperačných komplikácií. 
Porovnanie jednotlivých foriem externej drenáže
Porovnanie ďalšieho chirurgického riešenia pacientov a výskytu komplikácií pri zavedení jednotlivých foriem externej drenáže (rezervoár alebo EVD) zobrazujú grafy 3 a 4.
Graf 3. Ďalšie chirurgické riešenie pacientov po zavedení externej drenáže. 
Graf 4. Výskyt a typ komplikácií po zavedení externej drenáže. 
III. Interná drenáž
Ventrikuloperitoneálny a ventrikuloátriálny shunt (VPS, VAS)
V sledovanom súbore sme hodnotili 445 chirurgických intervencií asociovaných s VPS resp. VAS u 236 pacientov. Z celkového počtu zavedených kompletných shuntov bolo 4,5 % VAS a 95,5 % VPS. Primárne implantácie VPS/VAS tvorili 22,5 % všetkých výkonov. Dominantnou príčinou revízie shuntu u pacienta bola jeho mechanická porucha (85,4 %, n = 240).
Celková miera pooperačných komplikácií bola 50,4 %. Grafické znázornenie vzniku komplikácií v časovom intervale od operácie dokumentuje graf 5.
Graf 5. Celková funkčnosť shuntov v závislosti od časového intervalu od operácie. 
Mechanické komplikácie shuntu – malpozícia, obštrukcia, dekonexia katétra, mechanická porucha ventilu a pod. – boli zaznamenané u 33,8 % výkonov (n = 151). Obštrukciu na úrovni proximálneho katétra, malpozíciu proximálneho katétra alebo dekonexiu proximálneho katétra od ventilu sme peroperačne zaznamenali u 35,7 % výkonov (n = 94). Obštrukcia na úrovni distálneho katétra, tvorba pseudocysty ev. nutnosť jeho elongácie bola príčinou chirurgickej revízie systému u 47,9 % operácií (n = 126). Poruchu na úrovni ventilu, t.j. potrebu jeho výmeny pre chronickú hyperdrenáž alebo obštrukciu, sme zaznamenali u 8,4 % operácií (n = 22). Porucha na viacerých úrovniach ev. neznáma príčina afunkcie VPS peroperačne bola prítomná pri 8 % intervencií (n = 21).
Infekcia shuntu v pooperačnom období sa vyskytla u 9,6 % pacientov (n = 42). Funkčná komplikácia – potreba revízie systému pre chronickú hyperdrenáž – tvorila 4,3 % (n = 19), výskyt SDH/EDH 1,1 % (n = 5) a aditívnu neuroendoskopickú intervenciu – fenestráciu septa alebo cysty – vyžadovali 2 % pacientov (n = 9).
K faktorom, ktoré predisponujú k vzniku komplikácií, patria etiológia hydrocefalu a vek dieťaťa pri operácii. Signifikantne vyšší podiel komplikácií sme zaznamenali u posthemoragického hydrocefalu v porovnaní s hydrocefalom v dôsledku meningomyelokély (MMC) (p = 0,027) a komplikácie sa vyskytli najmä u mladších pacientov, signifikantná bola veková hranica <1 rok (p = 0,004) (graf 6).
Graf 6. Závislosť veku pacienta a typu pooperačnej komplikácie. 
IV. Neuroendoskopické intervencie
Hodnotených bolo 69 neuroendoskopických výkonov zrealizovaných v rokoch 2005–2012 u 58 pacientov. Priemerný vek pri operácii bol 43,67 mesiaca. V etiológii hydrocefalu dominoval kongenitálny hydrocefalus (49,3 %, n = 34).
Najčastejším neuroendoskopickým výkonom bola endoskopická ventrikulostómia III. mozgovej komory, ktorá (samostatne alebo spojená so súčasnou aqueduktoplastikou či cystostómiou) tvorila 59,4 % všetkých intervencií (n = 41). Ďalej nasledovala cystostómia (26 %), ventrikuloskopia (5,8 %), endoskopická extrakcia alebo inzercia katétrov (4,4 %), fenestrácia sépt (2,9 %) a izolovaná aqueduktoplastika (1,5 %). Celkový úspech endoskopických zákrokov v našom súbore bol 66,7 %.
Infekčné pooperačné komplikácie v sledovanom súbore sa vyskytli u 5,7 % pacientov (n = 4). Intraventrikulárnu hemorágiu s nutnosťou zavedenia EVD sme zaznamenali u 1 pacienta, rovnako ako vytvorenie EDH/SDH v pooperačnom období (jednotlivo po 1,4 %).
Endoskopická ventrikulostómia III. komory (ETV)
Hodnotili sme 41 ventrikulostómií III. komory zrealizovaných v rokoch 2007–2012. Celková úspešnosť ETV bola 58,5 %. Infekčné komplikácie tvorili 4,2 % ( n =2) a intraventrikulárna hemorágia s nutnosťou zavedenia EVD 2,4 % (n = 1). Analýzou časových intervalov od operácie po oklúziu ventrikulostómie (t. j. po výskyt klinických a rádiologických charakteristík afunkcie ETV) je zrejmé, že percento funkčných ventrikulostómií najstrmšie klesá v prvých 4,5 mesiacoch od intervencie a krivka sa ustáli približne po 45 mesiacoch (graf 7).
Graf 7. Prognóza ventrikulostómie III. komory. 
Priemerný vek pacientov pri operácii bol 44,18 mesiaca (medián 12 mesiacov), pričom pacienti s funkčnou ventrikulostómiou boli signifikantne starší v porovnaní s pacientmi, u ktorých nastala oklúzia stómie, alebo neboli prítomné vhodné predpoklady pre fyziologické vstrebávanie likvoru (p = 0,02). Vyššia pravdepodobnosť vytvorenia funkčnej ventrikulostómie v našom súbore bola u pacientov starších ako 1 rok (p <0,001).
Samostatnú ventrikulostómiu sme zrealizovali u 56,1 % pacientov (n = 23). V ostatných 43,9 % intervencií sme ETV vykonali súčasne s cystostómiou, aqueduktoplastikou alebo septostómiou. Pravdepodobnosť úspešnosti samostatne vykonanej ETV alebo ETV spolu s akveduktoplastikou bola signifikantne vyššia v porovnaní s ETV vykonanou spolu s cystostómiou (p = 0,043 a p = 0,038 v tomto poradí).
Podiel všetkých vzniknutých komplikácií pri neuroendoskopických intervenciách bol signifikantne nižší v porovnaní s operáciami v súvislosti s implantáciou alebo revíziou VPS/VAS (p = 0,017) (graf 8).
Graf 8. Porovnanie výskytu komplikácií VP shuntu a endoskopických intervencií v časovom intervale od operácie. 
Diskusia
Hydrocefalus v detskom veku zahŕňa heterogénnu skupinu ochorení charakterizovanú dilatáciou komorového systému intrakránia rôzneho stupňa závažnosti, rozdielnej etiológie a patofyziológie [2, 5, 10]. V sledovanom súbore sme sa zamerali na zhodnotenie etiológie hydrocefalu a výskyt pooperačných komplikácií s cieľom identifikovať možné prediktívne faktory ich výskytu.
Externá drenáž
Implantácia rezervoára je vhodná najmä u prematúrneho novorodenca s intraventrikulárnou hemorágiou (IVH) a s následnou dilatáciou komorového systému za účelom externej derivácie hemoragického likvoru [11, 12]. Prematúrni novorodenci, hospitalizovaní na oddelení patologických novorodencov, tvorili 77,4 % pacientov s implantovaným rezervoárom v sledovanom súbore. Indikačným kritériom na zavedenie rezervoára je podľa literatúry progresívna dilatácia komorového systému (p = 0,04), bradykardia (p = 0,07), zvyklosti pracoviska (p <0,001), nadmerný trend rastu kránia, palpačne tuhšia veľká fontanela a rozstup lebečných švov [13, 14, 15, 16]. Indikácia permanentného riešenia hydrocefalu bola v našom súbore stanovená u 77,3 % pacientov s implantovaným rezervoárom. Percento pacientov s PHH, ktorí po iniciálnej dočasnej liečbe vyžadujú internalizáciu drenáže, je v literatúre udávané medzi 69–95 %, v našom súbore 67,9 % [14, 17]. Neuroendoskopicky boli definitívne, t. j. bez nutnosti implantácie VPS, riešení 5 pacienti v sledovanom súbore (9,4 %).
Celková miera komplikácií v súvislosti s implantovaným rezervoárom bola 15,9 %; 3,2 % tvorili mechanické komplikácie a 11 % infekčné komplikácie. Predpokladáme, že vyššia miera infekčných komplikácií je dôsledkom zníženej imunity prematúrneho novorodenca či prípadnej polymorbidity pacienta. Ďalej sa na výskyte infekčných komplikácií podieľa aj samotná technika punkcií likvoru. Infekčné komplikácie hodnotené v súbore sa vyskytli tiež u pacientov, ktorí boli hospitalizovaní na iných – nižších pracoviskách a na Kliniku detskej chirurgie boli preložení práve z dôvodu výskytu infekcie rezervoára k ďalšiemu riešeniu. Hodnoty parametrov infekčných komplikácií v našom súbore sú však porovnateľné s literatúrou [18].
Kontinuálnu externú drenáž sme implantovali najmä za účelom derivácie infikovaného likvoru (52 %). Priemerná dĺžka zavedenia EVD u pacienta bola 21,89 dňa, priemerná dĺžka zavedenia 1 setu EVD 12,82 dňa. V literatúre sa uvádza vplyv dĺžky obdobia implantovanej EVD na rozvoj infekčnej komplikácie (p = 0,037) [19]. V našom súbore sme však podobný vzťah nepreukázali (p = 0,994). Celková miera pooperačných komplikácií u pacientov bola 45,7 % (n = 43). Infekčné komplikácie tvorili 10,63 %, čo je výsledok porovnateľný s literatúrou – udávané sú hodnoty od 9,4 % do 18,3 % pre štandardné katétre a s mierne nižšou hodnotou (6,5 %) v prípade použitia bactisealových katétrov [19, 20]. Limitáciou štúdie v našom súbore je nemožnosť zhodnotiť infekčné komplikácie jednotlivo pri bactisealových a štandardných katétroch, keďže ide o retrospektívnu štúdiu.
Interná drenáž
Celková miera komplikácií bola 50,4 %, pričom 38 % zo všetkých komplikácií vzniklo do 1 mesiaca od operácie a 60 % do 3 mesiacov. Miera pooperačných komplikácií v našom súbore bola porovnateľná so súčasne publikovanými výsledkami zahraničných autorov alebo nižšia [21, 22]. Z celkového počtu komplikácií predstavovali mechanické komplikácie – malpozícia, obštrukcia, dekonexia katétra a pod. – 33,8 % (n = 151), infekcia9,6 % a iné komplikácie 7,4 % z celkového počtu intervencií. Podľa literatúry sú faktory predisponujúce k vzniku komplikácií mladší vek dieťaťa (najmä <1 rok), nižšia váha pacienta a etiológia hydrocefalu (PHH) [17]. V našom súbore sme ako prediktívne faktory pooperačných komplikácií preukázali etiológiu hydrocefalu, pričom signifikantne vyšší podiel komplikácií sme zaznamenali u pacientov s PHH v porovnaní s hydrocefalom v dôsledku otvoreného defektu neurálnej rúry (p = 0,027); a nižší vek pacienta pri operácii (<1 rok, p = 0,004).
Neuroendoskopia
Najčastejším endoskopickým výkonom bola ventrikulostómia III. komory, ktorá samostatne alebo spojená so súčasnou akveduktoplastikou či cystostómiou tvorila 59,4 % všetkých endoskopických intervencií. Endoskopická ventrikulostómia je v súčasnosti považovaná za metódu prvej voľby pri obštrukčnom hydrocefale. Mnohé štúdie stanovujú prediktívne faktory úspechu ETV: vek >12 mesiacov, vyklenujúca sa spodina III. komory a etiológia hydrocefalu iná ako PHH a MMC (optimálny je hydrocefalus v dôsledku stenózy akveduktu alebo tumoru CNS) [23, 24, 25]. V našom súbore sme ako negatívne prediktívne faktory úspešnej ETV stanovili vek dieťaťa <1 rok (p <0,001) a hydrocefalus asociovaný s intraventrikulárnou cystou (p = 0,043 a p = 0,038 v porovnaní s hydrocefalom bez cysty a hydrocefalus asociovaný s akveduktálnou stenózou). Niektorí autori však definujú ETV ako vhodnú metódu aj u pacientov mladších ako 1 rok [26]. Lepšiu prognózu ventrikulostómie sme zaznamenali aj u kongenitálneho hydrocefalu, tento rozdiel však nebol signifikantný. Celkovo môžeme zhodnotiť, že úspech ETV závisí najmä od správneho výberu pacientov. Benefit ETV je významný vzhľadom na potenciál oslobodiť pacienta od zavedenia shuntu. Celková úspešnosť ETV v literatúre sa pohybuje v rozmedzí od 58 do 81,5 %, pričom úspešnosť ETV v našom súbore bola na spodnej hranici udávaných hodnôt (58,5 %). Predpokladáme, že dôvodom je širšie spektrum indikovaných pacientov pri zavádzaní metodiky. Komplikácie ETV iné ako oklúzia stómie predstavovali 6,6 % (4,2 % infekcia a 2,4 % IVH), čo je porovnateľné s údajmi v literatúre [24, 27].
Pri porovnávaní metód permanentnej drenáže likvoru – ETV a VPS – sme zaznamenali vyššiu mieru úspešnosti a nižšiu mieru komplikácií pri endoskopickej ventrikulostómii ako pri VPS (p = 0,017). Považujeme preto za indikované zvážiť u každého nového pacienta s hydrocefalom i u pacienta s afunkciou shuntu neuroendoskopickú intervenciu. Každá metóda má však svoje opodstatnené miesto v problematike detskej neurochirurgie a navzájom sa môžu alternovať alebo dopĺňať [28].
Záver
Rôznorodosť etiológie a patomorfológie hydrocefalu v detskom veku podmieňuje individuálny prístup a stratégiu chirurgickej liečby, založenú na súčasných poznatkoch o komplikáciách a optimálnych indikáciách jednotlivých metodík na vlastnom pracovisku i v zahraničí.
Analýzou foriem externej drenáže v sledovanom súbore sme zaznamenali nižšiu mieru celkových komplikácií komorového rezervoára v porovnaní s EVD (15,9 % a 45,7 % pre rezer-voár a EVD v tomto poradí), miera infekčných komplikácií však bola porovnateľná – 11 % (rezervoár) a 10,6 % (EVD). Súbor pacientov s implantovaným rezervoárom tvorili najmä prematúrni novorodenci s IVH (77,4 %), pričom dosiahnutý gestačný týždeň alebo korigovaný vek pri operácii neovplyvňovali signifikantne indikáciu premanentnej drenáže u pacienta (p = 0,249 a p = 0,848 pre g. t. a korigovaný vek v tomto poradí). Indikácia internalizácie drenáže bola stanovená u 67,9 % pacientov s implantovaným rezervoárom a 9,4 % pacientov bolo riešených endoskopicky.
Pri implantácii VPS alebo VAS bola celková miera pooperačných komplikácií 50,4 % (mechanické komplikácie 33,8 %, infekcia shuntu 9,6 %). Ako faktory predisponujúce k vzniku pooperačných komplikácií sme identifikovali etiológiu hydrocefalu (PHH v porovnaní s MMC, p = 0,027) a vek dieťaťa pri operácii <1 rok (p = 0,004).
Celková úspešnosť neuroendoskopických výkonov bola 66,7 %. Za pozitívne prediktívne faktory vytvorenia funkčnej ETV považujeme vek pacienta >1 rok (p <0,001) a hydrocefalus bez súčasnej intraventrikulárnej cysty (p = 0,043).
Celkový podiel komplikácií pri endoskopických intervenciách bol signifikantne nižší v porovnaní s komplikáciami VP shuntu (p = 0,017).
Došlo: 23. 4. 2013
Přijato: 19. 2. 2014
MUDr. Dana Dúbravová
Klinika detskej chirurgie LFUK a DFNsP
Limbová 1
833 40 Bratislava
Slovenská republika
e-mail: dana333us@yahoo.com
Zdroje
1. Albright AL. Principles and Practice of Pediatric Neurosurgery. 2nd ed. New York: Thieme Medical Publishers, Inc., 2008 : 176–258.
2. Čižmár J, Behunová J, Podracká Ľ. Ligneózna konjunktivitída, hydrocefalus a protrahované respiračné infekcie u pacienta s deficitom plazminogénu. Čes-slov Pediat 2012; 67 (1): 38–42.
3. Prášil P, Čermáková Z, Plíšek S. Význam dynamiky sérologií a PCR diagnostiky k pravděpodobnosti vrozené toxoplazmózy u detí séropozitivních matek. Čes-slov Pediat 2010; 65 (7–8): 432–440.
4. Ješina P, Magner M, Poupětová H, et al. Mukopolysacharidóza I – klinické projevy u 24 dětí z České republiky a Slovenska. Čes-slov Pediat 2011; 66 (4): 215–225.
5. Behunová J, Podracká Ľ. Rázštepy nervovej trubice – súčasné pohľady na etiopatogenézu a možnosti prevencie kyselinou listovou. Čes-slov Pediat 2008; 63 (1): 38–46.
6. Šabová L, Horn F, Drdulová T, et al. Clinical condition of patients with neural tube defects. Rozhl Chir 2010; 89 (8): 471–477.
7. Šteňo J, Bízik I, Šteňo A, et al. Craniopharyngiomas in children: how radical should the surgeon be? Childs Nerv Syst 2011; 27 (1): 41–54.
8. Michalek J, Svetlikova P, Fedora M, et al. Bactericidal permeability increasing protein gene variants in children with sepsis. Intensive Care Med 2007; 33 (12): 2158–2164.
9. Chocholová M, Horn F, et al. Ventrikuloátriálna šantová nefritída. Čes-slov Pediat 2009; 64 (11): 548–549.
10. Vojtaššák J, Ďuríková M, Braxatorisová T, et al. Dvojitá trizómia (+13, +15) u samovoľného potratu. Čes-slov Pediat 2001; (9): 507–509.
11. Grešíková M. Tromboembolické príhody u novorodencov pohľadom dnešnej medicíny. Čes-slov Pediat 2011; 66 (5): 299–307.
12. Zoban P. Nedonošený novorozenec. Čes-slov Pediat 2012; 67 (3): 203–208.
13. Kolarovszki B, De Riggo J. Hodnotenie klinických príznakov intrakraniálnej hypertenzie vo vzťahu k indikácii drenážneho výkonu u novorodencov a dojčiat s hydrocefalom. Čes-slov Pediat 2008; 63 (10): 521–527.
14. Riva-Cambrin J, Shannon CN, Holubkov R, et al. Center effect and other factors influencing temporization and shunting of cerebrospinal fluid in preterm infants with intraventricular hemorrhage. J Neurosurg Pediatr 2012; 9 (5): 473–481.
15. Zibolen M. Hydrocefalus u novorodencov – význam sonografického vyšetrenia mozgu. Čes-slov Pediat 2010; 65 (9): 510–515.
16. Bassan H, Eshel R, Golan I, et al. Timing of external ventricular drainage and neurodevelopmental outcome in preterm infants with posthemorrhagic hydrocephalus. Eur J Paediatr Neurol 2012; 16 (6): 662–670.
17. Chittiboina P, Pasieka H, Sonig A, et al. Posthemorrhagic hydrocephalus and shunts: what are the predictors of multiple revision surgeries? J Neurosurg Pediatr 2013; 11 (1): 37–42.
18. Tian AG, Hintz SR, Cohen RS, et al. Ventricular access devices are safe and effective in the treatment of posthemorrhagic ventricular dilatation prior to shunt placement. Pediatr Neurosurg 2012; 48 (1): 13–20.
19. Camacho EF, Boszczowski I, Basso M, et al. Infection rate and risk factors associated with infections related to external ventricular drain. Infection 2011; 39 (1): 47–51.
20. Lemcke J, Depner F, Meier U. The impact of silver nanoparticle-coated and antibiotic-impregnated EVD catheters on the risk of infections: a clinical comparison of 95 patients. Acta Neurochir 2012; 114 (Suppl): 347–350.
21. Shannon CN, Acakpo-Satchivi L, et al. Ventri-culoperitoneal shunt failure: an institutional review of 2-year survival rates. Childs Nerv Syst 2012; 28 (12): 2093–2099.
22. Wu Y, Green NL, Wrensch MR, et al. Ventri-culoperitoneal shunt complications in California: 1990 to 2000. Neurosurgery 2007; 61 (3): 557–562.
23. Dlouhy BJ, Capuano AW, Madhavan K, et al. Preoperative third ventricular bowing as a predictor of endoscopic third ventriculostomy success. J Neurosurg Pediatr 2012; 9 (2): 182–190.
24. Navarro R, Gil-Parra R, Reitman AJ, et al. Endoscopic third ventriculostomy in children: early and late complications and their avoidance. Childs Nerv Syst 2006; 22 (5): 506–513.
25. Lipina R, Reguli S, Novácková L, et al. Relation between TGF-beta 1 levels in cerebrospinal fluid and ETV outcome in premature newborns with posthemorrhagic hydrocephalus. Childs Nerv Syst 2010; 26 (3): 333–341.
26. Costa Val JA, Scaldaferri PM, Furtado LM, et al. Third ventriculostomy in infants younger than 1 year old. Childs Nerv Syst 2012; 28 (8): 1233–1235.
27. Bouras T, Sgouros S. Complications of endoscopic third ventriculostomy: a systematic review. Acta Neurochir 2012; 113 (Suppl): 149–153.
28. Zeman L, Tichý M, Hořínek D, et al. Možnosti endoskopických technik v neurochirurgii při řešení hydrocefalu – první zkušenosti s využitím laparoskopie. Čes-slov Pediat 2006; 61 (6): 365–369.
Štítky
Neonatologie Pediatrie Praktické lékařství pro děti a dorost
Článek MikropenisČlánek Antonín Mrskoš
Článek vyšel v časopiseČesko-slovenská pediatrie
Nejčtenější tento týden
2014 Číslo 2- Horní limit denní dávky vitaminu D: Jaké množství je ještě bezpečné?
- Isoprinosin je bezpečný a účinný v léčbě pacientů s akutní respirační virovou infekcí
- Syndrom Noonanové: etiologie, diagnostika a terapie
-
Všechny články tohoto čísla
- Antropometrické, hormonálne a metabolické zmeny u prepubertálnych detí, narodených ako SGA, so zníženým rastom, liečených rastovým hormónom, po prvom roku liečby
- Osteogenesis imperfecta asociovaná s izolovaným deficitom rastového hormónu
- Polohové anomálie varlat a kryptorchismus v prvním roce života
- Mikropenis
- 11. Český pediatrický kongres s mezinárodní účastí
- „EVIDENCE BASED PHARMACOTHERAPY IN NEWBORNS AND CHILDREN“
- Odešel prof. Dr. med. Dr. med. h. c. mult. Theodor Hellbrügge
- Antonín Mrskoš
- Vzťah medzi obezitou a závažnosťou hypertenzie u detí a adolescentov
- Výsledky rozšířeného novorozeneckého screeningu v České republice
- Etické aspekty rozšiřování novorozeneckého screeningu dědičných metabolických poruch
- Chirurgická liečba hydrocefalu a jej komplikácie
- Česko-slovenská pediatrie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Mikropenis
- Chirurgická liečba hydrocefalu a jej komplikácie
- Polohové anomálie varlat a kryptorchismus v prvním roce života
- Výsledky rozšířeného novorozeneckého screeningu v České republice
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



