-
Medical journals
- Career
Chemoterapie u invazivního a metastatického nádoru močového měchýře
Authors: J. Katolická
Authors‘ workplace: Onkologicko-chirurgické oddělení FN u svaté Anny, Brno
Published in: Urol List 2011; 9(3): 40-45
Overview
Svalovinu infiltrující karcinom močového měchýře je agresivní epiteliální tumor. Standardním postupem léčby je radikální cystektomie. Studie s neoadjuvantní a adjuvantní chemoterapií mají za cíl oddálit relaps onemocnění a zvýšit možnost vyléčení pacienta. Léčba metastatického karcinomu močového měchýře je založena na aplikaci režimů s cisplatinou.
Klíčová slova:
invazivní karcinom močového měchýře, chemoterapie, biologická léčbaNEOADJUVANTNÍ CHEMOTERAPIE
Standardním postupem u pacientů s lokalizovaným, svalovinu infiltrujícím karcinomem močového měchýře je radikální cystektomie s derivací moči. Část pacientů má riziko vzniku vzdálených metastáz a také lokoregionální recidivy. Multi-modální přístup ve formě neoadjuvantní nebo adjuvantní chemoterapie byl hodnocen v randomizovaných trialech a může být použit ke snížení počtu relapsů, a zvýšit tak možnost vyléčení pacienta [1]. U pacientů se svalovinu infiltrujícím karcinomem močového měchýře je nejdůležitější identifikovat jak nemocné, kteří mohou být radikální cystektomií vyléčeni, tak nemocné, kteří mají vysoké riziko lokální rekurence nebo vzniku metastáz. I přes radikální operaci se přibližně u poloviny těchto nemocných do dvou let objeví vzdálené metastázy [2]. Podání systémové chemoterapie založené na cisplatině aplikované před radikální cystektomii (neoadjuvantně) nebo po ní (adjuvantně) má potenciál eradikovat mikrometastázy a může prodloužit přežití takto léčených nemocných. Proto je, zejména předoperační podání chemoterapie, mnohými doporučováno jako nový standard léčby invazivního karcinomu močového měchýře. Aplikace chemoterapie neoadjuvantně má několik výhod: intaktní vaskularizaci, která je často operací změněná, s lepším průnikem chemoterapie, je také předpoklad zmenšení primárního tumoru s možností větší radikality operačního výkonu, a tím navození delší remise a/nebo prodloužení přežití takto léčených nemocných. Pacienti mají často lepší toleranci chemoterapie předoperačně než pooperačně [3]. Určitou nevýhodou tohoto postupu je možnost oddálení definitivní lokální terapie, a tím progrese onemocnění. Výsledky několika randomizovaných studií [4–8] a metaanalýza [9] všech trialů s neoadjuvantní chemoterapií u invazivního karcinomu močového měchýře favorizují kombinaci chemoterapie založené na cisplatině v kombinaci s radikální cystektomií před cystektomií samotnou (tab. 1).
Table 1. Výsledky randomizovaných klinických trialů s neoadjuvantní chemoterapií u svalovinu infiltrujícího karcinomu močového měchýře. 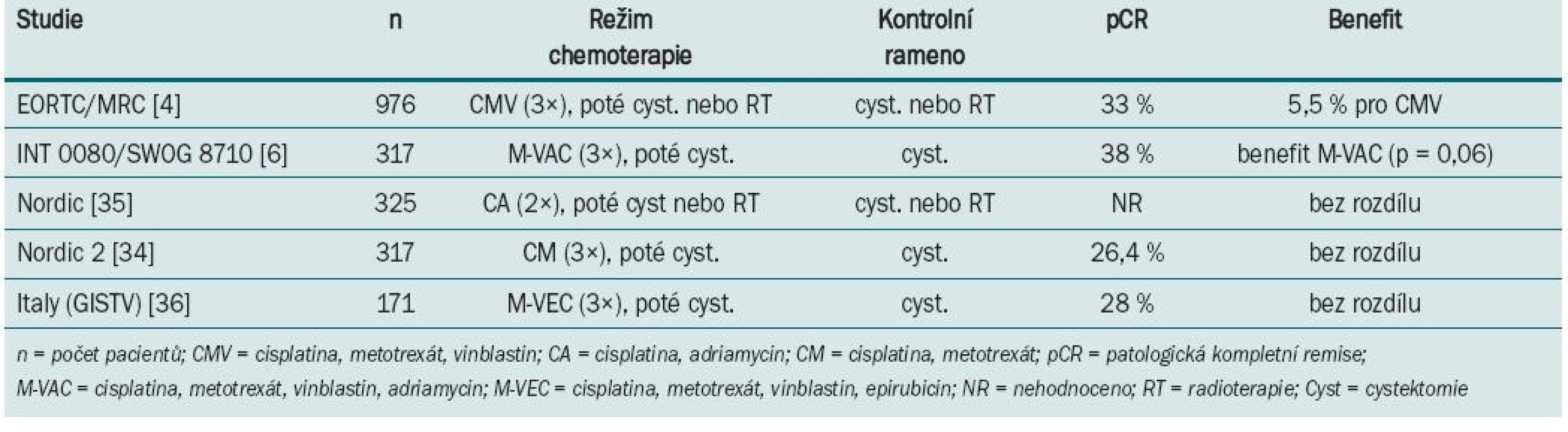
Největší studie s neoadjuvantním podáním chemoterapie (BA0630894) zařadila celkem 976 pacientů s T2–T4 uroteliálním karcinomem grade 3,4, kteří byli v 106 centrech randomizováni v průběhu 5,5 roku do ramene s chemoterapií režimem s cisplatinou, metotrexátem a vinblastinem (CMV) a do ramene bez chemoterapie [4]. Následně podle zvyklostí centra byla provedena radikální cystektomie a/nebo radioterapie. U 42 % pacientů s chemo-terapií a 43 % bez chemoterapie byla jako definitivní řešení zvolena radioterapie. Patologické kompletní remise bylo dosaženo u 33 % nemocných léčených chemoterapií s neoadjuvantním záměrem. Celkové přežití podobu tří let bylo 55 vs 50 % s absolutním benefitem přežití 5 %, který favorizuje rameno s chemoterapií. Poslední aktualizace po osmi letech sledování prokázala signifikantní 16% redukci rizika úmrtí u pacientů, kteří podstoupili neoadjuvantní chemoterapii CMV před radioterapií a/nebo cystektomií; to odpovídá nárůstu tříletého přežití z 50 na 56 %, zvyšuje možnost desetiletého přežití z 30 na 36 % a zvyšuje medián přežití o sedm měsíců (z 37 na 44 měsíců) u pacientů léčených kombinací CMV ve srovnání s těmi, kteří byli léčení pouze lokální terapií [10]. V trialu US Intergroup (INT 0080) bylo 307 z 317 zařazených pacientů s T2–T4a uroteliálním karcino-mem randomizováno do ramene s třemi cykly neoadjuvantní chemoterapie M-VAC (n = 154) před cystektomií nebo ramene bez chemoterapie (n = 153) pouze s cystektomií [6]. Studie trvala celkem 13 let. Patologické kompletní remise (pCR) bylo po neoadjuvantní chemoterapii dosaženo v 38 %. Medián sledování byl 8,7 let. Pacienti léčení chemoterapií měli tendenci zlepšení mediánu celkového přežití (77 vs 46 měsíců, p = 0,06). Následná retrospektivní analýza ukázala, že delší přežití (> 80 % v pěti letech) bylo spojeno nejen s podáním chemoterapie, ale také patologickým hodnocením a technickým provedením cystektomie, zejména nepřítomností pozitivních okrajů a disekcí pelvických lymfatických uzlin, kdy bylo v resekátu minimálně deset lymfatických uzlin. Randomizované klinické trialy NORDIC a GISTV neprokázaly benefit v prodloužení přežití u nemocných léčených chemoterapií.
Některé z randomizovaných klinických studií neprokázaly benefit v prodloužení přežití po podání neoadjuvantní chemo-terapie. Neadekvátní velikost vzorku, suboptimální chemoterapie, předčasné ukončení a/nebo neadekvátní sledování byly často atributy negativních výsledků. Aktualizace přehledů a metaanalýz klinických trialů byla publikována Advanced Bladder Cancer meta-analysis collaboration [9]. U pacientů, kteří byli před cystektomií léčeni chemoterapií založené na cisplatině, byl prokázán 5% absolutní benefit prodloužení přežití (p = 0,003). Data o kvalitě života nebo toxicitě různých chemoterapeutických režimů v neoadjuvantním podání nejsou dostatečně zpracována. Většina pacientů ve studiích EORTC/MRC, INT 0080 a Nordic studiích byli mladší nemocní, s mediánem věku 63–65 let, ve výborném klinickém stavu, s dobrými renálními funkcemi, což neodpovídá běžně léčené, především starší populaci s řadou interkurentních nemocí. Standardně používaný chemoterapeutický režim gemcitabin s cisplatinou používaný u metastatického karcinomu [12] nebyl prospektivně hodnocen v neoadjuvantním podání. Retrospektivní studie Dashe [13] prokázala pCR u 26 %, což je srovnatelné s ostatními režimy založenými na cisplatině. Pro pacienty, u kterých je cisplatina kontraindikována, může být přínosem v neoadjuvantním podání léčba paclitaxelem v kombinaci s gemcitabinem a carboplatinou. Studie fáze II [14] u pacientů s T2–T4, N0 nebo různé T, N1–3 byla prokázána pCR v 30 %. Problémem je ale toxicita, kdy byla pozorována neutropenie G III–IV u každého takto léčeného nemocného. Studie s akcelerovaným MVAC režimem podávaným v čtrnáctidenním intervalu za podpory růstových faktorů prokázala efekt chemoterapie a minimální oddálení definitivního řešení [15]. Plný počet cyklů chemoterapie absolvovalo 84 % léčených, u všech 80 nemocných proběhla plánovaná definitivní terapie (60 radikálních cystektomií, 20 radioterapií). pCR bylo dosaženo u 43 % pacientů a objektivní radiologické odpovědi bylo dosaženo u 75 % léčených. Toxicita minimálně G 3 byla u 11 % nemocných. Tento dobře tolerovatelný režim s dobrou odpovědí by vyžadoval další, především randomizované, studie. V současnosti probíhá několik studií s biologickou léčbou (tab. 2).
Table 2. Probíhající studie s neoadjuvantní chemoterapií u invazivního karcinomu močového měchýře. 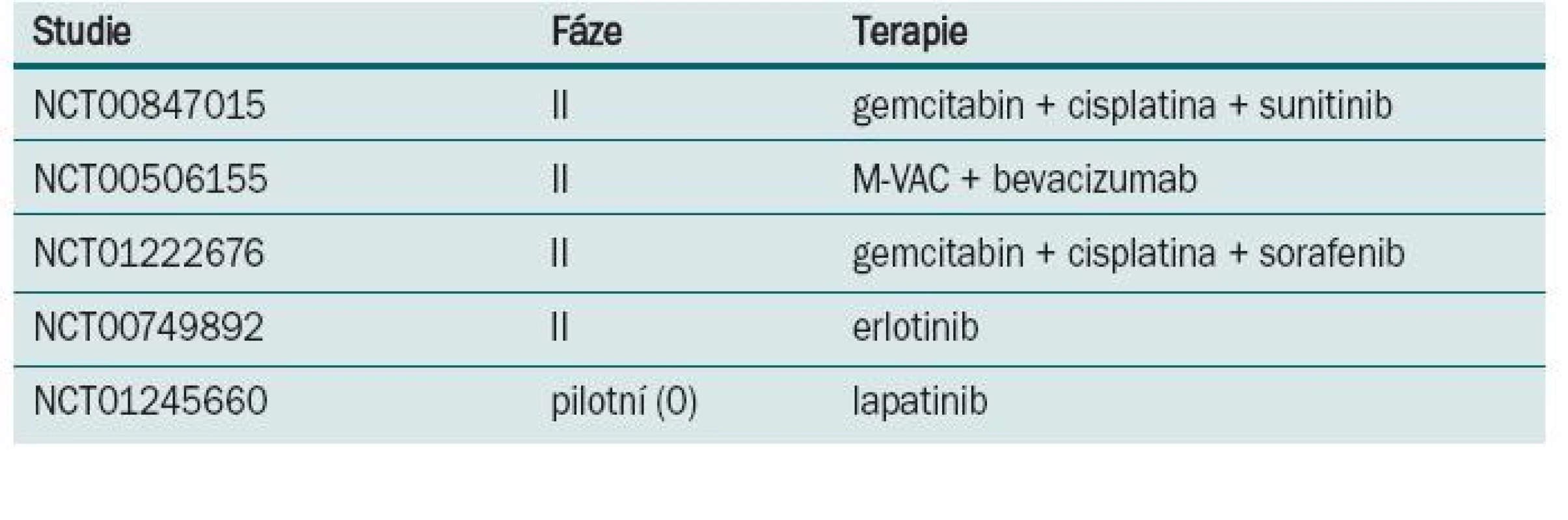
Primárním cílem léčby invazivního karcinomu močového měchýře je léčba s kurativním záměrem, šetření močového měchýře je druhořadé. Orgán šetřící postup je preferován především u starších nemocných s řadou přidružených nemocí a rizikem chirurgického výkonu. Dosažení kompletní remise a zachování močového měchýře je jedna z možných výhod předoperačního podání chemoterapie. Ne-randomizovaná studie se 111 pacienty, s T2–T3 N0 M0 uroteliálním karcinomem léčenými režimem M-VAC v neoadjuvantním podání prokázala stejné desetileté přežití jak ve skupině s radikální cystektomií, kde přežívalo 65 % odléčených, tak ve skupině s transuretrální resekcí nebo parciální cystektomií, kde přežívalo 75 % nemocných [16]. Studie Stenbergové [17] na 104 pacientech s T2–T4 uroteliálním karcinomem léčených M-VAC chemoterapií v neoadjuvanci, kde u 65 nemocných byl podle klinického hodnocení odpovědi na chemoterapii zachován močový měchýř (TURBT nebo parciální cystektomie). U 39 nemocných byla provedena radikálnícystektomie – beze změny. V hodnocení pětiletého přežití ve skupině se zachovaným močovým měchýřem přežívalo 67 % pacientů, ve skupině s radikální cystektomií 46 %. Na základě těchto výsledků při dosažení regrese primárního tumoru po neoadjuvantní chemoterapii je možné uvažovat o parciálním výkonu nebo zachování močového měchýře, ale s rizikem metachronního karcinomu a vědomím, že se nejedná o kurativní výkon.
CHEMOTERAPIE METASTATICKÉHO KARCINOMU MOČOVÉHO MĚCHÝŘE
První linie léčby
Standardním postupem v léčbě inoperabilního lokálně pokročilého nebo metastatického karcinomu je chemoterapie. Chemoterapeutické režimy založené na cisplatině u uroteliálního karcinomu močového měchýře dosahují vysokých odpovědí, ale medián přežití se i přes agresivní terapii pohybuje kolem 15 měsíců.
Režim M-VAC v nerandomizovaném klinickém trialu [18] prokázal regresi tumoru u 72 % nemocných, z toho v 36 % bylo dosaženo kompletní remise. Po dobu tří let přežívalo 55 % léčených, kteří této kompletní remise dosáhli. Následně byl M-VAC srovnáván s monoterapií/cisplatinou v prospektivní randomizované studii [19]. Režimem M-VAC nebo cisplatinou v 28denním intervalu bylo léčeno do progrese nebo maximálně šesti cykly 269 nemocných. M-VAC byl spojen s vysokou toxicitou, zejména leukopenií, mukositidou, febrilní neutropenií a také úmrtím spojeným s léčbou. Procento dosažených odpovědí, doba do progrese i celkové přežití bylo u kombinace M-VAC ve srovnání s monoterapií cisplatinou vyšší (39 vs 12 %, 10,0 vs 4,3 měsíce, 12,5 vs 8,2 měsíce). Další randomizovaný trial [20] srovnával M-VAC s režimem CISCA (cisplatina, cyklofosfamid a doxorubicin). Léčbou M-VAC bylo dosaženo vyšší procento odpovědí (65 vs 45 %) a také delší přežití (48 vs 36 týdnů) ve srovnání s léčbou kombinací CISCA. M-VAC byl v randomizovaném trialu EORTC fáze III (protokol #30924) srovnáván ve standardním dávkovacím režimu a ve vysokodávkovaném režimu [21]. Pacienti byli randomizováni do ramene s high-dose M-VAC podávaným každé dva týdny s podporou růstových faktorů a do ramene se standardním dávkováním podávaným každé čtyři týdny. Bylo dosaženo rozdílů v počtu objektivních odpovědí (63 vs 50 %), kompletních remisí (21 vs 9 %), doby do progrese (9,1 vs 8,2 měsíce), ale nebylo dosaženo rozdílu v celkovém přežití, které bylo stanoveno jako primární cíl (15,5 vs 14,1 měsíce). V následné revizi po sedmi letech sledování prokázal high-dose M-VAC signifikantní redukci rizika úmrtí v pětiletém sledování (21,8 vs 13,5 %; hazard ratio = 0,76). Toxicita byla vyšší v rameni s M-VAC. Na základě této studie byl high-dose M-VAC zaveden v řadě center jako standardní terapeutický režim. Ve studiích fáze II prokázal gemcitabin v kombinaci s cisplatinou odpověď v 50 % s mediánem přežití 14 měsíců. Na základě těchto výsledků byla provedena randomizovaná studie fáze III na 405 pacientech srovnávající čtyřkombinaci M-VAC s dvojkombinací gemcitabin/cisplatina [22]. Chemoterapie byla aplikována každé čtyři týdny s maximem do šesti cyklů. Většího počtu podaných cyklů za menší toxicity bylo dosaženo v dvojkombinačním režimu. Počet odpovědí (49 vs 46 %), doba do progrese (7,4 vs 7,4 měsíce) i celkové přežití (13,8 vs 14,8 měsíce) bylo v obou ramenech stejné. Bezpečnostní profil byl ale jednoznačně lepší pro rameno s gemcitabinem. Tyto výsledky posunuly kombinaci gemcitabin/cisplatina na místo standardního režimu pro pokročilý uroteliální karcinom močového měchýře. U metastatického karcinomu močového měchýře proběhla celá řada studií s taxany. V trialu EORTC fáze III (protokol #30987) byl ke kombinaci gemcitabin/cisplatina přidán paclitaxel. V tripletu sice bylo dosaženo vyššího počtu objektivních odpovědí (57 vs 46 %) a kompletních remisí (15 vs 10 %), ale statisticky signifikantního rozdílu v celkovém přežití dosaženo nebylo (15,7 vs 12,8 měsíce) [23]. Kombinace docetaxel/cisplatina byla srovnávaná s režimem M-VAC ve studii fáze III Hellenic Co-operative Oncology Group [24]. Ve všech sledovaných parametrech – odpověď na léčbu, doba do progrese, doba přežití – bylo v rameni s M-VAC dosaženo lepších výsledků. Studie EORTC (protokol #30986) srovnávala gemcitabin s carboplatinou s metotrexátem, carboplatinou a vinblastinem (M-CAVI) u pacientů s pokročilým karcinomem močového měchýře, kteří pro renální dysfunkci nebo komorbidity nemohou být léčení cisplatinou. Zařazeno bylo 178 nemocných, objektivních odpovědí v rameni s gemcitabinem a carboplatinou bylo dosaženo u 42 % léčených a u kombinace M-CAVI u 30 %. Carboplatina je variantou pro pacienty s kontraindikacemi cisplatiny, studie také ukázala, že věk není kontraindikací pro podání cisplatiny [25]. S lepším a hlubším poznáním biologie tumorů a cest regulace nádorového růstu např. VEGFR, EGFR, mTOR je i u karcinomu močového měchýře testována biologická léčba. Probíhá celá řada studií s biologickou léčbou v I. linii terapie metastatického karcinomu močového měchýře (tab. 3).
Table 3. Probíhající klinické studie s biologickou léčbou v I. linii léčby metastatického karcinomu močového měchýře. 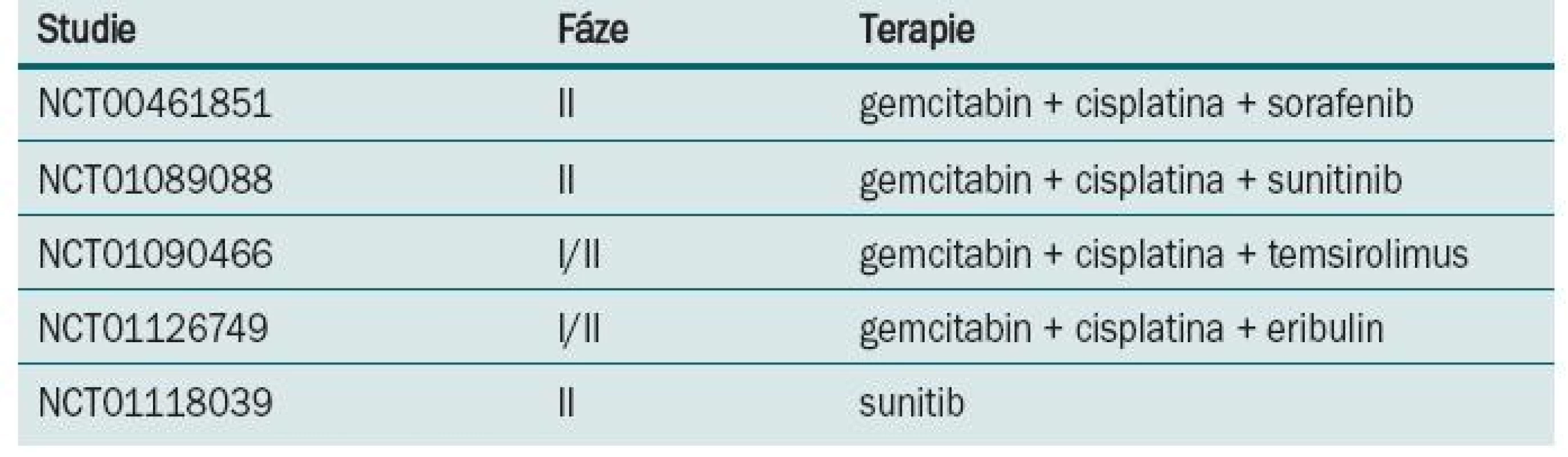
Bevacizumab ve studii fáze II Hoosier Oncology Group (GU 04-75) byl aplikován současně s gemcitabinem a cisplatinou v dávce 15 mg/kg každé tři týdny, u 72 % léčených bylo dosaženo objektivní odpovědi, kompletní remise bylo dosaženo u 21 % pacientů, doba bez progrese onemocnění byla 8,2 měsíce a celková doba přežití 20,4 měsíce. V současné době probíhá velká studie fáze III [26]. Pozitivita HER-2 neu pacientů s uroteliálním karcinomem močového měchýře je velmi variabilní, a to 8,5–81 %. Ve studii fáze II, kde byl trastuzumab u HER-2 neu pozitivních pacientů kombinován s paclitaxelem, carboplatinou a gemcitabinem, bylo u 70 % léčených dosaženo objektivní odpovědi, doba do progrese byla 9,3 měsíců a medián přežití 14,1 měsíců. I když jsou tyto výsledky u HER-2 neu pozitivních pacientů velmi slibné, není prozatím u uroteliálního karcinomu močového měchýře testování HER-2 neu exprese standardem [27].
Druhá linie léčby
Definovat standardní režim pro II. linii léčby uroteliálního karcinomu močového měchýře je velmi složité. Souvisí to především s kondicí pacientů, u kterých je po první linii prokázaná progrese onemocnění. Je poměrně těžké zařadit do klinické studie pro II. linii pacienta a po celou dobu studie ho v ní udržet. Monoterapie s paclitaxelem, ifosfamidem, docetaxelem prokázaly 20% a menší odpověď. Kombinační režimy např. gemcitabin s paclitaxelem a oxaliplatina s fluorouracilem (FOLFOX) demonstrovaly odpovědi od 20–27 % se signifikantní hematologickou toxicitou a periferní neuropatií. Pro druhou linii léčby uroteliálního karcinomu močového měchýře zatím není definován standardní režim.
Vinflunin, vinca alkaloid třetí generace, byl testován v druhé linii léčby u relabujícího nebo refrakterního pokročilého uroteliálního karcinomu močového měchýře po předchozí léčbě založené na cisplatině ve studii fáze III [28]. Trial srovnával léčbu vinfluninem v kombinaci s nejlepší podpůrnou léčbou (BSC) vs BSC. Celkem 370 pacientů bylo randomizováno do ramene vinflunin plus podpůrná léčba a do ramene pouze s podpůrnou léčbou v poměru 2 : 1. V rameni s vinfluninem se z hlediska toxicity G > 3 nejvíce objevila neutropenie (50 %), febrilní neutropenie (6 %), anémie (19 %), únava (19 %) a zácpa (16 %). Pacienti léčení kombinací vinflunin + BSC přežívali 6,9 měsíce, nemocní léčení pouze BSC 4,6 měsíce, tento dvouměsíční rozdíl ale nebyl statisticky signifikantní (p = 0,287). Následná Cox analýza hodnotící i prognostické faktory prokázala statisticky signifikantní efekt vinfluninu na celkové přežití (p = 0,036) a redukci rizika úmrtí o 23 %. Procento objektivních odpovědí (8,6 vs 0 %), procento kontroly nemoci (41,4 vs 24,8 %) a doba do progrese onemocnění (3,0 vs 1,5 měsíce) byly také statisticky signifikantní ve prospěch vinfluninu. Pokud vezmeme v úvahu ještě k tomu dobrý bezpečností profil vinfluninu, můžeme ho doporučit do druhé linie léčby uroteliálního karcinomu po selhání nebo intoleranci cisplatiny v první linii. Německá studie fáze III srovnávala krátkodobou terapii (maximálně šest cyklů chemoterapie po 21 dnech) a dlouhodobou terapii (léčba do progrese onemocnění) v kombinaci paclitaxel plus gemcitabin v druhé linii léčby u metastatického uroteliálního karcinomu po selhání prvoliniové terapie založené na cisplatině [29]. Výsledky neprokázaly rozdíl v celkovém přežití (7,8 vs 8,0 měsíce), době do progrese (4 vs 3,1 měsíce) ani počtu objektivních odpovědí (37,5 vs 41,5 %). Větší počet anémií (26 vs 6,7 %) se vyskytoval v rameni s dlouhodobou léčbou. Účinnost pemetrexedu byla hodnocena v druhé linii léčby studií Hoosier Oncology Group [30]. Objektivních odpovědí bylo 27,7 %, doba do progrese 2,9 měsíce a doba přežití 9,6 měsíce. Vzhledem k roli VEGFR a EGFR na růst a progresi uroteliálního karcinomu probíhá celá řada klinických studií s cílenou léčbou jako sunitinib (multikinázový TKi), everolimus (mTOR inhibitor), dále lapatinib (HER-2 a EGFR TKi), erlotinib (HER-1 a HER-2 TKi) a jiné.
ADJUVANTNÍ CHEMOTERAPIE
Podání adjuvantní chemoterapie má podobně jako aplikace neoadjuvantní chemoterapie řadu otazníků. Je zde několik randomizovaných trialů, kterým jsou ale vyčítány chyby ve statistickém hodnocení, designu a také hodnocení velikosti a biologické aktivity tumoru. Systematická metaanalýza jednotlivých pacientských dat z adjuvantních studií byla publikována v roce 2005 [31]. Výsledky založené na hodnocení 491 nemocných léčených v těchto trialech reprezentují 90 % všech nemocných randomizovaných do trialů založených na cisplatině a 66 % nemocných ze všech hodnocených studií. Výsledkem je 25% redukce rizika úmrtí pro ramena s chemoterapií ve srovnání s rameny s kontrolami, s celkovým hazard ratio pro přežití 0,75 (p = 0,019), což nepředstavuje spolehlivý základ pro adjuvantní léčbu. Italská studie fáze III pro pacienty s pT2G3, pT3–4, N0–2 po radikální cystektomii, kteří byli randomizováni do ramene se čtyřmi cykly gemcitabin plus cisplatina a do ramene se sledováním v mediánu follow-up 32,5 měsíce, prokázala stejné procento relapsů (43 vs 45 %) bez rozdílu v době do progrese onemocnění. V rameni s chemoterapií po dobu tří let přežívalo 67 % léčených, v rameni se sledováním 48 %. Tříletá doba bez progrese onemocnění byla zaznamenána u 47 % pacientů, resp. 35 %. Adjuvantní terapie tedy nepřinesla výraznější benefit [32]. Randomizovaná studie fáze III Spanish Oncology Genitourinary Group trial 99/01 sledovala pacienty s vysoce rizikovým, svalovinu infiltrujícím karcinomem močového měchýře s pT3–4 a/nebo N+, kde v jednom rameni byli léčeni čtyřmi cykly kombinace paclitaxel, gemcitabin a cisplatina nebo v druhém rameni pouze sledováni [33]. V mediánu sledování po dobu 51 měsíců byl zaznamenán statisticky významný rozdíl v celkovém přežití. Pět let přežívalo 60 % nemocných léčených chemoterapií a 31 % pouze sledovaných. Ve skupině s chemoterapií byla také delší doba do progrese, delší doba přežití bez příznaků onemocnění a také delší přežití v závislosti na nádorovém onemocnění. Velké studie jako EORTC trial (protokol #30994) a studie Cancer and Leukemie Group B byly předčasně ukončeny.
Na základě výsledků starších studií, metaanalýz a moderních klinických trialů není jasně definováno doporučení pro adjuvantní chemoterapii u uroteliálního karcinomu močového měchýře. Pacienti s pT2, N0 by po radikální cystektomii měli být pouze sledováni, u pacientů s pT3–4 a/nebo N+ by po radikální cystektomii měla následovat chemoterapie čtyřmi cykly M-VAC nebo gemcitabin/cisplatina [1].
CHEMOTERAPIE JINÝCH HISTOLOGICKÝCH TYPŮ NÁDORŮ MOČOVÉHO MĚCHÝŘE
Spinocelulární karcinom močového měchýře je v západních zemích diagnostikován v 3–5 %. U metastatického karcinomu je možné použít režim s cisplatinou nebo carboplatinou, gemcitabinem, paclitaxelem [37]. Adenokarcinomy jsou diagnostikovány v 0,5–2 % všech typů malignity močového měchýře. Chemoterapie je velmi individuální konvenční léčba, např. režim M-VAC nepřináší benefit [38]. Primární malobuněčný nebo neuroendokrinní karcinom močového měchýře je velmi agresivní. Jeho léčba je vedena podobně jako léčba malobuněčných plicních karcinomů [39]. U diseminovaných sarkomů je možné použít doxorubicin a ifosfamid. Gemcitabin s cisplatinou je doporučován v léčbě pacientů s metastatickým sarkomatoidním karcinomem [1].
MUDr. Jana Katolická, Ph.D.
Onkologicko-chirurgické oddělení FN u svaté Anny, Brno
jkatolicka@tiscali.cz
Sources
1. Vishnu P, Mathew J, Tan WW. Current therapeutic strategies for invasive and metastatic bladder cancer. Onco Targets and Therapy 2011; 4 : 97–113.
2. Raghavan D, Shipley WU, Garnick MMB et al. Biology and management of bladder cancer. N Engl J Med 1990; 322(16): 1129–1138.
3. Teramukai S, Nishiyama H, Matsui Y et al. Evaluation for surrogacy of end points by using data from observational studies: tumor downstaging for evaluating neoadjuvant chemotherapy in invasive bladder cancer. Clin Cancer Res 2006; 12(1): 139–143.
4. Neoadjuvant cisplatin, methotrexate, and vinblastine chemotherapy formuscle-invasive bladder cancer: a randomised controlled trial. International collaboration of trialists. Lancet 1999; 354(9178): 533–540.
5. Sherif A, Rintala E, Mestad O et al. Neoadjuvant cisplatin-methotrexate chemotherapy for invasive bladder cancer – Nordic cystectomy trial 2. Scand J Urol Nephrol 2002; 36(6): 419–425.
6. Grossman HB, Natale RB, Tangen CM et al. Neoadjuvant chemotherapy plus cystectomycomparedwithcystectomyaloneforlocallyadvancedbladdercancer. N Engl J Med 2003; 349(9): 859–866.
7. Malstrom PU, Rintala E, Wahlquist R et al. Five-year follow up of prospective trial of radical cystectomy and neoadjuvant chemotherapy: nordic cystectomy trial 1. The Nordic Cooperative Bladder Cancer Study Group. J Urol 1996; 155(6): 1903–1906.
8. Cortesi E. Neoadjuvant treatment for locally advanced bladder cancer: a randomized prospective clinical trial. American Society of Clinical Oncology Annual Meeting. 1995. Philadelphia, PA.
9. Vale CL. Meta-analysis Group MCTU, London, UK. Neoadjuvant chemotherapy in invasive bladder cancer: update of a systematic review and meta-analysis of individual patient data advanced bladder cancer (ABC) meta-analysis collaboration. Eur Urol 2005; 48(2): 202–205; discussion 205–206.
10. Griffiths G, trialists. OboIco. International phase III trial assessing neoadjuvant cisplatin, methotrexate, and vinblastin chemotherapy for muscle-invasive bladder cancer: long term results of the BA06 30894 Trial. J Clin Oncol 2011. doi: 10.1200/JCO.2010. 32.3139
11. Herr HW, Faulkner JR, Grossman HB et al. Surgical factors influence bladder cancer outcomes: a cooperative group report. J Clin Oncol 2004; 22(14): 2781–2789.
12. von der Maase H, Hansen SW, Roberts JT et al. Gemcitabin and cisplatin versus methotrexate, vinblastine, doxorubicin, and cisplatin in advance dormetastatic bladder cancer: results of a large, randomized, multinational, multicenter, phase III study. J Clin Oncol 2000; 18(17): 3068–3077.
13. Dash A, Pettus JA, Bochner BH et al. Efficacy of neoadjuvant gemcitabine plus cisplatine (GC) in muscle-invasive urothelial cancer (UC). American Society of Clinical Oncology Annual Meeting 2007; Chicago, IL.
14. Smith DC, Grivas P, Daignault S et al. A phase II trial ofneoadjuvant ABI-007, carboplatine and gemcitabine (ACG) in patients with localy advanced carcinoma of bladder. American Society of Clinical Oncology Genitourinary cancer symposium; 2011, Orlando, FL.
15. Blick C, Hall P, Pwint T et al. Accelerated MVAC as neoadjuvant chemotherapy for patients with muscle-invasive transitional cell carcinoma of bladder. American Society of Clinical Oncology Genitourinary cancer symposium; 2011, Orlando, FL.
16. Herr HW, Bajorin DF, Scher HI. Neoadjuvant chemotherapy and bladder-sparing surgery for invasive bladder cancer: ten-year outcome. J Clin Oncol 1998; 16(4): 1298–1301.
17. Stenberg CN, Pansadoro V, Calabro F et al. Can patients election for bladder preservation be based on response to chemotherapy? Cancer 2003; 97(7): 1644–1652.
18. Sternberg CN, Yagoda A, Scher HI et al. Methotrexate, vinblastine, doxorubicin and cisplatin for advanced transitional cell carcinoma of the urothelium. Efficacy and patterns of response and relapse. Cancer 1989; 64(12): 2448–2458.
19. Loehrer PJ Sr., Einhorn LH, Elson PJ et al. A randomized comparison of cisplatina loneor in combination with methotrexate, vinblastine and doxorubicin in patients with metastatic urothelial carcinoma: a cooperative group study. J Clin Oncol 1992; 10(7): 1066–1073.
20. Logothetis CJ, Dexeus FH, Finn L et al. A prospective randomized trial comparing MVAC and CISCA chemotherapy for patients with metastatic urotelial tumors. J Clin Oncol1990; 8(6): 1050–1055.
21. Sternberg CN, de Mulder PH, Schornagel JH et al. Randomized phase III trial of high-dose-intensity methotrexate, vinblastine, doxorubicin and cisplatin (MVAC) chemotherapy and recombinant human granulocyte colony-stimulating factor versus classic MVAC in advanced urothelial tract tumors: European Organization for Research and Treatment of Cancerprotocol no. 30924. J Clin Oncol 2001; 19(10): 2638–2646.
22. von der Maase H, Hansen SW, Roberts JT et al. Gemcitabine and cisplatine versus methotrexate, vinblastine, doxorubicin and cisplatin in advanced ormetastatic bladder cancer: results of a large, randomized, multinational, multicenter, phase III study. J Clin Oncol 2000; 18(17): 3068–3077.
23. Bellmunt J, von der Maase H, Mead GM et al. Randomized phase III study comparing paclitaxel/cisplatine/gemcitabine (PCG) and gemcitabine/ /cisplatin (GC) in patients with locally advanced (LA) ormetastatic (M) urothelial cancer without prior systemic therapy. American Society of Clinical Oncology Annual Meeting 2007; Chicago, IL.
24. Bamias A, Aravantinos G, Deliveliotis C et al. Docetaxel and cisplatinwith granulocyte colony-stimulating factor (G-CSF) versus MVAC with G-CSF in advanced urothelial carcinoma: a multicenter, randomized phase III study from Helenic Cooperative Oncology Group. J Clin Oncol 2004; 22(2): 220–228.
25. Dreicer R, Manola J, Roth BJ et al. Phase III trial methotrexate, vinblastine, doxorubicin and cisplatin versus carboplatin and paclitaxel in patients with advanced carcinoma of urotelium. Cancer 2004; 100(8): 1639–1645.
26. Hahn NM, Stadler WM, Zon R et al. Mature results from Hoosier Oncology Group GU 04–75 phase II trial ofcisplatin (C), gemcitabine (G) and bevacizumab (B) as first-line chemotherapy for metastatic urothelial carcinoma (UC). American Socienty of Clinical Oncology Annual Meeting:2010. Chicago, IL.
27. Hussain RS, Vaishampayan U, Du W et al. Combination paclitaxel, carboplatin, and gemcitabineisan active treatment for advanced urothelial cancer. J ClinOncol 2001; 19(9): 2527–2533.
28. Bellmunt J, Theodore C, Demkov Z et al. Phase III trial of vinflunine plus best supportive care alone after a platinum-containing regimen in patients with advanced transitional cell carcinoma of the urothelial tract. J ClinOncol 2009; 27(27): 4454–4461.
29. Albers P, Park SI, Niegisch G et al. Randomized phase III trial of 2nd line gemcitabine and paclitaxel chemotherapy in patients with advanced bladder cancer: short-term versus prolonged treatment (German Association of urological Oncology (AUO) trial AB 20/99) Ann Oncol 2011; 22(2): 288–294.
30. Sweeney CJ, Roth BJ, Kabbinavar FF et al. Phase II study of pemetrexedfor second-line treatment of transitional cell cancer of the urothelium. J Clin Oncol 2006; 24(21): 3451–3457.
31. Vale CL, On behalf of Meta-analysis Group MCTU, London, UK. Adjuvant chemotherapy in invasive bladder cancer: a systematic review and meta-analysis of individual patient data Advanced Bladder Cancer (ABC) Meta-analysis Collaboration. Eur Urol 2005; 482(2): 189–199; discussion 199–201.
32. Cognetti F, Ruggeri EM, Felici A et al. Adjuvantchemotherapy (AC) withcisplatin + gemcitabine (GC) versus chemotherapy (CT) at relapse (CR) in patients (pts) with muscle-invasive bladder cancer (MIBC) submitted to radical cystectomy (RC). An Italian multicenter randomised phase III trial. American Society of Clinical Oncology Annual Meeting; 2008. Chicago, IL.
33. Paz-Ares G, Solsona E, Esteban E et al. Randomized phase III trial comparing adjuvant paclitaxel/gemcitabine/cisplatin (PGC) to observation in patients with resected invasive bladder cancer: results of the Spanish oncology Genitourinary Group (SOUGUG) 99/01 study. American Society of Clinical Oncology Annual Meeting; 2010. Chicago, IL.
34. Sherif A, Rintala E, Mestad O et al. Neoadjuvant cisplatin-methotrexate chemotherapy for invasive bladder cancer – Nordic cystectomy trial 2. Scand J Urol Nephrol 2002; 36(6): 419–425.
35. Malmstrom PU, Rintala E, Wahlqvist R et al. Five-years followup of a prospective trial of radical cystectomy and neoadjuvant chemotherapy: nor-dic cystectomy trial I. The Nordic Cooperative Bladder Cancer Study Group. J Urol 1996; 155(6): 1903–1906.
36. Cortesi E. Neoadjuvant treatment for locally advanced bladder cancer: a randomized prospective clinical trial. American Society of Clinical Oncology Annual Meeting; 1995, Philadelphia, PA.
37. Swanson DA, Liles A, Zagars GK. Preoperative irradiation and radical cystectomy for stages T2 and T3 squamous cell carcinoma of the bladdder. J Urol 1990; 143(1): 37–40.
38. Lughezzani G, Sun M, Jeldres C et al. Adenocarcinoma versus urothelial carcinoma of urinary bladder: comparison between pathologic stage a tradical cystectomy and cancer-specific mortality. Urology 2010; 75(2): 376–381.
39. Choong NW, Quevado JF, Kaur JS. Small cell carcinoma of the urinary bladder. The Mayo Clinic experience. Cancer 2005; 103(6): 1172–1178.
Labels
Paediatric urologist Urology
Article was published inUrological Journal

2011 Issue 3-
All articles in this issue
- Možnosti neinvazivní diagnostiky a monitorace karcinomů močového měchýře
- Možnosti a místo chirurgické léčby superficiálního karcinomu močového měchýře
- Intravezikální instilační terapie povrchového karcinomu močového měchýře
- Ileální neovezika a její varianty
- Karcinom močového měchýře – nejnovější poznatky v oblasti operační a medikamentózní léčby
- Chemoterapie u invazivního a metastatického nádoru močového měchýře
- Role botulotoxinu při léčbě dysfunkce dolních cest močových u pacientů s roztroušenou sklerózou
- EAU Guidelines pro léčbu uroteliálního karcinomu močového měchýře, který neinvaduje svalovinu - aktualizovaná verze z roku 2011
- Léčba metastazujícího karcinomu močového měchýře a karcinomu invadujícího svalovinu - aktualizovaná verze EAU Guidelines
- Urological Journal
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Ileální neovezika a její varianty
- Intravezikální instilační terapie povrchového karcinomu močového měchýře
- Léčba metastazujícího karcinomu močového měchýře a karcinomu invadujícího svalovinu - aktualizovaná verze EAU Guidelines
- Možnosti neinvazivní diagnostiky a monitorace karcinomů močového měchýře
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

