-
Medical journals
- Career
Hypereozinofilie
Authors: J. Novotný
Authors‘ workplace: Oddělení klinické hematologie, FN Brno
Published in: Transfuze Hematol. dnes,27, 2021, No. 4, p. 278-282.
Category: Review/Educational Papers
doi: https://doi.org/10.48095/cctahd2021278Overview
Hypereozinofilie (HE) a hypereozinofilní syndrom (HES) představují etiopatogeneticky velmi polymorfní patologické syndromy mnohdy s obtížnou diferenciální diagnostikou. HES se závažným postižením tkání a orgánů vyžaduje promptní terapeutický zásah, zvláště při poškození srdce. Celosvětově jsou nejčastější příčinou HE parazitární onemocnění, v našich zeměpisných podmínkách je zatím vzácná. V rozvinutých zemích jsou nejčastější etiologií atopie (astma, rinitida, atopické dermatózy), lékové alergie, autoagresivní procesy a neoplazie. Asi u 50 % pacientů s HES se nepodaří prokázat příčinu HE – zde hovoříme o idiopatickém HES (iHES). Lékem první volby u závažného HES jsou vysokodávkované kortikosteroidy, slibná jsou biologická léčiva ve formě monoklonálních protilátek (mepolizumab, reslizumab, benralizumab, alemtuzumab), u HE s prokázanou aberantní tyrozinkinázovou aktivitou indikujeme inhibitory tyrozinové kinázy (TKI). Specifický přístup vyžaduje chronická eozinofilní leukemie (CEL-NOS – not otherwise specified). S postupným odhalováním prozatím nejasných příčin HE bude u řady pacientů s diagnózou iHES odkryta specifická etiologie HE.
Klíčová slova:
terapie – diagnóza – hypereozinofilie – hypereozinofilní syndrom – chronická eozinofilní leukemie
Úvod
Normální zastoupení eozinofilů v periferní krvi odpovídá 0–6 % rozpočtu s absolutními hodnotami 0–0,5×109/l, přičemž hypoeozinofilie není spojena s žádnými patologickými projevy [1]. Normální hodnoty eozinofilů v kostní dřeni jsou 1–6 % rozpočtu. Eozinofily jsou terminálně diferencovanými granulocyty, které hrají roli v přirozené imunitě, tkáňovém remodelingu a reparaci a jsou spojeny s patogenezí určitých onemocnění [1]. Eozinofily jsou primárně tkáňově rezidentními leukocyty. Za normálních okolností eozinofily opouštějí periferní cirkulaci a migrují do tkání, kde mohou perzistovat několik týdnů. Gastrointestinální trakt představuje největší rezervoár eozinofilů, ve kterém jsou tyto buňky přítomné ve sliznici od žaludku po tlusté střevo [2]. O eozinofilii hovoříme při zmnožení těchto elementů v periferii nad hodnotu 0,5×109/l, přičemž hodnoty 0,5–1,5×109/l označujeme jako mírnou eozinofilii. Při hodnotách 1,5–5,0×109/l hovoříme o středně těžké eozinofilii a hodnoty nad 5,0×109/l označujeme jako těžkou eozinofilii [2]
HYPEREOZINOFILIE A HES
Termínem hypereozionofilie (HE) rozumíme zmnožení eozinofilů nad 1,5×109/l, které perzistuje nejméně ve dvou stanoveních v odstupu více než 6 měsíců a/nebo kratší dobu při výrazné tkáňové infiltraci a/nebo výrazné dřeňové hypereozinofilii (zmnožení eozinofilní linie nad 20 % rozpočtu) [2,3]. Pokud je HE spojena s patologiemi cílových orgánů (poškození a/nebo poruchy funkce srdce, nervové soustavy, kůže, plic a GIT), diagnostikujeme po vyloučení klonální a reaktivní (sekundární) hypereozinofilie hypereozinofilní syndrom (HES). HES představuje velmi heterogenní skupinu klinických syndromů. Někteří nemocní vykazují známky HES i roky po stanovení periferní HE [2].
HE můžeme nazírat jako sekundární (reaktivní) formu s přítomností řady klinických syndromů a jednotek a jako primární klonální procesy při přítomnosti specifických genetických odchylek a/nebo u myeloidních patologií, kdy jsou eozinofily součástí klonálních proliferací (myeloidní HES-mHES).
Sekundární formy HE jsou zapříčiněny nadprodukcí IL-3, IL-5 a GM-CSF, které secernují mastocyty, stromální elementy a T-lymfocyty [4]. Nejčastější příčinou sekundární HE celosvětově představují parazitární onemocnění. V našich podmínkách jsou sekundární HE způsobeny přítomností alergií, polékových reakcí, autoagresivních onemocnění a neoplazií [4].
L-HES je zapříčiněn klonální hyperplazií aberantních T-Lymfocytů (CD4+CD3–) s hyperprodukcí IL-5. Klonální expanzi T-lymfocytů prokazujeme přestavbou T-celulárního receptoru [4].
Familiární HES je vzácným autozomálně dominantním onemocněním s nejasnou patogenezí, zatím zde nebyly prokázány specifické mutace. Onemocnění vykazuje většinou benigní průběh [1].
Primární (idiopatický) HES diagnostikujeme per exclusionem při neprokázání reaktivních nebo klonálních etiologií po extenzivním vyšetření pacienta [5]. Až 50 % HES spadá do této kategorie (iHES). S přibývajícími poznatky v diagnostice HES bude u řady případů iHES postupně nalezena specifická příčina.
Orgánová postižení u HES jsou způsobena degranulací eozinofilů s lokálním uvolněním potencionálně toxických substancí (maior basic protein 1 a 2, eozinofilní peroxidáza, eozinofilní kationický protein, eozinofilní neurotoxin). Postiženy mohou být kterékoli tkáně či orgány – nejčastěji se jedná o kůži, plíce, CNS, periferní nervy, GIT, srdce. Zvláště kardiální postižení (endomyokardiální fibróza, srdeční insuficience, trombózy s embolickými příhodami, restriktivní kardiomyopatie, poruchy rytmu, akutní infarkt myokardu, mitrální a trikuspidární valvulární insuficience) je spojeno s významnou mortalitou. U HES často detekujeme všeobecné příznaky (teploty, noční poty, úbytek váhy, artralgie, myalgie). Další příznaky souvisejí s výše uvedenými postiženími orgánů [1].
Nejčastější parazitární onemocnění představují Ancylostoma duodenale, Toxocarosis, Bilharziosis, Trichinelosis, Filariosis, Strongyloidiasis. Mezi infekční příčiny HE mohou patřit i HIV infekce, COVID-19 infekce [6], mykotická onemocnění, scabies, bakteriální infekce, alergická bronchopulmonární aspergilóza [7]. Při podezření na parazitární etiologii HE je nutná anamnéza cestování do tropických oblastí, dále jsou indikována serologická vyšetření a vyšetření stolice na parazity, případně vajíčka helmintů. Je vhodná konzultace parazitologa.
HE může být vzácně přítomna u Addisonovy choroby a tyreotoxikózy [7].
Alergické etiologie HE jsou spojeny s diagnózou astmatu, alergické rinitidy, atopické dermatózy a polékových přecitlivělostí. Řada medikamentů může vyvolat alergickou reakci či reakci se systémovými příznaky (exantém, teploty, lymfadenopatie, pneumonie, hepatitis a renální insuficience), hovoříme zde o DRESS syndromu (drug rash with eosinophilia and systemic symptoms). DRESS syndrom může mít i fatální průběh [1]. Často u alergických symptomů nacházíme zvýšení IgE. V diagnostice alergických syndromů provádíme funkční plicní vyšetření a kožní testy odhalující hypersenzitivitu, eventuálně bronchoskopii s histologickým vyšetřením, dále invazivní bronchoalveolární laváž s průkazem eozinofilů ve vzorku.
Autoagresivní onemocnění mohou být spojena s HE. Jedná se o systémový lupus erythematodes, revmatoidní artritidu, zánětlivá střevní onemocnění (colitis ulcerosa, morbus Crohn), eozinofilní granulomatóza s polyangitidou (EGPA syndrom, dříve Churg-Strauss syndrom) [8], chronická reakce štěpu vůči hostiteli (graft-versus host disease – GvHD) apod. Indikujeme zde vyšetření autoprotilátek (ANA, anti-DS DNA, ANCA aj.).
Neoplazie jako příčina sekundární HE: byly popsány B a T lymfoproliferace, Hodgkinův lymfom, bronchiální karcinom, GIT nádory (tumory žaludku, kolon, pankreatu) [1].
Etiopatogeneticky nejasné syndromy představují eozinofilní fasciitis, eozinofilní ezofagitis, eozinofilní gastroenteritis.
Syndrom eozinofilie myalgie (EMS) je spojen s ingescí tryptofanu. V popředí jsou myalgie, svědění, edémy, myozitida a fasciitida [10]. Toxický Oil syndrom (TOS) po požití anilinem kontaminovaného denaturovaného řepkového oleje postihl 25 000 pacientů eozinofilií, pneumonií, sklerotizující dermatózou a dalšími orgánovými příznaky s 400 až 2500 úmrtími [10,11]. Zajímavostí je zvýšená frekvence výskytu antifosfolipidových protilátek u pacientů s EMS a TOS. Klinický význam těchto protilátek je nejasný [12].
Eozinofilní plicní syndromy vídáme v podobě Löfflerova syndromu (měnlivé eozinofilní plicní infiltráty s eozinofilií různé etiologie – parazitární onemocnění, alergické reakce apod.), alergické bronchopulmonární aspergilózy, chronické eozinofilní pneumonie, aj.
Eozinofilní ezofagitis (EoE) je vzácným onemocněním s příznaky dysfagie a eozinofilní infiltrací omezenou na ezofagus. Při chronickém průběhu vede k remodelaci tkáně a fibróze s výslednou přítomností striktur. Jednotku nutno odlišit od refluxní nemoci. Základním vyšetřením je endoskopie s nejméně 4 bioptickými odběry z různých částí ezofagu. Etiopatogeneze EoE je nejasná, nejčastěji vidíme závislost na antigenech potravy (mléčné výrobky, pšenice, vejce, luštěniny, ořechy, plody moře), častá je přítomnost atopií (astma, rinitidy, ekzémů). V terapii indikujeme dietní opatření, inhibitory protonové pumpy, topické steroidy, eventuální dilataci striktur [13].
EGPA (Churg-Strauss) syndrom je vzácným autoagresivním onemocněním s průkazem vaskulitidy malých a středních cév. Diagnóza je opřena o přítomnost astmatu s eozinofilií, neuropatií, měnlivými plicními infiltráty, postižením paranazálních sinusů a histologickým obrazem vaskulitidy s eozinofilní infiltrací a nekrotizujícími granulomy. Etiopatogeneze EGPA je nejasná (alergeny, infekce, vakcinace a léky). V diferenciální diagnostice je nutné odlišit jiné eozinofilní syndromy a vaskulitidy. Cca 30–60 % nemocných vykazuje pozitivitu ANCA (anti neutrophil cytoplasmatic antibodies). V terapii podáváme kortikoidy a/nebo cyklofosfamid [8]. Diferenciální diagnostika EGPA a HES může být složitá.
S IgG4 asociované onemocnění (IgG4-related disease) může postihnout kterýkoli orgán a může být spojeno se zvýšeným IgE s hypereozinofilií. Časté jsou projevy vaskulitidy malých i velkých cév (vč. aortitidy), histologicky prokážeme denzní lymfoplazmocytární IgG4 infiltrát, fibrózu a mnohdy eozinofilní infiltrát. V terapii je indikováno podání kortikosteroidů, jiných imunosupresiv, v případě refrakterního postižení rituximab [9,10].
Eozinofilní fasciitis byla poprvé popsána Schulmanem v roce 1975 [14]. Jedná se o sklerotizující postižení kůže a fascií s myozitidou. V periferii prokazujeme HE a diagnóza se opírá o bioptické vyšetření. Jsou zvýšeny CRP a muskulární enzymy. Onemocnění příznivě reaguje na kortikoidy, eventuálně na další imunosupresiva. Etiopatogeneze je nejasná (extrémní cvičení, infekce, autoagrese, malignity) [15].
Chronická eozinofilní pneumonie (CEP) je etiopatogeneticky nejasná jednotka s průkazem eozinofilní infiltrace intersticia a alveolů. V terapii jsou indikovány kortikosteroidy, je popsána remise po podání benralizumabu [16].
U klonální HE je eozinofilní linie součástí patologického neoplastického klonu. Prokazujeme zde přestavbu (rearrangement) pro růstový faktor derivovaný z destiček (platelet-derived growth factor receptor alpha – PDGFRA, platelet-derived growth factor receptor beta – PDGFRB), receptor 1 pro růstový faktor fibroblastů (fibroblast growth factor receptor 1 – FGFR1), pericentriolar material 1-Janus kinase 2 (PCM1-JAK2). Jde zde o myeloidní a/nebo lymfoidní neoplazie [17]. Přestavby uvedených genů mají za následek zvýšenou tyrozin-kinázovou aktivitu a terapeuticky je zde indikováno podávání tyrozin-kinázového inhibitoru (TKI) imatinibu, eventuálně dalších TKI [18].
Další skupinu HE tvoří klasické klonální hematologické neoplazie (např. CML, CMML, AML, MDS) s hyperproliferací eozinofilní linie – eozinofily jsou zde rovněž součástí klonální hemoblastózy [18,19]. AML s postižením chromozomu 16 (inv16, t (16; 16)) je spojena s proliferací eozinofilů (AML M4 Eo, ev. vzácná akutní eozinofilní leukemie). U myeloproliferací pravidelně nacházíme zvýšení vitaminu B12 v séru.
Chronická eozinofilní leukemie (CEL-NOS – not otherwise specified) je diagnózou per exclusionem – nejsou přítomny výše popsané genové přestavby nebo BCR/ABL fúze, jsou vyloučeny ostatní klonální hyperproliferace a/nebo sekundární HE. Morfologicky nacházíme zmnožení blastů v periferii (> 2 %) a/nebo ve dřeni (> 5 %), jež nepřesahuje 20 %, a/nebo je prokázána klonální expanze eozinofilní linie. Diferenciální diagnostika idiopatického HES a CEL-NOS může být obtížná [18]. Jsou popsány progrese CEL do AML, vč. akutní eozinofilní leukemie.
Omennův syndrom představuje vrozené onemocnění s absencí B-lymfocytů, infiltrací kůže, jater, sleziny a střevní sliznice oligoklonálními autoreaktivními aktivovanými T-lymfocyty, eozinofilií a zvýšenou koncentrací IgE. Byly prokázány mutace tzv. RAG genů [20].
Systémová mastocytóza může být spojena s HE. Nacházíme zde mutaci KIT D816V a zvýšenou tryptázu v séru s histologickým průkazem mastocytózy v kostní dřeni, kůži a eventuálně v dalších orgánech [18]. Jedná se o vzácné onemocnění. Jde o klonální proliferaci CD34+/KIT+ buněk. HE u mastocytózy je spojena s horší prognózou [21].
VYŠETŘENÍ U HE A HES
Podrobná anamnéza a důkladné fyzikální vyšetření (kožní procesy, hepatosplenomegalie, uzlinový syndrom, astma a rinitida, nosní polypy), kožní alergologické testy, RTG plic, SONO břicha, EKG a echokardiografie, srdeční enzymy, endomyokardiální biopsie, MR a/nebo PET hrudníku, břicha a pánve, KO+diff+trombocyty, morfologie eozinofilů (dysplastické rysy – abnormální granulace, vakuolizace, jaderné hyper - a/nebo hypolobulizace), přítomnost nezralých forem a blastů, cytopenie, sternální punkce a trepanobiopsie – celularita, dysplazie, fibróza, proliferace, blasty. Přítomnost AML, ALL, MDS. Cytogenetika, FISH (PDGFRA,PDGFRB, FGFR1, BCR/ABL, JAK2, jiné aberace, přestavby chromozomu 16, KIT D816V), sérová tryptáza, vitamin B12, průtoková cytometrie (aberantní T-lymfocyty) přestavba T celulárního receptoru, histologická vyšetření dle postižení tkání a orgánů, funkční vyšetření plic, bronchoskopie s eventuální biopsií, eozinofily v invazivní bronchoalveolární laváží, sérologie parazitóz, stolice na parazity opakovaně, autoprotilátky (ANF, ANA, anti-DS DNA, revmatoidní faktor, ANCA), komplement (hypokomplementové vaskulitidy). IgE (zvýšené u sekundárních HE, u HES různé nálezy).
TERAPIE
Terapie sekundární HE spočívá v léčbě základního onemocnění (antiparazitární léky, kortikoidy, další imunosupresiva, mepolizumab u hypereozinofilního astmatu a EGPA, chemoterapie neoplazií) [22].
U idiopatického HES, zvláště s kardiálním postižením, jsou indikovány vysoce dávkované kortikoidy. U kortikoid-rezistentní formy iHES lze vyzkoušet hydroxyureu (HU), avšak nevýhodou je teratogenní účinek HU. Refrakterní iHES s výrazným orgánovým postižením je indikací k transplantační terapii [23]. Mepolizumab a reslizumab viz níže. Cílem terapie HES je snížení počtu eozinofilů pod 1,5×109/l s redukcí orgánových komplikací HES. Pokud je terapie kortikoidy účinná, lze dávku postupně redukovat na nejnižší možnou udržovací léčbu. Variantou je kortikoid šetřící terapie monoklonálními protilátkami.
U klonální HE se zvýšenou tyrozin-kinázovou aktivitou je doporučen TKI imatinib v dávce 100 mg denně, eventuálně další TKI nilotinib a dasatinib [24]. Asi 40 % nemocných vykazuje molekulární remisi i po přerušení léčby TKI, nutno však kontinuálně monitorovat trvání molekulární remise a léčbu TKI zahájit při relapsu [24].
Mepolizumab a reslizumab jsou anti-IL5 monoklonální protilátky, které mají kortikoid šetřící efekt u primární i klonální HE. Mepolizumab je indikován u závažného hypereozinofilního astmatu a EGPA v dávce 100 mg, resp. 300 mg s.c. po 4 týdnech. Reslizumab v dávce 3 mg/kg i.v. každé 4 týdny prokázal účinnost u hypereozinofilního astmatu a EoE. Klinické studie mepolizumabu a reslizumabu u HES probíhají [22].
Benralizumab je humanizovaná monoklonální protilátka proti IL5 receptoru a (IL-5Ra). Po navázání protilátky na povrch eozinofilů se tyto stávají terčem NK (natural killer) buněk prostřednictvím protilátkově dependentní celulární cytotoxitity (ADCC). Výhodou je výrazný pokles eozinofilie. Látka má význam v terapii hypereozinofilního, kortikoid-dependentního astmatu s výrazným kortikoid redukčním efektem. Probíhají studie medikace benralizumabu u HES [22].
Omalizumab je anti-IgE monoklonální protilátka. Význam této protilátky v terapií hypereozinofilních syndromů je omezený.
Dupilumab blokuje IL-4 a IL-13 receptorovou signalizaci. Je indikována v terapii atopické dermatitidy, astmatu, rinitidy s nosními polypy, eozinofilní ezofagitidy (EoE) [22].
Alemtuzumab je anti-CD 52 protilátka. Eozinofily exprimují povrchové CD 52. Protilátka prokázala účinnost u pokročilého HES a CEL-NOS. Pacienti relabovali po vysazení terapie [22].
Ruxolitinib je indikován u HES se zvýšenou JAK1 a JAK2 kinázovou aktivitou (PCM1-JAK2 fúze, JAK2/BCR fúze) [17].
U L-HES kortikoterapie, eventuálně anti-IL5 monoklonální protilátky.
Anti-Siglec-8 (AK002, rilentelimab). Siglec-8 je exprimován na eozinofilech, bazofilech a mastocytech. Klinické studie protilátky u chronické urtikárie, indolentní systémové mastocytózy, HES a atopické keratokonjunktivitidy probíhají [25].
CEL-NOS léčba interferonem α může odpovědět na chemoterapii hydroxyureou nebo léčbou interferonem a. Agresivní formy onemocnění jsou stejně jako refrakterní iHES se závažnými orgánovými komplikacemi indikací k transplantační terapii. Terapie alemtuzumabem viz výše [22].
Trombofilní projevy HES (venózní i arteriální trombózy, intrakardiální tromby s emboliemi) vyžadují medikaci protidestičkovými a/nebo antikoagulačními léky (aspirin, P2Y12 inhibitory, LMWH, warfarin, eventuálně NOACs). Při zahájení kortikoterapie HES se doporučuje prevence hyperkoagulací pomocí LMWH [26].
Chirurgické intervence u HES spočívají v korekci valvulárních postižení (mitrální a trikuspidální chlopeň) a/nebo v operaci endomyokardiální fibrózy – endomyokardektomii. Bioprotézy chlopní jsou vhodnější než mechanické náhrady pro nižší trombotický potenciál [27].
Souhrn dat, týkajících se HE, ilustruje tab. 1.
Table 1. Příčiny hypereozinofilního syndromu a jejich léčba. 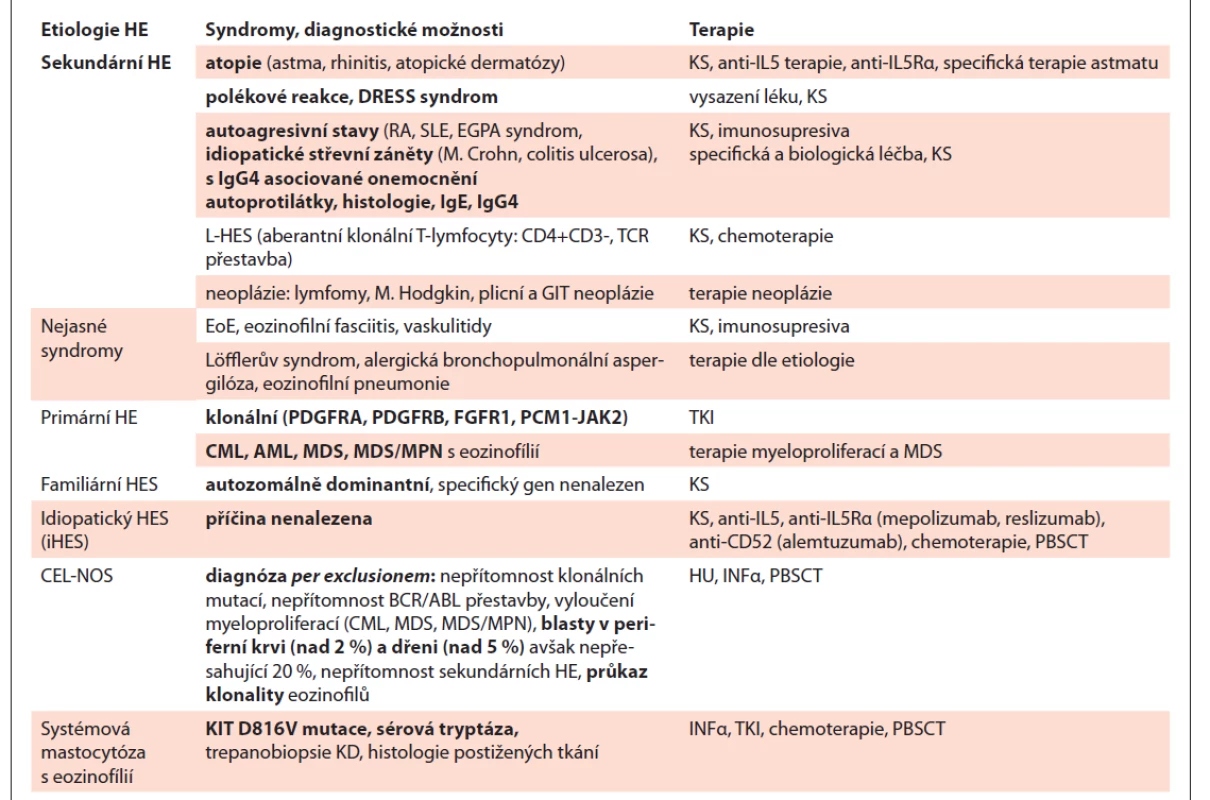
CEL-NOS – chronická eozinofi lní leukémie not otherwise specified, DRESS – drug rush with eosinophilia and systemic symptoms, EGPA – eosinophilic granulomatosis with polyangitis (Churg-Strauss), EoE – eozinofilní ezofagitis, FGFR1 – fibroblast growth factor receptor1, HE – hypereozinofilie, HU – hydroxyurea, IL5Rα – IL5 Receptor α, INFα – interferon α, KS – kostikosteroidy, L-HES – lymfocytární HES, PBSCT – periferal blood stem cell transplantation, PCM1-JAK2 – pericentriolar material1-Janus kinase 2, PDGFRA – platelet derived growth factor receptor alfa, PDGFRB – platelet derived growth factor receptor beta, RA – revmatoidní artritida, SLE – systémový lupus erythematodes, TKI – inhibitory tyrozinové kinázy ZÁVĚR
Nejčastější příčinou HE celosvětově jsou parazitární onemocnění. V našich zeměpisných podmínkách jsou vzácná, s rostoucí migrací budou však parazitózy nabývat na významu i v průmyslově rozvinutých zemích. V České republice jsou t.č. vedoucími etiologiemi HE atopie, polékové reakce vč. závažného DRESS syndromu, autoagresivní stavy a malignity. HES se závažným postižením tkání a orgánů vyžaduje promptní terapeutickou intervenci, zvláště při kardiálním postižení. Lékem první volby u závažného HES jsou vysokodávkované kortikoidy, zkouší se biologická terapie monoklonálními protilátkami (anti-IL5, anti IL5R, alemtuzumab). U HE s prokázanou aberantní tyrozin-kinázovou aktivitou nasazujeme TKI. S postupujícími poznatky budou u dosud idiopatických syndromů (iHES) stále více odkrývány specifické příčiny HE.
Čestné prohlášení
Autor prohlašuje, že v souvislosti s tématem, vznikem a publikací článku není ve střetu zájmů a vznik a publikace článku nebyly podpořeny žádnou farmaceutickou firmou.
Doručeno do redakce dne: 10. 5. 2021.
Přijato po recenzi dne: 26. 7. 2021.
MUDr. Jan Novotný, Ph.D.
OKH FN Brno, Jihlavská 20
625 00 Brno
e-mail: novotny.jan@fnbrno.cz
Sources
1. Klion AD, Ackerman SJ, Bochner BS. Contributions of eosinophils to human health and disease. Ann Rev Pathol Mech. 2020; 15: 179–209.
2. Schwartz JT, Fulkerson PC. An approach to the evaluation of persistent hypereosinophilia in pediatric patients. Front Immunol. 2018; 9 : 1944.
3. van Balkum M, Kluin-Nelemans H, van Hellemond JJ, et al. Hypereosinophilia: a diagnostic challenge. Netherlands J Med. 2018; 76 : 431–436.
4. Wang SA. The diagnostic work-up of hypereosinophilia. Pathobiol. 2019; 86 : 39–52.
5. Hu Z, Boddu PC, Loghavi S, et al. A multimodality work-up of patients with hypereosinophilia. Am J Hematol. 2018; 93 : 1337–1346.
6. Fraisse M, Logre E, Mentec H, et al. Eosinophilia in critically ill COVID-19 patients: a French monocenter retrospective study. Crit Care. 2020; 24 : 635.
7. Henes JC, Wirths S, Hellmich B. Differenzial Diagnose der Hypereosinophilie. Z Rheumatol. 2019; 78 : 313–321.
8. Venode G, Figueiredo C, Almedia C, et al. Eosinophilic granulomatosis with polyangiitis (Churg-Strauss syndrome). Rev Assoc Med Bras. 2020; 66 : 904–907.
9. Borges T, Silva S. IgG4-related disease: how to place it in the spectrum of immune-mediated and rheumatologic disorders? Modern Rheumatol. 2020; 30 : 609–616.
10. Schirmer JH, Hoyer BF. HES und weitere rheumatische Erkrankungen mit Hypereosinophilie. Z Rheumatol. 2019; 78 : 322–332.
11. Sanchez-Porro Valades P, Posada de la Plaz M, de Andres Copa P. Toxic oil syndrome: survival in the whole cohort between 1981 and 1995. J Clin Epidemiol. 2003; 56 : 701–708.
12. Carreira PE, Montalvo MG, Kaufman LD, et al. Antiphospholipid antibodies in patients with EMS and TOS. J Rheumatol. 1997; 24 : 69–72.
13. Fernandez-Becker NO, Raja S, Scarpignato C, et al. Eosinophilic esophagitis: updates on key unanswered questions. Ann N Y Acad Sci. 2020; 1481 : 30–42.
14. Shulman LE. Diffuse fasciitis with eosinophilia: a new syndrome? Trans Assoc Am Physic. 1975; 88 : 70–86.
15. Mango RL, Bugdayli K, Crowson C, et al. Baseline characteristics and long-term outcomes of eosinophilic fasciitis in 89 patients seen at a single center over 20 years. Int J Rheum Dis. 2020; 23 : 233–239.
16. Isomoto K, Baba T, Sekine A, et al. Promising effects of benralizumab on chronic eosinophilic pneumonia. Int Med. 2020; 59 : 1195–1198.
17. Mattis DV, Wang SA, Lu CM. Contemporary classification and diagnostic evaluation of HE. Am J Clin Pathol. 2020; 154 : 305–318.
18.Shomali W, Gotlib J. WHO-defined eosinophilic disorders: 2019 update on diagnosis, risk stratification, and management. Am J Hematol. 2019; 94 : 1149–1166.
19. Richardson AI, Skikne BS, Woodroof J. CML, BCR/ABL 1 positive in accelerated phase with marked eosinophilia with eosinophil atypia. Br J Haematol. 2020; 188 : 599.
20. Rigoni R, Fontana E, Dobbs K, et al. Cutaneous barrier leakage nad gut inflammation drive skin disease in Omenn syndrome. J Allergy Clin Immunol. 2020; 146 : 1165–1179.
21. Kluin-Nelemans HC, Reiter A, Illerhaus A, et al. Prognostic impact of eosinophils in mastocytosis: analysis of 2350 patients collected in the ECNM registry. Leukemia. 2020; 34 : 1090–1101.
22. Dispenza MC, Bochner BS. Diagnosis and novel approaches to the treatment of HES. Curr Hematol Malignancy Rep. 2018; 13 : 191–201.
23. Iurlo A, Cattaneo D, Gianelli U. HES in the precision medicine era: clinical, molecular aspects and therapeutic approaches (targeted therapies). Expert Rev Hematol. 2019; 12 : 1077–1088.
24. Helbig G. Imatinib for the treatment of HES. Expert Rev Clin Immunol. 2018; 14 : 163–170.
25. Legrand F, Cao Y, Wechsler JB, et al. Siglec 8 in patients with eosinophilic disorders: receptor expression and targeting using chimeric antibodies. J Allergy Clin Immunol. 2019; 143 : 2227–2237.
26. Brychtová Y, Doubek M. Myeloidní a lymfoidní neoplazie s eozinofilií. In: Doubek M, Mayer J. Léčebné postupy v hematologii 2020 Doporučení České hematologické společnosti České lékařské společnosti Jana Evangelisty Purkyně. 1. Vyd. Brno, Česká hematologická společnost ČLS JEP, 2020; 173–183.
26. Shomali W, Gotlib J. WHO-defined eosinophilic disorders: 2019 update on diagnosis, risk stratification, and management. Am J Hematol. 2019; 94 : 1149–1167.
Labels
Haematology Internal medicine Clinical oncology
Article was published inTransfusion and Haematology Today

2021 Issue 4-
All articles in this issue
- Hypereozinofilie
- Je možné pomocí časné molekulární odpovědi a její kinetiky předpovědět další osud pacientů s chronickou myeloidní leukemií?
- Kongenitální neutropenie u dětí a dospělých
- Neuro-imunitné interakcie organizmu v onkogenenéze mnohopočetného myelómu a ich terapeutické využitie
- Západonilská horečka na pozadí pandemie onemocnění COVID-19
- Prvních 50 COVID-19 pozitivních pacientů na Klinice hematoonkologie Fakultní nemocnice Ostrava v roce 2020
- Ohlédnutí za 2. českým hematologickým a transfuziologickým sjezdem
- Prof. MUDr. Jaroslav Malý, CSc., slaví 75 let
- Prof. MUDr. Vladimír Mihál, CSc. – sedmdesátiletý
- Redakční sdělení
- P31. REBOUND BASOPHILIA DURING CYTOREDUCTION IN PATIENTS WITH CHRONIC MYELOID LEUKAEMIA
- Transfusion and Haematology Today
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Hypereozinofilie
- Kongenitální neutropenie u dětí a dospělých
- Neuro-imunitné interakcie organizmu v onkogenenéze mnohopočetného myelómu a ich terapeutické využitie
- Západonilská horečka na pozadí pandemie onemocnění COVID-19
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

