-
Medical journals
- Career
Mykotické komplikácie po autológnej transplantácii krvotvorných buniek u pacientov s mnohopočetným myelómom
Authors: J. Gabzdilová; E. Tóthová 1; T. Guman 2; Š. Raffač 1; P. Jarčuška 3 4
Authors‘ workplace: Klinika hematológie a onkohematológie UNLP a LF UPJŠ, Košice 1; Ústav lekárskej a klinickej biofyziky LF UPJŠ, Košice 2; Oddelenie laboratórnej medicíny UNLP, Košice 3; Klinika infektológie a cestovnej medicíny UNLP a LF UPJŠ, Košice 4
Published in: Transfuze Hematol. dnes,21, 2015, No. 1, p. 24-29.
Category: Comprehensive Reports, Original Papers, Case Reports
Overview
Článok prináša skúsenosti s výskytom invazívnych mykotických infekcií u pacientov s mnohopočetným myelómom po autológnej transplantácii krvotvorných buniek, ktorí z hľadiska rozvoja tejto infekčnej komplikácie patria k nízkorizikovej skupine (LR). Hodnotí vplyv predchádzajúcej liečby základného ochorenia, komorbidity a rizikových faktorov na výskyt a etiológiu invazívnych fungálnych infekcií (IFI), ich klinickú manifestáciu a liečbu. V analyzovanom súbore 39 pacientov došlo k rozvoju invazívnej mykotickej infekcie u 4 pacientov. V dvoch prípadoch išlo o možnú invazívnu mykotickú infekciu pľúc, u ďalšieho pacienta bola diagnostikovaná pravdepodobná invazívna aspergilóza pľúc a ďalší prípad nasvedčoval pre pravdepodobnú pľúcnu trichosporonovú infekciu. Z rizík spojených s rozvojom týchto infekčných komplikácií sú významné predovšetkým podávanie kortikoterapie, rozvoj neutropénie, mukozitídy a renálna insuficiencia.
Kľúčové slová:
mnohopočetný myelóm, invazívne mykotické infekcie, rizikové faktory, autológna transplantácia krvotvorných buniekÚVOD
Mikroskopické huby spolu s ostatnými mikroorganizmami sú súčasťou nášho životného prostredia a boli dlhú dobu považované za patogény, ktoré u človeka nespôsobujú závažné ochorenia. V súčasnosti predstavujú vážny medicínsky problém predovšetkým u imunokompromitovaných pacientov [1]. V skupine onkohematologických chorých je viac ako polovica invazívnych fungálnych infekcií (IFI) vyvolaná vláknitými hubami, s dominantným postavením Aspergillus species. Invazívne kandidové infekcie sa vyskytujú menej často, približne v 35 %. Taktiež stúpa výskyt infekcií vyvolaných tzv. vzácnymi plesňami, a to hlavne zygomycétami (do tejto skupiny sú zaradené rody Absidia, Rhizopus, Mucor) a fusáriami. Mortalita spojená s invazívnou aspergilovou infekciou dosahuje približne 40 % a pri invazívnych kandidových infekciách 30 % [2, 3]. V skupine pa-cientov podstupujúcich alogénnu transplantáciu krvotvorných buniek je výskyt invazívnych mykotických ochorení približne 20 %, zatiaľ čo v období po autológnej transplantácii je približne 2 až 6 %. Invazívne fungálne infekcie sa u pacientov s mnohopočetným myelómom (MM) vyskytujú v 0,5–3 % [2, 3, 16]. Aj keď sa tieto infekčné komplikácie vyskytujú v populácii chorých s MM v menšej miere, vzhľadom na zmeny v liečebnej stratégii a predĺžené prežívanie týchto pacientov je potrebné prehodnotiť riziká aj v tejto skupine chorých.
V našej práci prezentujeme skúsenosti s výskytom invazívnych mykotických infekcií u pacientov s mnohopočetným myelómom, ktorí podstúpili autológnu transplantáciu krvotvorných buniek, a to s prihliad-nutím na predchádzajúcu liečbu základného ochorenia a riziká, ktoré potencujú rozvoj tejto závažnej komplikácie.
MATERIÁL A METÓDY
Retrospektívne sme analyzovali údaje od pacientov s mnohopočetným myelómom, podstupujúcich autológnu transplantáciu krvotvorných buniek v období od januára 2011 do decembra 2013, ktorí boli hospitalizovaní na Klinike hematológie a onkohematológie UNLP a LF UPJŠ v Košiciach.
Informácie sme získali z dokumentácie pacientov, kde boli podrobne uvedené denné záznamy o klinickom stave a liečbe pacientov ako aj výsledky hematologických, biochemických, mikrobiologických a zobrazovacích vyšetrení. Pacienti boli hospitalizovaní na onkohematologickej jednotke intenzívnej starostlivosti v jednolôžkových izbách s využitím HEPA filtrácie vzduchu a zvýšeným hygienickým režimom. Antiinfekčná profylaxia bola pacientom aplikovaná vo fáze útlmu krvotvorby v kombinácii ciprofloxacín a flukonazol. K primárnej antimykotickej profylaxii flukonazolom sme sa priklonili na základe prítomnosti rizikových faktorov IFI, predovšetkým neutropénie, rozvíjajúceho sa ťažkého slizničného poškodenia a prítomnosti centrálneho venózneho katétra. Nakoľko ide o retrospektívnu analýzu, tento postup reflektuje dlhodobé skúsenosti pracoviska s prihliadnutím k ekonomickým možnostiam. Antiinfekčná profylaxia bola podávaná do regenerácie krvotvorby s úpravou hladiny neutrofilov.
Závažná neutropénia bola vymedzená poklesom počtu neutrofilov < 0,5 x 109/l. Regenerácia počtu neutrofilov bola stanovená ako zvýšenie ich hladiny nad 0,5 x 109/l počas dvoch dní po sebe. Febrilná epizóda bola definovaná ako orálna teplota viac ako 38,5 ˚C nameraná jednorázovo alebo dve za sebou nasledujúce merania viac ako 38,0 ˚C počas dvoch hodín [4]. Mukozitída dutiny ústnej bola klasifikovaná podľa WHO od najmenej závažnej – I. stupeň, po IV. stupeň s nutnosťou zavedenia parenterálnej výživy [5]. U všetkých pacientov boli v pravidelných intervaloch realizované odbery biologického materiálu, ktorý bol odosielaný do mikrobiologického laboratória. Išlo o tampóny z nosa, tonzíl, stery z jazyka, tampón z rekta a moč. Sérologické vyšetrenie mykotických antigénov bolo realizované u pacientov s febrilitami a mukozitídou, u ktorých bolo zahájené pátranie po rozvíjajúcej sa invazívnej mykotickej infekcii. Vyšetrenia boli realizované každé 2–3 dni počas tohto obdobia. Galaktomanan (GM) bol vyšetrený metódou ELISA, s využitím komerčnej sady Platelia Aspergillus EIA. Za pozitívnu bola považovaná hodnota v sére s IP > 0,5 a ako pozitívny pacient bol označený chorý s 2 po sebe nasledujúcimi pozitívnymi odbermi. Výsledky testu sme hodnotili so zreteľom na riziko falošnej pozitivity a negativity. Sérologické vyšetrenie kandidového antigénu bolo takisto vyšetrené metódou ELISA – komerčná súprava Platelia Candida Ag – pozitívna bola vzorka s hodnotou nad 125 pg/ml.
Pri objavení sa febrility boli pacientom odoberané hemokultúry z centrálního venózneho katétra (CVK) a z periférnej krvi. Hemokultúry boli vyšetrené na prítomnosť baktérií a mykotických agens. Boli vyšetrené aj vzorky z miest, ktorých kolonizácia mohla viesť k vzniku infekčnej komplikácie. Tieto procedúry boli realizované opakovane denne počas obdobia subfebrilií, febrilít a rozvoja infekcií. Denne boli hodnotené parametre krvného obrazu a monitorované laboratórne parametre, predovšetkým zápalové markery – C-reaktívny proteín (CRP) a prokalcitonín (PCT), renálne, hepatálne parametre a mineralogram.
U pacientov s febrilnou neutropéniou (FN) bola zahájená empirická antibiotická liečba v súlade s odporúčaním medzinárodných odborných spoločností [6, 7]. Po obdržaní mikrobiologických výsledkov bola liečba upravená cielene podľa citlivosti zachytených patogénov.
Pri podozrení na rozvoj invazívnej fungálnej infekcie boli s prihliadnutím na ďalšie klinické známky infekcie realizované zobrazovacie vyšetrenia. Išlo predovšetkým o RTG hrudníka a HRCT pľúc (high-resolution computed tomography). V prípade pozitívneho nálezu bola plánovaná realizácia bronchoalveolárnej laváže, avšak vzhľadom na ťažkú trombocytopéniu spojenú s rizikom krvácania nebola prevedená u žiad-neho chorého.
Jednotlivé epizódy IFI sme klasifikovali podľa odporú-čaní EORTC/MSG z roku 2008 [8]. V skupine našich pa-cientov sme hodnotili predchádzajúcu liečbu základného ochorenia ako aj dlhodobé užívanie kortikosteroidov. Sledovaná bola aj prítomnosť komorbidít, ktoré predisponujú k rozvoju IFI: renálne zlyhanie, potreba hemodialýzy, diabetes mellitus, chronická obštrukčná choroba pľúc a ďalšie faktory asociované s rozvojom IFI.
SÚBOR PACIENTOV
Hodnotili sme údaje od 39 pacientov, ich charakteristika je uvedená v tabuľke 1.
Table 1. Charakteristika pacientov v sledovanom súbore 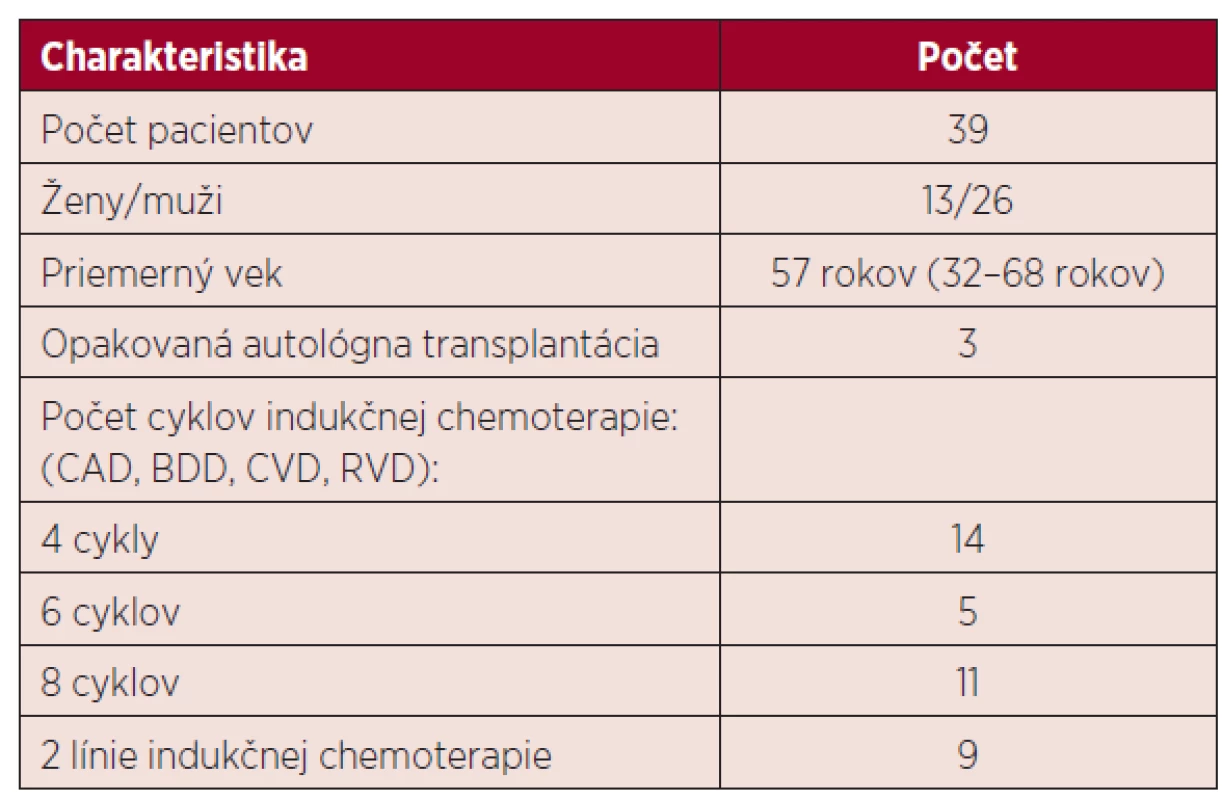
CAD – cyklofosfamid-doxorubicín-dexametazón, BDD – bortezomib-doxorubicín-dexametazón, CVD – cyklofosfamid-vinkristin-dexametazón, RVD – lenalidomid-bortezomib-dexametazón Všetci pacienti podstúpili vysokodávkovanú chemoterapiu nasledovanú podaním krvotvorných buniek z periférnej krvi. Pacienti sa líšili klinickým štádiom ochorenia, typom a počtom cyklov predchádzajúcej chemoterapie, liečebnou odpoveďou a pridruženými komorbiditami.
U všetkých pacientov v našom súbore bol podaný prípravný myeloablatívny režim (melphalan 200 mg/m2), po ktorom došlo k útlmu kostnej drene s ťažkou neutropéniou. V skupine chorých bez IFI trvalo obdobie do regenerácie počtu neutrofilov približne 6 dní, v skupine s IFI 8 dní. Vzhľadom na rozvoj bakteriálnej infekcie bolo u 32 pacientov potrebné aplikovať empirickú antibiotickú liečbu a po obdržaní výsledkov upraviť terapiu podľa citlivosti. Charakteristika rizikových faktorov u pacientov je uvedená v tabuľke 2.
Table 2. Charakteristika rizikových faktorov 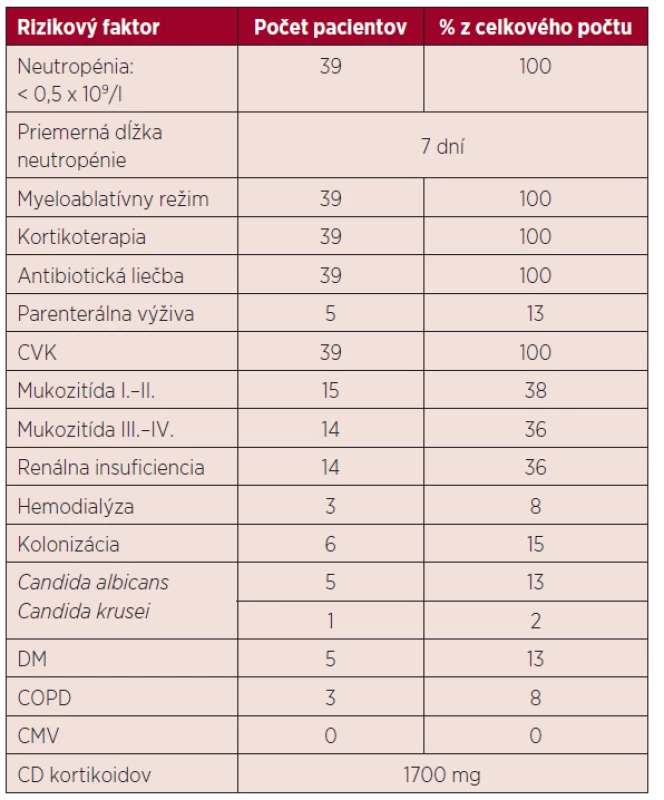
ATB – antibiotická liečba, CVK – centrálny venózny katéter, DM – diabetes mellitus, COPD – chronická obštrukčná pľúcna choroba, CMV – infekcia cytomegalovírusom, CD – celková dávka VÝSLEDKY
Možná alebo pravdepodobná invazívna fungálna infekcia sa vyskytla u 4/39 pacientov (10 % analyzovaného súboru).
U všetkých pacientov liečených pre IFI boli prítomné febrility nereagujúce na širokospektrálnu antibiotickú liečbu a klinické príznaky postihnutia respiračného systému (suchý kašeľ a sťažené dýchanie.) Z uvedených dôvodov bolo indikované HRCT vyšetrenie pľúc a doplnené vyšetrenie mykotických antigénov.
Podľa výsledkov vyšetrení, klinického stavu a klasifikácie EORTC/MSG (8) sme sa v 2 prípadoch na základe pretrvávajúcich febrilít, klinického stavu, HRCT nálezu na pľúcach, ale bez pozitivity GM priklonili k diagnóze možnej invazívnej mykotickej infekcie. V ďalšom prípade išlo o pravdepodobnú invazívnu pľúcnu infekciu Trichosporon spp. a 1 pacientka bola diagnostikovaná ako pravdepodobná invazívna aspergilóza pľúc. Charakteristika pacientov s IFI je uvedená v tabuľke 3. Vzhľadom k nízkemu počtu pacientov s IFI sme nemohli stanoviť štatistický korelát.
Table 3. Invazívne mykotické infekcie u pacientov s mnohopočetným myelómom 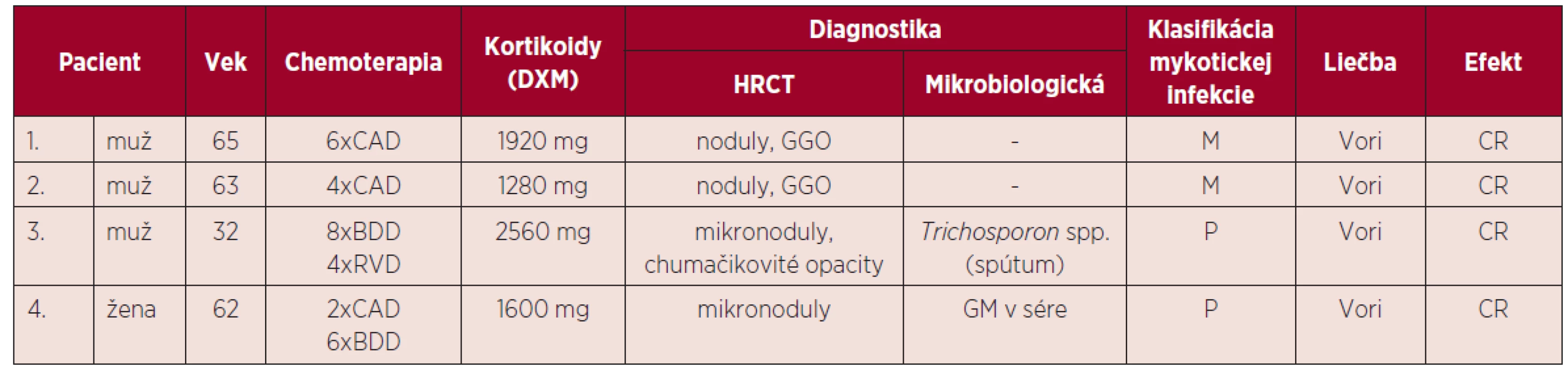
DXM – dexametazón, CAD – cyklofosfamid, doxorubicín, dexametazón, BDD – bortezomib, doxorubicín, dexametazón, RVD – lenalidomid, bortezomib, dexametazón, HRCT – počítačová tomografia s vysokým rozlíšením (high resolution computed tomography), GGO – opacity mliečneho skla (ground glass opacity), GM – galaktomanan, CR – kompletná remisia, P – pravdepodobná IFI, M – možná IFI, Vori – vorikonazol. Všetci pacienti boli liečení vorikonazolom v dávke 6 mg/kg/12 hodín v prvý deň, pokračujúc dávkou 4 mg/kg/12 hodín. V jednom prípade u pacienta s renálnou insuficienciou v chronickom dialyzačnom programe bola pre známu nefrotoxicitu vehikula v intravenóznej forme aplikovaná perorálna forma v dávke 200 mg/12 hod. Dĺžka liečby bola minimálne 3 týždne a všetci pacienti po zhodnotení kontrolného HRCT nálezu dosiahli kompletnú remisiu ochorenia, ktorá bola stanovená podľa Segalových kritérií odpovede na liečbu [9].
Výskyt invazívnej kandidovej infekcie sme nezaznamenali. Kandidami boli kolonizovaní 6 pacienti. U 5 pacientov bola kolonizovaná dutina ústna Candida albicans, citlivá na flukonazol a jeden pacient bol kolonizovaný C. krusei, ktorá bola flukonazol rezistentná, ale citlivá na echinokandíny. Vzhľadom na priebeh ochorenia a klinický stav pacienta echinokandíny nebolo potrebné podávať.
V skupine pacientov, u ktorých sa rozvinula ťažká mukozitída dutiny ústnej, sme zvýšili dávku flukonazolu na 800 mg/deň a aplikovaná bola formou perorálnej suspenzie a intravenózne.
Celková transplantačná mortalita v deň +100 po transplantácii bola nulová v skupine bez IFI ako aj u pacientov s IFI.
DISKUSIA
V posledných rokoch znamenalo zavedenie vysokodávkovanej chemoterapie nasledovanej autológnou transplantáciou krvotvorných buniek a zavedenie nových liečebných postupov (thalidomid, lenalidomid a bortezomib) predĺžené prežívanie u pacientov s mnohopočetným myelómom, čo posúva toto ochorenie do skupiny chronických ochorení. Všetky tieto okolnosti vedú k prehĺbeniu imunosupresie, a tak k zvýšenému riziku rozvoja infekčných komplikácií [10, 11, 15]. Imunodeficiencia pri MM je spojená s postihnutím viacerých úrovní imunitného systému. Vyplýva jednak z funkčného deficitu B-lymfocytov a s tým spojenej hypogamaglobulinémie, ale aj kvantitatívnych a funkčných zmien dendritických buniek, NK buniek a CD4+ T-lymfocytov. Ďalšími faktormi asociovanými s rozvojom infekcií je liečba základného ochorenia, orgánová dysfunkcia ako aj pridružené komorbidity pacienta, keďže MM postihuje prevažne starších pacien-tov [10, 12]. Riziko rozvoja infekčných komplikácií u pacientov podstupujúcich autológnu transplantáciu je najvyššie v období pred prihojením štepu, kde najvýznamnejším faktorom je pretrvávanie neutropénie a mukozitída. Obdobie po transplantácii je rizikové z hľadiska neskoršej obnovy bunkami sprostredkovanej imunity. Ďalšími faktormi, ktoré je potrebné u týchto pacientov zohľadniť sú: poškodenie obličiek, preťaženie organizmu železom, liečba základného ochorenia a ostatné známe rizikové faktory pre invazívnu aspergilózu a invazívnu kandidózu [10].
V našej skupine sa IFI vyskytla u 4 pacientov (10 %). Z tohto počtu išlo u 2 pacientov o diagnózu možnej IFI a v ďalších 2 prípadoch o diagnózu pravdepodobnej IFI (tab. 3). Tento výsledok je porovnateľný s výsledkami iných publikácií s touto problematikou [10, 11, 13].
Rozvoj IFI je spojený s dlhodobou neutropéniou. V našom súbore pacientov trvala fáza ťažkej neutropénie priemerne 8 dní v skupine s IFI a 6 dní u pacientov, kde sa IFI nevyskytla. Z ďalších faktorov je potrebné brať do úvahy vek, stav a predchádzajúcu liečbu základného ochorenia, komorbity pacienta a použitie kortikoidov v liečbe. V sledovanom súbore mali pacienti s IFI častejšie výskyt mukozitídy III. a IV. stupňa (75 % vs. 31 %), renálnej insufiencie (75 % vs. 31 %). Všetci pacienti boli liečení chemoterapeutickými schémami s obsahom kortikosteroidov (dexametazónu) v období od stanovenia diagnózy až do realizácie autológnej transplantácie. Priemerná celková dávka kortikoidov v sledovanej skupine bola 1 640 mg v skupine bez IFI vs. 2 150 mg u pacientov s IFI. Tento faktor sa zdá byť významný v sledovanej skupine, podobne ako v iných prácach, ktoré dokumentujú, že kortikosteroidy a ich dlhodobé užívanie je spojené so zvýšenou náchylnosťou na vznik invazívnych mykotických infekcií (tab. 4) [14]. Z ďalších predisponujúcich faktorov boli prítomné zavedenie CVK a liečba širokospektrálnymi antibiotikami. Invazívna fungálna infekcia sa rozvinula u pacientov s mukozitídou v dutine ústnej a možným rizikovým faktorom sú aj stavebné a rekonštrukčné práce, ktoré v sledovanom období prebiehali v nemocnici a jej okolí. Sú spojené s uvoľňovaním mykotických spór do okolia a kontamináciou dýchacích ciest. Hoci boli pacienti počas transplantácie hospitalizovaní na jednotke intenzívnej starostlivosti s filtráciou ovzdušia, počas podávania chemoterapeutickej liečby boli umiestnení na štandardnom lôžkovom oddelení a ku kolonizácii mohlo dôjsť aj počas pobytu v domácej starostlivosti.
Table 4. Rizikové faktory v skupine pacientov s IFI a bez IFI 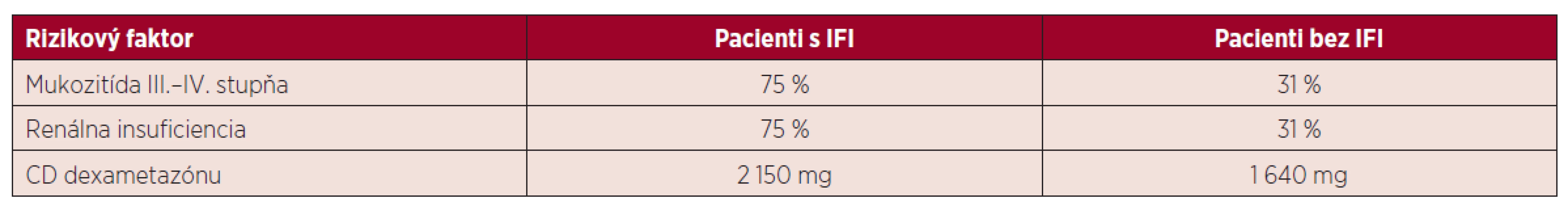
CD – celková dávka ZÁVER
Chorí s mnohopočetným myelómom nepatria z hľadiska rozvoja IFI do vysokorizikovej skupiny, ale počet týchto invazívnych infekcií aj v tejto populácii pribúda. Je to spojené so zavedením nových liečebných stratégií a transplantačných režimov, ktoré sú dnes štandardom v liečbe mnohopočetného myelómu. Preto je potrebné myslieť aj na takúto komplikáciu predovšetkým ak nie je prítomná jednoznačná odpoveď na antibiotickú liečbu u pacientov so známkami infekcie. Z rizík spojených s invazívnou mykotickou infekciou sú významné predovšetkým podávanie kortikoterapie, rozvoj neutropénie, mukozitídy a renálna insuficiencia. Sú potrebné nové epidemiologické a klinické poznatky a skúsenosti na zlepšenie kategorizácie predisponujúcich rizík a z toho vyplývajúcej antimykotickej stratégie začínajúcej od efektívnej profylaxie, diagnostiky až po cielenú antifungálnu liečbu.
Podiel autorov na príprave rukopisu
J.G. – príprava rukopisu, liečba pacientov, zber dát
E.T. – liečba pacientov, revízia rukopisu
T.G. – liečba pacientov, revízia rukopisu
Š.R. – laboratórne vyšetrenia pacientov, imunologický konzultant, revízia rukopisu
P. J. – príprava rukopisu, antibiotický konzultant, podiel na antiinfekčnej liečbe pacientov, revízia rukopisu.
Transparentná spolupráca
Autorka práce prehlasuje, že v súvislosti s témou, vznikom a publikáciou tohto článku nie je v strete záujmov a vznik ani publikácia článku neboli podporené žiadnou farmaceutickou firmou. Toto prehlásenie sa týka aj všetkých spoluautorov.
Doručeno do redakce: 14 . 12. 2014
Přijato po recenzi: 27. 1. 2015
MUDr. Juliana Gabzdilová
Klinika hematológie a onkohematológie UNLP a LF UPJŠ
Trieda SNP 1
040 01 Košice
Slovenská republika
e-mail: julianagabzdilova@centrum.sk
Sources
1. Upton A, Kirby KA, Carpenter P, et al. Invasive aspergillosis following hematopoietic cell transplantion: Outcomes and prognostic factors associated with mortality. Clin Infect Dis 2007; 44 : 531–540.
2. Pagano L, Morena C, Candoni A, et al. The epidemiology of fungal infections in patients with hematologic malignancies: the SEIFEM-2004 study. Haematologica 2006; 91 : 1068–1075.
3. Marr K A, Carter RA, Crippa F, et al. Epidemiology and outcome of mould infections in hematopoetic stem cell transplant recipients. Clin Infect Dis 2002; 34 : 909–917.
4. De Naurois I, Basso MJ, Marti F, et al. Management of febrile neutropenia: ESMO Clinical Practice Guidelines. Ann Oncol 2010; 21(suppl 5): v252–v256.
5. Lalla RV, Sonis ST, Peterson DE. Management of oral mucositis in patients with cancer. Dent Clin N Am 2008; 5 : 61–77.
6. Ráčil Z, Haber J, Drgoňa Ľ, et al. Empirická antimykotická léčba febrilní neutropenie u nemocných s hematologickou malignitou – doporučení odborníků – s podporou CELL, ČHS ČLS JEP, ČOS ČLS JEP, SCHS SLS. Postgrad Med 2010; 12 : 23–25.
7. Freifeld AG, Bow EJ, Sepkowitz KA, et al. Clinical practice guideline for the use of antimicrobial agents in neutropenic patients with cancer: 2010 update by the Infectious Diseases Society of America. Clin Infect Dis 2011; 52 : 56–90.
8. De Pauw B, Walsh TJ, Donnelly JP, et al. Revised definitions of invasive fungal diseases from the European Organization for Reasearch and Treatment of Cancer / Invasive Fungal Infections Cooperative Group and the National Institute of Allergy and Infectious Diseases Mycoses Study Group (EORTC/MSG) Consensus. Clin Infect Dis 2008; 46(12): 1813–1821.
9. Segal BH, Herbrecht R, Stevenns DA, et al. Defining response to therapy and study outcomes in clinical trials of invasive fungal diseases: Mycoses Study Group and European Organization for Research and Treatment of Cancer consensus criteria. Clin Infect Dis 2008; 47(5): 674–683.
10. Nucci M, Anaissie E. Infections in patients with multiple myeloma in the era of high-dose therapy and novel agents. Clin Infect Dis 2009; 49 : 1211–1225.
11. Post MJ, Lass-Floerl C, Gastl G, Nachbaur D. Invasive fungal infections in allogeneic and autologous stem cell transplant recipients: a single-center study of 166 transplanted patients. Transpl Infect Dis 2007; 9 : 189–195.
12. Schütt P, Brandhorst D, Stellberg W, et al. Immune parameters in multiple myeloma patients: influence of treatment and correlation with opportunistic infections. Leuk Lymphoma 2006; 47(8): 1570–1582.
13. Gill L, Kozlowska-Skrzypczak M, Mol A, et al. Increased risk for invasive aspergillosis in patients with lymphoproliferative diseases after autologous hematopoietic SCT. Bone Marrow Transplant 2009; 43 : 121–126.
14. Cornillet A, Camus A, Nimubona S, et al. Comparison of epidemiological, clinical and biological features of invasive aspergillosis in neutropenic and nonneutropenic patients: a 6-year survey. Clin Infect Dis 2006; 43(5): 577–584.
15. Nucci M, Nouér SA, Anaissia E. Early diagnosis of invasive pulmonary aspergillosis in hematologic patients: an opportunity to improve the outcome. Haematologica 2013; 98(11): 1657–1660.
16. Nosari AM, Pioltelli ML, Riva M, et al. Invasive fungal infections in lymphoproliferative disorders: a monocentric retrospective experience. Leuk Lymphoma 2014; 55 : 1844–1848.
Labels
Haematology Internal medicine Clinical oncology
Article was published inTransfusion and Haematology Today

2015 Issue 1-
All articles in this issue
- First-line treatment for severe aplastic anemia in children: bone marrow transplantation from a matched family donor versus immunosuppressive therapy
- Management and clinical outcomes in patients treated with apixaban vs warfarin undergoing procedures
- Recombinant long-acting glycoPEGylated factor IX in hemophilia B: a multinational randomized phase 3 trial
- Infekčné komplikácie behom indukčnej liečby akútnej myeloidnej leukémie bez použitia antibiotickej profylaxie
- Mykotické komplikácie po autológnej transplantácii krvotvorných buniek u pacientov s mnohopočetným myelómom
- Interference složek krevní plazmy při turbidimetrickém stanovení D-dimeru
- Excellent prognosis of late relapses of ETV6/RUNX1-positive childhood acute lymphoblastic leukemia: lessons from the FRALLE 93 protocol
- Clinical heterogeneity and predictors of outcome in primary autoimmune hemolytic anemia: a GIMEMA study of 308 patients
- The toxicity of very prolonged courses of PEGasparaginase or Erwinia asparaginase in relation to asparaginase activity, with a special focus on dyslipidemia
- Safety and efficacy of rituximab in adult immune thrombocytopenia: results from a prospective registry including 248 patients
- Inkorporace humanizované tkáně jako strategie pro zlepšení uchycení leukemie v imunodeficientní myši
- Uchycení akutní a chronické myeloidní leukemie v NOD scid gamma myši
- Transfusion and Haematology Today
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Infekčné komplikácie behom indukčnej liečby akútnej myeloidnej leukémie bez použitia antibiotickej profylaxie
- Interference složek krevní plazmy při turbidimetrickém stanovení D-dimeru
- Mykotické komplikácie po autológnej transplantácii krvotvorných buniek u pacientov s mnohopočetným myelómom
- Uchycení akutní a chronické myeloidní leukemie v NOD scid gamma myši
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

