-
Medical journals
- Career
Stanovení mimodřeňové leukemické infiltrace u dětské akutní lymfoblastické leukemie a jeho klinické využití. Přehledný článek a vlastní výsledky
Authors: J. Volejníková 1; E. Mejstříková 1; L. Slámová 1; V. Mihál 2; J. Štěrba 3; Y. Jabali 4; D. Procházková 5; B. Blažek 6; J. Hak 7; Z. Černá 8; O. Hrušák 1; J. Starý 1; J. Trka 1; E. Froňková 1
Authors‘ workplace: Klinika dětské hematologie a onkologie, 2. LF UK a FN Motol, Praha 1; Dětská klinika UP a FN Olomouc 2; Klinika dětské onkologie LF MU a FN Brno 3; Dětská klinika Nemocnice České Budějovice 4; Dětská klinika Masarykovy nemocnice v Ústí nad Labem 5; Oddělení dětské hematologie a hematoonkologie Kliniky dětského lékařství FN Ostrava 6; Dětská klinika LF UK HK a FN Hradec Králové 7; Dětská klinika LF UK Plzeň a FN Plzeň 8
Published in: Transfuze Hematol. dnes,18, 2012, No. 3, p. 124-129.
Category: Comprehensive Reports, Original Papers, Case Reports
Overview
Minimální reziduální nemoc (MRN) se stala důležitým stratifikačním kritériem u moderních protokolů pro léčbu akutní lymfoblastické leukemie (ALL) dětí i dospělých. Většina výsledků se týká kostní dřeně, studie zkoumající MRN mimo kostní dřeň jsou poměrně vzácné. Podle dosavadních prací MRN v periferní krvi u dětské ALL velmi dobře koreluje s MRN v kostní dřeni v případě T-ALL, u B-prekurzorové ALL je korelace horší a ve většině případů je zde MRN více než o jeden řád nižší než v kostní dřeni. Přesto mají hladiny MRN v periferní krvi prokazatelný prognostický význam v průběhu iniciální léčby dětské ALL, jak jsme prokázali pro den 15 na protokolu ALL IC-BFM 2002. Zatím neexistuje dostatek informací o přínosu vyšetřování mozkomíšního moku pomocí PCR a průtokové cytometrie u pacientů při iniciální diagnóze ALL. Zdá se, že průtoková cytometrie zachytí podstatně více pozitivních výsledků než klasická mikroskopie. PCR i průtoková cytometrie jsou vhodné pro vyšetření leukemického postižení v okamžiku relapsu v CNS, v průběhu léčby relapsu je výpovědní hodnota opět sporná kvůli nedostatečné kvalitě izolované DNA v případě PCR a kvůli rychlé degradaci vzorku při transportu v případě průtokové cytometrie. Jednoznačný přínos PCR je ve stanovení současného postižení kostní dřeně v okamžiku izolovaného extramedulárního relapsu, které zhoršuje prognózu pacienta.
Klíčová slova:
akutní lymfoblastická leukemie (ALL), minimální reziduální nemoc (MRN), periferní krev, extramedulární relapsÚvod
Současné protokoly pro léčbu akutní lymfoblastické leukemie (ALL) dětí i dospělých stále více začleňují do své rizikové stratifikace sledování minimální reziduální nemoci (MRN). Většina vyspělých zemí prokázala signifikantní vliv MRN na prognózu pacientů (1–8).
Děti s ALL jsou v České republice v současnosti léčeny podle protokolu AIEOP-BFM ALL 2009, jehož riziková stratifikace je založena na kombinaci hodnot MRN v kostní dřeni (KD) měřených ve dni 33 a v týdnu 12 léčby pomocí PCR a na MRN v KD ve dni 15 měřené pomocí průtokové cytometrie. Dospělí pacienti s ALL jsou léčeni podle protokolu GMALL, který pacienty ve skupině standardního rizika stratifikuje podle MRN v KD během prvního roku léčby. ALL je primárně onemocněním kostní dřeně, většina studií tedy používá logicky KD jako hlavní materiál, i když odběry periferní krve (PK) by znamenaly menší zátěž pro pacienty. V tomto článku chceme shrnout poznatky z literatury a naše vlastní zkušenosti s monitorováním MRN v mimodřeňových kompartmentech, především v PK a v mozkomíšním moku (CSF).
Metody
Molekulární genetika: Kvantifikace klonálně-specifických přestaveb genů pro imunoglobuliny (Ig) a T-buněčné receptory (TCR)
V současnosti nejvíce standardizovanou metodikou pro sledování MRN je detekce klonálně-specifických přestaveb genů pro Ig/TCR (9–11). Metoda je založena na iniciálním vyšetření spektra přestaveb Ig/TCR, pro které je daný vzorek klonální, sekvenování jejich unikátních V-(D)-J přechodů, navržení specifických primerů a optimalizaci kvantitativní PCR tak, aby byl pro každého pacienta získán nejméně jeden systém pro detekci MRN s minimální citlivostí 10-4. Tento postup je náročný metodicky, časově i finančně, a i při dodržování všech pravidel pro interpretaci výsledků přináší nebezpečí falešné pozitivity u vzorků s regenerací kostní dřeně (12). V současnosti se však jedná o jedinou mezinárodně standardizovanou metodu, která je univerzálně použitelná pro většinu pacientů s malignitami z lymfoidní řady.
Průtoková cytometrie
Kombinace monoklonálních protilátek jsou rozvrženy do tří zkumavek:
Zkumavka 1: CD58-FITC (klon AICD58)/xxPE/CD10-ECD (klon ALB1; xx=aberantně exprimovaný antigen)/CD45 PerCP (klon 2D1)/CD19-APC (klon J4.119)/CD34-PC7 (klon LIQ)/CD38-A700 (klon HIT2)/CD20-PB (klon 2H7). Jako znak xxPE používáme CD66c nebo CD33, NG2 podle exprese v diagnóze. Tyto aberantně exprimované antigeny mohou pomoci lépe identifikovat reziduální leukemickou populaci.
Zkumavka 2: CD20-FITC (klon 2H7)/CD10-PE (klon SS2/36)/CD45 PerCP (klon 2D1)/CD34-PC7 (klon LIQ)/CD19-APC (klon J4.119)/ CD38-A700 (klon HIT2)/Syto 41.
Zkumavka 3: Syto16/CD19-PE (klon SJ25C)/CD45 PerCP (klon 2D1)/CD71-A700 (MEM-75)/DAPI.
Měření provádíme na dvou průtokových cytometrech: DAKO CYAN, který je vybaven 3 lasery o vlnové délce 405 nm, 488 nm a 642 nm, a BD LSR II, který je vybaven lasery o vlnové délce 405 nm, 488 nm a 633 nm. Analýzu provádíme v software FlowJo 9.2 (TreeStar, Oregon, USA). Prvním krokem je výběr CD19poz buněk s nižší hodnou granularity (parametr side scatter – SSC) než mají granulocyty. V případě nízké exprese antigenu CD19 vybíráme buňky pomocí parametru CD19 a CD10 nebo CD34 nebo CD45. V další fázi vybíráme atypické buňky na jednotlivých dvourozměrných grafech s cílem optimálně oddělit populaci nemaligních B lymfocytů a atypických blastů. Suspektní leukemické buňky by měly tvořit kompaktní populaci v rámci optických parametrů forward scatter (FSC) a SSC. Konečná hodnota MRN je vyjádřena procentem z jaderných buněk definovaných pomocí fluorescenční značky (SYTO-16 nebo SYTO-41 - molekuly schopné vázat DNA i RNA a volně procházet buněčnou membránou). Pro přepočet na jaderné buňky v rámci dvou zkumavek se použije parametr obsažený v obou zkumavkách, zde antigen CD19. Rozmezí kvantifikovatelnosti MRN dosažitelné FC je definováno jako 0,01 %.
Korelace MRN v kostní dřeni a periferní krvi
První studie provedená na 35 párech vzorků KD a PK z průběhu indukční terapie ALL naznačila, že úroveň MRN v PK bude nižší než v KD (zde v průměru 12x) (13). S rozvojem vysoce citlivých technik byly provedeny dvě studie, které shodně prokázaly, že MRN v periferní krvi (PK) dobře koreluje s hladinou ve dřeni u většiny vzorků ALL z prekurzorů T-lymfocytů (T-ALL), zatímco u B-prekurzorové (BCP) ALL je nálož v PK s velkou variabilitou až 1000x nižší (14, 15). To se zdá být logické vzhledem k vývoji B-lymfocytů v KD a T-lymfocytů v thymu. Obě studie obsahovaly velmi malý počet vzorků s MRN měřitelnou v obou kompartmentech a také malé množství vzorků z prvních týdnů léčby, které mají prokazatelný prognostický význam. Na základě těchto studií se přesto od sledování MRN v krvi ustoupilo.
V naší studii (16) jsme vyšetřili 63 párových vzorků KD a PK u 19 pacientů s T-ALL a 431 párových vzorků KD a PK u 103 pacientů s BCP-ALL, a to převážně z časných bodů léčby (diagnóza, den 8, den 15, den 33, týden 12). Obrázek 1A ukazuje, že u pacientů s T-ALL je korelace hladin MRN mezi KD a PK velmi dobrá, zatímco u pacientů s BCP-ALL je situace podobná jako v předcházejících studiích, tedy MRN v PK zhruba o jeden řád nižší než v KD (obr. 1B).
Image 1. Srovnání hladin MRN v kostní dřeni (osa x) a v periferní krvi (osa y) u pacientů s T-ALL (A) a pacientů s BCP-ALL (B). 
Zdá se, že i v rámci BCP-ALL existují podskupiny s dobrou korelací KD-PK, a to proB ALL a ALL s fúzním genem BCR/ABL (obr. 1B). Malý počet pacientů v těchto podskupinách ale zatím neumožňuje spolehlivou statistickou analýzu.
Na základě těchto a publikovaných výsledků přistupujeme k nahrazení odběrů KD odběry krve teprve v časových bodech, ve kterých je již malá pravděpodobnost následného relapsu, tedy například při každoročních kontrolách déle než 3 roky po transplantaci krvetvorných buněk. Z výše uvedených studií na druhou stranu vyplývá, že u T-ALL již existuje dostatečné opodstatnění pro nahrazení odběrů KD periferní krví i v časnějších bodech léčby. To aplikujeme u části pacientů po transplantaci, ale pro nahrazení stratifikačních odběrů iniciální léčby (den 33, týden 12) dosud neexistuje dostatečné množství dat.
Prognostický význam postižení periferní krve
Jedním z největších počátečních úspěchů skupiny BFM bylo zjištění, že časná odpověď na prednizonovou předfázi (absolutní počet blastů v PK v den 8, tj. po 7 dnech prednizonu a jedné intrathekální dávce metotrexátu), je nejsilnějším prognostickým faktorem. Pacienti, kteří mají v 8. dni léčby v periferní krvi stále více než 1000 blastů na μl (asi 10 % ze všech pacientů), tvoří skupinu s mnohočetnou lékovou rezistencí, tzv. prednisone poor responders (PPR). Šance na přežití bez události (EFS) v této skupině byla na protokolu ALL-BFM 83 při desetiletém sledování 39 % ve srovnání s 66 % ve skupině s dobrou odpovědí na prednizon. Žádný jiný prognostický znak zatím sám o sobě nedokázal definovat tak velkou skupinu pacientů s EFS pod 50 % (17). Díky snadné dostupnosti a reprodukovatelnosti začlenila většina skupin tento znak do své rizikové stratifikace.
Další studie o roli postižení PK v průběhu léčby jsou velmi vzácné. Výše zmíněná studie (14) hodnotila riziko relapsu u 20 pacientů s přítomností MRN v KD na konci indukční léčby (den 46), léčených podle protokolů skupiny St. Jude Children‘s Research Hospital v Memphisu. Zajímavé bylo, že 4/5 pacientů s MRN zachycenou zároveň v PK prodělali relaps ve srovnání s 2/15 pacientů s MRN přítomnou pouze v kostní dřeni (čtyřletá kumulativní incidence relapsu 0,8 ± 0,25 vs. 0,13 ± 0,9; p = 0,007).
V naší studii vyšlo najevo, že hodnocení PK ve dni 15 pomocí PCR pro přestavby Ig/TCR má prognostický význam, podobně jako vyšetřování kostní dřeně v tomto časovém bodě (18). Pacienti s MRN v PK nižší než 10-4 měli výbornou prognózu se 100% pětiletým přežitím bez relapsu (RFS), zatímco ostatní pacienti měli RFS 64 ± 7 % (p = 0,0003). Hraničně signifikantní pro prognózu byla i hladina MRN v PK ve dni 8 (p = 0,06).
Důležité je, že naše stratifikace založená na MRN v PK ve dni 15 se překrývá se stávajícími rizikovými skupinami BFM protokolu (založeného na MRN v KD ve dni 33 a týdnu 12 léčby) pouze částečně a dokáže v rámci skupiny středního rizika dle BFM identifikovat podskupinu pacientů s nízkou MRN v PK s výbornou prognózou bez jediného relapsu (p = 0,008). Coxova regresní analýza prokázala, že MRN v PK v den 15 přidává další prognostickou informaci ke stávající rizikové stratifikaci založené na MRN v KD ve dni 33 a v týdnu 12.
Prognostický význam postižení centrálního nervového systému a jeho stanovení
Vedle PK je nejčastějším místem mimodřeňové leukemické infiltrace centrální nervový systém (CNS), i když symptomatické postižení CNS má v době diagnózy pouze asi 3 % dětských pacientů (19). Pomocí morfologického hodnocení mozkomíšního moku (CSF) lze ale přítomnost leukemických blastů prokázat u 15–20 % pacientů, z nichž většina postrádá neurologické symptomy (19, 20). Současným trendem je redukce léčby CNS (především radioterapie) za účelem snížení pozdních následků léčby (21). Z tohoto důvodu je velmi důležité přesné definování skutečného postižení CNS. Práce zkoumající prognostický význam postižení CNS ve smyslu CNS1 (bez postižení), CNS2 (< 5 jaderných buněk/μl v CSF a přítomnost blastů po cytocentrifugaci) a CNS3 (zřetelná CNS leukemie) se v některých aspektech rozcházejí. Zatímco u pacientů s CNS3 leukemií studie shodně prokázaly vyšší riziko relapsu s převahou relapsů v KD, údaje o prognostickém významu CNS2 se liší mezi dvěma nejvýznamnějšími studiemi (22, 23). Dalším aspektem diagnostiky postižení CNS je traumatická lumbální punkce, definovaná jako přítomnost erytrocytů ve vzorku CSF. V závislosti na definici je její výskyt podle jednotlivých studií 7–19 % (19, 24, 25). Podle některých studií představuje traumatická lumbální punkce spojená s přítomností blastů pro pacienta vyšší riziko relapsu, pravděpodobně kvůli zanesení leukemických buněk z krve do CNS (24). Moderní metody, tj. analýza přestaveb Ig/TCR a průtoková cytometrie, by mohly přinést přesnější kvantitativní i kvalitativní hodnocení CSF jak v době diagnózy, tak během sanace likvoru při iniciální leukemické infiltraci. Podle nové studie brazilských autorů byla pozitivita MRN v CSF (měřená metodou přestaveb Ig/TCR) v době diagnózy přítomna až u 47 % z celkem 65 vyšetřovaných dětí s ALL a byla spojena s významně horší prognózou, ale pouze při léčbě méně intenzivním ze dvou použitých protokolů. Autoři shrnují, že tito pacienti pravděpodobně profitují z intenzivnější chemoterapie, na přesvědčivé závěry je ale množství pacientů příliš malé (26).
V naší laboratoři jsme pilotně vyšetřili 24 vzorků CSF od pacientů při diagnóze ALL. 16 pacientů bylo mikroskopicky bez přítomnosti CNS postižení (CNS1), 8 pacientů mělo CNS2 status. Pomocí průtokové cytometrie jsme prokázali pozitivitu v CSF u všech pacientů s CNS2 a navíc i u 6 ze 16 pacientů (38 %) s CNS1 postižením. Celkem je tedy procento postižení CNS při diagnóze ALL na tomto malém souboru vyšší u průtokové cytometrie (58 %) než u klasické mikroskopie (33 %). Medián sledování souboru a jeho malá velikost zatím neumožňují vyvodit závěry o skutečném významu tohoto zjištění.
Po cytometrickém vyšetření jsme ze zbylých cca 200 μl CSF izolovali DNA pro stanovení MRN pomocí přestaveb Ig/TCR. V praxi se pro izolaci nejlépe osvědčila přímá izolace pomocí DNA Micro Kitu od firmy QIAGEN. Koncentrace izolované DNA stanovená pomocí kvantifikace genu pro albumin ukázala, že DNA izolovaná z CSF pacientů s CNS1 postižením je signifikantně méně koncentrovaná než DNA od pacientů s CNS2 (p = 0,002, Mann-Whitney). DNA izolovaná z CSF pacientů v okamžiku diagnózy izolovaného nebo kombinovaného relapsu v CNS měla zdaleka nejvyšší koncentraci (obr. 2), zatímco vzorky izolované v průběhu léčby relapsu měly opět nízkou koncentraci. Z těchto výsledků se zdá, že vyšetření pomocí PCR bude mít dostatečnou citlivost pro stanovení leukemické infiltrace při diagnóze relapsu v CNS, ale pro kvantifikaci méně rozsáhlého postižení CNS v diagnóze nebo pro monitorování léčby relapsu v CNS nebude dostatečně spolehlivé.
Image 2. Koncentrace DNA izolované z mozkomíšního moku v závislosti na mikroskopické infiltraci moku u pacientů s CNS 1 a CNS 2 postižením (v souboru nebyl žádný pacient s CNS 3 postižením), u pacientů při diagnóze izolovaného nebo kombinovaného relapsu v CNS a v průběhu jeho léčby. 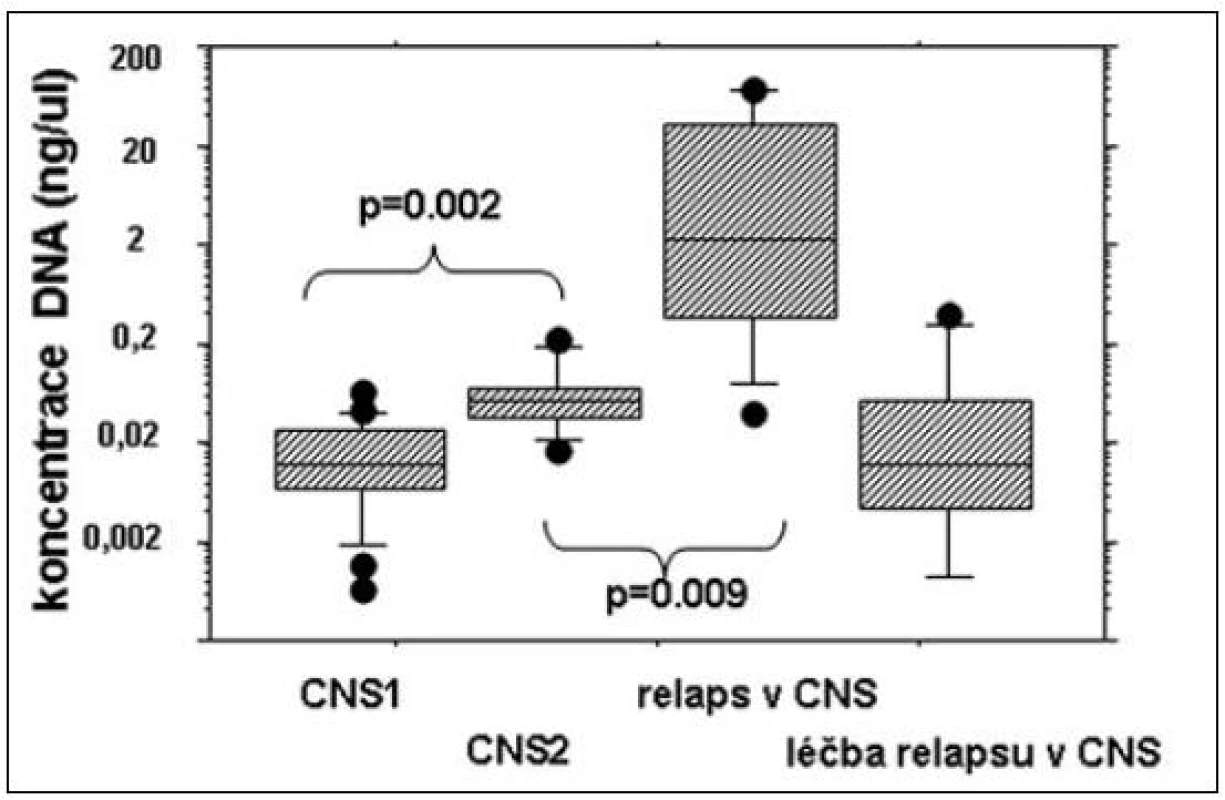
MRN u extramedulárních relapsů
Mezinárodní studie s účastí Německa, Francie a České republiky zkoumala molekulárně-genetické postižení KD v okamžiku izolovaného extramedulárního relapsu u 64 dětí s ALL (27). Většinou (59 %) se jednalo o relapsy v CNS, dále o testikulární relapsy (33 %) a zbytek tvořily relapsy v lymfatických uzlinách (2x), v ovariu (1x) a v mediastinu (1x). Studie ukázala, že alespoň minimální postižení KD (tj. detekovatelná hladina MRN v KD) je přítomno u 89 % pacientů. Pacienti s relapsem v CNS měli trend k vyššímu postižení KD než pacienti s testikulárním relapsem (MRN ≥ 10-4 u 80 % vs. 57 % pacientů; p = 0,08). Pacienti s hladinou MRN v KD vyšší než 10-4 v okamžiku extramedulárního relapsu měli vyšší kumulativní incidenci následných relapsů (0,65 ± 0,01) než pacienti s nízkou nebo negativní hladinou (0,24 ± 0,01; p = 0,01). Tyto výsledky zatím nebyly zohledněny v léčebném protokolu.
Studie o vlivu poklesu reziduální nemoci v CSF na prognózu pacientů s relapsem v CNS dosud chybějí, zřejmě kvůli poměrně nesnadné logistice přepravy a zpracování vzorků. Pomocí průtokové cytometrie a PCR pro přestavby Ig/TCR jsme vyšetřili celkem 21 vzorků CSF od 8 pacientů s kombinovaným nebo izolovaným relapsem v CNS. Systémy Ig/TCR zavedené při iniciální diagnóze ALL jsme použili pro stanovení výše infiltrace CNS v okamžiku CNS relapsu. U 7 z 8 pacientů byla pro prodělení kontrolním genem stanovena hladina postižení CNS přibližně 100 %, u jednoho pacienta došlo v relapsu ke ztrátě přestavby VH4-JH a tím k falešné negativitě. Pacient byl sledován navíc pomocí fúzního genu MLL/ELL, u kterého byla hladina MRN opět 100 %. Ze 13 vzorků z průběhu léčby relapsu bylo 5 pozitivních oběma metodami, 4 pozitivní pomocí PCR, ale negativní pomocí průtokové cytometrie a 4 negativní oběma metodami. Na tomto malém souboru se zdá, že PCR byla citlivější metodou. Významnou roli u průtokové cytometrie hraje doba transportu vzorku. Buňky ve vzorku velmi rychle hynou a po více než 24 hodinách výpovědní hodnota průtokové cytometrie dramaticky klesá, zatímco PCR je při použití DNA poměrně stabilní. Pro definitivní stanovení významu kinetiky MRN v CNS bude třeba provést rozsáhlejší multicentrickou studii, která je v současnosti plánována skupinou BFM.
Závěr
Uvedené výsledky ukazují, že u dětské ALL je prognosticky významná nejen hladina reziduální nemoci v kostní dřeni, ale i rozsah mimodřeňového postižení. Jeho vyšetřování zejména v periferní krvi a CNS pomocí moderních metod – průtokové cytometrie a molekulární genetiky – může přispět k dalšímu zlepšení léčebných výsledků: např. minimální reziduální nemoc v periferní krvi v 15. dni léčby má důležitý prognostický význam, zpřesňuje stávající rizikovou stratifikaci a identifikuje podskupinu pacientů s výbornou prognózou.
Podíl jednotlivých autorů na přípravě práce
E. Froňková a J. Volejníková sepsaly rukopis a provedly měření minimální reziduální nemoci metodami molekulární genetiky a analýzu těchto dat. E. Mejstříková a L. Slámová jsou odpovědné za oblast průtokové cytometrie. O. Hrušák a J. Trka konzultovali a supervidovali uvedené projekty naší skupiny. V. Mihál, J. Štěrba, Y. Jabali, D. Procházková, B. Blažek, J. Hak, Z. Černá a J. Starý zajistili odběry vzorků, management a klinická data pacientů.
Poděkování
Podpořeno grantem IGA NS10472-3.
MUDr. Jana Volejníková
Klinika dětské hematologie a onkologie
2. LF UK a FN Motol
V Úvalu 84
150 06 Praha
jana.volejnikova@fnmotol.cuni.cz
Doručeno do redakce: 2. 4. 2012
Přijato po recenzi: 3. 7. 2012
Sources
1. Cave H, van der Werff ten Bosch J, Suciu S, et al. Clinical significance of minimal residual disease in childhood acute lymphoblastic leukemia. European Organization for Research and Treatment of Cancer—Childhood Leukemia Cooperative Group. N Engl J Med 1998; 339 : 591-598.
2. Coustan Smith E, Sancho J, Hancock ML, et al. Clinical importance of minimal residual disease in childhood acute lymphoblastic leukemia. Blood 2000; 96 : 2691-2696.
3. van Dongen JJ, Seriu T, Panzer-Grumayer ER, et al. Prognostic value of minimal residual disease in acute lymphoblastic leukaemia in childhood. Lancet 1998; 352 : 1731-1738.
4. Flohr T, Schrauder A, Cazzaniga G, et al. Minimal residual disease-directed risk stratification using real-time quantitative PCR analysis of immunoglobulin and T-cell receptor gene rearrangements in the international multicenter trial AIEOP-BFM ALL 2000 for childhood acute lymphoblastic leukemia. Leukemia 2008; 22 : 771-782.
5. Pui CH, Relling MV, Sandlund JT, et al. Rationale and design of Total Therapy Study XV for newly diagnosed childhood acute lymphoblastic leukemia. Ann Hematol 2004; 83(Suppl 1): S124-126.
6. Schultz KR, Pullen DJ, Sather HN, et al. Risk - and response-based classification of childhood B-precursor acute lymphoblastic leukemia: a combined analysis of prognostic markers from the Pediatric Oncology Group (POG) and Children’s Cancer Group (CCG). Blood 2007; 109 : 926-935.
7. Zhou J, Goldwasser MA, Li A, et al. Quantitative analysis of minimal residual disease predicts relapse in children with B-lineage acute lymphoblastic leukemia in DFCI ALL Consortium Protocol 95-01. Blood 2007; 110 : 1607-1611.
8. Conter V, Bartram CR, Valsecchi MG, et al. Molecular response to treatment redefines all prognostic factors in children and adolescents with B-cell precursor acute lymphoblastic leukemia: results in 3184 patients of the AIEOP-BFM ALL 2000 study. Blood 2010; 115 : 3206-3214.
9. Pongers-Willemse MJ, Seriu T, Stolz F, et al. Primers and protocols for standardized detection of minimal residual disease in acute lymphoblastic leukemia using immunoglobulin and T cell receptor gene rearrangements and TAL1 deletions as PCR targets: report of the BIOMED-1 CONCERTED ACTION: investigation of minimal residual disease in acute leukemia. Leukemia 1999; 13 : 110-118.
10. van Dongen JJ, Langerak AW, Bruggemann M, et al. Design and standardization of PCR primers and protocols for detection of clonal immunoglobulin and T-cell receptor gene recombinations in suspect lymphoproliferations: report of the BIOMED-2 Concerted Action BMH4-CT98-3936. Leukemia 2003; 17 : 2257-2317.
11. van der Velden VH, Cazzaniga G, Schrauder A, et al. Analysis of minimal residual disease by Ig/TCR gene rearrangements: guidelines for interpretation of real-time quantitative PCR data. Leukemia 2007; 21 : 604-611.
12. Fronkova E, Muzikova K, Mejstrikova E, et al. B-cell reconstitution after allogeneic SCT impairs minimal residual disease monitoring in children with ALL. Bone Marrow Transplant 2008; 42 : 187-196.
13. Brisco MJ, Sykes PJ, Hughes E, et al. Monitoring minimal residual disease in peripheral blood in B-lineage acute lymphoblastic leukaemia. Br J Haematol 1997; 99 : 314-319.
14. Coustan-Smith E, Sancho J, Hancock ML, et al. Use of peripheral blood instead of bone marrow to monitor residual disease in children with acute lymphoblastic leukemia. Blood 2002; 100 : 2399-2402.
15. van der Velden VH, Jacobs DC, Wijkhuijs AJ, et al. Minimal residual disease levels in bone marrow and peripheral blood are comparable in children with T cell acute lymphoblastic leukemia (ALL), but not in precursor-B-ALL. Leukemia 2002; 16 : 1432-1436.
16. Volejnikova J, Mejstrikova E, Valova T, et al. Minimal residual disease in peripheral blood at day 15 identifies a subgroup of childhood B-cell precursor acute lymphoblastic leukemia with superior prognosis. Haematologica 2011; 96 : 1815-1821.
17. Schrappe M. Evolution of BFM trials for childhood ALL. Ann Hematol 2004; 83(Suppl 1): S121-123.
18. Basso G, Veltroni M, Valsecchi MG, et al. Risk of relapse of childhood acute lymphoblastic leukemia is predicted by flow cytometric measurement of residual disease on day 15 bone marrow. J Clin Oncol 2009; 27 : 5168-5174.
19. Burger B, Zimmermann M, Mann G, et al. Diagnostic cerebrospinal fluid examination in children with acute lymphoblastic leukemia: significance of low leukocyte counts with blasts or traumatic lumbar puncture. J Clin Oncol 2003; 21 : 184-188.
20. Mahmoud HH, Rivera GK, Hancock ML, et al. Low leukocyte counts with blast cells in cerebrospinal fluid of children with newly diagnosed acute lymphoblastic leukemia. N Engl J Med 1993; 329 : 314-319.
21. Pui CH, Campana D, Pei D, et al. Treating childhood acute lymphoblastic leukemia without cranial irradiation. N Engl J Med 2009; 360 : 2730-2741.
22. te Loo DM, Kamps WA, van der Does-van den Berg A, et al. Prognostic significance of blasts in the cerebrospinal fluid without pleiocytosis or a traumatic lumbar puncture in children with acute lymphoblastic leukemia: experience of the Dutch Childhood Oncology Group. J Clin Oncol 2006; 24 : 2332-2336.
23. Marwaha RK, Kulkarni KP, Bansal D, et al. Central nervous system involvement at presentation in childhood acute lymphoblastic leukemia: management experience and lessons. Leuk Lymphoma 2010; 51 : 261-268.
24. Gajjar A, Harrison PL, Sandlund JT, et al. Traumatic lumbar puncture at diagnosis adversely affects outcome in childhood acute lymphoblastic leukemia. Blood 2000; 96 : 3381-3384.
25. Howard SC, Gajjar AJ, Cheng C, et al. Risk factors for traumatic and bloody lumbar puncture in children with acute lymphoblastic leukemia. JAMA 2002; 288 : 2001-2007.
26. Biojone E, Queiroz Rde P, Valera ET, et al. Minimal residual disease in cerebrospinal fluid at diagnosis: a more intensive treatment protocol was able to eliminate the adverse prognosis in children with acute lymphoblastic leukemia. Leuk Lymphoma 2012; 53 : 89-95.
27. Hagedorn N, Acquaviva C, Fronkova E, et al. Submicroscopic bone marrow involvement in isolated extramedullary relapses in childhood acute lymphoblastic leukemia: a more precise definition of “isolated” and its possible clinical implications, a collaborative study of the Resistant Disease Committee of the International BFM study group. Blood 2007; 110 : 4022-4029.
Labels
Haematology Internal medicine Clinical oncology
Article was published inTransfusion and Haematology Today

2012 Issue 3-
All articles in this issue
-
Dasatinib v 2. línii liečby chronickej myelocytovej leukémie u pacientov s rezistenciou alebo intoleranciou imatinibu na Klinike hematológie a transfuziológie
Bratislava v rokoch 2007-2011 - Získaná aplastická anémie v dětském věku – dlouhodobé výsledky a rizika kombinované imunosupresivní léčby antithymocytárním globulinem a cyklosporinem A
- Stanovení mimodřeňové leukemické infiltrace u dětské akutní lymfoblastické leukemie a jeho klinické využití. Přehledný článek a vlastní výsledky
- Vzácny typ intestinálneho krvácania u pacienta s kolorektálnym karcinómom na antikoagulačnej liečbe
-
Dasatinib v 2. línii liečby chronickej myelocytovej leukémie u pacientov s rezistenciou alebo intoleranciou imatinibu na Klinike hematológie a transfuziológie
- Transfusion and Haematology Today
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Získaná aplastická anémie v dětském věku – dlouhodobé výsledky a rizika kombinované imunosupresivní léčby antithymocytárním globulinem a cyklosporinem A
- Vzácny typ intestinálneho krvácania u pacienta s kolorektálnym karcinómom na antikoagulačnej liečbe
- Stanovení mimodřeňové leukemické infiltrace u dětské akutní lymfoblastické leukemie a jeho klinické využití. Přehledný článek a vlastní výsledky
-
Dasatinib v 2. línii liečby chronickej myelocytovej leukémie u pacientov s rezistenciou alebo intoleranciou imatinibu na Klinike hematológie a transfuziológie
Bratislava v rokoch 2007-2011
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

