-
Medical journals
- Career
Vliv ultrazvuku na účinnost fotodynamické terapie – in vitro studie
Authors: Klára Pížová 1,2; Kateřina Tománková 1; Kateřina Langová 1; Adéla Hanáková 1,2; Hana Lenobelová 1; Hana Zapletalová 1; Jakub Malohlava 1,2; Svatopluk Binder 1; Robert Bajgar 1,2; Jaromír Vachutka 1; Ladislav Doležal 1; Hana Kolářová 1
Authors‘ workplace: Ústav lékařské biofyziky, Lékařská fakulta, Univerzita Palackého, Olomouc, ČR 1; Ústav molekulární a translační medicíny, Lékařská fakulta, Univerzita Palackého, Olomouc, ČR 2
Published in: Lékař a technika - Clinician and Technology No. 4, 2012, 42, 18-22
Overview
Fotodynamická terapie (PDT) patří k perspektivním metodám léčby nádorů. Je založená na selektivní akumulaci fotosensitizeru v nádorové tkáni a následném ozáření světlem určité vlnové délky. PDT je díky vysoké specifitě a selektivitě a faktu, že nevyvolává nežádoucí vedlejší účinky, v současnosti široce rozvíjena. Sonodynamická terapie (SDT) využívá k vyvolání cytotoxického efektu sensitizeru ultrazvuk. V naší práci jsme ověřovali, zda je možné tyto metody kombinovat a zvýšit tak jejich účinek. Z výsledků vyplývá, že ozáření v kombinaci s aplikací terapeutického ultrazvuku zvyšuje oproti samotnému ozáření ZnTPPS4 produkci reaktivních forem kyslíku a snižuje životnost nádorových buněk MCF7, zvláště v případě vyšších terapeutických dávek. Kombinace PDT a SDT může do budoucna přinést nové možnosti léčby nádorových, ale také nenádorových onemocnění.
Klíčová slova:
fotosensitizer, fotodynamická terapie, sonodynamická terapie, derivát porfyrinuÚvod
Fotodynamická terapie (PDT) je jednou z metod minimálně invazivního způsobu léčby celé řady nádorů i některých nenádorových onemocnění a v současné době se stále více rozvíjí. PDT kombinuje tři faktory - kyslík, viditelné záření a fotosensitizer, který se akumuluje přednostně v nádorové tkáni. Tyto komponenty jsou samy o sobě neškodné, ale společně mohou mít letální efekt a tak vyhubit nádorové buňky [1]. Po ozáření světlem určité vlnové délky je molekula fotosensitizeru excitována a dochází k přenosu energie na substráty v buňce (fotochemická reakce typu I), což vede k tvorbě volných radikálů a radikálových produktů (peroxidy, superoxidové ionty a hydroxylové radikály), které spouští řetězové radikálové reakce. Nebo energie excitovaného fotosensitizeru přechází přímo na molekulu kyslíku (fotochemická reakce typu II), čímž vznikne singletní kyslík (1O2), který poté oxiduje další molekuly v buňce. Výsledné poškození organel nádorových buněk vede k zániku nádoru. Buňky nádoru mohou umírat apoptózou nebo nekrózou [2–5]. Hlavními výhodami PDT oproti radioterapii a chemoterapii je vyšší selektivita při destrukci nádorové tkáně, možnost opakované aplikace a fakt, že PDT nezpůsobuje těžké lokální ani systémové komplikace. Další výhodou fotodynamických reakcí je možnost využít jejich principu jak k léčbě, tak k fluorescenční diagnostice nádoru [4].
Sonodynamická terapie (SDT) využívá k aktivaci senzitivní látky v patologických tkáních ultrazvuk. Doposud není objasněn mechanismus účinku SDT, výzkumy však naznačují, že SDT vyvolává tzv. vnitřní kavitaci, což je proces, kdy se vzduchová bublina vyvolaná ultrazvukem v kapalině náhle rozpadne a vyvolá šokovou vlnu doprovázenou silným uvolněním tepelné energie. Okolní molekuly vody se přitom rozloží na *H a *OH radikály, které spolu s následně vzniklými radikálovými produkty opět spouští řetězové radikálové reakce a poškozují molekuly buňky. Kromě kavitace může SDT způsobovat také změnu rozmístění sensitizeru v buňce a přeměnu agregovaných molekul sensitizeru na stabilnější monomerní formu, která má silnější cytotoxický účinek. Ultrazvuk může rovněž destabilizovat buněčnou membránu, díky čemuž se buňka stane citlivější a zvýší se transport léčiva přes buněčnou membránu. Tato metoda má oproti jiným fyzikálním způsobům léčby výhodu opět především v selektivitě, protože ultrazvuk je možné zaměřit na malou cílovou oblast. Výhodou oproti PDT je fakt, že ultrazvuk může pronikat hlouběji do tkáně [6–10].
Protože se v literatuře objevily náznaky, že některé fotosensitizery lze aktivovat jak fotochemicky, tak sonochemicky [11–18], zajímalo nás, jak a zda je možné zmíněné terapie kombinovat a tak zvýšit jejich účinnost. Hodnotili jsme tedy podpůrný vliv ultrazvuku na PDT s fotosensitizerem na bázi porfyrinu ZnTPPS4 na nádorovou buněčnou linii MCF7 v podmínkách in vitro. Účinek in vitro terapie jsme zkoumali pomocí detekce tvorby reaktivních forem kyslíku (ROS) a testem buněčné viability (MTT test).
Materiál a metody
Příprava buněčné kultury
Použili jsme buněčnou linii MCF7 (odvozená od lidského karcinomu prsu). Buňky byly kultivovány v médiu DMEM (10% fetálního bovinního séra, 2% 200 mM L-glutaminu, 0,4% penicilinu/streptomycinu, Sigma) ve sterilních Petriho miskách (TPP, 35 mm), (300 000 buněk/misku) v atmosféře 5% CO2 při 37°C.
Fotodynamická a sonodynamická terapie
Do kultivačního média DMEM byl přidán fotosentitizer ZnTPPS4 [zinečnatý komplex meso-tetrakis(4-sulfonatofenyl)porfyrinu] v koncentracích 0 (kontrola); 1; 2,5; 5 a 10 μmol/l. Po 24 h inkubace ve tmě (5% CO2, 37°C) byly buňky opláchnuty PBS a trypsinizovány 0,5% trypsinem (Sigma-Aldrich). Průběh trypsinnizace byl sledován na inverzním optickém mikroskopu Olympus IX81 s DSU jednotkou (Olympus). Po uvolnění buněk ze dna byla trypsinizace zastavena čerstvým médiem DMEM s 10% FBS a suspenze byla přenesena do 2ml zkumavek eppedorf (P-LAB). Suspenze byla centrifugována při 1250 rpm 5 minut centrifuga HERMLE Z 300 K) a pelet buněk byl resuspendován v 5μM roztoku 5-(and 6-)-chloromethyl-2´,7´-dichlorodihydrofluorescein diacetátu (CM-H2DCFDA), (Invitrogen). Po 30 min inkubace ve tmě byla polovina vzorků vystavena na 5 min působení terapeutického ultrazvuku (BTL-4000, BTL Industries) o frekvenci 1 MHz a intenzitě 2 W/cm2. Buněčná suspenze všech vzorků byla následně rozpipetována na 96ti jamkovou kultivační destičku (TPP) a ozářena LED diodami s vlnovou délkou 414 nm, FWHM 20 nm o celkové dávce 0 (kontrola); 10 a 25 J/cm2.
Detekce reaktivních forem kyslíku (ROS)
Ihned po ozáření byla měřena fluorescence 5-(-6)-chloromethyl - 2’,7’-dichlorofluoresceinu (CM-DCF), (excitace/emise: 485/540 nm) na readeru Synergy HT (BioTek). Poté byl přebytek sondy vymyt PBS, nahrazen čerstvým médiem DMEM a buňky byly inkubovány dalších 24 h (5% CO2, 37°C).
Test viability (MTT test)
Médium DMEM bylo nahrazeno 2mM roztokem 3-(4,5-dimethyl-2-thiazolyl)-2,5-diphenyl-2H-tetrazolium bromidu (MTT), (Sigma-Aldrich) v PBS. Buňky byly v roztoku MTT inkubovány 3,5 h (5% CO2, 37°C). Poté byl roztok MTT odstraněn a krystalky formazánu rozpuštěny v DMSO. Absorbance formazánu byla měřena na readeru Synergy HT při 570 nm (absorbance formazánu) a 690 nm (absorbance destičky - pozadí). Odečtené hodnoty absorbance byly zpracovány v programu PHOTOTOX a byly zjištěny hodnoty IC50 pro neozvučované a ozvučované vzorky.
Statistické zpracování dat
Ke statistickému zpracování dat byl použit software SPSS verze 15 (SPSS Inc. Chicago, USA). Nejprve se testy normality Shapiro-Wilk zjišťovalo, zda mají data normální rozdělení. Pokud bylo prokázáno, že mají normální rozložení, skupiny byly dále porovnány dvouvýběrovým t-testem. U skupin, kde se neprokázalo normální rozdělení dat, byly na následné porovnání použity neparametrické Mann-Whitney U-testy.
Výsledky
Detekce reaktivních forem kyslíku (ROS)
Jak je patrné z výsledných grafů, množství vzniklých ROS závisí zejména na celkové dávce ozáření, méně pak na koncentraci fotosensitizeru. Při terapii bez ozáření (viz Graf 1) byly hodnoty ROS podle očekávání minimální a rozdíly mezi ozvučenými a neozvučenými vzorky nebyly patrné. Při statistickém hodnocení (viz Tab. 1) sice vyšlo v případě 10 μM ZnTPPS4, že aplikace ultrazvuku hodnoty ROS statisticky významně zvýšila (p = 0,004), vzhledem k vysokým hodnotám ROS u ozařovaných vzorků je to ovšem zanedbatelné. Při terapii s dávkou ozáření 10 J/cm2 (viz Graf 2) aplikace ultrazvuku zvýšila produkci ROS při vyšších koncentracích ZnTPPS4 (5 a 10 μmol/l), jako statisticky významné (viz Tab. 1) bylo ovšem zvýšení pouze u nejvyšší koncentrace 10 μmol/l (p = 0,0001). V případě koncentrací 0 a 5 μmol/l je ale patrný statistický trend směrem ke zvýšení hodnot při aplikaci ultrazvuku, protože hodnoty signifikance byly těsně nad hladinou významnosti (p = 0,088). Při terapii s dávkou ozáření 25 J/cm2 (viz Graf 3) byly hodnoty ROS podle očekávání nejvyšší a je patrné, že použití ultrazvuku produkci ROS ještě zvyšovalo a to při všech aplikovaných koncentracích ZnTPPS4. Jako statisticky významné (viz Tab. 1) bylo ovšem zvýšení v případě 0μM ZnTPPS4 (p = 0,0001), 2,5μM ZnTPPS4 (p = 0,029) a 5μM ZnTPPS4 (p = 0,015).
Graph 1. Hodnoty fluorescence reaktivních forem kyslíku (ROS) při různých koncentracích fotosensitizeru ZnTPPS<sub>4</sub> v kombinaci s (světle šedé sloupce) nebo bez (tmavě šedé sloupce) aplikace terapeutického ultrazvuku na buňkách MCF7 naměřené ihned po terapii. Znázorněná data reprezentují průměrné hodnoty a směrodatné odchylky ze tří nezávislých měření. 
Table 1. Statistické vyhodnocení počátečních hodnot ROS. 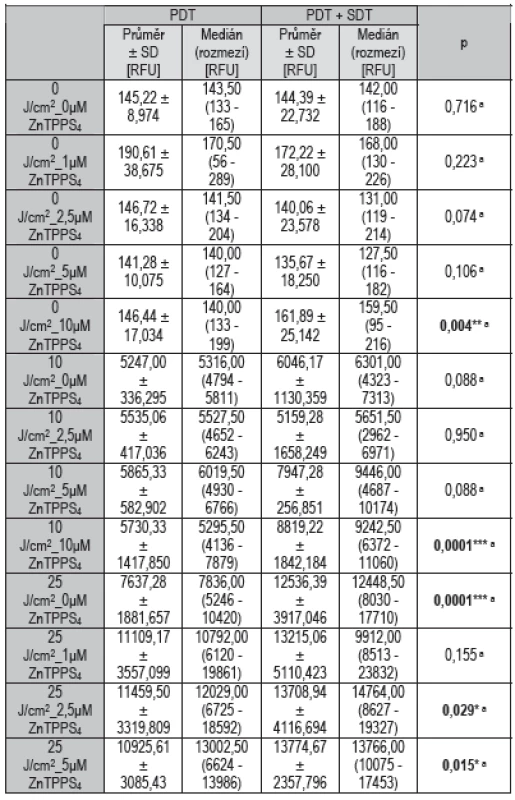
a Mann-Whitney U-testy * hodnoty jsou statisticky významné na hladině 0,05 ** hodnoty jsou statisticky významné na hladině 0,01 *** hodnoty jsou statisticky významné na hladině 0,001 Graph 2. Hodnoty fluorescence ROS při různých koncentracích fotosensitizeru ZnTPPS<sub>4</sub> v kombinaci s viditelným světlem vlnové délky 414 nm o celkové dávce ozáření 10 J/cm<sup>2</sup> a v kombinaci s (světle šedé sloupce) nebo bez (tmavě šedé sloupce) aplikace terapeutického ultrazvuku na buňkách MCF7 naměřené ihned po terapii. Znázorněná data reprezentují průměrné hodnoty a směrodatné odchylky ze tří nezávislých měření. 
Graph 3. Hodnoty fluorescence ROS při různých koncentracích fotosensitizeru ZnTPPS<sub>4</sub> v kombinaci s viditelným světlem vlnové délky 414 nm o celkové dávce ozáření 25 J/cm<sup>2</sup> a v kombinaci s (světle šedé sloupce) nebo bez (tmavě šedé sloupce) aplikace terapeutického ultrazvuku na buňkách MCF7 naměřené ihned po terapii. Znázorněná data reprezentují průměrné hodnoty a směrodatné odchylky ze tří nezávislých měření. 
Test viability (MTT test)
Na základě předběžných experimentů pomocí testu viability MTT v širší škále koncentrací ZnTPPS4 (data nezobrazena) byly vybrány pro každou dávku ozáření vždy tři koncentrace (a kontrola) tak, aby ta prostřední vyvolávala přibližně 50% úmrtnost buněk (pro 10 J/cm2 je to 5 μmol/l ZnTPPS4, pro 25 J/cm2 je to 2,5 μmol/l ZnTPPS4).
Při terapii bez ozáření životnost buněk podle očekávání neklesla pod 50 % při žádné aplikované koncentraci fotosensitizeru, ať už bez nebo s použitím ultrazvuku (viz Tab. 2), hodnotu IC50 tedy nebylo možno určit. Při terapii s dávkou ozáření 10 J/cm2 aplikace ultrazvuku snížila hodnotu IC50 v průměru ze 4,972 μmol/l na 3,693 μmol/l, snížení ale nebylo statisticky významné. Při terapii s dávkou ozáření 25 J/cm2 aplikace ultrazvuku snížila hodnotu IC50 v průměru z 2,632 μmol/l na 0,995 μmol/l a snížení se prokázalo jako statisticky významné (p = 0,048).
Table 2. Statistické vyhodnocení hodnot IC50. 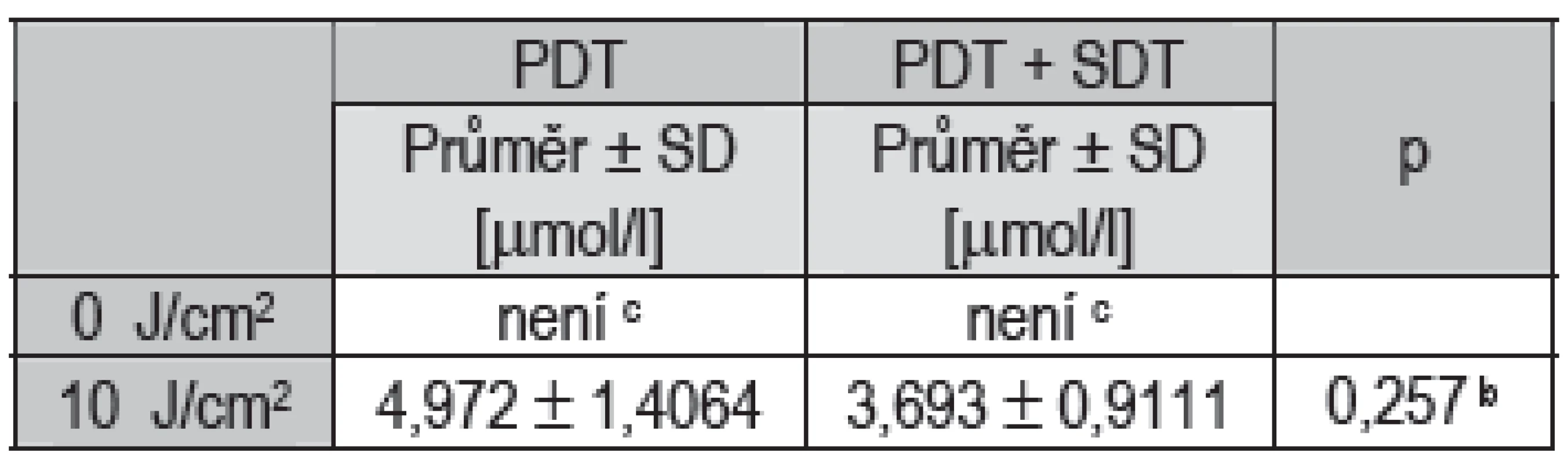
b Dvouvýběrový t-test c hodnoty životnosti neklesly pod 50 % * hodnoty jsou statisticky významné na hladině 0,05 ** hodnoty jsou statisticky významné na hladině 0,01 *** hodnoty jsou statisticky významné na hladině 0,001 Diskuze
Některé fotosensitizery lze aktivovat jak fotochemicky, tak sonochemicky [11–14, 17, 18]. V této práci jsme testovali na nádorové buněčné linii MCF7 v podmínkách in vitro, zda je možné PDT a SDT kombinovat a tak zvýšit jejich účinnost. Na základě výsledků lze soudit, že kombinace SDT a PDT je účinnější. Aplikace terapeutického ultrazvuku v kombinaci s PDT se ZnTPPS4 zvyšuje oproti samotné PDT produkci reaktivních forem kyslíku i úmrtnost buněk, což se statisticky prokázalo u vyšších terapeutických dávek (vyšší koncentrace fotosensitizeru, vyšší dávky ozáření).
Tímto tématem se naše skupina již dříve zabývala, když jsme zkoumali tvorbu ROS po PDT v kombinaci s SDT, rovněž na buněčné linii MCF7 [15], ale také na linii G361 (odvozené od lidského melanomu) [16], jako fotosensitizer jsme ovšem používali ftalocyanin ClAlPcS2. Kvůli poněkud odlišnému postupu (vzorky nebyly trypsinizovány, byly ozvučovány v Petriho miskách a ultrazvuk byl aplikován po delší dobu – 10 min) a především jinému typu sensitizeru nelze výsledky příliš srovnávat. Ovšem i při těchto experimentech se prokázalo, že PDT v kombinaci s SDT zvyšuje produkci ROS oproti samotné PDT, na buněčné linii MCF7 však opět pouze při nejvyšších terapeutických dávkách.
Předpokládá se, že SDT vyvolává kavitaci, může také měnit rozmístění fotosensitizeru v buňce, vyvolávat destabilizaci buněčné membrány a přeměnu agregovaných molekul fotosensitizeru na stabilnější monomerní formu se silnějším cytotoxickým účinkem [6–10]. Z výsledků vyplývá, že ultrazvuk působí mimo jiné na samotnou molekulu fotosensitizeru a v případě buněčné linie MCF7 se vliv ultrazvuku u kombinované terapie PDT s SDT nejvíce projevuje při vyšších terapeutických dávkách.
Závěr
Je velmi důležité hledat a rozvíjet nové účinnější způsoby léčby. Fotodynamická a sonodynamická terapie by mohla výhledově doplnit běžně používané terapeutické postupy pro zhoubné nádory jako chirurgické odstranění, radioterapie a chemoterapie. S pomocí PDT bylo dosaženo už celé řady úspěchů a několik fotosensitizerů bylo schváleno pro klinické použití (k léčbě nádorových i některých nenádorových onemocnění). PDT je ale neustále předmětem výzkumu. Hlavní snahou je zvýšit účinnost této metody a rozšířit její použití. V naší práci jsme prokázali, že aplikace terapeutického ultrazvuku může významně zvýšit účinnost PDT v podmínkách in vitro. I když všechny mechanismy kombinovaného efektu SDT a PDT ještě nejsou zcela vysvětleny, věříme, že tato kombinovaná terapie se může do budoucna stát další účinnou léčebnou metodou a je vhodné zabývat se jí dále.
Poděkování
Práce vznikla za podpory výzkumných projektů CZ.1.05/2.1.00/01.0030 a LF_2011_009.
Prof. RNDr. Hana Kolářová, CSc.
Ústav lékařské biofyziky
Lékařská fakulta
Univerzita Palackého v Olomouci
Hněvotínská 3, 775 15 Olomouc
E-mail: hana.kolarova@upol.cz
tel.: +420 585 632 101
Sources
[1] Pushpan, S.K., Venkatraman, S., Anand, V.G., Sankar, J., Parmeswaran, D., Ganesan, S., Chandrashekar, T.K.: Porphyrins in photodynamic therapy - a search for ideal photosensitizers. Curr Med Chem Anticancer Agents, 2, 2002, pp. 187-207.
[2] Calzavara-Pinton, P.G., Venturini, M., Sala, R.: Photodynamic therapy: update 2006. Part 1: Photochemistry and photobiology. J Eur Acad Dermatol Venereol, 21, 2007, pp. 293-302.
[3] O'Connor, A.E., Gallagher, W.M., Byrne, A.T.: Porphyrin and nonporphyrin photosensitizers in oncology: preclinical and clinical advances in photodynamic therapy. Photochem Photobiol, 85, 2009, pp. 1053-1074.
[4] Kudinova, N.V., Berezov, T.T.: Photodynamic Therapy of Cancer: Search For Ideal Photosensitizer. Biochemistry (Moscow) Supplement Series B: Biomedical Chemistry, 4, 2010, pp. 95–103.
[5] Agostinis, P., Berg, K., Cengel, K.A., Foster, T.H., Girotti, A.W., Gollnick, S.O., Hahn, S.M., Hamblin, M.R., Juzeniene, A., Kessel, D., Korbelik, M., Moan, J., Mroz, P., Nowis, D., Piette, J., Wilson, B.C., Golab, J.: Photodynamic therapy of cancer: an update. CA Cancer J Clin, 61, 2011, pp. 250-281.
[6] Suslick, K.S.: Sonochemistry. Science, 247, 1990, pp. 1439-1445.
[7] Worthington, A.E., Thompson, J., Rauth, A.M., Hunt, J.W.: Mechanism of ultrasound enhanced porphyrin cytotoxicity. Part I: A search for free radical effects. Ultrasound Med Biol, 23, 1997, pp. 1095-1105.
[8] Miyoshi, N., Takeshita, T., Misik, V., Riesz, P.: Monomerization of photosensitizers by ultrasound irradiation in surfactant micellar solutions. Ultrason Sonochem, 8, 2001, pp. 367-371.
[9] Rosenthal, I., Sostaric, J.Z., Riesz, P.: Sonodynamic therapy - a review of the synergistic effects of drugs and ultrasound. Ultrason Sonochem, 11, 2004, pp. 349-363.
[10] Hiraoka, W., Honda, H., Feril, L.B. Jr., Kudo, N., Kondo, T.: Comparison between sonodynamic effect and photodynamic effect with photosensitizers on free radical formation and cell killing. Ultrason Sonochem, 13, 2006, pp. 535-542.
[11] Jin, Z.H., Miyoshi, N., Ishiguro, K., Umemura, S., Kawabata, K., Yumita, N., Sakata, I., Takaoka, K., Udagawa, T., Nakajima, S., Tajiri, H., Ueda, K., Fukuda, M., Kumakiri, M.: Combination effect of photodynamic and sonodynamic therapy on experimental skin squamous cell carcinoma in C3H/HeN mice. J Dermatol, 27, 2000, pp. 294-306.
[12] Yumita, N., Nishigaki, R., Umemura, S.: Sonodynamically induced antitumor effect of Photofrin II on colon 26 carcinoma. J Cancer Res Clin Oncol, 126, 2000, pp. 601-606.
[13] Yumita, N., Umemura, S.: Sonodynamic therapy with photofrin II on AH130 solid tumor. Pharmacokinetics, tissue distribution and sonodynamic antitumoral efficacy of photofrin II. Cancer Chemother Pharmacol, 51, 2003, pp. 174-178.
[14] Milowska, K., Gabryelak, T.: Synergistic effect of ultrasound and phthalocyanines on nucleated erythrocytes in vitro. Ultrasound Med Biol, 31, 2005, pp. 1707-1712.
[15] Kolarova, H., Bajgar, R., Tomankova, K., Krestyn, E., Dolezal, L., Halek, J.: In vitro study of reactive oxygen species production during photodynamic therapy in ultrasound-pretreated cancer cells. Physiol Res, 56Suppl 1), 2007, pp. S27-32.
[16] Kolarova, H., Tomankova, K., Bajgar, R., Kolar, P., Kubinek, R.: Photodynamic and sonodynamic treatment by phthalocyanine on cancer cell lines. Ultrasound Med Biol, 35, 2009, pp. 1397-1404.
[17] Wang, J., Guo, Y., Gao, J., Jin, X., Wang, Z., Wang, B., Li, K., Li, Y.: Detection and comparison of reactive oxygen species (ROS) generated by chlorophyllin metal (Fe, Mg and Cu) complexes under ultrasonic and visible-light irradiation. Ultrason Sonochem, 18, 2011, pp. 1028-1034.
[18] El-Sikhry, H.E., Miller, G.G., Madiyalakan, M.R., Seubert, J.M.: Sonodynamic and photodynamic mechanisms of action of the novel hypocrellin sonosensitizer, SL017: mitochondrial cell death is attenuated by 11, 12-epoxyeicosatrienoic acid. Invest New Drugs, 29, 2011, pp. 1328-1336.
Labels
Biomedicine
Article was published inThe Clinician and Technology Journal

2012 Issue 4-
All articles in this issue
- Úskalí termografického měření v medicíně
- Vliv poruch sondy sonografu na kvalitativní parametry ultrazvukového B-obrazu
- Vliv ultrazvuku na účinnost fotodynamické terapie – in vitro studie
- Fantom pro diagnostický ultrazvuk a dopplerovské vyšetření
- A performance tester of defibrillator accumulators for clinical purposes
- Methodology of thermographic atlas of the human body
- Home measurement of blood pressure: present problems and perspective improvements
- The Clinician and Technology Journal
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Úskalí termografického měření v medicíně
- Fantom pro diagnostický ultrazvuk a dopplerovské vyšetření
- Vliv poruch sondy sonografu na kvalitativní parametry ultrazvukového B-obrazu
- Vliv ultrazvuku na účinnost fotodynamické terapie – in vitro studie
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

