-
Medical journals
- Career
Akutní nekrotizující pankreatitida: klasické laparotomie vs. miniinvazivní postupy
Authors: R. Kostka; J. Havlůj
Authors‘ workplace: Chirurgická klinika 3. LF UK v Praze, přednosta: prof. MUDr. R. Gürlich, CSc.
Published in: Rozhl. Chir., 2015, roč. 94, č. 4, s. 160-165.
Category: Original articles
Overview
Úvod:
Léčba nekrotizující pankreatitidy se stále vyvíjí. Standardní léčebnou metodou infikované pankreatické nekrózy a následných septických komplikací je otevřená chirurgická drenáž. Rozvoj radiologických zobrazovacích metod a intervenční radiologie umožnily rozvoj miniinvazivních postupů, mezi něž patří cílené transkutánní punkce a drenáž pod CT/USG kontrolou (PCD), endoskopická transgastrická nekrektomie (ENE), laparoskopická transperitoneální nekrektomie (LNE) a retroperitoneální přístupy k pankreatické nekróze (RENE).Metody:
Do studie byli zahrnuti nemocní léčení s akutní pankreatitidou (AP) v letech 2002–2013 (n=932). Ve skupině s nekrotizující formou AP byly porovnány výsledky chirurgické léčby nemocných, léčených klasickou laparotomickou cestou (skupina A) s výsledky nemocných léčených miniinvazivními metodami (skupina B). Statisticky byly výsledky hodnoceny chi-kvadrát testem.Výsledky:
V uvedeném období bylo léčeno s lehkou formou AP 677 (72,6 %), s těžkou formou 255 (27,4 %) nemocných. Poměr mužů a žen byl 1,4 : 1. Ve skupině s těžkou formou nemoci bylo 171 léčeno konzervativně, letalita 16,4 % (28/171). Chirurgická léčba byla indikována u 84 nemocných, letalita 26,2 % (22/84). Laparotomickou cestou bylo operováno 52 nemocných (skupina A), mimiinvazivní výkony byly užity celkem u 32 nemocných (skupina B), u kterých bylo provedeno 37 výkonů. Úhrnná letalita ve skupině A byla 30,8 % (16/52) vs. 18,8 % (6/32) ve skupině B, p = 0,224. Průměrná doba hospitalizace byla delší u skupiny A (65,4 dne, median 52,4) oproti skupině B (49 dnů, median 36,5). Nejčastějším miniinvazivním výkonem byla PCD u 19 nemocných, 5 z nich zemřelo na pokračující sepsi a multiorgánové selhání a 2 museli být znovu operováni laparotomickou cestou. RENE byla provedena u 8 nemocných, z toho 5x z lumbotomie, ENE u 2 nemocných, 1 zemřel, a LNE byla provedena u jednoho nemocného. Fasciotomie v linea alba byla užita u 2 nemocných při intraabdominální hypertenzi.Závěr:
Standardní léčebnou metodou infikované pankreatické nekrózy je otevřená chirurgická drenáž. Miniinvazivní metody jsou vhodnou alternativou léčby zvláště u kriticky nemocných, s nižší mortalitou a morbiditou. Tyto metody musí respektovat zejména lokalizaci léze a individuální stav pacienta.Klíčová slova:
nekrotizující pankreatitida – nekrektomie – perkutánní drenáž – endoskopie − laparoskopieÚVOD
Léčba nekrotizující akutní pankreatitidy (AP) se stále vyvíjí. Intenzivní konzervativní léčba, s cílem prevence rozvoje orgánového selhávání, je metodou první volby u sterilní pankreatické nekrózy a je úspěšná u většiny nemocných. Infekce pankreatické nekrózy a septické komplikace, spojené s následným orgánovým selháváním, si v pozdější fázi onemocnění obvykle vyžádají chirurgickou intervenci. Tento koncept je všeobecně přijímán a infekce pankreatické nekrózy je absolutní indikací k chirurgické intervenci, bez níž se letalita nekrotizující AP pohybuje od 80–100 %. Kromě toho volná nebo již se ohraničující akutní peripankreatická kolekce, doprovázející často těžké formy AP, vede k neúměrnému zvyšování nitrobřišního tlaku s možným rozvojem abdominálního kompartment syndromu (AKS) se všemi negativními dopady na orgánovou perfuzi. Proto i AKS musí být zahrnut do konceptu léčby. Přesto otázka vhodné chirurgické techniky zůstávala po dlouhá desetiletí stále nejasná. Klasický laparotomický přístup představuje pro nemocného s infikovanou pankreatickou nekrózou ve fázi počínající nebo již rozvíjejí se sepse značnou zátěž, dvojnásobně až trojnásobně zvyšující letalitu. Prudký rozvoj zobrazovacích metod a intervenční radiologie užitím miniinvazivních metod revolučním způsobem ovlivnily léčbu nekrotizující pankreatitidy. Mezi tyto metody patří cílené transkutánní punkce pod CT/USG kontrolou, endoskopická transgastrická nekrektomie, laparoskopická transperitoneální nekrektomie a retroperitoneální přístupy k pankreatické nekróze.
METODY
Údaje byly získány prospektivním sledováním vybraných parametrů u nemocných s akutní pankreatitidou léčených v letech 2002–2013. Ve skupině nemocných s nekrotizující formou AP byly porovnány výsledky chirurgické léčby nemocných léčených klasickou laparotomickou cestou (skupina A) s výsledky nemocných léčených miniinvazivními metodami (skupina B). Statisticky byly výsledky hodnoceny chi-kvadrát testem.
VÝSLEDKY
V uvedeném období bylo léčeno 932 nemocných s akutní pankreatitidou, z toho s lehkou formou 677 (72,6 %), s těžkou formou 255 (27,4 %). Poměr mužů a žen byl 1,4 : 1. Ve skupině nemocných s těžkou formou AP bylo 171 nemocných léčeno konzervativně, 28 z nich zemřelo, letalita 16,4 % (28/171). Chirurgická léčba byla indikována u 84 nemocných, 22 z nich zemřelo, úhrnná letalita 26,2 % (22/84). Z 84 chirurgicky léčených nemocných bylo laparotomickou cestou (konvenční zavřená drenáž, otevřená drenáž s laparostomií, lavážní techniky) operováno 52 nemocných (skupina A), miniinvazivní postupy byly užity u 32 nemocných (skupina B), u kterých bylo provedeno celkem 37 výkonů (Tab. 1). Letalita ve skupině A byla 30,8 % (16/52) vs. 18,8 % (6/32) ve skupině B, p=0,224. Průměrná doba hospitalizace byla delší u skupiny A (65,4 dne, medián 52,4) oproti skupině B (49 dnů, medián 36,5). Nejčastějším miniinvazivním výkonem byla navigovaná perkutánní punkce a drenáž (PCD) ohraničené kolekce tekutiny, abscesu nebo infikované pseudocysty pod CT/USG (Obr. 1), provedená u 19 nemocných, 5 z nich zemřelo na pokračující septické komplikace a multiorgánové selhání a 2 museli být znovu operováni laparotomickou cestou. Retroperitoneální nekrektomie a drenáž byla provedena u 8 nemocných (Obr. 2a, 2b, 3a, 3b), z toho u 5 laterálním řezem z lumbotomie (Obr. 4), u 3 z nich bilaterálně, v této podskupině nikdo nezemřel. Transgastrický endoskopický přístup byl užit u 2 nemocných, z toho 1x neúspěšně s letálním koncem na sepsi a 1x byla drenáž kolekce volné tekutiny v peritoneu provedena laparoskopicky. K méně invazivním postupům patří i fasciotomie v linea alba (Obr. 5), užitá u 2 nemocných při intraabdominální hypertenzi.
Table 1. Miniinvazivní postupy u těžké akutní pankreatitidy (2002–2013) Tab. 1: Miniinvasive procedures in severe acute pancreatitis (2002−2013) 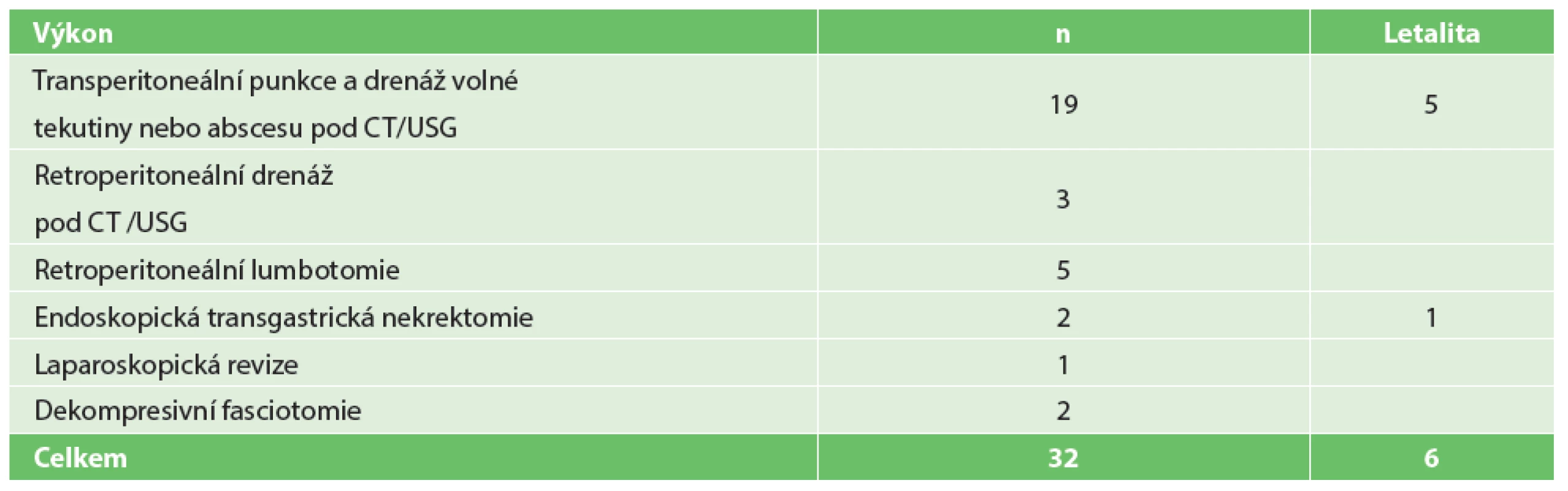
Image 1. Drén zavedený do kolekce infikované tekutiny vlevo od žaludku Fig. 1: Drain inserted into the fluid collection left-sided of the stomach 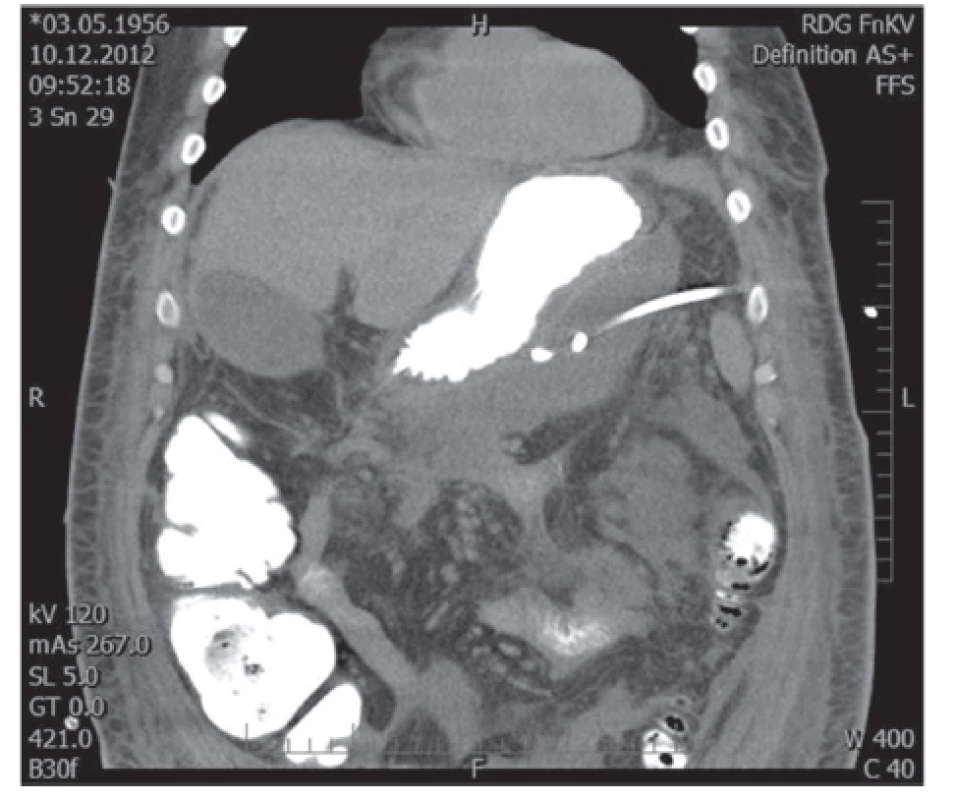
Image 2. a, 2b: Masivní kolekce tekutiny a nekrotické tkáně s bublinkami plynu v retroperitoneu Fig. 2a, 2b: Massive fluid collection and necrotic tissue with gas bubbles in retroperitoneum 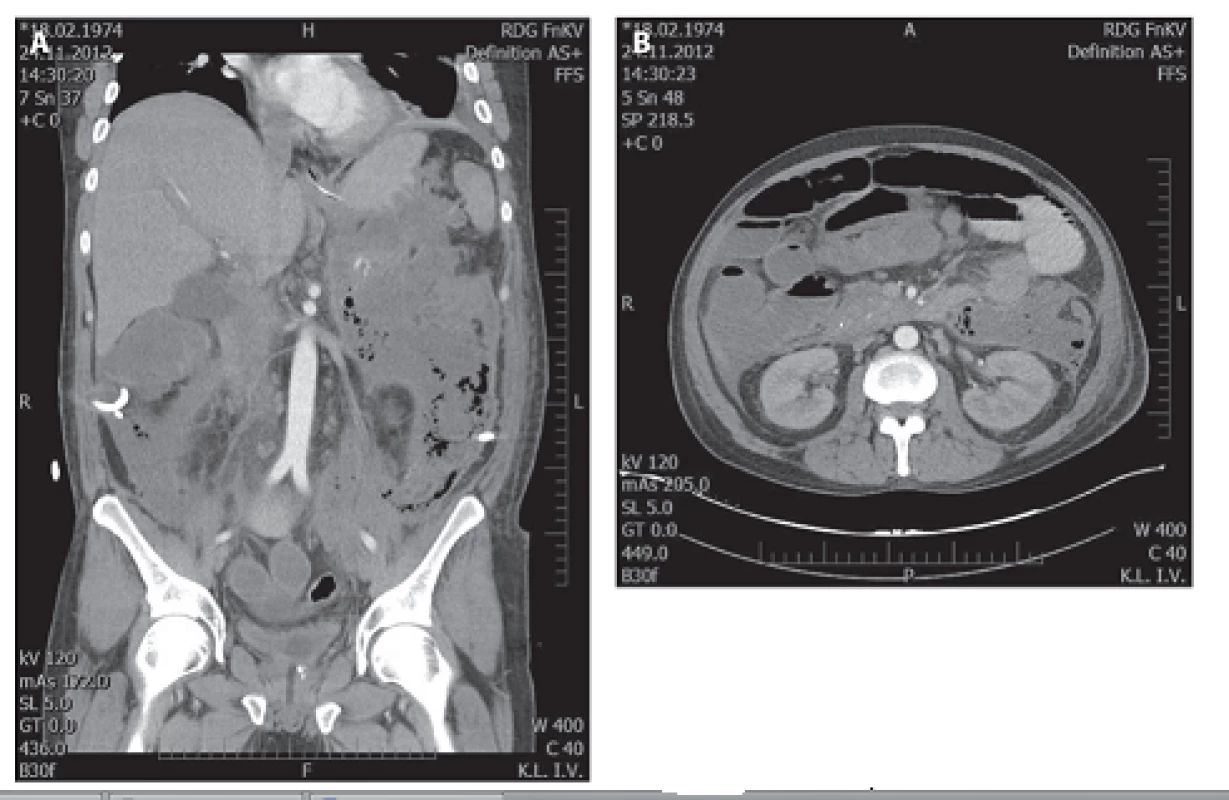
Image 3. Téměř úplná regrese nálezu v retroperitoneu 116. den po drenáži Fig. 3a, 3b: Fast complete regression of finding in retroperitoneum, day 116 after drainage 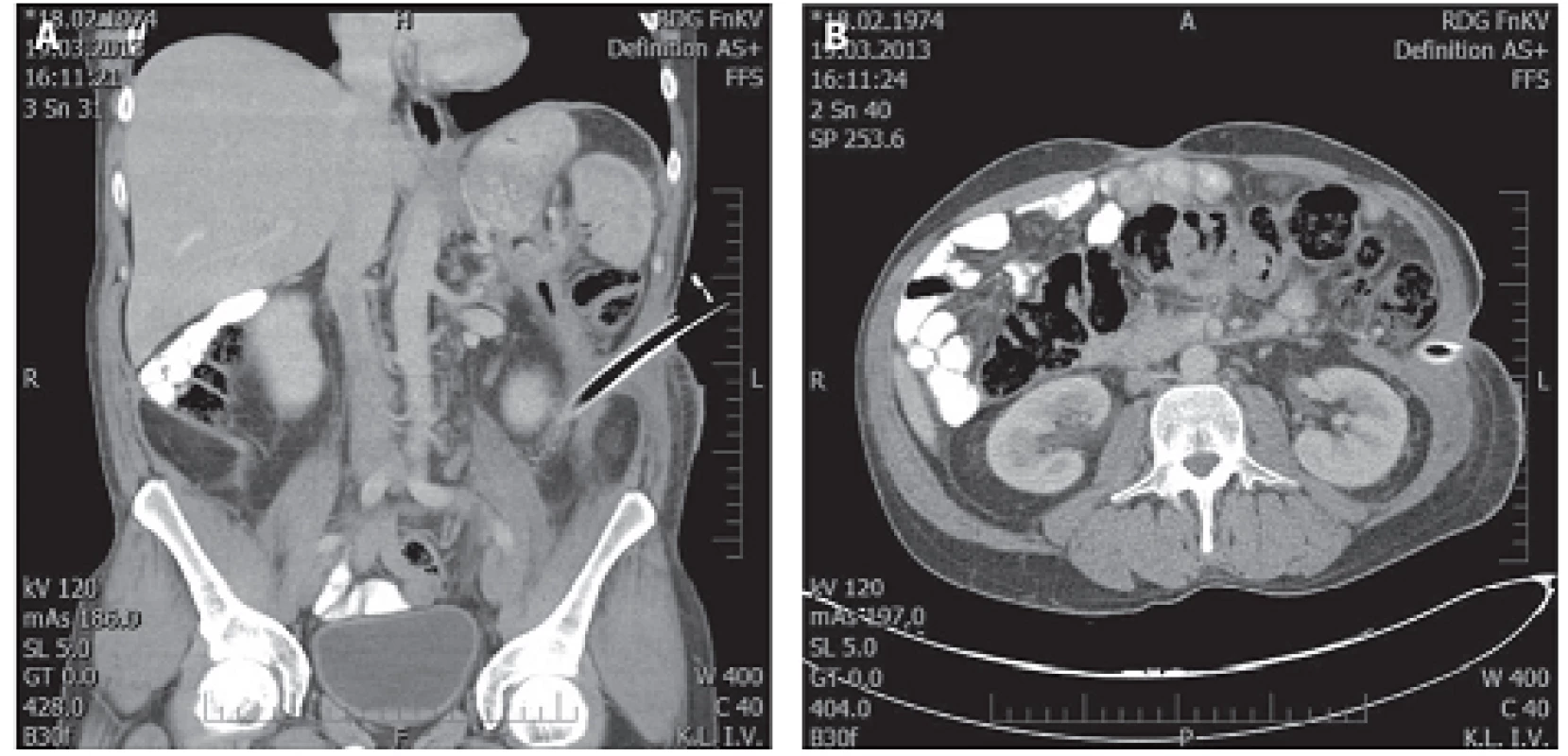
Image 4. Přístup do retroperitonea z lumbotomie Fig. 4: Access to the retroperitoneum via lumbotomy 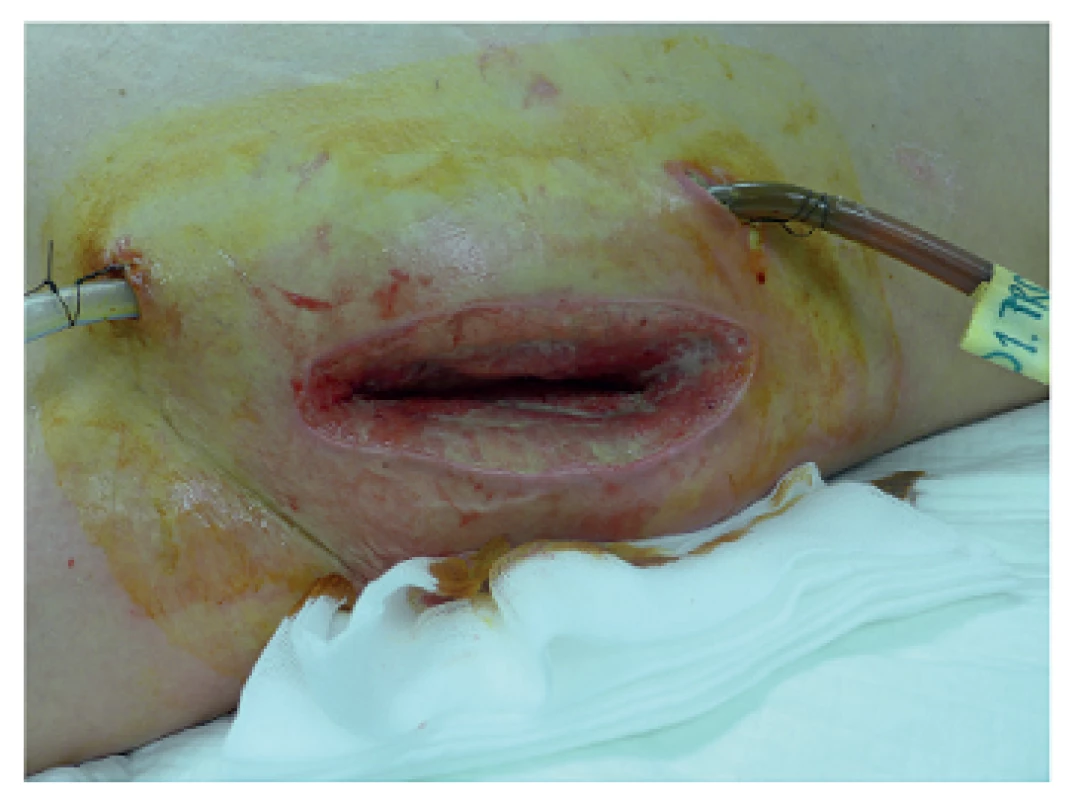
Image 5. Fasciotomie v linea alba při intraabdominální hypertenzi Fig. 5: Linea alba fasciotomy for abdominal compartment syndrome 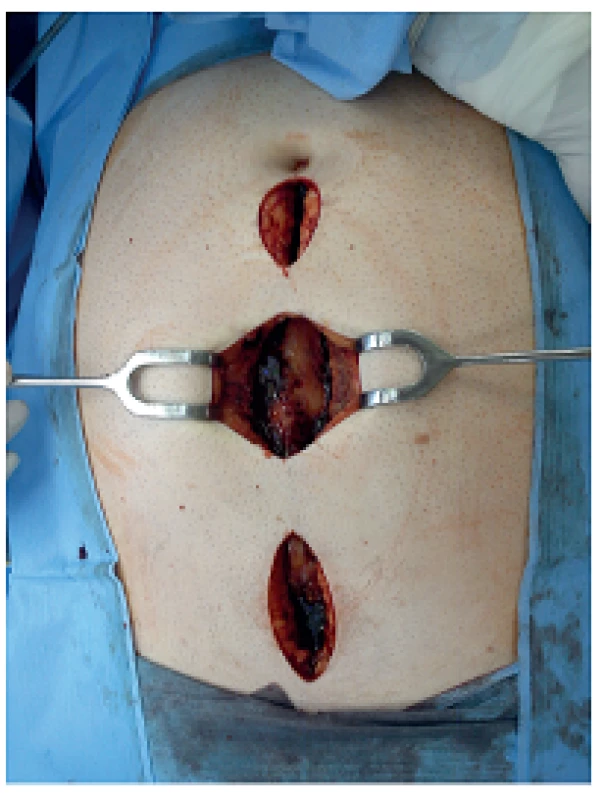
DISKUZE
Akutní pankreatitida je jedním z nejčastějších gastrointestinálních onemocnění, která vyžadují akutní hospitalizaci, s roční incidencí 13–45/100 000 obyvatel [1]. Zatímco lehká AP proběhne obvykle bez komplikací s letalitou pod 1 %, těžká AP je spojena s vysokou morbiditou a letalitou kolísající od 15–30 % [2]. V našem souboru dosáhla úhrnná letalita těžké AP 19,0 %. Nejvážnější komplikací těžké AP je infekce pankreatické nekrózy, ke které dochází v 30–70 % a klinicky se manifestuje obvykle ve 3.–4. týdnu trvání onemocnění. Riziko pankreatické infekce stoupá s rozsahem pankreatické nekrózy, takže u nekróz přesahujících 50 % plochy pankreatu se jich infikuje více než polovina [3,4]. Pokud není tato infekce léčena chirurgicky, letalita dosahuje až 100 % [5]. Klasické laparotomické přístupy představují pro pacienta s těžkou nekrotizující pankreatitidou značnou zátěž. Zhoršují již stávající střevní parézu, u zavřených postupů zvětšují intraabdominální tlak a jsou spojeny se značnou morbiditou a letalitou. Nemocní jsou často operováni již ve stadiu počínající nebo rozvíjejí se sepse a počínajícího orgánového selhávání, které zvyšují letalitu 2–3x [6]. Pooperační letalita v našem souboru A (operovaní laparotomickou cestou) 30,8 % odpovídá velkým souborům, kde se pohybuje od 11–39 % [7,8]. Výhodou klasické laparotomie je dokonalejší debridement ložiska a menší nároky na technické vybavení pracoviště. Výkon by měl být odložen pokud možno do 3.–4. týdne od začátku onemocnění, kdy dochází již k ohraničení nekróz [9], i když je již dostatečně známo, že odložení výkonu vede k prolongaci aplikace antibiotik s rizikem rozvoje kandidových infekcí [10]. Besseling a spol. (2007) doporučují chirurgický výkon až od 30. dne od začátku onemocnění [11], rovněž výsledky holandské studie z r. 2011 [12] potvrzují klesající letalitu u odložených výkonů (0.–14. den 56 %; 14.–29. den 26 %; >29. den 15 %). Recentní práce Kršky a spol. shrnující výsledky ve třech různých obdobích (1954–1999; 2002–2006; 2007–2011) potvrzuje trendy v chirurgické léčbě nekrotizující pankreatitidy laparotomickou technikou: klesající indikace k chirurgické léčbě (38 % vs. 16 %), odložení intervence do pozdější doby (z 8,9 dne do 22,5 dne) a pokles pooperační letality na 24 %, resp. 7,9 % ve třetím období [13].
Miniinvazivní výkony představují pro pacienta menší zátěž s malým vlivem na střevní peristaltiku a obvykle vedou i ke snížení intraabdominálního tlaku. Jejich nevýhodou je méně dokonalá jednorázová drenáž ložiska, nutnost opakovaných intervencí, větší procento komplikací (krvácení, perforace traktu) a větší nároky na technické vybavení pracoviště i zručnost intervenčního radiologa, ev. chirurga.
Minimálně invazivní techniky v léčbě AP se začaly rozvíjet od 80. let minulého století s rozvojem radiodiagnostiky a intervenční radiologie. Již v r. 1981 referovali Gerzof a spol. úspěšné užití techniky perkutánní drenáže v léčbě nitrobřišních abscesů [14]. Gagner v r. 1996 poprvé popsal 3 nové minimálně invazivní chirurgické techniky v léčbě nekrotizující AP: laparoskopickou retrokolickou nekrosektomii, retroperitoneoskopii a transgastrickou drenáž [15]. V následujících letech byly publikovány stovky studií, jejichž význam kriticky zhodnotili Bello a Matthews v r. 2012: po vyřazení studií s méně než 10 pacienty zařadili do své metaanalýzy 27 studií s 947 pacienty, popisující 4 základní miniinvazivní techniky: perkutánní drenáž (341 studií), endoskopickou nekrektomii (574 studií), laparoskopickou transperitoneální nekrektomii (148 studií) a retroperitoneální nekrektomii (194 studií). V závěru autoři zdůrazňují význam multidisplinárního přístupu radiologů, gastroenterologů, intenzivistů a chirurgů. Miniinvazivní přístup musí respektovat zejména lokalizaci léze a individuální stav pacienta [16].
Perkutánní drenáž (PCD) je nejčastější intervenční miniinvazivní technika, kterou umožnila především stále se zvyšující dostupnost CT a USG a technická dovednost radiologů, gastroenterologů a ev. i chirurgů. V r. 1998 Freeny a spol. referovali poprvé o sérii 34 nemocných s infikovanou pankreatickou nekrózou, která byla drénována CT navigovanými perkutánními katétry [17]. Nešlo pouze o pasivní drenáž, ale i o aktivní irigaci nekrotického materiálu zavedenými drény o průměru 28F. U 8 nemocných (24 %) v této sérii byl nutný chirurgický výkon ve smyslu „open surgery“ pro pokračující sepsi nebo krvácení. Letalita v tomto souboru byla 12 %. Technika PCD se dále rozvíjela užitím kontinuální laváže fyziologickým roztokem a manuální aspirací nekrotického materiálu [18] nebo užitím opakovaných laváží s odstraňováním nekróz zavedeným pevným košíkem [19]. Významným zjištěním bylo, že není nutné odstraňovat všechnu nekrotickou tkáň, se kterou si poradí imunní systém pacienta, ale kombinací drenáže, irigace a odsáváním odstranit infikovanou tekutinu [20]. Metaanalytická studie Baala a spol. zahrnula 384 pacientů v 11 studiích, v 56 % byla PCD dostačující pro vyléčení, úhrnná letalita 17 % [21]. Drenáž byla úspěšná v 75 % a jen 25 % nemocných si vyžádalo otevřenou intervenci. Holandská studie PANTER srovnává otevřenou nekrektomii (ONE) a tzv. „step-up“ přístup (perkutánní nebo endoskopická nekrektomie (ENE), následovaná minimálně invazivní retroperitoneální nekrektomií (RENE) u těch nemocných, u kterých nedošlo ke klinickému zlepšení). Letalita po ONE byla významně vyšší (69 %) oproti PCD a ENE (40 %) [22].
Endoskopická nekrektomie (ENE) je v recentní literatuře hojně popisovaná, ale jen 10 studií do roku 2012 splňuje kritéria Bello a Matthewse (více než 10 nemocných ve studii). U 274 nemocných z 352 (27 %) byla úspěšně provedena ENE, úhrnná letalita 5,6 %. Po lokalizaci ložiska via endoskopická USG následovala transmurální drenáž nejčastěji přes žaludek, následovaná dilatací a irigací nekrotického detritu, k odstranění nekróz byly užity bioptické kleště a košíčky. Průměrně byly nutné 3,2 procedury k dosažení rezoluce nekróz. Limitací všech endoskopických technik jsou časté komplikace, z nichž nejčastější jsou endoskopicky nekontrolovatelné krvácení, vzduchová embolie a nedostatečná drenáž zaváděnými stenty. Z dalších komplikací jsou uváděny horečka, punkce žlučníku, hypotenze, plicní embolie, hluboká žilní trombóza, peritonitida, Clostridium difficile kolitida, pneumoperitoneum, migrace stentu a střevní píštěl [16]. Úhrnná frekvence komplikací ve studii Bello a spol. dosáhla 28 %. Bausch a spol. [23] uvádějí recentně významně nižší počet sepsí po ENE (11 %) oproti ONE (73 %) a PCD (29 %) a významně nižší letalitu (6 % po ENE vs. 63 % po ONE a 21 % po PCD), ale vyšší počet specifických komplikací vyžadujících otevřený přístup (28 % po ENE vs. 21 % po PCD). Přímou endoskopickou nekrosektomii, popsanou Seewaldem v r. 2005 [24], při které se zavádí endoskop vytvořenou komunikací žaludkem přímo do ložiska, je možné užít úspěšně k drenáži dobře ohraničených ložisek pankreatické nekrózy nebo infikovaných pseudocyst. Ang a spol. takto uspěli u 7/8 pacientů [25].
Laparoskopická (transperitoneální)nekrektomie (LNE)
Dvě retrospektivní reprezentativní studie splňující kritéria dle Bello a spol. shrnují výsledky u 29 nemocných [26,27]. LNE byla úspěšná u 23 nemocných (79 %), u žádného si nevyžádala otevřenou nekrosektomii. Úhrnná letalita v obou studiích byla 10,3 % (3/29). Množství komplikací v Parekhově studii [26] bylo značné (58 %), mezi nejvážnější patřily infekce Clostridium difficile, pneudomonádová pneumonie a pankreatická píštěl. K drenáži retroperitonea byly užity 3 nebo 4 porty, přístup do retroperitonea buď inframesokolicky, nebo přes lig. gastrocolicum.
Retroperitoneální endoskopická nekrektomie (RENE)
Tři retrospektivní studie [28,29,30] a 2 prospektivní [31,32] sumarizují výsledky u 197 nemocných. RENE byla úspěšná v 88 % (173/197), letalita 17 % (33/197). Komplikace se vyskytly v 46 % (90/197), mezi nejvážnější patřily perforace žaludku a duodena, střevní a pankreatické píštěle, trombózy portální, slezinné a horní mezenterické žíly a reziduální abscesy. Přístup do retroperitonea je zajištěn obvykle krátkou lumbotomií (6 cm) pod 12. žebrem [28,30,31] s následnou tupou disekcí pro zavedení endoskopu a drenáže ložiska nebo CT navigovaným zavedením pigtailu 12F s následnou dilatací kanálu do 30F pro nefroskop a drenáž s irigací [29,32]. Zhao a spol. referuje o úspěšném užití techniky retroperitoneoskopie ze zadního translumbálního přístupu u 17 nemocných, pouze 1 z nich zemřel [33]. Recentně referují čínští autoři v r. 2013 v rozsáhlém souboru 412 pacientů statisticky významně nižší morbiditu i letalitu nemocných operovaných technikou RENE (108 nemocných, letalita 8,3 %) vs. ONE z laparotomie (304 nemocných, letalita 20,4 %, p=0,004) [34]. Úspěšné řešení infikované nekrózy, pseudocysty a abscesu v průběhu nekrotizující pankreatitidy kombinací miniinvazivních metod (perkutánní retroperitoneální drenáž, videoasistovaná endoskopická nekrektomie, USG navigovaná pseudocystogastrostomie a nasoabscesová drenáž via ERCP) publikovali recentně Doležalová a spol. [35].
Retroperitoneální lumbotomická nekrektomie (RLNE) bez užití endoskopu je sice pro nemocného více zatěžující než PCD nebo RENE, ale umožňuje jednorázový přístup k ložisku, důkladnou evakuaci septického ložiska s možností opakovaných laváží zavedenými drény. Do retroperitonea pronikáme laterálním řezem v prostoru mezi ledvinou a peritoneem, podle lokalizace ložiska zleva nebo zprava nebo oboustranně. Poté tupou disekcí pronikáme k ložisku s následnou evakuací hnisu, drenáží a laváží. Tento postup jsme zvolili u 5 nemocných v našem souboru, u všech ve stadiu pokročilé sepse, nikdo z nich nezemřel. Po odstranění drénů a sanaci ložiska v retroperitoneu dochází během několika týdnů ke spontánnímu uzávěru laterálních řezů.
Fasciotomie v linea alba je technicky jednoduchá a pacienta nezatěžující metoda u nemocných s intraabdominální hypertenzí (IAH) a hrozícím abdominálním kompartment syndromem (AKS). Na něm se podílí více složek: viscerální edém při masivní tekutinové resuscitaci, paralytický ileus a pankreatický ascites. Výsledkem je multiorgánové selhání, zejména kardiovaskulární, respirační a renální, projevující se především v časných stadiích nemoci. De Waelle a spol. udávají incidenci IAH u těžké AP 60–80 % a incidenci její klinické manifestace, tj. AKS kolem 27 % [36]. Pokud nejsou úspěšné konzervativní postupy (nazogastrická dekomprese, neuromuskulární blokátory, omezený přísun tekutin) a ani event. PCD ascitu, je indikována fasciotomie v linea alba jako metoda první volby. Leppäniemi a spol. takto uspěli u 6 z 10 nemocných, medián poklesu intraabdominálního tlaku byl 11 mmHg. U zbylých 4 nemocných byla nutná laparostomie v průběhu dalších 24 hodin [37].
ZÁVĚR
Standardní léčebnou metodou infikované pankreatické nekrózy je otevřená chirurgická drenáž. Miniinvazivní metody, které lze navzájem kombinovat, jsou vhodnou alternativou léčby zvláště u kriticky nemocných, s nižší letalitou a morbiditou. Aplikaci těchto metod umožnila přesná lokalizace léze pomocí CT. Volba nejvhodnější metody je vždy individuální a vyžaduje multidisciplinární přístup odborníků všech oborů, které se účastní léčby akutní nekrotizující pankreatitidy.
Seznam zkratek:
AKS – abdominal kompartment syndrom
PCD – perkutánní drenáž
MOS – multiorgánové selhání
ONE – otevřená nekrektomie
ENE – endoskopická nekrektomie
RENE – retroperitoneální endoskopická nekrektomie
LNE – laparoskopická nekrektomie
RLNE – retroperitoneální lumbotomická nekrektomie
IAH – intraabdominální hypertenze
Konflikt zájmů
Autoři článku prohlašují, že nejsou v souvislosti se vznikem tohoto článku ve střetu zájmů a že tento článek nebyl publikován v žádném jiném časopise.
Doc. MUDr. Rodomil Kostka, CSc.
Chirurgická klinika 3. LF UK a FNKV
Šrobárova 50
100 34 Praha 10
e-mail: rodomilkostka@gmail.com
Sources
1. Yadav D, Lowenfels AB. The epidemiology of pancreatitis and pancreatic cancer. Gastroenterology 2013;144 : 1252−61.
2. Karakayali FY. Surgical and interventional management of complications caused by acute pancreatitis. World J Gastroenterol 2014; 20 : 13412−23.
3. Rau B, Uhl W, Büchler MV, et al. Surgical treatment of infected necrosis. World J Surg 1997;21 : 155−61.
4. Isenmann R, Rau B, Beger HG. Bacterial infection and extent of necrosis are determinants of organ failure in patients with acute necrotizing pancreatitis. Br J Surg 1999;86 : 1020−4.
5. Gooszen HG, Besselink MG, van Santvoort HC, et al. Surgical treatment of acute pancreatitis. Langenbecks Arch Surg 2013;398 : 799−806.
6. Amano H, Takada T, Isaji S, et al. Therapeutic intervention and surgery of acute pancreatitis. J Hepatobiliary Pancreat Sci 2010;17 : 53−9.
7. Nieuwenhuijs VB, Besselink MG, van Minnen LP, et al. Surgical management of acute necrotizing pancreatitis: a 13-year experience and a systematic review. Scand J Gastroenterol Suppl 2003;239 : 111−6.
8. Rau B, Bothe A, Beger HG. Surgical treatment of necrotizing pancreatitis by necrosectomy and closed lavage: changing patient characteristics and outcome in a 19-year, single-center series. Surgery 2005;138 : 28−39.
9. Uhl W, Warshaw A, Imrie C, et al. IAP guidelines for the surgical management of acute pancreatitis. Pancreatology 2002; 2 : 565−73.
10. de Waele JJ, Vogelaers D, Blot S, et al. Fungal infections in patients with severe acute pancreatitis and the use of prophylactic therapy. Clinical Infectious Diseases 2003;37 : 208−13.
11. Besselink MGH, Verwer TJ, Schoenmaeckers EJP, et al. Timing of surgical intervention in necrotizing pancreatitis. Archives of Surgery 2007;142 : 1194−1201.
12. van Santvoort HC, Bakker OJ, Bollen TL, et al. A conservative and minimally invasive approach to necrotizing pancreatitis improves outcome. Gastroenterology 2011;141 : 1254−63.
13. Krška Z, Šváb J. Posuny v chirurgii pankreatu na 1. chirurgické klinice 1. LF UK a VFN. Rozhl Chir 2012;91 : 262−6.
14. Gerzof S, Robbins A, Johnson W, et al. Percutaneous catheter drainage of abdominal abscesses. N Engl J Med 1981;305 : 653−7.
15. Gagner M. Laparoscopic treatment of acute necrotizing pancreatitis. Semin Laparosc Surg 1996;3 : 21−28.
16. Bello B, Matthews JB. Minimally invasive treatment of pancreatic necrosis. World J Gastroenterol 2012;18 : 6829−35.
17. Freeny P, Hauptmann E, Althaus S, et al. Percutaneous CT-guided catheter drainage of infected acute necrotizing pancreatitis: techniques and results. Am J Roentgenol 1998;170 : 969−75.
18. Gmeinwieser J, Feuerbach S, Zirngibl H, et al. Percutaneous treatment of infected necrotizing pancreatitis. Eur IHPBA 1997;23 : 575−8.
19. Echenique A, Sleeman D, Yrizarry J, et al. Percutaneous catheter-directed debridement of infected pancreatic necrosis: results in 20 patients. J Vasc Intervent Radiol 1998;9 : 565−71.
20. Besselink MG, van Santvoort HC, Nieuwenhuijs VB. Minimally invasive ‚step-up approach‘ versus maximal necrosectomy in patients with acute necrotising pancreatitis (PANTER trial): design and rationale of a randomised controlled multicenter trial. BMC Surg 2006;11 : 6.
21. van Baal MC, van Santvoort HC, Bollen TL, et al. Systematic review of percutaneous catheter drainage as primary treatment for necrotizing pancreatitis. Br J Surg 2011;98 : 18−27.
22. van Santvoort HC, Besselink MG, Bakker OJ, et al. A step-up approach or open necrosectomy for necrotizing pancreatitis. N Engl J Med 2010;362 : 1491−1502.
23. Bausch D, Wellner U, Kahl S, et al. Minimally invasive operations for acute necrotizing pancreatitis comparison of minimally invasive retroperitoneal necrosectomy with endoscopic transgastric necrosectomy. Surgery 2012;152 Suppl. 1 : 128−34.
24. Seewald S, Groth S, Omar S, et al. Aggressive endoscopic therapy for pancreatic necrosis and pancreatic abscess: a new safe and effective treatment algorithm (videos). Gastrointest Endosc 2005; 62 : 92−100.
25. Ang TL, Kwek AB, Tan SS, et al. Direct endoscopic necrosectomy: a minimally invasive endoscopic technique for the treatment of infected walled-off pancreatic necrosis and infected pseudocysts with solid debris. Singapore Med J 2013;54 : 206−11.
26. Parekh D. Laparoscopic-assisted pancreatic necrosectomy: A new surgical option for treatment of severe necrotizing pancreatitis. Arch Surg 2006;141 : 895−902; discussion 902−3.
27. Zhu JF, Fan XH, Zhang XH. Laparoscopic treatment of severe acute pancreatitis. Surg Endosc 2001;15 : 146−8.
28. Gambiez LP, Denimal FA, Porte HL, et al. Retroperitoneal approach and endoscopic management of peripancreatic necrosis collections. Arch Surg 1998;133 : 66−72.
29. Raraty MG, Halloran CM, Dodd S, et al. Minimal access retroperitoneal pancreatic necrosectomy: improvement in morbidity and mortality with a less invasive approach. Ann Surg 2010;251 : 787−93.
30. Chang YC, Tsai HM, Lin XZ, et al. No debridement is necessary for symptomatic or infected acute necrotizing pancreatitis: delayed, mini-retroperitoneal drainage for acute necrotizing pancreatitis without debridement and irrigation. Dig Dis Sci 2006;51 : 1388−95.
31. Castellanos G, Piñero A, Serrano A, et al. Translumbar retroperitoneal endoscopy: an alternative in the follow-up and management of drained infected pancreatic necrosis. Arch Surg 2005;140 : 952−5.
32. Carter CR, McKay CJ, Imrie CW. Percutaneous necrosectomy and sinus tract endoscopy in the management of infected pancreatic necrosis: an initial experience. Ann Surg 2000;232 : 175−80.
33. Zhao G, Hu M, Liu R, et al. Retroperitoneoscopic anatomical necrosectomy: A modified single-stage video-assisted retroperitoneal approach for treatment of infected necrotizing pancreatitis. Surg Innov 2014; 14. pii: 1553350614552732. [Epub ahead of print]
34. Guo Q, Lu H, Hu W, Zhang Z. A retroperitoneal approach for infected pancreatic necrosis. Scand J Gastroenterol 2013;48 : 225−30.
35. Doležalová L, Volšanský P, Neumann F, et al. Těžká akutní pankreatitida – řešení komplikací kombinací miniinvazivních přístupů. Rozhl Chir 2014;93 : 216−9.
36. De Waele JJ, Leppäniemi AK. Intra-abdominal hypertension in acute pancreatitis. World J Surg 2009;33 : 1128−33.
37. Leppäniemi A, Hienonen P, Mentula P, et al. Subcutaneous linea alba fasciotomy, does it really work? Am Surg 2011;77 : 99−102.
Labels
Surgery Orthopaedics Trauma surgery
Article was published inPerspectives in Surgery

2015 Issue 4-
All articles in this issue
- Jak dál v zajištění péče o závažná poranění?
- Historie a současnost rekonstrukce palce ruky
- Operace tříselné kýly technikou ONSTEP
- Peroperační detekce sentinelové uzliny při resekci pro karcinom kolon – předběžné výsledky
- Akutní nekrotizující pankreatitida: klasické laparotomie vs. miniinvazivní postupy
- Maligní mezoteliom v peritoneální dutině – kazuistika
- Masivní krvácení do tenkého střeva: CT-angiografie a chirurgické řešení – kazuistika
- Karcinom sigmoidea v těhotenství – kazuistika
- Perspectives in Surgery
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Operace tříselné kýly technikou ONSTEP
- Masivní krvácení do tenkého střeva: CT-angiografie a chirurgické řešení – kazuistika
- Historie a současnost rekonstrukce palce ruky
- Akutní nekrotizující pankreatitida: klasické laparotomie vs. miniinvazivní postupy
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

