-
Medical journals
- Career
Solitárny fibrózny tumor príušnej slinnej žľazy
Authors: K. Macháleková 1; T. Feltsan 2; M. Polakovič 3; P. Šuráň 1; C. Bíró 1; Ľ. Malíček 2; K. Kajo 1
Authors‘ workplace: Ústav patológie, Onkologický ústav sv. Alžbety, s. r. o., Bratislava 1; Klinika stomatológie a maxilofaciálnej chirurgie, LF UK a Onkologický ústav sv. Alžbety, s. r. o., Bratislava 2; II. Rádiologická klinika LF UK a Onkologický ústav sv. Alžbety, s. r. o., Bratislava 3
Published in: Otorinolaryngol Foniatr, 68, 2019, No. 2, pp. 118-122.
Category: Case Reports
Overview
Solitárny fibrózny tumor (SFT) je zriedkavý mezenchýmový tumor, ktorý sa extrémne zriedkavo môže vyskytovať aj v príušnej slinnej žľaze. Autori v predkladanej práci opisujú prípad 39-ročného muža s jasne ohraničeným a nebolestivým tumorom v oblasti uhla ľavej sánky, o veľkosti 4x3cm, ktorý bol na základe histomorfologických charakteristík doplnených imunohistochemickým dôkazom markerov CD34, bcl-2 a CD99 diagnostikovaný ako SFT. Vzhľadom na nález niektorých atypických čŕt bol klasifikovaný ako tumor s nejasným biologickým potenciálom. V diskusii sú konfrontované zaznamenané klinické a histomorfologické charakteristiky lézie, diferenciálne diagnostické okruhy, prognostické aspekty a terapeutické možnosti s doteraz známymi literárnymi údajmi o SFT v príušnej slinnej žľaze.
Klíčová slova:
solitárny fibrózny tumor – príušná slinná žľaza – imunohistochémia
ÚVOD
Solitárny fibrózny tumor (SFT) je zriedkavý mezenchýmový nádor, ktorý bol pôvodne opísaný v pleure (2, 5, 8). Neskôr bol SFT zaznamenaný aj v niektorých extrapleurálnych orgánových lokalitách, ako sú končatiny, oblasť hlavy a krku, brušná dutina, panva, retroperitoneum a viscerálne orgány (6, 15). Jednou z raritných oblastí jeho výskytu je aj príušná slinná žľaza, v ktorej bolo doteraz opísaných približne 40 prípadov SFT, a to len vo forme kazuistík a menších súborov (7, 11). V práci opisujeme ďalší prípad výskytu SFT v príušnej slinnej žľaze s uvedením jeho klinického priebehu a s jeho morfologickými črtami v zobrazovacích technikách a histologickom obraze, pričom porovnávame tieto charakteristiky s údajmi získanými z literárneho prehľadu tohto vzácneho nádoru príušnej slinnej žľazy.
KAZUISTIKA
Opisujeme prípad 39-ročného, ktorý asi tri mesiace pozoroval pomaly rastúcu a nebolestivú hrčku lokalizovanú v oblasti uhla ľavej sánky. Palpačne išlo o tuho-elastickú tumoróznu rezistenciu o veľkosti 4x3 cm, guľovitého tvaru, bez fixácie ku kožnému krytu a slabo pohyblivú voči spodine. Počas vyšetrenia pomocou magnetickej rezonancie (MRI) sa zobrazila dobre ohraničená expanzia laločnatých kontúr, dosahujúca veľkosť 3 cm, ktorá bola lokalizovaná v tkanive ľavej príušnej slinnej žľazy (obr. 1), pričom väčšia časť nádoru sa nachádzala v zadnej povrchovej časti žľazy a len okrajovo zasahovala do jej hlbších partií. V MRI bol nádor T2 mierne nehomogénne hyperintenzívny, T1 homogénne hypointenzívny a po podaní kontrastnej látky sa zreteľne homogénne sýtil. Lézia sa voči okoliu správala expanzívne, mala naznačenú kapsulu a bola bez centrálnej nekrózy a známok propagácie mimo slinnú žľazu. Vzhľadom na benígny klinický priebeh, lokalizáciu v glandula parotis a výsledok MRI vyšetrenia, nebola indikovaná tenkoihlová biopsia a u pacienta bola v celkovej anestézii vykonaná konzervatívna ľavostranná parotidektómia. K bioptickému vyšetreniu bolo zaslané tkanivo slinnej žľazy, v ktorom sa po narezaní nachádzal ostro ohraničený nodulárny tumor veľkosti 4x3 x3 cm a tuho-elastickej konzistencie. Makroskopicky bolo tkanivo nádoru solídneho charakteru, šedo-belavej farby a bolo bez regresívnych zmien. V histologických preparátoch sa zobrazoval miestami okapsulovaný tumor s jasnými hranicami voči štruktúram seróznej slinnej žľazy, ktoré boli zachytené na periférii analyzovaných vzoriek (obr. 2). Nádor bol relatívne celulárny, tvorený predominantne vretenobunkovou populáciou rastúcou v necharakteristických vzoroch, len s naznačeným fascikulárnym a miestami storiformným usporiadaním (obr. 3). V prevažnej časti nádoru bunky vykazovali len mierne atypické črty a mitotická aktivita nepresahovala 3 mitózy na 10 veľkých zorných polí (HPF), ložiskovo však celulárna atypia dosiahla až stredný stupeň a mitotická aktivita bola vyššia ako 4 mitózy na 10 HPF. V stróme nádoru bol pomerne nápadný nález početných hyalínnych štruktúr pripomínajúcich keloid (obr. 4), ako aj výskyt perivaskulárnych hyalínnych depozít a typických „parohovite“ sa vetviacich ciev (obr. 5). V nádore neboli zachytené nekrózy ani krvácania a nebola dokázaná invázia do okolitých tkanivových štruktúr. Periférne zachytený parenchým seróznej slinnej žľazy vykazoval iba známky miernej tukovej atrofie. Imunohistochemicky boli nádorové bunky pozitívne pri dôkaze vimentínu, CD34 (obr. 6), CD99 a bcl2 a fokálne vykazovali expresiu hladko-svalového aktínu. Jednoznačne boli negatívne pri dôkaze S100 proteínu, široko-spektrálnych (AE/AE3) aj tkanivovo-špecifických cytokeratínov (CK7, CK20), CD117 a CD31. Celková proliferačná aktivita nádoru hodnotená Ki-67 indexom dosahovala max. 5 % pozitívnych buniek. Na základe histomorfologických charakteristík podporených imunohistochemickým profilom bol nádor diagnostikovaný ako SFT príušnej slinnej žľazy.
Image 1. MRI – šípkami je označený dobre ohraničený nádor s homogénnym post-kontrastným sýtením, lokalizovaný v povrchovej časti ľavej príušnej slinnej žľazy. 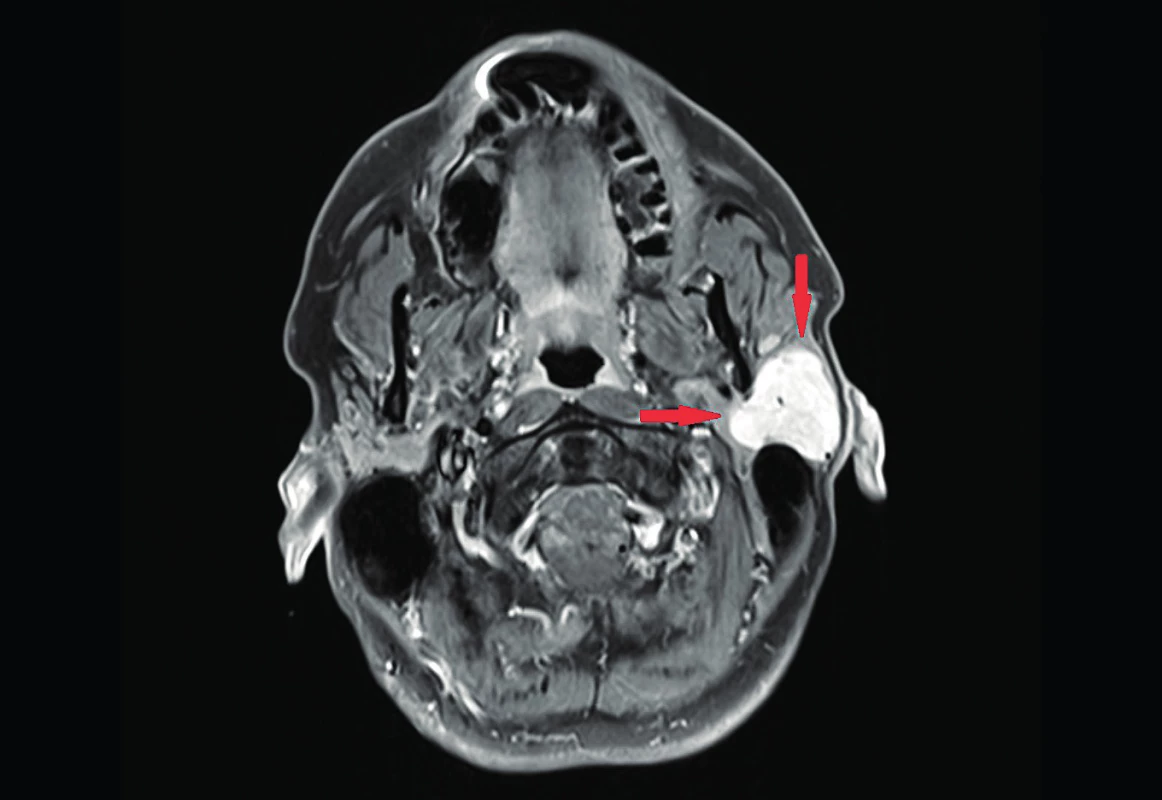
Image 2. Okapsulovaný tumor v parenchýme seróznej slinnej žľazy, ktorý bol zachytený na periférii vzoriek (vpravo dolu) (farbenie hematoxylín a eozín, zväčšenie 40x). 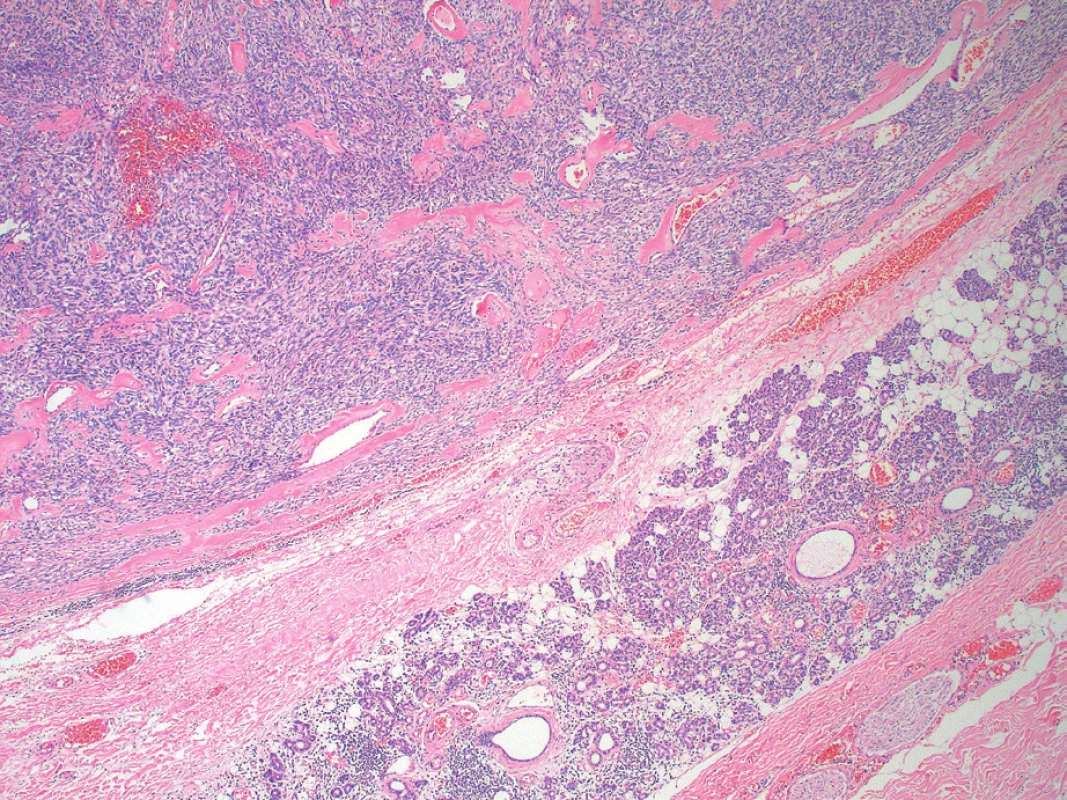
Image 3. Histomorfologický charakter lézie s oválnymi a vretenovitými bunkami usporiadanými v storiformných vzoroch (farbenie hematoxylín a eozín, zväčšenie 200x). 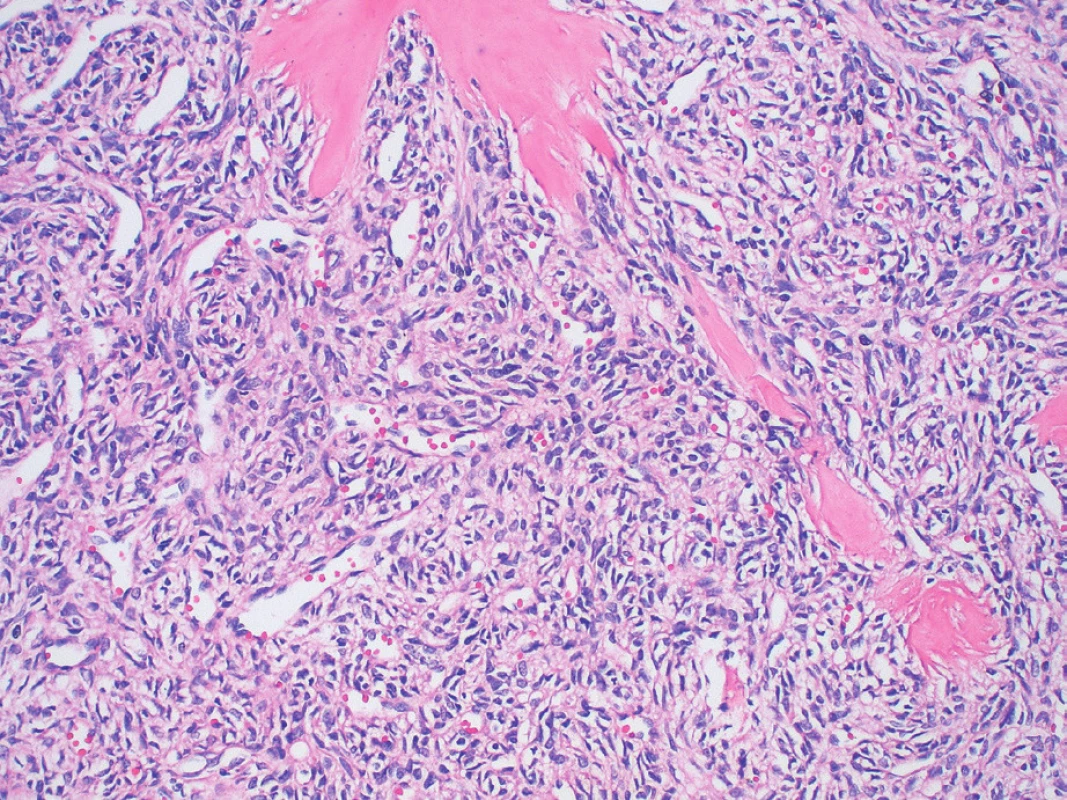
Image 4. Nález stromálnych hyalínnych štruktúr pripomínajúcich keloid (farbenie hematoxylín a eozín, zväčšenie 400x). 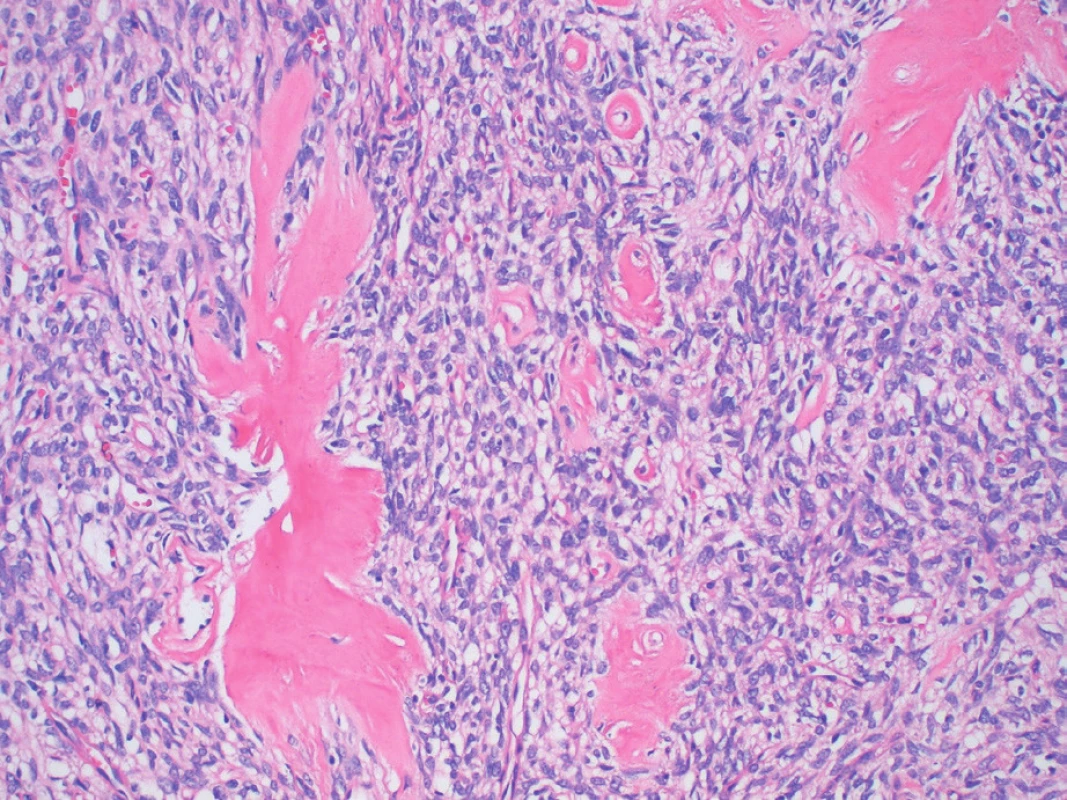
Image 5. Výskyt perivaskulárnych hyalínnych depozít a typických „parohovite“ sa vetviacich ciev (farbenie hematoxylín a eozín, zväčšenie 100x). 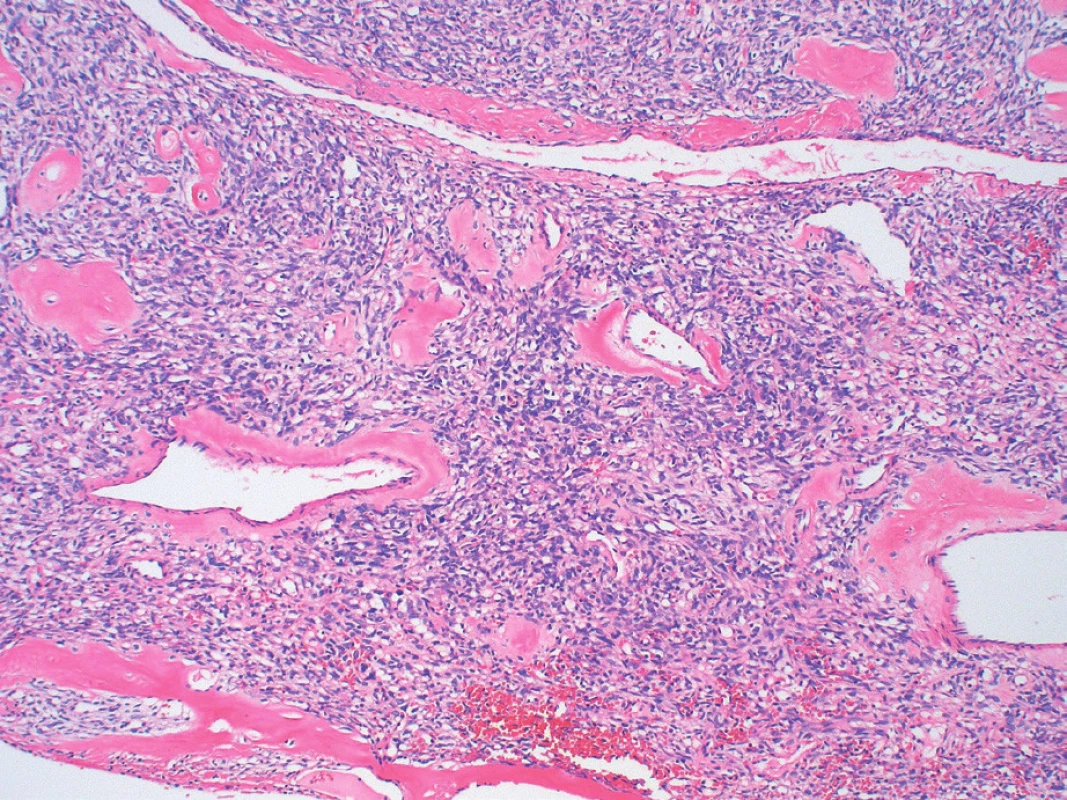
Image 6. Imunohistochemický dôkaz expresie CD34 (zväčšenie 100x). 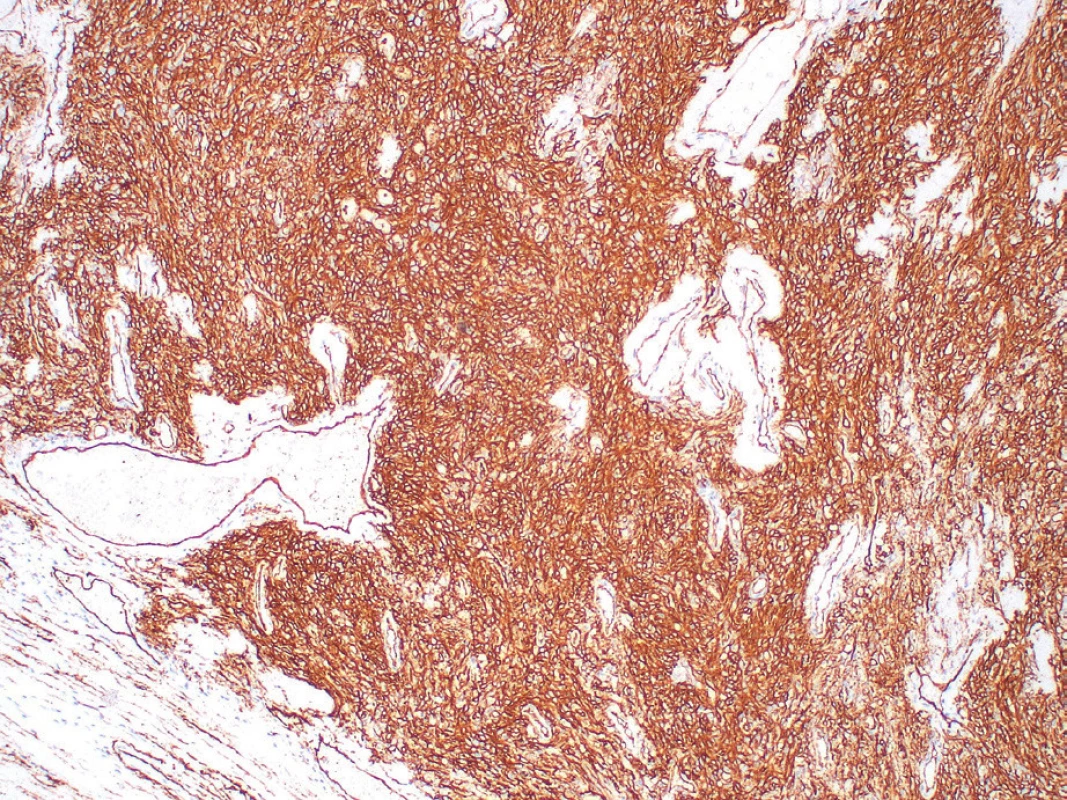
Image 7. Oblasť nádoru so strednou atypiou nádorových buniek a zachytenou mitotickou figúrou (v strede obrázka) (farbenie hematoxylín a eozín, zväčšenie 400x). 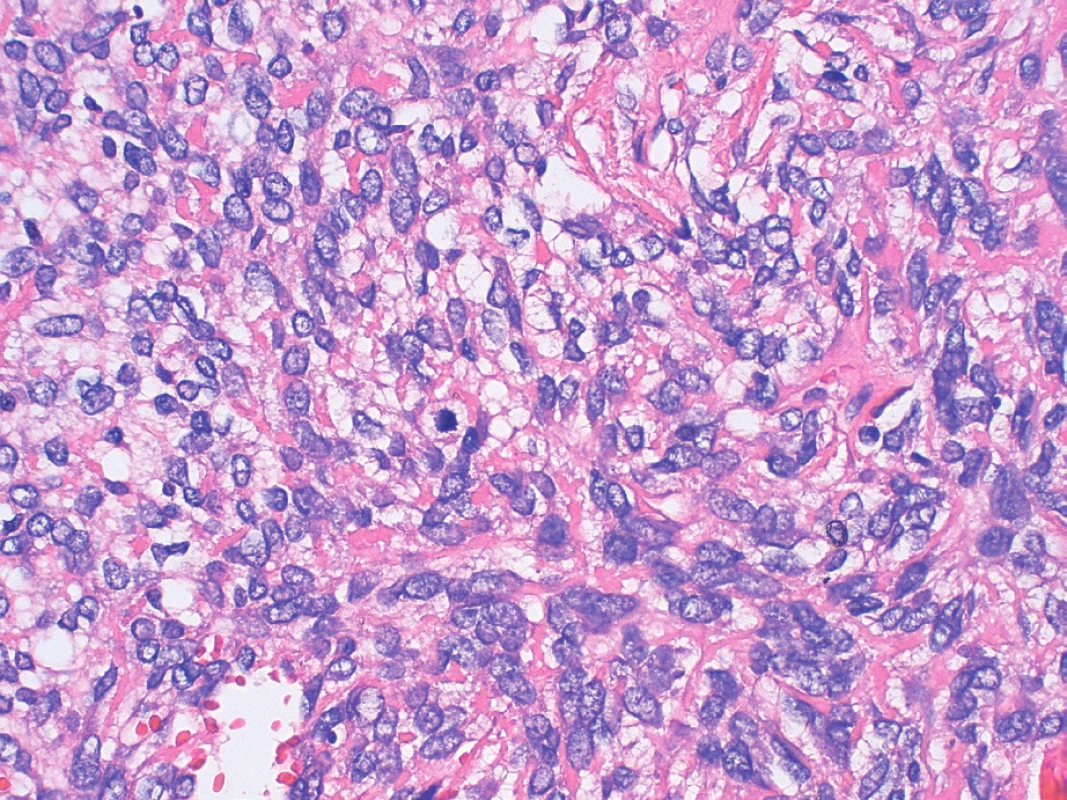
DISKUSIA
Solitárny fibrózny tumor je mezenchýmová neoplazma fibroblastického pôvodu s charakteristickou účasťou prominentnej parohovite sa vetviacej cievnej siete („haemangiopericytoma-like vessels“) (6). Aj keď prvá zmienka o SFT je v oblasti pleury a pochádza od Wagnera z roku 1870, prvý histopatologický opis tohto nádoru zaznamenali Klemperer s Rabinom až v roku 1931 (5). Neskôr bol tento typ nádoru okrem pleury identifikovaný aj v iných lokalizáciách tela a v takmer každom orgáne, čím sa jeho výskyt stal ubikvitárny (6). V oblasti hlavy a krku predstavuje tento nádor približne 6 % všetkých SFT, alebo jednu štvrtinu všetkých tzv. extrapleurálnych SFT, ktoré tvoria približne jednu štvrtinu všetkých SFT (11). V príušnej slinnej žľaze bolo doteraz publikovaných 30 prípadov tohto nádoru (7) a súbor ďalších 10 prípadov bol v tejto lokalite nedávno zaznamenaný v rámci veľkej multi-inštitucionálnej štúdie analyzujúcej SFT v oblasti hlavy a krku (11). V staršej literatúre dochádzalo k určitej terminologickej konfúzii, nakoľko sa často termín SFT zamieňal s inou neoplastickou entitou, tzv. hemangiopericytómom, a to v dôsledku ich morfologickej podobnosti a nepresne definovaných morfologických hraníc. V novej, 4. edícii klasifikácie nádorov mäkkých tkanív Svetovej zdravotníckej organizácie, sa oba pojmy (SFT a hemangiopericytóm) zjednotili do jednej entity označenej ako extrapleurálny SFT (3). Z hľadiska histologickej skladby sa SFT najčastejšie prezentuje ako klasický typ, ale známe sú aj celulárne, epiteloidné a lipomatózne formy SFT. Navyše sa tieto nádory môžu prezentovať aj myxoidnými alebo cystickými zmenami (3, 11). Etiopatogenéza SFT nie je známa, ale na základe imunohistochemických a ultraštrukturálnych analýz sa potvrdilo, že SFT je najskôr derivovaný z adultných mezenchýmových kmeňových buniek (9). Klinický obraz SFT slinnej žľazy je necharakteristický, obvykle ide o hmatný, nebolestivý a pomaly rastúci nádor postihujúci pacientov v stredných vekových kategóriách, bez predominancie pohlavia, s celkom ojedinelým výskytom u detí a adolescentov (1). V prípade propagácie nádoru do okolia sa môže prezentovať symptómami kompresie priľahlých štruktúr, ako to bolo opísané v jednom prípade so šírením do parafaryngeálneho priestoru (10). V predoperačnej diagnostike môže byť využité vyšetrenie pomocou MRI, kde je nález relatívne nešpecifický. SFT v MRI je spojený s hypointenzitou v T1-vážených obrazoch a hyperintenzitou v T2-vážených obrazoch (14). V predoperačnej diagnostike je možné využiť aj tenkoihlovú aspiračnú biopsiu, avšak výsledky tohto vyšetrenia pri diagnóze SFT sú veľmi otázne, obvykle je možné nález hodnotiť len na úrovni bližšie nešpecifikovanej vretenobunkovej neoplázie (1). Exaktná diagnostika SFT je zatiaľ možná len na základe bioptického vyšetrenia nádorového tkaniva, ktoré obsahuje komplexné zhodnotenie histomorfologických charakteristík lézií, doplnených imunohistochemickou analýzou špecifických markerov. Makroskopicky ide väčšinou o dobre ohraničené parciálne opúzdrené nádory, veľkosti od 1 - 25 cm, ktoré sú na rezoch často multinodulárne, bielej farby a tuhšej konzistencie. V prípade agresívnejších nádorov sa môže objaviť aj nekróza a známky infiltratívneho rastu (3). Histologicky je nádor tvorený monotónnou vreteno - a oválne bunkovou populáciou s variabilnou celularitou v rámci jedného tumoru, obsahuje striedajúce sa hypo - a hypercelulárne okrsky a vyznačuje sa prominentnou typickou „parohovite“ sa vetviacou vaskulatúrou s nápadnou účasťou stromálneho kolagénu. Nádor je bez tvorby patognomických architektonických vzorov. Mitotická aktivita zvyčajne nepresahuje 3 mitózy na 10 HPF. Niektoré SFT môžu obsahovať zrelé tukové bunky, alebo obrovské viacjadrové stromálne bunky, čím dochádza k morfologickému prekrývaniu sa s tzv. lipomatóznym hemangiopericytómom a obrovskobunkovým angiofibrómom (3). Na definitívne potvrdenie diagnózy SFT sa využíva imunohistochemický dôkaz CD34, čo je antigén hematopoetických progenitorových buniek. Obvykle je jeho expresia v nádore silná a difúzna, ale stupeň expresie môže klesať, alebo sa úplne strácať v malígnych, resp. dediferencovaných formách SFT (4). Z ostatných novších markerov sa niekedy, najmä v nejasných prípadoch, využíva aj dôkaz STAT6 (6).
Z hľadiska novších molekulovo genetických poznatkov bolo zaznamenané rekurentné intrachromozómové znovu-usporiadanie (12 q), ktoré vyúsťuje do fúzie NAB2-STAT6. Túto alteráciu je možné dokázať pomocou RT-PCR (6, 12). Diferenciálne diagnosticky v rámci bioptickej diagnostiky pripadajú do úvahy najmä kožný hlboký benígny fibrózny histiocytóm a protuberujúci dermatofibrosarkóm, ktoré majú súvis s kožou a navyše vykazujú mikroarchitektonické, príp. pri dermatofibrosarcoma protuberans aj proliferačné odlišnosti. Z ďalších možných nádorov imitujúcich SFT sú zastúpené hlavne monofázický synoviálny sarkóm a nádory z buniek pošiev periférnych nervov, ktoré majú však relatívne charakteristické mikroarchitektonické črty a sú spojené s negatívnym dôkazom CD34, prípadne sa vyznačujú expresiou S100 proteínu, ako je to najmä u nádorov z pošiev periférnych nervov (3). Najproblematickejšie odlíšiteľným v rámci diferenciálnej diagnostiky je vretenobunkový lipóm, ktorý má so SFT prekrývajúce sa morfologické črty a vykazuje taktiež expresiu CD34, no na rozdiel od SFT je spojený s negativitou STAT6 (6). V rámci širšieho diferenciačne diagnostického spektra v lokalizácii príušnej slinnej žľazy je potrebné vylúčiť aj vretenobunkové formy karcinómov a celulárny variant pleomorfného adenómu, pre ktoré sú charakteristické expresie cytokeratínov a EMA vzhľadom na ich epitelový histogenetický pôvod (7). Liečba SFT spočíva v kompletnej chirurgickej resekcii nádoru s negatívnymi okrajmi potvrdenými histologickým vyšetrením (1). Pri nádoroch, ktoré nie je možné kompletne extirpovať, alebo ktoré vykazujú jednoznačne malígne histologické črty, je možné využiť aj rádioterapiu a/alebo chemoterapiu (13). Poznatky v tejto oblasti sú však značne limitované vzhľadom na malé počty prípadov. Hoci je väčšina SFT z hľadiska prognózy benígna (cca 85-90 %), celkovo možno hodnotiť biologické správanie SFT ako nepredvídateľné. Malá časť SFT sa a priori správa agresívne a vykazuje známky malígneho chovania. V prehľade práce Bauera a spol. (1), v ktorej bolo analyzovaných 22 prípadov SFT v oblasti príušnej slinnej žľazy, boli tri SFT jednoznačne malígne. Zhubné formy SFT sú obvykle spojené s lokálnou rekurenciou a so vzdialenými metastázami (11). Celkovo je však odhad biologického potenciálu SFT veľmi ťažký. Agresívnejšie sa správajúce nádory boli zvyčajne väčšie (nad 10 cm) a boli lokalizované najmä vo viscerálnych oblastiach. Z histomorfologických čŕt spojených s agresívnym správaním boli pozorované zmeny ako hypercelularita, aspoň fokálny pleomorfizmus, viac ako 4 mitózy na 10 HPF, výskyt nekróz a infiltrácia do okolitých tkanivových štruktúr (6). Nakoľko niektoré z týchto znakov boli prítomné aj v našom prezentovanom prípade (obr. 7), bol výsledný biologický potenciál nádoru hodnotený ako neurčitý s odporučením sledovania pacienta, čo je v súlade s literárne navrhnutým prístupom. Podľa tohto prístupu majú byť všetci pacienti so SFT dispenzarizovaní a dlhodobo sledovaní (6). V recentnej štúdii, zaoberajúcej sa SFT v oblasti hlavy a krku, sa odporúča intenzívne prospektívne sledovanie pacientov s nádormi veľkosti nad 5 cm a s viac ako 4 mitózami na 10 HPF, a to z dôvodu zvýšenej lokálnej rekurencie, ktorá je častejšie pozorovaná aj v prípadoch s pozitívnymi resekčnými okrajmi (11).
ZÁVER
Solitárny fibrózny tumor v oblasti príušnej slinnej žľazy je extrémne zriedkavý nádor, na ktorý je treba myslieť v diferenciálnej diagnostike nádorov. Nakoľko je jeho biologické správanie ťažko predvídateľné, je potrebné dlhodobé sledovanie pacientov.
Adresa ke korespondenci:
MUDr. Katarína Macháleková, PhD.
Ústav patologie
Onkologický ústav sv. Alžbety, s.r.o.
Heydukova 10
812 50 Bratislava
Slovenská republika
Sources
1. Bauer, J., Miklos, A. Z., Thompson, L. D. R.: Parotid gland solitary fibrous tumor: a case report and clinicopathologic review of 22 cases from the literature. Head and Neck Pathol, 2012, 6, s. 21-31.
2. De Perrot, M., Fischer, S., Bründler, M. A. et al.: Solitary fibrous tumors of the pleura. Ann Thorac Surg, 74, 2002, s. 285-293.
3. Fletcher, C. D. M., Bridge, J. A., Lee, J. C.: Extrapleural solitary fibrous tumor. In: Fletcher, C. D. M., Bridge, J. A., Hogendoorn, P. C. W. et al. editors. WHO classification of tumours of soft tissue and bone. IARC Press, Lyon, 2013, s. 80-82.
4. Gengler, C., Guillou, L.: Solitary fibrous tumour and haemangiopericytoma: evolution of a concept. Histopathology, 48, 2006, 1, s. 63-74.
5. Klempeler, P., Rabin, C. B.: Primary neoplasms of the pleura: a report of five cases. Arch Pathol, 11, 1931, s. 385-412.
6. Lindberg, M. R.: Solitary fibrous tumor. In Lindberg, M. R., Luca, D., Gardner, J. M. et al editors. Soft tissue tumors. 2nd ed., Elsevier, Philadelphia, 2016, s. 176-183.
7. Rais, M., Kessab, A., Sayad, Z. et al.: Solitary fibrous tumor occurring in the parotid gland: a case report. BMC Clinical Pathol, 17, 2017, s. 22.
8. Robinson, L. A.: Solitary fibrous tumor of the pleura. Cancer Control, 13, 2006, 4, s. 264-269.
9. Rodriguez-Gil, Y., Gonzalez, M. A., Carcavilla, C. B. et al.: Lines of cell differentiation in solitary fibrous tumor: an ultrastructural and immunohistochemical study of 10 cases. Ultrastruct Pathol, 33, 2009, 6, s. 274-285.
10. Sato, J., Asakura, K., Yokoyama, Y. et al.: Solitary fibrous tumor of the parotid gland extending to the parapharyngeal space. Eur Arch Otorhinolaryngol, 255, 1998, 1, s. 18-21.
11. Smith, S. C., Googing, W. E., Elkins, M. et al.: Solitary fibrous tumor of the head and neck: a multiinstitutional clinicopathologic study. Am J Surg Pathol, 41, 2017, 12, s. 1642-1656.
12. Tai, H. C., Chuang, I. C., Chen, T. C. et al.: NAB2-STAT6 fusion types account for clinicopathological variations in solitary fibrous tumors. Mod Pathol, 28, 2015, 10, s. 1324-1335.
13. Yang, X. J., Zheng, J. W., Ye, W. M. et al.: Malignant solitary fibrous tumors of the head and neck: a clinicopathological study of nine consecutive patients. Oral Oncol, 45, 2009, 8, s. 678-682.
14. Zhou, Y., Zheng, J., Zhu, Q. et al.: Solitary fibrous tumor of the salivary gland: a case report. Oncol Lett, 11, 2016, 1, s. 901-903.
15. Zubor, P., Kajo, K., Szunyogh, N. et al.: A solitary fibrous tumor in the broad ligament of the uterus. Pathol Res Pract, 203, 2007, 7, s. 555-560.
Labels
Audiology Paediatric ENT ENT (Otorhinolaryngology)
Article was published inOtorhinolaryngology and Phoniatrics

2019 Issue 2-
All articles in this issue
- Invertovaný sinonazální papilom: možnost predikce inzerce tumoru
- Embolizační léčba epistaxí
- Efekt tréninku hlasu pomocí rezonančních cvičení brumenda u studentů – pilotní studie
- Video Head Impulse Test - nejnovější metoda vyšetření vestibulárního aparátu
- Metastazující karcinom prsu jako vzácná příčina hluchoty a zhoršení zraku
- Solitárny fibrózny tumor príušnej slinnej žľazy
- XIII. demonstrační kurz a seminář
- Leiomyosarkom hrtanu – diagnostika a léčebný protokol. Kazuistika a přehled literatury
- Otorhinolaryngology and Phoniatrics
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Video Head Impulse Test - nejnovější metoda vyšetření vestibulárního aparátu
- Efekt tréninku hlasu pomocí rezonančních cvičení brumenda u studentů – pilotní studie
- Invertovaný sinonazální papilom: možnost predikce inzerce tumoru
- Solitárny fibrózny tumor príušnej slinnej žľazy
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

