-
Medical journals
- Career
Levotyroxin
Authors: Jan Krátký
Authors‘ workplace: 3. interní klinika 1. lékařské fakulty Univerzity Karlovy a VFN v Praze
Published in: Vnitř Lék 2022; 68(1): 68-72
Category:
Overview
Levotyroxin je synteticky připravená levotočivá forma tyroxinu. V současnosti patří celosvětově k nejčastěji předepisovaným lékům. Hlavní indikací k terapii levotyroxinem je substituce hypotyreózy jakéhokoliv typu. Využívá se také k supresní léčbě u tyreoidálních karcinomů. Terapeutická dávka závisí na reziduální tyreoidální aktivitě, hmotnosti pacienta a požadovaném cíli léčby. Obvyklé zahajovací dávky se pohybují od 25–50 μg denně, léčbu dále upravujeme za monitorace tyreostimulačního hormonu (TSH). Postupná titrace dávky není doporučována při zahajování pooperační substituční terapie a u gravidních žen s hypotyreózou.
Většina tyroxinu je v plazmě navázána na transportní proteiny. Biologicky aktivní je však pouze volná frakce. Tyroxin funguje především jako prohormon, ze kterého vzniká dejodací hormonálně výrazně aktivnější trijodotyronin.
Správně vedená terapie levotyroxinem je bezpečná a má minimum nežádoucích účinků. Při předávkování se mohou vyskytnout palpitace a další příznaky hypertyreózy. Pro správné vstřebávání je třeba levotyroxin užívat nalačno, odděleně od ostatní medikace, zapíjet pouze vodou a poté minimálně 30 minut nejíst. Vstřebávání může být narušeno i jinou medikací, především léky zvyšujícími pH žaludeční šťávy.
Klíčová slova:
hypotyreóza – levotyroxin – tyreoidální hormony
Úvod
Terapie tyreopatií představuje hlavní náplň práce ambulantního endokrinologa. Je to dáno především vysokým výskytem onemocnění štítné žlázy v populaci a také tím, že obvykle jde o chronická onemocnění, která vyžadují dlouhodobou dispenzarizaci. Nejčastější funkční tyreoidální poruchou je periferní hypotyreóza, která se může vyskytovat u 5–10 % lidí v závislosti na zkoumané populaci (1). Nejvyšší prevalence je v populaci starších žen. V oblastech s dostatečným zásobením jódem je periferní hypotyreóza nejčastěji vyvolána chronickou lymfocytární tyreoiditidou (CLT), tedy autoimunitním zánětem štítné žlázy charakterizovaným lymfocytární infiltrací, který může vést k destrukci tyreoidální tkáně. CLT se podobně jako většina ostatních tyreopatií vyskytuje častěji u žen a její výskyt stoupá s věkem. Prevalence CLT se odhaduje kolem 5–10 % (2). Mezi časté příčiny hypotyreózy dále patří stavy po operaci štítné žlázy a po terapii radiojódem, farmakologicky indukovaná hypotyreóza (např. amiodaron, „check point inhibitory“, lithium) anebo pozdější fáze subakutní či poporodní tyreoiditidy.
Základem terapie hypotyreózy je podávání tyreoidálních hormonů, v dnešní době prakticky jen levotyroxinu. V ojedinělých případech, pokud samotný levotyroxin nestačí, může být do terapie přidán i trijodothyronin (T3). Kombinační terapie však nemá oporu v současných doporučených postupech a měla by být vyhrazena pouze pro ojedinělé případy, kdy přetrvává symptomatologie hypotyreózy i po normalizaci tyreostimulačního hormonu (TSH) při terapii levotyroxinem (3). Monoterapie levotyroxinem je tedy v současné době metodou volby v terapii hypotyreózy.
Fyziologický poměr tyreoidální sekrece tyroxinu (T4) : T3 je asi 14 : 1. T4 však funguje především jako prohormon, který je dále v periferii pomocí enzymů zvaných dejodázy upravován na hormonálně výrazně aktivnější T3.
V minulosti byly v terapii hypotyreózy využívány preparáty vyrobené ze sušených živočišných štítných žláz. Jejich hlavní nevýhodou byla kolísající koncentrace hormonů a s tím spojené obtížné nastavení substituční dávky léku. Tyto preparáty jsou sice stále v některých zemích dostupné, ale jejich využití je již minimální. Od 60. let minulého století je postupně nahradil synteticky připravený levotyroxin. Levotyroxin byl poprvé uměle syntetizován v roce 1927 (4), výrazněji se začal rozšiřovat až od konce 60. let minulého století a dnes patří k nejčastěji předepisovaným lékům na celém světě. Například v USA byl v roce 2019 levotyroxin druhým nejčastěji předepisovaným lékem s celkovým počtem více než 100 milionů předepsaných balení (5).
Chemická struktura
Levotyroxin je synteticky připravená levotočivá forma T4, má tedy stejnou strukturu a účinek jako přirozený hormon. Chemicky je tvořen dvěma zbytky aminokyseliny tyrozinu, na kterých jsou navázány 4 atomy jódu. Chemický vzorec levotyroxinu je uveden na obrázku 1.
Image 1. Chemická struktura levotyroxinu (T4) a trijodotyroninu (T3) 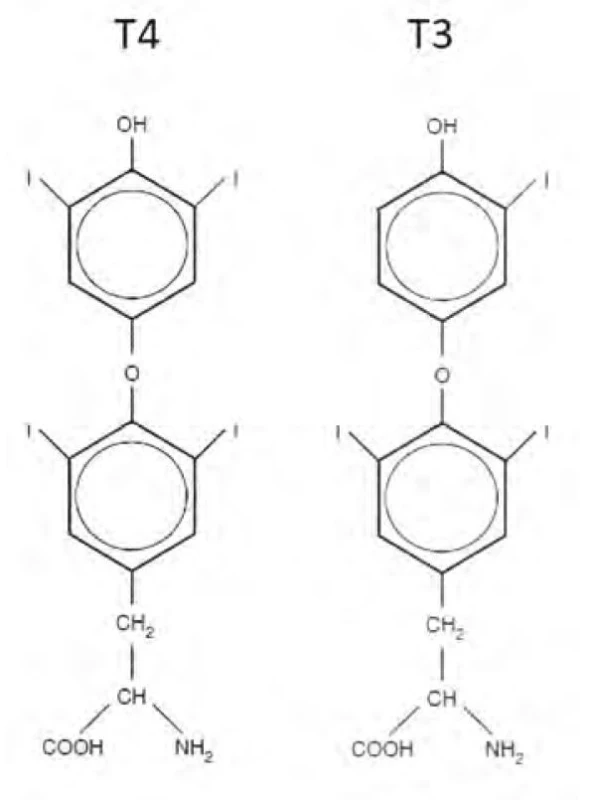
Mechanismus účinku
Levotyroxin je v České republice dostupný pouze v perorální formě. Existují i transdermální a parenterální preparáty, ty však u nás nejsou standardně dostupné.
Po podání per os se levotyroxin vstřebává téměř výlučně v horní části zažívacího traktu, především v proximálním tenkém střevě. Maximální plazmatické koncentrace je dosaženo asi 5–6 hodin po požití. Obvykle se vstřebává 70–80 % užité dávky (6). Vstřebávání levotyroxinu může být ovlivněno přítomností stravy v zažívacím traktu a závisí na kyselosti žaludeční šťávy. Při zahájení terapie levotyroxinem je tedy nutné pacienty poučit o správném užívání léku. Pacienti by měli levotyroxin užívat ráno nalačno, odděleně od ostatní medikace, tablety zapíjet pouze vodou a poté minimálně 30 minut nejíst. Druhou možností je večerní užití po minimálně čtyřhodinovém lačnění (7), to je však pro většinu pacientů méně komfortní. Problematické vstřebávání může být i u pacientů, kteří užívají medikamenty snižující kyselost žaludečních šťáv. V dnešní době jde především o často předepisované blokátory protonové pumpy. Při jejich nasazení se můžeme často setkat u dosud dobře substituovaného jedince s rozvojem hypotyreózy a s nutností úpravy dávky levotyroxinu.
Po vstřebání ze zažívacího traktu se v plazmě více než 99 % levotyroxinu naváže na transportní bílkoviny (TBG‑tyroxin binding globulin, transtyretin, albumin). Přibližně 0,3 % plazmatického levotyroxinu je ve volné, biologicky aktivní formě. Levotyroxin má velmi dlouhý biologický poločas (až 7 dní), který teoreticky umožňuje i dávkování v delších než jednodenních intervalech.
Hormonální aktivita T4 je výrazně nižší v porovnání s trijodotyroninem (T3), ten vzniká v periferních tkáních působením dejodáz – enzymů, které z T4 odštěpí jeden atom jódu za vzniku T3. T3 je následně uvolněn do krevního oběhu, kde je opět navázán na transportní proteiny. Biologický efekt tyreoidálních hormonů je převážně zprostředkován vazbou volného T3 na intracelulární receptory pro tyreoidální hormony, tento komplex se následně váže na cílové oblasti DNA a reguluje genovou expresi (viz Obr. 2) (8). Tímto mechanismem je regulována i zpětnovazebná suprese pituitární sekrece TSH.
Image 2. Mechanismus účinku trijodotyroninu (T3) přes vazbu na cytoplazmatický receptor tyreoidálních hormonů (TR) 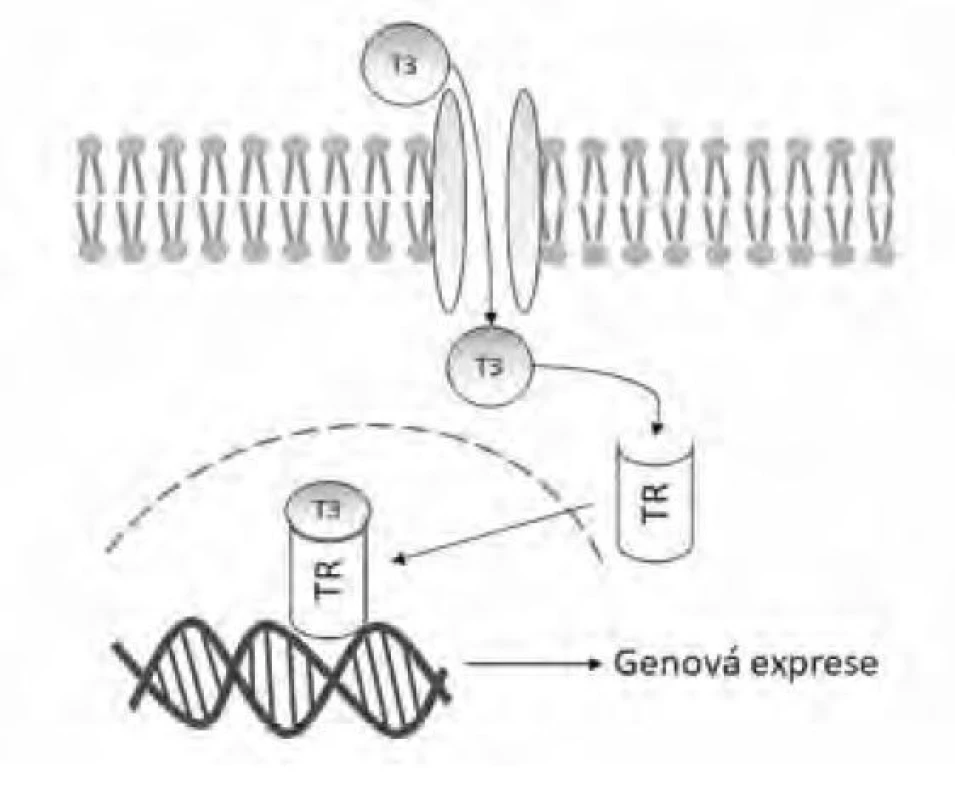
Mechanismus periferní dejodace prohormonu T4 na aktivní T3 přidává další možnost, jak reagovat na aktuální potřeby T3 v organismu. Změna aktivity periferních dejodáz vede ke změně koncentrace hormonálně aktivního T3. Například vzestup koncentrace T4 v periferních tkáních dejodázy inhibuje. Díky tomuto mechanismu nevyvolá krátkodobé zvýšení sérové koncentrace T4 po užití levotyroxinu výraznější změnu koncentrace T3. Monoterapie levotyroxinem tedy u většiny pacientů vede k relativně stabilním diurnálním koncentracím T3. Naopak kombinační terapie T4 + T3 způsobuje značné, nefyziologické kolísání koncentrací T3. Při terapii T3 stoupá sérová koncentrace volného T3, i když celkovou denní dávku T3 rozdělíme do dvou až třech denních dávek (9).
Indikace a kontraindikace terapie
levotyroxinem Hlavní indikací k zahájení terapie levotyroxinem je substituce hypotyreózy, především jde o periferní (primární) hypotyreózu nebo vzácněji i hypotyreózu centrální etiologie. U některých pacientů s diferencovanými karcinomy štítné žlázy, které vychází z folikulárních buněk (papilární a folikulární tyreoidální karcinom), využíváme levotyroxin k supresní terapii. Podání suprafyziologických dávek levotyroxinu způsobí žádoucí útlum hypofyzární sekrece TSH. Indikace a míra suprese TSH závisí na velikosti, agresivitě nádoru a na stadiu onemocnění (10). Levotyroxin je dále využíván k substituci u pacientů po tyreoidektomii pro benigní strumu. Někteří endokrinologové využívají levotyroxin k léčbě benigní uzlové strumy, což je v souladu s SPC, nicméně pozitivní přínos této terapie nebyl jednoznačně prokázán a je od něho spíše ústup z důvodu převažujících rizik. Například Americká tyreoidologická společnost ve svém aktuálním doporučení nedoporučuje rutinní terapii levotyroxinem u pacientů s benigní uzlovou strumou s normálním TSH (10). Další indikací dle SPC je použití v rámci supresních testů v diagnostice endokrinopatií (11).
Absolutní kontraindikací k podání levotyroxinu je předchozí alergická reakce. Terapie levotyroxinem by neměla být nově zahajována u pacientů s akutním infarktem myokardu a probíhající myokarditidou pro zvýšené riziko rozvoje maligní arytmie, dále u pacientů s akutní pankreatitidou. V případě souběžné adrenální insuficience je vždy nutné nejprve substituovat glukokortikodní deficit a následně teprve zahájit léčbu hypotyreózy. Podání levotyroxinu před adekvátní substitucí glukokortikoidy může totiž dále prohloubit příznaky adrenální krize.
Dávkování
Dávkování levotyroxinu je individuální. Velikost denní dávky záleží především na tom, zda a v jaké míře má pacient zachovanou vlastní tyreoidální hormonální produkci. Dalšími podstatnými faktory jsou hmotnost a tělesné složení. Ukazuje se, že potřebná dávka levotyroxinu koreluje spíše s beztukovou tělesnou hmotou (lean body mass) než s vlastní tělesnou hmotností (12). U atyreozních pacientů (pacienti s nulovou vlastní produkcí tyreoidálních hormonů) se průměrná denní substituční dávka levotyroxinu pohybuje kolem 1,6 – 1,7 μg/kg na den. U obézních lidí s vyšším procentuálním zastoupením tukové tkáně bývá relativní potřeba obvykle nižší. Například u lidí s BMI > 40 kg/m² se pohybuje pouze kolem 1,3 μg/kg za den (13). Terapeutickou dávku levotyroxinu konkrétního jedince vždy upravujeme tak, abychom dosáhli cílového rozmezí TSH. V případě prosté substituční terapie za cílové hodnoty TSH považujeme normální rozmezí dané laboratoří. Výjimkou jsou pacienti s diferencovanými tyreoidálními karcinomy, u kterých může být součástí léčebného postupu cílená supresní terapie s hodnotami TSH pod fyziologickým rozmezím. U pacientů s centrální hypotyreózou nemá monitorace TSH význam, proto se v jejich případě řídíme podle koncentrací volného T4, která by měla být před užitím levotyroxinu v horní polovině normálního rozmezí.
Zahajujeme ‑ li substituční terapii u periferní hypotyreózy, volíme nižší iniciální dávky, než které odpovídají plné substituční dávce. Zahajovací dávka se obvykle pohybuje kolem 50 μg denně. U starších, polymorbidních pacientů je na místě opatrnost a je vhodné volit ještě nižší počáteční dávky (12,5–25 μg/den). Denní dávku dále titrujeme obvykle po 12,5–25 μg dle kontrolních sérových koncentrací TSH. U mladších pacientů s těžší hypotyreózou můžeme dávku zvyšovat i razantněji bez rizika závažnějších nežádoucích účinků. Po zahájení léčby anebo při změně dávky je doporučeno provést laboratorní kontrolu po 2 měsících. Časnější kontrola (dříve než po 6 týdnech) nemá vzhledem k dlouhému biologickému poločasu levotyroxinu význam. V případě dosažení stabilních hodnot TSH v cílovém rozmezí je možné monitoraci protáhnout až na jeden rok. Existují však důvody k časnější kontrole. Patří mezi ně změna hmotnosti o více než 10 %, nasazení interferující medikace, onemocnění zažívacího traktu s rizikem poruchy vstřebávání anebo naopak zvýšená exkrece tyroxinu ledvinami při rozvoji nefrotického syndromu. Důvodem k časnější kontrole je i záměna jednotlivých preparátů s levotyroxinem ve stejné dávce.
Výjimkou, kdy nepoužíváme postupnou titraci, je zahájení léčby po totální tyreoidektomii a především gravidita. U pacientů po odstranění celé štítné žlázy obvykle volíme odpovídající plnou substituční dávku, kterou dále upravujeme dle laboratorních kontrol. Naopak u pacientů po hemityreoidektomii není potřeba zahajovat časnou substituční léčbu, protože pro část pacientů je k zachování normální tyreoidální funkce dostačující pouze polovina štítné žlázy (14). Navíc mírná elevace TSH po hemityreoidektomii může být pouze přechodného charakteru. Případnou substituční terapii je možné zahájit až při rozvoji trvalé anebo závažnější hypotyreózy (15).
Léčba hypotyreózy v graviditě je specifická záležitost. Pro správný vývoj plodu a fyziologický průběh gravidity je nezbytný dostatek tyreoidálních hormonů. Nejrizikovější období z pohledu plodu je první trimestr, protože asi do 12. týdne si plod neumí sám syntetizovat tyreoidální hormony a je zcela závislý na transplacentárním přísunu od matky. Abychom předešli hypotyreóze plodu s trvalými následky, volíme při nově diagnostikované hypotyreóze matky vyšší iniciální dávky levotyroxinu. V případě manifestní hypotyreózy 1,5–2,3 μg/kg, u subklinické hypotyreózy 1–1,5 μg/kg. TSH dále monitorujeme přibližně ve čtyřtýdenních intervalech až do dovršení 20. týdne těhotenství (16). Chronicky léčené pacientky je vhodné poučit, aby v případě gravidity zvýšily svoji chronickou dávku levotyroxinu přibližně o 20 % (tj. aby například užily 2x týdně dvojnásobek své denní dávky) a aby kontaktovaly svého dispenzarizujícího lékaře, který zajistí další pravidelné kontroly. Pro ženy v prvním trimestru jsou mírně odlišné normy TSH. Je to dáno hormonálními změnami v průběhu gravidity, kdy v prvním trimestru výrazně stoupá hladina choriového gonadotropinu (hCG). hCG má podobnou strukturu jako TSH a působí synergicky na TSH receptorech folikulárních buněk. Každá laboratoř by měla mít ideálně své vlastní normy pro gravidní ženy v prvním trimestru. Pokud to tak není, doporučuje se od horní hranice odečíst přibližně 0,5 mIU/l (17).
Nežádoucí účinky a interakce
Nežádoucí účinky správně vedené terapie levotyroxinem jsou vzácné. Ojediněle se mohou vyskytnout alergické reakce, které jsou většinou vyvolány přídatnými pomocnými látkami. Je tedy možné vyzkoušet záměnu preparátu.
V případě předávkování se mohou vyskytnout příznaky typické pro hypertyreózu. Pacienti si mohou stěžovat především na palpitace, zažívací obtíže (průjem), intoleranci tepla a při výraznější hypertyreóze mohou pozorovat i hubnutí. V tomto případě obvykle postačuje adekvátní úprava substituční léčby s dosažením cílových hodnot TSH. Již subklinická hypertyreóza (snížený TSH s normálním volným tyroxinem) je spojena se zvýšeným rizikem fibrilace síní a osteoporózy, proto bychom se měli snažit dosahovat eutyreózy a pacienty cíleně nepředávkovat, pokud to není nezbytně nutné z indikace tyreoidálního karcinomu.
Z pohledu lékových interakcí mají největší význam léky, které mohou interferovat s gastrointestinální absorpcí levotyroxinu. Jde především o léky snižující pH žaludeční šťávy (blokátory protonové pumpy, antihistaminika), dále o antacida s obsahem hliníku, cholestyramin, orlistat a soli železa užívané k terapii sideropenické anémie (18). Vyšší potřeba levotyroxinu může být také u žen, které užívají estrogeny, z důvodu zvýšené jaterní produkce vazebných proteinů.
Farmaka s vysokým obsahem jódu (kontrastní látky, amiodaron), také glukokortikoidy a propylthiouracyl mohou blokovat periferní konverzi T4 na T3 a tím snižovat účinek levotyroxinu. Kombinované užívání levotyroxinu a tyreostatika propylthiouracylu však nemá význam a nemělo by být prakticky využíváno.
Levotyroxin může vytěsňovat kumarinová antikoagulancia z vazebných proteinů. Při zahájení léčby levotyroxinem se zvyšuje riziko krvácení, proto je nutná častější kontrola koagulačních parametrů.
Antiepileptikum fenytoin může uvolňovat tyroxin z vazebných proteinů a může tedy způsobit vzestup plazmatické koncentrace volného T4 a tím zvyšovat účinek levotyroxinu.
Aktuálně dostupné preparáty
V České republice jsou aktuálně registrované pouze perorální formy levotyroxinu. V současnosti můžeme vybírat z široké skupiny preparátů od rozmanitých výrobců. Většina výrobců distribuuje levotyroxin ve formě tablet, což je nejčastěji užívaná forma levotyroxinu u nás. K dispozici máme široké rozmezí jednotlivých dávkovacích sil (od 25 μg po 200 μg tablety). Jednotlivé preparáty mají síly většinou odstupňovány po 12,5 až 50 μg, navíc jsou tablety obvykle vybaveny půlicími a někdy i čtvrticími rýhami, což umožňuje ještě citlivější dávkování. Přehled aktuálně dostupných preparátů je uveden v tabulce 1. Jednotlivé preparáty nejsou zcela ekvivalentní, liší se stabilitou preparátu, složením pomocných substancí i přesnou koncentrací účinné látky. Záměna preparátu u dobře nastaveného pacienta může způsobit změnu tyreoidálních parametrů, a proto je vhodné při případné změně provést časnější laboratorní kontrolu (2–3 měsíce).
Table 1. Přehled dostupných preparátů s levotyroxinem. 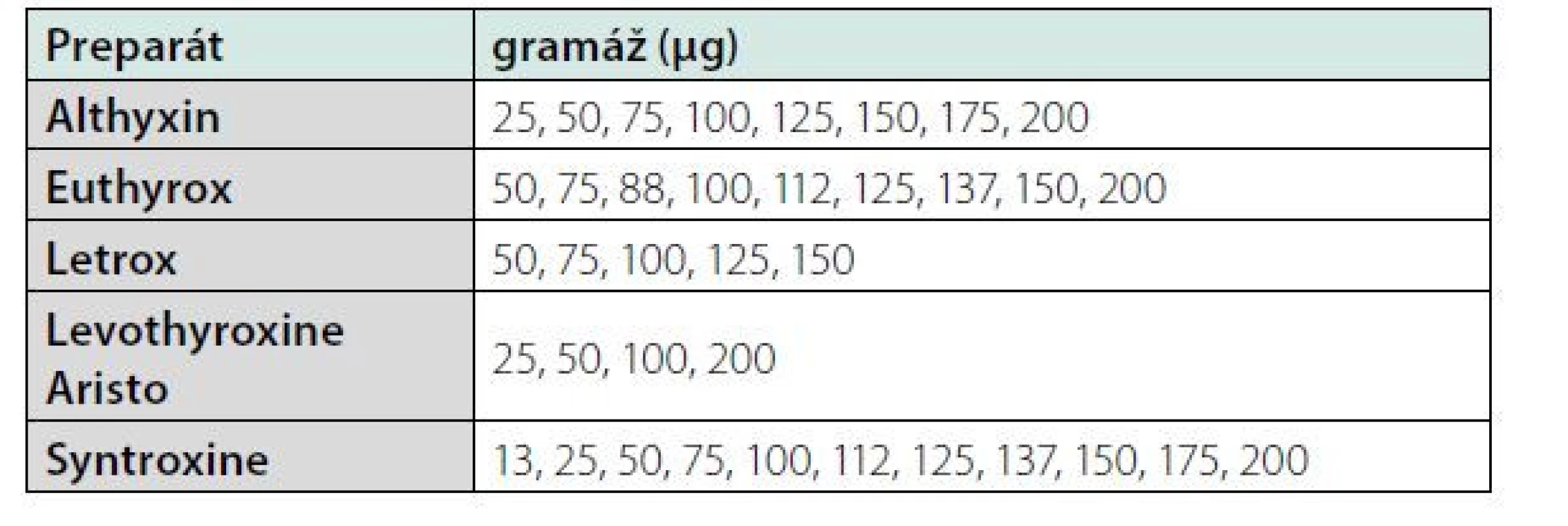
V posledních letech je u nás nově dostupný preparát ve formě gelových kapslí. Existují práce, které ukazují, že vstřebávání gelových kapslí není tolik závislé na kyselém žaludečním pH (19). Gelové kapsle by teoreticky mohly být výhodné pro pacienty s poruchou absorpce, například při užívání blokátorů protonové pumpy anebo u pacientů po gastrických operacích.
V ČR není aktuálně volně dostupný žádný parenterální preparát s levotyroxinem. Pro pacienty, kteří nejsou schopni polykat tablety, je vhodnou alternativou podání tablet do nazogastrické sondy (NGS) anebo do PEGu. Aplikaci tablet s levotyroxinem do NGS můžeme zvolit i u pacientů s myxedémovým kómatem. V tomto případě se doporučuje zahájit terapii stresovými dávkami hydrocortisonu, následně podat bolus 300–500 μg levotyroxinu do NGS, následně podávat cca 1,6 μg/ kg cestou NGS až do obnovení perorálního příjmu.
Závěr
Levotyroxin je jedním z celosvětově nejčastěji předepisovaných léků. Hlavní indikací je substituce hypotyreózy. Správně vedená a monitorovaná terapie levotyroxinu je účinná, bezpečná a má minimum nežádoucích účinků.
KORESPONDENČNÍ ADRESA AUTORA:
MUDr. Jan Krátký, Ph.D.
3. interní klinika 1. lékařské fakulty Univerzity Karlovy a VFN v Praze U Nemocnice 1, 128 08 Praha 2
Cit. zkr: Vnitř Lék 2022;68(1):68-73
Článek přijat redakcí: 2. 1. 2022
Článek přijat po recenzích: 2. 2. 2022
Sources
1. Vanderpump MP. The epidemiology of thyroid disease. Br Med Bull 2011;99 : 39-51
2. McLeod DS, Cooper DS. The incidence and prevalence of thyroid autoimmunity. Endocrine 2012;42 : 252-265.
3. Jonklaas J, Bianco AC, Cappola AR et al. Evidence‑Based Use of Levothyroxine/Liothyronine Combinations in Treating Hypothyroidism: A Consensus Document. Thyroid 2021;31 : 156-182.
4. Lindholm J, Laurberg P. Hypothyroidism and thyroid substitution: historical aspects. J Thyroid Res 2011;809341.
5. The Top 300 of 2019. Dostupné z<https://clincalc.com/DrugStats/Top300Drugs.aspx>
6. Fish LH, Schwartz HL, Cavanaugh J et all. Replacement dose, metabolism, and bioavailability of levothyroxine in the treatment of hypothyroidism. Role of triiodothyronine in pituitary feedback in humans. N Engl J Med 1987;31 : 764-770.
7. Pang X, Pu T, Xu L et all. Effect of l‑thyroxine administration before breakfast vs at bedtime on hypothyroidism: A meta‑analysis. Clin Endocrinol (Oxf) 2020;92 : 475-481.
8. Yen PM. Physiological and molecular basis of thyroid hormone action. Physiol Rev 2001;81 : 1097-1142.
9. Saravanan P, Siddique H, Simmons D J et al. Twenty‑four hour hormone profiles of TSH, Free T3 and free T4 in hypothyroid patients on combined T3/T4 therapy. Exp Clin Endocrinol Diabetes 2007;115 : 261-267.
10. Haugen BR, Alexander EK, Bible KC et al. 2015 American Thyroid Association Management Guidelines for Adult Patients with Thyroid Nodules and Differentiated Thyroid Cancer: The American Thyroid Association Guidelines Task Force on Thyroid Nodules and Differentiated Thyroid Cancer. 2016;Thyroid 26 : 1-133.
11. SPC přípravku Euthyrox dostupné z <https://www.sukl.cz/download/spc/SPC21491.pdf>
12. Santini F, Pinchera A, Marsili A et al. Lean body mass is a major determinant of levothyroxine dosage in the treatment of thyroid diseases. J Clin Endocrinol Metab 2005;90 : 124-127.
13. Papoian V, Ylli D, Felger EA et al. Evaluation of Thyroid Hormone Replacement Dosing in Overweight and Obese Patients After a Thyroidectomy. Thyroid 2019; 29 : 1558-1562.
14. Stoll SJ, Pitt SC, Liu J et al. Thyroid hormone replacement after thyroid lobectomy. Surgery 2009;146 : 554-558.
15. Park S, Jeon MJ, Song E et al. Clinical Features of Early and Late Postoperative Hypothyroidism After Lobectomy. J Clin Endocrinol Metab 2017;102 : 1317-1324.
16. Doporučení pro prevenci, časný záchyt a léčbu tyreopatií v těhotenství 2018. Dostupné z <https://www.endokrinologie.cz/cs/doporuceni‑pro‑prevenci‑casny‑zachyt‑a-lecbu‑tyreopatii‑v-tehotenstvi-2018>
17. Alexander EK, Pearce EN, Brent GA et al. 2017 Guidelines of the American Thyroid Association for the Diagnosis and Management of Thyroid Disease During Pregnancy and the Postpartum. Thyroid 2017;27 : 315-389.
18. Dvorakova M. Levothyroxine therapy - factors influencing its outcome. Vnitr Lek 2016;62 : 50-55.
19. Vita R, Benvenga S. Tablet levothyroxine (L‑T4) malabsorption induced by proton pump inhibitor; a problem that was solved by switching to L‑T4 in soft gel capsule. Endocr Pract 2014;20 : 38-41.
Labels
Diabetology Endocrinology Internal medicine
Article was published inInternal Medicine

2022 Issue 1-
All articles in this issue
- Ohlédnutí za XXVIII. kongresem ČIS ČLS JEP
- Jak vést interní oddělení: primář – školitel
- Jak provozovat moderní výkonově orientovanou interní ambulanci
- Pacient s jaterní cirhózou na interním oddělení
- Přímé náklady na léčbu pacientů s nevalvulární fibrilací síní nově indikovaných k léčbě apixabanem: retrospektivně prospektivní jednoramenná kohortová studie
- Doporučení Evropské společnosti pro hypertenzi pro měření krevního tlaku v ordinaci a mimo zdravotnické zařízení
- Multicentrická Castlemanova choroba. Příznaky, diagnostika a léčba
- Měření cholesterolu a současná doporučení
- Diferenciální diagnostika zvětšení hypofýzy
- Výhody současné léčby hypertenze a hypercholesterolemie fixní kombinací
- Levotyroxin
- Internal Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Pacient s jaterní cirhózou na interním oddělení
- Měření cholesterolu a současná doporučení
- Diferenciální diagnostika zvětšení hypofýzy
- Levotyroxin
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

