-
Medical journals
- Career
Familiární hypercholesterolemie v České republice v roce 2016
Authors: Tomáš Freiberger 1; Martina Vaclová 2; Lukáš Tichý 3; Vladimír Soška 4,5,6; Vladimír Bláha 7; Lenka Fajkusová 3; Richard Češka 2; Michal Vrablík 2
Authors‘ workplace: Genetická laboratoř Centra kardiovaskulární a transplantační chirurgie, Brno 1; III. interní klinika 1. LF UK a VFN v Praze 2; Centrum molekulární biologie a genové terapie FN Brno 3; Oddělení klinické biochemie a ICRC – oddělení kardiovaskulárních chorob, FN u sv. Anny v Brně 4; Katedra laboratorních metod, LF MU Brno 5; II. interní klinika LF MU a FN U sv. Anny v Brně 6; III. interní gerontometabolická klinika LF UK a FN Hradec Králové 7
Published in: Vnitř Lék 2016; 62(11): 924-928
Category: Reviews
Overview
Familiární hypercholesterolemie (FH) je nejčastějším autosomálně dominantně dědičným onemocněním, které je charakterizováno snížením katabolizmu LDL-cholesterolu a předčasnou klinickou manifestací aterosklerotického postižení cév. Projekt MedPed (Make early diagnosis to Prevent early deaths) má za cíl diagnostikovat pacienty s FH co nejdříve, aby co nejvíce profitovali ze včasně zahájené terapie a nedospěli k předčasné kardiovaskulární příhodě. V současné době (k 31. 10. 2016) evidujeme v celonárodní české databázi 6 947 pacientů s FH z 5 223 rodin. Při prevalenci FH 1 : 250 to představuje 17,4 % z celkového očekávaného počtu pacientů s FH v ČR. Určení mutace zodpovědné za FH, k němuž je nyní v ČR využívána moderní technologie sekvenování nové generace, vede ke zpřesnění diagnostiky, zvýšení spolupráce ze strany pacientů a především usnadnění kaskádovitého screeningu v rodinách. Přestože patříme z hlediska záchytu FH k nejúspěšnějším zemím na světě, většina pacientů zůstává stále nediagnostikována. Navíc se ukazuje, že při současných léčebných možnostech většina pacientů s FH nedosahuje cílových hodnot. V tomto směru jsou velkým příslibem nově schválené léky, inhibitory PCSK9, které budou snad v nejbližší době k dispozici i v České republice pro vybrané vysoce rizikové pacienty s FH.
Klíčová slova:
familiární hypercholesterolemie – kaskádovitý screening – LDL-cholesterol – MedPedÚvod
Familiární hypercholesterolemie (FH) je nejčastějším autosomálně dominantně dědičným onemocněním, které je charakterizováno snížením katabolizmu LDL-cholesterolu (LDL-C) a předčasnou klinickou manifestací aterosklerotického postižení cév [1]. Dlouhá léta tradovaná prevalence heterozygotní FH (heFH) 1 : 500 ve většině rozvinutých zemí [2,3] byla ve světle dat z recentních studií poopravena na hodnotu přibližně dvojnásobnou [4,5], což představuje celosvětově více než 30 milionů jedinců postižených touto chorobou. V populacích ovlivněných genetickým efektem zakladatele a s vysokou mírou příbuzenských sňatků, jako je tomu např. v Libanonu, jižní Africe nebo v oblasti Quebecu v Kanadě, je prevalence FH ještě vyšší. S tím souvisí také prevalence homozygotní formy FH (hoFH) pozměněná z původní hodnoty 1 : 1 000 000 na nynější hodnotu 1 : 300 000 [4].
FH byla poprvé popsána v roce 1938 jako familiární xantomatóza: prof. C. Muller spojil rodinný výskyt xantomů, vysoké hladiny cholesterolu a ischemické choroby srdeční s vrozenou poruchou metabolizmu pramenící z defektu jednoho genu [6]. Dalším průlomovým momentem v historii charakterizace FH byl rok 1963, kdy Khachadurian popsal heterozygotní a homozygotní fenotyp FH u pacientů v Libanonu a vymezil kodominantní typ dědičnosti [7]. Na tyto práce navázali v roce 1973 Goldstein a Brown, kteří popsali LDL receptor a jeho úlohu v katabolizmu cholesterolu a defekt v genu pro LDL receptor označili za příčinu FH [8]. Za tento objev se také v roce 1985 oba pánové stali laureáty Nobelovy ceny.
Pokud není FH léčena, relativní riziko předčasné koronární příhody je u pacientů s heFH výrazně vyšší než u ostatních jedinců a pacienti s hoFH jsou typicky postižení akutní kardiovaskulární příhodou do 20 let věku a často se nedožijí 30 let [9,10]. Situace pacientů s FH se podstatně zlepšila po uvedení statinů na trh v roce 1987. Celá řada studií, včetně metaanalýz, prokázala, že statiny jsou bezpečné léky redukující významně koncentraci LDL-C v cirkulaci i riziko kardiovaskulárních ischemických příhod a kardiovaskulární mortalitu [11]. Vedle režimových opatření jsou potentní statiny (atorvastatin a rosuvastatin) u FH jednoznačně lékem první volby, často s nutností přidání dalších léků, jako ezetimibu nebo sekvestrantů žlučových kyselin. V poslední době se objevily nové možnosti léčebného ovlivnění hypercholesterolemie a rizika ischemické kardiovaskulární ataky, zejména v podobě inhibitorů molekuly PCSK9, které podstatně rozšířily naše možnosti dosáhnout u pacientů s FH cílové hodnoty LDL-C. Dosavadní studie potvrdily vysoký potenciál a přidanou hodnotu léčby inhibitory PCSK9 [12,13], která už je schválená a snad bude v blízké budoucnosti k dispozici i v České republice.
Přestože FH je klinicky i laboratorně velmi dobře definována, přes pokročilé možnosti diagnostiky i dostatek informací o vysokém riziku předčasné manifestace aterosklerózy související s celoživotně zvýšenými hladinami LDL-C i přes dostupnost efektivní hypolipidemické terapie je FH stále nedostatečně diagnostikována, neléčena nebo léčena neadekvátně [1,14]. Navíc i při využití stávající dostupné léčby většina pacientů s FH nedosahuje cílových hodnot LDL-C [15,16]. A to i v České republice, která patří v záchytu FH díky projektu MedPed (Make early diagnosis to Prevent early deaths) k nejúspěšnějším zemím na světě.
Diagnostika FH
Diagnostika je založena na opakovaném vyšetření sérových koncentrací LDL-C (nejlépe bez léčby) a pečlivě odebrané rodinné anamnéze. Hodnoty LDL-C nad 95. percentilem populačně, věkově a pohlavně specifických hodnot svědčí pro možnou FH. Výskyt předčasné klinické manifestace aterosklerózy nebo hypercholesterolemie u probanda, jednoho z jeho rodičů, prarodičů nebo sourozenců je významným faktorem podporujícím diagnózu FH, stejně jako přítomnost šlachových xantomů či v mladém věku (do 40 let) objevivších se xantelazmat nebo arcus lipoides na rohovce. Koncentrace triglyceridů je obvykle v normě, ale vyšší hodnoty FH nevylučují. Samozřejmostí je vyloučení sekundární příčiny hypercholesterolemie, např. hypotyreóza nebo nefrotický syndrom. Diagnóza je potvrzena určením kauzální mutace v některém z genů, jejichž defekt je zodpovědný za vznik FH (LDLR, APOB nebo PCSK9) [14].
Zřejmě nejšířeji akceptovanými a v našich podmínkách nejvhodnějšími diagnostickými kritérii FH jsou Dutch lipid network criteria, která využívají bodový systém k hodnocení, zda se jedná o jistou, pravděpodobnou nebo možnou FH (tab. 1) [17]. Zohledňují jak údaje z rodinné anamnézy (hypercholesterolemie nebo výskyt předčasné kardiovaskulární příhody), tak přítomnost fyzikálních známek FH (šlachové xantomy, arcus lipoides na rohovce před 40. rokem věku), hodnoty LDL-C nebo průkaz kauzální mutace v genu LDLR, APOB nebo PCSK9, která má obzvlášť velkou váhu a je téměř dostačující pro stanovení jisté diagnózy FH (8 bodů z 9 potřebných).
Table 1. Dutch lipid network diagnostická kritéria familiární hyperchoplesterolemie 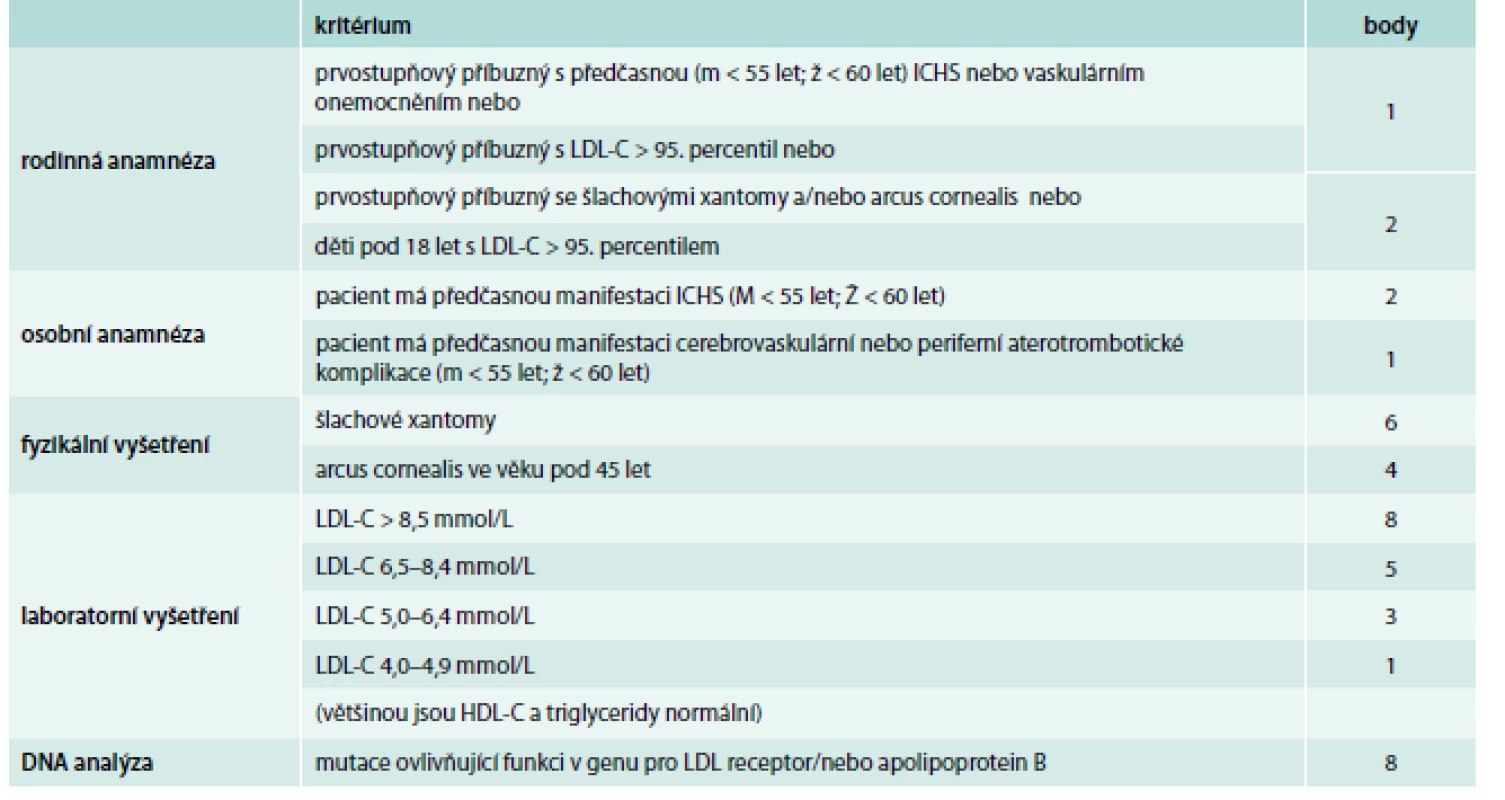
V každé z kategorií (rodinná anamnéza, osobní anamnéza, fyzikální vyšetření, laboratorní vyšetření, DNA analýza) je zvolena jen jedna (ta nejvyšší platná) bodová hodnota. Diagnóza FH je jistá při DLNC skóre ≥ 8, pravděpodobná při DLNC skóre 6–8, možná při DLNC skóre 3–5. Diferenciálně diagnosticky je nutno odlišit především familiární kombinovanou hyperlipidemii – polygenní poruchu vyznačující se variabilním lipidovým fenotypem, často se pojící s inzulinovou rezistencí, dále polygenní hypercholesterolemii, a u těžkých forem heFH či hoFH je potřeba myslet hlavně na sitosterolemii, která má autosomálně recesivní typ dědičnosti a může být potvrzena vyšetřením koncentrace fytosterolů v séru a molekulárně genetickým vyšetřením (mutace v genu ABCG5 nebo ABCG8) [18].
Jakkoliv je riziko předčasné klinické manifestace aterosklerózy dáno především celoživotně zvýšenými koncentracemi LDL-cholesterolu, řada dalších faktorů může riziko pacienta s FH významně modifikovat a je nutné se jimi zabývat. Více ohroženi jsou především pacienti se symptomatickou nebo i subklinickou aterosklerózou, kuřáci, muži, pacienti starší 40 let, kteří nebyli dosud léčeni, hypertonici, diabetici nebo pacienti se zvýšenými hladinami lipoproteinu(a) [19].
Molekulární aspekty FH
Většina případů familiární hypercholesterolemie je podmíněna defektním genem pro LDL receptor (LDLR) nebo apolipoprotein B-100 (APOB), vzácně jsou příčinou mutace v genu PCSK9 vedoucí ke zvýšení funkce tohoto proteinu. Ojediněle však byly popsány i mutace v jiných genech způsobující fenotyp FH, např. v genu STAP1 nebo APOE [19]. Fenotyp hoFH může být determinován také mutacemi v genu LDLRAP1, které jsou spojeny s autosomálně recesivní formou onemocnění, což znamená, že rodiče pacienta jsou zdraví nositelé defektu na jedné alele, zatímco k manifestaci onemocnění je potřeba zdědit defektní alelu od obou rodičů. Existuje částečná korelace genotypu a fenotypu, pokud vyšší hladiny LDL-C a těžší fenotyp jsou spojeny s tzv. nulovými mutacemi v genu LDLR, které vedou k poklesu aktivity LDL receptoru na úroveň < 2 %, než je tomu u tzv. defektních mutací, které mají za následek snížení aktivity LDL receptoru na 2–25 % jeho normální funkce.
Určení mutace v některém z genů, jejichž defekt je zodpovědný za vznik FH, znamená potvrzení diagnózy FH, a tím také potvrzení působení zvýšeného LDL-C již od narození. Zejména je ale znalost mutace důležitá pro účinný kaskádovitý screening, protože umožní jednoznačné potvrzení či vyloučení FH u ostatních členů rodiny. Znalost mutace v rodině také zvyšuje ochotu příbuzných přijít k vyšetření, což dokládají i údaje z české celonárodní databáze, podle níž je v rodinách se známou kauzální mutací průměrný počet pacientů s FH v jedné rodině 1,77, zatímco v rodinách bez detekované mutace je to jen 1,18. Přínos molekulárně genetického vyšetření podtrhují i výsledky recentní komunitní studie z USA, které ukázaly, že u pacientů s hypercholesterolemií byla přítomnost mutace nezávislým prediktorem manifestního kardiovaskulárního postižení [20]. Je ale potřeba zdůraznit, že negativní výsledek molekulárně genetického vyšetření neznamená vyloučení FH. Může být dán omezenou senzitivitou použitých metod, polohou mutace mimo analyzované oblasti genu nebo tím, že defekt leží v jiném genu. Část pacientů s klinickou diagnózou FH ovšem může mít ve skutečnosti polygenní hypercholesterolemii, která je způsobena určitými variantami (polymorfizmy) ve více různých genech, které každá jednotlivě vedou k malému zvýšení LDL-C, ovšem kolektivně mohou vést k podstatnému nárůstu LDL-C a mohou imitovat FH. Talmud et al určili 12 takových genů malého účinku, jejichž varianty nejvíce přispívaly ke zvýšení LDL-C. Podle kombinace různých variant těchto 12 genů je kalkulováno tzv. LDL skóre, jehož výše určuje polygenní vliv na koncentraci LDL-C. Bylo zjištěno, že výše LDL skóre může pomoci rozlišit pacienty s FH (mají nízké skóre) od pacientů s polygenní hypercholesterolemií (vysoké skóre), ale tento postup ještě vyžaduje ověření více studiemi na vyšším počtu pacientů [21]. Polygenní hypercholesterolemii má až 30 % pacientů s klinickou diagnózou FH [22].
Diagnostické možnosti se v poslední době významně zvýšily nástupem moderní technologie sekvenování nové generace (NGS). Při použití celoexomového sekvenování byla v nedávné studii kauzální mutace odhalena u 20 % pacientů s klinicky jistou diagnózou FH, u nichž předchozí analýza nevedla k nálezu mutace [22]. Ovšem aplikace cíleného NGS u pacientů s hypercholesterolemií v primární péči vedla k detekci mutace způsobující FH jen u 2 % jedinců [23].
Iniciativy ke zvýšení záchytu FH a počtu léčených pacientů
V České republice byl před 18 lety spuštěn program aktivního vyhledávání pacientů s FH, MedPed, kterým jsme se připojili k mezinárodnímu úsilí, jehož hlavním cílem je významně snížit riziko předčasného úmrtí u pacientů s FH [24]. Hlavními prostředky jsou včasné stanovení diagnózy a včasná a dlouhodobá léčba postižených osob, přičemž důraz je kladen zejména na vyhledávání ohrožených jedinců mezi příbuznými již diagnostikovaných pacientů, a také na molekulárně genetickou diagnostiku, která je v ČR v současnosti založena na cíleném sekvenování nové generace a kopíruje tak trend, který se prosazuje ve vyspělých zemích.
Síť projektu MedPed v ČR je nyní tvořena 69 aktivními centry a spolupracovníky. Sestává ze 2 párů národních center v Praze a v Brně, 15 regionálních center pro dospělé a 10 pro děti, 21 specializovaných pracovišť pro dospělé a 5 pro děti a dalších 14 spolupracujících lékařů.
V současné době, k 31. 10. 2016, máme v databázi evidováno 6 947 pacientů z 5 223 rodin. Počet pacientů s FH/FDB zařazených do databáze tak činí 17,4 % z očekávaného počtu asi 40 000 pacientů v ČR (při uvažované prevalenci 1 : 250). U 712 pacientů byla diagnóza stanovena do 19 let věku. Vzorek DNA je k dispozici od 4 399 nepříbuzných pacientů a mutace v genu pro LDL receptor nebo ApoB byla prokázána u 1 332 z nich. Kauzální mutace v genu PCSK9 nebyla v české populaci doposud detekována. V ČR evidujeme také 14 pacientů s homozygotní formou FH, resp. FDB.
I nástup nových léků na trh oživil zájem o FH a ve světě se objevila řada iniciativ zaměřená na zvýšení záchytu a počtu léčených pacientů s FH, a tím významnému omezení počtu předčasných úmrtí a kardiovaskulárních příhod v důsledku předčasně rozvinutého aterosklerotického postižení cév. V Austrálii, Pacifiku a jižní Americe proběhla 10 countries study vedená G. Wattem [25], v USA se již několik let úspěšně rozvíjí společná platforma pacientů a lékařů FH foundation [26]. V Evropě probíhá projekt FH studies collaboration vedený K. Rayem pod hlavičkou EAS (European Atherosclerosis Society) [1] a také projekt ScreenPro FH zaměřený na zlepšení diagnostiky a léčby FH v regionu jižní a východní Evropy a střední Asie, zejména v méně rozvinutých zemích, vedený R. Češkou [27]. V obou těchto iniciativách je Česká republika aktivně zapojena.
Závěr
Familiární hypercholesterolemie je závažná porucha lipidového metabolizmu, která je nejčastějším dědičným metabolickým onemocněním vůbec a vede k předčasným úmrtím v důsledku klinické manifestace aterosklerózy. Přesto, že ČR patří v záchytu FH k nejúspěšnějším zemím na světě, i u nás je stále většina pacientů nediagnostikována. Navíc část diagnostikovaných pacientů není adekvátně léčena. Ale i u pacientů, kteří adekvátně léčeni jsou, nedosahujeme ve většině případů cílových hodnot LDL-cholesterolu. V tomto směru jsou příslibem nové léky, které snad budou v blízké budoucnosti k dispozici pro nejvíce ohrožené pacienty s FH i v ČR a které pomohou zvýšit procento pacientů s dosaženými cílovými hodnotami LDL-cholesterolu.
Práce byla podpořena granty AZV ČR 15–28277A a 16–29084A. Poděkování patří všem spolupracujícím lékařům (jejich seznam je uveden na http://www.athero.cz/projekt-medped/pro-odborníky/pracoviště-medped), koordinátorkám Editě Firoňové, Elišce Mitvalské a Marii Plotěné, pracovníkům zajišťujícím molekulární diagnostiku, Martině Slezáčkové a Mgr. Petře Zapletalové, společnosti Galén Symposion a Mgr. Haně Středové za pomoc s logistikou projektu a sponzorujícím společnostem Amgen, AOP Orphan, Krka, MSD, Pfizer a Sanofi.
MUDr. Tomáš Freiberger, Ph.D.
tomfre@cktech.cz
Centrum kardiovaskulární a transplantační chirurgie,
Brno
www.cktch.cz
Doručeno do redakce 4. 11. 2016
Přijato po recenzi 24. 11. 2016
Sources
1. Vallejo-Vaz AJ, Kondapally Seshasai SR, Cole D et al. Familial hypercholesterolaemia: A global call to arms. Atherosclerosis 2015; 243(1): 257–259. Dostupné z DOI: <http://dx.doi.org/10.1016/j.atherosclerosis.2015.09.021 >.
2. Goldstein JL, Brown MS. Familial hypercholesterolemia: identification of a defect in the regulation of 3-hydroxy-3-methylglutarylcoenzyme A reduktase activity associated with over production of cholesterol. Proc Natl Acad Sci USA 1973; 70(10): 2804–2808.
3. Goldstein JL, Hobbs HH, Brown MS. Familial hypercholesterolemia. In: Scriver CR, Beaudet AL (eds) et al. The metabolic and molecular bases of inherited disease. 8th ed. McGraw-Hill: New York 2001. 2. Vol: 2863–2914. ISBN 978–0071363211.
4. Benn M, Watts GF, Tybjaerg-Hansen A et al. Familial hypercholesterolemia in the Danish general population: prevalence, coronary artery disease, and cholesterol-lowering medication. J Clin Endocrinol Metab 2012; 97(11): 3956–364. Dostupné z DOI: <http://dx.doi.org/10.1210/jc.2012–1563>. Erratum in J Clin Endocrinol Metab 2014; 99 : 4758–4759.
5. Sjouke B, Kusters DM, Kindt I et al. Homozygous autosomal dominant hypercholesterolaemia in the Netherlands: prevalence, genotype-phenotype relationship, and clinical outcome. Eur Heart J 2015; 36(9): 560–565. Dostupné z DOI: <http://dx.doi.org/10.1093/eurheartj/ehu058>
6. Müller C. Angina pectoris in hereditary xanthomatosis. Arch Intern Med 1939; 64 : 675–700.
7. Khachadurian AK. The inheritance of essential familial hypercholesterolemia. Am J Med 1964; 37 : 402–407.
8. Brown MS, Goldstein JL. A receptor-mediated pathway for cholesterol homeostasis. Science 1986; 232(4746): 34–47.
9. Huijgen R, Kindt I, Defesche JC et al. Cardiovascular risk in relation to functionality of sequence variants in the gene coding for the low-density lipoprotein receptor: a study among 29,365 individual stested for 64 specific low-density lipoprotein-receptor sequence variants. Eur Heart J 2012; 33(18): 2325–2330. Dostupné z DOI: <http://dx.doi.org/10.1093/eurheartj/ehs038>.
10. Cuchel M, Bruckert E, Ginsberg HN et al. [European Atherosclerosis Society Consensus Panel on Familial Hypercholesterolaemia]. Homozygous familial hypercholesterolaemia: new insights and guidance for clinicians to improve detection and clinical management. A position paper from the Consensus Panel on Familial Hypercholesterolaemia of the European Atherosclerosis Society. Eur Heart J 2014; 35(32): 2146–2157. Dostupné z DOI: <http://dx.doi.org/10.1093/eurheartj/ehu274>.
11. Baigent C, Blackwell L, Emberson J, Holland LE et al. Cholesterol Treatment Trialists’ (CTT) Collaboration. Efficacy and safety of more intensive lowering of LDL cholesterol: a meta-analysis of data from 170,000 participants in 26 randomised trials. Lancet 2010; 376(9753): 1670–1681.
12. Raal FJ, Stein EA, Dufour R et al. [RUTHERFORD-2 Investigators]. PCSK9 inhibition with evolocumab (AMG 145) in heterozygous familial hypercholesterolaemia (RUTHERFORD-2): a randomised, double-blind, placebo-controlled trial. Lancet 2015; 385(9965): 331–340. Dostupné z DOI: <http://dx.doi.org/10.1016/S0140–6736(14)61399–4>.
13. Kastelein JJ, Ginsberg HN, Langslet G et al. ODYSSEY FH I and FH II: 78 week results with alirocumab treatment in 735 patients with heterozygous familial hypercholesterolaemia. Eur Heart J 2015; 36(43): 2996–3003. Dostupné z DOI: <http://dx.doi.org/10.1093/eurheartj/ehv370>.
14. Nordestgaard BG, Chapman MJ, Humphries SE et al. [European Atherosclerosis Society Consensus Panel]. Familial hypercholesterolaemia is under diagnosed and under treated in the general population: guidance for clinicians to prevent coronary heart disease: Consensus Statement of the European Atherosclerosis Society. Eur Heart J 2013; 34(45): 3478–3490a. Dostupné z DOI: <http://dx.doi.org/10.1093/eurheartj/eht273>.
15. Pijlman AH, Huijgen R, Verhagen SN et al. Evaluation of cholesterol lowering treatment of patients with familial hypercholesterolemia: a large cross-sectional study in the Netherlands. Atherosclerosis 2010; 209(1): 189–194. Dostupné z DOI: http://dx.doi.org/10.1016/j.atherosclerosis.2009.09.014>.
16. Perez de Isla L, Alonso R, Watts GF et al. [SAFEHEART Investigators]. Attainment of LDL-cholesterol treatment goals in patients with familial hypercholesterolemia: 5-year SAFEHEART Registry follow-up. J Am Coll Cardiol 2016; 67(11): 1278–1285. Dostupné z DOI: <http://dx.doi.org/10.1016/j.jacc.2016.01.008>.
17. van Aalst-Cohen ES, Jansen AC, Tanck MW et al. Diagnosing familial hypercholesterolaemia: the relevance of genetic testing. Eur Heart J 2006; 27(18): 2240–2246.
18. Watts GF, Gidding S, Wierzbicki AS et al. Integrated guidance on the care of familial hypercholesterolaemia from the International FH Foundation. Int J Cardiol 2014; 171(3): 309–325. Dostupné z DOI: <http://dx.doi.org/10.1016/j.ijcard.2013.11.025>.
19. Santos RD, Gidding SS, Hegele RA et al. [International Atherosclerosis Society Severe Familial Hypercholesterolemia Panel]. Defining severe familial hypercholesterolaemia and the implications for clinical management: a consensus statement from the International Atherosclerosis Society Severe Familial Hypercholesterolemia Panel. Lancet Diabetes Endocrinol 2016; 4(9): 850–861. Dostupné z DOI: <http://dx.doi.org/10.1016/S2213–8587(16)30041–9>.
20. Khera AV, Won HH, Peloso GM et al. Diagnostic Yield and Clinical Utility of Sequencing Familial Hypercholesterolemia Genes in Patients With Severe Hypercholesterolemia. J Am Coll Cardiol 2016; 67(22): 2578–2589. Dostupné z DOI: <http://dx.doi.org/10.1016/j.jacc.2016.03.520>.
21. Talmud PJ, Shah S, Whittall R et al. Use of low-density lipoprotein cholesterol gene score to distinguish patients with polygenic and monogenic familial hypercholesterolaemia: a case-control study. Lancet 2013; 381(9874): 1293–1301. Dostupné z DOI: <http://dx.doi.org/10.1016/S0140–6736(12)62127–8>
22. Futema M, Plagnol V, Li K et al. Whole exome sequencing of familial hypercholesterolaemia patients negative for LDLR/APOB/PCSK9 mutations. J Med Genet 2014; 51(8): 537–544. Dostupné z DOI: <http://dx.doi.org/10.1136/jmedgenet-2014–102405>.
23. Norsworthy PJ, Vandrovcova J, Thomas ER et al. Targeted genetic testing for familial hypercholesterolaemia using next generation sequencing: a population-based study. BMC Med Genet 2014; 15 : 70. Dostupné z DOI: <http://dx.doi.org/10.1186/1471–2350–15–70>.
24. Freiberger T, Vrablík M. 15 let projektu MedPed v České republice. Hypertenze a kardiovaskulární prevence 2013; 2(5): 58–60.
25. Watts GF, Ding PY, George P et al. Translational Research for Improving the Care of Familial Hypercholesterolemia: The “Ten Countries Study” and Beyond. J Atheroscler Thromb 2016; 23(8): 891–900. Dostupné z DOI: <http://dx.doi.org/10.5551/jat.35949>.
26. O‘Brien EC, Roe MT, Fraulo ES et al. Rationale and design of the familial hypercholesterolemia foundation Cascade Screening for Awareness and DEtection of Familial Hypercholesterolemia registry. Am Heart J 2014; 167(3): 342–349. e17. Dostupné z DOI: <http://dx.doi.org/10.1016/j.ahj.2013.12.008>.
27. Ceska R et al. ScreenPro FH – Screening Project for Familial Hypercholesterolemia in Central, Southern and Eastern Europe: Rationale and Design. Submitted. Dostupné z WWW: <http://screenprofh.com/>.
Labels
Diabetology Endocrinology Internal medicine
Article was published inInternal Medicine

2016 Issue 11-
All articles in this issue
- Hypertenze a hypercholesterolemie v české populaci
- Genetická determinace dyslipidemií – co přinesly výsledky celogenomových screeningů a další směry výzkumu
- Molekulární genetika hypercholesterolemie
- Hyperlipoproteinemie u dětí
- Hyperlipoproteinemie a dyslipidemie jako vzácná onemocnění: diagnostika a léčba
- Léčba těžké familiární hypercholesterolemie
- Jak zvládat ošklivá dvojčata, LDL-cholesterol a lipoprotein (a)
- Diabetes a dyslipidémia: prečo majú k sebe tak blízko?
- Dieta při dyslipidemii a metabolickém syndromu
- Kyselina močová jako rizikový faktor kardiovaskulárních onemocnění
- Familiární hypercholesterolemie v České republice v roce 2016
- Komentář ke studii HOPE-3
- Studie SPRINT – co přinesla nejvýznamnější studie posledního období v oblasti hypertenze
- Internal Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Dieta při dyslipidemii a metabolickém syndromu
- Hyperlipoproteinemie u dětí
- Hyperlipoproteinemie a dyslipidemie jako vzácná onemocnění: diagnostika a léčba
- Kyselina močová jako rizikový faktor kardiovaskulárních onemocnění
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

