-
Medical journals
- Career
Funkční hypotalamická amenorea
Authors: Luboslav Stárka; Michaela Dušková
Authors‘ workplace: Endokrinologický ústav Praha, ředitelka doc. RNDr. Běla Bendlová, CSc.
Published in: Vnitř Lék 2015; 61(10): 882-885
Category: Reviews
Overview
Funkční hypotalamická amenorea (FHA) je vedle gravidity a syndromu polycystických ovarií nejčastější formou sekundární amenorey. FHA je důsledkem poruch v pulzní sekreci gonadoliberinu (GnRH), které pak vedou k poruše sekrece gonadotropinů FSH a LH. FHA je obranou organizmu v situacích ohrožujících životní funkce, které jsou chráněny pak přednostně před funkcí rozmnožovací. FHA je reverzibilní, po ukončení extrémní zátěže se zvolna sama může upravit. Uvádějí se 3 hlavní typy funkční amenorey: FHA se vztahem k úbytku hmotnosti, FHA v důsledku stresu a se vztahem k nadměrnému fyzickému výkonu. Konečným výsledkem jsou komplexní hormonální změny charakterizované hlubokou hypoestrogenemií. Vedle nízkých estrogenů tyto pacientky mají mírnou hyperkortizolemii, nízké hladiny inzulinu v séru, nízký IGF1 a nízký celkový trijodtyronin. Zdraví těchto žen je ohroženo ve více směrech, včetně stavu kostí, kardiovaskulárního systému a stavu mentálních funkcí. Pacientky mají sníženou kostní denzitu a jsou pak ohroženy zvýšeným rizikem fraktur. Osteopenie a osteoporóza jsou hlavní dlouhodobou komplikací FHA. Kardiovaskulární komplikace spočívají v dysfunkci endotelu a změnách v lipidogramu. Pacientky s funkční hypotalamickou amenoreou trpí častěji depresemi a úzkostmi a také problémy v sexuální oblasti než zdravé ženy.
Klíčová slova:
cvičení – hypogonadotropní hypoestrinizmus – osteoporóza – poruchy příjmu potravy – sekundární amenorea – stres – úbytek hmotnostiÚvod
Sekundární amenorea definovaná jako alespoň 3měsíční absence menstruačního krvácení postihuje 2–5 % dospělých žen v reprodukčním věku. Příčiny amenorey jsou rozmanité a jejich nadpoloviční část je spojena s poruchou velmi sofistikované souhry hormonů a dalších faktorů, která vede k pulzní sekreci gonadoliberinu (GnRH). Je-li narušena vhodná frekvence nebo amplituda této sekrece, je postižena i sekrece gonadotropinů LH (luteinizační hormon) a FSH (folikuly stimulující hormon) hypofýzou a následně sekrece estradiolu ovarii. Takový stav se označuje jako hypotalamická amenorea. Hypotalamickou amenoreu dále rozdělujeme na stavy s organickými příčinami a stavy bez zřejmé organické příčiny. K prvé skupině patří např. Kallmanův syndrom, izolovaný nedostatek gonadotropinů, nádory hypofýzy, Sheehanův syndrom, apoplexie nebo aneuryzma hypofýzy, syndrom prázdné selly, nepřiměřená sekrece prolaktinu, infekce (např. tuberkulóza), trauma hlavy nebo postiradiační stavy. Amenoreu v důsledku hypotalamo-hypofyzární poruchy bez organické příčiny pak někteří autoři [13] dále rozdělují tak, jak je uvedeno v tab.
Table 1. Rozdělení hypotalamické amenorey 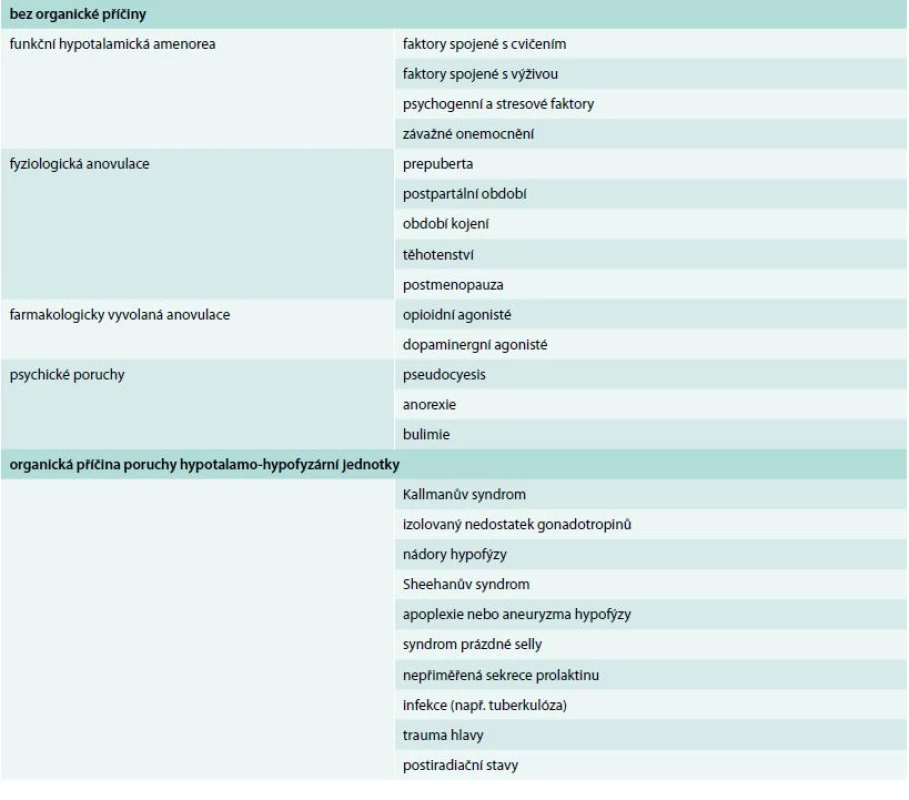
Funkční hypotalamická amenorea
Speciální skupinou je funkční hypotalamická amenorea (FHA). Vedle těhotenství a syndromu polycystických ovarií je FHA nejčastější příčinou zástavy menstruačního cyklu. Je vyvolána těžkou zátěží organizmu a má 3 základní etiologické příčiny – psychický nebo fyzický stres, nadměrné cvičení, energetický deficit např. při ztrátě hmotnosti (energetický deficit může však být nezávislý na tělesné hmotnosti) nebo kombinace těchto příčin. Takto indukovaná amenorea je nejčastější formou sekundární amenorey a je fyziologickou odezvou na podvýživu, nadměrnou námahu, těžký emoční stres nebo závažné chronická onemocnění. Jako funkční ji označujeme proto, že je adaptivní reakcí na situaci, která nutí organizmus k uchování energetických zdrojů potřebných pro přežití na úkor energeticky náročných dějů nutných pro reprodukci [6].
Funkční hypotalamická amenorea (FHA) je tedy definována jako neorganická a reverzibilní porucha výdeje gonadoliberinu vedoucí k hypoestrinnímu hypogonadizmu. Paleta poruch sekrece gonadoliberinu a LH je značně pestrá: snížená frekvence pulzů LH, úplná ztráta pulzního charakteru sekrece LH, zvýšená frekvence LH pulzů nebo dokonce zdánlivě normální sekreční vzor. Ve fyziologickém řízení sekrece GnRH (gonadotropin-releasing hormone/gonadotropiny uvolňující hormon) hrají roli četné neuropeptidy, neurotransmitery a neurosteroidy a přesný mechanizmus jejich souhry není zcela jasný. Pozornost na sebe upoutaly látky jako allopregnanolon, neuropeptid Y, kortikoliberin, leptin, ghrelin, β-endorfin nebo melatonin. I kdyby hladiny všech těchto látek byly v pořádku, může váznout synchronizace jejich působení. Na modulaci sekrece gonadoliberinu pak působí ještě další faktory, jako je pubertální zrání, změny v energetické rovnováze, tělesné složení, stres a emoce [14].
Hormonální poruchy asociované s FHA
Klíčovou roli v patologii FHA hraje porucha sekrece gonadoliberinu a jejím důsledkem je nedostatečná sekrece estrogenů ovarii. Při tom může být postižena i sekrece dalších hypotalamo-hypofyzárních působků. Typická je aktivace osy hypotalamus-hypofýza-nadledviny v důsledku stresu – ta je pak dalším patogenním faktorem FHA. Kortikoliberin (CRH) se zvyšuje v stresových situacích a jak bylo potvrzeno na řadě modelů, blokuje sekreci gonadoliberinu na hypotalamové úrovni [13,14]. Zvýšení sekrece kortikoliberinu vede ke zvýšení sekrece ACTH (adrenokortikotropní hormon) hypofýzou a kortizolu nadledvinami. Na rozdíl od glukokortikoidů, androgeny jak adrenálního, tak gonadálního původu bývají sníženy. U pacientů s FHA je také často zjišťována porucha osy hypotalamus-hypofýza-štítná žláza. Hladiny tyreotropinu jsou normální nebo snížené, zvýšena je hladina reverzního trijodtyroninu a snížena hladina trijodtyroninu podobně jako je tomu u „euthyroid sick syndromu“ u chronicky nemocných nebo hladovění [7]. K dalším možným nálezům u FHA patří někdy zvýšená noční sekrece růstového hormonu a nižší celková denní sekrece prolaktinu. U FHA bývá většinou nižší hladina inzulinu a IGF1 (inzulinu podobný růstový faktor/insulin-like growth factor) a zvýšená inzulinová citlivost.
Do komplexního mechanizmu patogeneze FHA vstupují kromě klasických hormonů i četné neuropeptidy, neurotransmitery a neurosteroidy, jako jsou kisspeptin, neuropeptid Y, ghrelin, leptin, melatonin, β-endorfin nebo allopregnanolon.
Klinické důsledky FHA
Na rozdíl od amenorey nelze funkční hypotalamickou amenoreu považovat za pouhý symptom. Její klinický dopad je mnohem hlubší než prostá porucha cyklu. Protože konečným výsledkem poruchy pulzní sekrece gonadoliberinu a gonadotropinů je hypoestrinizmus, má nedostatečné zásobení estrogeny negativní vliv na další stránky ženského zdraví, jako je kostní metabolizmus, kardiovaskulární systém, sexuální život nebo psychika. Navíc jsou další hormonální nepravidelnosti průvodním jevem kauzálních faktorů FHA, tj. stresu a negativní energetické rovnováhy. Pacientky s delším trváním hypotalamové amenorey mívají osteopenii nebo osteoporózu a následně zvýšené riziko fraktur. Kardiovaskulární komplikace spočívají v endoteliální dysfunkci a změnách profilu lipidů. Pacientky s FHA mají častěji než zdravé ženy sklon k depresím a úzkosti a mají častěji problémy v sexuálním životě [5]. Proto déletrvající funkční amenorea může mít neblahý vliv na celkové zdraví postižených žen [14].
Vyvolávající příčiny FHA
Dlouho známou příčinou FHA je nadměrné cvičení anebo jiná fyzická zátěž, jak je tomu u atletek [1,9,11,15,16] nebo u baletek [20], u nichž je často fyzická zátěž spojena se snahou udržet nižší tělesnou hmotnost. U atletek se někdy píše o „atletické triádě“, která představuje vzájemné propojení nepřiměřeně nízkého energetického příjmu, menstruační dysfunkce a snížené kostní denzity [8]. Objevuje se v některých druzích sportu, zejména u vytrvalostních disciplín, gymnastice a baletu. Zda se u konkrétní atletky za jinak stejných podmínek vyvine FHA nebo ne, rozhodují také genetické predispozice nebo metabolické odchylky připomínající syndrom polycystických ovarií [4]. Jinou poměrně častou příčinou FHA v důsledku negativní energetické bilance je anorexie nebo bulimie, ale i přílišné hubnutí z jiných příčin. Kromě známek FHA se zde uplatňuje i snížená hladina leptinu [19] nebo snížená aktivita inzulinu a IGF1 [12]. Příčinou FHA může být také psychický stres [10]. Jisté psychopatologické rysy mají i pacientky s FHA spojenou s tělesnou zátěží nebo poruchami příjmu potravy, např. zvýšenou sociální nejistotu, introverzi, tendenci k depresím, neúměrný důraz na dietu apod [3].
Vyšetření
Hypogonadotropní hypogonadizmus, který patří k FHA, není příliš specifickým příznakem, proto diagnózu funkční hypotalamické amenorey je třeba učinit per exclusionem. Vyloučit je třeba organické poškození osy hypotalamus-hypofýzy-ovarium i další příčiny amenorey, hyperandrogenemii, hypotyreózu, u primární amenorey testikulární feminizaci nebo neperforovaný hymen. U adolescentek je někdy obtížné rozpoznat, zda jde o FHA nebo o opožděnou menarche [2]. V anamnéze je důležité zjistit, jak se vyvíjela tělesná hmotnost, jaké jsou jídelní zvyklosti pacientky, jaká je její fyzická zátěž nebo zda nemá psychickou zátěž nebo trauma nebo zda užívá psychofarmaka nebo hormonální antikoncepci. Vyšetřením androgenů je možno vyloučit další častou příčinu sekundární amenorey, kterou je syndrom polycystických ovarií. Nedostatek estrogenů kromě laboratorního vyšetření lze prokázat negativním progesteronovým provokativním testem. Z laboratorních nálezů je charakteristická normální nebo nízká hladina FSA a LH navzdory hypoestrinizmu.
Léčba
Kauzální léčbou FHA je náprava fyzické nebo psychické zátěže anebo nedostatečného energetického příjmu. Uvádí se, že k obnovení menstruačního krvácení se při poruchách příjmu potravy dochází při dosažení hmotnosti o 2 kg vyšší, než byla hmotnost v době ztráty cyklu. Ke změně životního stylu, který by tuto nápravu zajistil, je často třeba psychologické podpory psychoterapií [3] nebo i např. hypnózou [17]. Fertilita může být léčena podáváním gonadotropinů nebo pulzního gonadoliberinu nebo s omezeným úspěchem někdy klomifenem, léčba plodnosti sama nemusí však vést k úpravě všech řídících hypotalamových funkcí. To pak může vyústit do porodních, fetálních nebo neonatálních komplikací. Podaří-li se behaviorální nebo psychologickou intervencí odstranit vyvolávající příčinu FHA, pak plné endokrinní zotavení zajistí lépe zdraví matky i dítěte [2].
U FHA trvající déle než rok nebo u BMI pod 18 kg/m2 je třeba vždy zkontrolovat minerálovou kostní denzitu a také její snížení léčit. Podávání estrogenů ve formě hormonální antikoncepce většinou u FHA není dostatečnou podporou kostní reparace. Hormonální náhrada u podvyživených pacientek nemá na kostní metabolizmus výraznější vliv. Příliš se u FHA nedoporučuje ani použití bisfosfonátů (pro jejich dlouhodobé uložení v kosti a možný teratogenní účinek). Podávání dostatečného množství kalciových přípravků (alespoň 1 g/den) a vitaminu D (400–1000 IU/den) je sice namístě, ale nejvhodnějším opatřením je docílit normální jídelní návyky a dostatečný příjem energie odstraněním vyvolávající příčiny [7,18].
Závěr
Funkční hypotalamická amenorea (FHA) je způsobena poruchou sekrece gonadoliberinu jako důsledek situace, která ohrožuje životní funkce organizmu. K jejich zachování se proto odpojují reprodukční funkce. FHA bývá vyvolána nedostatečným energetickým příjmem při nadměrném cvičení, jako je tomu u baletek nebo špičkových atletek, při těžkém psychickém nebo fyzickém stresu, u poruch příjmu potravy, jako je anorexie nebo bulimie, nebo při kombinaci těchto příčin a při těžším chronickém onemocnění. Po endokrinní stránce představuje FHA stav hypogonadotropního hypoestrinizmu, ale kromě osy hypotalamus-hypofýza-ovaria jsou postiženy i další endokrinní systémy. Protože FHA je reverzibilním stavem, je nejvhodnější léčbou odstranění negativních příčin. Při hypoestrinizmu trvajícím déle než rok je třeba léčebně dbát o udržení normální kostní denzity.
Práce vznikla v rámci řešení grantu IGA MZ ČR č. NT 12340–5.
Doručeno do redakce 30. 6. 2015
Přijato po recenzi 25. 9. 2015
prof. MUDr. et RNDr. Luboslav Stárka, DrSc.
lstarka@endo.cz
Endokrinologický ústav, Praha
www.endo.cz
Sources
1. Barrack MT, Ackerman KE, Gibbs JC. Update on the female athlete triad. Curr Rev Musculoskelet Med 2013; 6(2): 195–204.
2. Berga SL, Loucks TL. The diagnosis and treatment of stress-induced anovulation. Minerva Ginecol 2005; 57(1): 45–54.
3. Bomba M1, Corbetta F, Bonini L et al. Psychopathological traits of adolescents with functional hypothalamic amenorrhea: a comparison with anorexia nervosa. Eat Weight Disord 2014; 19(1): 41–48.
4. Caronia LM, Martin C, Welt CK et al. A genetic basis for functional hypothalamic amenorrhea. N Engl J Med 2011; 364(3): 215–225.
5. Dundon CM, Rellini AH, Tonani S et al. Mood disorders and sexual functioning in women with functional hypothalamic amenorrhea. Fertil Steril 2010; 94(6): 2239–2243.
6. Fourman LT, Fazeli PK. Neuroendocrine causes of amenorrhea – an update. J Clin Endocrinol Metab 2015; 100(3): 812–824.
7. Gordon MC. Functional hypothalamic amenorhea. N Engl J Med 2010; 363(4): 365–371.
8. Horn E, Gergen N, McGarry KA. The female athlete triad. R I Med J 2014; 97(11): 18–21.
9. Javed A, Kashyap R, Lteif AN. Hyperandrogenism in female athletes with functional hypothalamic amenorrhea: a distinct phenotype. Int J Womens Health 2015; 7 : 103–111. Dostupné z DOI: <http://dx.doi.org/10.2147/IJWH.S73011>.
10. Lachowsky M, Winaver D. Psychogenic amenorrhea. Gynecol Obstet Fertil 2007; 35(1): 45–48.
11. Lambrinoudaki I, Papadimitriou D. Pathophysiology of bone loss in the female athlete. Ann N Y Acad Sci 2010; 1205 : 45–50..
12. Laughlin GA, Dominguez CE, Yen SS. Nutritional and endocrine-metabolic aberrations in women with functional hypothalamic amenorrhea. J Clin Endocrinol Metab 1998; 83(1): 25–32.
13. Liu JH, Patel B. Central Causes of Amenorrhea. In: De Groot LJ, Beck-Peccoz P et al (eds). Endotext. South Dartmouth (MA): MDText.com, Inc: 2000-. Dostupné z WWW: <http://www.endotext.org/>.
14. Meczekalski B, Katulski K, Czyzyk A et al. Functional hypothalamic amenorrhea and its influence on women‘s health. J Endocrinol Invest 2014; 37(11): 1049–1056.
15. Misra M. Neuroendocrine mechanisms in athletes. Handb Clin Neurol 2014; 124 : 373–386.
16. O‘Donnell E, Goodman JM, Harvey PJ. Clinical review: Cardiovascular consequences of ovarian disruption: a focus on functional hypothalamic amenorrhea in physically active women. J Clin Endocrinol Metab 2011; 96(12): 3638–3648.
17. Tschugguel W, Berga SL. Treatment of functional hypothalamic amenorrhea with hypnotherapy. Fertil Steril 2003; 80(4): 982–985.
18. Vescovi JD, Jamal SA, De Souza MJ. Strategies to reverse bone loss in women with functional hypothalamic amenorrhea: a systematic review of the literature. Osteoporos Int 2008; 19(4): 465–478.
19. Warren MP, Voussoughian F, Geer EB et al. Functional hypothalamic amenorrhea: hypoleptinemia and disordered eating. J Clin Endocrinol Metab 1999; 84(3): 873–877.
20. Warren MP, Brooks-Gunn J, Fox RP et al. Osteopenia in exercise-associated amenorrhea using ballet dancers as a model: a longitudinal study. J Clin Endocrinol Metab 2002; 87(7): 3162–3168
Labels
Diabetology Endocrinology Internal medicine
Article was published inInternal Medicine

2015 Issue 10-
All articles in this issue
- Incidentalom nadledviny
- Adrenální insuficience
- Štítná žláza a gravidita – souhrn důležitých poznatků
- Léčba hypotyreózy a hypertyreózy
- Subklinické tyreopatie
- Chronická lymfocytární tyreoiditida a karcinom štítné žlázy
- Funkční hypotalamická amenorea
- Syndrom polycystických ovarií
- Novinky v diagnostice a léčbě MEN1
- Akromegalie: současný pohled
- Systémová léčba glukokortikoidy: praktický pohled
- Internal Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Funkční hypotalamická amenorea
- Systémová léčba glukokortikoidy: praktický pohled
- Incidentalom nadledviny
- Adrenální insuficience
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

