-
Medical journals
- Career
Léčba dospělých pacientů s akutní lymfoblastickou leukemií dle protokolu GMALL 07/ 2003 a její výsledky – první zkušenosti v České republice
Authors: F. Folber 1; C. Šálek 2; M. Doubek 1; J. Soukupová Maaloufová 2; T. Valová 3; J. Trka 3; N. Gökbuget 4; J. Vydra 5; T. Kozák 5; J. M. Horáček 6; P. Žák 6; P. Cetkovský 2; D. Hoelzer 4; J. Mayer 1
Authors‘ workplace: Interní hematoonkologická klinika Lékařské fakulty MU a FN Brno, pracoviště Bohunice, přednosta prof. MU Dr. Jiří Vorlíček, CSc. 2Klinický úsek Ústavu hematologie a krevní transfuze Praha, přednosta doc. MU Dr. Petr Cetkovský, Ph. D. 3Childhood leukaemia 1
Published in: Vnitř Lék 2010; 56(3): 176-182
Category: Original Contributions
Overview
Úvod:
V této analýze prezentujeme dvouleté zkušenosti s léčbou akutní lymfoblastické leukemie dospělých (ALL) dle protokolu německé studie GMALL 07/ 2003 na hematologických pracovištích skupiny CELL (Česká leukemická skupina – pro život).Metody:
Do analýzy bylo zařazeno celkem 37 pacientů. Hodnotili jsme dosažení kompletní a molekulární remise, výskyt relapsu a stav pacientů na konci sledovaného období. Byl sledován výskyt nežádoucích účinků po jednotlivých cyklech chemoterapie a příčiny úmrtí. Byla provedena statistická analýza rizikových faktorů ovlivňujících přežití pacientů.Výsledky:
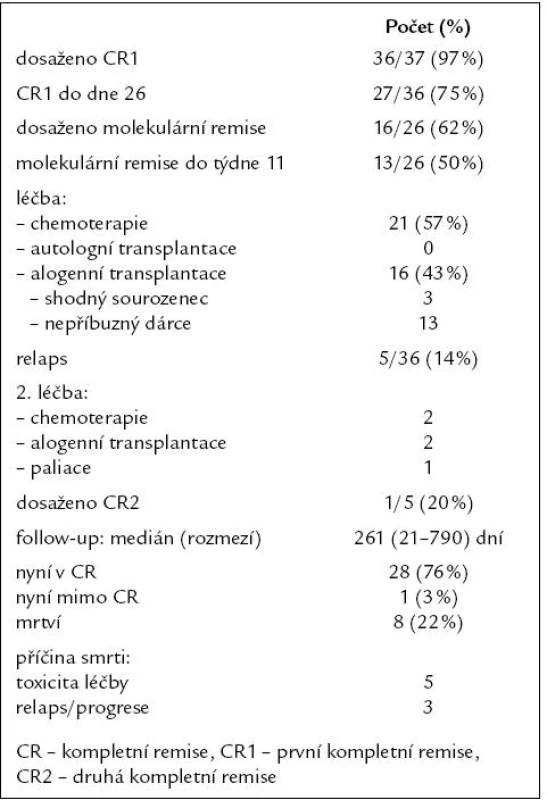
Kompletní remise bylo dosaženo u 36 (97 %) pacientů, molekulární remise u 16 (62 %) z 26 vyšetřitelných pacientů. Relaps onemocnění byl pozorován u 5 (14 %) pacientů. Na konci období sledování s mediánem 261 dní bylo 28 (76 %) pacientů živých v kompletní remisi, jeden (3 %) s relabovaným onemocněním a 8 (22 %) zemřelo. Příčinou smrti byla v 5 případech toxicita léčby a u 3 pacientů relaps či progrese ALL. Nežádoucí účinky léčby následovaly nejčastěji po 1. konsolidaci, 1. fázi indukce, 2. konsolidaci a 2. fázi indukce. Šlo většinou o infekční komplikace v rámci febrilní neutropenie, mukositidu gastrointestinálního traktu a nežádoucí účinky PEG ‑ asparaginázy. Toxicita alogenní transplantace byla obvyklá, 4 (25 %) pacienti po transplantaci zemřeli. Dvouleté přežití bez progrese bylo 66 %, dvouleté celkové přežití 70 %. Jako prognosticky nepříznivé rizikové faktory byly identifikovány vysoké riziko, věk pacientů nad 35 let, infiltrace CNS, relaps onemocnění a přetrvávající pozitivita minimální zbytkové nemoci. V diskuzi dále popisujeme praktické zkušenosti a možná úskalí tohoto protokolu.Závěr:
Naše počáteční zkušenosti jsou pozitivní. Léčba je proveditelná, dosavadní výsledky velmi dobré a toxicita přijatelná. Pacienti s vysokým rizikem by měli být směřováni k alogenní transplantaci, jelikož výsledky samotné konsolidační chemoterapie jsou v této skupině velmi špatné. Myslíme si, že tento léčebný protokol by se mohl stát standardem léčby akutní lymfoblastické leukemie dospělých v České republice.Klíčová slova:
akutní lymfoblastická leukemie – dospělí – chemoterapie – transplantace krvetvorných buněk – nežádoucí účinky – rizikové faktory – studie GMALL 07/ 2003Za podpory CELL (Česká leukemická skupina – pro život, www.leukemia - cell.org)
Úvod
Výsledky léčby akutní lymfoblastické leukemie (ALL) dospělých jsou stále neuspokojivé. I přes vysoké procento dosažených kompletních remisí (CR) přesahující 80 % [1] a použití moderních léčebných protokolů [2] se dlouhodobé přežití pohybuje pouze okolo 40 % [3,4]. Tento nedostatek se snaží napravit intenzifikace postremisní léčby, částečně inspirovaná protokoly pro léčbu pediatrických pacientů [5,6]. Podstata ALL dospělých se však od dětí liší, mimo logicky vyššího věku pacientů s komorbiditami je provázena i častějším výskytem cytogenetických a molekulárně genetických změn, spojených s vyšším rizikem a horšími léčebnými výsledky [7].
V této analýze prezentujeme první zkušenosti s léčbou ALL dospělých na hematologických pracovištích v České republice, která v rámci České leukemické skupiny – pro život (CELL) aktivně spolupracují s Evropskou pracovní skupinou pro léčbu ALL (EWALL) a Německou pracovní skupinou pro léčbu ALL (GMALL).
Metody
Do této analýzy byli zařazeni všichni pacienti léčení dle protokolu GMALL 07/ 2003 na našich pracovištích v letech 2006 – 2008. Jedná se o mezinárodní multicentrickou studii fáze 4 s cí-lem zlepšení bezpříznakového a celkového přežití pacientů s ALL a sledování minimální zbytkové nemoci.
Po splnění vstupních kritérií (potvrzení diagnózy ALL, věk 18 – 65 let, podepsaný informovaný souhlas) je léčba zahájena prefází a první a druhou fází indukční chemoterapie. U pacientů se zjištěnou bcr/ abl pozitivitou je již od 1. dne přidán k chemoterapii imatinib v dávce 600 mg/ den [8]. V případě nálezu více než 20 % CD20+ blastů je k indukční a 1. konsolidační chemoterapii přidán rituximab. Společně s 2. fází indukce je provedeno profylaktické ozáření lebky. U všech pacientů následuje první konsolidační chemoterapie.
Do skupiny standardního rizika (SR)jsou zařazeni pacienti s B-ALL, kteří mají vstupně méně než 30 × 109/ l leukocytů a dosáhli CR do 26. dne indukční chemoterapie, a pacienti s thymocytární T-ALL. Jako vysoké riziko (HR) jsou klasifikováni pacienti s B-ALL, kteří mají vstupně více než 30 × 109/ l leukocytů nebo dosáhli CR po 26. dni indukční chemoterapie nebo mají pro B-ALL nebo pozitivitu MLL, a ostatní pacienti s T-ALL. Velmi vysoké riziko (VHR) pak značí bcr/ abl pozitivní ALL. U pacientů HR a VHR následuje po 1. konsolidaci alogenní transplantace krvetvorby. Pokud není dostupný dárce, pokračuje léčba druhou, intenzivní konsolidací a autologní transplantací, nebo dalšími konsolidacemi stejně jako v případě SR. Během celé indukční a konsolidační léčby probíhá intratékální profylaxe infiltrace centrálního nervového systému (CNS) [9] a monitorace minimální zbytkové nemoci (MRD). V případě přetrvávající pozitivity MRD před 1. konsolidační chemoterapií jsou pacienti standardního rizika přeřazeni do větve HR a směřováni k alogenní transplantaci.
Léčba je ukončena po transplantaci krvetvorby nebo při setrvalé negativitě MRD po 6. konsolidační chemoterapii. Průběh léčebného protokolu ilustruje obr. 1. Protokol na přání pracovní skupiny GMALL nepublikujeme v plném znění, pro zájemce je k dispozici u autorů práce.
Obr. 1. Léčebný protokol GMALL 07/2003. 
Vzorky k vyšetření MRD jsou dle písemné dohody s centrálou studie GMALL zpracovány v akreditované laboratoři Childhood leukaemia investigation Prague (CLIP) FN Motol Praha [10].
Hodnocení výsledků léčby zahrnovalo procento dosažených kompletních a molekulárních remisí, výskyt relapsů a stav pacientů na konci sledovaného období. Molekulární remise je definována jako pokles sledovaného molekulárně genetického markeru (přestavba IgH/ TCR nebo bcr/ abl) pod 10–4, tedy jako jeho přítomnost v méně než 1/ 10 000 z celkového počtu alespoň 5 milionů vyšetřených buněk periferní krve nebo kostní dřeně [10].
Dále jsme sledovali výskyt nežádoucích účinků po jednotlivých částech chemoterapie dle CTCAE NCI verze 3 (Common Terminology Criteria for Adverse Events, National Cancer Institute) a příčiny úmrtí. Byla též provedena statistická analýza vlivu rizikových faktorů na sledované parametry přežití dle Kaplan-Meiera v různých skupinách pacientů, a to jak na přežití bez progrese onemocnění (PFS; doba od data diagnózy do progrese, relapsu nebo úmrtí), tak na celkové přežití (OS; doba od data diagnózy do úmrtí z jakékoliv příčiny).
Výsledky
Od října roku 2006 do prosince roku 2008 bylo léčeno celkem 37 pacientů s průměrným věkem 39 let v době diagnózy. Do skupiny standardního rizika bylo zařazeno 17 (46 %) pacientů, 11 (30 %) do vysokého rizika a 9 (24 %) do skupiny s velmi vysokým rizikem. Postižení centrálního nervového systému bylo pomocí cytologie a imunofenotypizace diagnostikováno u 4 (11 %) pacientů. Extramedulární infiltrace byla zjištěna u 6 (16 %) pacientů (5krát mediastinální lymfadenopatie, 1krát infiltrace Waldayerova mízního okruhu). Vstupní charakteristika pacientů je uvedena v tab. 1.
Table 1. Vstupní charakteristika pacientů. 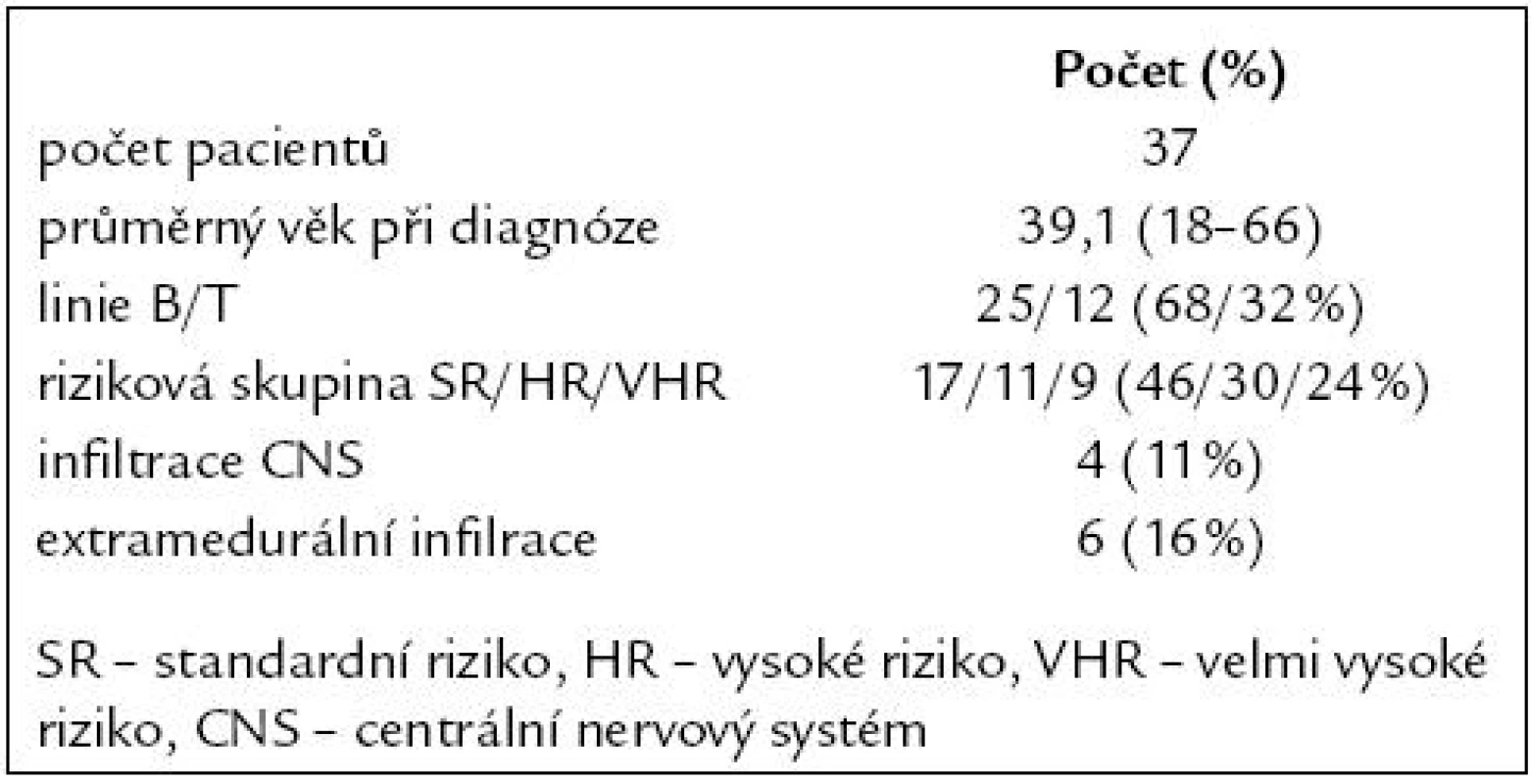
První kompletní remise (CR1) bylo dosaženo u 36 (97 %) pacientů, pouze ve 27 případech (75 %) však do 26. dne od zahájení indukční chemoterapie. Molekulární remise onemocnění bylo dosaženo u 16 (62 %) z 26 vyšetřitelných a sledovatelných pacientů, u 13 (50 %) k ní došlo do 11. týdne léčby. Postremisní léčba obsahovala u 21 (57 %) pacientů pouze konsolidační chemoterapii, autologně nebyl transplantován žádný pacient, alogenní transplantaci krvetvorby podstoupilo 16 (43 %) pacientů (dárcem byl 3krát shodný sourozenec a 13krát nepříbuzný dárce). Relaps onemocnění po dosažení CR1 byl pozorován u 5 (14 %) pacientů, pouze u 1 (20 %) z nich však bylo dosaženo 2. kompletní remise (CR2). Na konci období sledování s mediánem 261 dní bylo 28 (76 %) pacientů živých v kompletní remisi, 1 (3 %) mimo CR (relaps onemocnění na paliativní léčbě) a 8 (22 %) zemřelo. Příčinou smrti byla v 5 případech toxicita léčby a u 3 pacientů relaps či progrese ALL. Kompletní výsledky léčby jsou uvedeny v tab. 2.
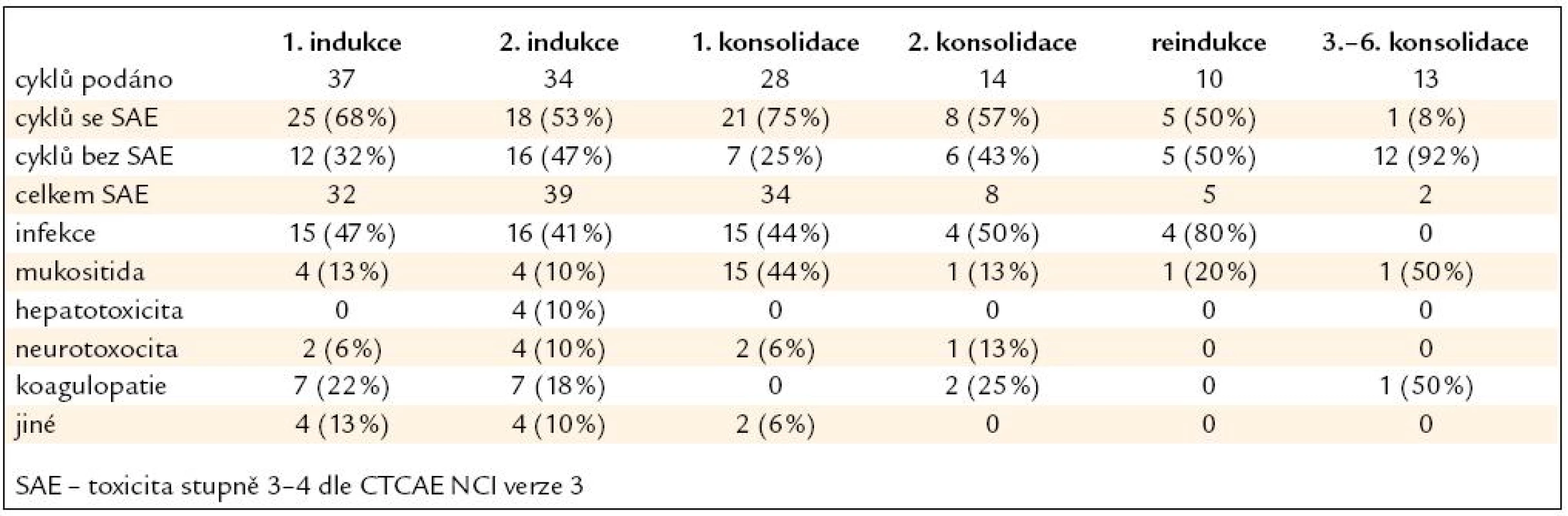
Nežádoucí účinky léčby následovaly nejčastěji po 1. konsolidaci (75 % podaných cyklů), 1. fázi indukce (68 % cyklů), 2. konsolidaci (57 % cyklů) a 2. fázi indukce (53 % cyklů). Šlo většinou o infekční komplikace v rámci febrilní neutropenie, mukositidu gastrointestinálního traktu (GIT) a nežádoucí účinky PEG-asparaginázy (hepatotoxicita, neurotoxicita, koagulopatie). Výskyt toxicity po jednotlivých součástech léčby je uveden v tab. 3 a na obr. 2 a 3. Toxicita alogenní transplantace byla obvyklá, svou kvalitou ani kvantitou nevybočovala z toxicity běžně pozorované na našich pracovištích. 4 (25 %) pacienti po alogenní transplantaci zemřeli, 3 z nich (75 %) v důsledku toxicity související s léčbou.
Obr. 2. Výskyt nežádoucích účinků léčby. 
Obr. 3. Typ nežádoucích účinků léčby. 
Dvouleté přežití bez progrese onemocnění (PFS) činilo v celém souboru 66 %, dvouleté celkové přežití (OS) pak 70 %. Medián přežití nebyl zatím v naprosté většině případů dosažen, po 12. měsíci sledování nebyly zatím zaznamenány žádné relapsy ani úmrtí. Jako statisticky významné prognosticky negativní faktory byly v našem souboru pacientů identifikovány: vysoké riziko (HR), věk pacientů nad 35 let a infiltrace CNS. Dále je patrný trend ke kratšímu přežití, pokud dojde k relapsu onemocnění anebo není dosaženo molekulární remise. Křivky přežití znázorňuje obr. 4.
Diskuze
Po zkušenostech s vlastními protokoly pro léčbu ALL [11 – 13] jsme se na našich pracovištích rozhodli, vzhledem k relativně malému počtu pacientů, použít léčebný protokol velké zahraniční pracovní skupiny s reprodukovatelnými a mezinárodně uznávanými výsledky [14].
Naše počáteční dvouleté zkušenosti jsou v zásadě pozitivní. Léčba je proveditelná a dobře tolerovaná, toxicita zvladatelná a očekávatelná; nejčastěji se jedná o infekční komplikace v rámci febrilní neutropenie, mukositidu GIT po metotrexátu a nežádoucí účinky PEG-asparaginázy. Přidání imatinibu k asparagináze nevedlo ke zvýšenému výskytu jejích nežádoucích účinků, čehož se některé zahraniční pracovní skupiny (PETHEMA, GRALL) obávají.
Léčebné výsledky a zkušenosti našich pracovišť jsou srovnatelné. U některých pacientů byl pozorován vyšší výskyt komplikací po PEG-asparagináze (Oncaspar, Medac), včetně těžké hepatotoxicity a neurotoxicity, mimo jinak běžné koagulopatie, snadno zvladatelné prostou substitucí koagulačních faktorů. Tuto potíž by mohlo vyjasnit plánované měření hladiny asparaginázy [15].
Zaznamenali jsme také problémy se separací periferních kmenových buněk, kdy často dochází k nedostatečnému nebo pozdnímu vyplavení buněk do periferní krve. V některých případech provádíme odběr kostní dřeně z lopat kostí kyčelních v celkové anestezii, jindy se pokoušíme o stimulaci, byť často neúspěšně. V současné době hledáme vhodný postup ke sběru kmenových buněk, abychom se mohli vyhnout odběru dřeňové krve.
Potvrdili jsme předpokládaný vliv známých rizikových faktorů (vyšší věk, riziko, infiltrace CNS, relaps a pozitivita MRD). Zarážející jsou velmi nepříznivé výsledky pacientů s vysokým rizikem (HR). Příčin je pravděpodobně více – již samotná podstata ALL vysokého rizika a z ní plynoucí nutnost intenzifikace konsolidační léčby pomocí transplantace krvetvorných buněk, která s sebou nese zásadní zvýšení morbidity i mortality. V porovnání s celým souborem měli pacienti vysokého rizika vyšší průměrný věk, dosáhli později kompletní remise a méně často molekulární remise a také častěji relabovali, rovněž sem byli zařazeni všichni pacienti, kteří měli při diagnóze zjištěnou infiltraci CNS. Tyto rozdíly překvapivě platí i při srovnání s pacienty velmi vysokého rizika (VHR), kde je však léčba dále intenzifikována v podobě imatinibu a alogenní transplantace provedené u všech pacientů. Pacienti s vysokým rizikem (HR) by tedy měli být léčeni intenzivně a pokud možno směřováni k alogenní transplantaci, jelikož výsledky samotné konsolidační chemoterapie jsou v této skupině velmi špatné [16].
Zásadním problémem, se kterým se setkáváme, je toxicita CNS v průběhu 2. indukčního cyklu, kdy 4 pacienti dospěli do komatózního stavu. Dva z nich byli starší 55 let, u 2 byla vstupně prokázána leukemická infiltrace CNS, stav 2 pacientů si vyžádal 4denní umělou plicní ventilaci. Všichni pacienti po odeznění komatu restituovali nervové funkce ad integrum. Ačkoliv podobné zkušenosti byly referovány z pediatrických pracovišť užívajících protokoly obdobného složení, zůstává příčina námi zaznamenané vysoké CNS toxicity neobjasněna. Toho času jsou uvedené případy konzultovány se studijní centrálou a prozatím byly časově posunuty profylaktické intratékální aplikace cytostatik na dobu po vyloučení potenciálně neurotoxických léčiv podávaných systémově.
K analýze MRD zatím nemáme dostatek dat a dlouhou dobu sledování. Tyto parametry budou hodnoceny jako jedny z hlavních cílů v kontextu celé studie GMALL [17].
Porovnání výsledků s našimi staršími protokoly a daty předchozí studie GMALL 05/ 93 je uvedeno v tab. 4. Stále se však naše ani zahraniční data nemohou srovnávat s úžasnými výsledky v léčbě ALL u dětí, což je jistě velkou výzvou do budoucna.
Table 4. Srovnání s předchozími léčebnými protokoly. 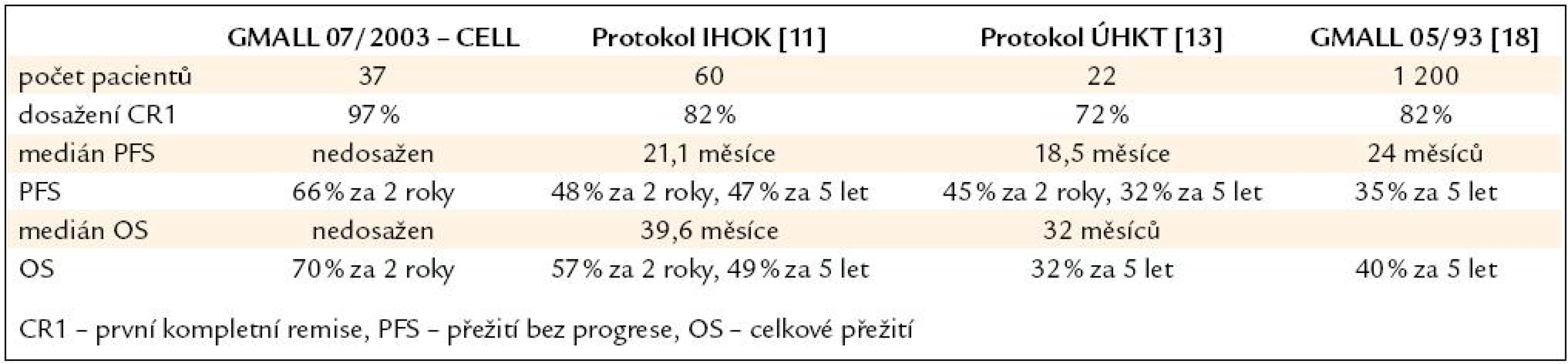
Závěr
Přestože jsme si vědomi krátké doby sledování do běžně dosahovaného mediánu přežití, dosavadní výsledky léčby jsou vynikající a toxicita přijatelná. Zařazování nových pacientů stále probíhá, sledování těch již léčených bude samozřejmě dále pokračovat. Podle našich prvních praktických zkušeností s tímto protokolem si myslíme, že by se mohl stát standardem léčby akutní lymfoblastické leukemie dospělých v České republice i Evropě.
Hematoonkologická centra, která mají zájem léčit pacienty dle této studie, mohou kontaktovat pracovní skupinu CELL.
MUDr. František Folber
www.fnbrno.cz/ihok
e-mail: ffolber@fnbrno.czDoručeno do redakce: 24. 4. 2009
Přijato po recenzi: 10. 12. 2009
Sources
1. Fielding AK, Rowe JM, Richards SM et al. Prospective outcome data on 267 unselected adult patients with Philadelphia ‑ chromosome positive acute lymphoblastic leukaemia confirms superiority of allogeneic transplant over chemotherapy in the pre‑imatinib era: Results from the international ALL trial MRC UKALLXII/ ECOG2993. Blood 2009; 113 : 4489 – 4496.
2. Rowe JM. Optimal management of adults with ALL. Br J Haematol 2009; 144 : 468 – 483.
3. Gökbuget N, Hoelzer D. Treatment of adult acute lymphoblastic leukemia. Semin Hematol 2009; 46 : 64 – 75.
4. Pui CH, Evans WE. Treatment of acute lymphoblastic leukemia. N Engl J Med 2006; 354 : 166 – 178.
5. Huguet F, Leguay T, Raffoux E et al. Pediatric ‑ inspired therapy in adults with Philadelphia chromosome ‑ negative acute lymphoblastic leukemia: the GRAALL ‑ 2003 study. J Clin Oncol 2009; 27 : 911 – 918.
6. Barry E, DeAngelo DJ, Neuberg D et al. Favorable outcome for adolescents with acute lymphoblastic leukemia treated on Dana ‑ Farber Cancer Institute Acute Lymphoblastic Leukemia Consortium Protocols. J Clin Oncol 2007; 25 : 813 – 819.
7. Hoelzer D, Thiel E, Löffler H et al. Prognostic factors in a multicenter study for treatment of acute lymphoblastic leukemia in adults. Blood 1988; 71 : 123 – 131.
8. De Labarthe A, Rousselot P, Huguet ‑ Rigal Fet al. Imatinib combined with induction or consolidation chemotherapy in patients with de novo Philadelphia chromosome ‑ positive acute lymphoblastic leukemia: results of the GRAAPH ‑ 2003 study. Blood 2007; 109 : 1408 – 1413.
9. Pui CH. Central nervous system disease in acute lymphoblastic leukemia: prophylaxis and treatment. Hematology Am Soc Hematol Educ Program 2006 : 142 – 146.
10. van der Velden VH, Cazzaniga G, Schrauder A et al. European Study Group on MRD detection in ALL (ESG ‑ MRD ‑ ALL). Analysis of minimal residual disease by Ig/ TCR gene rearrangements: guidelines for interpretation of real ‑ time quantitative PCR data. Leukemia 2007; 21 : 604 – 611.
11. Doubek M, Mayer J, Kořístek Z et al. Terapie akutní lymfoblastické leukemie dospělých kombinací sedmi chemoterapeutik v indukční léčbě, intenzivní konsolidací s autologní transplatací kmenových buněk krvetvorby nebo bez ní a s následnou udržovací léčbou: zkušenosti jednoho centra. Čas Lék Česk 2002; 141 : 122 – 126.
12. Doubek M, Folber F, Koristek Z et al. Autologous hematopoietic stem cell transplantation in adult acute lymphoblastic leukemia: still not out of fashion. Ann Hematol 2009; 88 : 881 – 887.
13. Linker C, Damon L, Ries C et al. Intensified and shortened cyclical chemotherapy for adult acute lymphoblastic leukemia. J Clin Oncol 2002; 20 : 2464 – 2471.
14. Gökbuget N, Hoelzer D, Arnold R et al. Treatment of Adult ALL according to protocols of the German Multicenter Study Group for Adult ALL (GMALL). Hematol Oncol Clin North Am 2000; 14 : 1307 – 1325.
15. Douer D. Is asparaginase a critical component in the treatment of acute lymphoblastic leukemia? Best Pract Res Clin Haematol 2008; 21 : 647 – 658.
16. Yanada M, Matsuo K, Suzuki T et al. Allogeneic hematopoietic stem Cell transplantation as part of postremission therapy improves survival for adult patients with high‑risk acute lymphoblastic leukemia. Cancer 2006; 106 : 2657 – 2663.
17. Gökbuget N, Raff R, Brügge ‑ Mann M et al. Risk/ MRD adapted GMALL trials in adult ALL. Ann Hematol 2004; 83 (Suppl 1): S129 – S131.
18. Gökbuget N, Hoelzer D. Treatment of adult acute lymphoblastic leukemia. Hematology Am Soc Hematol Educ Program 2006 : 133 – 141.
Labels
Diabetology Endocrinology Internal medicine
Article was published inInternal Medicine

2010 Issue 3-
All articles in this issue
- Nealkoholová steatóza a steatohepatitida – editorial
- Léčba dospělých pacientů s akutní lymfoblastickou leukemií dle protokolu GMALL 07/ 2003 a její výsledky – první zkušenosti v České republice
- Prevalencia markerov poškodenia pečene u pacientov s metabolickými rizikovými faktormi
- Léčba AL‑ amyloidózy – výsledky jednoho pracoviště a přehled publikovaných zkušeností s novými léky (bortezomibem, thalidomidem a lenalidomidem) u AL‑ amyloidózy
- Kombinační léčba hypertenze v běžné klinické praxi. Výsledky studie KOHYBA
- Příspěvek k diferenciální diagnostice chronických břišních bolestí
- Myokardiální dysfunkce v sepsi – charakteristika a patogenetické mechanizmy
- Myokardiální dysfunkce v sepsi – diagnostika a terapie
- Kardiovaskulárne následky po transplantácii kmeňových krvotvorných buniek
- Více než 10 let trvající kompletní remise monoklonální gamapatie nejistého významu a vymizení nefrotického syndromu vzniklého na podkladně light chain deposition disease po léčbě vinkristinem, adriamycinem a vysokými dávkami dexametazonu (VAD)
- Pretrvávajúce symptómy, diastolická dysfunkcia a nízka koronárna rezerva u pacientky po úspešnej korekcii rekoarktácie aorty
- Internal Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Příspěvek k diferenciální diagnostice chronických břišních bolestí
- Pretrvávajúce symptómy, diastolická dysfunkcia a nízka koronárna rezerva u pacientky po úspešnej korekcii rekoarktácie aorty
- Léčba dospělých pacientů s akutní lymfoblastickou leukemií dle protokolu GMALL 07/ 2003 a její výsledky – první zkušenosti v České republice
- Nealkoholová steatóza a steatohepatitida – editorial
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career