-
Medical journals
- Career
Příčina vzniku akutní dysfagie u geriatrické pacientky
Authors: Kamila Šablaturová
Authors‘ workplace: Sanatorium Jih, Ostrava
Published in: Geriatrie a Gerontologie 2021, 10, č. 4: 226-232
Category:
Overview
Kazuistika poukazuje na nezvyklou příčinu akutně vzniklé dysfagie u geriatrické pacientky, u které se manifestovalo onemocnění myasthenia gravis. Práce pojednává o průběhu, diagnostickém procesu a komplikacích, které v tomto případě končí fatálně. Myasthenia gravis postihuje spíše lidi v produktivním věku, z nichž jen malou část invalidizuje. Pokud se objeví u nemocných staršího věku, kteří navíc mají v časném období bulbární a respirační příznaky, mají horší prognózu. Jedná se o chronické autoimunitní onemocnění, které se projevuje kolísající svalovou slabostí a unavitelností kosterního svalstva. Diagnostika se opírá o pečlivě odebranou anamnézu, neurologické vyšetření, zátěžové testy, vyšetření protilátek, elektromyografické vyšetření a další pomocné metody. Léčba je chronická s cílem navození klinické remise.
Klíčová slova:
autoimunitní onemocnění – dysfagie – svalová slabost – myasthenia gravis – acetylcholinový receptor
Úvod
Myasthenia gravis (MG) je chronické autoimunitní onemocnění, které se projevuje kolísající svalovou slabostí a unavitelností kosterního svalstva. Jsou postiženy zejména svaly extraokulární, orofaryngeální, šíjové, pletencové a respirační. V důsledku autoimunitního procesu dochází k zániku funkčních acetylcholinových receptorů na postsynaptické membráně nervosvalové ploténky. Může se objevit v každém věku, 2× větší zastoupení je u žen než u mužů. Choroba postihuje častěji mladé ženy ve 2. až 3. decenniu a starší muže v 6. decenniu. V poslední době narůstá incidence u starších lidí, což je dáno poklesem mortality, lepšími diagnostickými možnostmi a „stárnutím“ populace.(1)
MG patří mezi vzácná onemocnění, nikoli však raritní. Prevalence se pohybuje kolem 240 / 1 milion, incidence cca 21 / 1 milion za rok. Podobně jako u jiných autoimunitních onemocnění frekvence výskytu v populaci stoupá.
Jak již bylo zmíněno, jedná se o chronické autoimunitní onemocnění s tvorbou protilátek proti alfa-podjednotce acetylcholinového receptoru (AChR). Tyto anti-AChR protilátky se nalézají u 80–88 % nemocných s MG, nazývá se tedy séropozitivní MG. Vazbou na receptor způsobují jeho blokádu, vazbou na okolní struktury vedou k degradaci receptoru. Aktivují komplement (zejména složku C5) s následným poškozením receptoru, rozšířením synaptické štěrbiny (molekuly acetylcholinu obtížně dosáhnou receptoru) a změnou vlastností iontových kanálů (viz obr. 1).(5) Asi u poloviny případů séronegativních MG se nacházejí protilátky proti svalově specifické tyrosinkináze (muscle specific kinase – MuSK), jedná se hlavně o protilátky třídy IgG4. MuSK je povrchový transmembránový receptorický protein, který je součástí membrány svalového vlákna a má podstatnou roli pro zabudování AChR do postsynaptické membrány nervosvalové ploténky, tzv. clustering (shlukování) AChR.(5,6) Dalším typem jsou anti-Lrp4 protilátky, které patří hlavně do podtříd IgG1 a IgG2. Lrp4 je člen rodiny strukturně příbuzných transmembránových proteinů, které vykonávají různé funkce ve vývoji nervosvalového spojení, včetně signální transdukce a receptorem zprostředkované endocytózy. Lrp4 je specificky exprimován v dobře diferencovaných myotubulech a je soustředěn na nervosvalové ploténce. Extracelulární doména molekuly Lrp4, která slouží jako funkční receptor, je v interakci s agrinem a tato vazba aktivuje MuSK, což vede k tvorbě většiny agregátů obsahujících AChR v junkční oblasti plazmatické membrány.(6) Podíl těchto autoprotilátek u tzv. dvojitě séronegativních pacientů (anti-AChR negat., anti-MuSK negat.) tvoří až 19 % z celkového počtu (obr. 1).
Image 1. Struktura nervosvalové ploténky (upraveno dle www.beverlydoc.com/wp-content/uploads/ 2020/03/Myasthenia-Gravis.jpg) 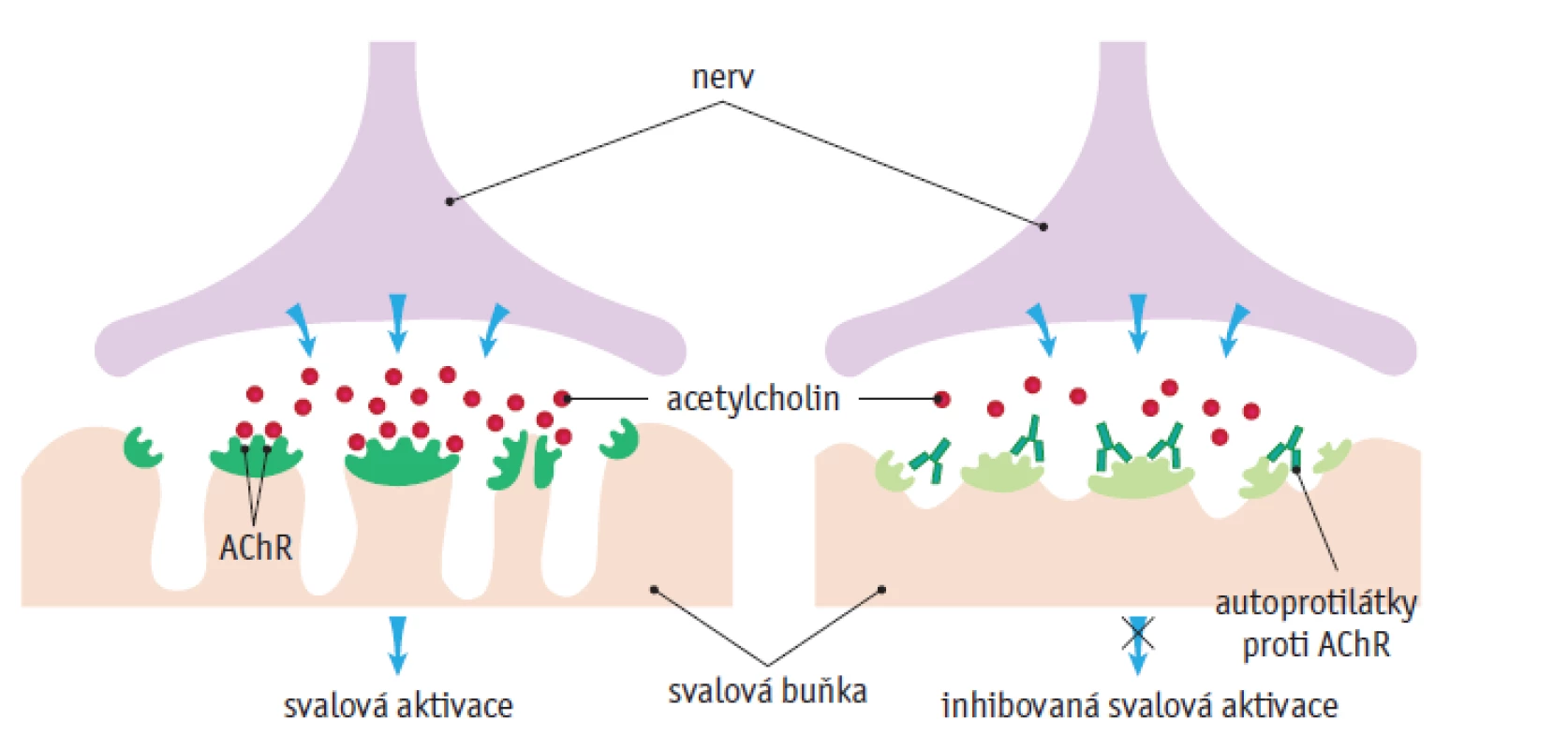
U mladých pacientů (přibližně do 45 let věku) má v patogenezi MG rozhodující význam thymus, kde dochází k folikulární hyperplazii. V thymu se nacházejí tzv. myoidní buňky, exprimující na svém povrchu antigenní epitopy AChR, které jsou rozpoznávány T buněčnými receptory jako cizorodé. Dochází k rozvoji autoimunitního zánětu s aktivací T a B lymfocytů, dysfunkci T regulujících buněk a produkci autoprotilátek.(2) Přibližně u 13 % pacientů se vyskytuje paraneoplastická MG, která je asociovaná s thymomem. Často se vyskytuje s jinými autoimunitními chorobami, nejčastěji s thyreoiditidou, dále revmatoidní artritidou, systémovým lupusem erythematodes (SLE).
Klinické projevy
Typickými příznaky myasthenia gravis je kolísající svalová slabost a únavnost příčně pruhovaného svalstva. Unavitelnost svalstva můžeme objektivně kvantifikovat, ale únava je subjektivní vjem pacienta. Svalová slabost se zhoršuje po zátěži a zlepšuje po odpočinku.
Bývá postiženo více svalových skupin, ale setkáváme se i s monofokálními formami onemocnění. Může docházet k přenosu svalové slabosti z jedné svalové skupiny na jinou, někdy i značně vzdálenou, např. padání očních víček po rychlé chůzi. Nejčastější příčinou manifestace nebo zhoršení příznaků MG jsou infekce, psychický stres, rizikové léky, operační zátěž, očkování. Do spektra symptomů myasthenia gravis nepatří bolesti, poruchy citlivosti, zachovány jsou šlachookosticové reflexy. Mezi nejčastější iniciální příznaky (více než 50 %) patří oslabení extraokulárních svalů, což se projeví diplopií a/nebo ptózou horního víčka, většinou asymetrickou. Přibližně u 20 % nemocných zůstávají projevy onemocnění omezeny pouze na extraokulární svaly. Tuto formu označujeme jako okulární MG. Onemocnění však může progredovat a postihovat i ostatní svaly – mimické, orofaryngeální, šíjové, pletencové, respirační. To se projevuje poruchou artikulace (dysartrie, rhinolalie, dysfonie), po odpočinku se zlepšuje, ale fyzickou aktivitou nebo verbálním projevem se opět horší. Dalším příznakem bývá oslabené kousání a polykání (dysfagie) – oslabení rtů, které způsobuje zpětné vytékání tekutin z dutiny ústní, neschopnost sání a pití tekutin brčkem, nemožnost rozkousat tužší sousta a posunout oslabeným jazykem potravu do nosohltanu, nemocní si pomáhají prsty, vázne polykání, je velké riziko aspirace. Typickým projevem je také hypomimie, obličej získá „tuhé“ rysy, patrný je oboustranný lagoftalmus, „vertikální“ úsměv, pocit tuhnutí v obličeji. Pacienti mohou mít i pokles hlavy, což je způsobeno převážně slabostí extenzorů oproti flexorům (dropped head syndrom). Další mohou být příznaky z oslabení končetin, většinou postihují proximální svaly, což se projeví obtížným vzpažením, problémy s činnostmi osobní hygieny (česání, holení, čištění zubů), vypadávání předmětů z ruky, podklesávání dolních končetin, obtížná chůze po schodech, pády. Závažnou komplikací je respirační insuficience při oslabení dýchacích svalů – myastenická krize. Jedná se o život ohrožující stav daný selháním svalů bránice a pomocných respiračních svalů, vedoucí k nutnosti zavést umělou plicní ventilaci.(1) Mezi hlavní rizikové faktory myastenické krize patří respirační infekce, progrese myasthenia gravis s rychlým oslabením orofaryngeálních svalů, náhlý psychický stres, náhlé nasazení či vysazení vyšších dávek kortikosteroidů, podání rizikových léků. Myastenická krize se může vyvinout velmi rychle, během několika desítek minut, nebo pomalou progresí generalizované slabosti, zejména spojené se slabostí orofaryngeálních svalů.(1)
Diagnostika
Na onemocnění je nutno pomýšlet při rozvoji klinických příznaků, které spadají do široké škály projevů tohoto onemocnění. Vlastní diagnostika je založena na klinickém vyšetření, které zahrnuje kvalitně odebranou anamnézu zaměřenou na typické projevy onemocnění, neurologické vyšetření, zátěžové testy. Mezi nejčastěji používané zátěžové testy patří Simpsonův test, kdy při postižení svalů extraokulárních lze zvýraznit ptózu usilovným minutovým pohledem vzhůru, dále zhoršení výslovnosti během artikulace, zakuckávání při zkoušce pití, nedokonalé špulení úst, pískání, nafouknutí tváří, vleže elevace hlavy 45 stupňů nad podložkou na výdrž, abdukce paží na výdrž, vyšetření síly stisku prstů dynamometrem v klidu a po zátěži, pokles pánve v Trendelenburgově postoji atd. (obr. 2).
Image 2. Simpsonův test (zdroj: www.zdravi.euro.cz/clanek/postgradualni- medicina/myasthenia-gravis- na-prahu-3-tisicileti-463472) 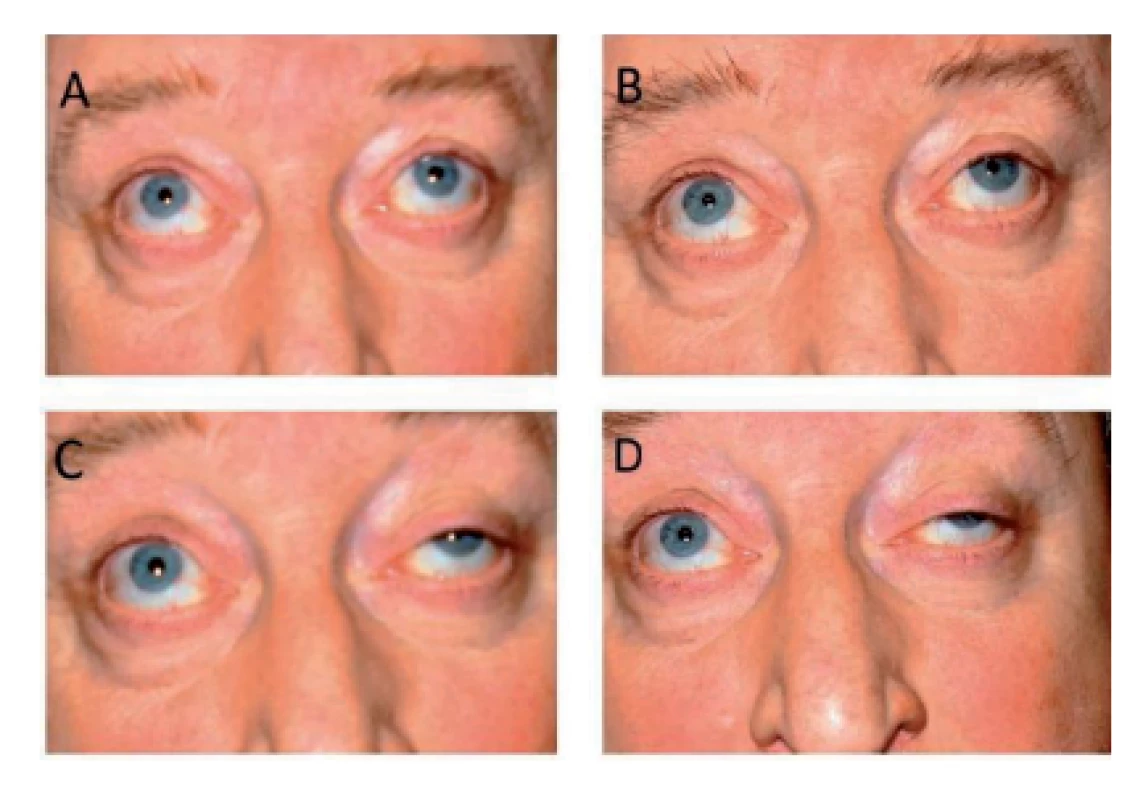
Součástí je také vyšetření protilátek – anti-AChR, anti-MuSK, anti-Lrp4. Diagnosticky přínosné je i elektromyografické vyšetření, kterým vyslovíme suspekci na postsynaptickou nervosvalovou poruchu, zachytíme-li reprodukovatelný pokles amplitudy akčního potenciálu po 4. stimulu periferního nervu o více než 8–10 %. Nejčastěji se vyšetřuje m. anconeus / n. radialis, m. trapezius / n. accessorius (obr. 3).
Image 3. Ploténkový potenciál u zdravých osob a osob s myasthenia gravis
(zdroj: www.myastheniagravis.cz/diagnostika)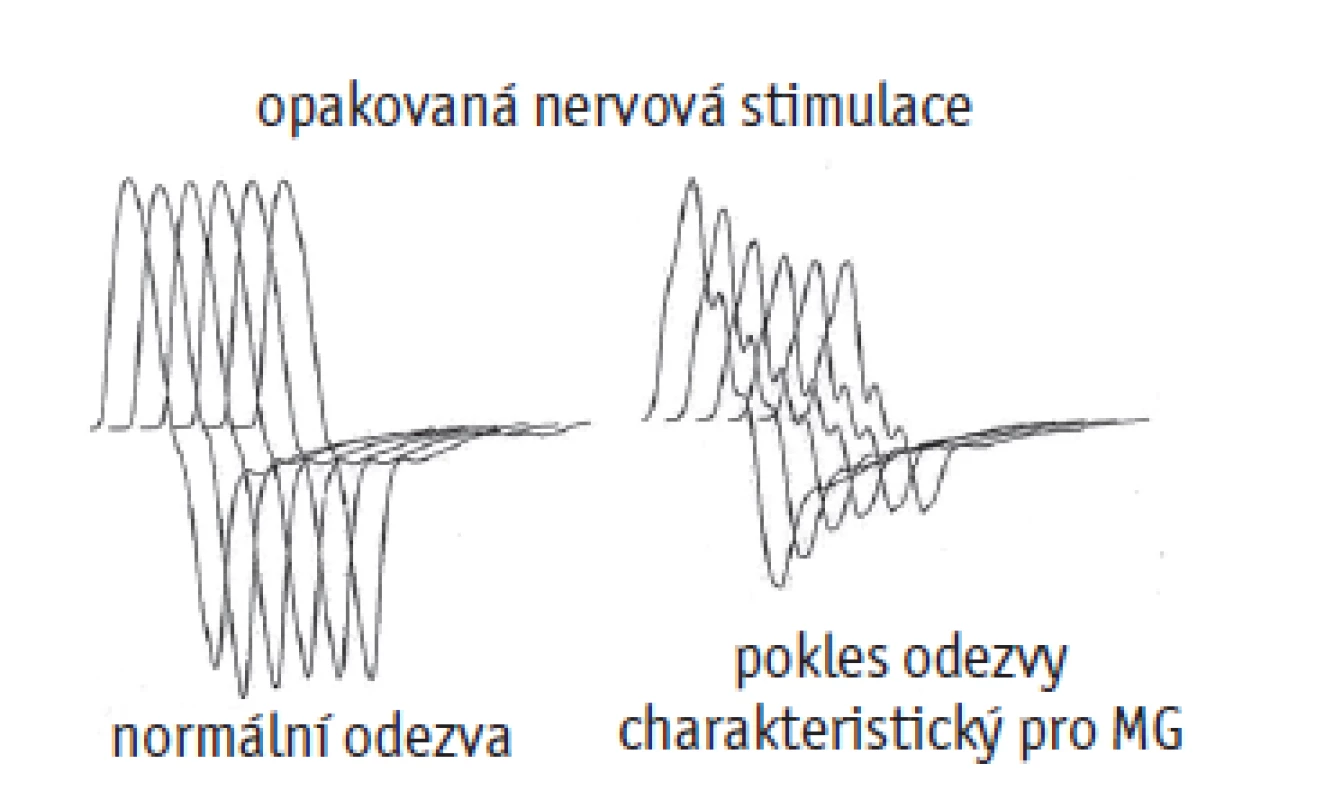
Mezi pomocné metody řadíme zobrazovací metody k vyloučení thymomu, nejčastěji se jedná o CT hrudníku. Postižení polykacího svalstva lze objektivizovat endoskopickou fibroskopií (FEES – flexible endoscopic evaluation of swallowing), spirometrické vyšetření odhalí restrikční poruchu.
Cílem léčby je navození klinické remise
Cílem léčby myasthenia gravis je zlepšit co nejvíce funkční stav pacienta, dosáhnout zlepšení co nejrychleji s minimem vedlejších projevů při použití, pokud možno, nejjednodušší terapie.(11)
Léčba vyžaduje individuální přístup k pacientovi, je potřeba zohlednit závažnost a rychlost progrese mya-stenické symptomatologie, stupeň funkčního postižení, pohlaví, věk a přítomnost přidružených onemocnění. Nezbytnou podmínkou úspěšné léčby je také co největší compliance ze strany pacienta. Velmi důležitá je informace ohledně možných nežádoucích účinků léčby.
Terapii myasthenia gravis lze rozdělit na symptomatickou, imunomodulační, biologickou a chirurgickou. Léky patřící do symptomatické terapie zvyšují nabídku acetylcholinu v oblasti nervosvalové ploténky. Inhibitory cholinesterázy reverzibilně blokují cholinesterázu, která enzymaticky hydrolyzuje acetylcholin na nervosvalové ploténce, a dochází k prodloužení účinku uvolněného acetylcholinu. Jedná se o léky, které zlepšují příznaky nemoci, ale neovlivňují její patogenezi. Dávkování je velmi indivi-duální, závisí na biologickém poločasu, tíži postižení a denních aktivitách.(4) Poměrně častou chybou je fixní časové podávání léků bez ohledu na fyzickou zátěž nebo klidový režim v noci. Hlavní nežádoucí účinky vyplývají z cholinergního efektu, kdy dochází k akumulaci acetylcholinu na muskarinových receptorech hladkých svalů a žláz se zevní sekrecí. Jedná se nejčastěji o průjmy, nauzeu, zvracení, slinění, slzení, někdy bronchospasmus. Aktivací svalových nikotinových receptorů vznikají svalové křeče, fascikulace. Tento efekt je často i limitujícím faktorem pro zvyšování dávky. Kumulace vysokých dávek inhibitorů může vést ve vzácných případech k tzv. cholinergní krizi. Jedná se depolarizační blokádu se svalovou slabostí, která může vyústit až v respirační insuficienci (od myastenické krize se liší přítomností dalších nežádoucích účinků na muskarinových receptorech – bronchospasmus, slinění, mióza, bradykardie). Tyto příznaky lze potlačit atropinem podávaným intravenózně, případně subkutánně. Pokud je krize způsobena kumulací dlouhodobě působících inhibitorů, je potřeba dávky atropinu i několikrát opakovat. Mezi léky této skupiny patří pyridostigmin, který se používá jako základní lék, neostigmin, který slouží spíše jako doplňková terapie pro zvládání zátěžových situací, ambenonium, užívané jako alternativa pro nemocné s intolerancí pyridostigminu, a distigmin, který se v terapii MG používá málo, protože je dlouhodobě působící a hrozí zvýšené riziko kumulace a rozvoje nežádoucích účinků.
Druhou skupinou jsou léky imunomodulační. Cílem této terapie je dosažení kompletní, nebo alespoň částečné klinické remise. Do této skupiny řadíme kortikosteroidy a imunosupresiva. Z kortikosteroidů je nejčastěji používán prednison nebo methylprednisolon. Podávání kortikoidů vede k remisi nebo významnému ústupu symptomů u 70–80 % nemocných.(4) Na počátku léčby se objevuje asi u ¹⁄³ pacientů přechodné zhoršení, které může vyústit až v myastenickou krizi, zejména pokud jsou před zahájením léčby přítomny závažné symptomy, jako je bulbární slabost nebo respirační insuficience. Proto je vhodné zvyšovat dávky kortikosteroidů postupně (max. 1 mg/kg/den). Bolusové podání intravenózního methylprednisolonu (5× 125–250 mg) následované sestupnou dávkou prednisonu se využívá zpravidla u nemocných se závažnou slabostí na umělé plicní ventilaci, kde je preferován rychlý efekt a další progrese klinických příznaků je málo pravděpodobná.(4) Samozřejmě i v tomto případě se vyskytují nežádoucí účinky léčby, mezi nejčastější patří redistribuce tuku a vzestup hmotnosti, steroidní diabetes, hypertenze, retence sodíku, osteoporóza, vředová choroba a deprese. Velkým problémem dlouhodobé léčby je steroidní myopatie. Hlavním opatřením je snížení dávky kortikoidů na nejnižší účinnou hladinu, dostatek pohybu (především izometrické cvičení) a přísun proteinů ve stravě. Co se týká imunosupresiv, je používána řada preparátů, z nichž jen velmi málo prokázalo účinnost v randomizovaných kontrolovaných studiích, tudíž se používají jako off-label terapie. Jsou považovány za léky šetřící kortikoidy a měly by být použity vždy, když udržovací dávka prednisonu je větší než 20 mg denně nebo nemocný trpí významnými nežádoucími účinky i při menší dávce. Obvykle po několika letech podávání imunosupresiv lze jejich dávky snížit, ale jejich úplné vysazení může vést k náhlému zhoršení myastenie.(4) Nejvýznamnějšími riziky této terapie je celkové snížení imunity, zvýšené riziko nádorového onemocnění a snížení fertility. Lékem první volby v kombinaci s kortikosteroidy je azathioprin. Jedná se o purinový analog, účinek spočívá v inhibici syntézy nukleových kyselin. Dochází k poklesu proliferace T i B lymfocytů. Azathioprin redukuje dávku kortikoidů potřebnou k udržení remise a redukuje i počet relapsů onemocnění. Při léčbě azathioprinem je potřeba pravidelně kontrolovat krevní obraz a jaterní testy. Způsobuje rezistenci na warfarin. Dalšími léky ze skupiny imunosupresiv používanými v terapii myasthenia gravis jsou cyklosporin A, mykofenolát mofetil, takrolimus, methotrexát, cyklofosfamid. Cyklosporin A potlačuje především CD4+ lymfocyty a blokuje produkci a sekreci interleukinu 2. Mezi hlavní nežádoucí účinky léčby cyklosporinem patří renální toxicita s následnou hypertenzí, která je způsobena reverzibilním ovlivněním buněk proximálního tubulu a jeho funkce. Poměrně častý je hirsutismus (30–50 %) a hyperplazie gingiv (15 %), zažívací potíže (nauzea, zvracení, pocit tlaku v žaludku, vzácně kolitida, hepatotoxicita), třes. Mykofenolát mofetil způsobuje potlačení produkce protilátek i buněčné imunity. Zvyšuje lymfocytární apoptózu, inhibuje expresi adhezivních molekul, redukuje sekreci TNF-α a zvyšuje expresi interleukinu 10. Mezi nežádoucí účinky tohoto léku patří průjem, zvracení, leukopenie, resp. neutropenie, sepse a oportunní infekce. Takrolimus patří do stejné skupiny imunosupresiv jako cyklosporin, která inhibují proliferaci aktivovaných T buněk, je však 10–100× účinnější. Nežádoucími účinky jsou gastrointestinální diskomfort a parestezie, je hepatotoxický a neurotoxický, může zhoršovat hypertenzi a diabetes. Methotrexát je antimetabolit folátu, používá se spíše v revmatologii. V terapii myastenie se příliš nepoužívá. Při použití methotrexátu v terapii je potřeba pravidelně kontrolovat krevní obraz a jaterní testy, 1× ročně provést rtg plic k vyloučení pneumonitidy. Cyklofosfamid potlačuje především B buňky. Jedná se o záložní lék u farmakorezistentních forem myasthenia gravis. K nežádoucím účinkům patří útlum krvetvorby, oligospermie, ovariální dysfunkce – anovulace, poruchy menstruačního cyklu a alopecie. Rizikem je i rozvoj hemoragické cystitidy. Poslední skupinou je léčba biologická. Bývá indikována u těžkých refrakterních forem myasthenia gravis. Do této skupiny řadíme rituximab, což je chimérická myší/lidská monoklonální protilátka namířená proti CD20 povrchovému znaku na B lymfocytech. Bývá velmi dobře tolerován. Rituximab se nyní používá již v indikaci off-label u refrakterní formy myastenie.(13) Další je ekulizumab, což je inhibitor terminálního komplementu, který se specificky a s vysokou afinitou váže na protein komplementu C5, čímž brání jeho štěpení na C5a a C5b a tvorbě terminálního komplexu komplementu C5b-9, který se účastní na destrukci postsynaptické membrány nervosvalové ploténky. Nežádoucí účinky léčby nejsou závažné, patří mezi ně častější infekce, zejména horních cest dýchacích, bolesti hlavy, nauzea apod. Ekulizumab byl v roce 2018 schválen v USA, Japonsku a zemích EU v indikaci refrakterní myasthenia gravis.(13) Další léky patřící do skupiny biologické léčby jsou ve stadiu klinických studií (např. zilucoplan, ravulizumab, efgartigimod, rozanolixizumab, abatacept, bortezomib).
Operační léčba (thymektomie) je indikovaná zejména u mladších pacientů s přítomností protilátek proti AChR, která zvyšuje pravděpodobnost navození klinické remise. Thymomy by měly být k operaci indikovány vždy, pouze u značně rizikových nemocných, neúnosných k operaci, je indikována konzervativní léčba doplněná ozářením, event. chemoterapií.(1)
V léčbě akutních stavů, kdy oslabením respiračních svalů může dojít k rozvoji myastenické krize s potřebou umělé plicní ventilace, je indikováno podání intravenózního imunoglobulinu (IVIG) nebo terapeutické plazmaferézy (TPF) či imunoadsorpce (IA). Intravenózní imunoglobuliny ovlivňují imunitní systém na mnoha úrovních včetně potlačení autoimunitního zánětu. Nežádoucí účinky IVIG zahrnují bolesti hlavy, alergické/anafylaktické reakce (zejména u IgA-defi-cientních pacientů), infekce (HIV nebo virové hepatitidy), žilní trombózu, aseptickou meningitidu a hemolýzu. Plazmaferéza či imunoadsorpce mechanicky odstraňují patologické autoprotilátky. Při terapeutické plazmaferéze se eliminuje 1–1,5 objemu plazmy, která se nahrazuje albuminem nebo mraženou lidskou plazmou většinou 5× každý druhý den. Kontraindikací je septický stav a porucha koagulace.(4) Terapie a dispenzarizace pacientů s myasthenia gravis by měla probíhat ve specializovaných centrech (tab. 1.).
Table 1. Přehled rizikových léků zhoršujících příznaky myasthenia gravis (upraveno dle Piťha J. Myasthenia gravis. Med Praxi 2015; 12(3): 121–125) 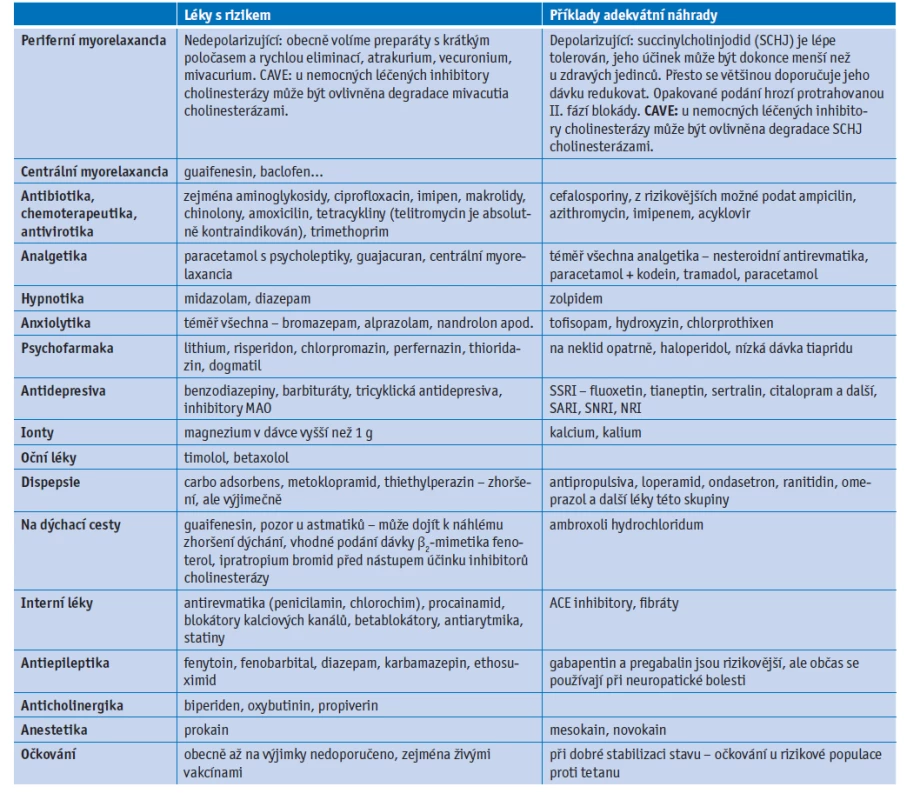
Popis případu
V kazuistice se jedná o 75letou ženu, která byla přijata do nemocnice na traumatologické oddělení akutně po pádu. Uklouzla v domácím prostředí a poranila si levou dolní končetinu. Z osobní anamnézy bylo zjištěno, že se jedná o diabetičku 2. typu na kombinované léčbě inzulinem a perorálními antidiabetiky (PAD), s hypotyreózou na substituční terapii, osteoporózou, povšechnou aterosklerózou, chronickou žilní insuficiencí dolních končetin. Vstupním traumatologickým a rtg vyšetřením byla diagnostikována fraktura krčku femoru vlevo. Pacientka byla indikována k operačnímu řešení a po předoperační přípravě byla provedena následující den v celkové anestezii otevřená repozice a osteosyntéza rekonstrukčním hřebem. Pooperační průběh byl u pacientky bez komplikací, několik málo dní po operaci byla přeložena na oddělení následné péče, kde se pokračovalo v terapii, ošetřovatelské péči. Zahájili jsme rehabilitaci, spolupráce pacientky však byla omezená pro počínající kognitivní deficit. Přibližně po měsíci hospitalizace došlo ke zhoršení zdravotního stavu ve smyslu dysartrie, produkce „slovního salátu“. Doplnili jsme akutní počítačovou tomografii (CT) mozku, která vyloučila čerstvé ložiskové změny, potvrdila atrofii mozku a aterosklerózu. S výsledkem CT byla pacientka vyšetřena neurologem, který potvrdil dysartrii. Během vyšetření pacientka leží s otevřenými ústy, vyplazeným jazykem, který se jeví oteklý, zarudlý. Ostatní neurologický nález je v normě. Stav je neurologem vyhodnocen jako suspektní angioedém jazyka s poruchou artikulace, o cévní mozkovou příhodu se zřejmě nejedná, myasthenia gravis je málo pravděpodobná, protože není kolísání intenzity obtíží během dne. Bylo doporučeno vysazení možné alergizující medikace, nasazení kortikoidů (hydrokortison 100 mg v infuzi fyziologického roztoku), ORL vyšetření. ORL vyšetření uzavřelo, že se jedná o Quinckeho edém spodiny dutiny ústní a hypofaryngu, doporučeny nadále kortikoidy, antihistaminika, kalcium. Dle kontroly za 2 dny dochází k regresi otoku. Pacientka si subjektivně nadále stěžuje na obtížné polykání (nedokáže přesně specifikovat, bolesti nemá, ale „prostě to nejde“), odmítá stravu, tekutiny i medikaci, spolupráce je minimální. Nasazujeme tedy parenterální terapii. Pro přetrvávající potíže opět provedena ORL kontrola, organická příčina v polykacích cestách vyloučena. Doplněno kontrolní neurologické vyšetření, kde vzhledem k vývoji anartrie a dysfagie pomýšleno diferenciálně diagnosticky na souběh dvou diagnóz, a to angioedém jazyka v regresi a kmenová ischemická cévní mozková příhoda (prodloužená mícha vlevo). Pomýšleno i na kompresi postranního smíšeného systému v rámci edému či lokálním procesu v oblasti krku nebo bulbární formu amyotrofické laterální sklerózy (ALS). Ta je však málo pravděpodobná pro náhlý vznik potíží. Myasthenia také spíše vyloučena pro nekolísání příznaků po odpočinku. K vyloučení patologie v oblasti krku byla doplněna počítačová tomografie, kde nenalezena patologie. Vzhledem k tomu, že pacientka přestala přijímat stravu i tekutiny, byla snaha o zavedení nazogastrické sondy k výživě. Při tomto výkonu dochází k přechodné dechové tísni pacientky a vzhledem k diagnostické nejistotě a možnému otoku dýchacích cest pacientka převzata na anesteziologicko-resuscitační oddělení, kde dochází k progresi respirační tísně s hyperkapnií, pacientka napojena na neinvazivní ventilaci, která je však bez efektu, proto přistoupeno k zajištění dýchacích cest orotracheální intubací a napojení na umělou plicní ventilaci.
Pokračováno v došetřování příčiny stavu, diferenciálně diagnosticky zvažována nadále ischemická CMP s lézí smíšeného postranního systému, dále autoimunitní neuro/myopatie (MG/ALS). Zahájena terapie kortikoidy, odebrány odběry na protilátky proti ACh receptorům, do medikace zavedeny testačně inhibitory acetylcholinesterázy. Z laboratoře hlášeny vysoce pozitivní protilátky proti ACh receptorům – 22,7 nmol/l (norma 0–0,25). S výsledky opět konzultován neurolog, vyslovena suspekce na myastenickou krizi s možnou indukcí vysokými dávkami kortikoidů v rámci terapie angioneurotického edému, nelze však stále vyloučit spolupodíl iktu. U lůžka pacientky tedy doplněno elektromyografické vyšetření (EMG), které potvrzuje diagnózu myasthenia gravis. Následně proběhla konzultace vyššího pracoviště, kdy bylo doporučeno pokračovat v terapii inhibitory acetylcholinesterázy 4× denně (7–13–19–01 h), domluven překlad k provedení plazmaferézy.
V pozadí aktuálních potíží ale zůstává celkový nepříznivý stav pacientky v souvislosti s progredující dyskognicí a perspektivou postupné ztráty soběstačnosti. K definitivnímu vyloučení podílu akutní cévní mozkové příhody byla provedena i magnetická rezonance (MRI) mozku s nálezem difuzní mozkové atrofie, víceložiskového postižení bílé hmoty supratentoriálně nejspíše starší postischemické etiologie. Definitivní diagnóza pacientky tedy zní myasthenia gravis s poruchou polykání (bulbární paralýza) a respiračním selháním – myastenická krize. Je však vyjádřena i centrální neurogenní léze vaskulární etiologie při těžším chronickém aterosklerotickém postižení, bez známek recentní cévní mozkové příhody dle MRI – klinicky centrální kvadruparéza s plegií dolních končetin, výrazná symptomatika pseudobulbárního syndromu. Stav pacientky se však před překladem na vyšší pracoviště komplikuje rychlým rozvojem sepse, příčinou je oboustranná pneumonie. Je nasazena empirická antibiotická terapie s následnou úpravou dle mikrobiologických nálezů, plná orgánová podpora, na které se stav daří přechodně relativně stabilizovat. Infekční komplikace však recidivují, opakovaně rotována antibiotická terapie, trvá potřeba intenzivní péče. Pacientka nakonec umírá na recidivu oboustranné pneumonie.
Diskuse a závěr
Cílem kazuistiky je poukázat na nezvyklou příčinu vzniku akutní dysfagie u geriatrické pacientky, u které nebyla známa diagnóza myasthenia gravis. I když je manifestace myasthenia gravis typická spíše pro mladší věk, mohou se příznaky projevit později. Dysfagie je poměrně častým problémem řešeným u geriatrických pacientů, její nejčastější příčinou jsou onemocnění orofaryngu, neuromuskulární onemocnění, zevní tlak na jícen nebo onemocnění jeho stěny a v neposlední řadě intraluminální obstrukce. Pokud se podaří objasnit příčinu dysfagie, snažíme se o léčbu kauzální, tedy o odstranění příčiny. Tam, kde příčinu zjistit nelze, volíme konzervativní postup.
V naší kazuistice došlo pravděpodobně k indukci myastenické symptomatologie vysokými dávkami kortikoidů, které byly podány k léčbě angioneurotického edému, a následný pokus o zavedení nazogastrické sondy způsobil svalovou slabost a vedl k rozvoji respiračního selhání. Myasthenia gravis je závažné, někdy život ohrožující onemocnění. Řadíme ji mezi vzácnější, nikoliv však raritní choroby, proto je důležité na ni pomýšlet v případě, že pacient trpí svalovou slabostí, zejména postihující více svalových skupin, kde zatím nebyla nalezena jiná příčina. U starších lidí může imitovat jiná onemocnění, což ukazuje naše kazuistika, kdy původně bylo pomýšleno na cévní mozkovou příhodu nebo ALS. Důležitá je konzultace a vyšetření lékařem s neurologickou specializací, rychlá diagnostika a časné zahájení léčby, které je rozhodující pro další prognózu pacienta. Centralizovaná péče urychluje diagnostiku, optimalizuje terapii a zlepšuje kvalitu života.(2)
MUDr. Kamila Šablaturová
Studium na Lékařské fakultě Masarykovy univerzity v Brně ukončila v roce 2009. V roce 2012 absolvovala interní kmen. Aktuálně pracuje v zařízení dlouhodobé péče Sanatorium Jih v Ostravě.
Korespondenční adresa:
MUDr. Kamila Šablaturová
Sanatorium Jih
Pavlovova 2626
700 30 Ostrava-Zábřeh
e-mail: ksablaturova@gmail.com
Sources
1. Piťha J, et al. Myasthenia gravis a ostatní poruchy nervosvalového přenosu. Praha: Maxdorf 2010 : 72–283.
2. Piťha J. Myasthenia gravis. Med Praxi 2015; 12(3): 121–125.
3. Voháňka S. Farmakoterapie myasthenia gravis. Neurol Praxi 2010; 11(2): 95–99.
4. Piťha J. Místo farmakoterapie v léčbě myasthenia gravis. Klin Farmakol Farm 2018; 32(2): 8–12.
5. Ehler E. Neuromuskulární nemoci. Medicína po promoci 2018; 3.
6. Jakubíková M, Piťha J. Současný pohled na imunopatogenezi myasthenia gravis. Cesk Slov Neurol N 2015; 78/111(6): 649–654.
7. Mantegazza R, Cavalcante P. Diagnosis and Treatment of Myasthenia Gravis. Curr Opin Rheumatol 2019; 31(6): 623–633.
8. Piťha J. Praktické zkušenosti s klinickou diagnostikou myasthenia gravis. Neurol Praxi 2010; 11(2): 90–94.
9. Piťha J, Bednařík J, Zapletalová O, et al. Klinický standard pro diagnostiku a léčbu myasthenia gravis. Cesk Slov Neurol N 2012; 75/108(2): 242–252.
10. Piťha J. Klinické aspekty při léčbě myasthenia gravis. Neurol Praxi 2016; 17(3): 158–162.
11. Špalek P. Myasthénia gravis. Cesk Slov Neurol N 2008; 71/104(1):7–24.
12. www.myastheniagravis.cz
13. Piťha J. Refrakterní myasthenia gravis – klinická charakteristika a možnosti biologické léčby. Cesk Slov Neurol N 2019; 82/115(5): 490–495.
14. Menon D, Barnet C, Bril V. Novel Treatments in Myasthenia Gravis. Front Neurol 2020; 11 : 538.
15. Kalvach Z, Zadák Z, Jirák R, et al. Geriatrie a gerontologie. Praha: Grada Publishing 2004 : 711–712.
16. Topinková E. Geriatrie pro praxi. Praha: Galén 2005 : 103–105.
Labels
Geriatrics General practitioner for adults Orthopaedic prosthetics
Article was published inGeriatrics and Gerontology

2021 Issue 4-
All articles in this issue
- Editorial
- Health literacy in the elderly: Awareness and misinformation in relation to the diagnosis of type 2 diabetes mellitus
- Measurement of perioperative neurocognitive disorder in seniors above 65 years old – pilot study
- Transforming the life path of „floating seniors“
- Subjective assessment in relation to selected aspects in the population over 60 years old
- Ethical dilemmas in infaustic prognoses: an empiric study
- Behavioral and personality disorders in old age
- Spiritual care for the elderly in a hospital setting: a path to forgiveness and reconciliation
- Cause of acute onset dysphagia in a geriatric female patient
- Vascular occlusions in COVID-19: a case series
- American Geriatrics Society Position Statement on Achieving Gender Equity in Geriatrics
- On the 30th anniversary of the 3rd Department of Internal Medicine – Metabolic Care and Gerontology in Hradec Králové
- Geriatrics and Gerontology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Behavioral and personality disorders in old age
- Cause of acute onset dysphagia in a geriatric female patient
- Ethical dilemmas in infaustic prognoses: an empiric study
- Health literacy in the elderly: Awareness and misinformation in relation to the diagnosis of type 2 diabetes mellitus
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career


