-
Medical journals
- Career
Biochemické hodnotenie účinku silymarínu a praziquantelu na fibrogenézu pečene pri experimentálnej infekcii larvami parazitického helminta Mesocestoides vogae (Cestoda)
Authors: S. Velebný; G. Hrčková; A. Königová
Authors‘ workplace: Parazitologický ústav SAV, Košice
Published in: Gastroent Hepatol 2011; 65(3): 120-125
Category: Hepatology: Original Article
Overview
Cieľ:
Infekcia larvami pásomnice M. vogae spôsobuje fibrogenézu pečene hostiteľa v chronickej fáze ochorenia, ktorá sa nedá potlačiť používanými antihelmintikmi. Cieľom práce bolo overiť, či podávanie praziquantelu so silymarínom ovplyvní tento proces, pričom na hodnotenie sme použili biochemické markery fibrogenézy.Metódy:
Myši (samce, ICR) sa infikovali larvami M. vogae orálne (p.o.) a od 15. do 24. dňa po infekcii (p.i.) sa im podávalo (p.o.) buď antihelmintikum praziquntel (PZQ) samotné alebo v kombinácii s hepatopretektívom silymarínom (SIL). Neliečené infikované myši slúžili ako kontrola. Na biochemické stanovenia sa použilo sérum a pečeň, ktoré boli odobraté myšiam počas troch týždňov po liečbe (p.t.).Výsledky:
U myší infikovaných larvami M. vogae sa po liečbe kombináciou PZQ a SIL zistil signifikantný (p < 0,05) vzostup antioxidačnej aktivity v pečeňovom parenchýme a regenerácia hepatocytov, pokles peroxidácie bunkových lipidov a fibrogenézy, ako aj zvýšenie efektívnosti liečby porovnaním s liečbou samotným PZQ.Závery:
Zistilo sa, že silymarín výrazne znižuje množstvo reaktívnych foriem kyslíka produkovaných zápalovými bunkami počas infekcie M. vogae v pečeni myší, čím potláča peroxidáciu lipidov, prispieva k regenerácii hepatocytov a pôsobí antifibroticky. Získané výsledky poukazujú na potrebu súčasného a dlhodobého podávania antihelmintika s hepatoprotektívnou a antioxidačne pôsobiacou látkou, akou je napr. silymarín, počas parazitárnej infekcie spôsobujúcej fibrózu pečene.Kľúčové slová:
aminotransferázy – fibrogenéza pečene – glutatión – kolagén – kyselina hyalurónová – Mesocestoides vogae – peroxidácia lipidov – praziquantel – silymarínÚvod
Medzi medicínsky závažné infekčné ochorenia pečene vyvolané parazitickými červami (helmintami) a prejavujúce sa fibrózou, patria schistozomóza (bilharzióza) a alveolárna echinokokóza. Človek, ako príležitostný medzihostiteľ, sa nakazí vajíčkami pásomnice Echinococcus multilocularis alimentárnou cestou, najčastejšie konzumáciou potravy (napr. lesné plody) kontaminovanej trusom infikovaných líšok. Oplodnené vajíčka obsahujú plne vyvinutú larvu onkosféru, ktorá sa v tráviacom trakte medzihostiteľa uvoľňuje a po penetrácii sliznice tenkého čreva sa dostáva do krvného a lymfatického obehu. Je zanesená do pečene, prípadne do iných vnútorných orgánov, kde toto larválne štádium ďalej rastie v podobe mnohokomorového mechúrika, pozostávajúceho z veľkého počtu malých cýst. Tieto larválne cysty vyvolávajú v orgánoch vnútrobunkové procesy, ktoré vedú k fibrogenéze. Chirurgické odstránenie cýst je veľmi problematické, lebo okolo nich sa nevytvára väzivový obal, a preto sa uprednostňuje liečba antihelmintikami [1]. Pretože larválne štádiá tejto pásomnice tvoriace cysty sa vyvíjajú veľmi pomaly, v experimentálnych prácach zameraných na výskum terapie parazitických infekcií vyvolávajúcich fibrózu pečene sa využíva podobná infekcia s rýchlo sa deliacimi larvami pásomnice Mesocestoides vogae [2]. Fibrogenéza je dynamický proces iniciovaný komplexom patobiochemických reakcií za účasti parenchýmových, neparenchýmových a zápalových buniek a rôznych signálnych mechanizmov [3], výsledkom čoho je nahradzovanie poškodeného tkaniva rôznymi zložkami extracelulárneho matrixu (ECM), hlavne kolagénmi typu I a III. Kľúčovú úlohu v patogenéze fibrogenézy pečene zohrávajú hviezdicové bunky (hepatic stellate cells – HSC; synonymá: fat storing cells, vitamin A-storing cells, lipocytes, Ito cells), ktoré sa transformujú na myofibroblasty pri regulačnom pôsobení rôznych profibrotických faktorov, cytokínov a reaktívnych foriem kyslíka (ROS) uvoľnených bunkami zápalového exudátu pri obrane proti patogénom [3]. Oxidačný stres je prejavom nerovnováhy medzi množstvom ROS a koncentráciou antioxidačne pôsobiacich látok v postihnutom tkanive a je jedným z hlavných faktorov iniciácie fibrogenézy. Medzi účinné spôsoby odstránenia nadbytku ROS pri chronických zápalových ochoreniach pečene a jej liečenia patrí podávanie antioxidačne pôsobiacich látok [4]. V medicínskej praxi používané antihelmintiká pre terapiu tkanivových cestodóz (albendazol, mebendazol a praziquantel) majú nedostatočný larvicídny účinok a nepôsobia antioxidačne [5]. Jedným z dôvodov nízkej účinnosti liečiva je aj obmedzené prenikanie k parazitom opúzdreným fibróznym tkanivom. Alternatívnym prístupom k terapii parazitických ohorení sprevádzaných fibrózou je súčasné podávanie antihelmintika a látok s antioxidačnými a hepatoprotektívnymi účinkami. Tieto látky majú priaznivý vplyv na regeneráciu pečeňových buniek alebo na spomalenie niektorých patologických procesov pri akútnych a chronických chorobách pečene [6]. Vzhľadom na uvedené fakty sme sa v našich štúdiách rozhodli overiť účinky kombinovanej terapie praziquantelom a silymarínom na fibrogenézu pečene vyvolanú infekciou larvami M. vogae. Silymarín je najlepšie klinicky preskúmané a všeobecne akceptované hepatoprotektívum v humánnej medicíne, u ktorého neboli zistené toxické účinky ani pri vysokých dávkach [7]. Z chemického hľadiska je to antioxidant flavonoidného typu, izolovaný zo semien pestreca mariánskeho (Silybum marianum). Jeho účinok spočíva (i) v stabilizácii bunkových a mitochondriálnych membrán, (ii) vo vychytávaní kyslíkových radikálov a redukcii peroxidácie lipidov, (iii) v podpore regenerácie poškodených buniek a normalizácii ich metabolizmu, (iv) v inhibícii transformácie HSC na myofibroblasty [8]. Naším cieľom bolo preskúmať účinok uvedených látok 1. na antioxidačnú schopnosť pečene, 2. na peroxidáciu lipidov, 3. na moduláciu fibrogenézy pečene, 4. na regeneráciu hepatocytov a 5. na účinnosť liečby v pečeni pri experimentálnej infekcii myší larvami M. vogae. Táto práca sumarizuje naše nedávno publikované výsledky [9–11].
Metódy
Zvieratá, infikovanie, liečivá, schéma pokusu a odber vzoriek
V pokusoch sa použili samce myši ICR (20 ± 2 g) vo veku 5–6 týždňov z vlastného chovu. Chovali sa v klimatizovaných priestoroch so svetelným režimom 12 hodín svetla a 12 hodín tmy pri teplote 22 oC s voľným prístupom k pitnej vode a krmivu. Po infikovaní larvami Mesocestoides vogae (per os) sa rozdelili do skupín: bez liečby (infikovaná kontrola, n = 30), liečba praziquantelom (PZQ, n = 20), liečba praziquantelom a silymarinom (SIL) (n = 20) a štvrtú skupinu tvorili neinfikované zvieratá (zdravá kontrola, n = 12). Počas experimentov sa dodržiavali požiadavky na ochranu zvierat (Nariadenie vlády SR č. 289/2003 Z.z.). Pokusy sa vykonali na základe rozhodnutia Štátnej veterinárnej a potravinovej správy SR č.k. Ro-992/06-221/3e.
Liečivá sa podávali orálne od 15. do 24. dňa po infekcii (p.i.). Praziquantel (Sigma) v suspenzii s koncentráciou 7 mg.ml-1 v 1% ricínovom oleji sa podával v dávke 35 mg.kg-1 živej hmotnosti (ž. hm.). Silymarín (Sigma, USA) v suspenzii s koncentráciou 6 mg.ml-1 v rovnakom vehikule sa podával v dávke 30 mg.kg-1 ž. hm. päť hodín po podaní PZQ. U zvierat zo zdravej kontroly, ktoré dostali rovnaký počet dávok PZQ ako infikované, sa stanovil obsah glutatiónu (GSH) v pečeni odobratej na 1., 4., 11. a 20. deň po poslednej dávke liečiva (p.t.). Krv z retroorbitálneho venózneho plexu a pečeň sa odobrala od zvierat infikovanej kontroly na 7., 14., 25., 28., 35. a 44. deň p.i., od liečených zvierat na 1., 4., 11. a 20. deň p.t., čo zodpovedá 25., 28., 35. a 44. dňu p.i. V každom z odberových dní sa použilo päť jedincov z každej infikovanej skupiny na odber vzoriek krvi a pečene pre biochemické stanovenia a na izoláciu lariev z pečene. Zo zdravej kontroly sa použili tri jedince na odber krvi a vzoriek pečene. Vzorky pečene sa uskladnili pri teplote -80 oC a krvné sérum pri teplote -18 oC.
Biochemické stanovenia a histologická analýza pečene
Antioxidačná schopnosť pečene sa hodnotila koncentráciou antioxidačne pôsobiaceho tripeptidu glutatiónu (GSH) v homogenáte pečene (μmol.g-1 tkaniva) použitím metódy Glutathione Assay Kit (Sigma, USA). Peroxidácia lipidov v pečeni sa vyjadrila prostredníctvom malondialdehydu (MDA) (μmol.g-1 proteínov), ktorý je jedným z množstva nízko-molekulových produktov rozkladu lipidov [12]. Proteíny v homogenátoch pečene sa stanovili Lowryho meódou (Sigma, USA). Kyselina hyalurónová je produkovaná špecializovanými bunkami spojivových tkanív (myofibroblasty), do obehu sa dostáva lymfatickým systémom a používa sa na hodnotenie stupňa fibrotického procesu. Obsah kyseliny hyalurónovej (HA) (ng.I-1 séra) sa stanovil metódou Hyaluronic Acid Quantitative Test Kit (Corgenix, USA).
Pečene myší sa spracovali klasickým spôsobom pre parafínové rezy. Priebeh fibrogenézy sa sledoval pomocou histochemickej lokalizácie bielkovín extracelulárneho matrixu farbením pomocou roztoku picrosirius red a kontrastným farbením fast green.
Štatistické spracovanie výsledkov
Namerané hodnoty sa uvádzajú ako priemer ± S.D. Výsledky sa spracovali metódou ANOVA použitím štatistického programu Statistica 6.0 (Stat Soft, Tulsa, USA). Signifikantnosť rozdielov hodnôt medzi skupinami sa hodnotila neparametrickým testom Kruskal-Wallisa.
Výsledky
V pečeni kontroly klesla koncentrácia GSH z hodnoty 89,37 ± 4,01 (zdravé myši) na 29,22 ± 2,94 (14. deň p.i.), následne stúpala na maximum 57,12 ±± 3,96 (28. deň p.i), z ktorého klesla na hodnotu 48,24 ± 4,64 na konci sledovaného obdobia. Podávaním PZQ v kombinácii so SIL sa signifikantne zvýšila koncentrácia GSH v pečeni tak v porovnaní so skupinou liečenou iba s PZQ už na 1. deň p.t. (87,10 ± 3,38 vs 33,25 ± 3,39, p < 0,05), ako aj porovnaním s kontrolou (87,10 ± 3,38 vs 48,54 ± 3,88, p < 0,05) a táto zvýšená hodnota pretrvávala až do 44. dňa p.i. (tab. 1) [10].
Table 1. Koncentrácia glutatiónu (GSH) v pečeniach myší infikovaných larvami Mesocestoides vogae, neliečených a liečených praziquantelom (PZQ) samotným alebo v kombinácii so silymarínom (SIL).
Tab. 1. Concentration of glutathione (GSH) in the livers of mice infected with Mesocestoides vogae larvae, untreated and treated with praziquantel (PZQ) alone and in combination with silymarin (SIL).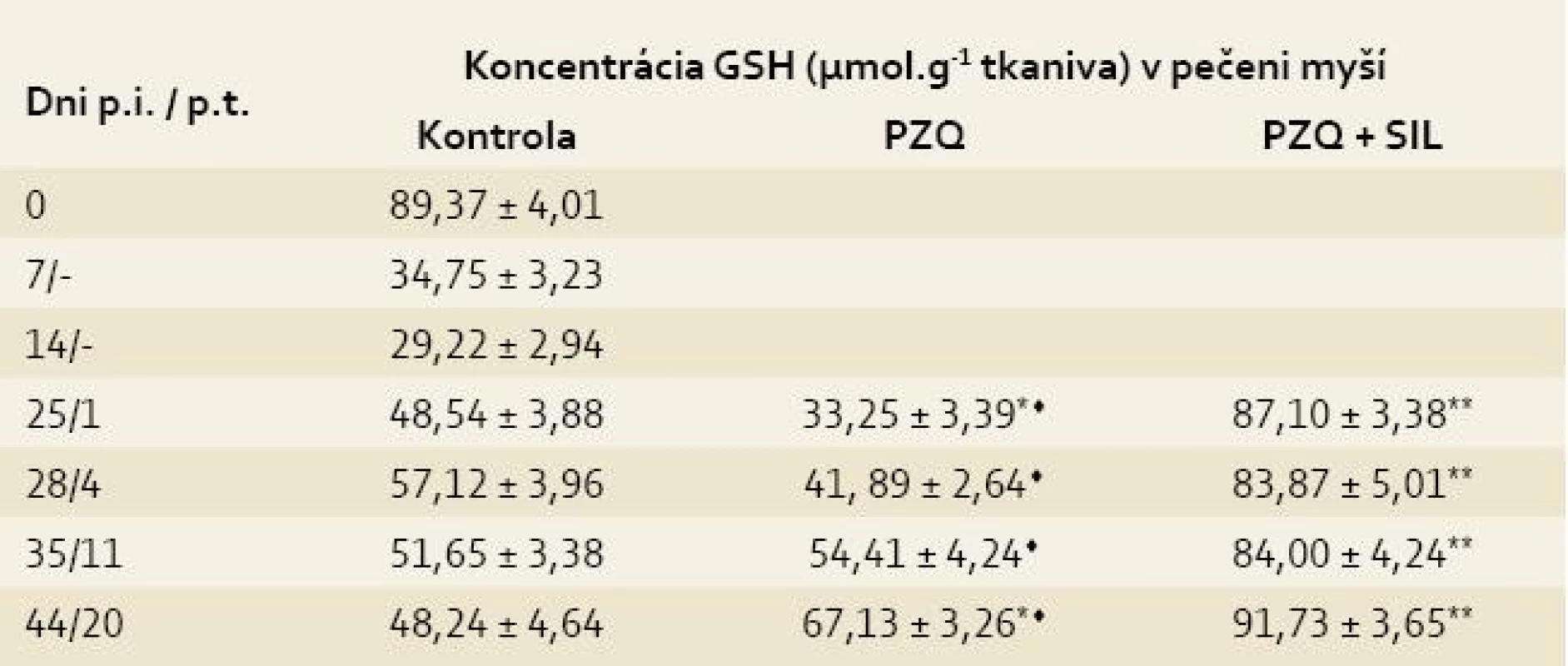
Legenda: Každá hodnota predstavuje priemer ± SD. p.i. = po infekcii p.t. = po liečbe Kontrola = infikované-neliečené myši Signifikantný rozdiel medzi hodnotami GSH v kontrole a liečených skupinách v príslušných dňoch p.t. : * = p < 0,05; ** = p < 0,01 Signifikantný rozdiel medzi skupinou liečenou PZQ a skupinou liečenou PZQ + SIL: ♦ = p < 0,05; ♦♦ = p < 0,01 V priebehu prvého týždňa p.i. prudko stúpla koncentrácia MDA z hodnoty 2,38 ± 0,15 (zdravé myši) na hodnotu 18,22 ± 4,23 a potom sa pozvoľne zvyšovala až do konca sledovaného obdobia, kedy dosiahla maximálnu hodnotu 32,26 ± 3,21. Peroxidácia lipidov bola síce potlačená v obidvoch liečených skupinách v porovnaní s kontrolou, ale po kombinovanej liečbe sa to prejavilo už na 1. deň p.t. (15,13 ± 3,31 vs 25,00 ± 3,42, p < 0,05), kým po liečbe s PZQ až na 4. deň p.t. (7,11 ± 1,50 vs 26,14 ± 4,42, p < 0,01). Znížený obsah MDA po liečbe pretrvával do konca pokusu, pričom rozdiely medzi liečenými skupinami boli už nesigifikantné (tab. 2) [10].
Table 2. Koncentrácia malóndialdehydu (MDA) v pečeniach myší infikovaných larvami Mesocestoides vogae, neliečených a liečených praziquantelom (PZQ) samotným alebo v kombinácii so silymarínom (SIL).
Tab. 2. Concentration of malondialdehyde (MDA) in the livers of mice infected with Mesocestoides vogae larvae, untreated and treated with praziquantel (PZQ) alone and in combination with silymarin (SIL).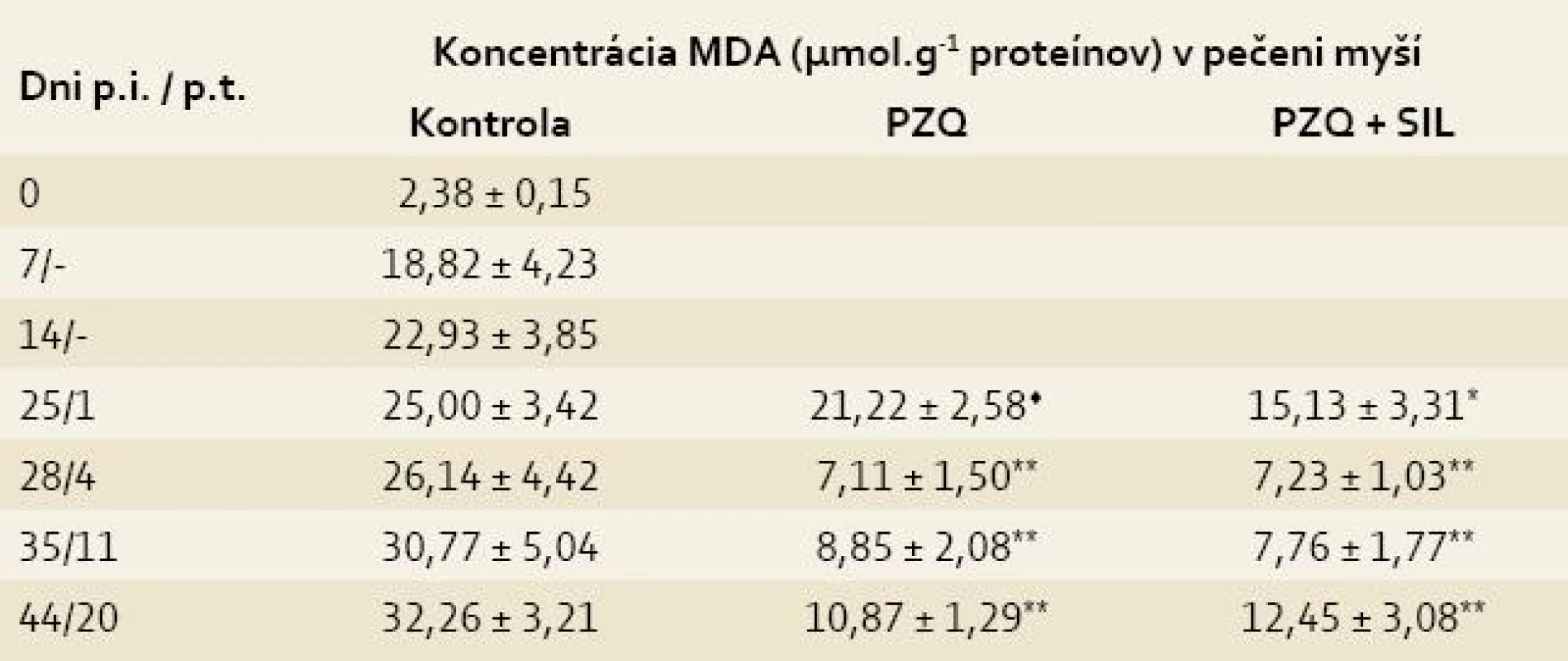
Legenda: Pozri tab. 1. Koncentrácia HA, zistená v sére zdravých myší (73,25 ± 6,35), sa postupne zvyšovala v priebehu infekcie M. vogae až po maximálnu hodnotu 379,10 ± 9,34 (44. deň p.i.). Liečba praziquantelom viedla k nesignifikantnému poklesu obsahu HA na 1. a 4. deň po poslednej dávke liečiva v porovnaní s kontrolou (297,41 ± 9,84 vs 312,47 ± 6,89, p > 0,05). Signifikantný pokles obsahu HA sa pozoroval počas siedmich dní po kombinovanej liečbe PZQ + SIL v porovnaní s kontrolu (napr. na 4. deň p.t. 227,33 ± 7,60 vs 321,60 ± 9,96, p < 0,01). Po ukončení liečby v obidvoch liečených skupinách stúpala koncentrácie HA, ktorá však neprevýšila hodnotu v kontrole, okrem skupiny liečenej s PZQ na 11. deň p.t. (tab. 3) [9].
Table 3. Koncentrácia kyseliny hyalurónovej (HA) v sérach myší infikovaných larvami Mesocestoides vogae, neliečených a liečených praziquantelom (PZQ) samotným alebo v kombinácii so silymarínom (SIL).
Tab. 3. Concentration of hyaluronic acid (HA) in the sera of mice infected with Mesocestoides vogae larvae, untreated and treated with praziquantel (PZQ) alone and in combination with silymarin (SIL).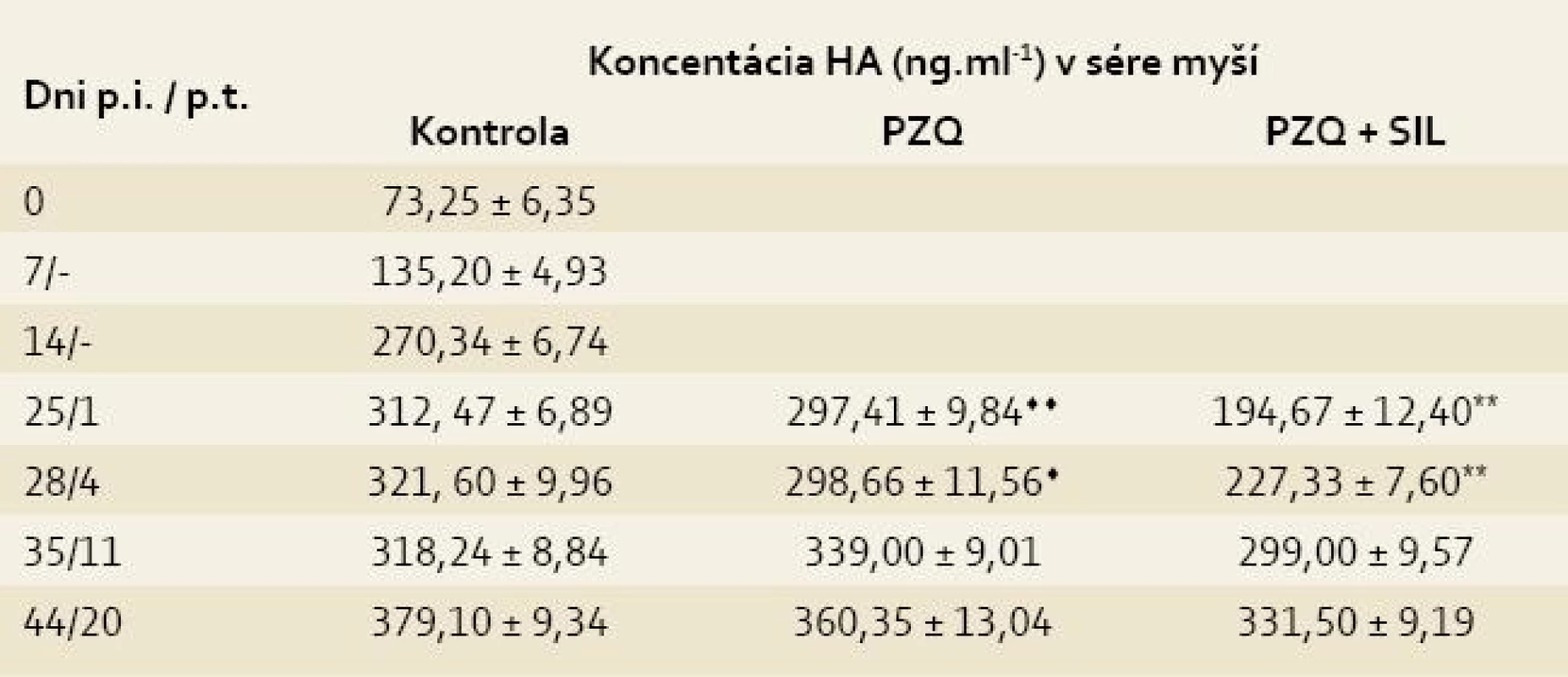
Legenda: Pozri tab. 1. Histochemickou analýzou pečení pomocou špecifického farbenia na bielkoviny extracelulárneho matrixu, najmä kolagénov, sa pozorovalo ich zvýšené množstvo v parenchýme pár dní po infekcii larvami. V kontrolnej skupine a skupine liečenej praziquantelom (obr. 1 a,b) množstvo fibrózneho tkaniva postupne narastalo hlavne v mieste poškodenia parenchýmu a okolo ciev a lariev, kde sa vytvárali kolagénové kapsuly. V skupine liečenej PZQ+SIL (obr. 1c) sme pozorovali znížené množstvo kolagénov, hlavne v parenchýme.
Image 1. Histopatologická analýza pečene s infekciou larvami M. vogae po terapii praziquantelom samotným (b) a v kombinácii so silymarínom (c), (a) – neliečená kontrola. Akumulácia kolagénu počas fibrogenézy sa lokalizovala pomocou farbenia picrosirius red okolo lariev, ciev, poškodeného tkaniva a difúzne uloženého v parenchýme.<br> Fig. 1. Histopathological analysis of the liver infected with M. vogae larvae after treatment with praziquantel alone (b) and combined with silymarin (c), (a) – untreated control. Accumulation of the collagen during fibrogenesis was localized by the picrosirius red staining around larvae, vessels, destroyed tissue and as diffused lesions in the parenchyma. 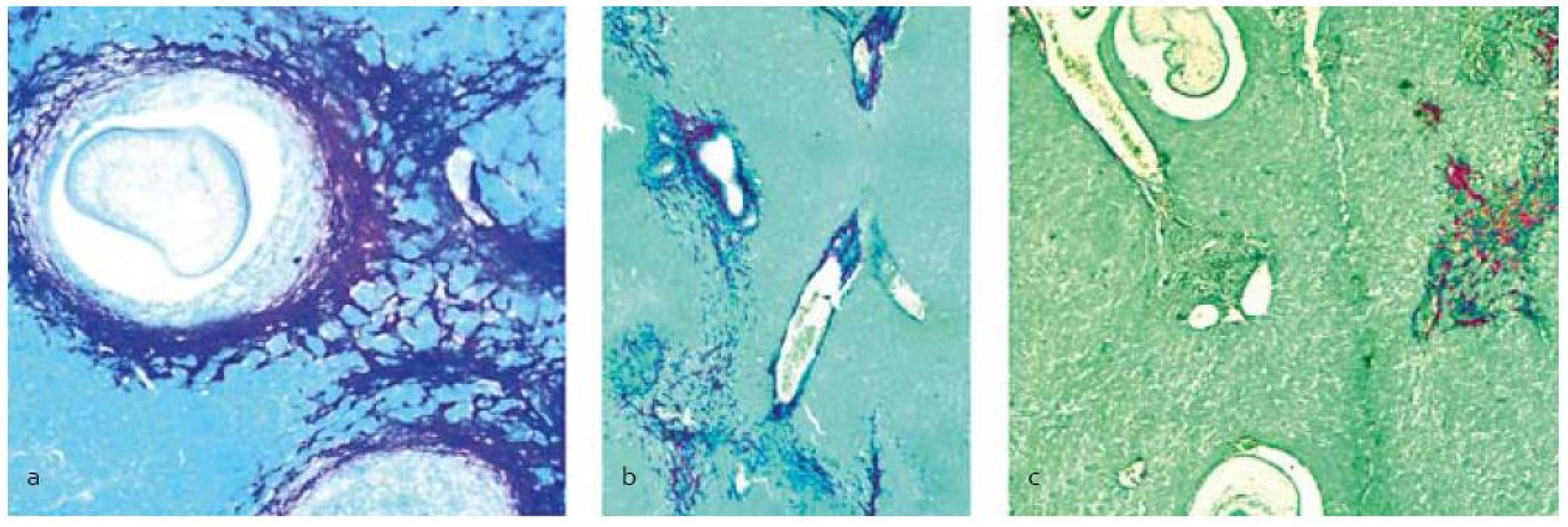
Diskusia
Tripeptid glutation v redukovanej forme je vnútrobunkovým antioxidantom, ktorý sa významne podieľa na ochrane buniek pred oxidačným stresom a na detoxikácii xenobiotík [13]. Počas oxidačného stresu, ktorý je dôsledkom zápalového procesu, prudko klesá obsah redukovanej formy glutatiónu a znižuje sa jeho redox potenciál [14]. Okrem toho sa v poškodenej pečeni transformujú hviezdicové bunky na myofibroblasty, ktoré produkujú nadmerné množstvo ECM, hlavne kolagénov [15]. V práci sme skúmali vplyv infekcie lariev M. vogae na oxidačné poškodenie pečene myší a overovala sa hypotéza, či PZQ samotný alebo v kombinácii so silymarínom môže modulovať koncentráciu GSH, peroxidáciu lipidov v pečeni a fibrózu. Zistilo sa, že v pečeni infikovaných a neliečených myší (kontrola) klesol obsah GSH na veľmi nízke hodnoty počas dvoch týždňov p.i., teda v čase keď larvy aktívne penetrovali pečeňou a mechanicky ju poškodzovali (tab. 1). Tieto hodnoty boli v korelácii s rýchlym nárastom obsahu MDA, čo poukazuje na intenzívny oxidačný stres a peroxidáciu lipidov (tab. 2). V ďalšej fáze experimentálnej infekcie sa zistil mierny vzostup obsahu GSH, čo môže byť prejavom tendencie obnovenia jeho redox potenciálu. Oxidačný stres a hepatocelulárne poškodenie boli v korelácii so signifikantne zvýšenou aktivitou aminotransferáz ALT a AST v sére [9]. PZQ je liečivom prvej voľby pri liečbe cestodóz a schistozomózy [16,17]. V našom pokuse sa zistil pokles obsahu GSH v pečeni do 4. dňa po liečbe s PZQ v porovnaní s kontrolou a až potom mierny nárast. Uvedený pokles spôsobil samotný PZQ, čo sa overilo aplikovaním liečiva zdravým myšiam [10]. Mierny nárast obsahu GSH po liečbe s PZQ bol v korelácii s poklesom peroxidácie lipidov, na čo poukazujú nižšie hodnoty obsahu MDA v porovnaní s kontrolou. Významným zistením bolo, že vďaka antioxidačnej schopnosti SIL po jeho aplikácii spolu s PZQ došlo k potlačeniu oxidačného stresu, čo naznačoval prudký nárast obsahu GSH a veľmi nízka hladina MDA v pečeni infikovaných myší. Súčasne bola veľmi výrazne potlačená aj proliferácia HSC a myofibroblastov [10], čomu nasvedčuje znížené množstvo kolagénov na histologických rezoch. Antifibrotická aktivita silymarínu po kombinovanej terapii sa prejavila poklesom hladiny kyseliny hyalurónovej v sére [9] a hydroxyprolínu v pečeni [11]. Okrem toho sa významne zvýšil larvicídny účinok PZQ v kombinácii so silymarínom v porovnaní s liečbou samotným antihelmintikom [11]. Keďže silymarín nepôsobil v in vitro testoch na larvy cytotoxicky [11], predpokladá sa, že zvýšená účinnosť sa dosiahla ako dôsledok potlačenej fibrogenézy. Tieto výsledky potvrdzujú, že ROS zohrávajú dôležitú úlohu pri stimulácii fibrogenézy a súčasne poukazujú na možnosť obmedzenia tohto procesu podávaním antioxidačne pôsobiacich látok, medzi ktorými má významné postavenie prírodný flavonoid silymarín.
Medzi hepatoprotektíva s obsahom silymarínu, často používané v klinickej praxi, patrí napríklad Flavobion (Zentiva) [18] alebo silnejšia Lagosa (Wörwag Pharma) [19]. Výsledky predklinických experimentov poukázali na veľmi nízku akútnu toxicitu silymarínu (LD50 > 2 000 mg.kg-1 po jednorázovom p.o. podaní) [8]. Denná dávka silymarínu v našich pokusoch (30 mg.kg-1) bola síce približne 5-krát väčšia, ako odporúčaná maximálna denná dávka uvedených liečivých prípravkov [18,19], ale napriek tomu neprekročila hodnotu LD50. Pre vysokú dávku silymarínu sme sa rozhodli preto, aby sme zabezpečili preukázanie jeho hepatoprotektívneho účinku aj napriek krátkej dobe (10 dní) podávania. Naproti tomu, v klinickej praxi je bežné dlhodobé podávanie hepatoprotektív v nižších dávkach, ktorými sa tiež dosahuje požadovaný účinok.
Záver
Praziquantel síce redukoval počet lariev M. vogae v pečeni myší, ale súčasne mierne znížil obsah glutatiónu, nepôsobil antioxidačne a v konečnom dôsledku ani antifibroticky. Naproti tomu, účinkom silymarínu v kombinácii s praziquantelom stúpol obsah glutatiónu v pečeni a jeho antioxidačné pôsobenie sa prejavilo obmedzením peroxidácie lipidov s priaznivým dôsledkom na regeneráciu hepatocytov a potlačením fibrogenézy, čím sa zvýšil larvicídny účinok antihelmintika. Získané výsledky poukazujú na potrebu súčasného a dlhodobého podávania antihelmintika s hepatoprotektívnou, antioxidačne pôsobiacou látkou počas parazitárnej infekcie spôsobujúcej fibrózu pečene.
Prehlásenie: Tento článok bol vytvorený realizáciou projektu „Centrum excelentnosti pre parazitológiu“ (kód ITMS: 26220120022) (podiel 0,75) na základe podpory operačného programu „Výskum a vývoj“ financovaného z Európskeho fondu regionálneho rozvoja a zároveň aj riešením projektu VEGA č. 2/0188/10 (podiel 0,25).
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
The authors declare they have no potential conflicts of interest concerning drugs, products, or services used in the study.Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
The Editorial Board declares that the manuscript met the ICMJE „uniform requirements“ for biomedical papers.RNDr. Samuel Velebný, CSc.
Parazitologický ústav SAV
Hlinkova 3, 040 01 Košice, SK
veleb@saske.sk
Sources
1. Dubinský P, Várady M, Reiterová K et al. Prevalence of Echinococcus multilocularis in red foxes in the Slovak Republic. Helminthologia 2001; 38 : 215–219.
2. White TR, Thompson RC, Penhale WJ et al. The effect of lentinan on the resistance of mice to Mesocestoides corti. Parasitol Res 1988; 74(6): 563–568.
3. Valková M. Hepatic fibrogenesis. Bratisl Lek Listy 2002; 103 : 76–85.
4. Vrba J, Modrianský M. Oxidative burst of Kupffer cells: Target for liver injury treatment. Biomed Pap Med Fac Univ Palacky Olomouc Czech Repub 2002; 146(2): 15–20.
5. Vuitton D. Alveolar echinococcosis of the liver: A parasitic disease in search of a treatment. Hepatology 1990; 12 (3 Pt 1): 617–618.
6. Brůha R. Hepatoprotektiva. Klin Farmakol Farm 2006; 20 : 154–157.
7. Flora K, Hahn M, Benner K. Milk thistle (Silybum marianum) for the therapy of liver disease. Am J Gastroenterol 1998; 93(2): 139–143.
8. Fraschini F, Demartini G, Esposti D. Pharmacology of silymarin. Clin Drug Invest 2002; 22(1): 51–65.
9. Velebný S, Hrčková G, Kogan G. Impact of treatment with praziquantel, silymarin and/or β-glucan on pathophysiological markers of liver damage and fibrosis in mice infected with Mesocestoides vogae (Cestoda) tetrathyridia. J Helminthol 2008; 82(3): 211–219.
10. Velebný S, Hrčková G, Königová A. Reduction of oxidative stress and liver injury following silymarin and praziquantel treatment in mice with Mesocestoides vogae (Cestoda) infection. Parasitol Int 2010; 59(4): 524–531.
11. Hrčková G, Velebný S. Flavonoid silymarin potentiates antihelmintic effect of praziquantel via down-regulation of oxidative stress and fibrogenesis in the liver. Proc World Med Conf, Malta, Sept 15–17, 2010 : 250–257.
12. Uchiyama M, Mihara M. Determination of malondialdehyde precursor in tissues by thiobarbituric acid test. Anal Biochem 1978; 86(1): 271–278.
13. Yuan LY, Kaplowitz N. Glutathione in liver disease and hepatotoxicity. Mol Aspects Med 2009; 30(1–2): 29–41.
14. Han D, Hanawa N, Saberi B et al. Mechanism of liver injury. III. Role of glutathione redox status in liver injury. Am J Gastrointest Liver Physiol 2006; 291: G1–7.
15. Anthony B, Allen JT, Li YS et al. Hepatic stellate cells and parasite-induced liver fibrosis. Parasite Vectors 2010; 3(1): 60–66.
16. Aragon AA, Imani RA, Blackburn VR et al. Towards an understanding of the mechanism of action of praziquantel. Mol Biochem Parasitol 2009; 164(1): 57–65.
17. Watson M. Praziquantel. J Exot Pet Med 2009; 18 : 229–231.
18. www.adcc.sk/web/humanne-lieky/pil//flavobion-pil-7451.html
19. wwww.adcc.sk/web/humanne-lieky//spc/lagosa-spc-12987.html
Labels
Paediatric gastroenterology Gastroenterology and hepatology Surgery
Article was published inGastroenterology and Hepatology
2011 Issue 3-
All articles in this issue
- Vítejte na palubě!
- Význam Evropské gastroenterologické federace (UEGF) se zvyšuje a může být příkladem politickým strukturám
- Hepatologie na počátku třetího tisíciletí
- Biochemické hodnotenie účinku silymarínu a praziquantelu na fibrogenézu pečene pri experimentálnej infekcii larvami parazitického helminta Mesocestoides vogae (Cestoda)
- Sérové hodnoty hyaluronové kyseliny souvisejí se stupněm jaterní fibrózy i portální hypertenzí
- Radiální endosonografie vs esofagogastroduodenoskopie v detekci jícnových a žaludečních varixů
- Význam měření portosystémového tlakového gradientu (HVPG) u pacientů s cirhózou
- Hepatocelulární karcinom – diagnostika a terapie z pohledu klinického onkologa
- Neobvyklá komplikace chronické pankreatitidy
- Kvantitativní imunochemický test krvácení do stolice v populačním screeningu kolorektálního karcinomu
-
Jaké nesteroidní antirevmatikum zvolit u nemocných se zvýšeným rizikem gastrointestinální toxicity?
Komentář ke studii CONDOR - Pohled na (intervenční) léčbu akutní pankreatitidy se mění
- Nácvik aplikace OTSC klipů na porcinních modelech
- Americká gastroenterologie – lépe již bylo?
- Doporučený postup pro diagnostiku a léčbu krvácení do zažívacího traktu při portální hypertenzi
- Gastroenterology and Hepatology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Význam měření portosystémového tlakového gradientu (HVPG) u pacientů s cirhózou
- Hepatocelulární karcinom – diagnostika a terapie z pohledu klinického onkologa
- Neobvyklá komplikace chronické pankreatitidy
- Sérové hodnoty hyaluronové kyseliny souvisejí se stupněm jaterní fibrózy i portální hypertenzí
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

