-
Medical journals
- Career
Sarkomatoidný karcinóm močového mechúra s heterológnou osteosarkomatóznou diferenciáciou
Authors: Karol Kajo 1; Vladimír Baláž 2; Katarína Macháleková 1,3; Peter Čunderlík 1; Milan Švec 2; Jozef Babeľa 2
Authors‘ workplace: BB BIOCYT diagnostické centrum s. r. o. Banská Bystrica 1; II. urologická klinika SZU vo FNsP F. D. Roosevelta, Banská Bystrica 2; Oddelenie patológie, Onkologický ústav sv. Alžbety s. r. o., Bratislava 3
Published in: Ces Urol 2011; 15(2): 120-125
Category: Case report
Overview
Na konkrétnom prípade poukázať na histomorfologické a klinické charakteristiky zriedkavého sarkomatoidného karcinómu (SC) s heterológnou osteosarkomatóznou diferenciáciou v močovom mechúri.
Išlo o 78-ročného muža s masívnou makroskopickou hematúriou a s ultrasonograficky a CT potvrdeným nádorom močového mechúra veľkosti 50 × 45 mm, bez dokázaných známok diseminácie do vzdialených orgánov. V materiáli z transuretrálnej resekcie bol histologicky potvrdený malígny bifázický nádor s karcinómovou zložkou z prechodného epitelu s vysokým stupňom malignity a s osteosarkómovým mezenchymálnym komponentom. Imunohistochemickou analýzou bola dokázaná expresia epitelových markerov (cytokeratíny, epitelový membránový antigén) v karcinómovom komponente, pričom v osteosarkómovej zložke nebola dokázaná pozitivita týchto antigénov. Pre komorbiditu bolo upustené od ďalšej chirurgickej liečby a pacient následne podstúpil kombinovanú rádioterapiu s chemoterapiou.
SC s heterológnou osteosarkómovou diferenciáciou je zriedkavým nádorom v močovom mechúre, na ktorý je treba myslieť v rámci spektra tumoróznych lézií, pretože sa vyznačuje rýchlym rastom a agresívnym správaním.Kľúčové slová:
karcinosarkóm, močový mechúr, osteosarkóm, sarkomatoidný karcinóm.ÚVOD
Najčastejšími malígnymi nádormi v močovom mechúre sú uroteliálne karcinómy – UC (synonymum „transitional cell carcinoma“). V rámci skupiny týchto tumorov sú známe aj zriedkavé varianty, medzi ktoré patrí sarkomatoidný karcinóm – SC (1). SC predstavuje približne 0,3 % všetkých nádorov močového mechúra (2).
V histologickom obraze SC pripomína rôzne malígne transformované mezenchýmové tkanivá, čiže sarkómy, pričom môže alebo aj nemusí obsahovať heterológne elementy. Z heterológnych diferenciácií bývajú najčastejšie zastúpené tkanivá pripomínajúce osteosarkóm, chondrosarkóm, leiomyosarkóm, malígny fibrózny histiocytóm, fibrosarkóm a rabdomyosarkóm (3–6).
Doteraz bolo vo svetovom písomníctve zaznamenaných približne 90 prípadov SC močového mechúra, z ktorých menej ako 35 bolo s oseálnou diferenciáciou (7, 8). V práci prezentujeme ďalší prípad SC s osteosarkómovým mezenchymálnym komponentom a zároveň poukazujeme na jeho niektoré klinické a histomorfologické charakteristiky.
Kazuistika
Išlo o 78-ročného muža, nefajčiara, bez kontaktu s karcinogénmi a s anamnézou ischemickej choroby srdca a arteriálnej hypertenzie, ktorý v predchorobí neudával vážnejšie ťažkosti s močením. Pacient bol prijatý na hospitalizáciu v spádovej nemocnici pre výraznú makroskopickú hematúriu s tamponádou močového mechúra a kompletnou retenciou moču. Najprv mu bol zavedený močový katéter a boli podané hemostyptiká. Na primárnom pracovisku ultrasonografické vyšetrenie dokázalo krvné koagulá v močovom mechúri a bolo vyjadrené podozrenie na nádor obličky. Doplňujúcim CT vyšetrením sa našli viacpočetné jednoduché cysty v oboch obličkách a infiltratívny proces v močovom mechúre veľkosti 50 × 45 mm, bez vyjadrenia rozsahu nádorovej infiltrácie spádovým radiológom (obr. 1). Následne bol pacient odoslaný na liečbu na vyššie pracovisko, kde bola realizovaná cystoskopia v celkovej anestézii. Pasáž uretrou bola voľná, endoskopicky v oblasti pravého ústia a pravej bočnej steny bol nájdený rozsiahly tumorózny infiltratívny proces, veľkosti do 7 cm. Útvar bol na povrchu nekrotický, rozpadnutý, krvácavý, s početnými inkrustáciami. Vzhľadom na jeho rozsah bola urobená transuretrálna resekcia vo dvoch etapách. Priebeh resekcie bol komplikovaný pre značnú tvrdosť nádoru, pričom došlo k zničeniu dvoch resekčných slučiek. Makroskopicky bol nádor kompletne zresekovaný. Pooperačný priebeh bol priaznivý a pacient bol s voľným močením a bez hematúrie prepustený do domáceho liečenia.
Image 1. Nádor močového mechúra v obraze počítačovej tomografie (označený šípkou) Fig. 1. Tumour of the urinary bladder in computer tomography image (arrow) 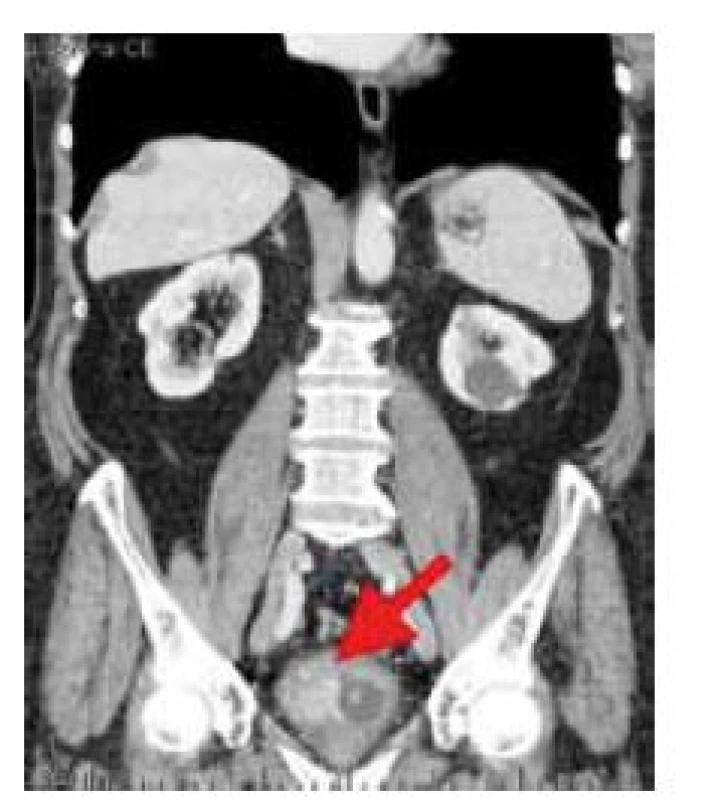
Makroskopicky išlo v materiáli po resekcii o približne 30–40 cm3 rezkov nádorového tkaniva šedobelavej farby, s okrskami krvácania a nekróz.
V histologickom obraze nádorové tkanivo vykazovalo bifázickú skladbu, ktorá pozostávala jednak zo zreteľných okrskov UC s vysokým stupňom malignity, ako aj z rozsiahlych ložísk osteosarkómového charakteru (obr. 2 a 3). Pri bežnom farbení hematoxylín-eozínom (HE) obe zložky súvisle do seba prechádzali, takže medzi nimi nebola zreteľná hranica. Imunohistochemicky boli epitelové markery (cytokeratíny a epitelový membránový antigén) exprimované v nádorových bunkách epitelového komponentu, ale neboli prítomné v osteosarkómovej zložke (obr. 4), ktorá bola pozitívna len pri dôkaze vimentínu. V nádore sa vyskytovali rôzne rozsiahle okrsky regresívnych zmien v zmysle nekrózy a myxoidnej degenerácie. Nádorové hmoty boli v celom rozsahu vyšetrených vzoriek, a teda tumor infiltroval aj svalovú vrstvu steny močového mechúra.
Image 2. Histomorfologická skladba sarkomatoidného karcinómu s heterológnou osteosarkomatóznou diferenciáciou – v pravej časti obrázka je karcinómová zložka s vysokým stupňom malignity a vľavo je osteosarkómový komponent (HE × 200) Fig. 2. Histomorphological composition of sarcomatoid carcinoma with heterogonous osteosarcomatous differentiation – high-grade carcinomatous component is on the right and mesenchymal component is on the left (HE × 200) 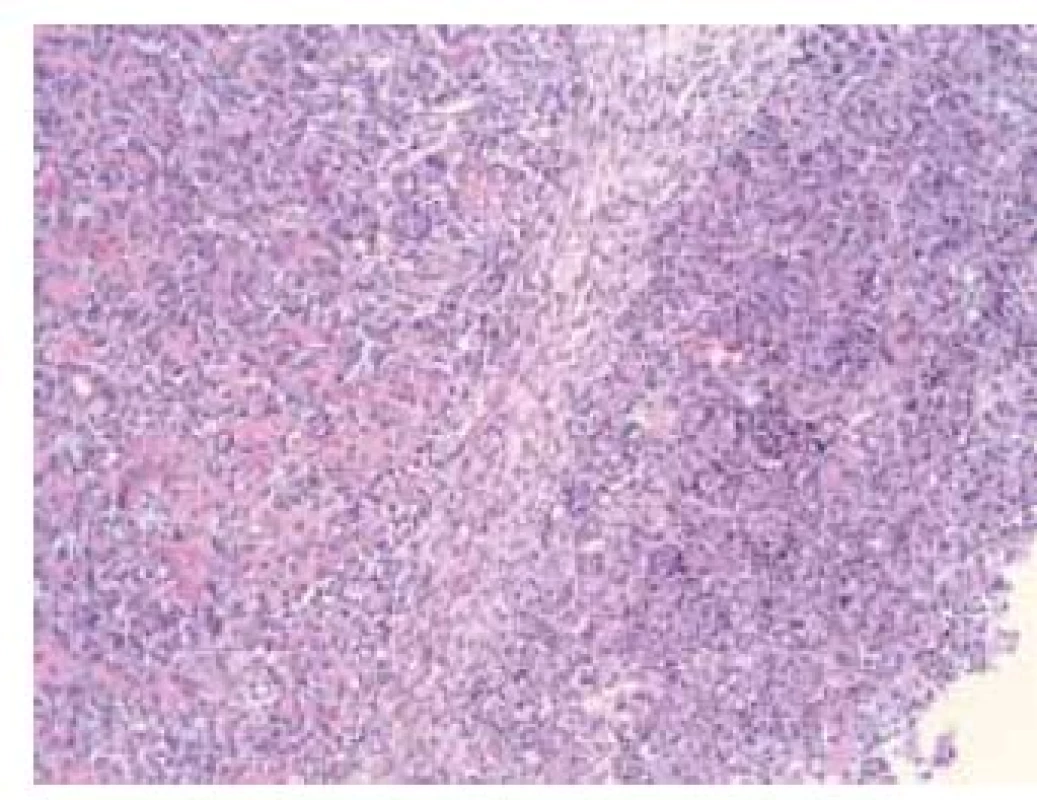
Image 3. Detail na osteosarkómový komponent s tvorbou osteoidu (HE × 400) Fig. 3. Detail on the osteosarcomatous component with osteoid production (HE × 400) 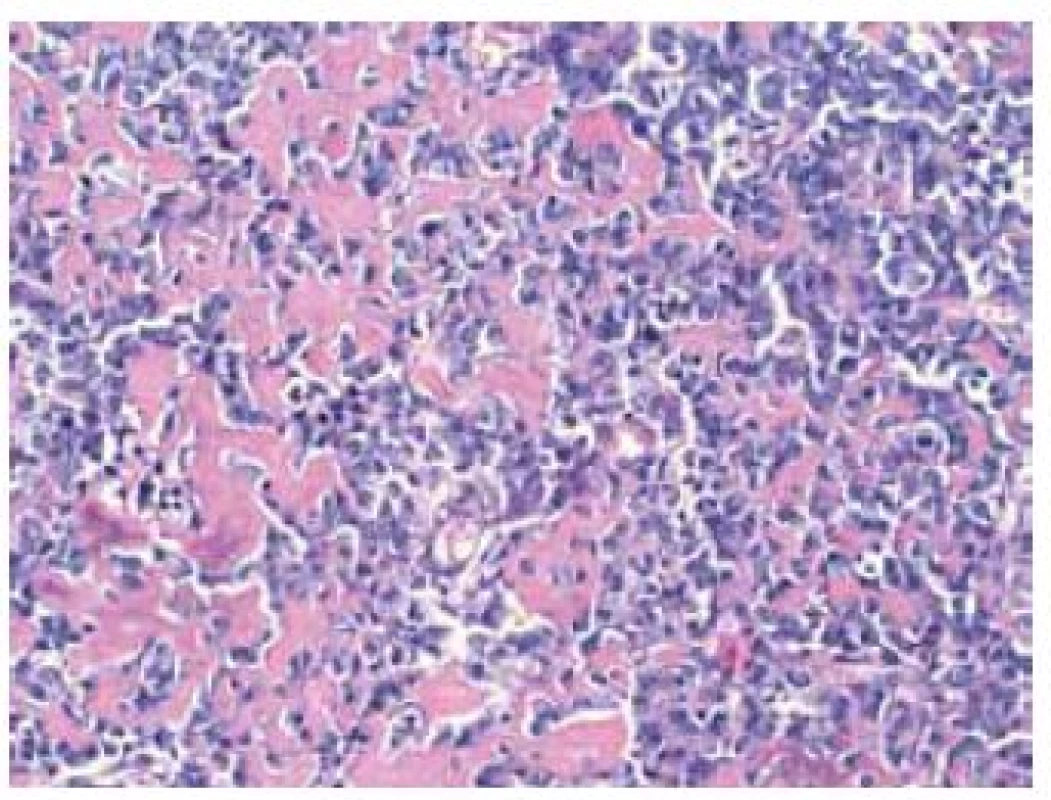
Image 4. Imunohistochemický dôkaz cytokeratínu typ 7 v epitelovej zložke v pravej časti, osteosarkómový komponent vľavo je negatívny Fig. 4. Immunohistochemical detection of cytokeratin type 7 in epithelial component on the right part of the picture, osteosarcomatous component in the left is negative 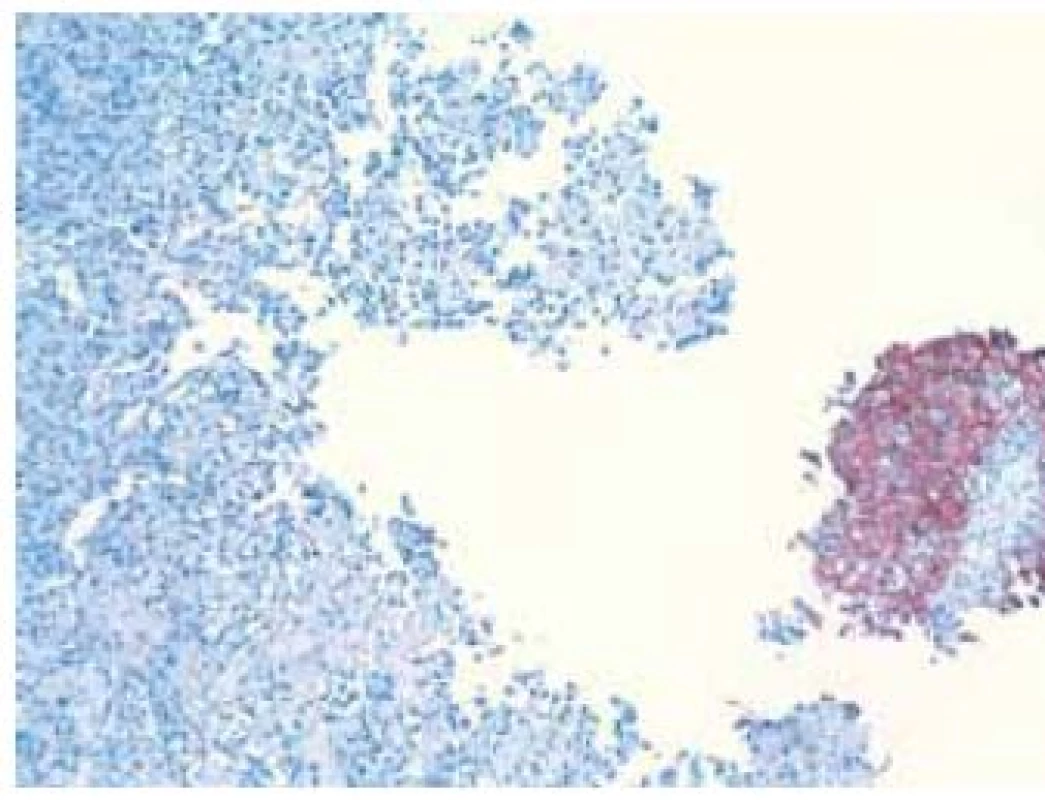
Pre závažný interný nález (celková ateroskleróza so subkompenzovanou ischemickou chorobou srdca) bolo u pacienta upustené od ďalšej radikálnej operačnej liečby. Po následnej paliatívnej cytoreduktívnej transuretrálnej resekcii bol konzultovaný onkológ, ktorý indikoval kombinovanú liečbu rádioterapie s chemoterapiou. Celkovo bola pacientovi aplikovaná externá rádioterapia na močový mechúr a lymfatickú drenáž v dávke 50,4 Gy s boostom na močový mechúr a tumor do celkovej tumorovej dávky (CTD) 61,2 Gy so štyrmi cyklami gemcitabinu týždenne. Pacient ostal v sledovaní onkourológa v relatívne dobrom stave s nálezom bilaterálnej ureterohydronefrózy, ktorá sa následne reaktívne vyvinula vplyvom hojenia po rozsiahlej resekcii nádoru v blízkosti oboch ústí. Hladina kreatinínu bola 133 μmol/l a pacient je bez známok krvácania. Ani po roku sledovania neboli vzdialené metastázy dokázané.
Diskusia
SC predstavujú značne heterogénnu skupinu nádorov. Zaraďujú sa sem jednak monofázické neoplazmy, ktoré v celom rozsahu pripomínajú sarkómy alebo bifázické nádory so zreteľným malígnym epitelovým a mezenchýmovým komponentom, pričom medzi oboma zložkami môže byť plynulý alebo ostrý prechod. Tieto bifázické nádory môžu v rámci mezenchymálneho komponentu vykazovať rôzne homológne alebo heterológne tkanivové diferenciačné línie. Jednou z možných heterológnych línií je oseálna diferenciácia, keď sú v nádore prítomné okrsky osteosarkómového charakteru. Epitelová zložka je najčastejšie vo forme UC s vysokým stupňom malignity, ako bolo vyznačené aj v našom prípade, ale boli opísané aj typy malobunkového a skvamózneho karcinómu alebo kombinácie viacerých typov epitelových malignít (3–6).
V literatúre bývajú SC označované viacerými názvami, pričom najčastejšie sa používa termín karcinosarkóm. Stotožňujeme sa s názorom (8), že termín karcinosarkóm je vhodnejší a viac ilustratívny pre pochopenie histologickej skladby nádoru ako pojem SC, ktorý je v súčasnosti platným pomenovaním podľa klasifikácie WHO (1). SC častejšie postihujú mužov ako ženy, a to v pomere 1,7–4 : 1,0. Vekové rozpätie pacientov je síce pomerne široké (od 21 do 91 rokov a s priemerom 66,4 roka), ale väčšina prípadov je diagnostikovaných v 7. decéniu života (6, 8).
Makroskopicky sa tieto nádory prezentujú ako polypoidné útvary alebo zvredovatelé ložiská, ktoré sa klinicky prejavujú rýchlym rastom, hematúriou, dyzúriou a retenciou moču (6, 7). Boli opísané aj prípady s perforáciou močového mechúra (9), prípadne bolesťou v podbruší (10).
Etiopatogenéza SC je dosiaľ neznáma. Za hlavný rizikový faktor sa podobne ako pri ostatných UC považuje fajčenie (8). U niektorých pacientov bola v anamnéze zaznamenaná radiačná terapia alebo chemoterapia. Tiež bola opísaná transformácia konvenčného UC do karcinosarkómu vplyvom liečby cyklofosfamidom a rádioterapiou (5, 10), resp. došlo k progresii konvenčného UC do karcinosarkómu po BCG imunoterapii (2). Bunkový pôvod týchto nádorov je predmetom mnohých diskusií. Predpokladá sa, že tieto nádory vznikajú z jednej totipotentnej neoplastickej kmeňovej bunky so schopnosťou derivácie do rôznych terminálne diferencovaných buniek. Túto hypotézu podporujú práce, v ktorých boli v sarkomatóznej zložke imunohistochemicky dokázané markery (napr. cytokeratíny) alebo ultraštrukturálne organely epitelovej diferenciácie (tonofilamentá, dezmozómy). Vysvetlením by mohol byť aj proces označovaný ako epitelovo-mezenchymálny prechod (angl. „epithelial-mesenchymal transition“), pri ktorom dochádza k transformácii epitelových buniek do mezenchýmových prostredníctvom špeciálneho transkripčného programu (11). V priebehu epitelovo-mezenchymálneho zvratu dochádza k zmenám vo fenotype buniek spočívajúcej v reorganizácii cytoskeletu (poklesu expresie cytokeratínov a narastajúcej akumulácii vimentínu) a k uvoľneniu medzibunkových spojov. V súčasnosti sa upúšťa od hypotézy, že ide o kolíziu dvoch histogeneticky odlišných nádorov.
Exaktná diagnostika týchto nádorov je možná len na základe histomorfologického vyšetrenia, pričom bioptická diagnostika týchto nádorov nie je ťažká a už z preparátov ofarbených konvenčným HE je možné vo väčšine prípadov stanoviť ich presný typ. Odporúča sa však dodatočné imunohistochemické vyšetrenie za účelom definitívneho stanovenia zastúpení jednotlivých diferenciačných línií v rámci mezenchýmového komponentu. Karcinomatózny komponent býva charakteristicky pozitívny pri dôkaze markerov epitelovej diferenciácie, napr. cytokeratínov (10), ako to bolo aj v našom prípade. Tieto nádory sú v mezenchýmovom komponente pozitívne pri dôkaze vimentinu a tiež môžu vykazovať expresiu ďalších tkanivovo-špecifických antigénov, ako napr. svalových markerov pri leiomyosarkóme alebo rabdomyosarkóme (10), či S-100 proteínu pri chondrosarkomatóznej alebo liposarkomatóznej diferenciačnej línii.
Diferenciálne diagnosticky pri nádoroch mechúra s oseálnou zložkou okrem karcinosarkómu do úvahy pripadajú len primárny osteosarkóm, UC s kostnou a chrupavčitou metapláziou a benígne reaktívne lézie s okrskami regresívnych dystrofických kalcifikácií a osifikácií. Primárny osteosarkóm močového mechúra je extrémne zriedkavý a nie sú v ňom prítomné okrsky jednoznačnej epitelovej diferenciácie. Mnohí z autorov pochybujú o jeho existencii a niektoré opísané prípady v literatúre považujú za nedôsledne vyšetrené SC s prehliadnutím epitelového komponentu (7). Konvenčný UC s oseálnou metapláziou je obvykle na rozdiel od SC nádor s nízkym stupňom malignity, v ktorom kostná zložka vykazuje zrelú lamelárnu architektúru a jej bunky sú bez atypie. Benígne reaktívne lézie nevykazujú atypické črty charakteristické pre neoplastický rast, napr. atypické mitózy.
Optimálna liečba nie je známa a skúsenosti s terapiou sú malé už aj pre fakt, že tieto nádory sú extrémne zriedkavé a väčšina doteraz opísaných prípadov bola prezentovaná len vo forme kazuistík. Všeobecne sa odporúča kombinácia chirurgickej liečby (radikálna cystektómia alebo transuretrálna resekcia) s následnou rádioterapiou, aj keď výsledky tejto liečby sú rôzne (10). Pri samotnej chemoterapii bola len sporadicky zaznamenaná kompletná remisia metastatického SC močového mechúra liečeného gemcitabínom a cisplatinou (12). V našom prípade platina nebola podávaná pre mierne zvýšené hodnoty kreatinínu.
Prognóza SC je zlá. Výsledky z Mayo kliniky za dlhé obdobie 1936–1995 potvrdili, že takmer všetci pacienti majú už v čase diagnózy infiltráciu svalovej vrstvy mechúra a väčšina z nich zomiera na lokálnu progresiu alebo metastázy v lymfatických uzlinách, pľúcach, pleure, mozgu, pečeni alebo v kostiach (2, 4). Až 75 % prípadov býva v II. a III. štádiu ochorenia (8), pričom práve patologické štádium sa zatiaľ ukazuje ako najlepší prognostický faktor. Približne 70 % pacientov zomiera v priebehu jedného až 48 mesiacov (1), pričom podľa najnovších literárnych zdrojov je 1-, 5 - a 10-ročné prežívanie zaznamenané len u 53,9 %, 28,4 % a 25,8 % prípadov (13). V predikcii prognózy tohto ochorenia bude dôležité definovanie ďalších histomorfologických znakov, k čomu však bude potrebné podchytenie viacerých pacientov s týmto ochorením a ich dôsledný follow-up.
Záver
SC s heterológnou osteosarkómovou diferenciáciou je síce zriedkavým nádorom v močovom mechúre, ale treba naň myslieť v rámci spektra tumoróznych lézií, pretože sa vyznačuje rýchlym rastom a agresívnym správaním.
Došlo: 21. 9. 2010.
Přijato: 17. 11. 2010.
Kontaktní adresa
doc. MUDr. Karol Kajo, PhD.
BB BIOCYT diagnostické centrum, s.r.o.
Námestie Ľ. Svobodu 1,
975 17 Banská Bystrica,
Slovenská republika
e-mail: karol.kajo@jfmed.uniba.sk
Sources
1. Eble JN, Santer G, Epstein JI, Sesterhenn IA. World Health Organization Classification of Tumours: Pathology and Genetics of Tumours of the Urinary System and Male Genital Organs. Lyon: IARC Press 2004; 359.
2. Arenas LF, Fontes DA, Pereira EM, Hering FL. Sarcomatoid carcinoma with osseous differentiation in the bladder. Int Braz J Urol 2006; 32 : 563–565.
3. Torenbeek R, Blomjous CM, de Bruin PC, Newling DWW, Meiler CJLM. Sarcomatoid carcinoma of the urinary bladder. Am J Surg Pathol 1994; 18 : 241–249.
4. Lopez-Beltran A, Pacelli A, Rothenberg HJ, et al. Carcinosarcoma and sarcomatoid carcinoma of the bladder: clinicopathological study of 41 cases. J Urol 1998; 159 : 1497–1503.
5. Sigal SH, Tomaszewski JE, Brooks JJ, Wein A, LiVolsi VA. Carcinosarcoma of bladder following long-term cyclophosphamide therapy. Arch Path Lab Med. 1991; 115 : 1049–1051.
6. Maestroni U, Giollo A, Barbieri A, et al. Bladder carcinosarcoma: a case observation. Acta Bio Medica Ateneo Parmense 2004; 75 : 74–76.
7. Perret L, Chaubert P, Hessler D, Guillou L. Primary heterologous carcinosarcoma (metaplastic carcinoma) of the urinary bladder. A clinicopathologic, immunohistochemical, and ultrastructural analysis of eight cases and a review of the literature. Cancer 1998; 82 : 1535–1549.
8. Baschinsky DY, Chen JH, Vadmal MS, et al. Carcinosarcoma of the urinary bladder – an agressive tumor with diverse histogenesis. A clinicopathologic study of 4 cases and review of the literature. Arch Pathol Lab Med 2000; 124 : 1172–1178.
9. Atsuko F, Yasunori K, Kazuya M, Mutsumi U. Sarcomatoid carcinoma of the urinary bladder with a spontaneous perforation: a case report. Acta Urol Jpn 2002; 48 : 607–610.
10. Naiki T, Kawai N, Nagata D, Andoh Y, Kamisawa H, Katoh T, Akita H, Okamura T. Carcinosarcoma of the urinary bladder with rapid growth: a case report. J Rural Med 2009; 4 : 27–31.
11. DeWever O, Pauwels P, CeCraene B, et al. Molecular and pathological signatures of epithelialmesenchymal transitions at the cancer invasion front. Histochem Cell Biol 2008; 130 : 481–494.
12. Froehner M, Gaertner HJ, Manseck A, Wirth MP. Durable complete remission of metastatic sarcomatoid carcinoma of the bladder with cisplatin and gemcitabine in an 80-year-old man. Urology 2001; 58 : 799.
13. Wang J, Wang FW, LaGrange CA, Henstreet GP, Kessinger A. Clinical features of sarcomatoid carcinoma (carcinosarcoma of the urinary bladder: analysis of 221 cases. Sarcoma 2010; article ID 454792, doi:10.1155/2010/454792.
Labels
Paediatric urologist Nephrology Urology
Article was published inCzech Urology

2011 Issue 2-
All articles in this issue
- Neurální kontrola dolních močových cest
- Lichen sclerosus – stále přehlížená urologická diagnóza se závažnými komplikacemi
- Karbonická anhydráza IX (CA IX) a její exprese u adenokarcinomu ledviny a uroteliálních nádorů močového měchýře
- Role laparoskopie v urologii
- Nehmatné varle u dítěte: začít diagnostickou laparoskopií nebo otevřenou revizí třísla?
- Léčba neurogenní hyperaktivity detruzoru botulinumtoxinem A – první zkušenosti se subslizniční aplikací
- Výsledky léčby retroperitoneálních sarkomů a jejich hlavní rizika
- Sarkomatoidný karcinóm močového mechúra s heterológnou osteosarkomatóznou diferenciáciou
- Extrakce kalcifikované spirály z močového měchýře s použitím Holmiového laseru
- Czech Urology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Lichen sclerosus – stále přehlížená urologická diagnóza se závažnými komplikacemi
- Neurální kontrola dolních močových cest
- Nehmatné varle u dítěte: začít diagnostickou laparoskopií nebo otevřenou revizí třísla?
- Karbonická anhydráza IX (CA IX) a její exprese u adenokarcinomu ledviny a uroteliálních nádorů močového měchýře
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

