-
Medical journals
- Career
Kardiovaskulární komorbidity a ateroskleróza u systémového lupus erythematodes
Authors: A. Smržová; P. Horák
Authors‘ workplace: Fakultní nemocnice a Univerzita Palackého, Olomouc ; III. interní klinika – nefrologická, revmatologická a endokrinologická
Published in: Čes. Revmatol., 25, 2017, No. 3, p. 141-147.
Category: Original article
Overview
Cílem studie je detekce subklinické aterosklerózy pomocí měřením tloušťky intima media a její vztah ke kardiovaskulárním manifestacím, tradičním rizikovým faktorů, klinickým projevům, imunologickému profilu a vybraným laboratorním markerům.
Metody:
Pacienti byli vyšetřeni v období od března 2015 do ledna 2016. Bylo vyšetřeno čtyřicet dva pacientů se SLE (5 mužů, 37 žen). U těchto pacientů byly detekovány tradiční rizikové faktory, klinické projevy, imunologický profil, aktivita choroby a kumulativní poškození pomocí skórovacích systémů SELENA-SLEDAI 2K a SLICC, kumulativní dávka glukokortikoidů, doba trvání onemocnění, přítomnost kardiovaskulárních příhod. Výsledky byly zhodnoceny statisticky.Výsledky:
Patologické IMT bylo zjištěno u 10 pacientů (23,8 %), přítomnost plátů u 7 respondentů (13,7 %). Subklinická ateroskleróza hodnocená alespoň jedním parametrem byla detekována u 14 pacientů (33 %). IMT korelovalo (p ≤ 0,5) s věkem pacientů, s věkem v době diagnózy, délkou a intenzitou kouření, anamnézou ischemické choroby srdeční a cévní mozkové příhody, indexem poškození SLICC, nízkou hladinou trombocytů a C3 komplementu, vysokým titrem antikardiolipinových protilátek IgG i IgM. Přítomnost plátů korelovala s věkem, věkem v době diagnózy, délkou a intenzitou kouření „kouřoroky“, anamnézou ICHS, indexem poškození SLICC a nízkou hladinou trombocytů.Závěr:
IMT a detekce plaků jsou velmi důležité markery subklinické aterosklerózy. V našem souboru i v četných dalších studiích korelují s tradičními rizikovými faktory a aktivitou onemocnění, jsou dobrým prognostickým faktorem přítomnosti kardiovaskulárních komorbidit.Klíčová slova:
Systémový lupus erythematodes, kardiovaskulární komorbidity, ateroskleróza, tloušťka intima media
Nemoci oběhové soustavy jsou na prvním místě v příčině úmrtí ve všeobecné populaci. V České republice v roce 2015 činil podíl kardiovaskulárních příhod na celkové standardizované úmrtnosti 43 % (u mužů to bylo 41,8 %, u žen 44,9 %) (1). Profil úmrtnosti na kardiovaskulární onemocnění a revmatologické diagnózy shrnuje graf 1. V celkových číslech by se mohlo zdát, že úmrtnost spojená se systémovými chorobami pojiva je nízká, je však třeba vzít v potaz fakt, že řada úmrtí je finálně přiřazena jiným jednotkám a komorbiditám, které mohou se systémovými chorobami úzce souviset (1). Nejde ale jen o úmrtnost pacientů, systémové choroby pojiva jsou spojeny rovněž s vyšší nemocností. V pracovní neschopnosti pro diagnóze systémové choroby pojiva bylo v roce 2012 12,1/100 000 pacientů s průměrnou délkou pracovní neschopnosti 80,2 dne. Rovněž počet hospitalizací činil nezanedbatelné číslo, 47 000 s průměrnou délkou hospitalizace 7,4 dne (1).
Graph 1. Úmrtnost na kardiovaskulární a revmatologická onemocnění v České republice (počet/100,000 obyvatel). Data: Ústav zdravotnických informací a statistiky České republiky 2015. 
Systémový lupus erythematodes (SLE) je typickým představitelem systémové choroby pojiva s četnými orgánovými manifestacemi a komplikacemi, kdy kardiovaskulární projevy jsou na předním místě v morbiditě i mortalitě pacientů. Vysoké riziko kardiovaskulárních příhod u pacientů s SLE bylo popsáno již v roce 1976 (2). Urowitz a Gladman popsali bimodální model úmrtnosti pacientů se SLE, kdy první vrchol přisoudili aktivitě choroby. Druhý, pozdější nárůst úmrtnosti souvisel s pozdními manifestacemi a komplikacemi choroby s nárůstem indexu poškození a také vedlejšími účinky léčby. Zlepšením diagnostických a léčebných metod SLE se právě druhý vrchol nárůstu úmrtí stává důležitým terapeutickým a preventivním cílem. Poslední studie ukazují, že pacienti s SLE mají 2,66krát větší riziko kardiovaskulárních příhod než běžná populace (3). Tradiční rizikové faktory nejsou jediným parametrem způsobujícím aterosklerózu u systémového lupusu. Po adjustaci rizikových faktorů je relativní riziko nefatálního infarktu 10,1, ischemické srdeční choroby 7,5, cévní mozkové příhody 7,9 a smrti v důsledku ischemické choroby srdeční 17,0 (4). Zvyšuje se také potřeba i délka hospitalizace pacientů s SLE (5). Vzhledem k těmto skutečnostem se jeví detekce subklinické aterosklerózy u pacientů s SLE jako velmi důležitá složka účinné prevence.
Metody
V naší studii jsme se zaměřili na detekci tloušťky intima media (intima media thickness – IMT) a přítomnost aterosklerotických plátů u pacientů se SLE. V období od března 2015 do ledna 2016 bylo vyšetřeno 42 pacientů s SLE (5 mužů, 37 žen) splňujících klasifikační kritéria ACR (American College of Rheumatology) pro SLE (6). Průměrný věk činil 40,2 (± 12,4) let a délka trvání choroby 10,4 (± 6,7) let. U pacientů s SLE jsme hodnotili klinické manifestace a anamnézu kardiovaskulárních příhod, kde pokladem je ateroskleróza (ischemická choroba srdeční manifestovaná jako angina pectoris, infarkt myokardu či srdeční selhání, cévní mozková příhoda – CMP). Jednalo se o diagnózy stanované kardiologem či neurologem dle doporučení jednotlivých společností identifikované rozborem dokumentace pacienta. Hodnotila se aktivita choroby a index poškození (určení remise, skórovací systémy SLEDAI-2K a SLICC) (7, 8). Byly zhodnoceny tradiční rizikové faktory. Obezita a nadváha hodnocena pomocí BMI (hmotnostně – výškový index). Kouření se hodnotilo anamnesticky dle dokumentace a dle rozhovoru s nemocným. Dyslipidémie byla stanovena jako minimálně jeden patologický laboratorní odběr – celkového cholesterolu, triglyceridů, HDL a LDL cholesterolu. Z dalších rizikových faktorů byla zjišťována přítomnost diabetu a arteriální hypertenze dle doporučení České diabetologické a Kardiologické společnosti (9, 10). Byla spočtena průměrná a kumulativní dávka glukokortikoidů jako významný rizikový faktor aterosklerózy. Z laboratorních parametrů byly hodnoceny high sensitivity C-reaktivní protein (hsCRP, při vyloučení infekční příčiny jeho elevace – norma 0–5 mg/l), lipidogram (celkový cholesterol – 2,9–5,0 mg/l, patologické hodnoty nad 5,0 mg/l, triglyceridy – 0,45–1,7 mmol/l, patologické hodnoty nad 1,7 mmol/l, lipoproteiny s vysokou hustotou – HDL – 1,2–2,7 mmol/l, patologické hodnoty pod 1,2 mmol/l, lipoproteiny s nízkou hustotou – LDL – 1,2–3,0 mmol/l, patologické hodnoty nad 3,0 mmol/l, jako dyslipidémie byl hodnocen alespoň jeden patologický nález), imunologické parametry (hladiny C3 a C4 složky komplementu – 0,98–1,97 g/l, resp. 0,12–0,4 g/l, patologické hodnoty nižší než 0,98 resp. 0,12 g/l, anti-dsDNA protilátky – pozitivní nad 20 UI/ml, antinukleozomální protilátky – ANUC – pozitivní nad 20 UI/ml). Všichni pacienti absolvovali ultrasonografické vyšetření karotického řečiště – hodnoceno jedním certifikovaným vyšetřujícím dle standardizovaného protokolu po 30 minutách klidového režimu. Byla měřena hodnota tloušťky intima media a přítomnost plátů. Hodnocena byla vrstva intimy 1 cm proximálně od bulbu karotidy, v místě bez přítomností plátů za EKG synchronizace, bylo provedeno pět vyšetření na každé straně a stanoven průměr. Přítomnost plátů byla hodnocena v celé délce karotického řečiště. V běžné populaci není jednoznačně stanovaná patologická hodnota IMT, nicméně většina prací a doporučení stanovuje patologickou hodnotu IMT nad 0,9 mm. Práce zaměřující se na věkové rozvrstvení populace a také Evropská kardiologická společnost udávají normální hodnoty respondentů mladších 40 let 0,6 mm (11, 12). K hodnocení distribuce jednotlivých dat byl použit Shapiro-Wilkův test normality. Byly hodnoceny následující modality: průměr, standardní odchylka, medián, minimální a maximální hodnota. Rozdíly mezi jednotlivými hodnocenými skupinami byly hodnoceny pomocí Mann-Whitneyho testu s korekcí. Korelace byly hodnoceny pomocí Spearmanova korelačního koeficientu. Hodnoty p < 0,05 byly považovány za statisticky významné. Ke zpracování byl použit statistický software Anova 2010.
Výsledky
Podle klinických projevů aktivity choroby (SLEDAI-2K) a imunologické aktivity (snížení komplementu, patologické hodnoty anti ds DNA) byli pacienti rozděleni do tří skupin – úplná remise (bez klinických projevů i imunologické aktivity – 8 pacientů), parciální remise (přítomnost maximálně jednoho klinického projevu hodnoceného dle SLEDAI 2K 1-4 body bez imunologické aktivity či pouze samotná imunologická aktivita – 18 pacientů) a aktivní onemocnění (klinické projevy i imunologická aktivita – 16 pacientů). Průměrná hodnota SLEDAI-2K 7,2 ± 7,3 a SLICC byla 1,2 ± 1,7. Lupusová nefritida byla prokázána u 22 nemocných. Postižení CNS vykazovalo 10 pacientů. Klasifikační hematologické projevy byly v době provedení studie přítomny u 14 nemocných a muskuloskeletární projevy v 32 případech.
Z vybraných komorbidit byla sledována přítomnost arteriální hypertenze (20 pacientů), diabetes melitus měli 4 pacienti a osteoporóza byla diagnostikována u 6 žen.
Kardiovaskulární příhody na podkladě aterosklerózy byly v anamnéze zjištěny u sedmi pacientů. Čtyři pacienti měli diagnostikovanou anginu pectoris, pět pacientů ischemickou mozkovou příhodu, u dvou pacientů byla anamnéza infarktu myokardu a u pěti srdečních selhání. Tři pacienti měli více než jednu kardiovaskulární příhodu.
V našem souboru byla průměrná délka užívání glukokortikoidů 91,6 ± 76,4 měsíců, průměrná kumulativní dávka 16,5 ± 15,7 g a průměrná denní dávka 7,9 ± 8,2 mg.
Z tradičních rizikových faktorů bylo hodnoceno BMI (průměr 24,7 ± 4,8 kg/m2), v mezích nadváhy a obezity bylo 13 pacientů (BMI nad 25 kg/m2, 30,9 %). Celkem kouřilo 13 pacientů (8 aktivních kuřáků, 19 %) a 5 exfumatorů (11,9 %), průměrná délka kouření byla 4 tzv. „kouřo-roky“ (každý den vykouřená 1 krabička – 20 cigaret po celý rok). Dyslipidémie byla přítomna u 31 pacientů (73,8 %) s hodnotou celkového cholesterolu 4,1 ± 1,4mmol/l a triglyceridů 1,7 ± 0,8 mmol/l. Diagnózu arteriální hypertenze mělo 20 respondentů (47,6 %). Hodnocení kardiovaskulárního rizika podle hsCRP bylo následující: vysoké riziko nad 5 mg/l mělo 6 pacientů (14,3 %) a stejný počet respondentů bylo ve středním riziku hsCRP 3–5 mg/l (9). Nízkou hladinu C3 složky komplementu mělo 27 pacientů (64,3 %, průměrná hodnota 0,89 ± 0,2 mg/l). Snížení C4 složky bylo zachyceno u 16 vyšetřených (38,1 %, průměrná hodnota 0,14 ± 0,06). Vysoké hladiny anti ds-DNA a antinukleozomálních protilátek byly naměřeny u 28 resp. 38 pacientů (71 %resp. 90,5 %, průměrná hodnota anti ds-DNA 70,7 ± 71UI/ml a ANUC 120,7 ± 69,9UI/ml). Profil souboru shrnuje tabulka 1.
Table 1. Sledované parametry souboru. 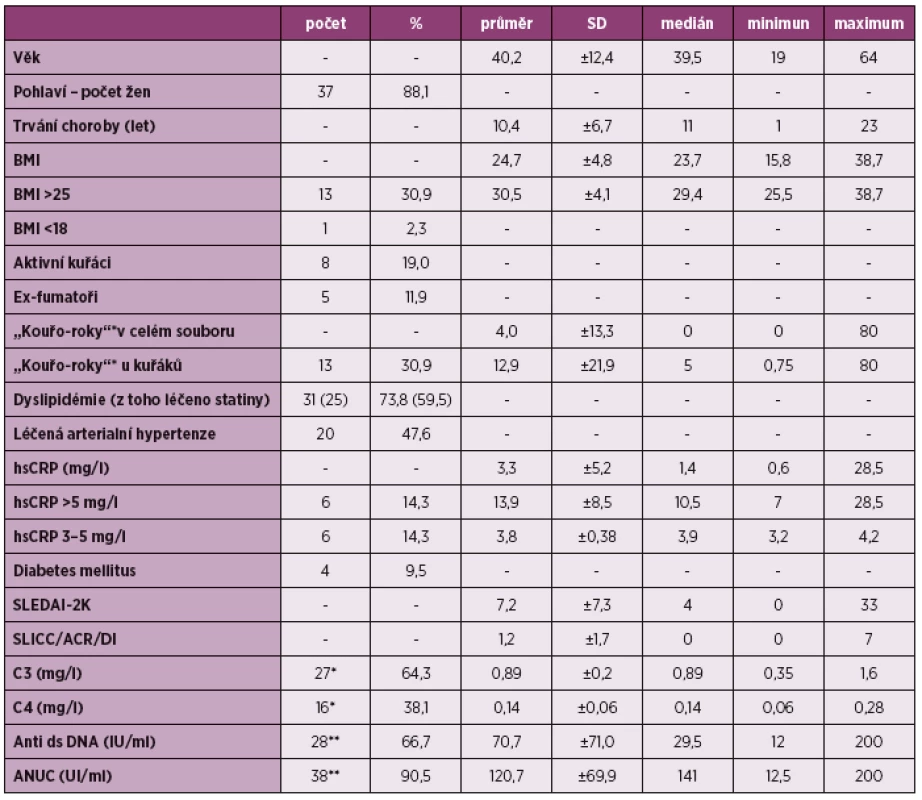
* “kouřo-roky” – počet let, kdy dotyčný kouří 20 cigaret/denně (1 krabičku) ** počet pacientů s hodnotami nižších než norma *** počet pacientů s hodnotami vyšších než norma SD – směrodatná odchylka, BMI – body mass index (hmotnostně-výškový index), hsCRP – vysoce rozlišujicí C-reaktivní protein, SLEDIA-2K – skórovací systém aktivity systémového lupusu (Systemic Lupus Erythematosus Disease Activity Index), SLICC/ACR/DI – skórovací systém hodnotící kumulativní poškození u pacientů se systémovým lupusem (Systemic Lupus International Collaborating Clinics/American College of Rheumatology Damage Index), C3 – složka komplementu, C4 – složka komplementu, anti ds DNA – protilátky proti dvoušroubovici DNA, ANUC – antinukleozomální protilátky Ultrasonografické měření IMT a přítomnosti plátů prokázalo nadhraniční hodnoty IMT (≥ 0,6 mm) u 10 pacientů (23,8 %) a detekované pláty u 7 respondentů (16,7 %). Přítomnost obou sledovaných parametrů byla u 3 pacientů (7,1 %). Ultrasonograficky detekovanou subklinickou aterosklerózu (přítomnost plátu či patologická hodnota IMT) jsme zjistili u 14 vyšetřených (33,3 %).
Ke statistickému zhodnocení jsme volili korelace IMT, přítomností plátů či minimálně jednoho z těchto markerů subklinické aterosklerózy s výše uvedenými parametry. Za statisticky významnou byla považována korelace s hodnotou p ≤ 0,05. Této hladiny významnosti bylo dosaženo v případě následujících porovnání:
IMT korelovalo s věkem (r = 0,61), věkem v době diagnózy (r = 0,62), délkou a intenzitou kouření „kouřoroky“ (r = 0,34), anamnézou ICHS (r = 0,38), anamnézou CMP (r = 0,37), indexem poškození SLICC (r = 0,33), hladinou trombocytů (r = -0,27), hladinou C3 (r = -0,38), antikardiolipinových protilátek IgG (r = 0,33) IgM (r=0,38) a sedimentace erytrocytů (r = 0,32). Přítomnost plátů korelovala s věkem (r = 0,40), věkem v době diagnózy (r = 0,33), délkou a intenzitou kouření „kouřoroky“ (r = 0,51), anamnézou ICHS (r = 0,50), indexem poškození SLICC (r = 0,30), hladinou trombocytů (r = -0,37).
Dalším krokem bylo zhodnocení významnosti subklinické aterosklerózy u kardiovaskulárních manifestací, které mají patofyziologický poklad právě aterosklerózu (tabulka 2). Byly zjištěny významné výskytem IMT a anginou pectoris (p = 0,005), CMP (p = 0,02), srdečním selhání (p = 0,04). Přítomnost plátů korelovala s anginou pectoris (p > 0,001). Přítomnost patologické IMT nebo plátů korelovala s anginou pectoris (p = 0,001), CMP (p = 0,008), infarktem myokardu (p = 0,02). Pokud jsme hodnotili pacienty s minimálně jednou kardiovaskulární příhodou, korelovaly obě hodnocení subklinické aterosklerózy s tím, že jejich kombinace vykazovala signifikanci velmi výraznou p = 0,009.
Table 2. Korelace IMT a přítomnosti plátů s kardiovaskulárními manifestacemi. Tabulka ukazuje počet pacientů s patologickou IMT (nad 0,6 mm) a přítomností plátů ve skupině s s/bez uvedených kardiovaskulárních příhod. Poslední řádek sumarizuje korelace přítomnosti subklinické aterosklerózy u 7 pacientů s anamnézou alespoň jedné kardiovaskulární příhody. 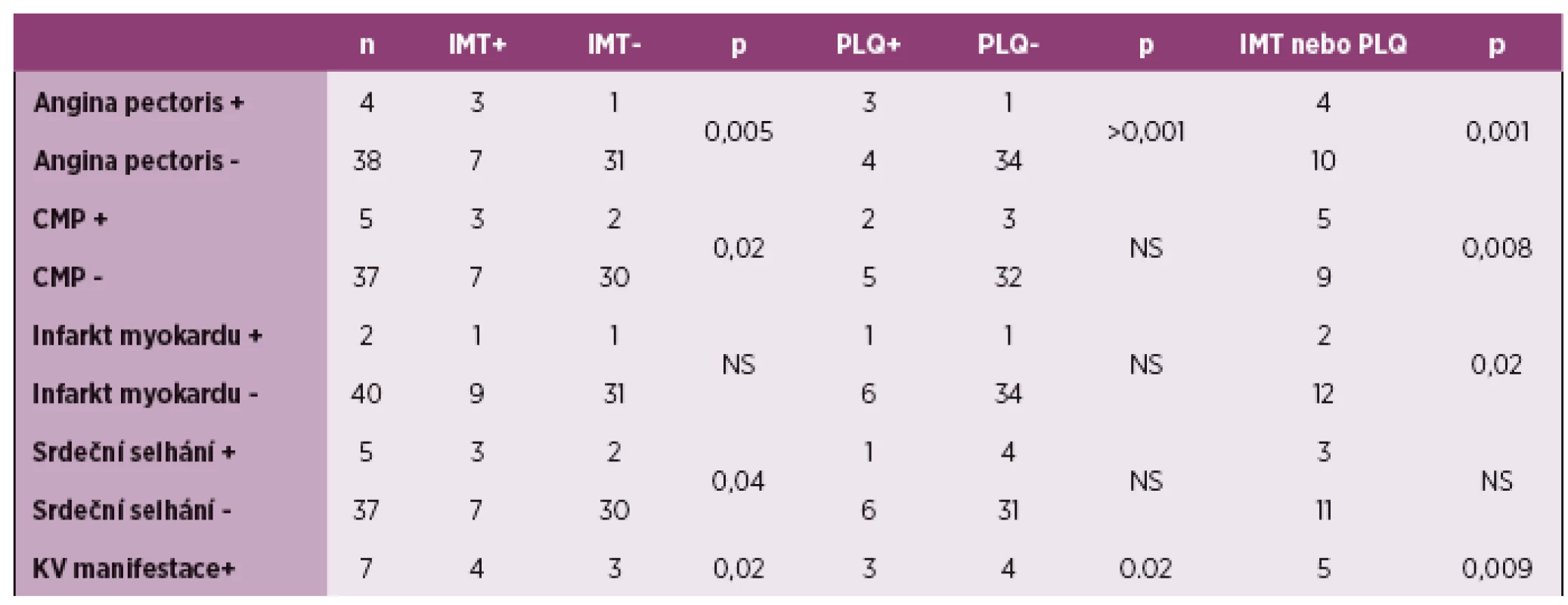
IMT – tloušťka intima media, PLQ – ateroslerotický plát, CMP – cévní mozková příhoda, KV – kardiovaskulární, NS – nesignifikantní Pacienti s kardiovaskulární příhodou měli v 71 % verifikovanou subklinickou aterosklerózu (hodnoceno alespoň jedním z parametrů). Naopak pacienti bez kardiovaskulární příhody měli v 21 % přítomnou subklinickou aterosklerózu (graf 2 a 3).
Graph 2. Přítomnost aterosklerózy dle měření tloušťky intima media či aterosklerotického plátu u pacientů se systémovým lupus erythematodes a kardiovaskulární příhodou. 
Graph 3. Přítomnost aterosklerózy dle měření tloušťky intima media či aterosklerotického plátu u pacientů se systémovým lupus erythematodes bez kardiovaskulární příhody. 
Diskuse
Ateroskleróza je závažný aspekt vedoucí k onemocněním s vysokou mortalitou a morbiditou pacientů. Je velmi důležité aktivně detekovat jak tradiční, tak specifické rizikové faktory aterosklerózy a zaměřovat se na prevenci jejího vzniku. Zánětlivá revmatická onemocnění, zvláště pak systémový lupus erythematodes mají vysoké riziko tzv. akcelerované aterosklerózy.
V roce 2016 byla publikovaná metaanalýza subklinické aterosklerózy u SLE zahrnující 80 studií, jednalo se o 6 085 pacientů s SLE a 4 794 zdravých kontrol (13). Z metaanalýzy vyplývá, že nemocní s SLE mají signifikantně vyšší hodnoty tloušťky intima media oproti zdravým kontrolám. Rozdíl činil v průměru 0,07 mm (p < 0,001). Pacienti s SLE také vykazovali častější výskyt aterosklerotických plátů, i když byly sledovány jen v 23 % klinických studií (4417 pacientů s SLE a 3528 zdravých kontrol). Četnost detekovaných plátů byla 23,6 % u pacientů s SLE a 13,0 % v kontrolní skupině. Poměr šancí (odd ratio, OR) činí 2,45 (95 % CI: 2,02, 2,97; p < 0,001).
Kouření je nejsilnějším tradičním rizikovým faktorem vedoucím k ateroskleróze. Kuřáci s SLE mají třikrát vyšší riziko kardiovaskulárních příhod (15). Zároveň kouření snižuje účinnost antimalarik (chlorochin a hydroxychlorochin), která působí částečně antiaterogenně (16). Vliv vysokého arteriálního tlaku na vznik a progresi aterosklerózy byl prokázána v dvojitě zaslepené studii s vysokým počtem pacientů (200 respondentů). Zvláště hodnoty systolického tlaku nad 120 mmHg korelovaly s přítomností aterosklerotických plátů, detekovaných ultrasonograficky a CT kalciovým skóre (17). Dyslipidémie, nejvíce hodnoty celkového cholesterolu, koreluje s kardiovaskulárními manifestacemi nejen v běžné populaci, ale i u pacientů s SLE (18). Na lipidový profil má navíc vliv užívaní glukokortikoidů, kdy dávky vyšší než 7,5 mg denně zvyšují celkový cholesterol (19). Glukokortikoidy také mění rozložení tuku na rizikové ukládání v abdominální oblasti a zvyšují také prevalenci metabolického syndromu, který je u SLE až 32 % (20). Aktivní onemocnění je rizikovým faktorem vzniku aterosklerózy. Byla prokázána např. souvislost s hladinou anti dsDNA protilátek (3).
V našem souboru jsme se zabývali významem měření subklinické aterosklerózy a její korelace s výskytem kardiovaskulárních příhod. Mladé ženy s SLE mají až 50krát častější výskyt infarktu myokardu než jejich zdravé vrstevnice (21). Od toho se odvíjí i častější hospitalizace pro diagnózu infarktu myokardu, která je u SLE pacientů celkově 2,27krát častější, než v běžné populaci. 3,8krát častěji mají pacienti s SLE městnavou srdeční slabost a 2,05krát častěji projevy cévní mozkové příhody (4). Relativní riziko vzniku infarktu myokardu je pak 10,1, pro manifestaci cévní mozkové příhody 7,9, celkové relativní riziko aterosklerózy u SLE je 7,1 (22).
Registr LUMINA (multicentrický, multietnický), sledující prospektivně 637 nemocných s SLE stanovil roční incidenci kardiovaskulárních onemocnění na 6,2 %, infarktů myokardu na 2 %, CMP na 2,8 % (23). Kanadská prospektivní kohorta 1 249 nemocných udává incidenci kardiovaskulárního onemocnění 5,7 %, IM 1,1 % a CMP 1,8 %. Rizikovými skupinami v obou kohortách byli nemocní pocházející z bílé populace, muži, pacienti s pozdějším věkem vzniku SLE, obézní, kuřáci, nemocní s hypertenzí a familiárním výskytem kardiovaskulárních onemocnění. Větší riziko se pojilo s pozitivitou antikardiolipinových protilátek, hs-CRP a vyšším indexem poškození (SLICC) při zařazení do studie (23, 24). Ve srovnání se všeobecnou populací je prevalence kardiovaskulárních projevů u SLE vysoká.
Překládaná práce navazuje na naši studii hodnotící kardiovaskulární příhody ve vztahu k dalším parametrů aktivity systémového lupusu (25). Hodnocení poukazuje na přítomnost kardiovaskulárních komorbidit u třetiny sledovaných pacientů, jednalo se však i o pacienty s tromboembolizační příhodou. Kardiovaskulární příhody korelovaly jak s tradičními rizikovými faktory (obezita, patologický obvod pasu a boků, kouření, s celkovým cholesterolem, LDL, poměrem celkového cholesterolu a HDL cholesterolu, apolipoproteiny A1 a B), tak s parametry aktivity onemocnění, jako SLEDAI, hsCRP, přítomnost kardiolipinových protilátek a lupus antikoagulans vykazovaly hraniční signifikanci (25).
V naši studii jsme prokázali významnou souvislost aterosklerózy s kardiovaskulárními komorbiditami. U pacientů s SLE s kardiovaskulárních příhodou se v 71 % jednalo o patologické hodnoty IMT nebo přítomnost plátů. Ve skupině bez kardiovaskulárních příhod se vyskytovala ateroskleróza v 21 %.
Detekce subklinické aterosklerózy naskýtá tedy velký prostor pro primární prevenci kardiovaskulárních komorbidit. Nutnost aktivního screeningu a prevence kardiovaskulárních manifestací u SLE reflektují také evropská i česká doporučení pro léčbu pacientů se systémovým lupus erythematodes (26). Při vstupní návštěvě a pak minimálně jedenkrát ročně se doporučuje cíleně detekovat kardiovaskulární příhody, hodnotit tradiční rizikové faktory, kompenzaci arteriální hypertenze, kontrola lipidového spektra a glykémie.
Grantová podpora:
MH CZ - DRO (FNOl, 00098892); MZ CR VES15-28659A
adresa pro korespondenci:
MUDr. Andrea Smržová
III. IK, FN Olomouc
I. P. Pavlova 6
779 00 Olomouc
andrea.smrzova@fnol.cz
Sources
1. Zdravotnická ročenka České republiky 2015. http://uzis.cz/node/7693
2. Urowitz MB, Bookman AA, Koehler BE, et al. The bimodal mortality pattern of systemic lupus erythematosus. Am J Med 1976; 60 : 221–225.
3. Magder LS, Petri M. Incidence of and risk factors for adverse cardiovascular events among patients with systemic lupus erythematosus. Am J Epidemiol 2012; 176 : 708–719.
4. Esdaile JM, Abrahamowicz M, Grodzicky T, et al. Traditional Framingham risk factors fail to fully account for accelerated atherosclerosis in systemic lupus erythematosus. Arthritis Rheum 2001; 44 : 2331–2337.
5. Shah MA, Shah AM, Krishnan E. Poor outcomes after acute myocardial infarction in systemic lupus erythematosus. J Rheumatol 2009; 36 : 570–575.
6. Petri M, Orbai AM, Alarcon 6) GS, et al. Derivation and validation of the Systemic Lupus International Collaborating Clinics classification criteria for systemic lupus erythematosus. Arthritis Rheum 2012; 64 : 2677–86.
7. Bombardier C, Gladman DD, Urowitz MB, et al. Derivation of the SLEDAI. A disease activity index for lupus patients. The Committee on Prognosis Studies in SLE. Arthritis Rheum 1992; 35 : 630–40.
8. Gladman DD, Goldsmith CH, Urowitz MB, et al. The Systemic Lupus International Collaborating Clinics/American College of Rheuma-tology (SLICC/ACR) Damage Index for Systemic Lupus Erythema-tosus International Comparison. J Rheumatol 2000; 27 : 373–276.
9. http://www.diab.cz/dokumenty/standard_labor_2012.pdf
10. Filipovský J, et al. Summary of 2013 ESH/ESC Guidelines for the management of arterial hypertension. Prepared by the Czech Society of Hypertension/Czech Society of Cardiology. Cor et Vasa 2014; 56: e494–e518.
11. https://www.escardio.org/Journals/E-Journal-of-Cardiology-Practice/Volume-13/Intima-media-thickness-Appropriate-evaluation-and-proper-measurement-described
12. Veller MG1, Fisher CM, Nicolaides AN, Renton S, Geroulakos G, Stafford NJ, Sarker A, Szendro G, Belcaro G. Measurement of the ultrasonic intima-media complex thickness in normal subjects. J Vasc Surg 1993; 17(4): 719–25.
13. Pearson TA, Mensah GA, Alexander RW et al. Markers of inflammation and cardiovascular disease: application to clinical and public health practice: A statement for healthcare professionals from the Centres for Disease Control and Prevention and the American Heart Association. Circulation 2003; 107(3): 499–511.
14. Wu GC, Liu HR, Leng RX, Li XP, Li XM, Pan HF, Ye DQ. Subclinical atherosclerosis in patients with systemic lupus erythematosus: A systemic review and meta-analysis. Autoimmun Rev 2016; 15(1): 22–37.
15. Urowitz MB, Gladman D, Ibañez D, et al. Clinical manifestations and coronary artery disease risk factors at diagnosis of systemic lupus erythematosus: data from an international inception cohort. Lupus 2007; 16 : 731–5.
16. Kreuter A, Gaifullina R, Tigges C, et al. Lupus erythematosus tumidus: response to antimalarial treatment in 36 patients with emphasis on smoking. Arch Dermatol 2009; 145 : 244–8.
17. Kiani AN, Post WS, Magder LS, et al. Predictors of progression in atherosclerosis over 2 years in systemic lupus erythematosus. Rheumatology (Oxford) 2011; 50 : 2071–79.
18. Wierzbicki AS. Lipids, cardiovascular disease and atherosclerosis in systemic lupus erythematosus. Lupus 2000; 9(3): 194–201.
19. Petri M, Lakatta C, Magder L, Goldman D. Effect of prednisone and hydroxychloroquine on coronary artery disease risk factors in systemic lupus erythematosus: a longitudinal data analysis. Am J Med 1994; 96(3): 254–9.
20. Urowitz MB et al. Systemic Lupus International Collaborating Clinics. Atherosclerotic vascular events in a multinational inception cohort of systemic lupus erythematosus. Arthritis Care Res (Hoboken) 2010; 62(6): 881–7.
21. Urowitz MB et al. Atherosclerotic vascular events in a single large lupus cohort: Prevalence and risk factors. J Rheumatol 2007; 34 : 70–5.
22. Chung CP, Avalos I, Oeser A, et al. High prevalence of the metabolic syndrome in patients with systemic lupus erythematosus: association with disease characteristics and cardiovascular risk factors. Ann Rheum Dis 2007; 66 : 1542–43.
23. Urowitz MB et al. Systemic Lupus International Collaborating Clinics. Atherosclerotic vascular events in a multinational inception cohort of systemic lupus erythematosus. Arthritis Care Res (Hoboken) 2010; 62(6): 881–7.
24. Toloza SM et al. Systemic lupus erythematosus in a multiethnic US cohort (LUMINA). XXIII. Baseline predictors of vascular events. Arthritis Rheum 2004; 50(12): 3947–57.
25. Smržová A et al. Cardiovascular events in patients with systemic lupus erythematosus, Cor et Vasa 2014; 56: e144–e151.
26. Horák P, Tegzová D, Závada J, Olejárová M, Skácelová M, Smržová A, Žurek M. Doporučení ČRS pro léčbu nemocných se SLE. Čes Revmatol 2013; 21 : 3–14.
Labels
Dermatology & STDs Paediatric rheumatology Rheumatology
Article was published inCzech Rheumatology

2017 Issue 3
Most read in this issue- Současné možnosti terapie entezitid
- Nástin genetické architektury primární hyperurikémie a dny
- Kardiovaskulární komorbidity a ateroskleróza u systémového lupus erythematodes
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

