-
Medical journals
- Career
Estetrol a možnosti jeho klinického využití
Authors: Křepelka Petr
Authors‘ workplace: Ústav pro péči o matku a dítě, Praha Katedra gynekologie a porodnictví IPVZ, Praha 3. LF UK, katedra gynekologie a porodnictví, Praha
Published in: Ceska Gynekol 2021; 86(3): 217-221
Category:
doi: https://doi.org/10.48095/cccg2021217Overview
Metody kombinované hormonální antikoncepce představují jednu z nejčastěji používaných metod plánovaného rodičovství. Vykazují vysokou antikoncepční efektivitu, dobrou kontrolu cyklu a přináší řadu nekontracepčních benefitů. Limitem širokého použití kombinované hormonální antikoncepce je riziko kardiovaskulárních komplikací u jedinců se specifickými rizikovými faktory. Bylo prokázáno, že riziko kardiovaskulárních komplikací souvisí s použitou estrogenní komponentou. V současné době je nejčastěji používaným estrogenem v kombinované orální antikoncepci ethinylestradiol nebo estradiol-valerát. Perspektivní estrogenní komponentou kombinované orální antikoncepce je estetrol, hormon produkovaný výlučně fetálními játry. Vykazuje tkáňově selektivní receptorovou aktivitu. Na rozdíl od doposud užívaných estrogenů negativně neovlivňuje tvorbu jaterních proteinů a parametry krevní srážlivosti. Estetrol není perspektivní pouze jako estrogenní komponent kombinované orální antikoncepce, ale je vhodný i pro léčbu a prevenci osteoporózy, hormonální terapii klimakterického syndromu a syndromu vulvovaginální atrofie.
Klíčová slova:
estetrol – hormonální antikoncepce – estrogeny – drospirenon – komplikace hormonální antikoncepce
Objev estetrolu
Estetrol (E4) byl izolován Egonem Diczfalusy a spolupracovníky v Karolinska Institutu ve Stockholmu v roce 1965. Byl získán extrakcí z 200 litrů moči žen v pokročilém stadiu gravidity [1]. Základní výzkum byl proveden do roku 1984. V roce 2001 zahájila společnost Pantarhei Bioscience svůj výzkum aktivity E4. Motivací byla skutečnost, že se jedná o hormon produkovaný pouze lidským plodem a nemá negativní biologický účinek na mateřský organizmus. Nový výzkum odhalil, že E4 je bezpečným hormonem se selektivní vazbou na oba estrogenové receptory a mírnou preferencí pro receptor ERaa proti ERb.
Struktura a farmakokinetika E4
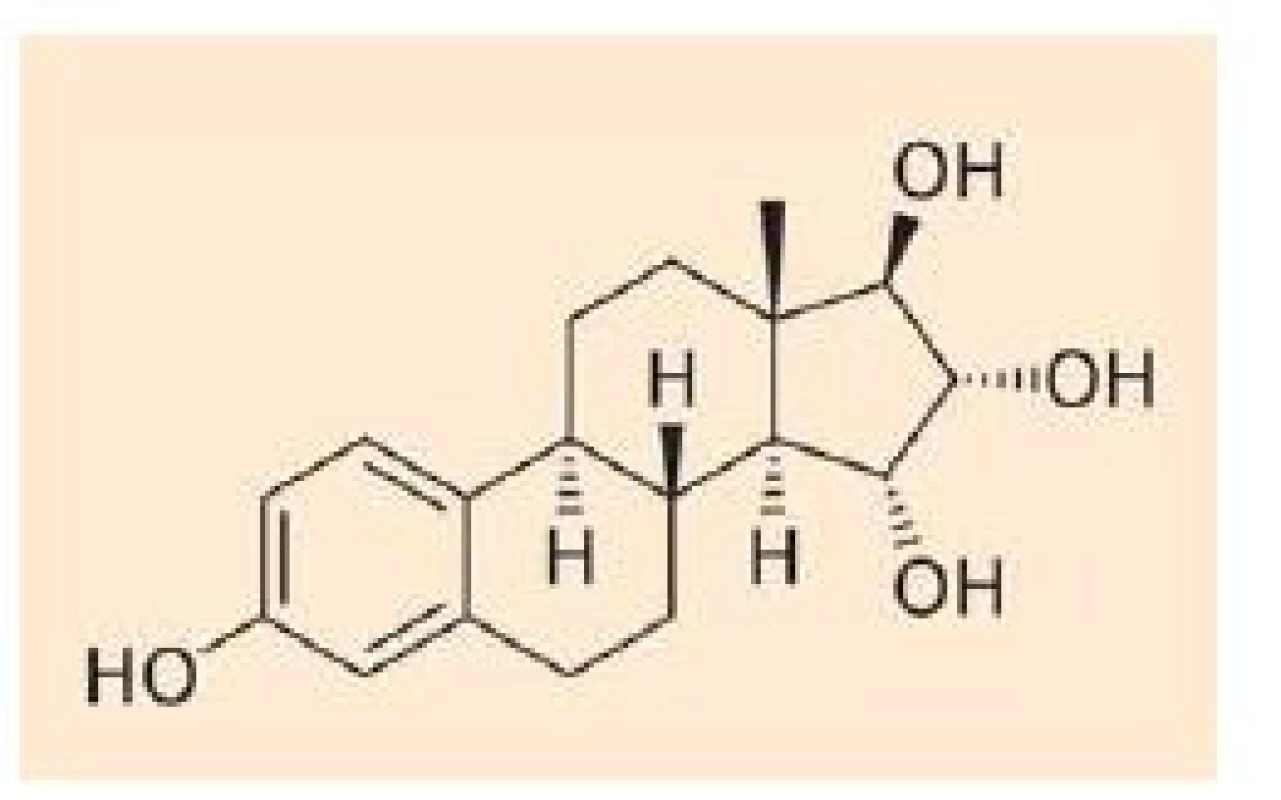
E4 je unikátní estrogen se čtyřmi hydroxylovými skupinami (obr. 1). Bylo prokázáno, že je syntetizován výhradně fetálními játry v průběhu těhotenství a přechází transplacentárně do mateřského oběhu. Farmakokinetické studie analyzující absorpci, distribuci, metabolizmus a exkreci E4 u žen ve III. trimestru gravidity a žen postmenopauzálních prokázaly jeho minimální metabolizmus [2]. Nedochází k jeho konverzi zpět na estradiol (E2) nebo estriol (E3) a po parenterálním podání je nezměněný vyloučen močí ve formě monoglukuronidu. Prakticky vůbec nevstupuje do enterohepatální cirkulace [3].
E4 je detekován v moči těhotných žen od 9. týdne gravidity. Jeho plazmatická koncentrace se zvyšuje ve druhém trimestru, kdy dosahuje setrvalé hodnoty kolem 43 nmol/l až do konce gravidity [4,5]. Koncentrace konjugovaného E4 je sedmkrát vyšší než jeho forma nekonjugovaná. Ve fetální plazmě je koncentrace nekonjugovaného E4 12–19× vyšší než v mateřské plazmě [6]. Koncentrace E4 v plodové vodě představuje přibližně 30 % koncentrace ve fetální plazmě a je 5–6× vyšší než koncentrace v mateřské plazmě [7]. Mateřská močová exkrece ve třetím trimestru se pohybuje mezi 0,5 a 2,3 mg [8]. Plazmatická koncentrace E4 u těhotných žen vykazuje velké interindividuální rozdíly a předpokládá se, že jeho sledování není vhodné pro diagnostiku těhotenských patologií [6]. Při perorálním podání ženám ve čtyřech různých dávkách 0,1, 1, 10 a 100 mg E4 byla prokázána jeho velmi dobrá biologická dostupnost s velmi malou variabilitou dosažených plazmatických koncentrací mezi jednotlivými ženami. Biologický poločas E4 byl stanoven na 28 hod, z čehož vyplývá jeho efektivita při jednodenním orálním podání [9]. Po orálním podání E4 postmenopauzálním ženám v denních dávkách 10, 20 a 40 mg po dobu 28 dnů byla prokázána jeho velmi rychlá absorpce z gastrointestinálního traktu s následným prvotním rychlým poklesem plazmatické koncentrace a postupné eliminace. Vyrovnaného stavu bylo dosaženo po 2 týdnech podávání a hodnota koncentrace byla závislá na podávané denní dávce. Plazmatická koncentrace byla mírně zvýšena proti 1. dni aplikace 28. den aplikace. Po rychlé absorpční fázi dochází k úvodnímu rychlému poklesu s pomalou terminální eliminací. Je vhodný pro perorální podání v jedné denní dávce [10].
Receptorová aktivita E4
Estrogeny působí na úrovni buňky genomickým a negenomickým mechanizmem. Genomický mechanizmus zajišťuje interakce estrogenů s receptory ERa a ERb. Negenomický účinek estrogenů je zprostředkován receptorem GPER (G protein-coupled estrogen receptor 1). E4 vykazuje mírnou afinitu k estrogenovým receptorům ERa a ERb, přičemž k receptoru ERa je afinita 4–5× větší. Jeho afinita k dalším receptorům steroidních hormonů (testosteron, glukokortikoidy, progesteron) je však extrémně nízká. Genomické klinické účinky E4 probíhají pouze na úrovni estrogenních receptorů. Afinita k estrogenovým receptorům E4 je vysoce selektivní, a tedy výhodná, neboť lze předpokládat nízký výskyt vedlejších účinků. Vazebné vlastnosti E4 jsou výhodné pro farmakodynamiku kontraceptiva, neboť nepůsobí jinou nežádoucí receptorovou aktivitu s předpokládaným nízkým výskytem vedlejších účinků [11]. E4 podobně jako E2 se váže na receptor ERa, aktivuje jeho dvě funkce AF-1 (ligand-independent activation function) a AF-2 (ligand-dependent activation function) a současně se podílí na rekrutování koaktivátoru SRC3 (koaktivátor steroidního receptoru 3). Estrogenní efekt je 10–20× slabší, než je účinek ethinylestradiolu (EE). Při podání vysokých dávek stimuluje E4 cestou ERa děložní genovou expresi, epiteliální proliferaci a vykazuje antiaterogenní účinek. E4 neovlivňuje endoteliální produkci oxidu dusnatého (NO) a neurychluje regeneraci endotelu, což jsou dva procesy závislé na membránou iniciované steroidní signalizaci (MISS). E4 antagonizuje účinky závislé na MISS E2 nejen v endotelu, ale i v buněčné linii karcinomu prsu MCF-7 (Michigan cancer foundation-7). Tímto účinkem se E4 chová jako typický selektivní modulátor estrogenových receptorů. Perspektivně je E4 zkoumán v souvislosti s autoimunitními chorobami souvisejícími s thymocyty, jako je roztroušená skleróza, revmatoidní artritida a Sjögrenův syndrom. Vzhledem k tomu, že se tato onemocnění zlepšují v průběhu gravidity, existuje hypotéza, že efektem klinického zlepšení je právě E4. Další oblasti, které jsou perspektivní pro výzkum, jsou vztah E4 a libida, atrofie tkání, migrény a kardiovaskulární morbidity u žen [12].
Jaterní metabolizmus E4 a jeho vazba na plazmatické proteiny
Při experimentu na animálním modelu je E4 velmi pomalu metabolizován jaterními buňkami, glukuronizován, sulfatizován a vylučován z organizmu. E4 je produkt konečné fáze metabolizmu, a nemá tedy žádné biologicky aktivní metabolity. Pokud je E4 ve vysoké koncentraci (10 mmol/l), neinhibuje jaterní enzymy cytochrom P450, CYP1A2, CYP2C9, CYP2C19, CYP2D6 a CYP 3A4. EE má silný inhibiční účinek na CYP3A4, E2 jej naopak stimuluje [11]. Lze tedy předpokládat, že E4 nebude na rozdíl od EE a E2 vykazovat významné interakce s jinými léky. E4 nestimuluje produkci globulinu vážícího pohlavní hormony (SHBG – sex hormone-binding globulin), a neovlivňuje tak jeho plazmatickou koncentraci. SHBG nejvíce zvyšuje E2, EE a E3 vykazují srovnatelnou stimulaci syntézy SHBG. E4 se navíc neváže na SHBG na vazebném místě pro estrogeny ani na vazebném místě pro androgeny. Testosteron a E2 mají vysokou vazebnou afinitu k SHBG, EE a E3 nižší. SHBG tedy nemá žádný vliv na distribuci E4 v plazmě, a není tudíž negativně ovlivněna jeho biologická dostupnost ve tkáních [13].
Působení E4 na kostní tkáň
Srovnání účinků E4 a EE na kostní metabolizmus bylo studováno na animálním modelu. E4 významně inhibuje odbourávání kostní tkáně. Denní dávka 2,5 mg/kg byla ekvivalentní tímto účinkem dávce 0,1 mg/kg EE. Z experimentu je možné vyvodit, že E4 působí prevenci osteoporózy a je perspektivní i pro léčbu osteoporózy a osteoporotických zlomenin [14].
Působení E4 na pochvu a dělohu
Vliv E4 na tkáně dělohy a pochvy byl testován na animálním modelu. Konkrétně byl hodnocen vliv na poševní epitel a hmotnost dělohy. E4 vede k proliferaci vaginální sliznice, endometria a zvyšuje hmotnost dělohy u experimentálních zvířat. Efekt je závislý na použité denní dávce. V porovnání s EE je tento proliferační účinek přibližně 20× slabší. Lze vyvodit závěr, že E4 je perspektivní v léčbě vulvovaginální atrofie. Proliferační efekt na endometrium je slabý, ale je třeba jej při léčbě E4 monitorovat [15].
Působení E4 na mléčnou žlázu
Pokus na zvířecím modelu srovnávající účinek E4 s tamoxifenem a EE na prsní žlázu prokázal, že experimentálně vyvolaný nádor mléčné žlázy u krysy reaguje po podání E4 podobně jako po podání tamoxifenu, tedy snížením počtu nádorů i zmenšením jejich velikosti. Tento účinek nebyl prokázán u EE. Efekt snížení počtu nádorů je závislý na dávce E4. E4 tedy působí jako selektivní modulátor estrogenových receptorů (SERM) a antagonista estrogenů a jeví se perspektivním v léčbě karcinomu prsu [16].
Působení E4 na kardiovaskulární ústrojí
Preklinický i klinický výzkum dokládá, že estrogeny modulují funkce kardiovaskulárního systému. 17b-estradiol brání ukládání lipidů do cévní stěny při experimentu na animálním modelu. Zatímco ERb hraje klíčovou roli u buněk myokardu, ERa se uplatňuje zejména svou protektivní funkcí vůči endotelu. Selektivní aktivace jaderného ERa pomocí E4 zabraňuje hypertenzi vyvolané angiotensinem II, podporuje regeneraci endotelu, a podílí se tak na prevenci aterogeneze [17]. E4 v kombinaci s progestinem nezvyšuje plazmatickou koncentraci koagulačních faktorů na rozdíl od perorálního E2 a EE. Při dlouhodobém podávání E4 laboratorním myším se prodlouží krvácivost a je omezena tvorba žilní i intraarteriální trombózy. E4 aktivuje epiteliální proliferaci cestou receptoru ERa. Na buněčném modelu s absencí ERa byla prokázána absence antitrombotického ochranného účinku E4, prodloužený čas krvácivosti však zůstal zachován [18]. E4 v kombinaci s drospirenonem (DRSP) má schopnost navodit anovulaci s minimálním vlivem na hemostatické parametry, jaterní, kostní metabolizmus a sekreci inzulinu podobných růstových faktorů ve srovnání s kombinací EE a DRSP. Ženám ve fertilním věku byla podávána kombinace E4 s DRSP nebo levonorgestrelem (LNG) v různých dávkách a poté byly hodnoceny definované metabolické parametry (plazmatické koncentrace globulin vázajícího pohlavního hormonu SHBG, lipoproteinů a triglyceridů). Kombinace E4 a DRSP i kombinace E4 a LNG ve srovnání s kombinací EE/DRSP vykazovaly jen minimální změny sledovaných parametrů. U kombinace E4 s DRSP a LNG nebyly prokázány žádné změny v plazmatické koncentraci inzulinu podobných růstových faktorů (ILGH) [19].
Perspektiva léčby deficitu estrogenů a E4
E4 byl testován v léčbě vazomotorického klimakterického syndromu. Na animálním modelu významně snižuje kožní teplotu. Účinek je závislý na použité dávce [20]. Podávání E4 v dávce 2 mg bylo komparováno s podáváním estradiol-valerátu ve stejné dávce po dobu 28 dnů. Následovala aplikace E4 v dávce 10 mg u žen s více než 35 návaly týdně a 20 a 40 mg E4 postmenopauzálním ženám po hysterektomii. Byly sledovány parametry vaginální cytologie, výskyt návalů horka a pocení a proliferace endometria. E4 ve všech aplikovaných denních dávkách vykazoval prokazatelný proliferační vliv na vaginální cytologii s nálezem zvýšení počtu superficiálních buněk. Výška endometria hodnocená ultrazvukem se zvyšovala při denní dávce 10 mg a vyšší. Snížení počtu a závažnosti návalů horka bylo pozorováno při dávkách 2 mg i 10 mg E4 a při dávce 2 mg estradiol-valerátu. E4 v dávkování 2–40 mg denně zlepšuje vaginální cytologii a redukuje výskyt vazomotorických symptomů u postmenopauzálních žen. Proliferace endometria nastává při denních dávkách 10 mg a vyšších. E4 je perspektivní v léčbě vazomotorických symptomů klimakterického syndromu a syndromu vulvovaginální atrofie [21].
Estetrolem navozená inhibice ovulace
E4 silně inhibuje sekreci LH (luteinizační hormon) a FSH (folikulostimulační hormon). Na zvířecím modelu účinně inhibuje ovulaci, a to v dávce 0,3 mg 2× denně a vyšší. V experimentu je v inhibici ovulace 18× méně účinný ve srovnání s EE. U člověka byl též prokázán ovulaci inhibující účinek E4, závislý na dávce. Anovulace je dosaženo mechanizmem centrální inhibice sekrece gonadotropinů. Hluboká a trvalá inhibice hladiny FSH trvající déle než 7 dní byla pozorována při denní dávce 100 mg E4 [22].
Kombinovaná hormonální antikoncepce a E4
Kombinovaná orální antikoncepce obsahující 15 mg E4/3 mg DRSP byla srovnávána s kombinovanou orální antikoncepcí s obsahem EE/LNG a EE/DRSP. Kombinace obsahující E4 má v šestém cyklu aplikace menší vliv na plazmatickou koncentraci gonadotropinů, plazmatická koncentrace FSH byla vyšší o 30,5 %, LH nižší o 7,5 %, u kombinace EE/LNG byly zaznamenány koncentrace FSH nižší o 84 % a LH o 90 %. U kombinace EE/DRSP se koncentrace FSH snížila o 64 % a LH o 90,0 %. Zvýšení plazmatické koncentrace kortisolu bylo u kombinace E4/DRSP o 26,0 % a u globulinu vázajícího kortisol (CGB – cortisol-binding globulin) o 40 %. Kombinace obsahující EE vykazují významně větší elevaci plazmatické koncentrace kortisolu i CBG, kombinace EE/LNG vykazuje zvýšení koncentrace kortisolu o 109 %, CBG o 152 % a kombinace EE/DRSP zvýšení kortisolu o 107 %, CBG o 140 %. Zvýšení sekrece angiotensinogenu byl u kombinace EE/DRSP o 75 %, u kombinace EE/LNG o 170 % a kombinace EE/DRSP o 206,5 %. SHBG se zvýšil u kombinace E4/DRSP o 55 %, u kombinace EE/LNG o 74 % a u kombinace EE/DRSP o 251 %. Triglyceridy se zvyšují u kombinace EE/DRSP o 24 %, EE/LNG o 28 % a EE/DRSP o 65,5 %. Kombinovaná orální antikoncepce s obsahem 15 mg E4/3 mg DRSP má příznivý metabolický profil a ovlivňuje syntézu jaterních proteinů méně než kombinovaná antikoncepce obsahující EE/LNG nebo EE/DRSP [23].
Kombinovaná orální antikoncepce s obsahem 15 mg E4/3 mg DRSP vykazuje silný inhibiční účinek na ovulaci. Během šesti cyklů nenastala ovulace ani u jednoho ze subjektů výzkumu, zatímco u kombinace EE/DRSP byla v jednom případě pozorována jedna a v dalším dvě ovulace. U většiny žen bylo Hogladnovo skóre 1, tedy žádná ovariální aktivita. Kombinace E4/DRSP ve srovnání s kombinací EE/DRSP vykazuje nižší míru suprese LH a srovnatelnou mírů suprese LH prokázanou u E2 a progesteronu [24]. Vliv kombinované orální antikoncepce s obsahem 15 mg E4/3 mg DRSP na hemokoagulační parametry byl testován stanovením endogenního trombinového potenciálu (ETP) a rezistence vůči aktivovanému proteinu C (APCR) během šesti cyklů ve srovnání s kombinovanou orální antikoncepcí s obsahem EE/LNG a EE/DRSP. Zatímco u kombinace E4/DRSP došlo k navýšení ETP o 30 %, u kombinace EE/LNG to bylo o 165 % a u kombinace EE/DRSP o 219 %. Protrombinový fragment 1+2 se zvýšil u kombinace E4/DRSP o 23 %, EE/LNG o 71 % a EE/DRSP o 64 %. SHBG se zvýšil u EE/DRSP o 55 %, u EE/LNG o 74 % a u EE/DRSP o 251 %. Studie prokazuje, že vliv kombinované orální antikoncepce na hemostázu je ovlivněn výhradně estrogenní komponentou [25]. Vliv kombinace různých dávek E4 ve výši 5 nebo 10 mg s DRSP v dávce 3 mg na plazmatickou koncentraci SHBG, angiotensinogenu a 12 dalších hemostatických markerů byl komparován s kombinací 20 μg EE s 3 mg DRSP. Vyšetření bylo provedeno 24. den podávání ve třetím cyklu. Kombinace s obsahem E4 vykazovala nižší estrogenní vliv v porovnání s kombinací s obsahem EE. Vliv na koncentraci SHBG a angiotensinogen byl u kombinace s E4 nižší o 15–20 % proti kombinaci s EE. Kombinace s E4 v dávce 5 a 10 mg redukují hladinu D-dimerů a kombinace s dávkou 5 mg E4 snižuje též protrombinový fragment 1+2 [26]. Kombinovaná orální antikoncepce s E4 je hodnocena uživatelkami vysokou mírou spokojenosti a velmi dobrou kontrolou tělesné hmotnosti. Dále byly srovnávány kombinace E4 v denní dávce 15 nebo 20 mg se 3 mg DRSP, nebo 150 μg LNG proti referenční kombinaci estradiol-valerátu s dienogestem. Nejvyšší podíl žen, které dokončily studii, byl ve skupině s kombinací 15 mg E4 se 3 mg DRSP (91,1 %) nejnižší u kombinace 20 mg E4 s LNG. Podobného výsledku bylo dosaženo v hodnocení míry spokojenosti, kdy s kombinací 15 mg E4 se 3 mg DRSP bylo spokojeno 73,1 % uživatelek a u kombinace 20 mg E4 s LNG to bylo pouze 50,6 % uživatelek. Ve skupině s kombinací 15 mg E4 se 3 mg DRSP byl i nejvyšší podíl žen ochotných pokračovat s metodou (82,1 %), ve skupině s kombinací 20 mg E4 s LNG chtělo pokračovat v metodě 58,3 % uživatelek [27].
Závěr
E4 je bezpečným hormonem se selektivní vazbou na oba estrogenové receptory a s mírnou preferencí pro receptor ERa proti ERb. Nebyla prokázána toxicita pro lidský organizmus ani při použití vysokých denních dávek 10 mg/kg po dobu 4 týdnů. Má vysokou biologickou dostupnost, a je tedy vhodný pro perorální podání. Neváže se na SHBG a má dlouhý eliminační poločas (28 hod). V dobře ověřených a prediktivních modelech potkanů se E4 chová jako agonista estrogenu ve všech vyšetřovaných tkáních (kost, vagina, myometrium, endometrium, mozek, inhibice ovulace). Ve tkáních nádoru mléčné žlázy se chová jako estrogenní antagonista. V játrech vykazuje pomalý metabolizmus, neinhibuje cytochrom P45036, a lze tedy předpokládat, že nebude interagovat s léky. Současně nestimuluje syntézu SHBG, z čehož vyplývá vysoká pravděpodobnost nízkého rizika ovlivnění hemokoagulace, a tedy i rizika hluboké žilní trombózy a plicní embolie.
Sources
1. Hagen AA, Barr M, Diczfalusy E. Metabolism of 17b-oestradiol-4-14C in early infancy. Acta Endocrinol 1965; 49 : 207–220.
2. Fishman J, Solomon S. Metabolism, production and excretion rates of 15alpha-hydroxyestriol in late pregnancy. J Clin Endocrinol Metab 1972; 35 (3): 339–344. doi: 10.1210/jcem-35 - 3-339.
3. Schut HA, Bowman JM, Solomon S. Precursor role of 15alpha-hydroxyestradiol and 15alpha-hydroxyandrostenedione in formation of estetrol. Can J Biochem 1978; 56 (2): 101–106. doi: 10.1139/o78-016.
4. Holinka CF, Diczfalusy E, Coelingh Bennink HJ. Estetrol: a unique steroid in human pregnancy. J Steroid Biochem Mol Biol 2008; 110 (1–2): 138–143. doi: 10.1016/j.jsbmb.2008.03.027.
5. Coelingh Bennink F, Holinka CF, Visser M et al. Maternal and fetal estetrol levels during pregnancy. Climacteric 2008; 11 (Suppl 1): 69–72. doi: 10.1080/13697130802056321.
6. Kundu N, Wachs M, Iverson GB et al. Comparison of serum unconjugated estriol and estetrol in normal and complicated pregnancies. Obstet Gynecol 1981; 58 (3): 276–281.
7. Sciarra JJ, Tagatz GE, Notation AD et al. Estriol and estetrol in amniotic fluid. Am J Obstet Gynecol 1974; 118 (5): 626–642. doi: 10.1016/ s0002-9378 (16) 33738-3.
8. Heikkilä J, Luukkainen T. Urinary excretion of estriol and 15alpha-hydroxyestriol in complicated pregnancies. Am J Obstet Gynecol 1971; 110 (4): 509–521. doi: 10.1016/0002-9378 (71) 90692-2.
9. Visser M, Holinka CF, Coelingh Bennink HJ. First human exposure to exogenous single-dose oral estetrol in early postmenopausal women. Climacteric 2008; 11 (Suppl 1): 31–40. doi: 10.1080/13697130802056511.
10. Coelingh Bennink HJ, Verhoeven C, Zimmerman Y et al. Pharmacokinetics of the fetal estrogen estetrol in a multiple-rising-dose study in postmenopausal women. Climacteric 2017; 20 (3): 285–289. doi: 10.1080/13697137. 2017.1291608.
11. Visser M, Foidart JM, Coelingh Bennink HJ. In vitro effects of estetrol on receptor binding, drug targets and human liver cell metabolism. Climacteric 2008; 11 (Suppl 1): 64–68. doi: 10.1080/13697130802050340.
12. Abot A, Fontaine C, Buscato M et al. The uterine and vascular actions of estetrol delineate a distinctive profile of estrogen receptor a modulation, uncoupling nuclear and membrane activation. EMBO Mol Med 2014; 6 (10): 1328–1346. doi: 10.15252/emmm.201404112.
13. Hammond GL, Hogeveen KN, Visser M et al. Estetrol does not bind sex hormone binding globulin or increase its production by human HepG2 cells. Climacteric 2008; 11 (Suppl 1): 41–46. doi: 10.1080/13697130701851814.
14. Coelingh Bennink HJ, Heegaard AM, Visser M et al. Oral bioavailability and bone-sparing effects of estetrol in an osteoporosis model. Climacteric 2008; 11 (Suppl 1): 2–14. doi: 10.1080/ 13697130701798692.
15. Heegaard AM, Holinka CF, Kenemans P et al. Estrogenic uterovaginal effects of oral estetrol in the modified Allen-Doisy test. Climacteric 2008; 11 (Suppl 1): 22–28. doi: 10.1080/ 13697130701842490.
16. Coelingh Bennink HJ, Singer C, Simoncini T et al. Estetrol, a pregnancy-specific human steroid, prevents and suppresses mammary tumor growth in a rat model. Climacteric 2008; 11 (Suppl 1): 29. doi: 10.1080/13697130802040 325.
17. Guivarc‘h E, Buscato M, Guihot AL et al. Predominant role of nuclear versus membrane estrogen receptor a in arterial protection: implications for estrogen receptor a modulation in cardiovascular prevention/safety. J Am Heart Assoc 2018; 7 (13): e008950. doi: 10.1161/JAHA. 118.008950.
18. Valéra MC, Noirrit-Esclassan E, Dupuis M et al. Effect of estetrol, a selective nuclear estrogen receptor modulator, in mouse models of arterial and venous thrombosis. Mol Cell Endocrinol 2018; 477 : 132–139. doi: 10.1016/j.mce.2018.06.010.
19. Mawet M, Maillard C, Klipping C et al. Unique effects on hepatic function, lipid metabolism, bone and growth endocrine parameters of estetrol in combined oral contraceptives. Eur J Contracept Reprod Health Care 2015; 20 (6): 463–475. doi: 10.3109/13625187.2015.1068934.
20. Holinka CF, Brincat M, Coelingh Bennink HJ. Preventive effect of oral estetrol in a menopausal hot flush model. Climacteric 2008; 11 (Suppl 1): 15–21. doi: 10.1080/13697130701822807.
21. Coelingh Bennink HJ, Verhoeven C, Zimmerman Y et al. Clinical effects of the fetal estrogen estetrol in a multiple-rising-dose study in postmenopausal women. Maturitas 2016; 91 : 93–100. doi: 10.1016/j.maturitas.2016.06.017.
22. Coelingh Bennink HJ, Holinka CF, Diczfalusy E. Estetrol review: profile and potential clinical applications. Climacteric 2008; 11 (Suppl 1): 47–58. doi: 10.1080/13697130802073425.
23. Klipping C, Duijkers I, Mawet M et al. Endocrine and metabolic effects of an oral contraceptive containing estetrol and drospirenone. Contraception 2021; 103 (4): 213–221. doi: 10.1016/j.contraception.2021.01.001.
24. Duijkers I, Klipping C, Kinet V et al. Effects of an oral contraceptive containing estetrol and drospirenone on ovarian function. Contraception 2021; 103 (6): 386–393. doi: 10.1016/j.contraception.2021.03.003.
25. Douxfils J, Klipping C, Duijkers I et al. Evaluation of the effect of a new oral contraceptive containing estetrol and drospirenone on hemostasis parameters. Contraception 2020; 102 (6): 396 – –402. doi: 10.1016/j.contraception.2020.08.015.
26. Kluft C, Zimmerman Y, Mawet M et al. Reduced hemostatic effects with drospirenone-based oral contraceptives containing estetrol vs. ethinyl estradiol. Contraception 2017; 95 (2): 140 – –147. doi: 10.1016/j.contraception.2016.08.018.
27. Apter D, Zimmerman Y, Beekman L et al. Estetrol combined with drospirenone: an oral contraceptive with high acceptability, user satisfaction, well-being and favourable body weight control. Eur J Contracept Reprod Health Care 2017; 22 (4) : 260–267. doi: 10.1080/ 13625187.2017.1336532.
Labels
Paediatric gynaecology Gynaecology and obstetrics Reproduction medicine
Article was published inCzech Gynaecology

2021 Issue 3-
All articles in this issue
- Kryokonzervace spermatu před gonadotoxickou léčbou ve Fakultní nemocnici Brno v letech 1995–2020
- Vliv reziduálního defektu svěrače konečníku na kvalitu života pacientek
- Změny kvality sexuálního života po operacích pro sestup pánevních orgánů
- Vrozený deficit antitrombinu a gravidita – závažný trombofilní stav ohrožující matku i plod
- Sonograficky riadená vákuumaspiračná liečba ektopickej gravidity v jazve po cisárskom reze
- Guillain-Barré syndrom v graviditě
- Sexualita žen se syndromem Mayer-Rokitansky-Küster-Hauser
- Sakrospinózní hysteropexe – alternativa v primární chirurgické léčbě sestupu apikálního kompartmentu
- Adenomyóza – možný vliv na funkci a receptivitu endometria
- Antifosfolipidové protilátky a infekce covidem-19 u žen se sníženou plodností
- 5. evropský kongres o endometrióze
- Estetrol a možnosti jeho klinického využití
- Czech Gynaecology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Estetrol a možnosti jeho klinického využití
- Adenomyóza – možný vliv na funkci a receptivitu endometria
- Vrozený deficit antitrombinu a gravidita – závažný trombofilní stav ohrožující matku i plod
- Změny kvality sexuálního života po operacích pro sestup pánevních orgánů
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career