-
Medical journals
- Career
Adenomyóza – možný vliv na funkci a receptivitu endometria
Authors: Crha Karel 1; Ješeta Michal 1; Pilka Radovan 2; Ventruba Pavel 1; Žáková Jana 1; Vodička Jan 2; Crha Tomáš 1
Authors‘ workplace: Gynekologicko-porodnická klinika LF MU a FN Brno 1; Porodnicko-gynekologická klinika LF UP a FN Olomouc 2
Published in: Ceska Gynekol 2021; 86(3): 205-209
Category: Review Article
doi: https://doi.org/10.48095/cccg2021205Overview
Cíl studie: V současné době rychle přibývá nových studií o adenomyóze, která může výrazně zhoršovat kvalitu života ženy. Názory na patogenezi, diagnostiku a možnosti účinné léčby nejsou jednotné. Cílem práce je prezentovat současné poznatky o adenomyóze a jejím vlivu na funkci a receptivitu endometria.
Metodika: Rešerše relevantní literatury v databázích Web of Science, Scopus, PubMed/Medline.
Výsledky: Nové poznatky o patogenezi adenomyózy přináší především molekulárně genetické studie angiogeneze a tranzice epiteliálních a stromálních buněk endometria. Základní klinickou vyšetřovací metodou je transvaginální ultrazvuk, ve specifických případech magnetická rezonance nebo hysteroskopie. Klasifikace adenomyózy by měla důsledně využít pravidla klasifikace #Enzian. Léčba adenomyózy by měla respektovat její klinické projevy a reprodukční plán pacientky, optimálně v centrech pro léčbu endometriózy.
Závěr: Selhání implantace a nepravidelné děložní krvácení mohou být způsobeny vlivem adenomyózy na vaskularizaci endometria a epitelově-mezenchymová tranzice/mezenchymově-epitelová tranzice. Nové poznatky v této oblasti, např. analýza proteomu endometriálního sekretu, by mohly přinést nové možnosti efektivní terapie a objektivní hodnocení jejího efektu.
Klíčová slova:
adenomyóza – poruchy plodnosti – receptivita endometria – proteom – pánevní bolest
Úvod
V současné době rychle přibývá nových studií o adenomyóze, která může výrazně zhoršovat kvalitu života ženy – pánevní bolestí, nepravidelným děložním krvácením a poruchami plodnosti. Názory na patogenezi, diagnostiku a možnosti účinné léčby nejsou jednotné. Cílem této práce je prezentovat současné poznatky o adenomyóze a jejím vlivu na funkci a receptivitu endometria.
Definice, epidemiologie
Adenomyóza je ektopický výskyt endometriální tkáně v myometriu. Historicky byla diagnostikována většinou až histologickým vyšetřením odstraněné dělohy. Hlavním histologickým rysem je přítomnost endometriálních žlázek a stromatu ve stěně děložní, většinou provázená hyperplazií buněk hladkého svalstva. Současné zobrazovací metody s vysokým rozlišením – především ultrazvuk (UZ) a magnetická rezonance (MR) – umožňují neinvazivní a snadno dostupnou diagnostiku ložisek adenomyózy. Byla prezentována řada studií hodnotících podíl adenomyózy na nepravidelném krvácení, poruchách plodnosti a dalších děložních patologiích [1,2].
Prevalence adenomyózy v jednotlivých studiích se pohybuje ve velmi širokém rozmezí v závislosti na mnoha faktorech – použité diagnostické metody, výběr vyšetřovaných žen, jejich věk a indikace k vyšetření. Nejsou také jednotná přesná diagnostická kritéria pro UZ a MR vyšetření nebo laparoskopický nález. U žen ve věku do 40 let byla prokázána ve 20 %, u žen nad 40 let přibližně v 80 % [3]. V retrospektivní studii 945 pacientek, které podstoupily hysterektomii, byla prokázána pozitivní korelace mezi přítomností adenomyózy a celkovým počtem těhotenství – abortů i porodů, které žena měla [4].
Patogeneze
Patogeneze adenomyózy zůstává stále nejasná, nové poznatky přináší především molekulárně genetické studie [5]. Předpokládá se několik mechanizmů vzniku podobně jako u endometriózy [4]. Může vznikat de novo metaplastickou transformací v myometriu rozptýlených embryonálních pluripotentních buněk derivovaných z paramezonefrických mülleriánských duktů [6].
Další hypotéza předpokládá invazi buněk bazálního endometria do myometria při defektu junkční zóny mezi těmito tkáněmi. Tento průnik může být podmíněn její traumatizací – tzv. tissue injury and repair (TIAR) – zvýšením intrauterinního tlaku při spontánních kontrakcích dělohy např. v průběhu menstruačního krvácení nebo v souvislosti s nitroděložními výkony. Při reparaci dochází v místě poranění ke zvýšené expresi aromatázy a ke zvýšené koncentraci estrogenů, které endometriální buňky stimulují.
Molekulární aspekty patogeneze adenomyózy
Při vzniku a rozvoji adenomyózy se uplatňuje řada signálních molekul – hormonů a cytokinů a jejich vzájemná souhra. Zvýšená koncentrace estrogenů a jejich receptorů podporuje expresi interleukinu (IL) 10, který potlačuje imunitní dozor v myometriu a podílí se na dalším růstu ektopicky uložených endometriálních buněk. IL-1 a IL-6 navozují zánětlivou reakci s produkcí ROS (reactive oxygen species). Vlivem této dysbalance může docházet k metaplazii buněk hladkého svalstva na fibroblasty a naopak.
Zajímavé výsledky přináší studie exprese RNA (ribonukleová kyselina) ve tkáni adenomyózy. Bylo prokázáno, že v ektopicky uložené endometriální tkáni je signifikantně vyšší exprese lncRNA (long non coding RNA) v porovnání s eutopickým endometriem, což ovlivňuje funkci NRP2 (neuropilin 2) a novotvorbu cév [7,8].
Klinické projevy
K typickým projevům adenomyózy patří zvětšení dělohy, pánevní bolest, hypermenorea, reprodukční potíže vč. zvýšeného rizika předčasného odtoku plodové vody a předčasného porodu. Odhaduje se, že v jedné třetině případů je asymptomatická [9]. V metaanalýze byl také prokázán nepříznivý vliv na výsledky léčby poruch plodnosti metodami asistované reprodukce. Často je adenomyóza spojena s dalšími projevy hyperestrinizmu – endometriózou, hyperplazií endometria a děložními myomy [1,10].
Diagnostika
Přestože definitivní potvrzení adenomyózy je možné jen histopatologickým vyšetřením dělohy, jsme v dnešní době schopni s vysokou přesností popsat adenomyózu zobrazovacími metodami. Základní vyšetřovací metodou je transvaginální UZ [11,12]. K nejčastějším ultrazvukovým známkám adenomyózy patří zvětšení dělohy, asymetrické ztluštění myometria přední nebo zadní stěny děložní, anechogenní ložiska v myometriu a neostrá endomyometrální junkce (JZ – junkční zóna). V UZ obraze má JZ podobu hypoechogenní vrstvy (myometria) lemující endometrium. Ztluštění JZ je známkou endometriální invaze do myometria. Šíře JZ > 12 mm bývá typická u nálezu adenomyozy.
Vyšetření MR je další vhodnou zobrazovací metodou, avšak vzhledem k omezené dostupnosti méně využívanou. V T2 obraze bývá typické rozšíření JZ, která má podobu neostře ohraničené hypointenzní vrstvy (představující hyperplastické myometrium s heterotopickou endometriální tkání). S tímto obrazem bývá často spojen i nález hyperintenzních ložisek v myometriu, cysticky dilatovaných endometriálních žláz nebo hemoragických ložisek [6].
Hysteroskopie může přispět k diagnostice ložisek endometriózy uložených do 2 mm od hranice mezi endometriem a myometriem – označuje se jako adenomyosis subbasalis. K hysteroskopickému obrazu patří modře prosvítající cysty vyplněné čokoládově hnědým obsahem, biopsie může potvrdit diagnózu [13].
Klasifikace
Klasifikace adenomyózy by měla důsledně respektovat pravidla klasifikace #Enzian, která byla na základě mezinárodního a mezioborového konsenzu akceptována a prezentována [14]. Adenomyóza je klasifikována jako kompartment FA, při UZ diagnostice by měla být dodržena pravidla MUSA (Morphological Uterus Sonographic Assessment) [15].
Vliv adenomyózy na angiogenezi
Angiogeneze je proces, při kterém ze stávajících cév vyrůstají nové cévy. Je významnou součástí mnoha fyziologických i patologických procesů. Intenzivně probíhá při regeneraci endometria v proliferační fázi cyklu, je také nezbytná pro úspěšnou implantaci embrya.
Pro ložiska adenomyózy je charakteristické zmnožení cév v jejich okolí, je tak velmi pravděpodobné, že ektopické endometrium uvolňuje signální faktory, které vedou k tvorbě nových cév. Tento mechanizmus je dobře znám u zhoubných nádorů, kdy mutace nádorových buněk vede k produkci angiogenních faktorů a růstu tumoru.
Estrogeny, které jsou důležitým faktorem adenomyózy, mohou také stimulovat progenitorové endoteliální buňky a následně tvorbu nových kapilár. Nadměrná exprese genů řídících angiogenezi, např. VEGF (vascular endotelial growth factor), vede ke zvýšenému vytváření nových cév, snížení pevnosti cévní stěny a vyšší permeabilitě. Bylo také prokázáno, že polymorfizmus genu pro angiogenní faktor FGF 1, 2 (fibroblast growth factor) zvyšuje riziko vzniku adenomyózy a endometriózy [7]. Byla také prokázána zvýšená aktivita prozánětlivých cytokinů IL-6, IL-22, které výrazně regulují angiogenezi. Přehled je uveden v tab. 1. Abnormální vaskularizace ložisek adenomyózy může těmito signálními drahami působit na eutopické endometrium a jeho fyziologickou funkci. Klinickým projevem může být porucha jeho receptivity a nepravidelné krvácení.
Table 1. Přehled pro-angiogenních a anti-angiogenních faktorů v glandulárním epitelu a stromatu ektopického a eutopického endometria. Overview of pro-angiogenic and anti-angiogenic factors in the glandular epithelium and stroma of ectopic and eutopic endometrium. 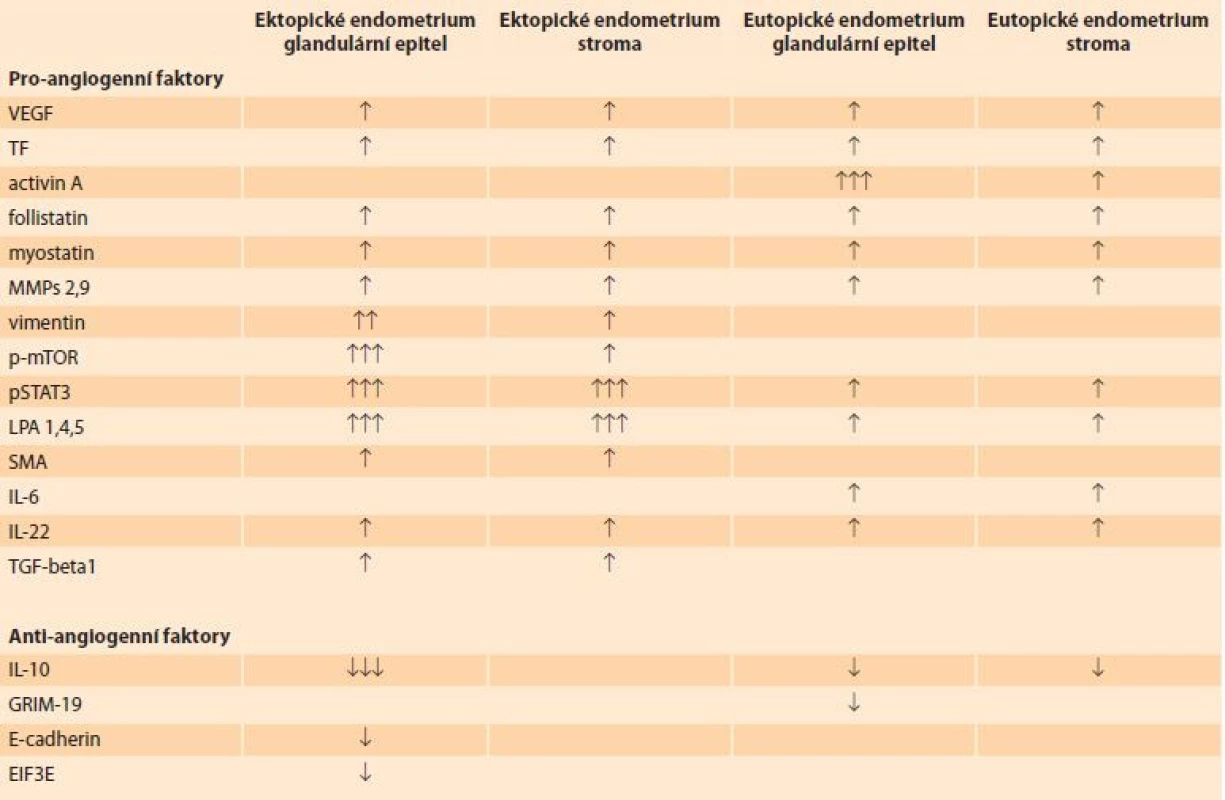
VEGF – vascular endothelial growth factor, TF – tissue factor, MMPs – matrix metalloproteinase, p-mTOR – mammalian target of rapamycin, pSTAT3 – phospho-signal transducer and activator of transcription 3, LPA – lysophosphatidic acid, SMA – smooth muscle actin, IL – interleukin, TGF – transforming growth factor, GRIM – gene associated with retinoic-interferon-induced mortality, EIF3E – eukaryotic translation initiation factor ↑/↓ – zvýšení/snížení angiogeneze ve srovnání s kontrolním endometriem ↑↑/↓↓ – zvýšení/snížení angiogeneze ve srovnání s eutopickým endometriem ↑↑↑/↓↓↓ – zvýšení/snížení angiogeneze ve srovnání s kontrolním a eutopickým endometriem Zajímavé výsledky přinesly studie hodnotící mikroskopickou vaskularitu ektopického a eutopického endometria (MVD – microvascular density), při kterých byly endoteliální buňky značeny protilátkami proti CD31, CD34 a dalšími charakteristickými markery endoteliálních buněk. V porovnání s kontrolními vzorky z děloh bez adenomyózy byla MVD signifikantně vyšší v eutopickém i ektopickém endometriu [2].
Vliv adenomyózy na přeměnu epiteliálních a mezenchymálních buněk endometria
Schopnost regenerace, remodelace a diferenciace buněk je předpokladem receptivity endometria, implantace a vývoje embrya. Důležitým faktorem těchto procesů je vzájemná přeměna mezenchymálního a epiteliálního fenotypu endometriálních buněk – epiteliálně-mezenchymální tranzice (EMT – epitelial-mezenchymal transition) a mezenchymálně-epiteliální tranzice (MET – mezenchymal-epithelial transition). Mechanizmy řídící tvorbu a zánik cévních pletení úzce souvisí se vzájemnou přeměnou jednotlivých buněk endometria a fyziologickou funkcí. Bylo prokázáno, že obnovu děložní sliznice a její struktury zajišťují kmenové buňky. Endometriální mezenchymální kmenové buňky (eMSCs – endometrial mezenchymal stem cells) se nachází perivaskulárně ve funkční a bazální vrstvě při hranici s myometriem. Mnohé faktory klíčové pro fyziologickou tranzici – např. vimentin, cadherin, SMA (smooth muscle activin) – mají v endometriu dělohy s adenomyózou odlišnou aktivitu než v děloze bez adenomyózy. Abnormní vaskularizace, TIAR a endokrinní disruptory tak mohou vést k poruchám receptivity a metroragii [16–18]. Přehled EMT/MET byl publikován nedávno [19].
Terapie adenomyózy
Léčba adenomyózy by měla respektovat její klinické projevy a reprodukční plán pacientky. Medikamentózní léčba je podobná jako u endometriózy – blokáda ovarií agonisty gonadotropiny uvolňujícího hormonu (GnRH), dlouhodobé podávání progestinů, kombinovaná nízkodávkovaná hormonální antikoncepce, symptomatická léčba pánevní bolesti nesteroidními analgetiky [20–22].
U žen plánujících těhotenství je chirurgická léčba problematická, rozsáhlá traumatizace dělohy znamená riziko pro těhotenství a porod. V literatuře jsou uvedeny možnosti resekce ložisek, elektrokoagulace či destrukce metodou „high-intensity focused ultrasound“. Subbazální ložiska mohou být odstraněna hysteroskopicky [6,13,23]. U žen, které neplánují těhotenství, je pro odstranění symptomů nejúčinnější hysterektomie. Nepravidelné krvácení může být řešeno také ablací endometria [24].
Závěr
Z poznatků o adenomyóze vyplývá, že selhání implantace a nepravidelné krvácení mohou být způsobeny jejím vlivem na vaskularizaci endometria a EMT/MET. Nové poznatky v této oblasti, např. analýza proteomu endometriálního sekretu, by mohly přinést nové možnosti efektivní terapie a objektivní hodnocení jejího efektu.
Publikační etika: Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do bio medicínských časopisů.
Konflikt zájmů: Autoři deklarují, že v souvislosti s předmětem studie/ práce nemají žádný konflikt zájmů.
Dedikace: Práce vznikla za podpory projektu MZ ČR – RVO (FNBr: 65269705) a AZV NV-18-08-00291.
Sources
1. Younes G Tulandi T. Effects of adenomyosis on in vitro fertilization treatment outcomes: a meta-analysis. Fertil Steril 2017; 108 (3): 483 – –490. doi: 10.1016/j.fertnstert.2017.06.025.
2. Harmsen MJ, Wong CF, Mijatovic V et al. Role of angiogenesis in adenomyosis-associated abnormal uterine bleeding and subfertility: a systematic review. Hum Reprod Update 2019; 25 (5): 647–671. doi: 10.1093/humupd/dmz024.
3. Harada T, Khine YM, Kaponis A et al. The impact of idenomyosis on women’s fertility. Obstet Gynecol Surv 2016; 71 (9): 557–568. doi: 10.1097/OGX.0000000000000346.
4. Genc M, Genc B, Cengiz H. Adenomyosis and accompanying gynecological pathologies. Arch Gynecol Obstet 2015; 291 (4): 877–881. doi: 10.1007/s00404-014-3498-8.
5. Mullen RD, Behringer RR. Molecular genetics of Müllerian duct formation, regression and differentiation. Sex Dev 2014; 8 (5): 281–296. doi: 10.1159/000364935.
6. Szubert M, Koziróg E, Olszak O et al. Adenomyosis and infertility-review of medical and surgical approaches. Int J Environ Res Public Health 2021; 18 (3): 1235. doi: 10.3390/ijerph18031235.
7. Yen CF, Huang SJ, Lee CL et al. Molecular characteristics of the endometrium in uterine adenomyosis and its biochemical microenvironment. Reprod Sci 2017; 24 (10): 1346–1361. doi: 10.1177/1933719117691141.
8. Zhou C, Zhang T, Liu F et al. The differential expression of mRNAs and long noncoding RNAs between ectopic and eutopic endometria provides new insights into adenomyosis. Mol Biosyst 2016; 12 (2): 362–370. doi: 10.1039/c5mb00733j.
9. Juang CM, Chou P, Yen MS et al. Adenomyosis and risk of preterm delivery. BJOG 2007; 114 (2): 165–169. doi: 10.1111/j.1471-0528. 2006.01186.x.
10. Vercellini P, Consonni D, Dridi D et al. Uterine adenomyosis and in vitro fertilization outcome: a systematic reviewand meta-analysis. Hum Reprod 2014; 29 (5): 964–977. doi: 10.1093/humrep/deu041.
11. Van den Bosch T, de Bruijn AM, de Leeuw RA et al. A sonographic classification and reporting system for diagnosing adenomyosis. Ultrasound Obstet Gynecol 2019; 53 (5): 576–582. doi: 10.1002/uog.19096.
12. Dolná Z, Hašlík L, Frydrach J et al. Porovnání ultrazvuku a magnetické rezonance v diagnostice hluboké infiltrující endometriózy. Gyn Por 2020; 4 (3): 149–153.
13. Kovář P, Daňková Kučerová J, Dvořáčková J et al. Adenomyóza. Gyn Por 2020; 4 (3): 138–144.
14. Keckstein J, Saridogan E, Ulrich UA et al. The #Enzian classification: a comprehensive non-invasive and surgical description system for endometriosis. Acta Obstet Gynecol Scand 2021. Online ahead of print. doi: 10.1111/aogs.14 099.
15. Van den Bosch T, Dueholm M, Leone FP et al. Terms, definitions and measurements to describe sonographic features of myometrium and uterine masses: a consensus opinion from the Morphological Uterus Sonographic Assessment (MUSA) group. Ultrasound Obstet Gynecol 2015; 46 (3): 284–298. doi: 10.1002/uog.14806.
16. Owusu-Akyaw A, Krishnamoorthy K, Goldsmith LT et al. The role of mesenchymal-epithelial transition in endometrial function. Human Reprod Update 2019; 25 (1): 114–133. doi: 10.1093/humupd/dmy035.
17. Ješeta M, Crha T, Žáková J et al. Bisfenoly v patologii reprodukce. Ceska Gynekol 2019; 84 (2): 161–165.
18. Vodička J, Dvořan M, Smékalová K et al. Možnosti přípravy endometria ke kryotransferu. Ceska Gynekol 2018; 83 (1): 24–28.
19. Crha K, Ventruba P, Žáková J et al. The role of uterine microbiome and epithelial-mesenchymal transition in endometrial function. Med J Cell Biol 2019; 7 (3): 146–151. doi: 10.2478/acb-2019-0020.
20. Hudeček R, Ventruba P, Gazárková E et al. Konzervativní terapie klinických projevů endometriózy v reprodukční gynekologii. Bolest 2019; 22 (2): 60–69.
21. Papíková Z, Hudeček R, Ventruba P et al. Účinnost dienogestu v terapii klinických symptomů endometriózy rektovaginálního septa. Ceska Gynekol 2019; 84 (5): 331–336.
22. Ventruba P, Žáková J, Ješeta M et al. Současná témata reprodukční medicíny v České republice. Ceska Gynekol 2016; 81 (3): 234–240.
23. Zhang L, Rao F, Setzen R. High intensity focused ultrasound for the treatment of adenomyosis: selection criteria, efficacy, safety and fertility. Acta Obstet Gynecol Scand 2017; 96 (6): 707–714. doi: 10.1111/aogs.13159.
24. Huser M, Papíkova Z, Dziaková M et al. Radiofrekvenční ablace endometria – nová možnost konzervativní léčby silného menstruačního krvácení. Ceska Gynekol 2018; 83 (6): 418–423.
Labels
Paediatric gynaecology Gynaecology and obstetrics Reproduction medicine
Article was published inCzech Gynaecology

2021 Issue 3-
All articles in this issue
- Kryokonzervace spermatu před gonadotoxickou léčbou ve Fakultní nemocnici Brno v letech 1995–2020
- Vliv reziduálního defektu svěrače konečníku na kvalitu života pacientek
- Změny kvality sexuálního života po operacích pro sestup pánevních orgánů
- Vrozený deficit antitrombinu a gravidita – závažný trombofilní stav ohrožující matku i plod
- Sonograficky riadená vákuumaspiračná liečba ektopickej gravidity v jazve po cisárskom reze
- Guillain-Barré syndrom v graviditě
- Sexualita žen se syndromem Mayer-Rokitansky-Küster-Hauser
- Sakrospinózní hysteropexe – alternativa v primární chirurgické léčbě sestupu apikálního kompartmentu
- Adenomyóza – možný vliv na funkci a receptivitu endometria
- Antifosfolipidové protilátky a infekce covidem-19 u žen se sníženou plodností
- 5. evropský kongres o endometrióze
- Estetrol a možnosti jeho klinického využití
- Czech Gynaecology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Estetrol a možnosti jeho klinického využití
- Adenomyóza – možný vliv na funkci a receptivitu endometria
- Vrozený deficit antitrombinu a gravidita – závažný trombofilní stav ohrožující matku i plod
- Změny kvality sexuálního života po operacích pro sestup pánevních orgánů
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

