-
Medical journals
- Career
Sledování tvorby cytokinů u tkáňové kultury lidských makrofágů stimulovaných ionty kovů
Authors: Z. Venclíková 1; J. Bártová 1; J. Běláček 2
Authors‘ workplace: Ústav klinické a experimentální stomatologie 1. LF UK a VFN, Praha 1; Ústav biofyziky a informatiky 1. LF UK a VFN, Praha 2
Published in: Česká stomatologie / Praktické zubní lékařství, ročník 113, 2013, 3, s. 80-84
Category: Original Article – Experimental Study
Věnováno prof. MUDr. Zdeňku Broukalovi, CSc., k významnému životnímu jubileu
Overview
Úvod:
Makrofágy jsou buňky přirozené imunity, které hrají důležitou roli v imunitní reakci. V časných fázích zánětu jsou hlavním zdrojem prozánětlivých cytokinů. Cytokiny jsou tvořeny během interakce buněk s antigenem a hrají významnou úlohu v aktivaci i regulaci imunitní odpovědi.
Cíl práce, metoda: Cílem práce bylo sledování tvorby cytokinů u tkáňové linie THP1 (monocyto-makrofágová linie lidského původu), kultivované po dobu pěti dnů s přídavkem solí kovů titanu, rtuti, chromu, kobaltu, niklu a paladia, a to z toho důvodu, že tyto kovy jsou častou součástí dentálních slitin. V případě koroze slitiny ve vlhkém prostředí dutiny ústní mohou u některých pacientů vyvolávat hypersenzitivní reakci organismu.Výsledky a závěr:
Výsledkem práce bylo zjištění, že zkoumané ionty kovů mohou v různé míře ovlivňovat buňky linie THP1 ve smyslu zvýšené, ale i snížené tvorby chemotaktických faktorů, prozánětlivých cytokinů, ale i cytokinů, které se podílejí na regulaci imunitní odpovědi. Ovlivnění jejich tvorby po expozici kovům v podmínkách in vivo může vést k rozvoji nežádoucí reakce na kovové materiály.Klíčová slova:
cytokiny – makrofágy – multiplexové stanovení – koroze – dentální slitinySeznam použitých zkratek je uveden na konci článku.
ÚVOD
Cytokiny byly již před více než dvaceti lety definovány jako proteiny sekretované buňkami, které regulují proliferaci, buněčný růst, diferenciaci a přežívání buněk různých tkání. Jejich funkce se realizuje interakcí se specifickým membránovým receptorem buněk. Cytokiny se tvoří během interakce buněk s antigenem a hrají významnou úlohu v aktivaci i regulaci imunitní odpovědi. Působí ve velmi nízkých koncentracích (pg-ng/ml).
Modulace cytokinové produkce může být způsobena i v důsledku expozice organismu kovům z dentálních slitin používaných k sanaci chrupu. Ve vlhkém prostředí dutiny ústní mohou dentální slitiny korodovat, zejména je-li přítomna štěrbinová koroze [1, 4]. Korozní produkty v podobě kovových iontů se pak následně mohou ukládat do okolních tvrdých i měkkých tkání, někdy za vzniku modrošedého zabarvení, nebo mohou být spolknuty, v trávicím ústrojí resorbovány a pomocí fagocytujících buněk makrofágů transportovány do dalších lokalit organismu. Korozní produkty tedy neovlivňují pouze tkáně ústní dutiny, ale po spolknutí mohou působit i na slizniční epitel gastrointestinálního traktu a další orgány.
Fyziologická interakce kovových iontů se sliznicí vede, u většiny lidí, k indukci orální (slizniční) tolerance. U menšiny lidí se však může rozvinout intenzivní reakce na dentální slitiny. Imunitní reakce (odpověď) se může projevit lokálně, ústním dyskomfortem a místní reakcí různé intenzity. Místní reakce může být provázena systémovou reakcí, která je charakterizována přítomností buněk, které jsou na kovové ionty senzibilizovány.
V časných fázích zánětu jsou hlavním zdrojem prozánětlivých cytokinů makrofágy.V této studii jsme považovali za potřebné imunologicky ověřit na tkáňových liniích makrofágů lidského původu, jak kovy působí na buňky přirozené imunity, neboť tyto buňky hrají klíčovou roli v procesu získané imunitní odpovědi cestou exprese jejich stimulačních molekul a produkcí cytokinů.
MATERIÁL A METODY
Ve studii byla použita lidská monocyto-makrofágová linie THP1, která byla kultivována po dobu pěti dnů se solemi rtuti (Hg), niklu (Ni), ale též s dalšími, byť méně častými alergeny, jako jsou titan (Ti), chrom (Cr), kobalt (Co) a paladium (Pd).
Kultivace buněčné linie
Linie THP1 byla kultivována v RPMI 1640 médiu (GIBCO, Sigma) s přídavkem 10% fetálního bovinního séra (FBS). Buňky byly dvakrát týdně pasážovány naředěním na koncentraci 2×105/ml. Byla kontrolována životnost buněk, která neklesla u žádné z linií pod 95 %. Buňky byly diferencovány po dobu 72 hodin s přídavkem jednoprocentního dimethyl sulfoxidu (DMSO) do kultivačního média. U diferencovaných buněk životnost neklesla pod 90 %. Do pokusu byly buňky nasazovány v koncentraci 1×106/ml. Přenesené buňky byly následně kultivovány po dobu pěti dnů s roztoky solí kovů Ti, Hg, Cr, Co, Ni a Pd v koncentracích, které jsou běžně užívány na našem pracovišti při in vitro prováděném průkazu reakce na kovy testem buněčné proliferace lymfocytů (modifikace tzv. Melisa testu). Po kultivaci buněk s kovy nebo pouze s médiem, byly supernatanty vzorků odebrány, zamraženy a uchovány při teplotě -20 oC do stanovení tvorby cytokinů. Jako kontrola sloužily buňky kultivované pouze s médiem a přídavkem FBS – v tabulce 1 označeny BB.
Table 1. Výsledky kultivace monocyto-makrofágové linie THP1 s kovovými ionty 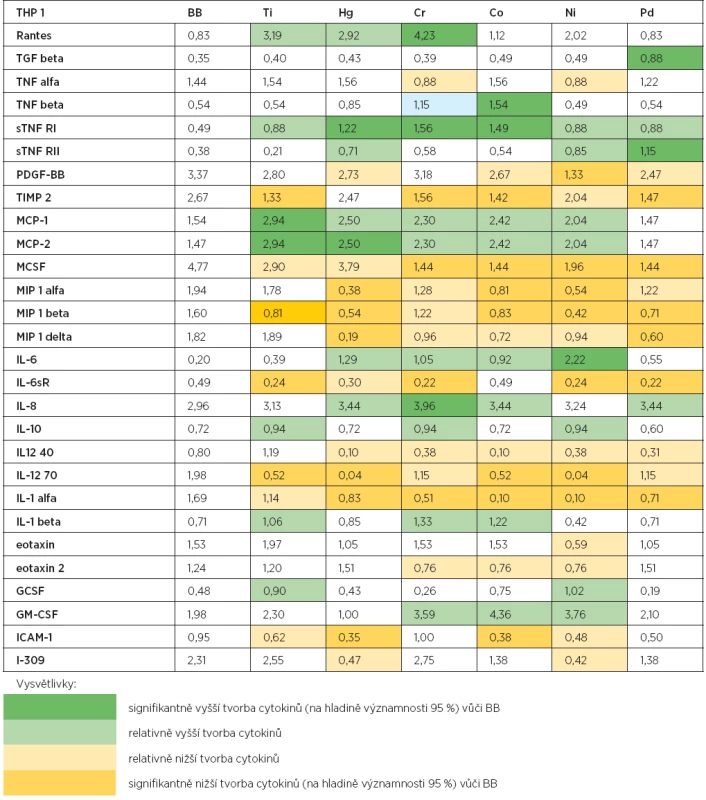
Stanovení tvorby cytokinů [2]
Cytokiny byly stanoveny metodou „human cytokine antibody arrays“, která umožňovala stanovení 40 cytokinů v jednom vzorku, při použití membrány Ray Bio® Human Inflammation Antibody Array III (Ray Biotech, Inc., USA). Stanovení tvorby cytokinů se provádělo pátý den po stimulaci THP 1 buněk solemi příslušných kovů. Komerčně připravené membrány s navázanými protilátkami proti cytokinům byly blokovány jednoprocentním roztokem bovinního sérového albuminu a inkubovány 30 minut při pokojové teplotě. Na takto připravené membrány se nanesly supernatanty vzorků získaných po pětidenní kultivaci buněk se solemi kovů nebo pouze médiem a inkubovaly se dvě hodiny při pokojové teplotě. Po inkubaci a promytí byla na membrány nanesena biotinylovaná detekční protilátka. Po dvouhodinové inkubaci a promytí následovalo přidání a inkubace membrán jednu hodinu ve tmě s roztokem streptavidin peroxidázy. Po promytí byla luminiscenční reakce na membránách vyvolána detekčním pufrem a měřena luminiscenčním detektorem LAS-1000 (Fuji Film, Tokio, Japonsko). Získaná data byla digitalizována a intenzita reakce se měřila pomocí obrazové analýzy. Výsledné hodnoty optické denzity vzorků, stimulovaných solemi kovů, byly porovnávány s denzitou buněk kultivovaných pouze s médiem (BB).
Statistické vyhodnocení výsledků
Rozdíly v tvorbě cytokinů tvořených buněčnou kulturou za přítomnosti každého ze šesti testovaných kovů nebo média byly formálně vyhodnoceny jednotnou statistickou metodikou: Pro úroveň každého cytokinu (uvedeného na řádku tabulky 1) byly vypočteny pomocné skóry Z (Ti), Z (Hg), Z (Cr), Z (Co), Z (Ni), Z (Pd) podle předpisů Z (Ti) = (Ti – BB)/SD, …….., Z(Pd) = (Pd – BB)/SD, kde Ti, ……, Pd jsou naměřené hodnoty „tvorby shora uvedeného cytokinu buněčnou kulturou za přítomnosti daného kovu“, BB je hodnota odpovídající „tvorbě tohoto cytokinu bez přítomnosti kovu“ (interpretovaný jako komparativní standard) a SD značí směrodatnou odchylku vypočtenou „v rámci naměřených hodnot pro celou šestici kovů“. V tabulce jsou barevně vyznačeny naměřené hodnoty podle hodnot skórů (Z), pokud se nacházely v následujících rozmezích:
- a) „Z >= 2“ (tmavozelená) – statisticky významně vyšší než BB na formální hladině spolehlivosti 95 %;
- b) „2 > Z >= 1“ (světlezelená) – znatelně vyšší než BB (ale nikoli statisticky významně);
- c) „-2 < Z <= -1“ (světležlutá) – znatelně nižší než BB (ale nikoli statisticky významně);
- d) „Z <= -2“ (tmavožlutá) – statisticky významně nižší než BB na formální hladině spolehlivosti 95 %.
VÝSLEDKY
Výsledky kultivace makrofágové linie THP1 s kovovými ionty jsou uvedeny v tabulce 1. V tabulce jsou uvedeny pouze cytokiny, u kterých došlo po přidání kovových iontů k ovlivnění jejich produkce.
Tvorba cytokinů u buněk makrofágové linie THP1 byla po kultivaci s kovovými ionty, v porovnání s buňkami stimulovanými pouze médiem (BB), ovlivněna jak ve smyslu zvýšené, tak i snížené produkce. Ionty titanu signifikantně stimulovaly tvorbu MCP-1 a MCP-2. Naopak inhibována byla tvorba TIPM 2, MIP 1 beta, IL-6sR a IL-12 70. Ionty rtuti stimulovaly signifikantně vyšší tvorbu sTNF RI a MCP-2. Naopak inhibici tvorby cytokinů po stimulaci Hg jsme detekovali u MIP 1 alfa, MIP 1 beta a MIP 1 delta, IL-12 70, IL-1 alfa a ICAM-1. Ionty chromu signifikantně zvyšovaly tvorbu Rantes, sTNF RI a IL-8. Signifikantně nižší tvorbu cytokinů jsme naopak zjistili v tvorbě TIMP 2, MCSF, IL-6sR a IL-1 alfa. Ionty kobaltu signifikantně zvyšovaly tvorbu TNF beta a sTNF RI a inhibovaly tvorbu TIMP 2, MCSF, MIP 1 alfa, MIP 1 beta, IL-12 70, IL-1 alfa a ICAM 1. Ionty niklu zvyšovaly signifikantně tvorbu IL-6 a naopak inhibovaly tvorbu PDGF-BB, MCSF, MIP1 alfa a beta, IL-6sR, IL-12 70 a IL-1 alfa. Paladium signifikantně stimulovalo tvorbu TGF beta a sTNF RII a inhibovalo tvorbu TIMP 2, MCSF, MIP 1 beta a delta, IL-6sR a IL-1 alfa.
DISKUSE A ZÁVĚR
Cílem naší studie bylo zjistit, jak tvorbu cytokinů u makrofágové linie THP1 ovlivňují kovové ionty.
Ray Bio® Human Inflammation Antibody Array III je kit určený pro multiplexové stanovení cytokinů, kterým je možné detekovat u monocytů, makrofágů, T-lymfocytů, B-lymfocytů, dendritických a jiných buněk tvorbu až 40 cytokinů. Není specificky zaměřen na jeden buněčný typ. Proto ve výsledcích tabulky 1 nejsou zastoupeny veškeré cytokiny, ale jen ty, které tvořila lidská monocyto-makrofágová linie THP1.
Signifikantně zvýšenou tvorbu zánětového faktoru Rantes jsme zjistili po stimulaci ionty chromu, který je známým kontaktním alergenem. Naopak protizánětlivý účinek s inhibicí mitózy má TGF beta, jehož produkce byla signifikantně zvýšena působením iontů paladia. Kobalt aktivoval další prozánětlivý faktor – TNF beta.
Signifikantně zvýšená tvorba MCP-1 po stimulaci titanem a MCP-2 po stimulaci titanem a rtutí má význam v chemotaxi monocytů do místa zánětu, ale i aktivaci bazofilů, které hrají úlohu v alergických reakcích. Nikl signifikantně zvyšoval tvorbu IL-6 a chrom IL-8, což jsou oba prozánětlivé cytokiny. Inhibována byla naopak tvorba IL-12 70 po kultivaci s ionty titanu, rtuti, kobaltu a niklu. Inhibice IL-12 70 vede ke snížené aktivaci TH1 lymfocytů, které hrají úlohu v reakcích oddálené přecitlivělosti. Podobně byla ionty rtuti, chromu, kobaltu, niklu a paladia inhibována tvorba IL-1 alfa, který se účastní v kostimulaci lymfocytů T, indukce TNF alfa i IL-8. Snížená tvorba IL-1 alfa po kultivaci s kovovými ionty může příznivě ovlivňovat zánětlivé reakce. Wataha a kol. [5] sledovali tvorbu IL-1 beta a TNF alfa u THP1 kultury lidských monocytů po přidání solí stříbra, zlata, mědi, rtuti a niklu. Jedině v případě niklu pozorovali, po třídenní kultivaci, signifikantně zvýšenou produkci IL-1 beta a TNF alfa. Naše výsledky, získané po pětidenní inkubaci tento nález nepotvrdily, což může být způsobeno hodnocením v různých časových údobích (3 a 5 dní), jakož i použitím rozdílných přísad a koncentrací solí kovů do média ke kultivaci buněk a rozdílných metod, kterými byly cytokiny identifikovány. Široké spektrum účinků na sekreci cytokinů u kultury THP1 lidských monocytů kultivovaných s niklem (Ni2+) popisují též Lewis a kol. [3].
Výsledkem naší studie bylo zjištění, že zkoumané ionty jako korozní produkty kovových dentálních materiálů mohou v různé míře ovlivňovat buňky linie THP1 ve smyslu zvýšené, ale i snížené tvorby chemotaktických faktorů, prozánětlivých cytokinů, ale i cytokinů, které se podílejí na regulaci imunitní odpovědi. Ovlivnění jejich tvorby po expozici kovům, a tím porušení homeostázy regulačních mechanismů v podmínkách in vivo, může vést k rozvoji nežádoucí reakce na kovové materiály.
Seznam zkratek cytokinů použitých v textu
G-CSF faktor stimulující kolonie granulocytů GM-CSF faktor stimulující kolonie granulocytů a makrofágů IFN interferon IL interleukin I-309 ligand chemokinů IP-10 interferon gamma indukující protein MCP membránový kofaktorový protein M-CSF faktor stimulující kolonie makrofágů MIP chemotaktický faktor pro monocyty MIG faktor inhibující granulocyty PDGF růstový faktor produkovaný destičkami RANTES chemokin TGF transformující růstový faktor TH pomocný T-lymfocyt TH 1 T-lymfocyty uplatňující se v buňkami zprostředkované imunitě TH 2 T-lymfocyty uplatňující se v humorální imunitě TNF faktor nekrotizující nádory TIMP tkáňový faktor inhibující metaloproteinázy Poděkování
Tato práce vznikla za podpory IGA MZ ČR, č. NT 12206-4.MUDr. Zora Vencliková, CSc.
Ústav klinické a experimentální stomatologie
1. LF UK a VFN
Karlovo nám. 32
121 11 Praha 2
e-mail: venclikova@vus.cz
Sources
1. Joska, L., Venclíková, Z., Poddaná, M., Benada O.: The mechanism of gingiva metallic pigmentations formation. Clin. Oral. Investig., roč. 13, 2009, č. 1, s. 1–7.
2. Kokešová, A., Frolová, L., Kverka, M., Sokol, D., Rossmann, P., Bártová, J., Tlaskalová-Hogenová, H. Oral administration of probiotic bacteria (E. coli Nissle, E. coli 083, Lactobacillus casei) influences the severity of dextran sodium sulfate-induced colitis in BALB/c mice. Folia Microbiol. (Praha), roč. 51, 2006, č. 5, s. 478–484.
3. Lewis, J. B., Messer, R. L., Pitts, L., Hsu, S. D., Hansen, J. M., Wataha, J. C.: Ni (II) ions dysregulate cytokine secretion from human monocytes. J. Biomed. Mater. Res. B. Appl. Biomater., roč. 88, 2009, č. 2, s. 358–365.
4. Poddaná, M., Joska, L., Venclíková, Z.: Vliv koroze na vznik pigmentace měkké tkáně. Čes. Stomat., roč. 107, 2007, č. 1, s. 10–13.
5. Wataha, J. C., Rathanasathien, S., Hanks, C. T., Sun, Z. N.: In vitro IL-1 beta and TNF-alpha release from THP-1 monocytes in response to metal ions. Dent. Mater., roč. 12, 1996, č. 6, s. 322–327.
Labels
Maxillofacial surgery Orthodontics Dental medicine
Article was published inCzech Dental Journal

2013 Issue 3-
All articles in this issue
- Přehled novějších možností ve farmakoterapii nemocí ústní sliznice, slinných žláz a parodontu
- Využití negativního tlaku v léčbě zánětů orofaciální oblasti
- Sledování tvorby cytokinů u tkáňové kultury lidských makrofágů stimulovaných ionty kovů
- Estetika chrupu při asymetrických změnách tvaru frontálních zubů
- Czech Dental Journal
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Využití negativního tlaku v léčbě zánětů orofaciální oblasti
- Estetika chrupu při asymetrických změnách tvaru frontálních zubů
- Přehled novějších možností ve farmakoterapii nemocí ústní sliznice, slinných žláz a parodontu
- Sledování tvorby cytokinů u tkáňové kultury lidských makrofágů stimulovaných ionty kovů
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

