-
Medical journals
- Career
Využití droplet-based mikrofluidních technik při přípravě mikročástic
Authors: Martina Naiserová; Jakub Vysloužil; Kateřina Kubová; Martina Holická; David Vetchý; Josef Mašek; Eliška Mašková
Published in: Čes. slov. Farm., 2021; 70, 155-163
Category: Review Articles
doi: https://doi.org/https://doi.org/10.5817/CSF2021-5-155Overview
Mikročástice jsou široce používány v nesčetných oblastech průmyslu, jako jsou farmaceutika, potraviny, kosmetika a další. Ve srovnání s tradičními metodami pro syntézu mikročástic poskytují mikrofluidní techniky výkonné platformy pro vytváření vysoce kontrolovatelných kapek emulze jako šablon pro výrobu uniformních mikročástic s pokročilými strukturami a funkcemi. Mikrofluidní techniky mohou generovat kapky emulze s přesně řízenou velikostí, tvarem a složením. Přesnější proces přípravy je účinným nástroj ke kontrole profilu uvolňování léčiva a přináší také snadno dostupnou reprodukovatelnost. Článek poskytuje informace o základních nastaveních droplet-based techniky a příklady typů mikročástic připravitelných touto metodou.
Klíčová slova:
mikročástice – mikrofluidní technika – metoda odpaření rozpouštědla – PDMS – mikrokanálky
Úvod
Během posledních desetiletí došlo k obrovskému vývoji v oblasti miniaturizovaných systémů pro manipulaci s tekutinami, známých jako mikrofluidní systémy1). Mikrofluidika se tak stala jedním z nově se vyvíjejících oborů mechaniky tekutin. Zabývá se technikou generování a řízení pohybů velmi malých objemů tekutin v prostředí kanálků a dutin, jejichž rozměry se pohybují od jednotek milimetrů až po jednotky mikrometrů2). Tyto miniaturizované systémy umožňují provádět velké množství experimentů v krátkém čase, při velmi malé spotřebě surovin. Ze specializované oblasti výzkumu v rámci mikroelektronického průmyslu se v posledních letech rozrostla do vysoce interdisciplinárního odvětví, které kombinuje prvky strojírenství, fyziky, chemie, biologie a nanotechnologie2). Mikrofluidní systémy nacházejí uplatnění při většině chemických reakcí, při práci se vzorky potravin, paliv a olejů, při vývoji nových sloučenin, léků, katalyzátorů a v analytice1, 2). Kromě snížení spotřeby surovin patří mezi výhody také zrychlení procesu, vyšší výkonnost a efektivnost3, 4). Při využití charakteristik mikrofluidního zařízení v kombinaci se dvěma nemísitelnými kapalinami je pak možné získat emulzi s úzkou velikostní distribucí definovanou průměrem kanálků zařízení. Toho je možné využít k přípravě polymerních mikročástic jako nosičů léčiva.
Mikročásticové lékové formy jsou v dnešní době pevnou součástí nabídky komerčně dostupných léků pro humánní terapii a i z tohoto důvodu nadále patří mezi intenzivně studovanou skupinu. Kromě již tradiční enkapsulace různých analogů GnRH (z ang. gonadotropin-releasing hormon)5) se používají také jako nosiče řady jiných léčiv, jako např. bromokryptinu nebo dokonce inzulinu6). Vzhledem k nejčastějším typům podání (subkutánní, intramuskulární, perorální či inhalační podání) by se velikost mikročástic měla pohybovat v jednotkách až desítkách μm7–10). Polymerní mikročástice se připravují celou řadou postupů, a to především metodou odpaření rozpouštědla, sprejovým sušením nebo chemickými metodami (polymerové jevy)11). V praxi je však u používaných metod problematické získat vzorek s uniformní distribucí velikosti částic, což může vést ke komplikacím s disolučním profilem léčiva nebo k nerovnoměrnému odbourávání použitých biodegradovatelných polymerů.
Předkládaný přehledový článek uvádí informace o základních uspořádáních mikrofluidní soustavy používaných k tvorbě emulzních kapek a možném využití mikrofluidní soustavy jako podsestavy pro tradiční techniky přípravy mikročástic za účelem zisku mikročástic s definovanou velikostí a úzkou distribucí.
Mikrofluidní generování emulzí
Původní uspořádání mikrofluidních systémů počítalo s použitím mísitelných kapalin. Hlavní myšlenkou bylo významné zmenšení měřítka chemických a biochemických reakcí, z čehož plyne nízká spotřeba reakčního materiálu, rychlost procesu a možnost skládat několik podobných provedení za sebou. Vzhledem k tomu se technika řadí mezi tzv. „A lab on a chip“ metody12). Teprve později se začalo uvažovat o použití dvou a více nemísitelných kapalin, což následně umožnilo vznik směru droplet-based mikrofluidiky.
Celá mikrofluidní soustava se skládá z několika komponentů: dávkujícího zdroje kapalin ve formě injekční stříkačky v lineárním dávkovači či specializované mikrofluidní pumpy, spojovacích elementů a mikrofluidních čipů, které představují samotné srdce metody. V těchto čipech se nacházejí mikrokanálky různých prostorových uspořádáních, délek a průměrů. Dříve se v mikrofluidních čipech využíval zejména křemík, sklo a kovy. Tyto materiály měly řadu výhod, například vynikající stabilitu povrchu, kompatibilitu s rozpouštědly a vhodné optické vlastnosti. Hlavní nevýhodou byly vysoké náklady spojené s cenou materiálu a způsobem výroby1). Proto byly tradičně používané materiály nahrazeny polymery. Vzhledem ke své jednoduchosti výroby, poměrně nízké fluorescenci pozadí (což usnadňuje vizualizaci tvorby částic při využití fotoluminiscenčních metod) a dobré biologické kompatibilitě je standardním materiálem používaným pro výzkumné účely poly(dimethylsiloxan) (PDMS), a to jak pro kontinuální tok, tak pro droplet-based techniky2). PDMS je biokompatibilní, transparentní a snadno tvarovatelný elastický polymer, který je elektricky nevodivý a propustný pro kyslík i oxid uhličitý. Nevýhodou PDMS je jeho deformace v přítomnosti silných organických rozpouštědel. Proto se v některých případech používají i materiály odolnější vůči rozpouštědlům, například polykarbonát, cyklický kopolymer olefinu, polyamidová plastická pryskyřice a thiolen13, 14). K výrobě čipů se v současnosti používají především soft-litografické techniky. Pro přípravu PDMS čipů se obvykle pomocí standardní kontaktní fotolitografie vyrobí tzv. master (předloha) a z tohoto masteru se generuje replika nalitím již namíchané směsi PDMS, s následným odplyněním a vytvrzováním (obr. 1). Pokud se pro mikrofluidní experimenty používají vodná rozpouštědla, není obvykle nutné další řešení utěsnění hadiček a spojů, protože gumový charakter PDMS velmi těsně uzavírá všechny mezery. Pokud se však používají kapaliny olejové povahy, je často nutné materiál čipu ještě dále upravit, např. ošetřením čipu kyslíkovou plazmou pro zisk OH – terminálních zakončení, což vede k vytvoření kovalentní vazby PDMS těla čipu a skleněného krytu2).
Image 1. Zjednodušené schéma přípravy PDMS čipu kontaktní fotolitografií (upraveno dle2)) 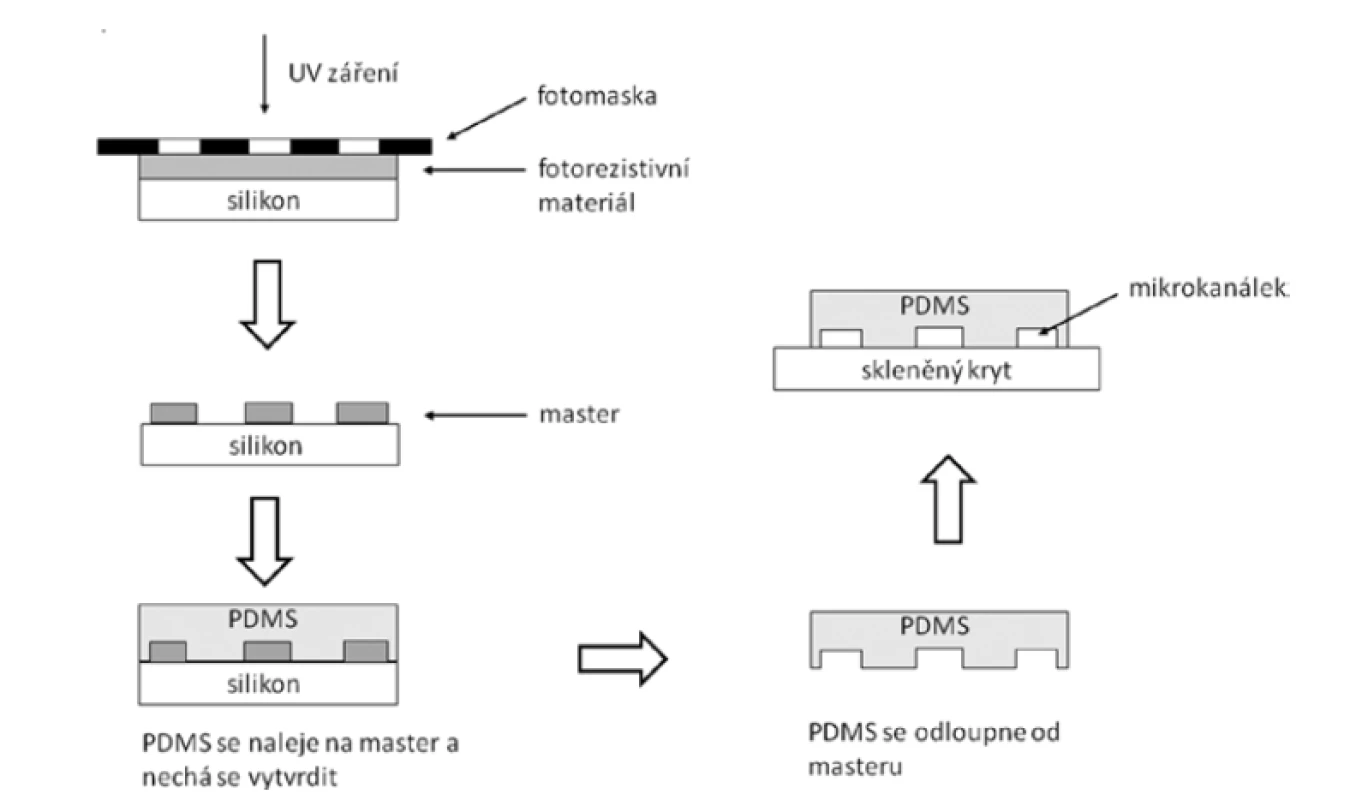
Povrchovou modifikací mikrofluidních kanálků mohou být změněny jejich smáčivé vlastnosti. Obdobně se dá využít i změna koncentrace povrchově aktivní látky rozpuštěné v kontinuální fázi15). Monodisperzní emulze typu o/v i v/o mohou být připraveny ve stejném zařízení, ale je nezbytné správně zvolit povrchově aktivní činidlo, které je přidáváno do vodné nebo olejové fáze16). Pro droplet-based techniku je smáčivost stěn a jejich odolnost proti organickým rozpouštědlům obzvláště důležitá. Důležitými faktory pro řízenou tvorbu kapek jsou fyzikální vlastnosti využitých kapalin, geometrie mikrofluidního zařízení a procesní podmínky. Tvorba kapek v mikrofluidním zařízení může být ovlivněna např. regulací průtoku a vstupního tlaku obou fází17). Zvýšením průtoku kontinuální fáze může být snížena velikost kapek. Zvýšením průtoku olejové fáze se zase zvyšuje frekvence tvorby kapek18). Existují tři základní typy mikrofluidních geometrií, které se používají pro tvorbu kapek, a to uspořádání ve tvaru T (T-junction), soustředný tok (flow focusing) a souběžné uspořádání (co-flowing)19).
Uspořádání typu „T“
Geometrické uspořádání typu T představuje nejjednodušší mikrofluidní strukturu pro tvorbu emulzních kapek16). Uspořádání je tvořeno horizontálním kanálem a kanálem na něj kolmým20). Hlavním kanálem proudí kapalina kontinuální (vodné) fáze a disperzní kapalina (lipofilní fáze) se vstřikuje přes kolmý kanál (tzv. crossflowing) 21). Nejdříve dispergovaná kapalina z kolmého kanálku zaplní část horizontálního kanálku. Na tuto část dispergované kapaliny ale okamžitě působí tok kontinuální fáze, a tedy i vyvolané smykové napětí. Tlak proti proudu vyvíjející se kapky způsobí, že se čelo dispergované fáze naruší směrem dolů a dojde k rozpadu za vzniku kapky16), kdy proud kontinuální fáze v horizontálním kanálku v podstatě odstřihne část dispergované fáze o hranu kanálku (obr. 2a)22). Používají se i uspořádání, kde jsou fáze prohozeny. V horizontálním kanálku je dispergovaná fáze a v kolmém kanálku je kontinuální fáze (tzv. perpendicular flowing). Obvykle se používají dva kolmé kanálky k lepšímu odstřižení. V tomto uspořádání je kapka odstřižena jen pomocí proudění kontinuální fáze (obr. 2b)22). Velikost kapek lze měnit změnou průtoku kapaliny, šířkou kanálu nebo změnou poměru viskozit mezi oběma fázemi13). Zvýšení teploty se projevuje vznikem větších kapek vzhledem ke změně viskozity a mezifázového napětí kapalin23).
Image 2. Uspořádání typu T (přepracováno dle16)): a – standardní T uspořádání, b – T uspořádání se vstřikováním disperzní fáze přes hlavní kanál, c – T uspořádání s „head-on“ geometrií, d – aktivní T geometrie s řízenou pohyblivou konstrukcí stěn, zde zvýšením tlaku vzduchu/plynu v přiléhající struktuře
DF – dispergovaná fáze, KF – kontinuální fáze, E – emulze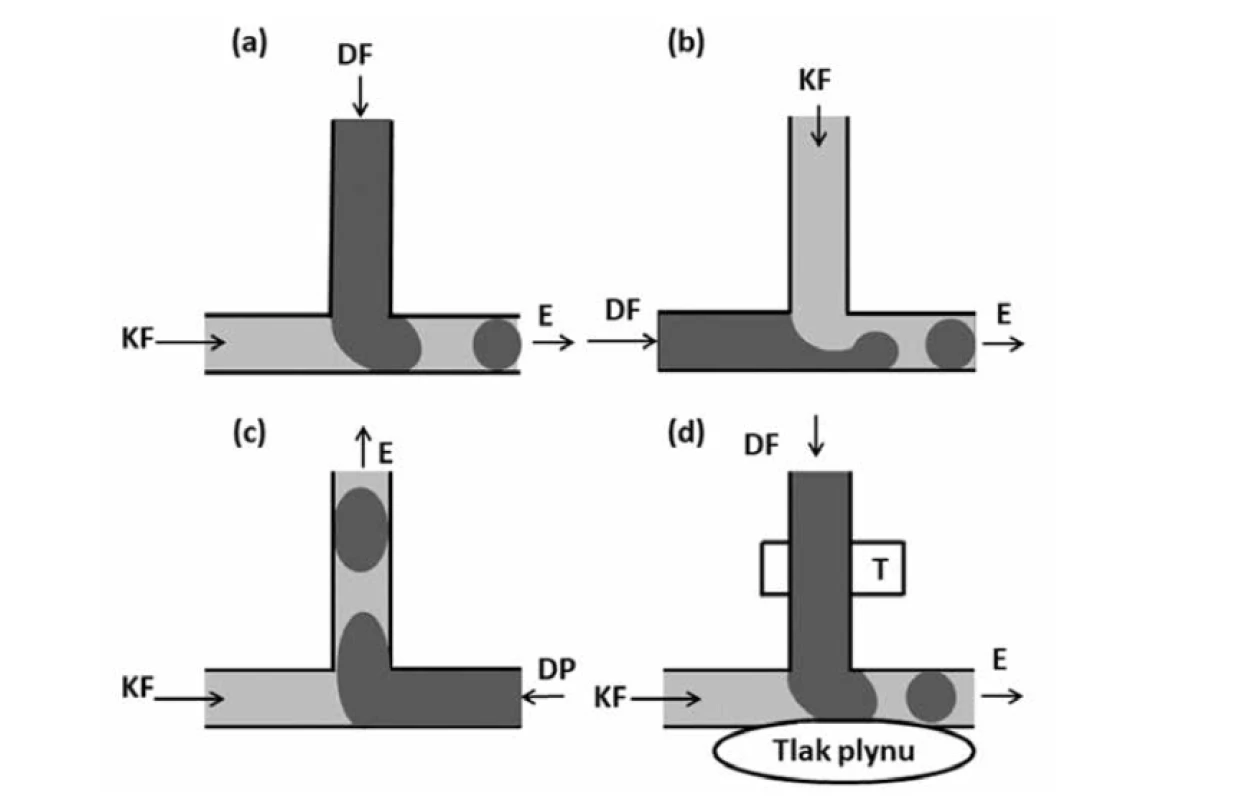
Dále však existuje celá řada úprav tohoto uspořádání. Jedním z nich je např. tzv. „head-on“ geometrie, u které jsou dvě tekutiny vstřikovány ze dvou protilehlých stran hlavního kanálu a vznikající kapky jsou odstřihovány do ortogonálního (kolmého) kanálu (obr. 2c). Existují i varianty klasického uspořádání s pohyblivými stěnami, což umožňuje regulaci průsvitu, a tedy i lepší možnost regulace velikosti částic (obr. 2d)16).
Dříve se většina studií zabývajících se tvorbou kapek v mikrokanálech věnovala především tradičním systémům, ve kterých se vyskytovaly pouze Newtonské kapaliny. S rozšířením mikrofluidní techniky do nejrůznějších odvětví je třeba zohlednit také využití nenewtonských kapalin. Jedná se o kapaliny, u kterých není rychlost deformace úměrná napětí. Zkoumáním procesu emulgace prov T uspořádání pro nenewtonské/newtonské systémy se zabývali například Husny a Cooper-White24). Autoři srovnávali tvorbu polymerních kapek a rozpadovou dynamiku u nízko viskózních polyethylenoxidových tekutin a newtonských tekutin24). Gu a Liow25) zkoumali tvorbu kapek xanthanové klovatiny v oleji při různých průtokových podmínkách. Se vrůstajícím průtokem roztoku xanthanové klovatiny exponenciálně klesala doba tvorby kapek. Kritická rychlost průtoku roztoku byla stanovena na 0,35 ml/h. Nad touto hodnotou již doba tvorby kapek neklesala exponenciálně. Zjištěno také bylo, že se vzrůstající viskozitou roztoku klovatiny se také zvětšuje průměr kapek a doba jejich vzniku25).
Uspořádání typu „Y“
Geometrické uspořádání Y je modifikací geometrie T. V tomto uspořádání jsou kontinuální a dispergova ná fáze také přiváděny dvěma oddělenými vstupními kanály a emulze odchází prostřednictvím společného výstupního kanálu (obr. 3). Velikost kapek vytvořených v tomto uspořádání není závislá na průtokové rychlosti a viskozitě dispergované fáze, což je odlišnost od uspořádání tvaru T. Při použití dvou kapalin s nízkým Reynoldsovým číslem dochází ve společném kanálu k paralelnímu laminárnímu proudu obou kapalin. Mísení těchto dvou proudů může probíhat pouze difuzí a je omezeno na šířku středu kanálu. Tento jev je využit v řadě oblastí, např. diagnostika krve, tvorba anizotropních (Janusových) částic atd.16).
Image 3. Uspořádání typu Y (přepracováno dle16))
DF – dispergovaná fáze, KF – kontinuální fáze, E – emulze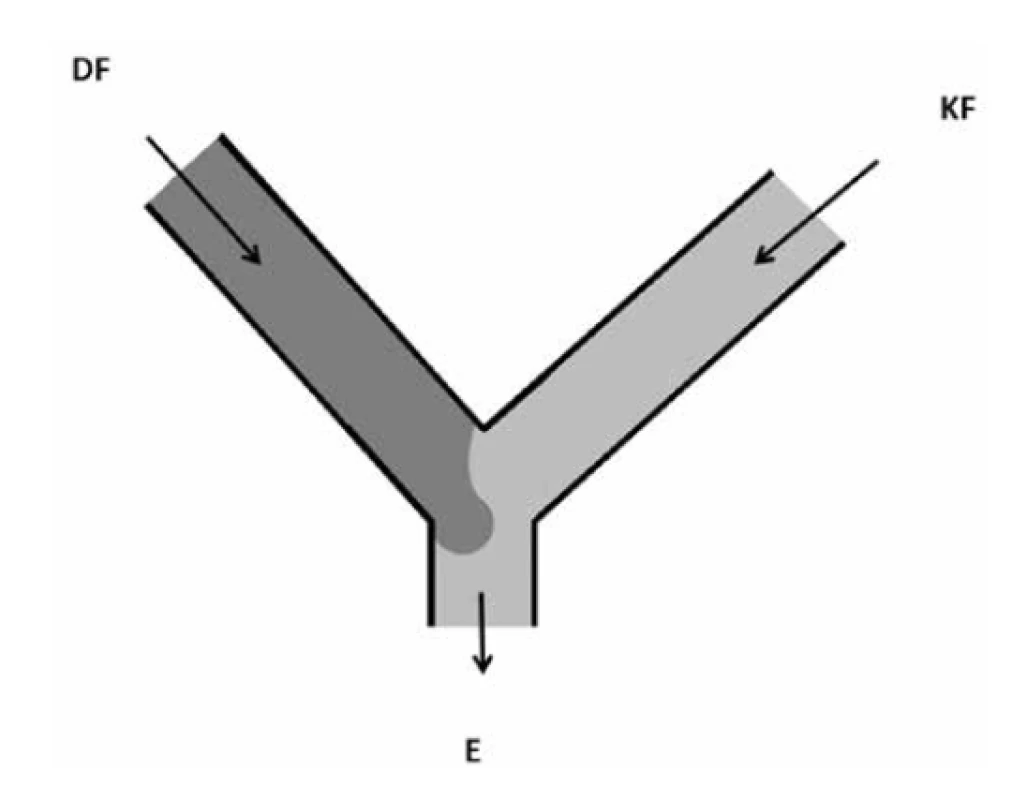
Uspořádání typu soustředného toku (flow-focusing)
Další velmi často používanou strukturou je soustředné uspořádání (obr. 4). Je široce využíváno pro tvorbu sférických monodisperzních kapek22). V této geometrii dochází k rychlé a kontinuální tvorbě kapek za využití proudu nemísitelných kapalin26). Princip tvorby kapky se poněkud liší od těch, které byly vytvořeny v geometrii T. Za normálních podmínek by při soustředném toku vznikala kapka s významně větší délkou, než je průměr kanálku, a bez další regulace pak mohou vznikat příliš velké částice, což je samozřejmě nežádoucí. Proto se při této metodě využívají průtokové otvory, které v kombinaci s dalšími faktory, jako jsou viskozita a rychlost toku, slouží jako nástroj k regulaci velikosti částic27). Disperzní fáze proudí středovým kanálem a kontinuální fáze je přiváděna přes dva vnější kanály. Obě kapaliny jsou nuceny společně protéci malým otvorem umístěným po proudu toku. Kontinuální fáze způsobuje tlakové a smykové napětí, které stlačuje disperzní fázi do velmi tenkého niťovitého proudu, který se rozkládá v nebo za průtokovým otvorem16). U pomalého proudění vzniká hned za průtokovým otvorem kulatá kapka. Se zvyšující se rychlostí dochází za průtokovým otvorem k provynikání disperzní fáze do odtokového kanálku. Kapky se tvoří na konci takto vzniklého proudu v odtokovém kanálku (obr. 4a). V tomto základním uspořádání kapalina ve středním kanálu nesmáčí stěny otvoru, a proto jsou k přípravě emulzí potřeba hydrofilní či hydrofobní stěny. Pokud kapalina ve středním kanálu smáčí stěny otvoru, jsou kapky vytvářeny z kapaliny protékající vnějšími kanály, a to po proudu od ústí (obr. 4b). Existuje také alternativní uspořádání s počátečním protiproudem (obr. 4c). Kontinuální a dispergovaná fáze nejprve proudí v hlavním kanálu proti sobě, čímž dochází k deformaci středového toku dispergované fáze a odstřihnutí kapek, aby následně obě fáze protékaly soustředně menším koaxiálním kanálem, dispergovaná fáze již tedy ve formě kapek16).
Image 4. Uspořádání typu soustředného toku (přepracováno dle16)): a – standardní uspořádání, b – uspořádání soustředného toku s kontinuální fází dodávanou přes středový kanál, c – soustředný tok s protiproudem
DF – dispergovaná fáze, KF – kontinuální fáze, E – emulze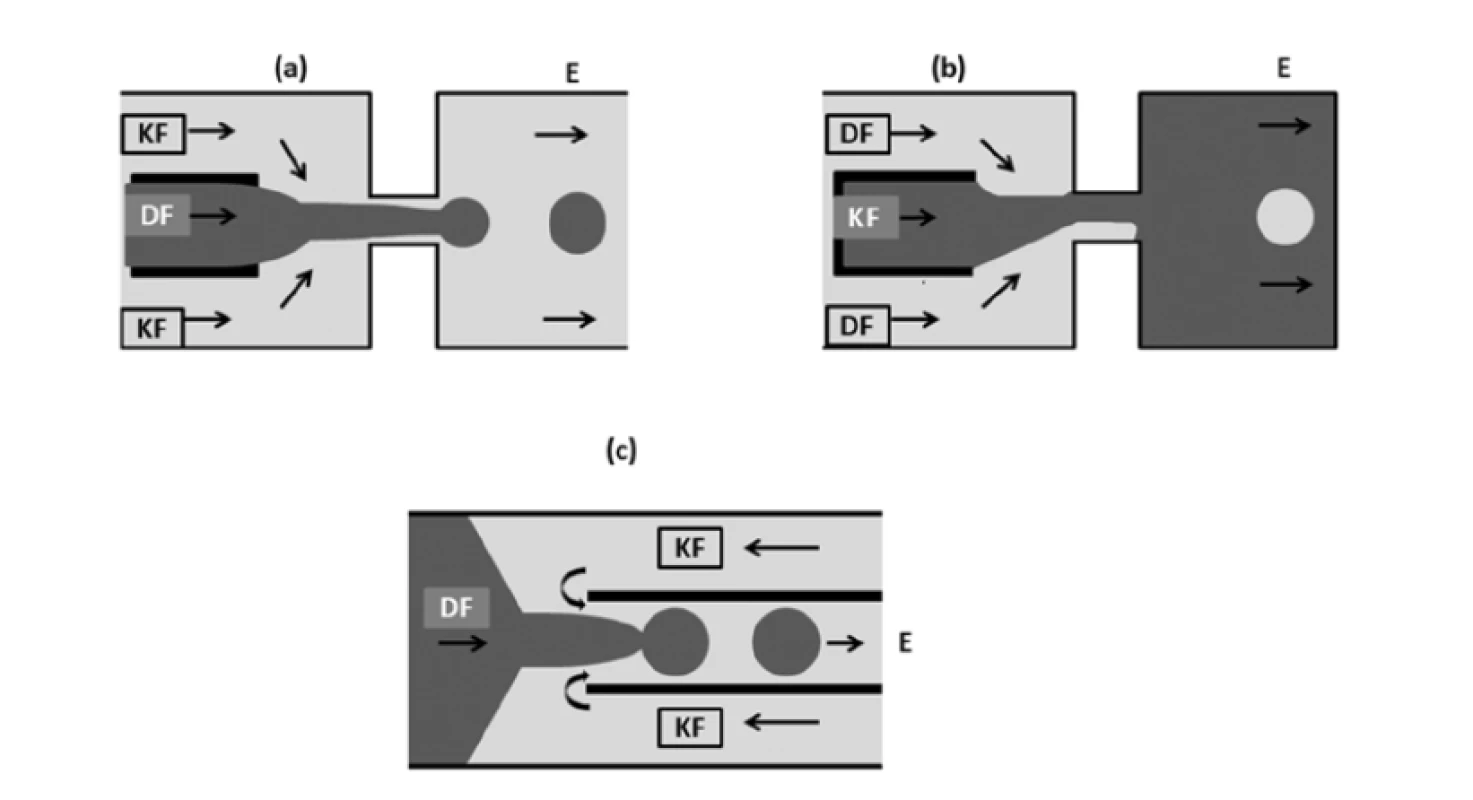
Při metodě soustředného toku se objevují dva režimy: odkapávání a tryskání. Režim odkapávání probíhá při nízkých průtokových rychlostech a vznikají při něm vysoce uniformní sférické kapky. K tryskání dochází při vyšších rychlostech průtoku a jeho výhodou je rychlejší příprava22).
Uspořádání typu souběžného toku (co-flowing)
Další technika používaná ke generování kapek je mikrofluidní systém souběžného toku. Tato metoda je podobná metodě soustředného toku, kde je disperzní fáze umístěna v kapiláře nebo jehle, kolem které proudí kontinuální fáze, tentokrát však bez zúžení průtokového otvoru (obr. 5). Kapky se tvoří přímo na hrotu jehly nebo kapiláry. Tvorba kapek je způsobena viskózním tlakem vyvíjeným na rozhraní vnějším proudem28). Kapky mohou být vytvořeny přímo na špičce trubice nebo jehly, k čemuž dochází v kapacím režimu, nebo se kapky generují do hlavního kanálu ke konci proudění tekutiny v režimu tryskání. Při režimu tryskání dochází k rychlejšímu toku a disperzní fáze vytváří tenký proud, který se rozpadá na kapky22).
Image 5. Uspořádání typu souběžného toku (přepracováno dle16))
DF – dispergovaná fáze, KF – kontinuální fáze, E – emulze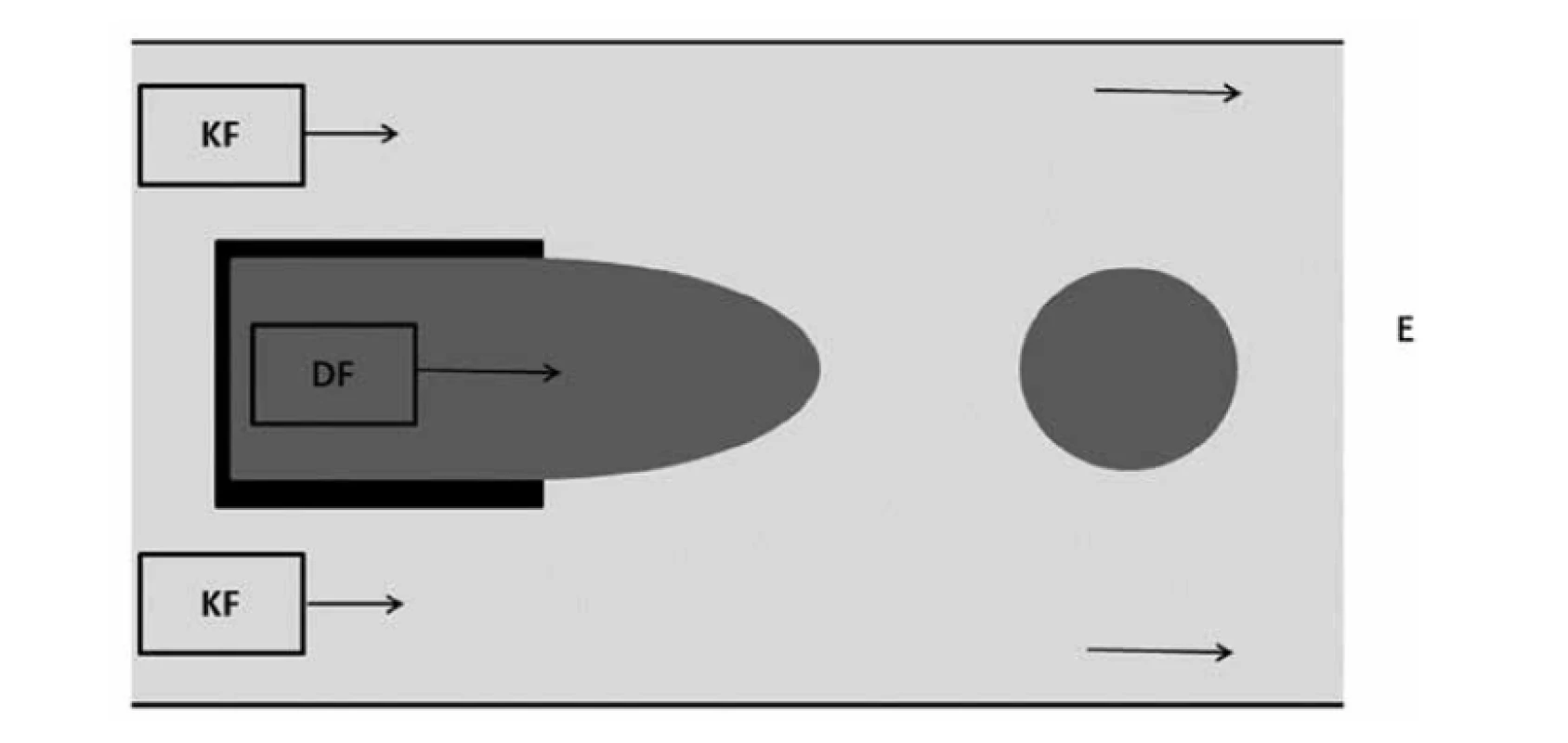
Všechny zmíněné metody jsou základními možnostmi pro přípravu jednoduchých emulzí, a to jak přímých, tak i obrácených. Kombinací dvou a více jednotek generujících kapky mohou být částice vytvořené v první jednotce, zapouzdřeny uvnitř kapek tvořících se v dalších připojených jednotkách. Generují se tedy kapky tvořené dvojitou, trojitou nebo vícenásobnou emulzí. Přesného a individuálního řízení velikosti vnitřních a vnějších kapiček lze dosáhnout úpravou průtokových rychlostí v každém kroku generujícím kapky. Zatímco jsou kapky pravidelně vytvářeny v každé jednotce, může být také počet vnitřních kapiček uvnitř vnější kapky přesně regulován tím, že se v každé jednotce upraví frekvence tvorby kapek29).
Mikrofluidní příprava mikročástic
Využití mikrofluidní techniky se přímo nabízí například při přípravě mikročástic metodou odpaření rozpouštědla. Metoda využívá dvou téměř nemísitelných fází, ze kterých se připravuje velice jemná emulze30). Problematická je fáze homogenizace emulze, kdy lze využitím mechanických homogenizátorů dosáhnout velmi malých rozměrů kapek (a následně tedy i částic), velikostní distribuce je ale poměrně široká31). Z podobných důvodů v úvahu připadají i další techniky přípravy, např. příprava lipofilních částic ve vodném prostředí nebo příprava mikročástic z gelotvorných látek. Zapojení mikrofluidní techniky umožňuje vytvářet emulzní kapky s přesně kontrolovanou velikostí (v některých případech méně než 1% variace, v rozměrech milimetrů až mikrometrů a dokonce i stovek nanometrů), tvarem a složením32). Mikrofluidní techniky navíc umožňují tvorbu vícefázových a anizotropních částic33). Příprava založená na této technice je omezena z hlediska rychlosti přípravy, protože mikročástice jsou generovány v jediném kanálku34). Tento problém je ale možné částečně odstranit zapojením většího množství mikrofluidních zařízení.
Příprava sférických mikročástic
Jako jedni z prvních demonstrovali tvorbu mikrosfér pomocí mikrofluidního zařízení Nakajima et al. Připravovali pevné lipidové mikrosféry vyrobené z hydrogenovaného rybího oleje. Kapky oleje ve vodě byly vytvořeny za pomoci mikrofluidního zařízení při teplotě 70 °C, při nižší teplotě poté ztuhly a byly lyofilizovány za vzniku pevných mikrosfér o rozměrech 20 μm. Variační koeficient velikosti částic byl menší než 5 %, což bylo významné zlepšení oproti tradičně používaným metodám35).
Využít mikrofluidní techniky je možné také při přípravě monodisperzní částic gelačními metodami. Příkladem mohou být mikročástice tvořené poly(N-isopropylakrylamidem); vodná fáze obsahovala monomer N-isopropylakrylamid, síťující látka byla N,N-methylenbisakrylamid a kontinuální fázi tvořil roztok peroxodisíranu amonného36). Tohoto principu bylo využito i ve studii Hwang et al., kdy byly připraveny prostřednictvím mikrofluidní techniky soustředného toku částice s poly(N-isopropylakrylamidem) s nízkým variačním koeficientem velikosti (1,2 %)37).
Monodisperzní mikročástice je vzhledem k mikrofluidní sestavě možné připravit také u metody odpaření rozpouštědla. Ve studii Xu et al. byly soustředným tokem připraveny částice o dvou definovaných velikostech 11 a 41 μm, přičemž nejvyšší hodnota polydisperzního indexu dosahovala pouze 3,9 %. Jako modelové léčivo byl použit bupivakain, který byl rozpuštěn ve vnitřní dispergované fázi PLGA/dichlormethan, kontinuální fáze byl vodný Tris pufr s polyvinyl alkoholem (1%) jako emulgátorem38).
Pro léčbu proliferativní vitreoretinopatie byly syntetizovány mikročástice obsahující kortikoid dexamethason. Byla využita mikrofluidní geometrie typu T pro vytvoření částic na bázi oxidu křemičitého s velkým povrchem a porézní strukturou. Kontinuální fáze byla tvořena minerálním olejem obsahujícím 2 % Span® 80 a disperzní fází byla 20% suspenze nanočástic oxidu křemičitého. Po odpaření vody a kalcinaci byl na krystalové mikročástice nanesen polymerní roztok PLGA obsahující dexamethason, který vyplnil všechny póry mikročástice39).
Manipulací s mezifázovou nestabilitou emulzních kapek během procesu odpařování rozpouštědla mohou být vyrobeny mikročástice se zvrásněným povrchem40).
Příprava nesférických mikročástic
Kromě velmi přesné kontroly nad velikostí částic v mikrometrovém měřítku poskytuje mikrofluidika také ojedinělou možnost vytvářet nesférické částice kontrolovaného tvaru. Takové částice je velmi náročné připravit pomocí tradičních metod. Problémem je zejména vliv povrchového napětí, které nutí tvořící se částici zaujmout pravidelný tvar koule41).
Nesférické mikročástice mohou být produkovány prostřednictvím změny vnitřních rozměrů kanálku a současného využití UV zářiče, který působí na částice obsahující polymer citlivý na tento typ záření (UV polymerizace). Působením UV záření je možné získat částice ve tvaru tyčinek nebo disků. Pomocí mikrokanálku, který má rozměry menší než velikost tvořící se emulzní kapky, můžeme získat částice ve tvaru disku nebo kolíku (plug shape) v závislosti na dimenzích prostoru kanálku42). Ke tvarování částic v kanálku se využívá také snížení teploty nosné kapaliny, které vede ke vzniku diskovitých částic. Při zvýšení průtokové rychlosti je možné získat také částice ve tvaru elipsoidu43).
Nesférické částice mohou být také tvořeny z kapek obsahujících dvě nemísitelné fáze, přičemž jednu z fází je možné posléze vytvrdit. Tyto kapky mohou být dvoufázové organické útvary, které jsou dispergované v kontinuální vodní fázi nebo dvojité emulzní kapky (v/o/v). Kapky obsahující dvě organické fáze (fotopolymerizovatelný akrylát a silikonový olej) byly připraveny pomocí mikrofluidního zařízení uspořádaného v Y geometrii. Organické fáze byly přiváděny odděleně pomocí dvou ramen kanálku. Na Y křižovatce se vytvořil paralelní proud dvou organických fází. Tento dvoufázový proud následně vstoupil do proudu vodné fáze, která obklopuje proud organických fází z vnějších stran. Jako vodná fáze byl použit 0,3% roztok dodecylsulfátu sodného. Vlivem působení povrchově aktivní látky a UV polymerizací vytvrditelné části kapek se tvořily částice ve tvaru kukuřičných zrn. Částice vykazovaly vlastnosti tzv. Janusových částic (viz dále)44). U dvojitých emulzních kapek v/o/v může manipulace s mezifázovou energií pomocí povrchově aktivní látky způsobit tvorbu asférických kapek typu jádro-plášť ve tvaru žaludu. UV polymerizací střední olejové fáze dochází k produkci miskovitých částic, které mají tvar závislý na objemu a složení olejové fáze. Tyto mikročástice mohou být využity jako řízené mikrokontejnery pro uvolnění nebo vychytání další substance45).
Janusovy mikročástice
Janusovy částice jsou nejjednodušším případem nepravidelných nebo středově nesymetrických částic. Jsou pojmenovány podle římského boha Januse, který měl dvě různé tváře. Tyto anizotropní částice totiž mají dvě nebo více prostorových oblastí, které mají různé povrchové, strukturní nebo materiálové vlastnosti. Částice se dále mohou lišit z hlediska magnetických, fluorescenčních a optických charakteristik46). Obecně se dají Janusovy mikročástice vyrobit mikrofluidní technikou pomocí řízeného toku. Rovnoměrné mikročástice se vytvoří současným odříznutím dvou paralelních proudů. Následná UV polymerizace kapiček (obě části mikročástice jsou vytvrditelné) zajišťuje jejich ztuhnutí dříve, než se obě fáze promíchají47). Janusovy částice mohou napodobovat chování povrchově aktivních látek a mohou být využity jako nové nosiče pro doručení léků do specifických míst v těle. Příkladem mohou být anizotropní částice obsahující v jedné části pouze PLGA a v druhé PLGA a modifikovaný (acetalovaný) dextran s navázaným cytostatikem irinotekanem. Vlivem kyselého pH prostředí dochází k odštěpení dextranu a uvolnění léčiva48).
Příprava porézních mikročástic
Mikročástice s porézní strukturou se jeví jako slibné systémy pro dodávání léků, adsorpční materiály a senzory. Pórovité mikročástice mohou být vyráběny vytvořením pórů ze seskupení povrchově aktivní látky, emulzních kapiček, bublin a prostorů pro separaci fází v prekurzorech mikročástic. Takové šablony pórů lze jednoduše aplikovat na kapky mikrofluidní emulze za vzniku mikročástic s řízenou porézní strukturou29). Porézní částice je možné vyrobit z poly(N-isopropylakrylamid) pomocí mikrofluidní emulgace. K polymerizaci vodné fáze o/v/o umístěné v ledové vodní lázni dochází vlivem působení UV záření. Vytvoří se mikrogel poly(N-isopropylakrylamidu) s rovnoměrně rozptýlenými jemnými olejovými kapičkami, které slouží jako porogeny. Olejové kapičky jsou následně vytlačeny z mikrogelu promýváním isopropanolem a deionizovanou vodou49). Porézní struktury mohou být vytvořeny v mikročásticích pomocí kombinace generování plynových bublin s procesem ztuhnutí mikročástice. Příkladem může být včlenění H2O2 do vodných kapek obsahujících fotopolymer NOA 61 (Norland Optical Adhesive 61). Působením UV záření dochází k rozkladu peroxidu vodíku na O2 a H2O. Následným zahřátím na 60 °C dochází k úniku bublinek kyslíku a vzniku mikročástic s porézní strukturou50).
Přesné ovlivnění porézní struktury umožňuje efektivní cestu k modulaci profilu uvolňování léčiva z mikročástic.
Příprava core-shell mikročástic
Pro vytvoření částic s vnitřním jádrem poskytují dvojité emulze ideální šablonu. Vnitřní kapičky mohou sloužit jako šablony pro tvorbu jádrového prostoru a vnější kapičky pro tvorbu vnějšího pláště. Využití mikrofluidní techniky umožňuje přesné ovlivnění velikosti vnitřních a vnějších kapek pro jemné doladění velikosti jádra a pláště. Taková metoda umožňuje vytvořit komorové částice s pláštěm s různými složeními a funkcemi29). Tyto částice mohou poskytnout účinnou kontrolu kinetiky uvolňování léčiva a zabránit náhlému počátečnímu uvolnění léčiva. Léčivo je zpravidla umístěno v jádru mikročástice a plášť podporuje difuzi média směrem k jádru a tok léčiva do okolí. Plášť umožňuje omezení burst efektu51).
Khan et al. vyvinuli vícesložkové částice methylakrylátu typu jádro-plášť. V jádru se nacházelo nesteroidní antiflogistikum ketoprofen a v plášti bylo umístěno antiulcerózum ranitidin. Pro přípravu mikročástic byla využita mikrofluidní geometrie typu T. Vzniklé mikročástice byly polymerizovány UV zářením, což zajistilo integritu dvou aktivních molekul léčiva. Pro zapouzdření jádra bylo nutné zvolit vhodnou koncentraci hydrofilního monomeru a povrchově aktivní látky52). Kombinace dvou léčiv byla použita také při výrobě částic obsahujících kopolymer kyseliny mléčné a glykolové (PLGA) a polymléčnou kyselinu (PLA). V plášti byl umístěn doxorubicin a PLGA a jádro bylo tvořeno paklitaxelem a PLA53).
Závěr
Mikrofluidní techniky představují novou moderní metodu vhodnou pro přípravu mikro - a nanočástic. Jedná se o možnou inovaci již známé metody odpaření rozpouštědla pro přípravu mikročástic. Pořízení mikrofludního zařízení přitom nemusí představovat výrazné finanční náklady. Jednoduché zařízení je možné vyrobit v laboratorních podmínkách za využití běžných pomůcek, jako jsou například jehly, stříkačky a hadičky. Vzhledem k vynikající schopnosti mikrofluidní strategie přesně řídit velikost, tvar, počet a složení emulzních šablon lze flexibilně vyrábět pokročilé mikročástice s kontrolovanou strukturou a funkcemi. Další intenzivní výzkum této metody a také použitelných materiálů by mohl přispět k využití této metody v průmyslu a vést k vytvoření vysoce hodnotných částic.
Publikace vznikla v rámci projektu QK1810221, NAZV – Program aplikovaného výzkumu Ministerstva zemědělství ČR na období 2017–2025, ZEMĚ; a projektu CZ.02.1.0 1/0,0/0,0/15_003/0000495 – Operační program výzkum, vývoj, vzdělávání, Ministerstva školství, mládeže a tělovýchovy ČR.
Střet zájmů: žádný.
M. Naiserová • PharmDr. Jakub Vysloužil, Ph.D. • K. Kubová •
M. Holická • D. Vetchý
Masarykova Univerzita, Farmaceutická fakulta
Ústav farmaceutické technologie
Palackého třída 1946/1, 612 00 Brno
e-mail: vyslouzilj@pharm.muni.cz
J. Mašek • E. Mašková
Výzkumný ústav veterinárního lékařství, Brno
Oddělení farmakologie a toxikologie
Sources
1. Pihl J., Karlsson M., Chiu D. T. Microfluidic technologies in drug discovery. Drug Discov. Today 2005; 10, 1377 – 1383.
2. Seemann R., Brinkmann M., Pfohl T., Herminghaus S. Droplet based microfluidics. Rep. Prog. Phys. 2001; 75, 016601.
3. Grym J.; Foret F. Mikrofluidika: Nový způsob úpravy a vnášení vzorku pro hmotnostní spektrometrii. Chem. Listy 2005; 99, 915–921.
4. Minteer S. D. (ed.). Microfluidic techniques: reviews and protocols. Springer Science & Business Media 2006.
5. Šnejdrová E., Dittrich M. Poly (α-hydroxyacids) as Drug Carriers. Chem. Listy 2011; 105, 27–33.
6. Cai Y., Wei L., Ma L., Huang X., Tao A., Liu Z., Yuan W. Long-acting preparations of exenatide. Drug Des. Devel. Ther. 2013; 7, 963–970.
7. Mohamed F., van Der Walle C. F. Engineering biodegradable polyester particles with specific drug targeting and drug release properties. J. Pharm. Sci. 2008; 97, 71 – 87.
8. Gaumet M., Gurny R., Delie F. Localization and quantification of biodegradable particles in an intestinal cell model: the influence of particle size. Eur. J. Pharm. Sci. 2009; 36, 465–473.
9. Gasparini G., Kosvintsev S. R., Stillwell M. T. Preparation and characterization of PLGA particles for subcutaneous controlled drug release by membrane emulsification. Colloids Surf. B 2008; 61, 199–207.
10. Vasiliauskas R., Liu D., Cito S., Zhang H., Shahbazi M. A., Sikanen, T. Simple microfluidic approach to fabricate monodisperse hollow microparticles for multidrug delivery. ACS Appl. Mater. 2015; 7, 14822–14832.
11. Bajerová M., Dvořáčková K., Gajdziok J., Masteiková R., Rabišková M. Metody přípravy mikročástic ve farmaceutické technologii. Čes. slov. Farm. 2009; 58, 191–199.
12. Klusoň P., Stavárek P., Hejda S., Pěnkavová V., Bendová M., Vychodilová H. Mikroreaktory a mikrofluidní reaktory pro syntézu speciálních chemikálií. Chem. Listy 2016; 110, 892–899.
13. Teh S. Y., Lin R., Hung L. H., Lee A. P. Droplet microfluidics. Lab. Chip. 2008; 8, 198–220.
14. Fontana F., Ferreira M. P. A., Correia A., Hirvonen J., Santos H. A. Microfluidics as a cutting-edge technique for drug delivery applications. J Drug Deliv Sci Technol. 2016; 34, 76–87.
15. Xu J. H., Li S. W., Tan J., Wang Y. J., Luo G. S. Controllable preparation of monodisperse O/W and W/O emulsions in the same microfluidic device. Langmuir 2006; 22, 7943–7946.
16. Vladislavjevic G. T., Khalid N., Neves M. A., Kuroiwa T., Nakajima M., Uemura K. Industrial lab-on-a-chip: design, applications and scale-up for drug discovery and delivery. Adv. Drug Deliv. Rev. 2013; 65, 1626–1663.
17. Ward T., Faivre M., Manouk A., Stone H. A. Microfluidic flow focusing: Drop size and scaling in pressure versus flow-rate-driven pumping. Electrophoresis 2005; 26, 3716–3724.
18. Bashir S., Rees J. M., Zimmerman W. B. Simulations of microfluidic droplet formation using the two–phase level set method. Chem. Eng. Sci. 2011; 66, 4733–4741.
19. Utada A. S., Fernandez-Nieves A., Stone H. A., Weitz D. A. Dripping to jetting transitions in coflowing liquid streams. Phys. Rev. Lett. 2007; 99, 094502.
20. Zhao C. X. Multiphase flow microfluidics for the production of single or multiple emulsions for drug delivery. Adv. Drug Deliv. Rev. 2013; 65(11), 1420–1446.
21. Garstecki P., Fuersteman M. J., Stone H. A., Whitesides G. M. Formation of droplets and bubbles in a microfluidic T-junction – scaling and mechanism of break-up. Lab. Chip. 2006; 6, 437–446.
22. Zhao C. X., Middelberger A. P. J. Two-phase microfluidic flows. Chem. Eng. Sci. 2011; 66, 1394–1411.
23. Hoa P. C., Yap Y. F., Nguyen N. T., Chee-Kiong Ch. J. Thermally mediated droplet formation at a microfluidic T-junction. Micro Nanosyst. 2011; 3, 65–75.
24. Husny J., Cooper-White J. J. The effect of elasticity on drop creation in T-shaped microchannels. J. Nonnewton Fluid Mech. 2006; 137, 121–136.
25. Gu Z., Liow J. L. Microdroplet formation in a T-junction with xanthan gum solutions. Chemeca 2011: Engineering a Better World: Sydney Hilton Hotel, NSW, Australia 18–21 September 2011; 1442.
26. Weinmeister R., Freeman E., Eperon I. C., Stuart A. M., Hudson A. J. Single-Fluorophore Detection in Femtoliter Droplets Generated by Flow Focusing. ACS Nano. 2015; 9, 9718–9730.
27. Chen X., Glawdel T., Cui N., Ren C. L. Model of droplet generation in flow focusing generators operating in the squeezing regime. MICROFLUID NANOFLUID 2015; 18, 1341–1353.
28. Gañán-Calvo A. M., Montanero J. M., Martín-Banderas L., Flores-Mosquera M. Building functional ma terials for health care and pharmacy from microfluidic principles and flow focusing. Adv. Drug Deliv. Rev. 2013; 65, 1447–1469.
29. Zhang M., Wang W., Xie R., Ju X., Liu Z., Jiang L., Chu L. Controllable microfluidic strategies for fabricating microparticles using emulsions as templates. Particuology 2016; 24, 18–31.
30. Vysloužil J., Dvořáčková K., Kejdušová M., Rabišková M. Příprava léčivých mikročástic metodou odpařování rozpouštědla. Chem. Listy 2013; 107, 16–23.
31. Vysloužil J., Doležel P., Kejdušová M., Košťál V., Beneš L., Dvořáčková K. Long-term controlled release of PLGA microparticles containing antidepressant mirtazapine. Pharm. Dev. Technol. 2016; 21, 214–221.
32. Chu L. Y., Utada A. S., Shah R. K., Kim J. W., Weitz D. A. Controllable monodisperse multiple emulsions. Angewandte Chemie 2007; 119, 9128–9132.
33. Hood R. R., Wyderko T., Devoe D. L. Programmable digital droplet microfluidics using a multibarrel capillary bundle. Sens. Actuators B Chem. 2015; 220, 992–999.
34. Kim C. M., Park S. J., Kim G. M. Applications of PLGA microcarriers prepared using geometrically passive breakup on microfluidic chip. Int. J. Precis. Eng. Manuf. 2015; 16, 2545–2551.
35. Sugiura S., Nakajima M., Tong J., Nabetani H., Seki M. Preparation of monodispersed solid lipid microspheres using a microchannel emulsification technique. J. Colloid Interface Sci. 2000; 227, 95–103.
36. Shah R. K., Kim J. W., Agresti J. J., Weitz D. A., Chu L. Y. Fabrication of monodisperse thermosensitive microgels and gel capsules in microfluidic devices. Soft Matter. 2008; 4, 2303–2309.
37. Hwang M. Y., Kim S. G., Lee H. S., Muller S. J. Generation and characterization of monodisperse deformable alginate and pNIPAM microparticles with a wide range of shear moduli. Soft Matter. 2017; 13, 5785–5794.
38. Xu Q., Hashimoto M., Dang T. T., Hoare T., Kohane D. S., Whitesides G. M., Anderson D. G. Preparation of monodisperse biodegradable polymer microparticles using a microfluidic flow‐focusing device for controlled drug delivery. Small 2009; 5, 1575–1581.
39. Guo R., Sun X. T., Zhang Y., Wang D. N., Yang C. G., Xu, Z. R. Three-dimensional poly (lactic-co-glycolic acid)/ silica colloidal crystal microparticles for sustained drug release and visualized monitoring. J. Colloid Interface Sci. 2018; 530, 465–472.
40. Liu S., Deng R., Li W., Zhu J. Polymer microparticles with controllable surface textures generated through interfacial instabilities of emulsion droplets. Adv. Funct . Mater. 2012; 22, 1692–1697.
41. Dendukuri D., Doyle P. S. The synthesis and assembly of polymeric microparticles using microfluidics. Adv. Mater. 2009; 21, 4071–4086.
42. Dendukuri D., Tsoi K., Hatton T. A., Doyle P. S. Controlled synthesis of nonspherical microparticles using microfluidics. Langmuir 2005; 21, 2113–2116.
43. Xu S., Nie Z., Seo M., Lewis P., Kumacheva E., Stone H. A., Whitesides G. M. Generation of monodisperse particles by using microfluidics: control over size, shape, and composition. Angewandte Chemie 2005; 117, 734–738.
44. Nisisako T., Torii T. Formation of Biphasic Janus Droplets in a Microfabricated Channel for the Synthesis of Shape ‐ Controlled Polymer Microparticles. Advanced materials 2007; 19, 1489–1493.
45. Wang W., Zhang M. J., Xie R., Ju X. J., Yang C., Mou C. L., Chu L. Y. Hole-shell microparticles from controllably evolved double emulsions. Angew. Chem. Int. Ed. 2013; 52, 8084–8087.
46. Yánez-Sedeño P., Campuzano S., Pingarrón J. M. Janus particles for (bio) sensing. Appl. Mater. Today 2017; 9, 276–288.
47. Nie Z., Li W., Seo M., Xu S., Kumacheva E. Janus and ternary particles generated by microfluidic synthesis: design, synthesis, and self-assembly. J. Am. Chem. Soc. 2006; 128, 9408–9412.
48. Rahmani S., Park T. H., Dishman A. F., Lahann J. Multimodal delivery of irinotecan from microparticles with two distinct compartments. J. Control. Rel. 2013; 172, 239–245.
49. Mou C. L., Ju X. J., Zhang L., Xie R., Wang W., Deng N. N., Chu L. Y. Monodisperse and fast-responsive poly (N-isopropyl acrylamide) microgels with opencelled porous structure. Langmuir 2014; 30, 1455 – 1464.
50. Gong X., Wen W., Sheng P. Microfluidic fabrication of porous polymer microspheres: dual reactions in single droplets. Langmuir 2009; 25, 7072–7077.
51. Misra A. C., Lahann J. Progress of Multicompartmental Particles for Medical Applications. Adv. Healthc. Mater. 2018; 7, 1701319.
52. Khan I. U., Stolch L., Serra C. A., Anton N., Akasov R., Vandamme T. F. Microfluidic conceived pH sensitive core–shell particles for dual drug delivery. Int. J. Pharm. 2015; 478, 78–87.
53. Lee W. L., Guo W. M., Ho V. H., Saha A., Chong H. C., Tan N. S., Loo S. C. J. Delivery of doxorubicin and paclitaxel from double-layered microparticles: The effects of layer thickness and dual-drug vs. Single-drug loading. Acta Biomater. 2015; 27, 53–65.
Labels
Pharmacy Clinical pharmacology
Article was published inCzech and Slovak Pharmacy

2021 Issue 5-
All articles in this issue
- Laudatio RNDr. Roman Smieško – 70 rokov
- Využití droplet-based mikrofluidních technik při přípravě mikročástic
- Telacebek (Q203): Vynára sa na obzore nové efektívne a bezpečné antituberkulotikum?
- Antiadhezívna, antibiofilmová a disperzná aktivita biosurfaktantov izolovaných z Bacillus amyloliquefaciens 3/22
- Vliv meloxikamu a extraktu z kryokonzervované placenty na počáteční zánětlivou reakci – experimentální studie
- Filmy z kyseliny poly-γ-glutamové a poly-ε-lysinu jako potenciální prostředek pro terapii ran – formulace, příprava a hodnocení
- Czech and Slovak Pharmacy
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Využití droplet-based mikrofluidních technik při přípravě mikročástic
- Telacebek (Q203): Vynára sa na obzore nové efektívne a bezpečné antituberkulotikum?
- Antiadhezívna, antibiofilmová a disperzná aktivita biosurfaktantov izolovaných z Bacillus amyloliquefaciens 3/22
- Vliv meloxikamu a extraktu z kryokonzervované placenty na počáteční zánětlivou reakci – experimentální studie
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

