Štúdium lokálnych anestetík – časť 200*
Výber optimálneho typu chitosanu pre formuláciu lokálnych anestetík karbamátového typu do hydrogélov
Authors:
Jozef Čižmárik 1; Zuzana Vitková 2; Petra Herdová 2
Authors‘ workplace:
Katedra farmaceutickej chémie, Farmaceutická fakulta, Univerzita Komenského, Bratislava
1; Katedra galenickej farmácie, Farmaceutická fakulta UK, Bratislava
2
Published in:
Čes. slov. Farm., 2012; 61, 285-287
Category:
Short News
*Venované 60. výročiu založenia Farmaceutickej fakulty Univerzity Komenského v Bratislave.
Overview
Cieľom tohto výskumu bolo štúdium hydrogélov na báze rôznych typov prírodného polyméru chitosanu s obsahom lokálnych anestetík karbamátového typu. Koncentrácia gélotvornej látky v hydrogéloch bola 2,5 %. Študovanými liečivami bol heptakaíniumchlorid (HEP), pentakaíniumchlorid (PEN) a karbizokaíniumchlorid (KAR). Hodnotili sa tokové vlastnosti pripravených gélov a liberácia liečiv z nich. Na základe dosiahnutých výsledkov sa stanovil optimálny typ biopolyméru pre PEN – CHIT B a KAR – CHIT C, v prípade HEP sa zistilo, že chitosan nie je vhodný ako gélotvorný základ.
Kľúčové slová:
heptakaín • pentakaín • karbizokaín • biopolymér • liberácia
Úvod
Vstrebávanie liečiv z hydrogélov ovplyvňuje okrem teploty, pH, koncentrácie liečiva aj typ použitého polyméru. Prostredníctvom použitej gélotvornej látky možno ovplyvňovať rýchlosť a rozsah absorpcie liečiva. Optimálny gélotvorný základ by mal byť fyzikálne, chemicky a mikrobiologicky stabilný, biokompatibilný a schopný rýchlo uvoľniť liečivo do stratum corneum.
Väčšina súčasne používaných polymérov je syntetického pôvodu, ich biokompatibilita a biologická odbúrateľnosť je oveľa obmedzenejšia ako u prírodných polymérov, ku ktorým patrí aj chitín, chitosan a ich deriváty. Vo farmácii majú preto v posledných rokoch významné postavenie biodegradovateľné polyméry vďaka ich biokompatibilite, biodegradabilite, adsobčnej schopnosti a netoxickým vlastnostiam1).
Jeden z týchto biodegradovateľných polymérov je aj predmetom formulácie lokálnych anestetík do hodnotených hydrogélov. Jedná sa o chitosan, ktorý sa získava z chitínu kôrovcov. Patrí medzi perspektívne polysacharidy so širokou škálou využitia v rôznych aplikáciách. Uplatňuje sa ako základ pri príprave hydrogélov. Náplasti a gély s obsahom chitosanu udržujú vlhkosť a súčasne z rany absorbujú nadbytočnú vlhkosť. Pôsobia chladivo a majú upokojujúci efekt. Používa sa v terapii dekubitov a popálenín, znižuje tvorbu jaziev, podporuje hojenie rán, má antimikrobiálny efekt a patrí medzi liečivá podporujúce granuláciu. Chitosan disponuje tiež výbornými biodegradačnými, biokompatibilnými, bioadhezívnými a antioxidačnými vlastnosťami. Pri nanesení na ranu má dezinfekčný, hemostatický a analgetický účinok2), čo vytvára predpoklad jeho možného uplatnenia pri formulácii lokálnych anestetík. Používa sa v oftalmológii – disponuje výhodnými vlastnosťami (optická jasnosť, imunologická kompatibilita, mechanická stabilita, dostatočné optické korekcie, priepustnosť plynov, zmáčanlivosť), čo sa uplatňuje pri výrobe kontaktných šošoviek. Chitosan má antacídne a antiulcerózne vlastnosti, používa sa vo funkcii nosiča rôznych liečiv s riadeným uvoľňovaním. Uplatňuje sa pri transdermálnej absobcii, pri nosovej a orálnej aplikácii a pri formulácii vakcín1).
Chitosan sa ľahko rozpúšťa v kyslom prostredí, kedy dochádza k protonizácii aminoskupiny, vlákna polyméru získavajú súhlasný kladný náboj a odpudzujú sa, v dôsledku čoho polymér napučiava. Zmenou jeho fyzikálno-chemických vlastností sa zabezpečí uvoľňovanie liečiva. Na základe molekulovej hmotnosti chitosanu možno ovplyvniť jeho biologickú aktivitu. Stúpajúcou molekulovou hmotnosťou sa spomaľuje liberácia liečiva z hydrogélu3).
Vzhľadom na to, že v terapeutickej praxi používané lokálne anestetiká sa vyrábajú vo forme gélov hlavne na báze derivátov celulóz, cieľom tejto štúdie bola formulácia vybraných lokálnych anestetík do hydrogélov na báze chitosanu. V štúdii sa sledoval vplyv rôznych typov chitosanu na tokové vlastnosti a liberáciu vybraných lokálnych anestetík z hydrogélov.
Pokusná časť
Použité chemikálie
Heptakaíniumchlorid (HEP) – heptacaine-N-[(2-heptyloxyfenylkarbamoyloxy)-ethyl]-piperidíniumchlorid; Karbizokaíniumchlorid (KAR) – 1-[2-(2-heptyloxyfenylkarbamoyloxy)- 2-metyletyl]-dietylamóniumchlorid; Pentakaíniumchlorid (PEN) – (+/-)-trans-[(3-pentyloxyfenylkarbamoyloxy)-2-cyklohexyl]-pyrolidíniumchlorid – pripravila Katedra farmaceutickej chémie, Farmaceutická fakulta, UK, Bratislava; chitosan – 3 typy: A – chitosan získaný z kreviet – molekulová hmotnosť 190 000 až 375 000 – (Sigma – Aldrich, USA); B – chitosan – molekulová hmotnosť 190 000–310 000 – (Sigma – Aldrich, USA); C – chitosan sukcinát získaný z kôrovcov – Liposan UltraTM (Vanson Europe LTD, Cheshire, England); kyselina mliečna (Interpharm, SR); chlorid sodný (Natrii chloridum SL1) Spolchim spol. s.r.o., Bratislava, SR) na prípravu izotonického roztoku.
Použité prístroje a materiál
Permeačná aparatúra vyrobená na KGF, FaF, UK, Bratislava, SR; Permeačná membrána (celofán) – EKOZ s. r. o, SR; Spektrofotometer – Philips Pyll Unicam 8625 Ltd., Cambridge, GB; Termostat U 10-Prüfgeräte – Werk Medingen, D; Viskotester VT 500 Haake Mess-Technik GmbH, Karlsruhe, D.
Zloženie a príprava hydrogélov:
Navážené množstvo liečiva sa rozpustilo v 1% roztoku kyseliny mliečnej, potom sa dispergoval chitosan a dovážil sa roztok kyseliny mliečnej do predpísanej hmotnosti hydrogélu. Liečivá (HEP, KAR, PEN) boli použité v 0,1% (m/m) koncentrácii. Vo funkcii gélotvornej látky sa použili 3 typy chitosanu (CHIT A, CHIT B, CHIT C). Pre porovnanie výsledkov tokových vlastností hydrogélov boli pripravené gély bez a s obsahom liečiv.
Stanovenie reologických parametrov
Reologické vlastnosti hydrogélov sa hodnotili 48 h po príprave hydrogélov pomocou rotačného viskozimetra VISCOTESTER VT 500 pri teplote 20° C ± 0,2° C.
Liberácia liečiv z hydrogélov a stanovenie obsahu liečiv
Liberácia liečiv sa sledovala použitím permeačnej aparatúry v 6 komôrkach, kde do donorovej časti sa dali 3 g gélu a do akceptorovej časti 20 ml fyziologického roztoku (0,9% NaCl). Aparatúra sa temperovala na 37 °C ± 0,2 °C. Odbery sa robili v časovom rozsahu 3 hodín, t.j. po 15., 30., 45., 60., 90., 120. a 180. minúte. Ako semipermeabilná membrána bol použitý celofán. Vykonalo sa 6 paralelných stanovení. Uvoľnené množstvo liečiv sa stanovilo spektrofotometricky pri príslušnej vlnovej dĺžke: λPEN = 238 nm, λKAR = 279 nm, λHEP = 233 nm.
Výsledky
V prvej časti štúdie sa hodnotila liberácia liečiva HEP z chitosanových hydrogélov. Zistilo sa, že liečivo sa veľmi pomaly uvoľňovalo, z pomedzi použitých CHIT A, B a C sa najviac liečiva uvoľnilo z CHIT B (0,055 mg/20 ml) (graf 1), potom z CHIT C (0,033 mg/20 ml) a najmenej z CHIT A (0,031 mg/20 ml). Tieto rozdiely neboli štatisticky významné. Rýchlostná konštanta uvoľňovania HEP bola najvyššia v prípade CHIT B v 180. min (k180 = 0,006 h-1).

PEN sa najpomalšie uvoľňoval z gélu CHIT A (graf 1) – uvoľnené množstvo po 180. min tvorilo 1,091 mg/20 ml (štatistický významný rozdiel (P < 0,05) oproti CHIT B a CHIT C). Z ostatných dvoch typov chitosanových gélov bolo uvoľňovanie rýchlejšie, avšak vzájomne veľmi podobné (rozdiel nebol štatisticky významný). Po 180. min sa uvoľnilo z hydrogélu na báze CHIT C 1,620 mg/20 ml, takmer rovnaké ako z hydrogélu na báze CHIT B 1,580 mg/20 ml. Vzhľadom na priebeh liberácie liečiva v jednotlivých časových intervaloch bol vyhodnotený ako optimálny gélotvorný základ CHIT B. Pri tomto type bola vypočítaná tiež najvyššia hodnota rýchlostnej konštanty uvoľňovania (k180 = 0,250 h-1).
V prípade lokálneho anestetika KAR sa v priebehu celej liberácie najlepšie uvoľňovalo liečivo z hydrogélu na báze CHIT C (graf 1) – rozdiel oproti ostatným typom bol štatisticky významný. Po 180. min sa najvyššie uvoľnené množstvo liečiva dosiahlo 1,365 mg/20 ml s najvyššou hodnotou rýchlostnej konštanty (k180 = 0,202 h-1). Pri ostatných dvoch typov základov to bolo: (CHIT A) 1,0203 mg/20 ml a (CHIT B) 0,9504 mg/20 ml.
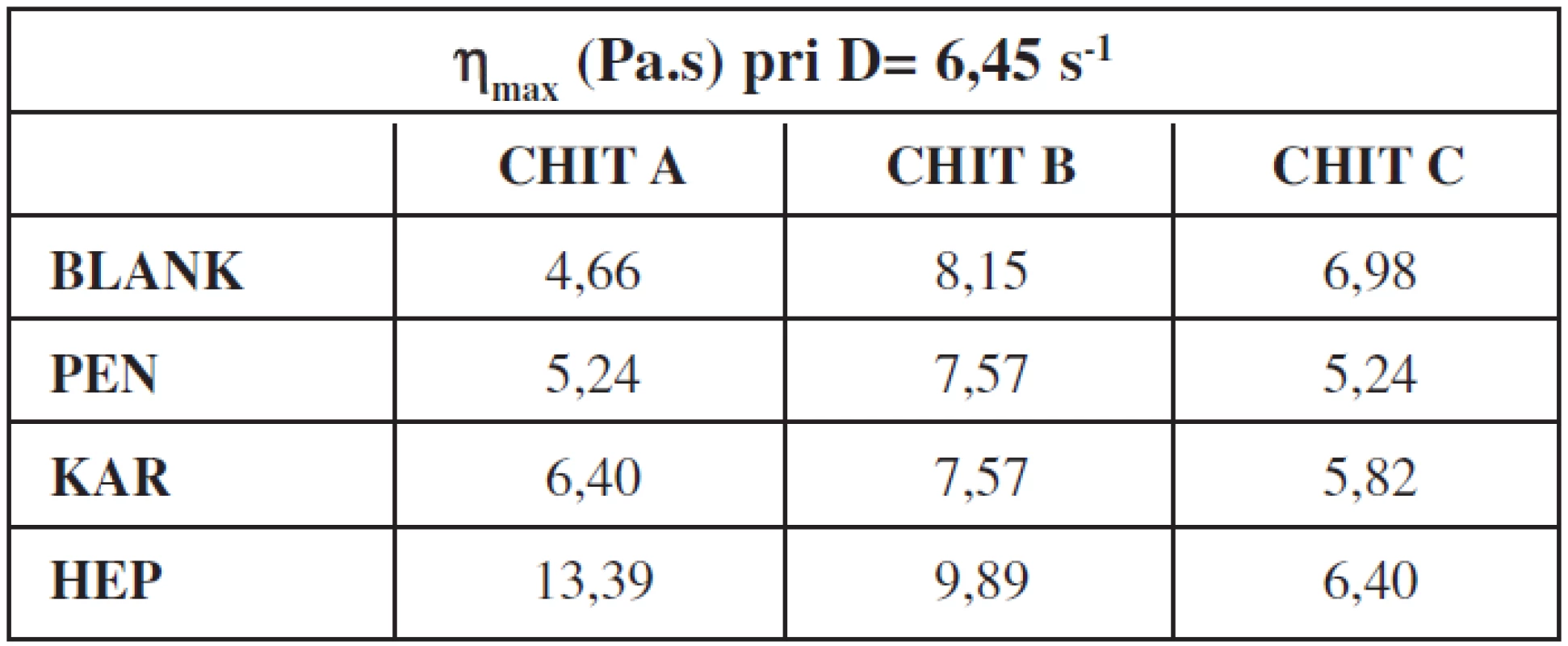
Na základe reologického merania sa vypočítali maximálne hodnoty štruktúrnej viskozity gélov (tab. 1) s liečivom a bez liečiva. V prípade gélov bez liečiv najvyššiu hodnotu štruktúrnej viskozity mal gél na báze CHIT typ B. Na pridanie liečiva reagovali hydrogély rôznym spôsobom. V prípade CHIT A nastalo pomerne výrazné zvýšeniu štruktúrnej viskozity pri všetkých liečivách, pričom pri CHIT C tieto hodnoty poklesli. V prípade CHIT B liečivá PEN a KAR hodnoty štruktúrnej viskozity znížili a HEP zvýšilo.
Z výsledkov reologického merania sa zostrojili tokové krivky hydrogélov na báze optimálnych gélotvorných základov. Z grafu 2 je vidieť, že gély mali nenewtonovské, časovo nezávislé plastické vlastnosti.

Na základe vyhodnotenia všetkých dosiahnutých výsledkov sa stanovil optimálny typ chitosanu k príprave gélotvorných základov pre študované lokálne anestetiká. V prípade liečiva PEN – CHIT B; pre liečivo KAR – CHIT C. V prípade liečiva HEP sa zistilo, že chitosan nie je vhodný ako gélotvorný základ pre formuláciu tohto lokálneho anestetika, nakoľko liečivo sa z neho uvoľňuje len v malom množstve.
Stret záujmov: žiadny.
Došlo 18. októbra 2012 / Přijato 26. novembra 2012
Jozef Čižmárik1, Zuzana Vitková2, Petra Herdová2
1Katedra farmaceutickej chémie, Farmaceutická fakulta, Univerzita Komenského, Bratislava
Adresa pro korespondenci:
Zuzana Vitková
PharmDr. Petra Herdová, PhD.
2Katedra galenickej farmácie, Farmaceutická fakulta UK
Odbojárov 10, 832 32 Bratislava, Slovenská republika
e-mail: herdova@fpharm.uniba.sk
Sources
1. Majeti N.V., Kumar R. A review of chitin and chitosan applications. React. Polym. 2000; 46, 1–27.
2. Dasha M., Chiellini F., Ottenbriteb R. M., Chiellini E. Chitosan – a versatile semi-synthetic polymer in biomedical applications. Prog. Polym. Sci. 2011; 36, 981–1014.
3. Rinaudo M. Chitin and chitosan: Properties and applications. Prog. Polym. Sci., 2006; 31, 603–632.
Labels
Pharmacy Clinical pharmacologyArticle was published in
Czech and Slovak Pharmacy

2012 Issue 6
Most read in this issue
- Hodnocení obsahové stejnoměrnosti tablet s nízkým obsahem léčivé látky s úzkým terapeutickým indexem
- Analýza farmaceutické péče při dispenzaci léčiva orlistat v režimu OTC
- POKYNY PRO AUTORY ČASOPISU ČESKÁ A SLOVENSKÁ FARMACIE
- Halloysit – zajímavý nanotubulární nosič pro léčiva
