-
Medical journals
- Career
Laboratorní ukazatele neurodegenerace v likvoru a míra motorického postižení u Parkinsonovy nemoci: korelační studie
Authors: H. Vranová 1; P. Kaňovský 1; J. Mareš 1; M. Nevrlý 1; D. Stejskal 2,3; I. Nestrašil 1; J. Zapletalová 4
Authors‘ workplace: Neurologická klinika LF UP a FN Olomouc 1; Oddělení laboratorní medicíny, Nemocnice Šternberk o. z., Středomoravská nemocniční a. s. 2; Ústav lékařské chemie a biochemie LF UP Olomouc 3; Ústav lékařské biofyziky LF UP Olomouc 4
Published in: Cesk Slov Neurol N 2008; 71/104(3): 324-328
Category: Short Communication
Overview
Parkinsonova nemoc (PN) je chronické progredientní neurodegenerativní onemocnění. U pacientů s tímto onemocněním dochází procesem neurodegenerace k morfologickým a neurochemickým změnám centrálního nervového systému, které jsou vyjádřeny postupnou progresí nemoci. Tzv. Braakův koncept dělí toto postižení do 6 stupňů a ty uvádí do korelace s klinickým stavem, hodnoceným pomocí Hoehnovy-Yahrovy stupnice. Zároveň je známo, že neurodegenerativním procesem dochází k elevaci určitých laboratorních ukazatelů v likvoru. Cílem předkládané studie bylo stanovení koncentrací neurodegenerativních ukazatelů v likvoru u pacientů s PN a u kontrolní skupiny jedinců, a dále zjistit, zda v podskupině pacientů s PN existují korelace mezi těmito hladinami a délkou trvání onemocnění či mírou motorického postižení vyjádřeného Hoehnovou-Yahrovou stupnicí. Do studie bylo zařazeno 32 pacientů s PN a 20 jedinců bez příznaků neurodegenerativního onemocnění jako kontrolní skupina. U všech jedinců byly stanoveny hladiny tau-proteinu, beta-amyloidu(1-42) a cystatinu C v likvoru a dále vypočítán index tau-protein/beta-amyloid(1-42). U pacientů s PN byly zjištěny signifikantně vyšší hladiny tau-proteinu v likvoru oproti kontrolní skupině (p = 0,05). Dále byly u pacientů s PN do 2 let trvání nemoci zjištěny signifikantně vyšší hladiny tau-proteinu v likvoru (p = 0,03) a vyšší hodnoty indexu tauproteinbeta-amyloid(1-42) (p = 0,01) oproti pacientům s délkou trvání nemoci nad 2 roky. Nebyla prokázána korelace hladin tau-proteinu v likvoru s tíží motorického postižení vyjádřeného Hoehnovou-Yahrovou stupnicí. Ostatní sledované hodnoty nevykázaly žádnou korelaci s diagnózou, délkou trvání onemocnění či tíží motorického postižení. Výsledky provedené studie svědčí o přínosné roli stanovení tau-proteinu v likvoru jako laboratorního ukazatele přítomnosti neurodegenerace u pacientů s PN, a to zvlástě u pacientů s délkou trvání onemocnění do 2 let od prvního prvního projevu klinickýh příznaků.
Klíčová slova:
Parkinsonova nemoc – tau-protein – beta-amyloid – cystatin C – likvorÚvod
Parkinsonova nemoc (PN) je chronické neurodegenerativní onemocnění, u kterého je hlavní poruchoue deficit dopaminu v oblasti bazálních ganglií. Deficit je způsoben sníženým transportem dopaminu do oblasti striata cestou nigrostriatálních projekcí a jeho prvotní příčinou je apoptotický zánik melaninových buněk v oblasti substantia nigra v mezencefalu [1].
Podstatou patofyziologie PN je funkční defekt bílkoviny zvané alfa-synuklein, čímž se PN řadí mezi synukleinopatie. V postižených neuronech u PN nacházíme Lewyho tělíska, což jsou intraneuronální inkluze v cytoplazmě blízko jádra. Lewyho tělíska jsou složena z různých poteinů, pro diagnostiku je nejdůležitější přítomnost ubikvitinu, proteinu p62 a alfa-synukleinu. Výsledky nedávno zveřejněných studií svědčí o tom, že součástí Lewyho tělísek je i degenerovaný tau-protein, který navíc potencuje degeneraci alfa-synukleinu a tímto se podílí na patogenezi PN [2–5].
Kromě výše popsané poruchy jsou ale u PN popisovány další morfologické a neurochemické změny, které jsou spojeny s postupnou progresí nemoci. Nedávno publikovaný tzv. Braakův koncept [6,7] uvádí 6 stupňů prokázaného morfologického postižení centrální nervové soustavy v průběhu progrese PN, přičemž těchto 6 stupňů koreluje s klinickým stavem, který je možno vyjádřit hodnotami Hoehnovy-Yahrovy stupnice. Podle této koncepce jsou v průběhu PN postihovány v podstatě všechny struktury centrální nervové soustavy (CNS).
Morfologické změny tkání CNS podle Braakova konceptu jsou působeny relativně pomalu progredujícím neurodegenerativním procesem. Zároveň tento koncept počítá s tím, že míra neurodegenerativního procesu koreluje s tíží motorického postižení [8].
Je známo, že neurodegenerace souvisí s přítomností určitých laboratorních ukazatelů v likvoru. Lze předpokládat, že míra motorického postižení u PN hodnocená pomocí Hoehnovy-Yahrovy stupnice, by mohla souviset s určitou koncentrací neurodegenerativních ukazatelů (tau-protein, beta-amyloid(1-42), cystatin C) v likvoru.
Cílem předkládané studie bylo stanovení koncentrací neurodegenerativních ukazatelů v likvoru u pacientů s PN a u kontrolní skupiny jedinců a dále zjistit, zda v podskupině pacientů s PN existují korelace mezi těmito hladinami a délkou trvání onemocnění či mírou motorického postižení vyjádřeného Hoehnovou-Yahrovou stupnicí.
Tau-protein
Tau-protein se za normálních podmínek podílí na integritě buněčného cytoskeletu. Pokud dojde k jeho nadměrné fosforylaci, jak k tomu dochází u řady neurodegenerativních onemocnění včetně PN, pak dochází k poruše integrity buňky, ztrátě její fyziologické funkce, až k buněčné smrti. Očekávané hodnoty tau-proteinu v likvoru u zdravých jedinců jsou kolem 160 ng/l (ng/l = nanogram/litr).
Beta-amyloid
Beta-amyloid je tvořen z amyloidového prekurzorového proteinu (APP). APP je štěpen buď alfa-sekretázou a produktem je sAPPa, u něhož se předpokládá, že má neuroprotektivní význam, a nebo beta-amyloid štěpícím enzymem (BACE), čili beta-sekretázou a v následném kroku chí-sekretázou a produktem štěpení je beta-amyloid40 a beta-amyloid42. Ty tvoří po agregaci jádro neuritických plak. Následuje kaskáda dalších procesů, např. oxidativní stres, cytotoxické jevy a zánětlivá odpověď a výsledkem je zánik neuronu a rozvoj demence. Snížená hladina beta-amyloidu v likvoru je nalézána u pacientů s Alzheimerovou demencí [9,10] či u pacientů s PN s demencí [9]. Očekávané hodnoty beta-amyloidu v likvoru u zdravých jedinců jsou kolem 850 pg/ml a pro hodnocení degenerace se využívá spíše než prosté stanovení s výhodnou index tau-protein/beta-amyloid [11].
Cystatin C
Cystatin C je inhibitor cysteinových proteáz, které hrají důležitou roli např. v procesu trávení potravy, aktivaci komplementu či krevní koagulaci. Cystatin C se účastní procesu neuronální degenerace a reparace centrálního nervového systému tak, že v mozku pravděpodobně inhibuje aktivitu katepsinu L v astrocytech, který spolu s katepsinem S patří ke klíčovým komponentám regulace imunitního potenciálu astrocytů a mikroglie. Dále je cystatin C podle současných znalostí považován za amyloidogenní protein, který se vyskytuje společně s beta-amyloidem ve stěnách arteriol u pacientů s Alzheimerovou demencí. Díky zvýšení koncentrace cystatinu C v určitých tkáních či systémovém oběhu dochází např. k precipitaci amyloidu v cerebrálních cévách, cerebrálním hemoragiím a akcelerované ateroskleróze [12,13].
Pacienti a metodika
Skupina vyšetřovaných
Studie byla schválena ústavní etickou komisí a všichni pacienti podepsali informovaný souhlas.
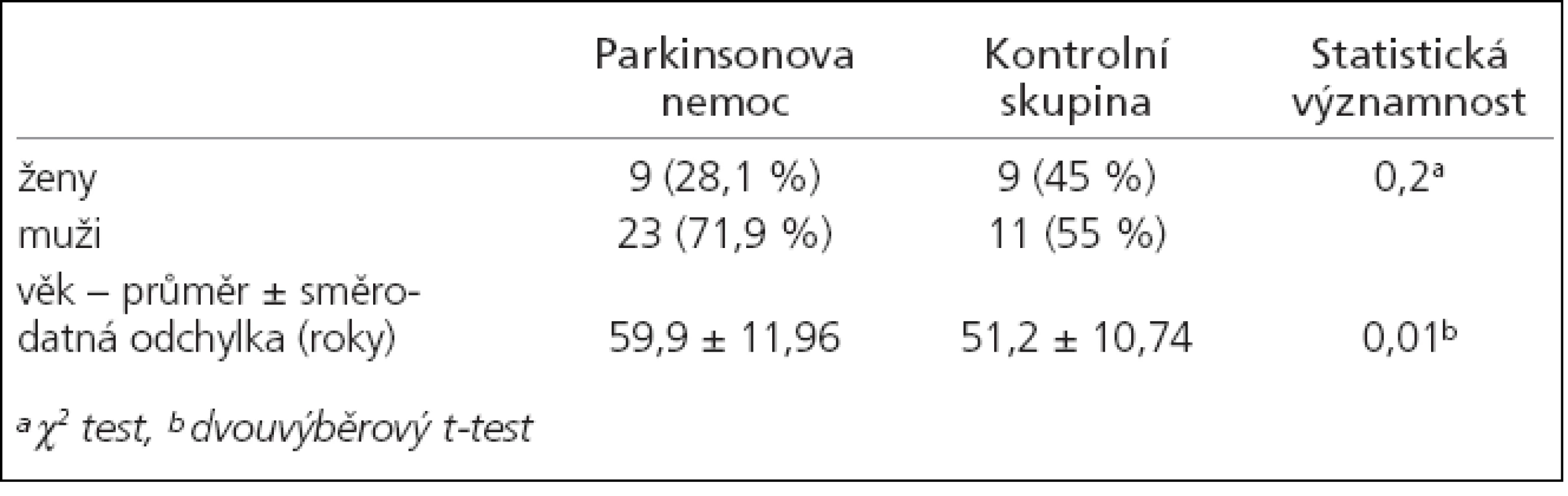
V rámci studie bylo vyšetřeno 32 pacientů trpících PN bez příznaků demence, 9 žen, 23 mužů, ve věku 29–77 let, průměrný věk 59,9 ± 11,96 let, průměrný věk na začátku onemocnění byl 55,2 ± 12,77 let, průměrná doba trvání nemoci 4,4 ± 3,6 let. 12 pacientů bylo léčeno L-dopou, průměrná dávka byla 492,3 ± 137,2 mg denně, průměrná doba trvání terapie L-dopou byla 3,92 ± 3,4 let.
Jako kontrolní skupina bylo vyšetřeno 20 pacientů, 9 žen, 11 mužů, ve věku 32–73 let, průměrný věk 51,2 ± 10,74 let. Kontrolní skupinu tvořilo 6 pacientů s vertebrogenním onemocněním, 6 pacientů s psychogenními poruchami, 3 pacienti po cévní mozkové příhodě, 2 pacienti s tenzní cefaleou, 2 pacienti s diabetickou neuropatií a 1 pacient po boreliové infekci. Diagnóza PN byla stanovena podle kritérií United Kingdom Parkinson’s Disease Society Brain Bank [14]. Kognitivní deficit byl vyloučen psychologickým vyšetřením, jehož součástí byl Minimental Status Examination (MMSE). U všech pacientů byly vyšetřeny hladiny tau-proteinu, beta-amyloidu(1-42) a cystatinu C v likvoru.
Laboratorní vyšetření a technika náběru krve
Likvor byl získáván cestou lumbální punkce, která byla prováděna za obvyklých sterilních kautel při poloze vyšetřovaného vsedě, vpich byl směřován do meziobratlového prostoru L4/5. Při punkci bylo odebíráno celkem 10 ml likvoru do sterilní zkumavky. Po odběru byl likvor vyšetřen morfologicky a centrifugován (10 min při 1 100 g při 4° C). Z části vzorku byly stanoveny hladiny cystatin C, druhá část byla zamražena při -80° C a do 10 týdnů od zamražení byla v sérii u všech osob změřena koncentrace celkového tau-proteinu (ELISA, Biosource, Velká Británie), beta-amyloidu(1-42) (ELISA, Innogenetics, Belgie) a cystatinu C (ELISA, Biovendor, Česká republika). Analytické charakteristiky všech ELISA metod při verifikaci údajů výrobce byly uspokojivé (opakovatelnost i reprodukovatelnost < 9 %). Současně byl u všech pacientů proveden výpočet indexu tauprotein/beta-amyloid(1-42) v likvoru [11].
Rozdělení souboru na podskupiny
Pro hodnocení sledovaných parametrů byly výsledky porovnány mezi skupinou pacientů s PN a kontrolní skupinou. V podskupině pacientů s PN byly dále výsledky sledovaných ukazatelů porovnávány s mírou motorického postižení, vyjádřeného hodnotami Hoehnovy-Yahrovy stupnice. Ke zjištění korelace sledovaných ukazatelů s délkou trvání onemocnění byla podskupina pacientů s PN rozdělena na pacienty s délkou trvání nemoci do 2 let (včetně) a nad 2 roky, hodnoty pak byly porovnány mezi oběma skupinami.
Statistické zpracování dat
Data byla zpracována pomocí software Medcalc (Belgie). Ke zjištění rozdílů mezi skupinou pacientů s PN a kontrolní skupinou a dále v podskupinách pacientů s PN byly použity pro kategoriální znaky χ2 test, pro metrické parametry Studentův t-test, resp. Mannův-Whitneyův test. K posouzení závislosti hodnot měrných parametrů a Hoehnovy-Yahrovy stupnice byla použita neparametrická Spearmanova korelační analýza. Hodnota p < 0,05 byla považována za statisticky signifikantní. Neparametrické testy pro analýzu dat byly použity z důvodu nenormální distribuce parametrů (pro testy normality byl použit test Shapiro-Wilk), resp. z důvodů přítomnosti extrémních hodnot v datech.
Výsledky
Při porovnání demografických dat obou skupin bylo zjištěno, že skupiny mají stejné zastoupení obou pohlaví, avšak skupina jedinců s PN je oproti kontrolní skupině signifikantně starší (p = 0,01) (tab. 1).
Bylo zjištěno, že jedinci s PN měli významně vyšší koncentrace tau-proteinu v likvoru oproti kontrolní skupině (mediány 225 vs 197 ng/l; p = 0,05). Ostatní sledované hodnoty se v obou skupinách významně nelišily (tab. 2, graf 1).
Table 2. Porovnání sledovaných hodnot u pacientů s Parkinsonovou nemocí vs kontrolní skupina pomocí neparametrického Mannn-Whitney testu. 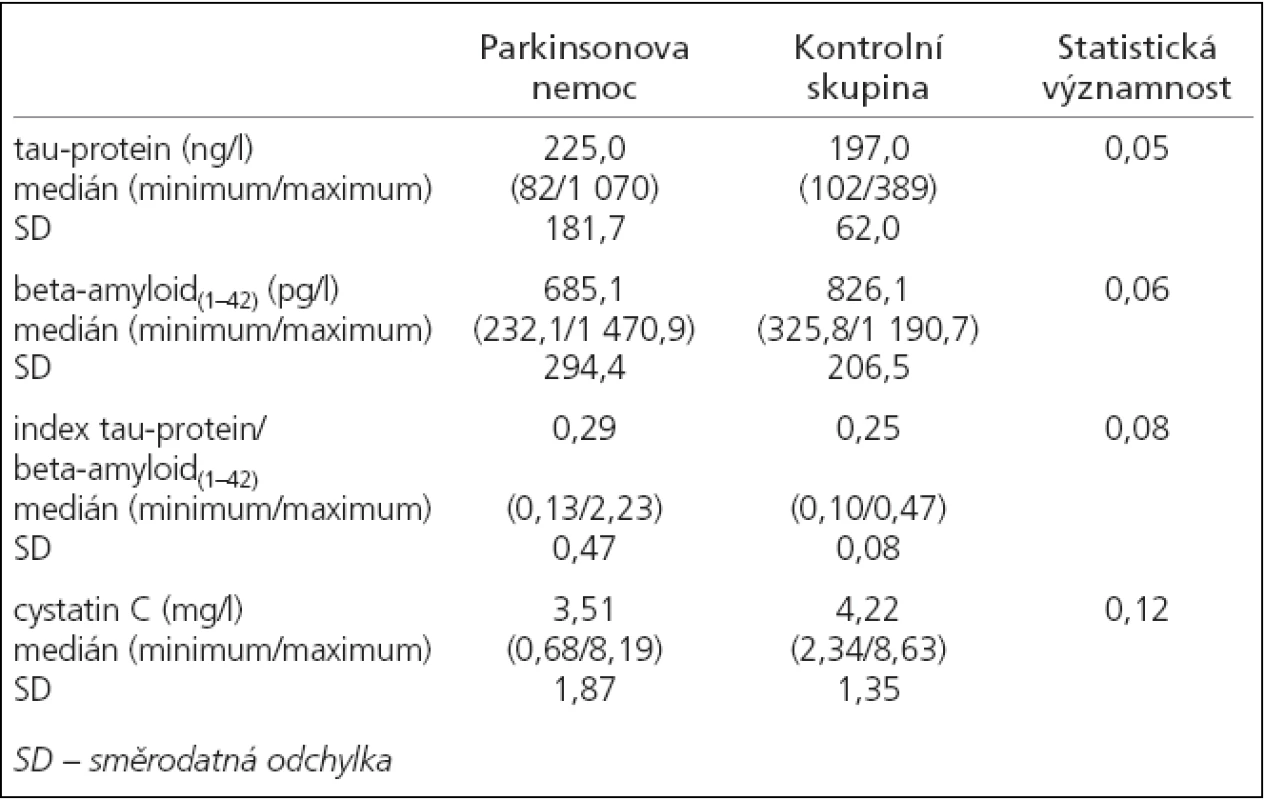
Graph 1. Porovnání hladin tau-proteinu v likvoru u pacientů s PN vs kontrolní skupina. 
U jedinců s PN s délkou trvání nemoci do 2 let byly nalezeny významně vyšší koncentrace tau-proteinu v likvoru (mediány 263 vs 202 ng/l; p = 0,03) a vyšší hodnota indexu tau-protein/beta-amyloid(1-42) (mediány 0,44 vs 0,23; p = 0,04) oproti pacientům s délkou trvání nemoci nad 2 roky (tab. 3, graf 2). Ostatní sledované hodnoty se podle doby trvání nemoci významně nelišily.
Table 3. Porovnání sledovaných hodnot u pacientů s PN nemocí do 2 let trvání nemoci (PN 1) vs trvání nemoci nad 2 roky (PN 2) pomocí neparametrického Mannova-Whitneyova testu. 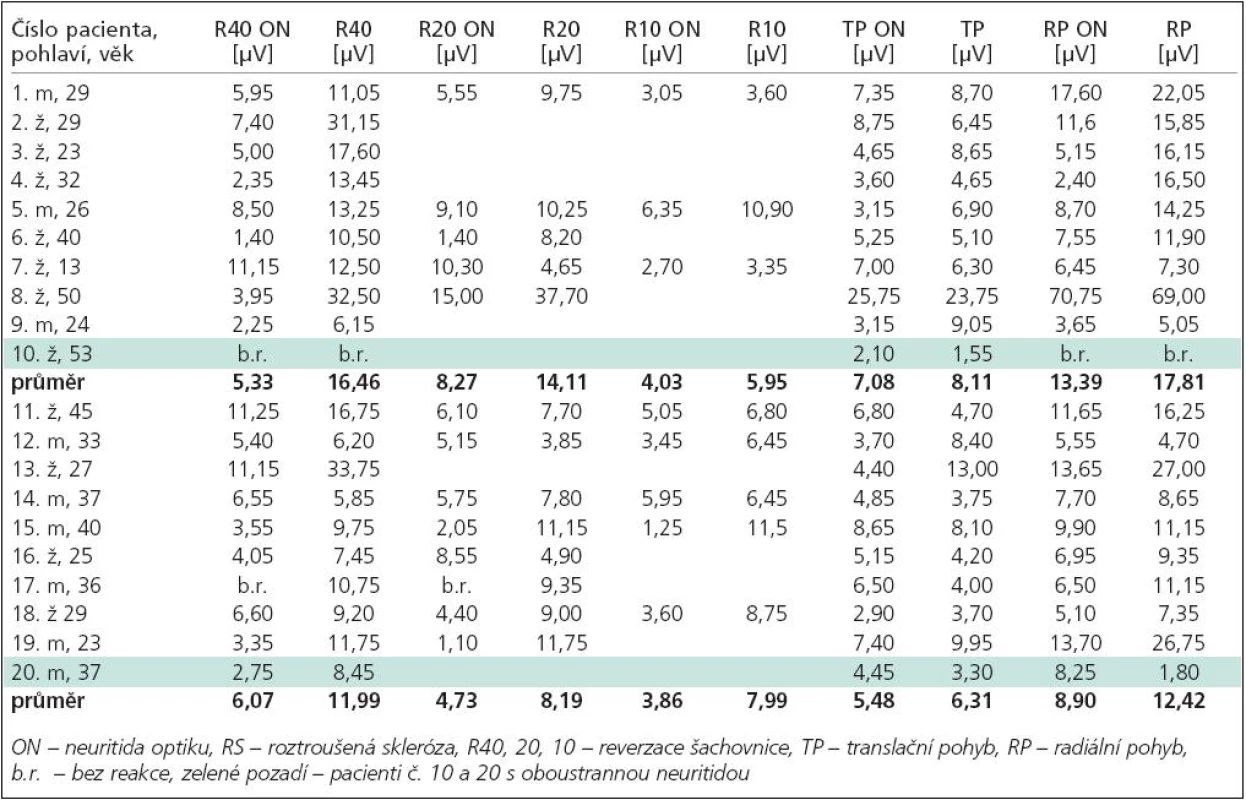
Graph 2. Porovnání hladin tau-proteinu v likvoru u pacientů s PN do 2 let trvání nemoci vs s délkou trvání nemoci nad 2 roky. 
U hladin tau-proteinu byla zjištěna korelace s tíží motorického postižení vyjádřeného Hoehnovou-Yahrovou stupnicí, tato korelace však nedosahovala hladiny statistické významnosti (p = 0,07). U ostatních sledovaných parametrů nebyla zjištěna souvislost s tíží motorického postižení vyjádřeného Hoehnovou-Yahrovou škálou (tab. 4).
Table 4. Vyjádření vztahu závažnosti motorického postižení u pacientů s PN hodnocené pomocí Hoehnovy-Yahrovy škály (H–Y) se sledovanými hladinami uvedených parametrů v likvoru (hodnoceno pomocní Spermannova korelačního koeficientu). 
Diskuse
V rámci předkládané práce jsme prokázali významně vyšší hladinu tau-proteinu v likvoru u pacientů s PN oproti kontrolní skupině, což koreluje s výsledky provedených studií o jeho spolupodílu na vzniku onemocnění, nekoreluje však s dříve provedenou studií u jedinců s PN bez příznaků demence [15]. Tento výsledek však může být ovlivněn právě tím, že skupina jedinců s PN je signifikantně starší [16].
Současně jsme prokázali signifikantně vyšší hladinu tau-proteinu v likvoru u pacientů s PN do 2 let od manifestace prvních symptomů nemoci. Tento fakt nás vedl k hypotéze, že k neurodegeneraci pravděpodobně dochází v největší míře (resp. že neurodegenerativní proces je nejvíce intenzivní) v počátečním stadiu, tj. tehdy, když tíže patologických změn v mozku „prolomí“ hranici klinické manifestace. Dříve provedené studie prokázaly vyšší hladinu tau-proteinu u jedinců s PN s demencí oproti jedincům s PN bez příznaků demence [17]. Proto by bylo vhodné u zařazených jedinců s PN následně klinicky sledovat jejich kognitivní deficit a zvýšení hladiny tau-proteinu v likvoru jako potenciální ukazatel pozdějšího rozvoje demence [18].
Limitací studie však zůstává, že u jedinců zařazených do kontrolní skupiny mohl taktéž probíhat blíže neurčený neurodegenerativní proces, který u nich v době odběru likvoru nebyl klinicky vyjádřen.
Závěr
Závěrem lze shrnout, že stanovení tau-proteinu v likvoru lze považovat za přínosný laboratorní ukazatel přítomnosti neurodegenerace u pacientů s PN. Za cennou považujeme skutečnost, že jsme prokázali jeho zvýšení především u osob, u kterých trvá nemoc 2 roky a méně od prvního projevu klinických příznaků. Stanovení beta-amyloidu(1-42) ani cystatinu C se u našeho souboru pacientů s PN neosvědčilo. Stejně tak se nám nepodařilo prokázat ani významnou souvislost mezi uvedenými ukazateli a stupněm motorického poškození.
V současnosti asi nedokážeme jednoznačně říci, zda Braakův staging progrese Parkinsonovy nemoci do detailu odpovídá skutečnosti, a to jednoduše proto, že počáteční stupně stagingu (tj. I–III) budou moci být jen velmi obtížně klinicko-patologicky korelovány u více případů, pokud vůbec. Výsledky naší studie zatím nesvědčí ve prospěch hypotézy, že hladina neurodegenerativních markerů v likvoru pacientů s PN koreluje s tíží jejich motorického postižení, hodnoceného pomocí Hoehnovy-Yahrovy stupnice.
MUDr. Hana Vranová
Neurologická klinika
Fakultní nemocnice Olomouc
I.P. Pavlova 6
775 20 Olomouc
e-mail: vranovaha@seznam.cz
Přijato k recenzi: 20. 4. 2007
Přijato do tisku: 8. 4. 2008
Sources
1. Růžička E, Roth J, Kaňovský P et al. Extrapyramidová onemocnění 1. Parkinsonova nemoc a Parkinsonské syndromy. Praha: Galén 2000.
2. Arima K, Hirai S, Sunohara N, Aoto K, Izumiyama Y, Ueda K et al. Cellular co-localization of phosphorylated tau - and NACP/alpha-synuclein-epitopes in Lewy bodies in sporadic Parkinson's disease and in dementia with Lewy bodies. Brain Res 1999; 843(1–2): 53–61.
3. Ishizawa T, Mattila P, Davies P, Wang D, Dickson DW. Colocalization of tau and alpha-synuclein epitopes in Lewy bodies. J Neuropathol Exp Neurol 2003; 62(4): 389–397.
4. Esposito A, Dohm CP, Kermer P, Bähr M, Wouters FS. Alpha-Synuclein and its disease-related mutants interact differentially with the microtubule protein tau and associate with the actin cytoskeleton. Neurobiol Dis 2007; 26(3): 521–531.
5. Jensen PH, Hager H, Nielsen MS, Hojrup P, Gliemann J, Jakes R. Alpha-synuclein binds to Tau and stimulates the protein kinase A-catalyzed tau phosphorylation of serine residues 262 and 356. J Biol Chem 1999; 274(36): 25481–25489.
6. Braak H, Del Tredici K, Rüb U, de Vos RA, Jansen Steur EN, Braak E. Staging of brain patology related to sporadic Parkinson’s disease. Neurobiology of Aging 2003; 24(2): 197–211.
7. Braak H, Ghebremedhin E, Rub U, Bratzke H, Del Tredici K. Stages in the development of Parkinson's disease-related pathology. Cell Tissue Res 2004; 318(1): 121–134.
8. Muller J, Wenning GK, Jellinger K, McKee A, Poewe W, Litvan I. Progression of Hoehn and Yahr stages in Parkinsonian disorders: a clinicopathologic study. Neurology 2000; 55(6): 888–891.
9. Bibl M, Mollenhauer B, Esselmann H, Lewczuk P, Klafki HW, Sparbier K et al. CSF amyloid-beta-peptides in Alzheimer's disease, dementia with Lewy bodies and Parkinson's disease dementia. Brain 2006; 129(Pt 5): 1177–1187.
10. Portelius E, Zetterberg H, Andreasson U, Brinkmalm G, Andreasen N, Wallin A et al. An Alzheimer's disease-specific beta-amyloid fragment signature in cerebrospinal fluid. Neurosci Lett 2006; 409(3): 215–219.
11. Stejskal D, Vavroušková J, Mareš J, Urbánek K. Application of new laboratory marker assays in neurological diagnosis - a pilot study. Biomed Pap Med Fac Univ Palacky Olomouc Czech Repub 2005; 149(2): 265–266.
12. Mareš J, Stejskal D, Vavrouškova J, Urbánek K, Herzig R, Hluštík P. Use of cystatin C determination in clinical diagnostics. Biomed Pap Med Fac Univ Palacky Olomouc Czech Repub 2003; 147(2): 177–180.
13. Mareš J, Herzig R, Urbánek K, Vranová H, Hluštík P, Stejskal D et al. Využití stanovení cystatinu C u pacientů s neurodegenerativním chorobami. Cesk Slov Neurol N 2006; 69/102(3): 195–199.
14. Hughes AJ, Daniel SE, Kilford L, Lees AJ. Accuracy of clinical diagnosis of idiopathic Parkinson’s disease: a clinico-pathological study of 100 cases. J Neurol Neurosurg Psychiatry 1992; 55(3): 181–184.
15. Molina JA, Benito-Leon J, Jimenez-Jimenez FJ, Ortí-Pareja M, Berbel A, Tallón-Barranco A et al. Tau protein concentrations in cerebrospinal fluid of non-demented Parkinson's disease patients. Neurosci Lett 1997; 238(3): 139–141.
16. Yang W, Ang LC, Strong MJ. Tau protein aggregation in the frontal and entorhinal cortices as a function of aging. Brain Res Dev Brain Res 2005; 156(2): 127–138.
17. Mollenhauer B, Trenkwalder C, von Ahsen N, Bibl M, Steinacker P, Brechlin P et al. Beta-amlyoid 1-42 and tau-protein in cerebrospinal fluid of patients with Parkinson's disease dementia. Dement Geriatr Cogn Disord 2006; 22(3): 200–208.
18. Fagan AM, Roe CM, Xiong C, Mintun MA, Morris JC, Holtzman DM et al. Cerebrospinal fluid tau/beta-amyloid(42) ratio as a prediction of cognitive decline in nondemented older adults. Arch Neurol 2007; 64(3): 343–349.
Labels
Paediatric neurology Neurosurgery Neurology
Article was published inCzech and Slovak Neurology and Neurosurgery

2008 Issue 3-
All articles in this issue
- Přínos vyšetření čichu v časné diagnostice demencí neurodegenerativní etiologie
- Analýza pulzové vlny v objektivizaci bolesti – předběžné sdělení
- Kvalita života u pacientů po subarchnoidálním krvácení – roční katamnéza
- Retrospektivní analýza nálezů zrakových evokovaných potenciálů při akutním zánětu zrakového nervu
- Laboratorní ukazatele neurodegenerace v likvoru a míra motorického postižení u Parkinsonovy nemoci: korelační studie
- Doporučený postup sekundární prevence recidivy po akutní cévní mozkové příhodě: mozkovém infarktu/tranzitorní ischemické atace a hemoragické cévní mozkové příhodě
- Degenerace krční meziobratlové ploténky – indikace a možnosti chirurgické léčby
- Depersonalizace a derealizace – současné nálezy
- Sexuální dysfunkce u žen s epilepsií a jejich příčiny
- Pohybové aktivity pacientů trpících dědičnou polyneuropatií
- Asociace vybraných rizikových faktorů s tíží aterosklerotického postižení v karotické bifurkaci
- Funkce pravé komory srdeční a výskyt plicní hypertenze u pacientů se syndromem obstrukční spánkové apnoe
- Tau-protein, fosforylovaný tau-protein a beta-amyloid42 v likvoru u demencí a roztroušené sklerózy
- Migréna v těhotenství
- Sporadický „guamský parkinsonský komplex“ nebo koincidence více neurodegenerativních onmocnění?
- Použití DTI traktografie v neuronavigaci při operacích mozkových nádorů: kazuistiky
- Management ischemické cévní mozkové příhody a tranzitorní ischemické ataky – doporučení European Stroke Organisation (ESO) 2008 – zestručněná česká verze
- Czech and Slovak Neurology and Neurosurgery
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Depersonalizace a derealizace – současné nálezy
- Degenerace krční meziobratlové ploténky – indikace a možnosti chirurgické léčby
- Migréna v těhotenství
- Pohybové aktivity pacientů trpících dědičnou polyneuropatií
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career