-
Medical journals
- Career
CMP a fibrilace síní – management pacientů s tímto rizikovým faktorem
Authors: prim. MUDr. Polák Martin
Authors‘ workplace: Interní oddělení, Klaudiánova nemocnice, Mladá Boleslav
Published in: CMP jour., 5, 2023, č. 1, s. 9-14
Category:
Fibrilace síní (FiS) je supraventrikulární arytmie s nekoordinovanou aktivitou síní. V současné době se jedná o nejčastější setrvalou arytmii v dospělé populaci. Vznik FiS je přitom spojen s vzestupem kardiovaskulární a celkové mortality. Z hlediska vzniku cévní mozkové příhody (CMP) a její prognózy představuje nejvýznamnější rizikový faktor.
Prevalence FiS
Prevalence FiS se odhaduje na 2–4 %. Výskyt arytmie se zvyšuje se stoupajícím věkem. U pacientů starších 80 let se vyskytuje až v 10 %. Předpokládá se, že do roku 2050 se počet pacientů s FiS zvýší 3–7násobně. Tento vzestup souvisí mimo jiné s prodlužujícím se věkem (předpokládá se, že 50 % pacientů s FiS bude starších 80 let), prodlužováním délky života díky kardiovaskulárním intervencím, ale také s větším nárustu rizikových faktorů (obezita, stres apod.). FiS je nejčastěji doprovázena onemocněním srdce (ICHS, chlopenní vady). Způsobuje cca 10–15 % případů ischemických mozkových příhod (iCMP) na podkladě kardioembolizační příhody.
FiS je také jedním z důvodů nárustu nákladů na léčení, a to jak při managementu vlastní arytmie, tak především následků nepoznané či neléčené arytmie (jen v USA činí tyto náklady 16–26 mld. USD/rok). Předpokládá se, že ve vyspělých zemích náklady vzrostou až na 2,5 % prostředků vynakládaných ročně na zdravotní péči. To je důvodem narůstajícího zájmu o diagnostiku i léčbu FiS a prevenci následků této arytmie.
FiS je nejdůležitějším rizikovým faktorem pro vznik CMP a její prognózu. Riziko CMP zvyšuje 3–5násobně. CMP je pacientů s FiS spojena s horším průběhem, vyšším rizikem úmrtí, delší dobou hospitalizace, větším neurodeficitem a následně větším rizikem invalidizace.
Rizikové faktory vzniku FiS
U FiS je vedle věku důležité znát také další rizikové faktory (viz tab. 1). Na jejím vzniku se navíc mohou podílet různé spouštěče (viz tab. 2).
Table 1. Rizikové faktory pro vznik FiS 
Table 2. Spouštěcí faktory FiS 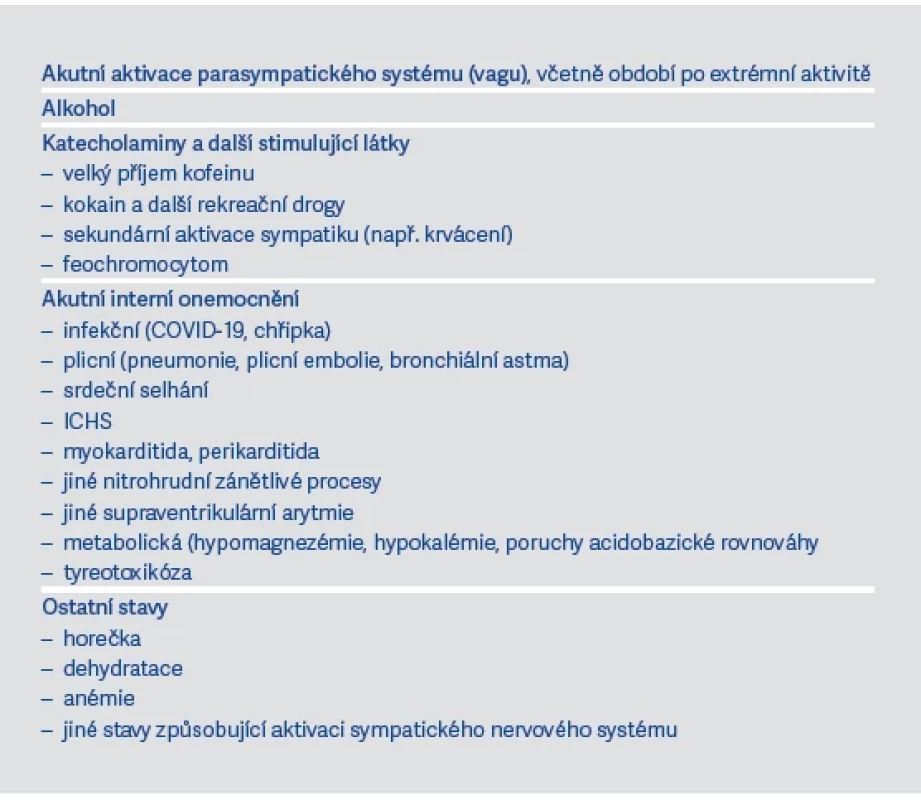
Klinický průběh a projevy FiS
FiS má v cca 10–20 % případů zcela asymptomatický průběh a její odhalení je náhodné až při komplikaci arytmie, jak tomu bývá právě u CMP. Mnohdy není u pacientů s CMP při přijetí žádná arytmie zachycena (kryptogenní CMP). Je třeba mít na paměti, že až u 25 % pacientů s iCMP s FiS mohou být přítomné jiné zdroje embolizace do CNS, např. aorta a karotické tepny. Nejčastějším zdrojem kardioembolizačních CMP jsou samozřejmě tromby v levé srdeční síni a v oušku levé síně.
V souvislosti s iCMP kardioembolizačního původu je nezbytné hovořit o asymptomatické („tiché“) FiS. Je definována jako arytmie bez přítomnosti zjevných symptomů. Odhaduje se, že až 50 % pacientů s FiS je asymptomatických, přičemž riziko komplikací, včetně CMP, je dokonce vyšší (až 6násobně), než u pacientů symptomatických. Je nutné pamatovat i na skutečnost, že asymptomatické epizody FiS se mohou objevit i po katetrizačním léčení arytmie doprovázené symptomy. To má dopad rovněž na další diagnostiku zaměřenou na odhalení paroxysmů FiS.
Screening a diagnostika FiS a stanovení rizika CMP
U pacientů přijatých s diagnózou iCMP zjistíme přítomnost FiS až u 25 %. Z toho tedy vyplývá, že veškeré naše snažení musí být zaměřeno na prevenci CMP. K tomu využíváme screeningové, diagnostické a následně preventivně-terapeutické postupy. Jakmile zjistíme, že u pacienta je přítomná nevalvulární FiS, je třeba zhodnotit riziko kardioembolických příhod pomocí skóre CHA2DS2VASc (viz tab. 3). Skóre nám říká pravděpodobnost vzniku iCMP na základě několika faktorů a následně nás vede v rozhodovacím procesu ohledně preventivních opatření, především zahájení antikoagulační terapie (viz dále).
Table 3. Skóre CHA2DS2VASc pro nevalvulární FiS 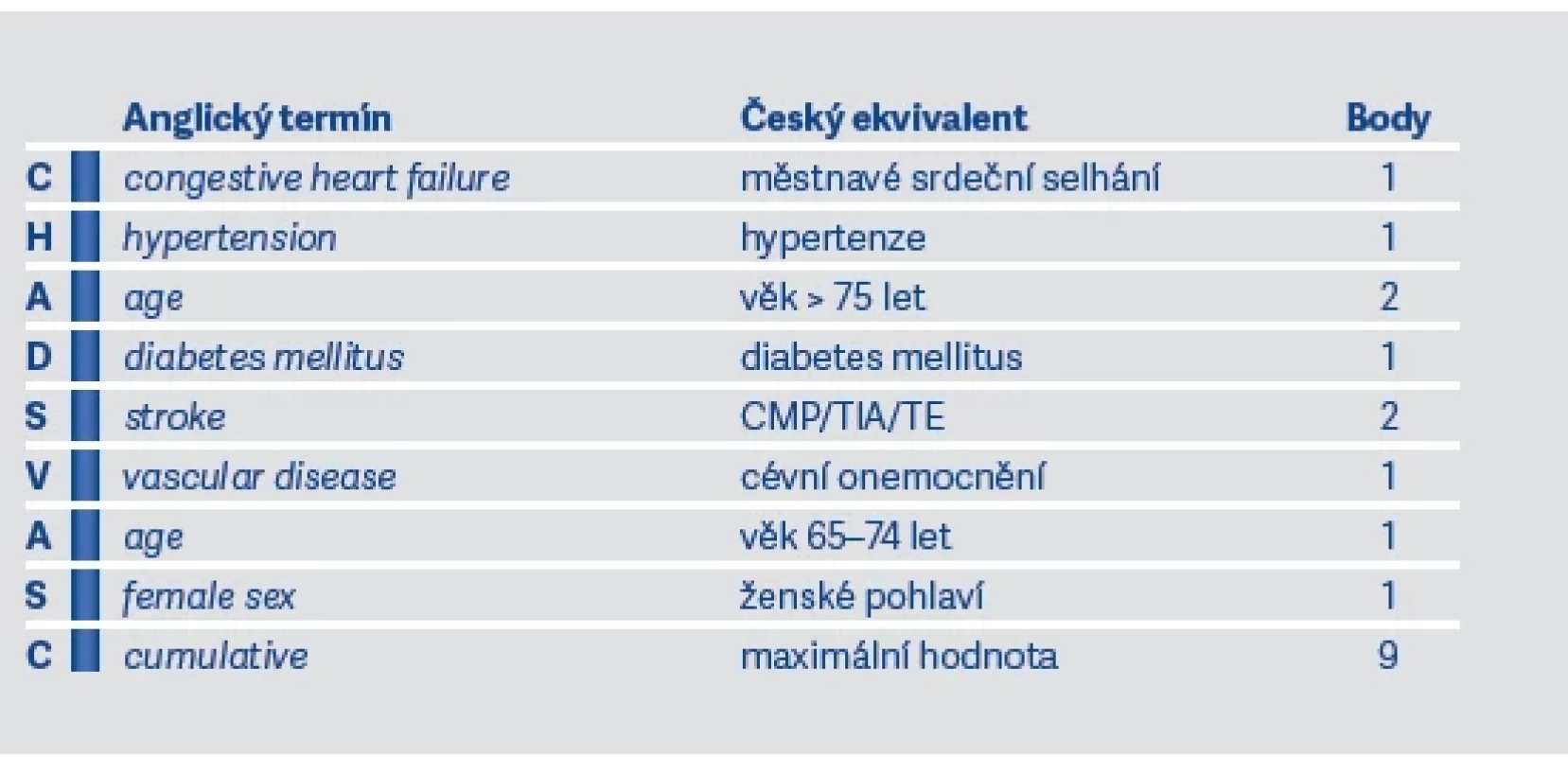
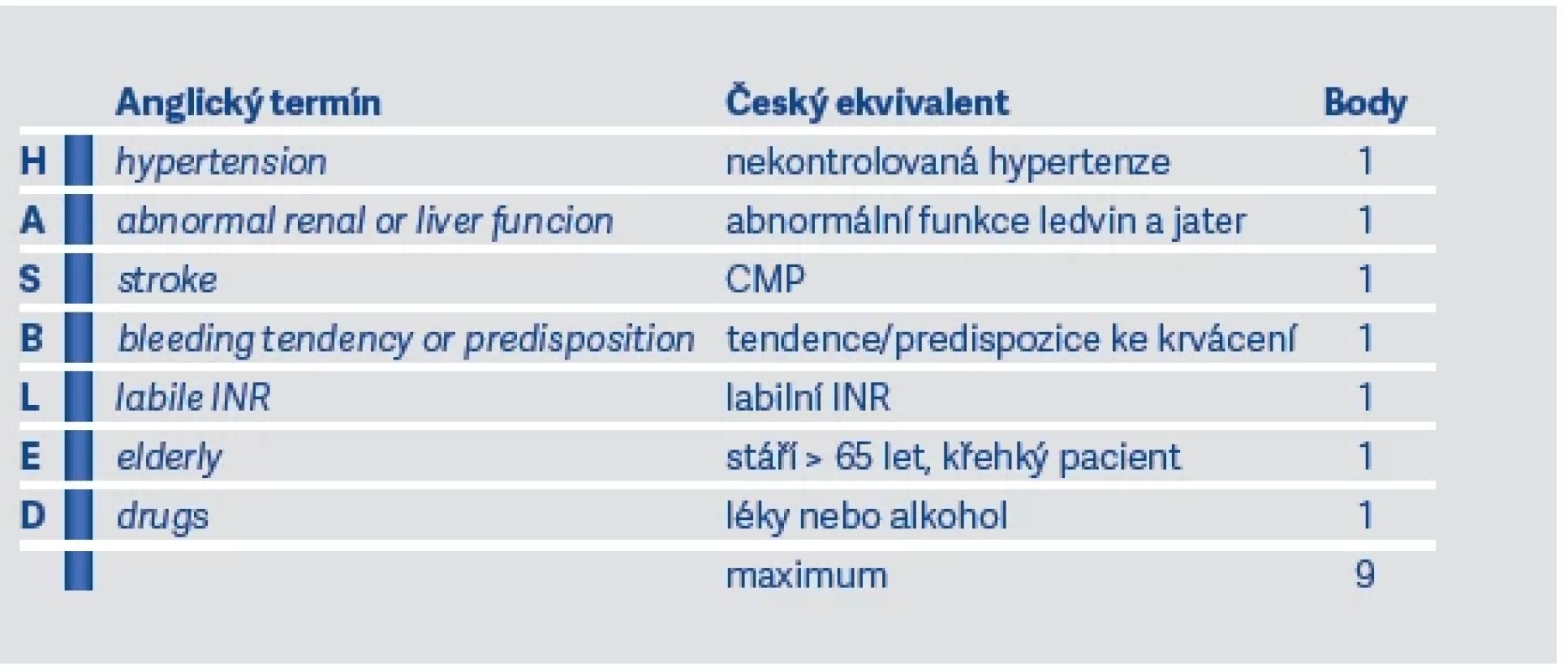
Současně se stanovením rizika CMP je také nutné stanovit riziko krvácení při antikoagulační terapii. Krvácení je nejčastějším nežádoucím účinkem antikoagulační terapie a může vést ke zvýšení morbidity a mortality. Toto riziko stanovujeme na základě skóre HAS-BLED (viz tab. 4). Jeho hodnota pak může ovlivňovat další rozhodovací proces v preventivně-terapeutických opatřeních.
Vysoké riziko krvácení tedy neznamená, že u pacienta nebude zahájena antikoagulační terapie nebo že bude již zahájená antikoagulační terapie přerušena. Znamená však, že musíme zvážit rizika versus benefity z antikoagulační terapie, častěji pacienta kontrolovat a snažit se zlepšit jeho rizikový profil ovlivněním rizikových faktorů. U hodnot skóre HAS-BLED > 3 body je přítomné vysoké riziko krvácení. Pokud rizika antikoagulační terapie převažují a rizikové faktory nejsme schopni ovlivnit, pak se rozhodujeme pro jiné preventivně-léčebné metody (viz dále).
Z pohledu prevence iCMP na podkladě kardioembolizačních příhod se snažíme zachytit nejčastější příčinu, tedy FiS, a to jak v případech, kdy při přijetí pro CMP arytmie není zachycena, nebo při palpitacích v anamnéze, kdy arytmie rovněž není zachycena, tak i v období po provedení intervenčního řešení FiS. K záchytu arytmie nám slouží různé metody s různým stupněm úspěšnosti. Příslušnou metodu volíme buď z důvodu screeningu FiS, nebo diagnostiky FiS u symptomatických pacientů, ale bez záchytu arytmie v době vyšetření, případně postprocedurálně (po elektrické kardioverzi, farmakologické verzi nebo ablačním řešení) k záchytu asymptomatických epizod FiS. Některé z metod se významně posunuly vpřed v rámci pandemie COVID-19 a díky možnostem telemedicíny.
Některé práce ukazují, že ve věku nad 65 let by screening FiS měl být prováděn periodicky, podobně jako je tomu u vyšetření pro časný záchyt nádorových onemocnění. Existují také důkazy, že 24hodinové holterovské monitorování EKG má úspěšnost záchytu maximálně 3 %, zatímco týdenní až 30denní monitorování (epizodní záznamníky) v tomto ohledu dosahuje až 50–70 %. V případě použití implantabilních záznamníků EKG je úspěšnost záchytu asymptomatických epizod FiS 100%, podobně i při použití dlouhodobého monitorování u pacientů, kteří mají implantované kardiostimulátory či kardiovertery-defibrilátory (ICD).
Velmi úspěšná jsou také nejrůznější digitální zařízení jako chytré hodinky a telefony apod. umožňující diagnostiku s možností extrakce a přenosu dat, včetně přenosu do ambulance příslušného zdravotnického zařízení. Digitální zařízení fungují na principu detekce EKG nebo fotopletysmografie. Přehled těchto metod ukazují tab. 5 a 6 a vychází i z materiálu profesora Miloše Táborského publikovaného v doporučeních České kardiologické společnosti v roce 2022.
Table 5. Screeningové metody pro záchyt FiS 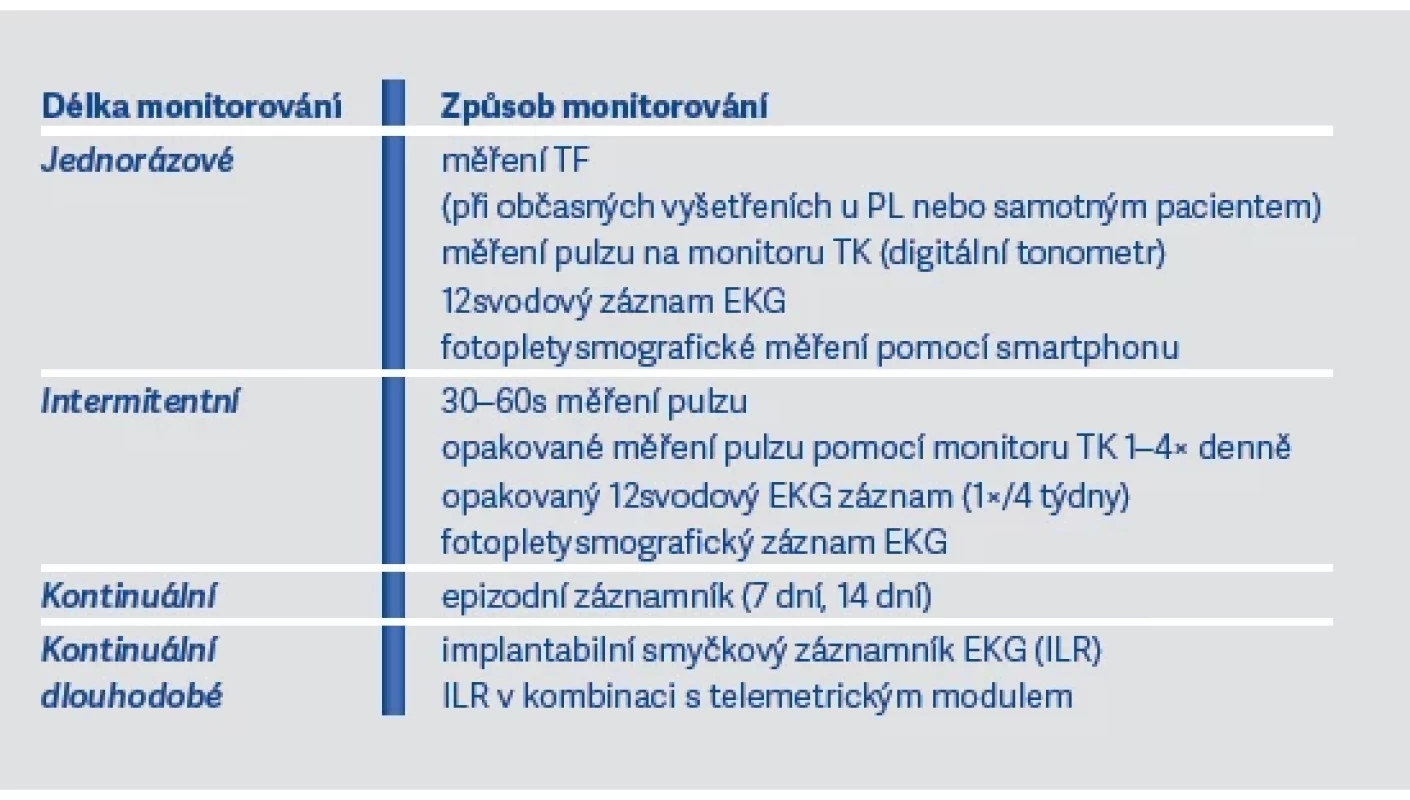
Table 6. Příklady metod diagnostiky FiS při palpitacích nebo u kryptogenní CMP 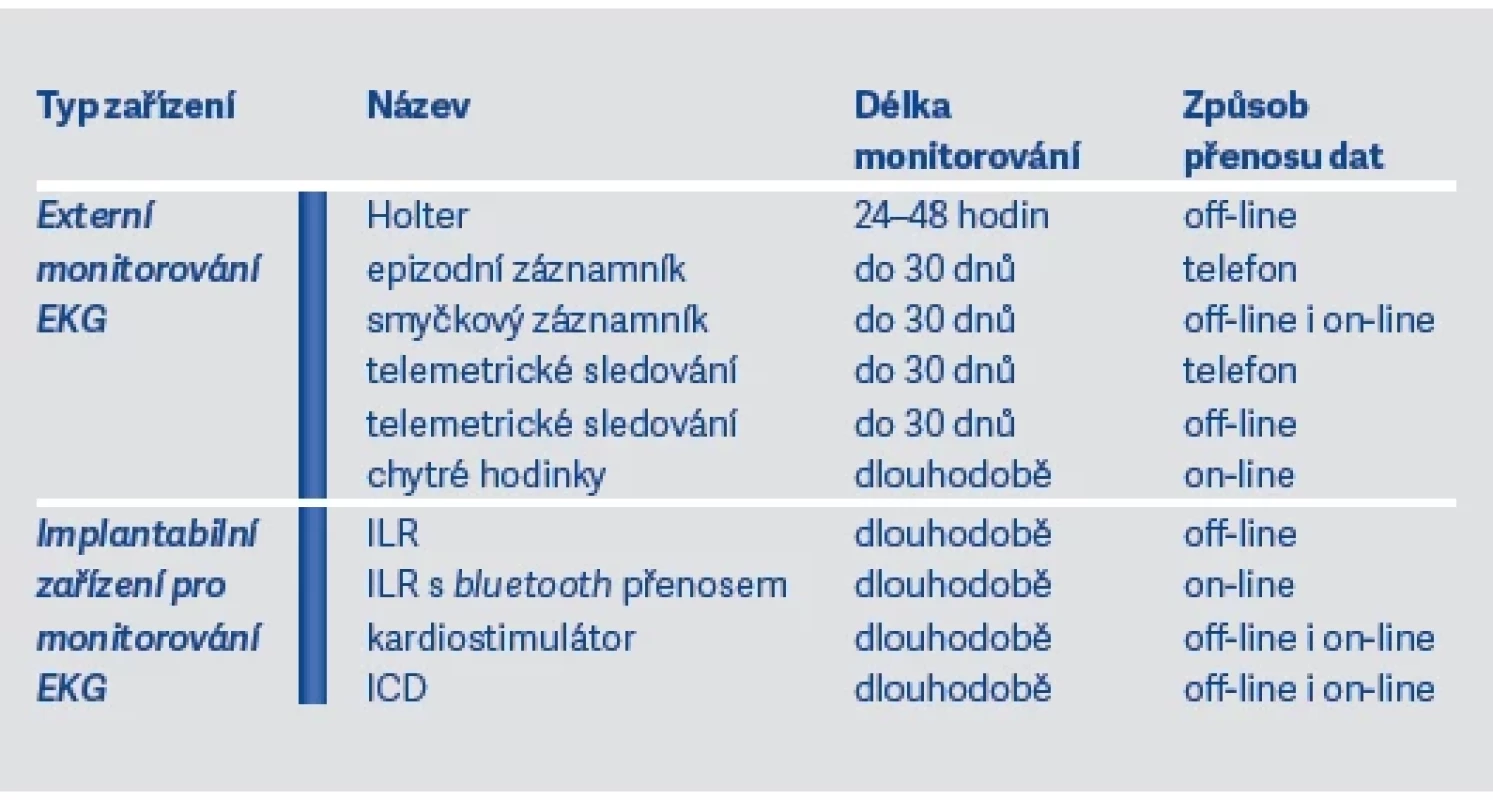
Pro postprocedurální diagnostiku paroxysmů FiS (po elektrické či farmakologické verzi nebo po ablačním výkonu) se používají buď zařízení pro monitorování EKG typu epizodního či smyčkového záznamníku na dobu až 30 dnů, nebo zařízení pro dlouhodobé monitorování EKG (ILR, kardiostimulátory, ICD).
Terapeutický postup
Při prvozáchytu FiS se s ohledem na prevenci kardioembolizační příhody, především CMP, musíme zaměřit především na antikoagulační terapii. Postup je následující:
1. Vyhodnotíme stupeň rizika CMP pomocí skóre CHA2DS2VASc: U mužů při skóre 0 a u žen při skóre 0–1 antikoagulační terapii nezahajujeme. Jinak zahájíme antikoagulační terapii u nevalvulární FiS preferenčně NOACs (dabigatran, apixaban, rivaroxaban, edoxaban), u valvulární FiS antagonisty vitaminu K (warfarin).
2. Vyhodnotíme riziko krvácení pomocí skóre HAS-BLED: V případě vysokého rizika krvácení (skóre > 3) je třeba velmi pečlivé kontroly klinického stavu i laboratorních parametrů. Neznamená to tedy, že nelze antikoagulační terapii zahájit. V případě, že rizikové faktory pro krvácení nejsou ovlivnitelné a riziko krvácení převyšuje benefit antikoagulační terapie, je nutné pacienta indikovat k nefarmakologické prevenci kardioembolizačních příhod.
Pokud dlouhodobě přetrvává FiS nebo se objevují paroxysmy i postprocedurálně, pak je nutná dlouhodobá antikoagulační terapie, a to po prodělané CMP.
Mezi nefarmakologické metody prevence kardioembolizačních příhod patří především uzavření ouška levé síně. Jedná se o katetrizační výkon, kdy použijeme zařízení Watchman či Amulet. Uzávěr ouška je indikovaný především při výskytu závažných krvácení při antikoagulační terapii i bez ní (např. karcinom močového měchýře) nebo při recidivujících kardioembolizačních příhodách i přes účinnou antikoagulační terapii.
Nejlepší prevencí kardioembolizačních příhod při FiS je její odstranění, tedy kontrola rytmu (rhythm control). K tomu slouží farmakologické a nefarmakologické metody. Pro zahájení kontroly rytmu je důležité časové kritérium, tedy kdy arytmie začala – to je ovšem možné určit jen u symptomatické FiS. Pokud je arytmie asymptomatická, pak okamžik vzniku nelze spolehlivě určit. Často doje ke spontánní verzi na sinusový rytmus. V případě, že FiS trvá maximálně 48 hodin, je možné zahájit pokus o kontrolu rytmu podáním antiarytmik, nejlépe ze skupiny IC (propafenon) či III (amiodaron). V případě hemodynamické nestability je nutné provést v analgosedaci elektrickou kardioverzi (EKV), a to i bez antikoagulační terapie. V případě, že není jasná délka trvání FiS, máme možnost provést EKV, a to buď po transezofageální echokardiografii (TEE) s negativním nálezem stran trombů v oušku LS, nebo elektivně po náležité antikoagulační terapii trvající 3 týdny.
Pokud se podaří nastolit sinusový rytmus, pak je naší snahou tento rytmus udržet. K tomu opět můžeme využít farmakologické či nefarmakologické metody. Z farmakoterapie podáváme opět antiarytmika třídy IC (propafenon), je-li zachovaná systolická funkce LK, nebo antiarytmika třídy III (amiodaron) v případě, že je přítomná systolická dysfunkce LK. Při podávání antiarytmik si musíme být vědomi i proarytmogenního účinku antiarytmik, např. torsade de pointes. V současné době tak začínají být metodou volby (pokud nejsou přítomné nepříznivé okolnosti jako těžká dilatace LS či těžká systolická dysfunkce LK) nefarmakologické – ablační – metody, které vedou k izolaci plicních žil. Nejmodernější metodou je ablace pomocí pulzního pole (PFA – pulsed field ablation). Ta umožňuje kromě izolace plicních žil i boxové ošetření zadní stěny LS.
V případě, že se verze na sinusový rytmus nezdaří nebo není z různých důvodů možná, přistupujeme ke kontrole srdeční frekvence (rate control). K té se využívají především antiarytmika třídy II (betablokátory) nebo IV (blokátory kalciového kanálu nedihydropyridového typu, např. verapamil). U pacientů s FiS s extrémně rychlou srdeční frekvencí je možné použít betablokátory s ultrakrátkým poločasem (esmolol, landiolol). U pacientů, kde je přítomné srdeční selhání, lze použít i digitalis. Kontrola frekvence je při tachykardii vhodná i před pokusem o kontrolu rytmu.
V případě, že farmakoterapie ke kontrole frekvence není možná, lze použít i nefarmakologickou léčbu, kdy implantujeme kardiostimulátor a následně kompletně přerušíme AV převod.
Detailní informace jak k farmakoterapii ke kontrole rytmu či frekvence, tak k nefarmakologické léčbě jsou již nad rámec tohoto sdělení a je třeba odkázat na další literární zdroje.
Sources
1. Oficiální stanovisko EHRA. Jak používat digitální techniku k detekci a monitorování arytmií v péči o jedince s poruchami srdečního rytmu: Praktický návod Evropské asociace srdečního rytmu (EHRA). Doporučené postupy ČKS 2022.
2. Doporučení ESC pro diagnostiku a léčbu fibrilace síní, 2020. Souhrn dokumentu připravený ČSK. Cor et Vasa 2021; 63 (2): 135–161.
Labels
Internal medicine Cardiology Neurosurgery Neurology Radiodiagnostics Trauma surgery
Article was published inCMP journal
2023 Issue 1-
All articles in this issue
- Editorial
- Sekundární prevence ischemických CMP: stručný přehled vybraných aktuálních odborných doporučení pro praxi
- CMP a fibrilace síní – management pacientů s tímto rizikovým faktorem
- Vzácné příčiny ischemických CMP – 1. část
- Virtuální realita v rehabilitaci pacientů po CMP
- Kvalita života a case management v rehabilitaci osob po CMP
- Akutní mozkové krvácení na přímých perorálních antikoagulanciích – závažná komplikace s dobrým koncem
- CMP journal
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Sekundární prevence ischemických CMP: stručný přehled vybraných aktuálních odborných doporučení pro praxi
- CMP a fibrilace síní – management pacientů s tímto rizikovým faktorem
- Virtuální realita v rehabilitaci pacientů po CMP
- Vzácné příčiny ischemických CMP – 1. část
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career