-
Medical journals
- Career
Stomatitidy při terapii s inhibitory mTOR a další cílené onkologické terapii, možnosti ovlivnění a význam lokální kortikoterapie
Authors: Samuel Vokurka 1; Šárka Kozáková 2; Veronika Jánská 3; Anežka Černá 1; Jan Liška 4
Authors‘ workplace: Onkologická a radioterapeutická klinika LF UK a FN Plzeň 1; Ústavní lékárna, MOÚ Brno 2; Lékárna, FN Plzeň 3; Stomatologická klinika FN Plzeň 4
Published in: Klin Onkol 2020; 33(6): 436-439
Category: Review
Overview
Východiska: Stomatitidy související s cílenou (terčovou) onkologickou léčbou, typicky pak např. s terapií everolimem, patří mezi významné komplikace ovlivňující kvalitu života pacienta a intenzitu jeho onkologické léčby. Kortikoidy především k lokální aplikaci představují zásadní léčebnou a případně i profylaktickou intervenci. Cíl: Základní souhrn klinického obrazu, výskytu a přehledu možností ovlivnění výskytu stomatitidy související s cílenou (terčovou) onkologickou léčbou. Výsledky: Při léčbě everolimem bývají až dvě třetiny pacientů postiženy stomatitidou. Roztok s dexamethasoni natrii phosphas 0,1 mg/ml (0,01%) v rámci studie SWISH prokázal významnou redukci komplikace při profylaktickém výplachu dutiny ústní během léčby s everolimem. Tento roztok je také navrhován v rámci doporučení Evropské společnosti pro lékařskou onkologii jako základ léčby stomatitidy s defekty při cílené terapii. Dostupnost lokálních přípravků s obsahem dexametazonu je variabilní s ohledem na koncentraci a druh dexametazonové soli a formu přípravku. Závěr: Roztoky s obsahem dexametazonu jsou součástí péče o dutinu ústní pacientů při cílené onkologické léčbě; ujednocení indikací a receptur pro standardní využívání v praxi je však dále otevřeným tématem.
Klíčová slova:
stomatitida – ošetřování – dexametazon – cílená molekulární léčba
Terminologie
Postižení dutiny ústní je poměrně typickou komplikací onkologické léčby. Mukozitida dutiny ústní představuje charakteristický typ toxicko-zánětlivého postižení sliznice a podslizniční tkáně vzniklý v souvislosti s chemoterapií nebo radioterapií a takto je i toto postižení referováno (mucositis) v systému Medical Subject Headings [1]. Postižení dutiny ústní označované jako stomatitida by, kromě jiných případů, mělo být rezervováno pro postižení sliznice dutiny ústní vzniklé v souvislosti s terapií cílenou, resp. biologickou a imunoterapií. Typickým příkladem zde je např. stomatitida asociovaná s terapií inhibitory mTOR (mammalian target of rapamycin). K převážně méně těžkým stomatitidám pak dochází i v souvislosti s aplikací jiných molekul cílené léčby, jako jsou např. bevacizumab, erlotinib, sorafenib, sunitinib, gefitinib a lapatinib, kde většinou nemusí nastat rozvoj defektů, ale bývá spíše zvýšená citlivost a bolestivost sliznic, změny a poruchy vnímání chutí [2–5].
Patogeneze a diagnostika
Etiologie a patogeneze stomatitid je odlišná od klasické mukozitidy po chemoterapii nebo radioterapii. Na poškození sliznice při léčbě inhibitory mTOR (everolimus, temsirolimus a sirolimus) se podílejí komplexní mechanizmy a ovlivnění signálních drah a procesů ovlivňujících buněčný metabolizmus, reparaci, neoangiogenezi a funkci imunitních dějů s výsledně imunosupresivním potenciálem (dráha PI3K – PKB – AKT – mTOR – p27 – cyklinD – CDK4/6 – Rb – E2F – aktivace buněčného cyklu z G1 do S fáze, redukce VEGF a HIF). V případě jiných molekul cílené léčby jsou ovlivněny na ně vázané specifické dráhy [3,6,7].
Diagnostika slizničních lézí způsobených v souvislosti s cílenou terapií je typicky postavena na klinickém obraze a anamnestických údajích, přičemž na rozdíl od klasické postchemoterapeutické a postiradiační mukozitidy, kde se změny rozvíjejí většinou již v několika následných dnech a týdnech, se v tomto případě postižení může manifestovat až za několik týdnů i měsíců [3]. Defekty v souvislosti s terapií inhibitory mTOR bez ohledu na populaci pacientů (léčba solidních nádorů, potransplantační imunosupresivní léčba) mají typický aftózní vzhled s jasným ohraničením, lemem erytému s centrálním výbledem, typicky na nekeratinizované sliznici a především na hraně jazyka, bukálně a labiálně, většinou ≤ 1 cm, ale i více, s mediánem bolestivosti 8 (škála 0–10), viz obr. 1 a 2. Histopatologický nález je nespecifický – fibrin se zavzatými neutrofily, spodina s granulační tkání s projevy akutního a chronického zánětu pronikající do svaloviny s myozitidou a fragmentací, bez známek cytopatického virového efektu v přilehlém intaktním epitelu [3,8].
Image 1. Aftózní léze sliznice dolního rtu v průběhu terapie s everolimem
(foto archiv S. Vokurka).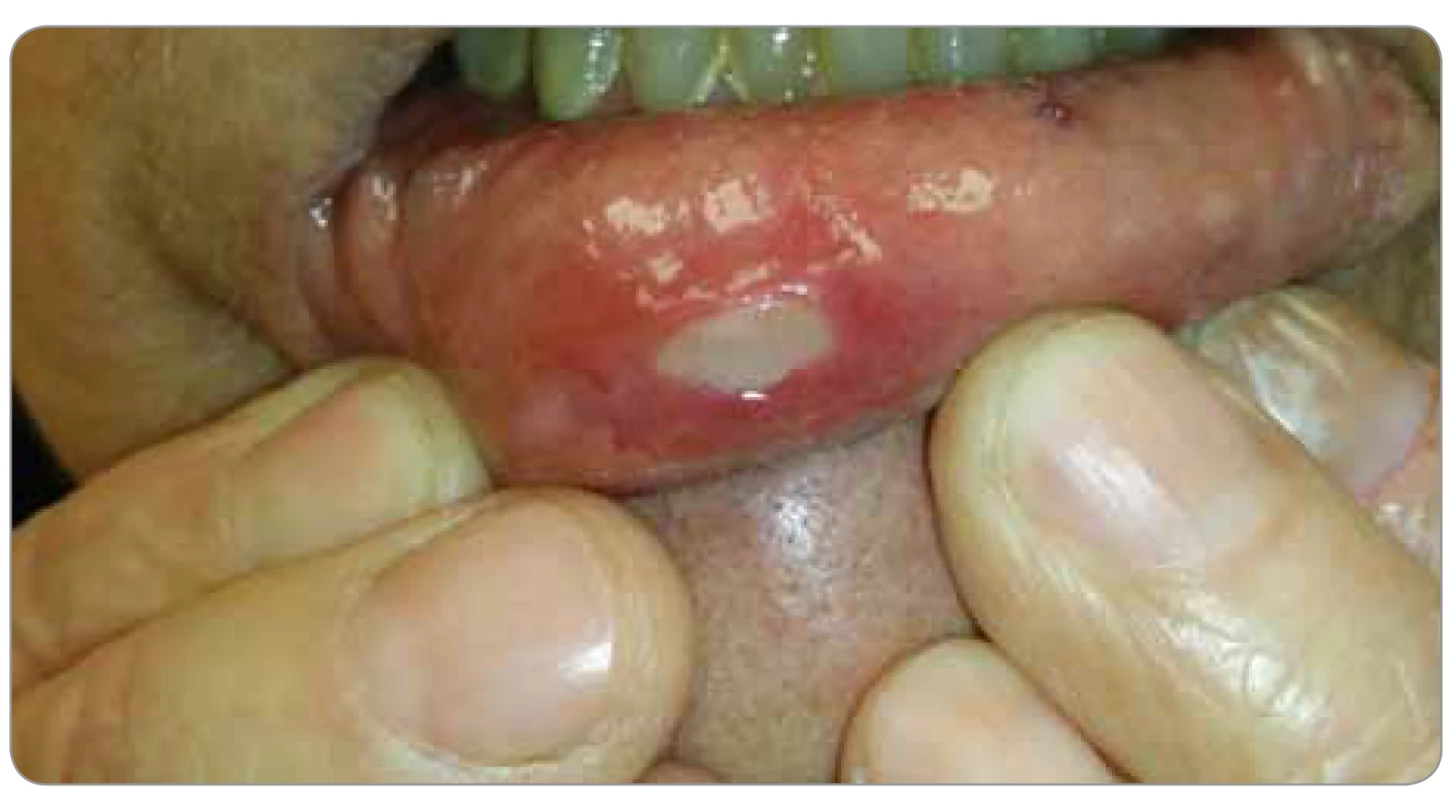
Image 2. Postižení jazyka v průběhu terapie s everolimem
(foto archiv S. Vokurka).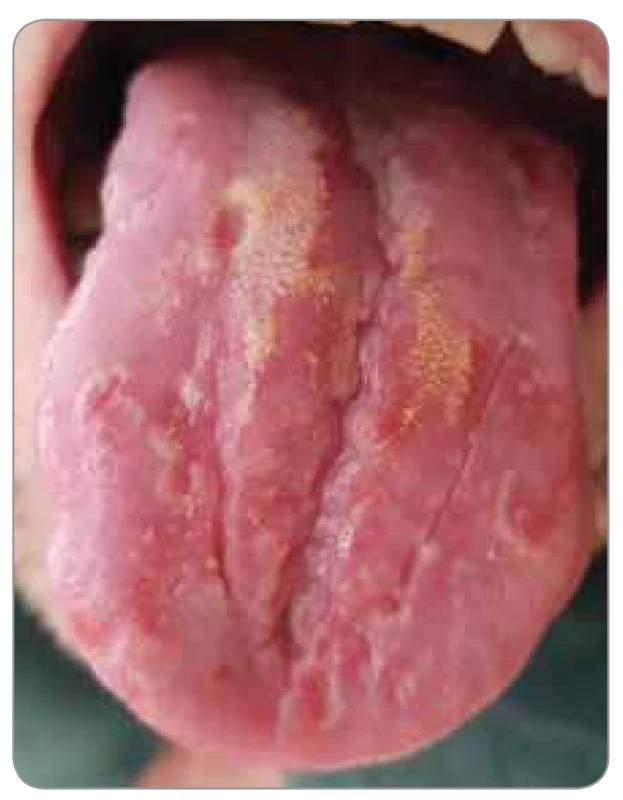
Výskyt
Metanalýza studií fáze III s everolimem v rámci léčby karcinomu prsu, ledvin, neuroendokrinních nádorů pankreatu a karcinoidů ukázala na celkovou incidenci stomatitidy 67 % (59–71 %), s těžkými stupni postižení s omezením p. o. příjmu u 9 % případů. U celkem 89 % postižených pacientů došlo k rozvoji komplikace do 8 týdnů po zahájení terapie s everolimem a u 40 % pak k recidivě [9–13]. Významný výskyt této komplikace byl pozorován také v podmínkách běžné praxe, kdy retrospektivní analýza 42 onkologických pacientů léčených everolimem v průběhu roku 2016 na Onkologické a radioterapeutické klinice FN Plzeň potvrdila postižení sliznic dutiny ústní u 50 % a postižení omezující p. o. příjem u téměř 21 % pacientů s jasnými dopady na zhoršení kvality života a také případnou potřebu snížení intenzity onkologické léčby dle doporučení v SPC léčiva [14,15].
Aktuálně zatím nevýznamnější studií řešící problematiku možnosti prevence stomatitidy při terapii s everolimem byla nezaslepená studie II. fáze SWISH [16], ve které byl hodnocen efekt výplachů dutiny ústní v USA běžně dostupným komerčním roztokem s obsahem dexametazonu (dexamethasone sodium phosphate, dexamethasoni natrii phosphas) 0,1 mg/ml (0,01%) u postmenopauzálních pacientek s HR+/HER2 − metastatickým karcinomem prsu léčených everolimem v dávce 10 mg/den v kombinaci s exemestanem 25 mg/den p. o. Prakticky se tedy jednalo o kohortu pacientek léčených pro karcinom prsu podle kritérií a v kontextu protokolu studie BOLERO-2 [9], kde však žádný dexametazonový roztok k profylaktické péči o dutiny ústní nebyl zařazen. Pacienti studie SWISH byli instruováni k užívání 10 ml roztoku k působení v dutině ústní po dobu 2 minut s následným vyplivnutím, nepřijímáním p. o. po dobu 1 hodiny po výplachu, 4× denně, po dobu 8 týdnů a případně pak dále podle uvážení lékaře a pacienta. Byl povolen nystatin do dutiny ústní dle uvážení lékaře a lokálních zvyklostí. Naprostá většina (95 %) pacientů užívala roztok dexametazonu v doporučené frekvenci 3–4× denně a medián četnosti výplachů byl 3,95× denně. Výskyt stomatitidy ve studii SWISH do 8 týdnů od zahájení terapie everolimem a celkově po dobu sledování byl 21 a 27 % oproti výskytu 61 a 67 % v rámci protokolu studie BOLERO-2. V době hodnocení 8. týdne mělo stomatitidu stupně ≥ 2 s defekty sliznic celkem 2 % pacientů SWISH vs. 27 % v BOLERO-2 (výskyt těžké stomatitidy stupně 3 byl celkově 1 vs. 8 %). Většina případů stomatitid (18/25, 72 %) ve studii SWISH se objevila během prvních 8 týdnů léčby, zbylé pak v době do 98. dne. Kandidóza dutiny ústní jako potenciálně související nežádoucí účinek léčby roztokem kortikoidu byla zaznamenána u dvou pacientů, přičemž u obou byla vstupně zajištěna antifungální profylaxe. Nebyla zjištěna žádná korelace mezi antifungální profylaxí a výskytem stomatitidy nebo kandidózy. Více než 74 % pacientů pokračovalo v užívání roztoku s dexametazonem déle než 8 týdnů. Stomatitida jako důvod ukončení léčby everolimem byla ve studii SWISH a BOLERO-2 velmi podobná (2 vs. 2,7 %), nicméně pokud jde o důvod přerušení nebo redukce dávky, pak byl rozdíl velmi výrazný – 3 vs. 23,7 %. Medián dávkové intenzity everolimu v 8. týdnu studie byl na hodnotě 10 mg ve SWISH, zatímco ve studii BOLERO-2 to bylo 8,6 mg [9,16]. Roztoky kortikoidů (dexametazon, prednisolon, hydrokortizon) byly využívány v prevenci a ovlivnění stomatitidy při everolimu i v rámci jiných pozorování [17–19].
Doporučení
Pozitivní zkušenosti se odrážejí i v doporučeních ESMO (European Society for Clinical Oncology) pro opatření při cílené onkologické léčbě, tedy jak pro léčbu s inhibitory mTOR, tak i jinými, včetně např. terapie EGFR inhibitory nebo VEGFR inhibitory [4]. V komplexním pohledu na celou problematiku je kladen důraz na udržování řádné hygieny dutiny ústní z důvodu zvýšeného rizika infekčních komplikací. K výplachům dutiny ústní a kloktání by měly být upřednostňovány spíše roztoky solné (poznámka autora – koncentrace není specifikována, ve studiích bývá využíván fyziologický roztok, NaCl 0,9%) než jen čistě výplachy vodou. K doporučení jsou také v rámci prevence výplachy s bikarbonátem sodným 4–6× denně (koncentrace není specifikována), přičemž v případě terapie již rozvinuté stomatitidy je doporučeno zvýšení frekvencí výplachů až každou hodinu. Pro řešení suchosti sliznic dutiny ústní lze využít žvýkačky nebo bonbony (bez cukru), přípravky nahrazující sliny nebo využití stimulantů slinné sekrece. Léčba bolesti má být řešena s ohledem na její intenzitu, lokálně s využitím výplachů s obsahem anestetik (např. viskózní roztok s 2% lidocainem), v úvahu dále připadají ochranné viskózní slizniční přípravky, lokální přípravky s obsahem nesteroidních antiflogistik (např. amlexanox 5% pasta), paracetamol nebo opioidy, vč. rychlých forem (např. fentanyl orální, nasální) dle individuální tolerance a vlhkosti sliznic. V případě vícečetných a hůře dostupných defektů sliznic jsou doporučeny výplachy roztokem dexametazonu v koncentraci 0,1 mg/ml, resp. 0,01% (tedy jako studie SWISH [16]), v případě lokalizovaného omezeného výskytu lze lokálně využít gel s klobetasolem 0,05%, případně u perzistentních aftů také místní intralezionální injekce triamcinolonu (týdně do dávky 28 mg), u vysoce pokročilých, recidivujících či jícnových aftů pak kortikoidy systémově (pulz 30–60 mg nebo 1 mg/kg prednison nebo prednisolon po dobu týdne, s postupným poklesem v týdnu dalším).
Zajištění vhodného dexametazonového roztoku k terapii nebo profylaxi stomatitidy nemusí být zcela jednoduché. Originální komerčně vyráběný přípravek používaný v rámci studie SWISH [16] není v ČR běžně dostupný a přibližně do poloviny roku 2018 nebyla k dispozici ani dobře rozpustná a v něm obsažená dexametazonová sodná sůl (dexamethasone sodium phosphate, dexamethasoni natrii phosphas). Alternativou s poměrně dobrým efektem tedy mohlo být, jako např. v rámci observační pilotní studie Onkologické a radioterapeutické kliniky FN Plzeň, využití náhradní receptury pro přípravu roztoku z originálního léčiva Dexamed inj., které rozpustnou sůl dexamethasoni natrii phosphas obsahuje [20,21]. V současné době je ale tato rozpustná sůl již v ČR k dispozici jako výchozí surovina a k profylaxi a terapii stomatitidy při everolimu nebo temsirolimu je v rámci kliniky zaveden magistraliter roztok s obsahem této soli 0,1 mg/ml (0,01%) – tedy v koncentraci odpovídající přípravku studie SWISH a doporučení k léčbě z ESMO guidelines [4]:
dexamethasoni natrii phosphas 0,013
glyceroli 85% 5,0
aqua conservans ad 100,0
Pozn.: přísada glycerolu v aktuální receptuře pro přípravu za standardních podmínek je pro ovlivnění mírné palčivosti konzervační vody (aqua conservans) volené do základu s ohledem na garanci stability mikrobiálně. Navážka základní suroviny je 0,013 g, což po přepočtení na čistý dexametazon odpovídá 0,01 g.
K dispozici jsou zavedeny v praxi i přípravky s vyšší viskozitou i koncentrací dexametazonu (1 mg/ml, resp. 0,1%), které jejich přilnavost více disponuje pro terapii lokalizovanějších lézí. Jedním z těchto přípravků je např. viskózní gel Dexagel 0,1% RSP [22] nebo také receptura používaná v MOÚ Brno:
dexamethasoni acetas 0,1
aqua purificata 93,4
syrspend SF pH 4 1,0
Další možností řešení výskytu stomatitidy je v běžné praxi (obecně jako řešení aftů dutiny ústní u onkologických pacientů) aplikace již řadu let zavedených polykomponentních suspenzí (tedy nikoliv roztoků!) s obsahem ve vodě nerozpustné soli dexamethasoni acetas a lokálního anestetika (trimecain), které jsou oblíbené pro svůj lokální efekt, dominantně anestetický, snad i terapeutický, jakkoliv nelze s ohledem na suspenzní charakter přípravku jeho působení do místa určení jednoznačně zaručit. Příkladem je zde magistraliter přípravek „Dexametazon s anestetikem na afty“ (obr. 3) v receptuře připravované např. lékárnou FN Plzeň a jinde, případně v mírně odlišných variantách:
Image 3. Dexametazon s anestetikem na afty – Lékárna FN Plzeň
(foto archiv S. Vokurka).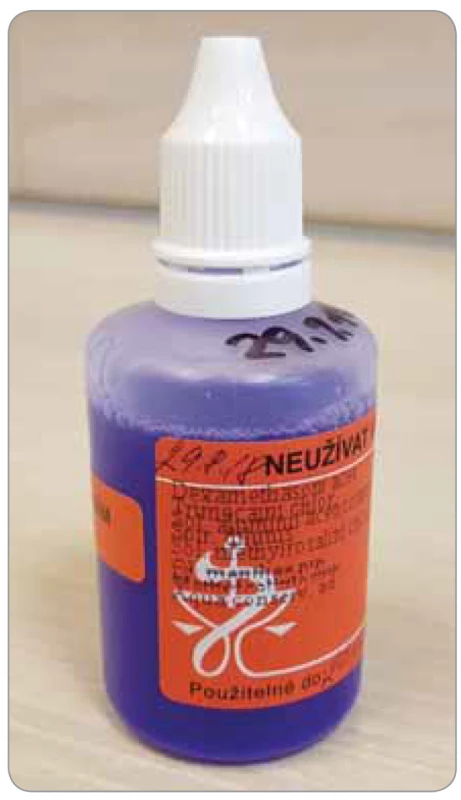
dexamethasoni acetatis 0,02
trimecaini hydrochloridum 1,0
aluminii acetotartratis sol. 5,0
ethanoli 60% 10,0
methylrosanilinii chlor. sol. 0,5% gutt. III
menthae piperitae etherol. gutt. I
methylcellulosi 0,4
aq. conservantis ad 50,0
Závěr
Stomatitidy při cílené onkologické léčbě jsou komplikací s poměrně významným výskytem a dopadem na kvalitu života pacientů, především pak v případě léčby s inhibitory mTOR. Dexametazon jako jeden ze zástupců kortikoidů má významné postavení v podpůrné léčbě těchto stomatitid, ale význam má i v jejich profylaxi, typicky pak v případě pacientek na léčbě s everolimem. Ujednocení indikací receptur a jejich standardní využívání v onkologické podpůrné praxi je stále otevřeným tématem s možností dalšího rozvíjení.
Podpořeno projektem institucionálního výzkumu
MZ ČR – FNPL, 00669806.
Supported by the grant of the Ministry of Health
of the Czech Republic - Conceptual Development
of Research Organization (Faculty Hospital
in Pilsen - FNPL, 00669806).
Autoři deklarují, že v souvislosti s předmětem
studie nemají žádné komerční zájmy.
The authors declare they have no potential
confl icts of interest concerning drugs, products,
or services used in the study.
Redakční rada potvrzuje, že rukopis práce
splnil ICMJE kritéria pro publikace zasílané do
bi omedicínských časopisů.
The Editorial Board declares that the manuscript
met the ICMJE recommendation for biomedical
papers.
prof. MUDr. Samuel Vokurka, Ph.D.
Onkologická a radioterapeutická
klinika LF UK a FN Plzeň
alej Svobody 80
323 00 Plzeň 1 – Severní Předměstí
e-mail: vokurka@fnplzen.cz
Obdrženo/Submitted: 3. 4. 2020
Přijato/Accepted: 26. 4. 2020
Sources
1. MeSH Descriptor Data 2020. [online]. National Institute of Health, US National Library of Medicine, USA. Available from: https: //meshb.nlm.nih.gov/record/ui?ui=D052016.
2. Raber-Durlacher J, Barasch A, Peterson E et al. Oral complications and management considerations in patients treated with high-dose cancer chemotherapy. Support Cancer Ther 2004; 1 (4): 219–229. doi: 10.3816/ SCT.2004.n.014.
3. Sonis S, Treister N, Chawla S et al. Preliminary characterization of oral lesions associated with inhibitors of mammalian target of rapamycin in cancer patients. Cancer 2010; 116 (1): 210-215. doi: 10.1002/cncr.24696.
4. Peterson DE, Boers-Doets CB, Bensadoun RJ et al. Management of oral and gastrointestinal mucosal injury: ESMO Clinical Practice Guidelines for diagnosis, treatment, and follow-up. Ann Oncol 2015; 26 (Suppl. 5): v139–v151. doi: 10.1093/annonc/mdv202.
5. Elting LS, Chang YC, Parelkar P et al. Risk of oral and gastrointestinal mucosal injury among patients receiving selected targeted agents: a meta-analysis. Support Care Cancer 2013; 21 (11): 3243–3254. doi: 10.1007/s00520-013-1821-8.
6. Laplante M, Sabatini DM. mTOR signaling in growth control and disease. Cell 2012; 149 (2): 274–293. doi: 10.1016/j.cell.2012.03.017.
7. Vokurka S, Hugo J. Everolimus. In: Vokurka S, Hugo J (eds). Moderní molekuly v onkologii. 1. vyd. Praha: Maxdorf 2019 : 120–123.
8. Villa A, Aboalela A, Luskin KA et al. mTOR inhibitor-associated stomatitis in hematopoietic stem cell transplant patients receiving sirolimus prophylaxis for graft-versus-host disease. Biol Blood Marrow Transplant 2015; 21 (3): 503–508.
9. Rugo HS, Pritchard KI, Gnant M et al. Incidence and time course of everolimus-related adverse events in postmenopausal women with hormone receptor-positive advanced breast cancer: insights from BOLERO-2. Ann Oncol 2014; 25 (4): 808–815. doi: 10.1093/annonc/mdu009.
10. Motzer RJ, Escudier B, Oudard S et al. Phase 3 trial of everolimus for metastatic renal cell carcinoma: final results and analysis of prognostic factors. Cancer 2010; 116 (18): 4256–4265. doi: 10.1002/cncr.25219.
11. Yao JC, Shah MH, Tetsuhide Ito et al. Everolimus for advanced pancreatic neuroendocrine tumors. N Engl J Med 2011; 364 (6): 514–523. doi: 10.1056/NEJMoa1009290.
12. Pavel ME, Hainsworth JD, Baudin E et al. Everolimus plus octreotide long‑acting repeatable for the treatment of advanced neuroendocrine tumours associated with carcinoid syndrome (RADIANT‑2): a randomised, placebo‑controlled, phase 3 study. Lancet 2011; 378 (9808): 2005–2012. doi: 10.1016/S0140-6736 (11) 61742-X.
13. Rugo HS, Hortobagyi GN, Yao J et al. Meta-analysis of stomatitis in clinical studies of everolimus: incidence and relationship with efficacy. Ann Oncol 2016; 27 (3): 519–525. doi: 10.1093/annonc/mdv595.
14. Vokurka S, Votavová M, Arnetová V et al. Everolimus v denní klinické praxi se zaměřením na problematiku postižení sliznice dutiny ústní – zkušenost onkologického centra v průběhu roku 2016. Klin Onkol 2017; 30 (Suppl 1): 195–197.
15. Souhrn údajů o přípravku, Afinitor tbl. Státní ústav pro kontrolu léčiv ČR a Evropská léková agentura. [online]. Dostupné z: https: //www.ema.europa.eu/en/documents/product-information/afinitor-epar-product-information_cs.pdf.
16. Rugo HS, Seneviratne L, Beck JT et al. Prevention of everolimus-related stomatitis in women with hormone receptor-positive, HER2-negative metastatic breast cancer using dexamethasone mouthwash (SWISH): a single-arm, phase 2 trial. Lancet Oncol 2017; 18 (5): 654–662. doi: 10.1016/S1470-2045 (17) 30109-2.
17. de Oliveira MA, Martins EMF, Wang Q et al. Clinical presentation and management of mTOR inhibitor-associated stomatitis. Oral Oncol 2011; 47 (10): 998–1003. doi: 10.1016/j.oraloncology.2011.08.009.
18. Pilotte AP, Hohos MB, Polson KM et al. Managing stomatitis in patients treated with Mammalian target of rapamycin inhibitors. Clin J Oncol Nurs 2011; 15 (5): e83–89. doi: 10.1188/11.CJON.E83-E89.
19. Jones VL, Jensen LL, McIntyre KJ et al. Evaluation of miracle mouthwash (MMW) plus hydrocortisone versus prednisolone mouth rinses as prophylaxis for everolimus-associated stomatitis: preliminary results of a randomized phase II study. [online]. Available from: https: //www.ncbi.nlm.nih.gov/pmc/articles/PMC6738305/
20. Šípová S, Vrabcová L, Živná V et al. Obecné a specifické možnosti péče o sliznice dutiny ústní pacientů při chemoterapii, radioterapii a cílené terapiu. [abstrakt]. Klin Onkol 2019; 32 (Supl 1): XII/294, 65.
21. Souhrn údajů o přípravku, Dexamed inj sol. Státní ústav pro kontrolu léčiv ČR a Evropská léková agentura. [online]. Dostupné z: http: //www.sukl.cz/modules/medication/detail.php?code=0084090&tab=texts.
22. Sklenář Z, Ščigel V (eds). Magistraliter receptura ve stomatologii. 2. vyd. Praha: Havlíček Brain Team 2013.
Labels
Paediatric clinical oncology Surgery Clinical oncology
Article was published inClinical Oncology

-
All articles in this issue
- Praktický návod pro testování a cílenou léčbu dospělých pacientů se solidními nádory s genovou fúzí NTRK v běžné klinické praxi
- Možnosti rehabilitácie pri sarkopénii a kachexii onkologických pacientov
- Stomatitidy při terapii s inhibitory mTOR a další cílené onkologické terapii, možnosti ovlivnění a význam lokální kortikoterapie
- První klinické zkušenosti v České republice s aplikací perirektálního hydrogelu před radioterapií pro karcinom prostaty
- SNHG7 a FAIM2 jsou ve tkáni kolorektálního karcinomu up-regulovány a koexprimovány
- Ukrajinská multicentrická prospektivní studie hodnoty prognostické role PET/ CT u primárních pacientů s Hodgkinovým lymfomem v kohortě z reálného života
- Dabrafenib v monoterapii u BRAF+ nemalobuněčného karcinomu plic – naše zkušenosti
- Multirezistentná oportúnna talaromykóza u pa cientky s karcinómom ovária
- Hodnocení expozice nízkým dávkám u hypofrakcionované radioterapii prsu s modulovanou intenzitou – zohlednění účinku velikosti frakce při lineárně-kvadratickém modelu
- Chemie jménem CRISPR
- Imunostimulační a protinádorový účinek extraktů z Reishi a Coriolu na úrovni klinických studií a stav jejich zavedení do praxe
- Atezolizumab a bevacizumab v léčbě hepatocelulárního karcinomu
- Aktuality z odborného tisku
- Profesor Pavel Šlampa slaví 60 let
- Clinical Oncology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Imunostimulační a protinádorový účinek extraktů z Reishi a Coriolu na úrovni klinických studií a stav jejich zavedení do praxe
- První klinické zkušenosti v České republice s aplikací perirektálního hydrogelu před radioterapií pro karcinom prostaty
- Stomatitidy při terapii s inhibitory mTOR a další cílené onkologické terapii, možnosti ovlivnění a význam lokální kortikoterapie
- Možnosti rehabilitácie pri sarkopénii a kachexii onkologických pacientov
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

