Ateroskleróza – indikátor liečby pacienta s diabetes mellitus 2. typu
Authors:
Katarína Rašlová 1,2
Authors‘ workplace:
Metabolické centrum MUDr. Kataríny Rašlovej s. r. o., Bratislava
1; Koordinačné centrum pre familiárne hyperlipoproteinémie, SZU v Bratislave
2
Published in:
AtheroRev 2021; 6(2): 90-94
Category:
Reviews
Overview
Poznatky o fyziologických a patofyziologických procesoch v regulácii hladiny glukózy prinieslo nové možnosti liečby a nové antidiabetiká: agonisty receptora glucagon-like peptide 1 (GLP1 RA) a inhibítory sodium-glukózového kotransportéra 2 (SGLT2i). Nedávno publikované prospektívne randomizované štúdie preukázali ich významné kardiovaskulárne benefity bez rizika hypoglykémie a s poklesom alebo neutrálnym efektom na hmotnosť. Výsledky týchto štúdií boli dôvodom publikovania nových odporúčaní American Diabetes Association (ADA) a European Association for Study Diabetes (EASD). Pri výbere antidiabetickej liečby dáva konsenzus ADA/EASD špeciálny dôraz práve na zníženie kardiovaskulárneho (KV) rizika a hmotnosti, nízke riziko hypoglykémie, ale aj na pokles progresie obličkových komplikácií. Postavenie metformínu ako lieku prvej línie sa nemení, lebo v súčasnosti nie sú dostatočné vedecké dôkazy o tom, že metformín nemá byť liekom prvej volby. Avšak u pacientov s veľmi vysokým KV-rizikom sa má rovno začať kombinovaná liečba SGLT2i alebo GLP1 RA spolu s metforminom.
Klíčová slova:
agonisty receptora glucagon-like peptide 1 – diabetes mellitus 2. typu – hmotnosť -hypoglykémia – inhibítory sodium-glukózového kotransportéra 2 – makrovaskulárne komplikácie
Úvod
Diabetes mellitus 2. typu (DM2T) je ochorenie, ktorého základnou patofyziologickou poruchou je inzulínová rezistencia v pečeni a svaloch a s tým súvisiace zlyhanie funkcie B-buniek pankreasu. Významnú úlohu pri vývoji DM2T predstavujú akcelerovaná lipolýza v tukovom tkanive, porucha funkcionality enteroendokrinných buniek (EEB), ktoré sa nachádzajú pozdĺž celého gastrointestinálneho traktu, alfa-bunky pankreasu, ktoré zvýšene produkujú glukagón, obličky a mozog [1].
Epidémia DM2T narastá celosvetovo a súvisí to hlavne so stúpajúcim výskytom obezity. Podľa odhadov International Diabetes Federation (IDF) do roku 2045 dosiahne počet diabetikov 2. typu 629 miliónov [2].
Nedostatočne kompenzovaný DM2T je spojený s rizikom mikrovaskulárnych komplikácií a závažný zdravotnícky problém predstavujú komplikácie makrovaskulárne. Pacienti s DM2T majú viac ako 2-násobné riziko mozgovej a 2- až 4-násobne vyššie riziko infarktu myokardu (IM) ako osoby bez diabetu [3].
Včasné zahájenie liečby u DM2T zlepšuje celkovú metabolickú kontrolu a prevenciu v rozvoji mikro- a makrovaskulárnych komplikácií [4].
Kardiovaskulárne riziko u diabetes mellitus 2. typu
Prospektívne populačné štúdie z rôznych krajín sveta presvedčivo ukázali, že DM2T možno považovať za ekvivalent ischemickej (koronárnej) choroby srdca (ICHS). Počas päťročného sledovania viac ako 91-tisíc mužov lekárov v USA mali diabetici bez potvrdenej ICHS na začiatku štúdie rovnaké riziko úmrtia z KV-príčin ako tí muži, ktorí diabetes nemali a už prekonali infarkt myokardu. Rovnaké výsledky ukázali štúdie z Fínska, Dánska a Škótska [5–8].
Komplexné informácie o vysokej KV-mortalite a morbidite u DM2T boli príčinou toho, že Food and Drug Administration (FDA) od r. 2008 žiada potvrdenie KV-bezpečnosti pre novo registrované antidiabetiká. Z toho dôvodu je povinnosťou farmaceutického priemyslu robiť morbiditno-mortalitné štúdie.
Využitie poznatkov o fyziologických a patofyziologických procesoch v regulácii hladiny glukózy prinieslo nové možností liečby a nové antidiabetiká: agonisty receptora glucagon-like peptide 1 (GLP1 RA) a inhibítory sodium-glukózového kotransportéra 2 (SGLT2i).
Nedávno publikované prospektívne randomizované štúdie preukázali ich významné KV-benefity bez rizika hypoglykémie a s poklesom alebo neutrálnym efektom na hmotnosť. Výsledky týchto štúdií boli dôvodom publikovania nových odporúčaní American Diabetes Association (ADA) a European Association for Study Diabetes (EASD). Ich konsenzus dáva špeciálny dôraz pri výbere antidiabetickej liečby práve na zníženie KV-rizika a hmotnosti, nízke riziko hypoglykémie, ale aj na pokles progresie obličkových komplikácií [9,10].
Postavenie metformínu ako prvolínovej liečby sa nezmenilo z viacerých dôvodov:
kardiovaskulárna protektivita metformínu je podporená 3 randomizovanými štúdiami a množstvom observačných dát
početné potenciálne mechanizmy účinku podporujú koncepciu kardiovaskulárnej ochrany
súčasná liečba metformínom môže zvýšiť účinok inkretínových terapií na KV-ochorenie (KVO)
metformín sa môže kombinovať s akýmkoľvek iným antidiabetikom [11]
Dve najmladšie skupiny antidiabetík GLP1 RA a SGLT2i zaraďuje konsenzus ako liečbu, ktorá by mala byť pridaná k metformínu hneď v druhej línií.
Inhibítory sodium-glukózového kotransportéra 2 (SGLT2i)
Obličky majú kľúčovú úlohu v zabezpečení homeostázy glukózy. Produkujú glukózu v procese glukoneogenézy, využívajú glukózu ako zdroj energie a v proximálnom tubule dochádza k jej spätnej reabsorbcii. Obličky filtrujú približne 180 g glukózy denne a takmer celé toto množstvo sa u zdravého človeka spätne reabsorbuje pomocou SGLT2, ktorý sa až v 90 % podieľa na spätnej reabsorbcii sodíka. SGLT2i znižujú hladinu glukózy tým, že zvyšujú jej exkréciu močom. Ich účinok závisí na koncentrácii glukózy v krvi a glumerulárnej filtrácii. Rovnomerne s účinkom liečby a tým ako poklesom hladiny glukózy v krvi dochádza tiež ku zníženiu jej vylučovania močom. Mohlo by sa tiež povedať, že SGLT2i majú samoregulujúci efekt na hladinu glukózy v krvi, čím sa vysvetľuje, prečo majú tieto lieky nízke riziko hypoglykémie [12].
Anti-aterosklerotické efekty SGLT2i sa študovali na experimentálnych modeloch ApoE-/- myši, Ldlr-/- myši a králika. Štúdie na modeli ApoE-/- myši ukázali, že kanagliflozín a empagliflozín redukovali proces aterosklerózy znížením hladiny MCP1 (Monocyte Chemoattractant Protein 1) a VCAM1 (Vascular Cell Adhesion Molecule 1), empagliflozín tiež znížil ICAM1 (Intercellular Cell Adhesion Molecule 1), TNFα (Tumor Necrosis Factor alpha ) a NADPH oxidázové subjednotky (Nicotinamide Adenine Dinucleotide PHosphat), čím sa znížila endotelová dysfunkcia.
Po liečbe empagliflozínom došlo ku zmenšeniu aterosklerotického plaku a zníženiu infiltrácie tukového tkaniva zápalovými bunkami. Ateroprotektivita sa dosiahla aj inhibíciou systému renin-aldosteron a sympatikovej aktivity [13].
Klinické štúdie, ktoré sledovali vplyv liečby SGLT2i na KV-morbiditu a mortalitu
Prospektívne štúdie s SGLT2i ukázali ich významný vplyv na zníženie rizika srdcového zlyhania a aterosklerózou podmienených kardiovaskulárnych komplikácií.
V roku 2015 boli publikované výsledky prvej štúdie s SGLT2i – EMPA-REG OUTCOME, ktorá porovnávala efekt empagliflozínu voči placebu na výskyt a úmrtnosť na KV-príhody u diabetikov 2. typu [14].
Primárnym cieľom bolo hodnotenie vplyvu liečby na KV-mortalitu, nefatálny srdcový infarkt a nefatálnu mozgovú cievnu príhodu (3P MACE), pričom empagliflozín znížil toto riziko o 14 %.
Empagliflozín v porovnaní s placebom významne znížil KVmortalitu o 38 % ako aj počet hospitalizácií z dôvodu srdcového zlyhania o 35 %. Celková mortalita v skupine pacientov liečených empagliflozínom klesla o 32 %. Táto liečba mala priaznivý efekt na pokles hmotnosti, krvného tlaku a nebola spojená s rizikom hypoglykémií.
V roku 2020 bola publikovaná zaujímavá analýza, ktorá sa pozrela na vplyv liečby empagliflozínom nielen na prvé príhody, ale na ich výskyt počas celej štúdie (4P MACE) [15]. Celkový počet príhod bol signifikantne nižší pri liečbe empagliflozínom (RR 0,78 [95% CI 0,67–0,91]; p = 0,0020), rovnako fatálny alebo nefatálny IM (RR 0,79 [95% CI 0,62–0,998]; p = 0,049;) aj kompozitný fatálny alebo nefatálny IM alebo koronárna revaskularizácia (RR 0,80 [95% CI 0,67–0,95]; p = 0,012).
Kardiovaskulárne benefity boli potvrdené tiež s kanagliflozínom v programe CANVAS [16]. Prehľad je uvedený v tab. 1.
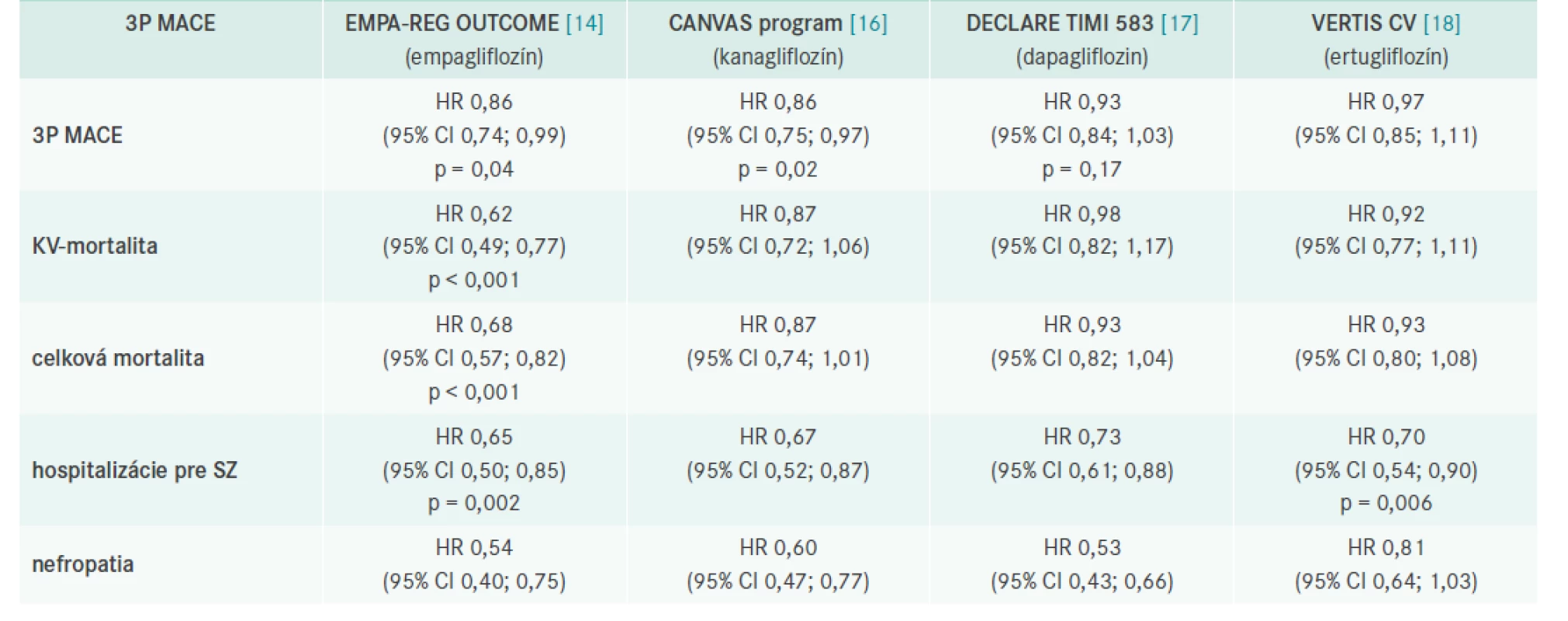
Metaanalýza 3 štúdií (EMPA-REG OUTCOME, CANVAS, DECLARE), ktorá hodnotila 34 322 pacientov, ktorej cieľom bolo analyzovať, či rozdiely v základných charakteristikách týchto štúdií sú príčinou rozdielov v účinku na KV- a obličkové ochorenia, ukázala zaujímavé výsledky. SGLT2i znížili výskyt 3P MACE o 11 % (HR 0,89 [95% CI 0,83–0,96], p = 0,0014), pričom benefit bol zistený iba u tých diabetikov, ktorí už prekonali KV-príhodu. SGLT2i znížili riziko KV mortality alebo hospitalizácie pre srdcové zlyhanie o 23 % (0,77 [0,71–0,84], p < 0,0001) avšak rovnako profitovali pacienti s manifestným KV- ochorením alebo anamnézou srdcového zlyhania ako tí, ktorí tieto príhody neprekonali. SGLT2i významne znížili progresiu renálneho ochorenia o 45 % (0,55 [0,48–0,64], p < 0,0001) bez ohľadu na výskyt KV ochorenia pri zaradení do štúdie [19].
GLP1-receptorové agonisty
GLP1-receptorové agonisty (GLP1 RA) majú mechanizmus účinku, ktorý sa zakladá na poznaní funkcie inkretínových hormónov GLP1 a GIP (inzulínotropný polypeptid závislý od glukózy). Tieto hormóny sa vylučujú z tenkého čreva ako odpoveď na príjem potravy a veľmi komplexne ovplyvňujú metabolizmus glukózy: stimulujú sekréciu a syntézu inzulínu z B-buniek pankreasu v závislosti od perorálne prijatej glukózy, spomaľujú vyprázdňovanie žalúdka a znižujú chuť do jedla ovplyvnením GLP1 v mozgu, silne inhibujú sekréciu glukagónu, stimulujú natriurézu, čo má za následok spomalenie progresie nefropatie. Prirodzený GLP1 má veľmi krátke trvanie účinku (asi 2 minúty), lebo je enzymaticky rozkladaný pomocou enzýmu dipeptidyl peptidázy 4 (DPP4). GLP1 RA napodobňujú prirodzený GLP1 a sú odolné voči DPP4 enzymatickému rozkladu [20].
Charakteristika GLP1-receptorových agonistov
Od roku 2005, kedy FDA zaregistrovala exenatid ako prvý zo skupiny GLP1 RA, pribudli rýchlo ďalšie molekuly: liraglutid, semaglutid, lixisenatid, dulaglutid a albiglutid.
Podľa dĺžky účinku sa delia GLP1 RA na molekuly s krátkym alebo dlhým účinkom. Dĺžka účinku je daná predovšetkým tým, ako je molekula podobná prirodzenému GLP1, pomalou absorpciou z miesta podania, väzbou na albumín alebo integráciou v mikrokapsulách a odolnosťou voči DPP4. Pôsobenie krátko- aj dlhopôsobiacich GLP1 RA na metabolizmus glukózy sa líši mierou účinku. Pankreas je hlavným cieľovým orgánom pre pôsobenie GLP1 RA pri liečbe DM2T. Funkčné účinky v pankrease zahŕňajú na glukóze závislé uvoľňovanie inzulínu, ktoré nastáva rýchlo po orálnom príjme potravy, ako aj zvýšenie biosyntézy inzulínu, glukokinázy a glukózových transportérov. Znížením sekrécie glukagónu dochádza ku poklesu glukoneogenézy v pečeni. Na dlhodobo efektívnej liečbe diabetu sa tiež podieľa antiapoptotický účinok, zníženie stresu v endoplazmatickom retikule, prevencia oxidatívneho stresu a zníženie toxického účinku pôsobením mastných kyselín [21].
GLP1 RA s krátkym účinkom
Do tejto skupiny GLP1 RA patria exenatid a lixisenatid.
Základom molekuly exenatidu je peptid exendin 4, ktorý bol izolovaný z jaštera Gila monster a je zložený z 39 aminokyselín. Molekula exendin 4 je v 50 % identická s ľudským GLP1. Exenatid je syntetická verzia exendinu 4. Pre krátky polčas účinku sa podáva 2-krát denne pred jedlom.
Základom molekuly lixisenatidu je exendin 4, rovnako ako u exenatidu. Molekula lixisenatidu je zložená zo 44 aminokyselín a je modifikovaná zámenou prolinu za lyzín, čím sa dosiahne významná rezistencia voči štiepeniu cestou DPP4. Preto má lixisenatid dlhší účinok ako exenatid a môže sa podávať 1-krát denne [21].
GLP1 RA s dlhým účinkom
Patria sem liraglutid, semaglutid, dulaglutid, albiglutid a exenatid QW. Molekuly prvých štyroch uvedených sú v 90–97 % homologické s prirodzeným ľudským GLP1.
Liraglutid je analóg GLP1 s 97% sekvenčnou homológiou s ľudským GLP1, ktorý sa viaže na receptor GLP1 a aktivuje ho. Profil predĺženého účinku podmieňujú predovšetkým tieto mechanizmy: samoviazanie vedúce k pomalej absorpcii, naviazanie na albumín, vyššia enzymatická stabilita voči DPP4 a neutrálnej endopeptidáze, ktorá katalyzuje degradáciu viacerých peptidových hormónov a ovplyvňuje dlhý polčas premeny v plazme [22].
Semaglutid je analóg GLP1 s 94% sekvenčnou homológiou s ľudským GLP1. Podáva sa subkutánne 1-krát týždenne. Modifikáciou molekuly GLP1 formou optimálnych mastných kyselín a väzobných kombinácií sa dosiahla dlhá a revezibilná väzba na albumín, čo umožňuje subkutánne podávanie 1-krát za týždeň [22]. V súčasnosti končia klinické štúdie s perorálne podávaným semaglutidom.
Dulaglutid je agonista receptora GLP1, ktorého molekula obsahuje 2 identické disulfidovým mostíkom spojené reťazce. Každý reťazec obsahuje modifikovanú ľudskú sekvenciu GLP1 RA, ktorá je kovalentne naviazaná na fragment ťažkého reťazca Fcy – modifikovaného ľudského imunoglobulínu IgG4 prostredníctvom malého peptidového linkera. GLP1-analógová časť dulaglutidu je približne na 90 % homologická s prirodzeným ľudským GLP1. V dôsledku týchto chemických vlastností vzniká rozpustná zmes s predĺženým polčasom 4,7 dňa, čo umožňuje jej subkutánne podávanie raz týždenne. Okrem toho bola molekula dulaglutidu navrhnutá tak, aby zabránila imunitnej odpovedi závislej od Fcγ -receptora a aby znižovala jeho imunogénny potenciál [23].
Exenatid QW má predĺžený účinok, ktorý sa dosiahol tým, že molekula exenatidu sa nachádza v mikrokapsulách, ktoré po subkutánnom podaní podliehajú spontánnej hydrolýze. Počas tohto procesu sa aktívne liečivo pomaly uvoľňuje do obehu, čím sa zabezpečuje možnosť podávania 1-krát týždenne. Exenatid QW má rovnaké farmakologické vlastnosti, ako exenatid s krátkym účinkom, čo sa potvrdilo v 8 štúdiách DURATION 1–8 [23].
Klinické štúdie, ktoré sledovali vplyv liečby GLP1 RA na KV-morbiditu a mortalitu
Liraglutid, semaglutid, albiglutid a dulaglutid – dlhoúčinkujúce GLP1 RA , ktoré boli hodnotené v prospektívnych kardiovaskulárnych štúdiách, potvrdili, že u pacientov s DM2T štatisticky významne znižujú kombinované riziko úmrtia z KV-príčin, nefatálneho infarktu myokardu a nefatálnej cievnej mozgovej príhody (3-Point Major Adverse Cardiovascular Events – 3P MACE) v porovnaní s komparátorom placebom [24–26].
Prvá KV-prospektívna štúdia s GLP1 RA liraglutidom – LEADER ukázala, že diabetici, ktorí dostali liečbu liraglutidom, mali o 13 % nižšie riziko úmrtia na KV-príhodu alebo prekonania nefatálnej srdcovej alebo mozgovej príhody ako pacienti v placebovom ramene a štatisticky významne o 22 % nižšie riziko KV-mortality [27].
Všetky CVOT (CardioVascular Outcome Trial) štúdie s GLP1 RA potvrdili KV-bezpečnosť a významný pokles glykémie a HbA1c bez rizika hypoglykémie spojený s poklesom telesnej hmotnosti (tab. 2).
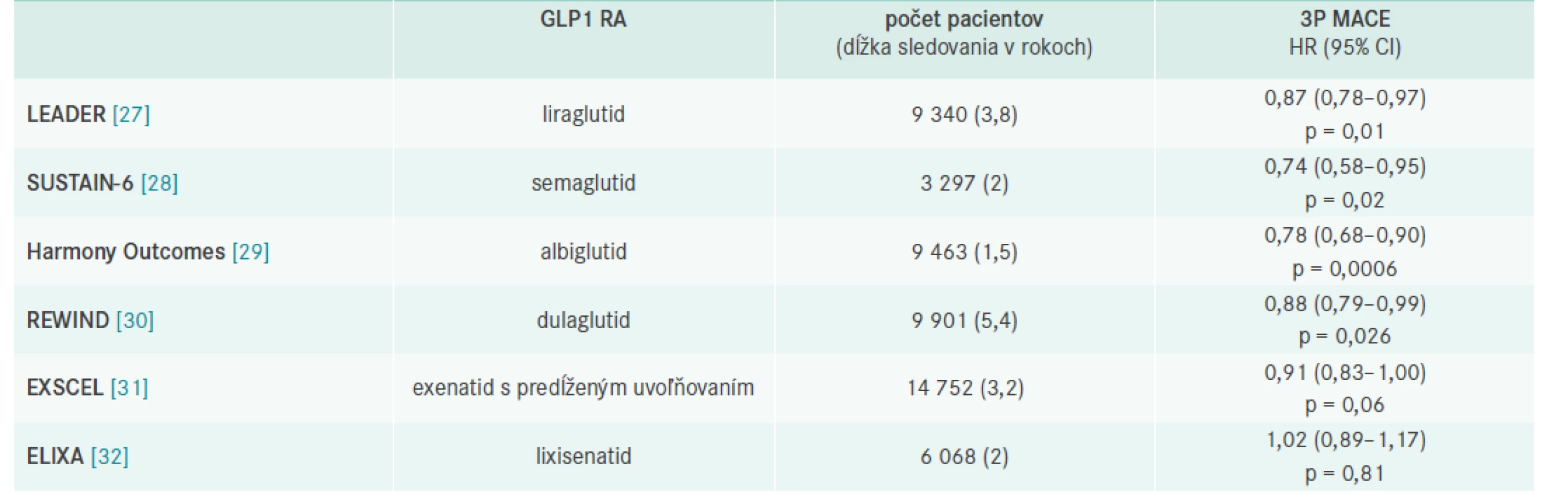
Štúdie s dlhoúčinkujúcimi GLP1 RA: LEADER (liraglutid), SUSTAIN-6 (semaglutid), REWIND (dulaglutid) a HARMONY (albiglutid) ukázali superioritu voči placebu a štatisticky významné zníženie rizika primárneho endpointu, ktorým bol 3P MACE (-13 %; -26 %; -12 % a -22 %, resp) [27–30].
Štúdie Exscel (exenatid s predlženým uvoľňovaním) a Elixa (lixisenatid) potvrdili KV-bezpečnosť [31,32]. Prehľad je uvedený v tab. 2.
Záver
Manažment DM2T predstavuje narastajúci komplex terapeutických možností, ktoré ovplyvňujú nielen glykémiu. Komplexný, ale aj individualizovaný prístup zameraný na ovplyvnenie KV-rizika je zásadnou podmienkou pre ovplyvnenie komplikácií DM a kvalitu života pacienta. CVOT-študie s SGLT2i a GLP1 RA pridávali skúšanú liečbu ku antidiabetickej teraHR pii (ak nebol konkrétny liek exklúznym kritériom) a väčšina pacientov užívala ICAM1 metformín. Konsenzy ADA/EASD 2018, 2019 a ESC guidelines 2019 sa líšia v názoroch autorov k tomu, či má byť metformín stále liekom prvej línie, alebo to majú byť nové skupiny antidiabetík s potvdreným KV-benefitom. Tieto postoje sú predmetom bohatých a inšpiratívnych diskusií, lebo v súčasnosti nie sú dostatočné EBM o tom, že metformín nemá byť liekom prvej volby. Avšak konsenzus ADA/EASD hovorí o tom, že u pacientov s veľmi vysokým KV-rizikom sa má rovno začať kombinovaná liečba SGLT2i alebo GLP1 RA spolu s metformínom.
doc. MUDr. Katarína Rašlová, CSc.
www.szu.sk
Doručeno do redakce | Doručené do redakcie | Received 9. 5. 2021
Přijato po recenzi | Prijaté po recenzii | Accepted 2. 6. 2021
Sources
1. DeFronzo RA. Banting Lecture. From the triumvirate to the ominous octet: a new paradigm for the treatment of type 2 diabetes mellitus. Diabetes 2009; 58(4): 773–795. Dostupné z DOI: .
2. IDF Diabetes Atlas. 8th Edition 2017. Dostupné z WWW: .
3. Informace dostupné z WWW: .
4. Ray KK, Wilde MI, Sivakumaran R et al. Effect of intensive control of glucose on cardiovascular outcomes and death in patients with diabetes mellitus: a meta-analysis of randomised controlled trials. Lancet 2009; 373(9677): 1765–1772. Dostupné z DOI: .
5. Lotufo PA, Gaziano JM, Chae CU et al. Diabetes and all-cause and coronary heart disease mortality among US male physicians. Arch Intern Med 2001; 161(2): 242–247. Dostupné z DOI: .
6. Juutilainen A, Lehto S, Rönnemaa T et al. Type 2 diabetes as a „coronary heart disease equivalent“: an 18-year prospective population-based study in Finnish subjects. Diabetes Care 2005; 28(12): 2901–2907. Dostupné z DOI: .
7. Schramm T K, Gislason GH, Køber L et al. Diabetes patients requiring glucose- lowering therapy and nondiabetics with a prior myocardial infarction carry the same cardiovascular risk: a population study of 3.3 million people. Circulation 2008; 117(15): 1945–1954. Dostupné z DOI: .
8. Whiteley L, Padmanabhan S, Hole D et al. Should diabetes be considered a coronary heart disease risk equivalent?: results from 25 years of follow-up in the Renfrew and Paisley survey. Diabetes Care 2005; 28(7): 1588–1593. Dostupné z DOI: .
9. Davies MJ, D‘Alessio DA, Fradkin J et al. Management of Hyperglycaemia in Type 2 Diabetes, 2018. A Consensus Report by the American Diabetes Association (ADA) and the European Association for the Study of Diabetes (EASD). Diabetes Care 2018; 41(12): 2669–2701. Dostupné z DOI: .
10. Buse JB, Wexler DJ, Tsapas A et al. 2019 Update to: Management of Hyperglycemia in Type 2 Diabetes, 2018. A Consensus Report by the American Diabetes Association (ADA) and the European Association for the Study of Diabetes (EASD). Diabetes Care 2020; 43(2): 487–493. Dostupné z DOI: .
11. Zilov AV. Mechanisms of action of metformin with special reference to cardiovascular protection. Diabetes Metab Res Rev 2019; 35(7): e3173. Dostupné z DOI: .
12. Norton I, Shannon CE, Fourcaudot M et al. Sodium glucose transporter an d glucose transporter expression in the kidney. of type 2 diabetic subjects. Diabetes Obes Metab 2017; 19(9): 1322–1326. Dostupné z DOI: .
13. Liu Z, Ma X, Ilyas I et al. Impact of sodium glucose cotransporter 2 (SGLT2) inhibitors on atherosclerosis: from pharmacology to pre-clinical and clinical therapeutics. Theranostics 2021; 11(9): 4501–4515. Dostupné z DOI: .
14. Zinman B, Wanner C, Lachin JM et al. Empagliflozin, cardiovascular outcomes, and mortality in type 2 diabetes. N Engl J Med 2015; 373(22): 2117–2128. Dostupné z DOI: .
15. McGuire DK , Zinman B, Inzucchi SE et al. Effects of empagliflozin on first and recurrent clinical events in patients with type 2 diabetes and atherosclerotic cardiovascular disease: a secondary analysis of the EMPA-REG OUTCOME trial. Lancet Diabetes Endocrinol 2020; 8(12): 949–959. Dostupné z DOI: .
16. Neal B, Perkovic V, Mahaffey KW et al. Canagliflozin and cardiovascular and renal events in type 2 diabetes. N Engl J Med 2017; 377(7): 644–657. Dostupné z DOI: .
17. Wiviott SD, Raz I, Marc P. Bonaca MP et al. [DECLARE–TIMI 58 Investigators]. Dapagliflozin and Cardiovascular Outcomes in Type 2 Diabetes. N Engl J Med 2019; 380(4): 347–357. Dostupné z DOI: .
18. Cannon CP, Pratley R, Dagogo-Jack S et al. for the VERTIS CV Investigators. Cardiovascular Outcomes with Ertugliflozin in Type 2 Diabetes. N Engl J Med 2020; 383(15): 1425–1435. Dostupné z DOI: .
19. Zelniker TA, Wiviott SD, Raz I et al. et al. SGLT2 inhibitors for primary and secondary prevention of cardiovascular and renal outcomes in type 2 diabetes: a systematic review and meta-analysis of cardiovascular outcome trials. Lancet 2019; 393(10166): 31–39. Dostupné z DOI: .
20. Smith EP, An Z, D’Alessio DA et al. The role of β cell glucagon-like peptide- 1 signaling in glucose regulation and response to diabetes drugs. Cell Metab 2014; 19(6): 1050–1057. Dostupné z DOI: .
21. Drucker DJ. Mechanisms of Action and Therapeutic.Application of Glucagon- like Peptide-1. Cell Metabolism 27(4); 2018: 740–756. Dostupné z DOI: .
22. Knudsen LB and Lau J. The Discovery and Development of Liraglutide and Semaglutide. Front Endocrinol (Lausanne) 2019; 10: Article 155. Dostupné z DOI: .
23. Cornell S. A review of GLP-1 receptor agonists in type 2 diabetes: A focus on the mechanism of action of once-weekly agents J Clin Pharm Ther 2020; 45(Suppl 1): 17–27. Dostupné z DOI: .
24. Schubert M, Hansen S, Leefmann J et al. Repurposing Antidiabetic Drugs for Cardiovascular Disease. Front Endocrinol (Lausanne) 2020; 11: Article 568632. Dostupné z DOI: .
25. Kristensen SL, Rorth R, Jhund PS et al. Cardiovascular, mortality, and kidney outcomes with GLP-1 receptor agonists in patients with type 2 diabetes: a systematic review and meta-analysis of cardiovascular outcome trials. Lancet Diabetes Endocrinol 2019; 7(10): 776–785. Dostupné z DOI: .
26. Drucker DJ. The ascending GLP-1 road from clinical safety to reduction of cardiovascular complications. Diabetes 2018; 67(9): 1710–1719. Dostupné z DOI: .
27. Marso SP, Daniels GH, Brown-Frandsen K et al. Liraglutide and cardio- vascular outcomes in type 2 diabetes. N EnglJMed 2016; 375(4): 311–322. Dostupné z DOI: .
28. Marso SP, Bain SC, Consoli A et al. Semaglutide and cardiovascular outcomes in patients with type 2 diabetes. N Engl J Med 2016; 375(19): 1834–1844. Dostupné z DOI: .
29. Hernandez AF, Green JB, Janmohamed S et al. [Harmony Outcomes committees and investigators]. Albiglutide and cardiovascular outcomes in patients with type 2 diabetes and cardiovascular disease (Harmony Outcomes): a double-blind, randomised placebo-controlled trial. Lancet 2018; 392(10157): 1519–1529. Dostupné z DOI: .
30. Gerstein HC, Colhoun HM, Dagenais GR et al. Dulaglutide and cardiovascular outcomes in type 2 diabetes (REWIND): a double-blind, randomised placebo- controlled trial. Lancet 2019; 394(10193): 121–130. Dostupné z DOI: .
31. Holman RR, Bethel MA, Mentz RJ et al. [EXCEL Study group]. Effects of Once-Weekly Exenatide on Cardiovascular Outcomes in Type 2 Diabetes. N Engl J Med; 2017; 377(13): 1228–1239. Dostupné z DOI: .
32. Marc A. Pfeffer, M.D., Ph.D., Brian Claggett, Ph.D., Rafael Diaz, M.D., et al. for the ELIXA Investigators. Lixisenatide in Patients with Type 2 Diabetes and Acute Coronary Syndrome. N Engl J Med 2015; 373(23): 2247–2257. Dostupné z DOI: .
Labels
Angiology Diabetology Internal medicine Cardiology General practitioner for adultsArticle was published in
Athero Review

2021 Issue 2
Most read in this issue
- Pohybová aktivita v léčbě a prevenci se zaměřením na rizikové faktory kardiovaskulárních onemocnění
- Inhibitory SGLT2 a ateroskleróza na pozadí účinků gliflozinů u srdečního selhání
- Číslo LDL žije!
- Inzulinová rezistence a její ovlivnění v klinické praxi
