-
Články
Top novinky
Reklama- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
Top novinky
Reklama- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Top novinky
ReklamaBezpečnost tofacitinibu u ulcerózní kolitidy – sdružené výsledky 6 studií
7. 12. 2023
Na výročním sjezdu Americké gastroenterologické společnosti (ACG) v říjnu 2023 v kanadském Vancouveru byly prezentovány výsledky finální analýzy bezpečnosti tofacitinibu v léčbě ulcerózní kolitidy z programu klinických studií zahrnujícího 1157 pacientů s délkou expozice této terapii až 9,2 roku.
Úvod
Tofacitinib je inhibitor Janusových kináz (JAK) indikovaný mimo jiné u pacientů s ulcerózní kolitidou (UC). Jeho bezpečnost v léčbě tohoto zánětlivého onemocnění byla hodnocena v programu klinických studií, které zahrnovaly 8týdenní studii indukční léčby fáze II, dvě shodné 8týdenní studie indukční léčby fáze III (OCTAVE Induction 1 a 2), roční studii udržovací léčby fáze III (OCTAVE Sustain), nezaslepené prodloužení studie udržovací léčby (OCTAVE Open) a studii fáze IIIb/IV (RIVETING).
InzerceMetodika analýzy a hodnocená populace
Data o bezpečnosti tofacitinibu u pacientů s UC byla analyzována u kohort pacientů v udržovací léčbě a u celkových kohort. Jednalo se o 6 skupin: U pacientů v kohortě s udržovací léčbou byla porovnávána bezpečnost při léčbě tofacitinibem 5 mg 2× denně (1) nebo 10 mg 2× denně (2) oproti placebu (3). V celkové kohortě byla hodnocena bezpečnost tofacitinibu v převažující dávce 5 mg 2× denně (průměrná denní dávka < 15 mg) (4), v převažující dávce 10 mg 2× denně (průměrná denní dávka ≥ 15 mg) (5) a souhrnně u všech pacientů léčených 5 či 10 mg 2× denně (6) ve studiích fáze II, III, v nezaslepeném prodloužení a ve fázi IIIb/IV.
Celková kohorta zahrnovala pacienty s mediánem délky sledování 1,7 roku (průměr 2,8 roku, rozmezí 1 den až 9,2 roku). Déle než 2 roky užívalo tofacitinib 47,7 % pacientů a dávku 10 mg 2× denně užívalo 81,1 % všech zařazených. Parametry jako průměrný věk, celkové průměrné skóre Mayo, délka trvání UC i podíl pacientů s předchozím selháním léčby inhibitorem TNF-α, s předchozím užíváním imunosupresivní léčby a s užíváním kortikosteroidů při vstupu do studie byly v jednotlivých skupinách podobné.
Výsledná zjištění
Výskyt nežádoucích příhod
Výskyt nežádoucích příhod, jednotlivých nejčastějších nežádoucích příhod, závažných nežádoucích příhod a podíl pacientů s vysazením léčby z důvodu nežádoucích příhod je shrnut v následující tabulce. Nejčastějšími nežádoucími příhodami při léčbě tofacitinibem byly zhoršení UC, nazofaryngitida a artralgie.
Tab. Výskyt nežádoucích příhod ve studiích s tofacitinibem v léčbě ulcerózní kolitidy dle hodnocené terapie
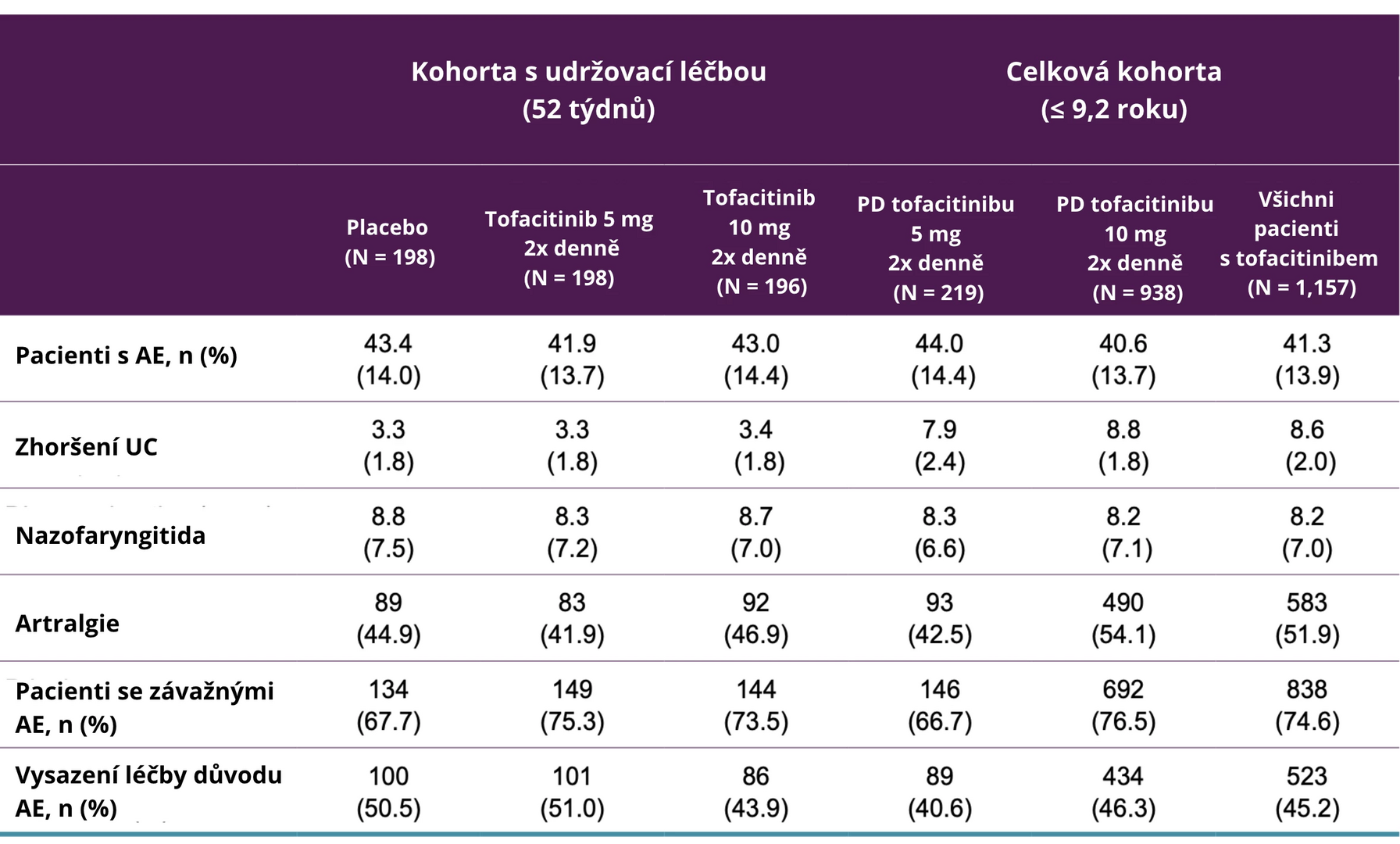
Pozn.: AE – nežádoucí příhoda; PD – převažující dávka; UC – ulcerózní kolitida.
Výskyt nežádoucích příhod zvláštního významu
Incidence nežádoucích příhod zvláštního významu (infekce, malignity, gastrointestinální perforace, velké nežádoucí kardiovaskulární příhody a tromboembolie) v kohortě s udržovací léčbou a v celkové kohortě je znázorněna na obrázku níže. V celkové kohortě byl výskyt nežádoucích příhod zvláštního významu s výjimkou závažných infekcí a všech infekcí herpes zoster obecně < 1 případ na 100 pacientoroků expozice. Výskyt těchto nežádoucích příhod zůstával stabilní během pokračující léčby až po dobu 9,2 roku.
Obr. Incidence nežádoucích příhod zvláštního významu na 100 pacientoroků expozice tofacitinibu
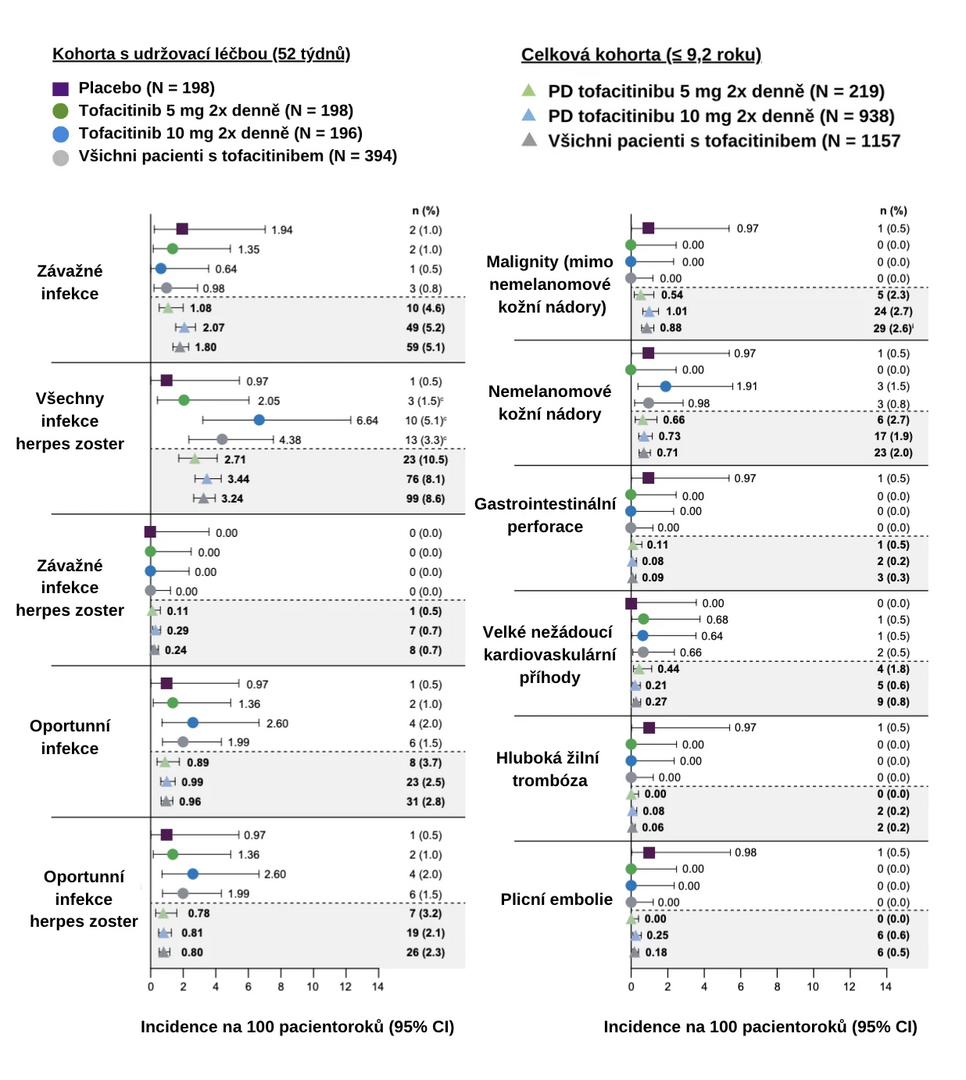
Pozn.: CI – interval spolehlivosti; PD – převažující dávka.
Fatální nežádoucí příhody
Při léčbě tofacitinibem došlo k 8 případům úmrtí, přičemž každé z nich mělo jinou příčinu: akutní myeloidní leukémie (po 347 dnech léčby tofacitinibem), disekce aorty (po 31 dnech), srdeční zástava při karcinomu plic (po 1725 dnech), pneumonie a respirační selhání při infekci COVID-19 (po 2342 dnech), angiosarkom jater (po 187 dnech), maligní melanom (po 1359 dnech), metastatický kolorektální karcinom (po 2124 dnech) a plicní embolie při cholangiokarcinomu (po 378 dnech).
Limitace
Při interpretaci těchto výsledků je třeba mít na paměti, že v celkové kohortě jsou zahrnuti pacienti se změnou dávky tofacitinibu, a chybí tedy analýza bezpečnosti v závislosti na dávce léčiva. Celková expozice tofacitinibu byla navíc při dávce 10 mg 2× denně 3násobná v porovnání s dávkou 5 mg 2× denně.
Závěr
Bezpečnostní profil tofacitinibu v léčbě pacientů s UC odpovídá poznatkům získaným u jiných indikací tohoto léčiva a údajům sesbíraným při používání v reálné klinické praxi.
(zza)
Zdroj: Panés J., D’Haens G. R., Sands B. E. et al. P3632 Tofacitinib for the treatment of ulcerative colitis: up to 9.2 years of safety data from the global clinical program. ACG 2023 Annual Scientific Meeting, Vancouver, 2023 Oct 20–25.
Líbil se Vám článek? Rádi byste se k němu vyjádřili? Napište nám − Vaše názory a postřehy nás zajímají. Zveřejňovat je nebudeme, ale rádi Vám na ně odpovíme.
Štítky
Dětská gastroenterologie Gastroenterologie a hepatologie
Nejčtenější tento týden Celý článekPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



