-
Články
Top novinky
Reklama- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
Top novinky
Reklama- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Top novinky
ReklamaSkúsenosti s liečbou hepatoblastómu u najmenších detí – využitie predoperačnej 3D virtuálnej analýzy MeVis pri resekciách pečene
Experience with hepatoblastoma treatment in small children – the use of preoperative 3D virtual analysis MeVis for liver resections
Introduction:
Hepatoblastoma is an uncommon but most frequent liver cancer in infants and children. The therapy is complex, including neoadjuvant, surgical, and adjuvant therapy. For surgery, the presence of a specialized surgeon and an anaesthesiologist is required. For planning the surgery, the 3D analysis MeVis is currently available. The objective of the work is the assessment of a group of children operated for a liver hepatoblastoma and the assessment of contribution of a pre-surgery virtual 3D analysis MeVis for a surgeon.Methods:
It represents a retrospective assessment of the operated children for the given diagnosis. Upon confirming the disease, the patients underwent neoadjuvant therapy, and then the MeVis analysis of a liver, a surgery, and an adjuvant therapy. The oncologic treatment was performed according to the SIOPEL recommendations.Results:
In the period of 2012 to 2016, we treated 5 infant patients with the diagnosed hepatoblastoma. The children were at the age between 4 and 37 months, 4 girls, 1 boy. The size of tumours according to the SIOPEL classification was PRETEXT II to IV. All children underwent a surgery without any complications and without any signs of post-operative failure of the post-resection remnant of the liver. The functional volume of the post-resection remnant of the liver was between 28%−70% according to the MeVis analysis. During the long-term monitoring, one patient underwent lung metastasectomy, all children are currently without any signs of relapse of the disease.Conclusion:
In case of quick catching and correct management of a hepatoblastoma, the results of therapy are very good. For successful treatment, a surgeon experienced in liver resection, presence of a specialized paediatric anaesthesiologist, and a paediatric oncologist are is required. The exact volumetric analysis MeVis is a contribution for a pre-operational review of the finding, and for the preparation of the surgery. The disease is uncommon, and therefore, the groups of patients are small. Due to that reason, the treatment should be centralized to a specialized department.Key words:
hepatoblastoma − MeVis − volumetry − liver resection
Autoři: J. Janek 1; P. Bician 2; P. Kenderessy 3; P. Kothaj 1; K. Novotná 4; J. Koňarčík 5; Ľ. Laca 6; J. Ulianko 1; I. Dedinská 6
Působiště autorů: Chirurgická klinika SZU, FNsP F. D. Roosevelta, Banská Bystrica prednosta: prof. MUDr. P. Kothaj, CSc 1; Klinika pediatrickej onkológie a hematológie SZU, DFN Banská Bystrica prednosta: MUDr. E. Bubanská, PhD 2; The Harley Street Clinic, Children’s Hospital, London clinical lead: Dr. D. Inwald, MB BChir MRCP FRCPCH PhD 3; Rádiologické oddelenie, FNsP F. D. Roosevelta, Banská Bystrica primár: MUDr. S. Okapec 4; Martinské bioptické centrum s. r. o. vedúci pracoviska: Prof. MUDr. L. Plank, CSc 5; Chirurgická klinika a transplantačné centrum, FN Martin prednosta: prof. MUDr. L. Laca, PhD 6
Vyšlo v časopise: Rozhl. Chir., 2017, roč. 96, č. 1, s. 25-33.
Kategorie: Původní práce
Souhrn
Úvod:
Hepatoblastóm je raritný, ale najčastejší nádor pečene detského veku. Liečba je komplexná, zahŕňa neoadjuvantnú, chirurgickú a adjuvantnú liečbu. Nevyhnutná je prítomnosť špecializovaného chirurga a anesteziológa pre samotný chirurgický výkon. Pre chirurgické plánovanie operácie je v súčasnosti k dispozícii 3D analýza MeVis. Cieľom práce je vyhodnotenie súboru operovaných detí pre hepatoblastóm pečene a vyhodnotenie prínosu predoperačnej virtuálnej 3D analýzy MeVis pre chirurga.Metóda:
Ide o retrospektívne zhodnotenie operovaných detí pre danú diagnózu. Pacienti po potvrdení ochorenia absolvovali neoadjuvantnú liečbu, následne MeVis analýzu pečene, chirurgický výkon a adjuvantnú liečbu. Onkologická liečba prebiehala podľa doporučení SIOPEL.Výsledky:
V období rokov 2012 až 2016 sme liečili 5 detských pacientov s diagnostikovaným hepatoblastómom. Išlo o deti vo veku 4 až 37 mesiacov, 4 dievčatá, 1 chlapec. Rozsah tumoru bol podľa SIOPEL klasifikácie PRETEXT II až IV. Všetky deti absolvovali samotný chirurgický výkon bez komplikácií a bez známok pooperačného zlyhávania postresekčného zvyšku pečene. Funkčný objem postresekčného zvyšku pečene sa pohyboval v rozmedzí 28−70 % podľa MeVis analýzy. V dlhodobom sledovaní sa jeden pacient podrobil pľúcnej metastazektómii, všetky deti sú v súčasnosti bez známok relapsu ochorenia.Záver:
Pri rýchlom záchyte a správnom manažmente hepatoblastómu sú výsledky liečby veľmi dobré. Pre úspech liečby sú nevyhnutné skúsenosti chirurga s resekčnou liečbou pečene, prítomnosť špecializovaného detského anesteziológa a detského onkológa. Exaktná volumetrická analýza MeVis je prínosom pre predoperačné zhodnotenie nálezu a prípravu operácie. Ochorenie je raritné, preto aj súbory pacientov sú malé. Z tohto dôvodu je žiadúce liečbu centralizovať na špecializované pracovisko.Kľúčové slová:
hepatoblastóm − MeVis − volumetria − resekcia pečeneÚvod
Hepatoblastóm je raritný nádor pečene, z pohľadu nádorov pečene u detí je však najčastejší. Predstavuje 91 % všetkých detských nádorov pečene. Príčiny vzniku nádorov pečene u detí nie sú známe, hepatoblastóm sa najčastejšie vyskytuje v súvislosti s niektorými genetickými poruchami. Nádorový marker, ktorým sledujeme odpoveď na liečbu a rekurenciu ochorenia, je α-fetoproteín. V liečbe nádorov pečene má zásadný význam kompletná chirurgická resekcia, úlohou chemoterapie je zmenšenie nádoru tak, aby bol resekabilný. U nálezov, ktoré sú rozsiahle, centrálne lokalizované a neresekabilné, dáva šancu na vyliečenie transplantácia pečene [1]. Nevyhnutným predpokladom úspešnej liečby je exaktná znalosť segmentálnej anatómie pečene, vyhodnotenie vzťahu nádoru k ostatným štruktúram pečene a kalkulácia objemu postresekčného zvyšku pečene. V súčasnej dobe počítačových technológií je významným prínosom pre chirurga spracovanie CT nálezu s následným vytvorením trojdimenzionálneho modelu pečene, nádoru a všetkých priľahlých štruktúr, vrátane stanovenia objemu ponechanej pečene po resekcii FRL (Future Remnant Liver). Cieľom práce je retrospektívne zhodnotenie súboru operovaných detí pre hepatoblastóm pečene a vyhodnotenie prínosu predoperačnej virtuálnej 3D analýzy MeVis pre chirurga.
Metóda
Detskí pacienti s hmatnou rezistenciou v dutine brušnej boli primárne diagnostikovaní pomocou ultrasonografie s následným potvrdením nádoru pečene pomocou CT vyšetrenia (Obr. 1). Na histologické potvrdenie diagnózy sa vykonal odber tkaniva nádoru z minilaparotómie v celkovej anestézii. Po získaní výsledku bola začatá neoadjuvantná liečba podľa protokolu SIOPEL. V skupine standard risk (SIOPEL 6) cisplatinou v dávke 80 mg/m2 (4 dávky), v skupine high risk (SIOPEL 4) dvojkombináciou cisplatina 70 mg/m2 (8 dávok) +doxorubicín 30mg/m2 (6 dávok). Po ukončení neoadjuvantnej liečby bolo vykonané kontrolné CT vyšetrenie podľa protokolu MeVis (DICOM formát, hrúbka rezov 0,8−1,5 mm, rozlíšenie 512x512, odporúčané množstvo kontrastnej látky, oneskorenie skenovania pre arteriálnu, venóznu a biliárnu fázu). Po získaní volumetrickej analýzy s resekčnými návrhmi z MeVis Medical Solutions AG bol naplánovaný chirurgický výkon. Základnou podmienkou okrem resekability nálezu bola úprava koagulačných parametrov a krvného obrazu tesne pred operáciou. Pre úspech operácie bola nevyhnutná špecializovaná pediatrická anestézia s komplexným monitoringom. Na peroperačnú detekciu tkanivovej perfúzie bol použitý NIRS (Near Infrared Spectroscopy) s centrálnou sondou na frontálnom laloku a periférnou sondou na svalovej skupine ramena, ktoré boli kalibrované po úvode do anestézie voči parametru saturácie krvi vo vena cava superior − VCS. Ako vazodilatačný komponent znižovania prietoku cez VCI bol použitý hrudný epidurálny katéter a hlavná hypnotická zložka anestézie sevofluran. Umiestenie epidurálneho katétra, ako aj inzercia centrálneho venózneho katétra (CVK), bola vždy sonograficky verifikovaná, CVK bol vždy umiestnený do VCS. Hemodynamické zmeny spôsobené krvnými stratami, manipuláciou s pečeňou a dolnou dutou žilou boli vyhodnocované z informácií od operatéra, NIRS, TEE (1x) a štandardného monitoringu ako je EKG, pulzná oxymetria a invazívny tlak krvi. Presnou komunikáciou medzi chirurgom a anestéziológom sa predchádzalo zbytočnej indikácii objemovej tekutinovej terapie. Podobne sa reagovalo na krvné straty počas výkonu, ktoré sa kumulovali hlavne do krátkej fázy resekcie tkaniva pečene. Jednotlivé krvné deriváty boli hradené v pomere zodpovedajúcom plnej krvi 2 : 2:1 s cieľom zabrániť dilúcii krvných faktorov zrážania. Presnosť tohoto procesu bola kontrolovaná tromboelastogramom, nebola zaznamenaná žiadna hyperfibrinolytická reakcia a preto fibrinolytiká neboli štandardne podávané. Chirurgický prístup do dutiny brušnej bol vykonaný z rozšírenej pravostrannej subkostálnej laparotómie. Nasledovala mobilizácia pečene, cholecystektómia a preparácia štruktúr v oblasti hilárnej platne, vo všetkých prípadoch boli disekované štruktúry triád s prerušením artérie a vény; žlčové cesty boli prerušené počas transekcie parenchýmu. Ani u jedného pacienta nebol potrebný predný prístup z dôvodu veľkosti a sťaženej mobilizácie pravého laloka. Po vyfarbení resekčnej línie nasledovalo peroperačné ultrasonografické potvrdenie priebehu hepatálnych žíl. Samotná transekcia pečene bola urobená pomocou CUSA s klipovaním malých ciev a žlčovodov. V tejto fáze bola použitá na kontrolu krvácania 2x selektívna vaskulárna exklúzia – SVE (oklúzia inflow na pravej vena portae a arteria hepatica, oklúzia outflow na pravej vena hepatica) a 1x Pringle manéver 13 minút. Anestézia bola vedená vždy s kontrolovaným nízkym prietokom cez dolnú dutú žilu. Resekčná plocha bola ošetrená hemostatickou fibrínovou penou TachosilTM (Obr. 2). Všetci takto manažovaní pacienti boli extubovaní krátko po výkone na operačnom stole, krátkodobý inotropný suport bol vo všetkých prípadoch ukončený počas sutúry brušnej steny. Tesne po operácii bola vykonaná ultrasonografická kontrola prietokov v postresekčnom zvyšku pečene (vena portae, arteria hepatica, vv. hepaticae). V pooperačnom období boli aj v tejto vekovej kategórii uplatňované princípy ERAS (Enhanced Recovery After Surgery). Všetci pacienti boli v bezprostrednom pooperačnom období na tekutinovom reštrikčnom režime s epidurálnou anestéziou. Vzhľadom na možnú toxicitu lokálnych anestetík pri nízkej hladine albumínu sme tento udržiavali substitúciou na normálnej hladine, čo čiastočne znemožňovalo posudzovanie funkčnosti reziduálneho pečeňového parenchýmu, na tento účel sme preto používali hladinu koagulačných faktorov pochádzajúcich z pečene. U všetkých pacientov bol zahájený enterálny príjem minimálne do 12 hodín, ktorý dobre tolerovali. Prepustení boli z oddelenia JIS po 72 hodinách po extrakcii epidurálneho katétra. Po úspešnom absolvovaní operácie a po normalizácii pečeňových funkcií pokračovala adjuvantná liečba podľa SIOPEL doporučenia. V skupine standard risk cisplatina 80 mg/m2 (2 dávky), v skupine high risk carboplatina AUC 6,6 mg/ml. min (3 dávky) + doxorubicín 20 mg/m2 (6 dávok). U pacientky č. 2 po pľúcnej metastazektómii nasledovali 4 cykly irinotecanom 20 mg/m2. Po ukončení liečby sú v dlhodobom pooperačnom priebehu sledované hladiny α-fetoproteínu prvý rok každý mesiac, RTG hrudníka každé 3 mesiace, kontrolná ultrasonografia každé 3 mesiace. V prípade podozrenia rekurencie ochorenia na základe nálezu predchádzajúcich vyšetrení bolo indikované kontrolné CT vyšetrenie.
Obr. 1. Obrovský hepatoblastóm pravého laloka pečene na CT, pacient č. 3 Fig. 1 Huge hepatoblastoma of liver right lobe on CT, patient No. 3 
Výsledky
V období rokov 2012 až 2016 sme vo Fakultnej nemocnici F. D. Roosevelta v spolupráci s Detskou fakultnou nemocnicou v Banskej Bystrici liečili 5 detských pacientov s diagnostikovaným hepatoblastómom. Diagnóza bola potvrdená z bioptickej vzorky odobratej z mini laparotómie na začiatku liečby. Tento výkon nebol ani raz komplikovaný krvácaním, prebehol bez nutnosti podania krvnej transfúzie. Histopatologicky bol 3x prítomný epiteliálny typ a 2x zmiešaný. Anaplastický subtyp hepatoblastómu nebol prítomný. Jedno dieťa malo extrahepatálne pľúcne postihnutie v čase diagnózy (Tab. 1). Išlo o deti vo veku 2,5 až 37 mesiacov, 4 dievčatá, 1 chlapec. Rozsah tumoru bol podľa SIOPEL klasifikácie PRETEXT II až IV (Tab. 2). Všetky deti sa podrobili neoadjuvantnej a následne po resekcii adjuvantnej terapii. U všetkých detí došlo počas neoadjuvantnej liečby k významnej objemovej regresii nádoru od 11 % do 84 % (Tab. 4). U 4 pacientov bol operačný výkon naplánovaný podľa virtuálnej 3D MeVis analýzy, ktorá poskytla exaktný obraz o lokalizácii nádoru a jeho vzťahu k vitálnym štruktúram pečene (Obr. 6−9) Objem postresekčného zvyšku pečene − FRL bol v rozmedzí 24 %−42 %. Funkčný objem postresekčného zvyšku - fFRL sa pohyboval v rozmedzí 28 % až 70 %. U všetkých detí bola urobená radikálna chirurgická liečba s kompletným odstránením nádoru, 1x pravostranná hemihepatektómia + segmentektómia III, 2x pravostranná hemihepatektómia, 2x pravostranná trisectionektómia (Tab. 2). Ani u jedného z pacientov nedošlo k zlyhaniu postresekčného zvyšku pečene, syntéza koagulačných parametrov a hladiny bilirubínu sa normalizovali v priebehu dvoch dní. Biliárny leak po resekcii ani krvácanie z transekčnej plochy neboli prítomné. V prípade použitia Pringle manévera u pacienta č. 5 nedošlo ku rozvoju kongescie čreva s rýchlym pooperačným nástupom peristaltiky s možnosťou skorej perorálnej realimentácie. V dlhodobom sledovaní bola u jedného dieťaťa vykonaná pľúcna metastazektómia 27 mesiacov po skončení liečby s následným podaním 4 cyklov irinotecan. Toto dieťa je v druhej kompletnej remisii, ktorá trvá viac ako 10 mesiacov. Ostatní štyria pacienti sú bez známok relapsu ochorenia 9−51 mesiacov od ukončenia liečby tiež v kompletnej remisii.
Tab. 1. Charakteristika nádorov Tab. 1: Tumours characteristics 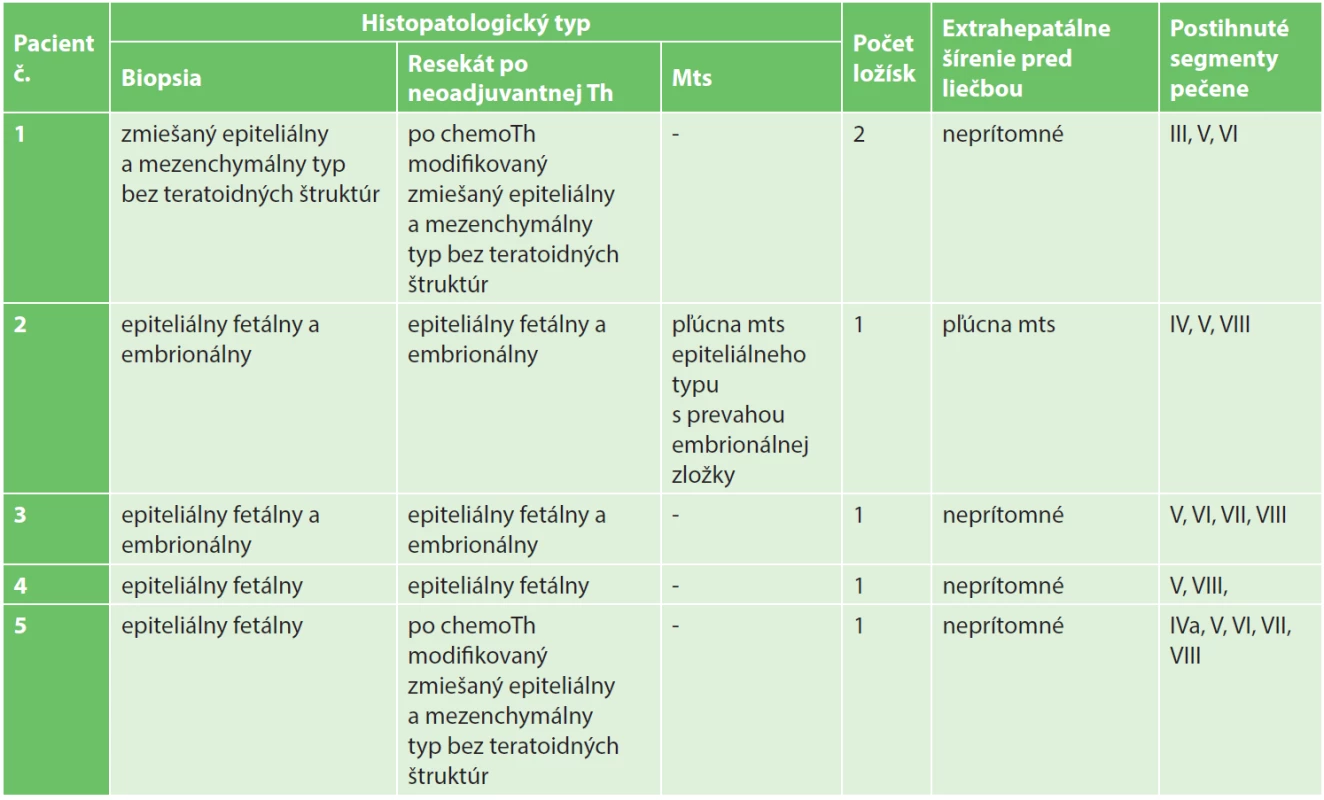
Tab. 2. Súbor pacientov Janek/Kothaj 2012-2016 ( fFRL – funkčný postresekčný zvyšok, m- mesiace, HR – vysoké riziko, SR – štandardné riziko) Tab. 2: Patients characteristics Janek/Kothaj 2012−2016 (fFRL – functionally future remnant liver, m – months, HR – high risk, SR – standard risk) 
Tab. 3. Volumetria tumorov v čase stanovenia diagnózy a po neoadjuvantnej liečbe. Stanovené použitím softvéru OsiriX a MeVis. Tab. 4: Tumours volumetry at tumour diagnosis and after neoadjuvant therapy Measured with software OsiriX and MeVis. 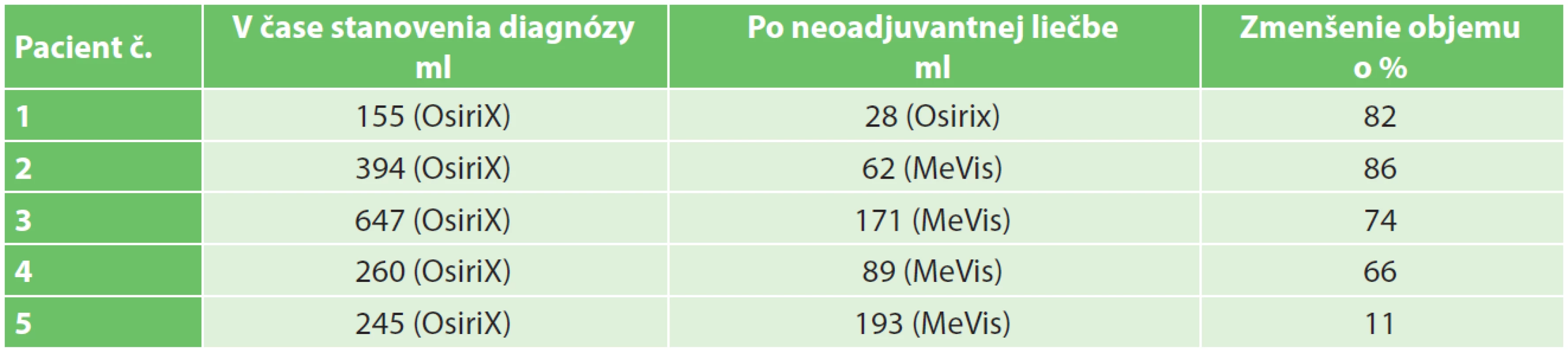
Obr. 2. MeVis analýza tumoru, arteria hepatica a vena portae, pacient č. 2 Fig. 6: MeVis analysis of tumor, hepatic artery and portal vein, patient No. 2 
Obr. 3. MeVis analýza rizika vzdialenosti hepatálnych žíl od tumoru, pacient č. 3 Fig. 7: MeVis risk analysis of distance between tumor and hepatic veins, patient No. 3 
Obr. 4. MeVis resekčný návrh a volumetria remnantu, pacient č. 5 Fig. 8: Mevis resection proposal and remnant volumetric analysis, patient No. 5 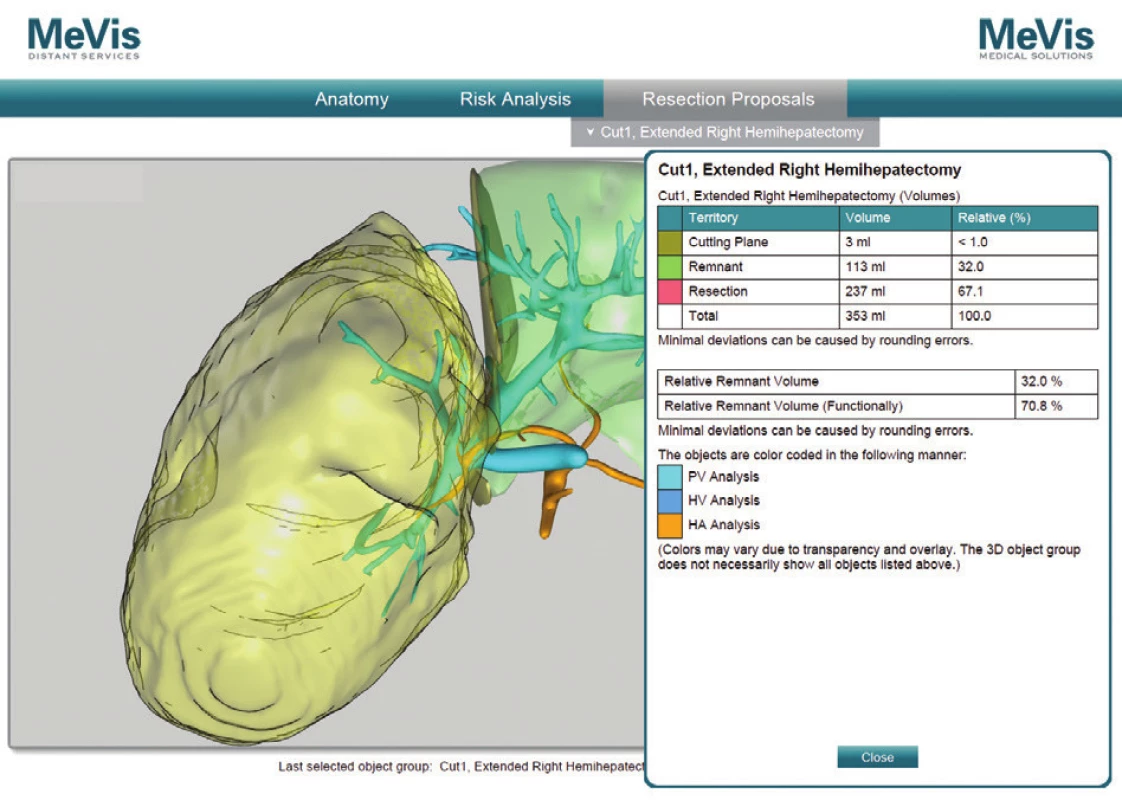
Obr. 5. MeVis hilové štruktúry, žlčové cesty po podaní Biliscopin, pacient č. 4 Fig. 9: MeVis hilar anatomy, bile duct after BiliscopinTM administration, patient No. 4 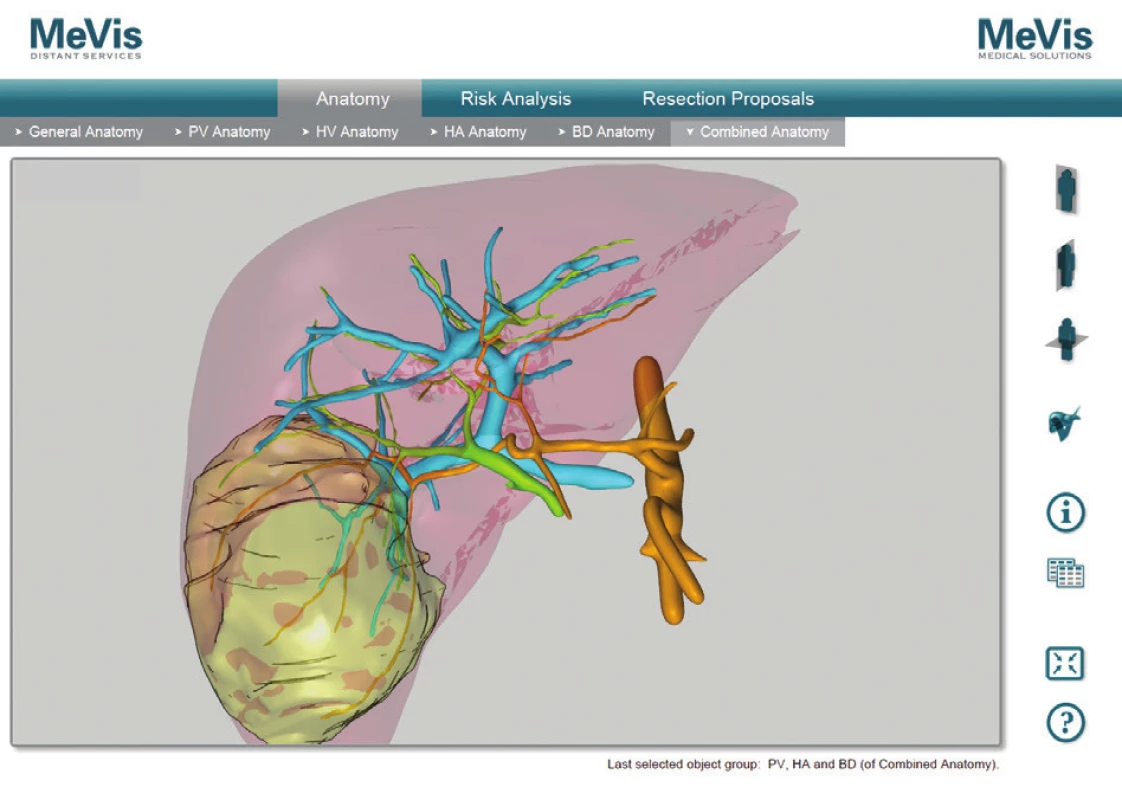
Diskusia
Hepatoblastóm predstavuje najčastejší primárny nádor pečene u detí vo veku do 5 rokov. Jeho incidencia je 1,2 prípadu na 1 milión obyvateľov [2]. Priemerný vek detí v čase diagnózy je 18 mesiacov. V prípade, ak nie je liečený, pacienti umierajú do dvoch rokov. Môže sa vyskytnúť u súrodencov, jeho vznik sa spája s familiárnou polypózou alebo Gardnerovým syndrómom [3,4]. Častejší je jeho výskyt u novorodencov s malou pôrodnou hmotnosťou alebo u detí s vrodenými vývojovými anomáliami ako je rázštep podnebia, kardiovaskulárne alebo obličkové vady, prípadne biliárne atrézie [5,6]. V prípade našich pacientov prítomnosť vrodených vývojových vád nebola dokázaná. Histopatologicky sa hepatoblastómy delia na epiteliálne a zmiešané epitelio-mezenchymálne typy. Epiteliálne obsahujú tieto subtypy: fetálny, embrionálny, makrotrabekulárny, anaplastický. Zmiešané majú subtypy bez teratogénného a s teratogénným komponentom. Prehľad jednotlivých typov v našom súbore je uvedený v Tab. 1. Fetálny histologický typ má najlepšiu prognózu. Klinický priebeh je najčastejšie asymptomatický, nádor objavia náhodne rodičia ako hmatnú rezistenciu brucha. Väčšina detí prospieva a je v dobrom klinickom stave. V literatúre sa uvádza, že pacienti s anaplastickým subtypom hepatoblastómu majú často v čase diagnózy už prítomné vzdialené metastázy. My sme diagnostikovali pľúcnu metastázu embryonálneho subtypu u pacienta č. 2 v čase diagnózy primárneho nádoru. Z laboratórnych parametrov je u 90 % pacientov elevovaný α-fetoproteín. Dôležitý je ale fakt, že u detí mladších ako 1 rok, sú hladiny α-fetoproteínu fyziologicky zvýšené. Hladiny α-fetoproteínu sú po narodení veľmi zvýšené a klesajú v priebehu prvých 6 až 12 mesiacov na hodnoty <20 ng/ml [7]. Hladiny α-fetoproteínu u našich pacientov v čase stanovenia diagnózy a po ukončení liečby sú uvedené v Tab. 3. U druhej pacientky sme po prvej kompletnej remisii zaznamenali opätovný nárast hodnôt z 2,65 ng/ml na 47 ng/ml v čase rekurencie pľúcnej metastázy. Po pľúcnej metastazektómii a adjuvantnej liečbe irinotecanom došlo ku poklesu na 1,04 ng/ml a druhej kompletnej remisii. Základným zobrazovacím vyšetrením pri diagnostike hepatoblastómu je zvyčajne ultrasonografia, kedy sa zachytí nádorová masa v dutine brušnej vychádzajúca z pečene. Nevyhnutným zobrazovacím vyšetrením je 4 fázové CT, ktoré zachytí natívnu, arteriálnu, venóznu a oneskorenú fázu po podaní kontrastnej látky. Hepatoblastóm sa zobrazuje ako dobre ohraničený nádor bez kapsuly (Obr. 1.) Pozitrónová emisná tomografia – PET je indikovaná pri pátraní po rekurencii ochorenia alebo pri podozrení na nádorový rozsev. PET CT vyšetrenie sme realizovali u pacienta č. 1 na diagnostiku ložiska hepatoblastómu v pečeňovom segmente III. Na staging ochorenia sme použili PRETEXT systém (PREtreatment Tumor EXTension), navrhnutý International Society of Pediatric Oncology Liver Tumor Study Group [8]. Tento systém je založený na segmentálnej anatómii pečene a podľa toho, ktoré sekcie pečene nádor zasahuje, klasifikuje jeho rozsah do štyroch kategórií [9]. PRETEXT systém vykazuje vyššiu prediktívnu hodnotu prežívania v porovnaní s ostatnými klasifikačnými systémami: TNM a COG [10]. Podľa rozsahu nádoru skupina SIOPEL rozdeľuje nálezy na tzv. skupinu so štandardným rizikom „standard risk“ a skupinu s vysokým rizikom „high risk“. V skupine „standard risk“ sú zaradení pacienti bez extrahepatálneho šírenia PRETEXT I, II alebo III. V skupine „high risk“ sú zaradení pacienti PRETEXT IV a so šírením do dolnej dutej žily alebo pečeňových žíl (V), do portálnej žily (P), s extrahepatálnym šírením (E), pacienti so vzdialenými metastázami alebo hladinou α-fetoproteínu <100 ng/ml. V skupine našich pacientov boli tri deti v skupine standard risk a dve high risk (PRETEXT IV a pľúcna metastáza). Od začlenenia do skupín sa odvíja neo-adjuvantná liečba. Prvej skupine sa podáva predoperačne monoterapia cisplatinou, druhej skupine intenzifikovaná liečba v kombinácii carboplatin+cisplatina+doxorubicín. Po neoadjuvantnej liečbe väčšinou dochádza ku významnému zmenšeniu nádoru, ktorý sa tak stáva resekabilný, tzv. „downstaging“. To, že je hepatoblastóm značne chemosenzitívny, sa nám potvrdilo v objemovej regresii nádorov, ktoré sa zmenšili u prvých štyroch detí priemerne o 76,5 % (66 %−84 %) (Obr. 3, 4). U najmenšieho dieťaťa (2,5 mesačné dievča, pacient č. 5) došlo k regresii len o 11 %. Vysvetľujeme si to tým, že u detí s hmotnosťou <5 kg je doporučená len tretinová dávka cisplatiny (1,8 mg/kg), čo môže spôsobiť menšiu objemovú regresiu nádoru (Tab. 4). Pre započatie liečby je mandatórne bioptické potvrdenie diagnózy. Vykonáva sa buď perkutánna „thru-cut“ biopsia alebo odber vzorky laparoskopicky, prípadne z mini laparotómie. Dôležité je nerobiť bioptické vyšetrenie cez tú časť pečene, ktorá predstavuje budúci remnant po resekčnom výkone. Na našom pracovisku sme všetky vzorky odoberali z mini laparotómie, pričom sme odobrali cca 1 ml tkaniva nádoru. Ani raz nedošlo ku krvácavým komplikáciám, počas, ani po výkone nebolo potrebné podávať transfúzie krvi. Samotný resekčný výkon nasleduje po predoperačnej chemoterapii. Cieľom operácie je kompletné odstránenie nádoru bez ponechania akéhokoľvek nádorového zvyšku. Iba kompletné odstránenie nádoru dáva reálnu nádej postihnutým deťom na vyliečenie. V prípade, že nádor je neresekabilný, ale nie je prítomné extrahepatálne šírenie, musí byť zvážená transplantácia pečene. Vo väčšine prípadov v skupine „standard risk“ postačuje pravo alebo ľavostranná hemihepatektómia. Väčšie alebo multifokálne nádory, nepresahujúce 3 sekcie, vyžadujú extendované hepatektómie. V niektorých prípadoch sú indikované centrálne resekcie, ako mezohepatektómia alebo pravá predná sektorektómia [11,12]. Jednotlivé typy resekčných výkonov v našom súbore sú uvedené v Tab. 2. Kontrola krvácania počas transekcie pečene je esenciálna, pretože aj minimálne množstvo krvných strát u malého dieťaťa môže vyvolať hemodynamickú instabilitu a tiež významne ovplyvňuje funkciu pečeňového remnantu. Doporučuje sa transekovať pečeň so zníženým centrálnym venóznym tlakom na 1−2 mmHg tzv. „low CVP anesthesia“, čo významne znižuje backflow do resekčnej plochy a súčasne používať kontrolu inflow do pečene [13]. V prípade selektívnej oklúzie pravého alebo ľavého ramena vena portae a súčasnej oklúzie prislúchajúcej hepatálnej vény hovoríme o selektívnej vaskulárnej exklúzii – SVE. Túto techniku sme použili 2x. Pringle manéver sme použili 1x u najmenšieho dieťaťa v dĺžke trvania 13 minút, pacient č.5. Bezpečný kumulatívny čas pri Pringle manévri sa považuje u detí do 45 minút, avšak treba byť opatrný u novorodencov, kde hrozí kongescia čreva (14). Anestéziologický manažment pri resekcii pečene v detskom veku má niekoľko špecifík. Napriek tomu, že chirurgické techniky vývojom za posledné desaťročie dramaticky redukovali krvné straty, tieto stále predstavujú vážny problém. Priemerné krvné straty u detí do 10 kg aj v súčasnosti predstavujú minimálne stratu polovice efektívneho krvného obehu dieťaťa [15,16,17].
Tab. 4. Hladiny α-fetoproteínu v čase stanovenia diagnózy a po ukončení liečby Tab. 3: α-fetoprotein levels at tumours diagnosis and after treatment 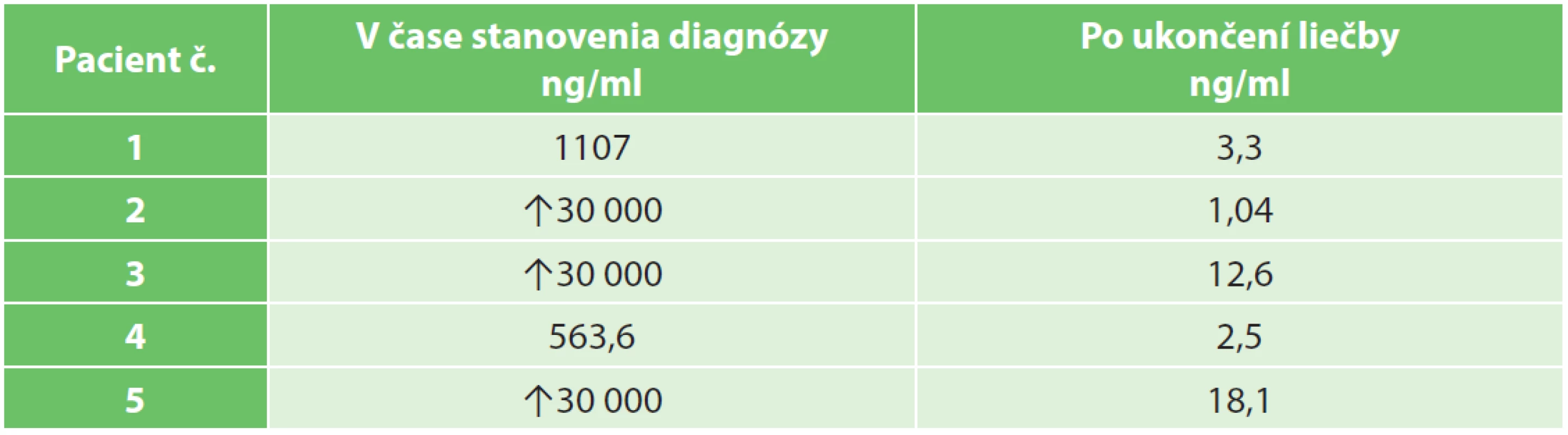
Obr. 6. Resekčná plocha ošetrená Tachosilom<sup>TM</sup> Fig. 2 Resection surface covered with Tachosil<sup>TM</sup> 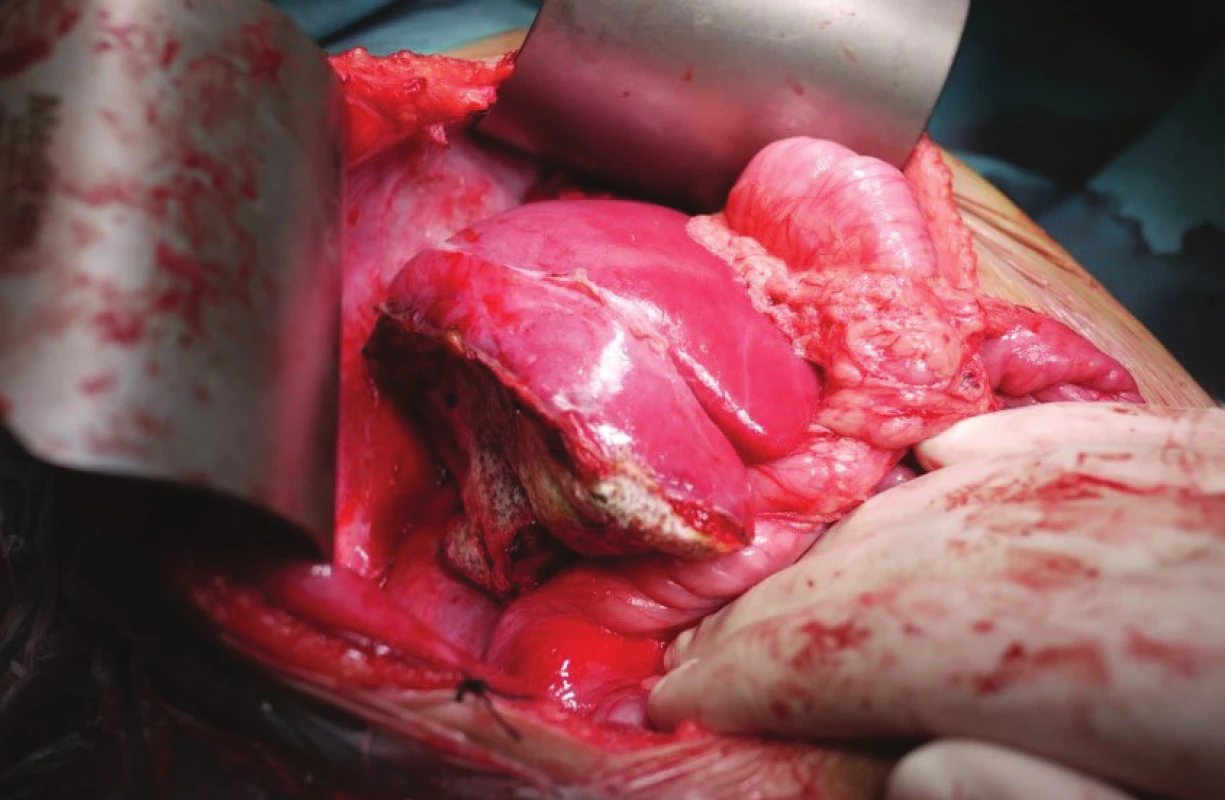
Obr. 7. Hepatoblastóm pred neoadjuvantnou liečbou, pacient č. 2 Fig. 3: Hepatoblastoma before neoadjuvant therapy, patient No. 2 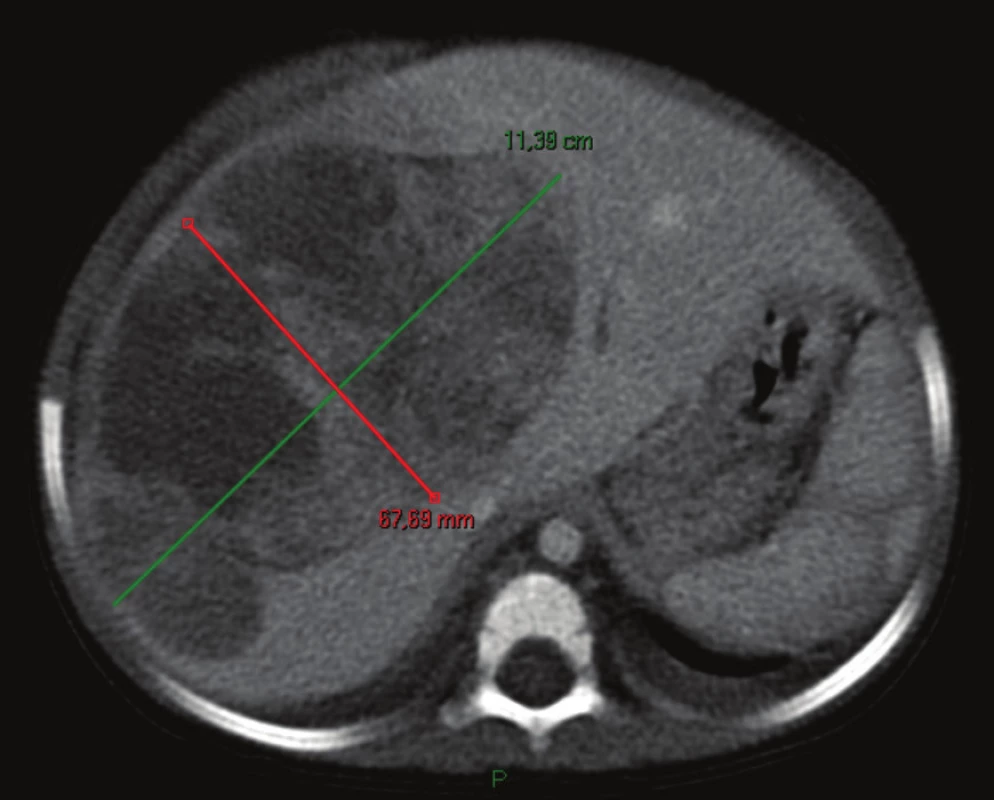
Obr. 8. Zmenšenie nádoru po neoadjuvantnej liečbe, pacient č. 2 Fig. 4: Tumor shrinking after neoadjuvant therapy, patient No. 2 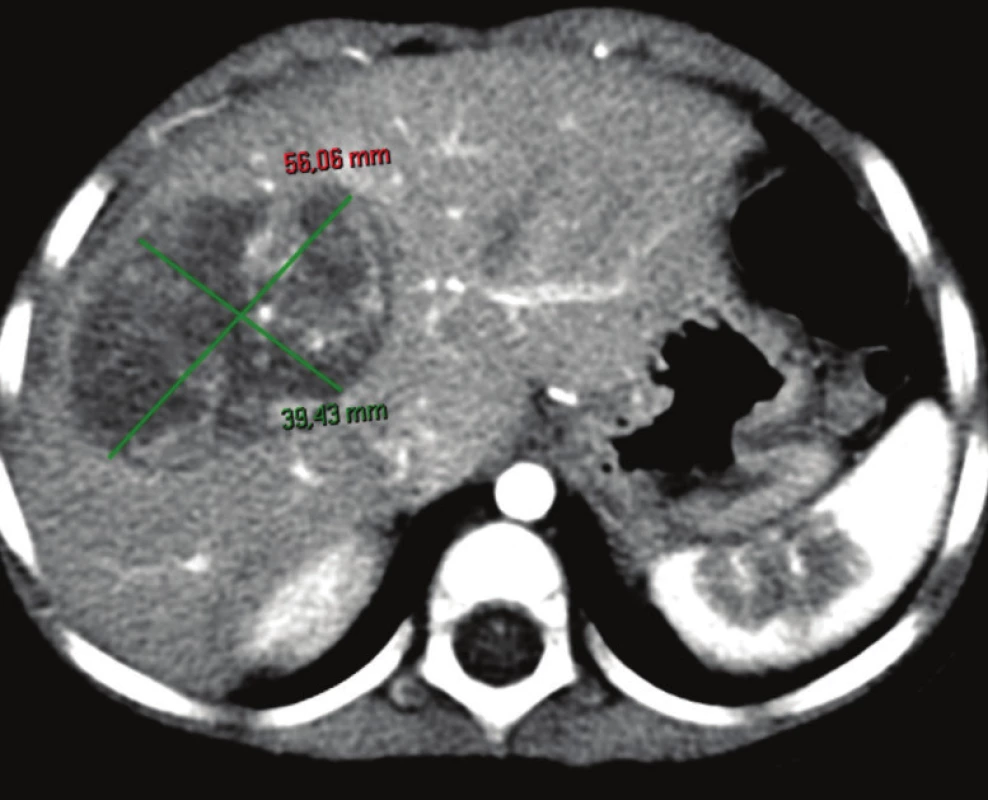
Obr. 9. Výpočet objemu tumoru v koronárnej rovine, softvér OsiriX, pacient č. 1 Fig. 5: Tumor volume calculation in coronary plane, software OsiriX, patient No. 1 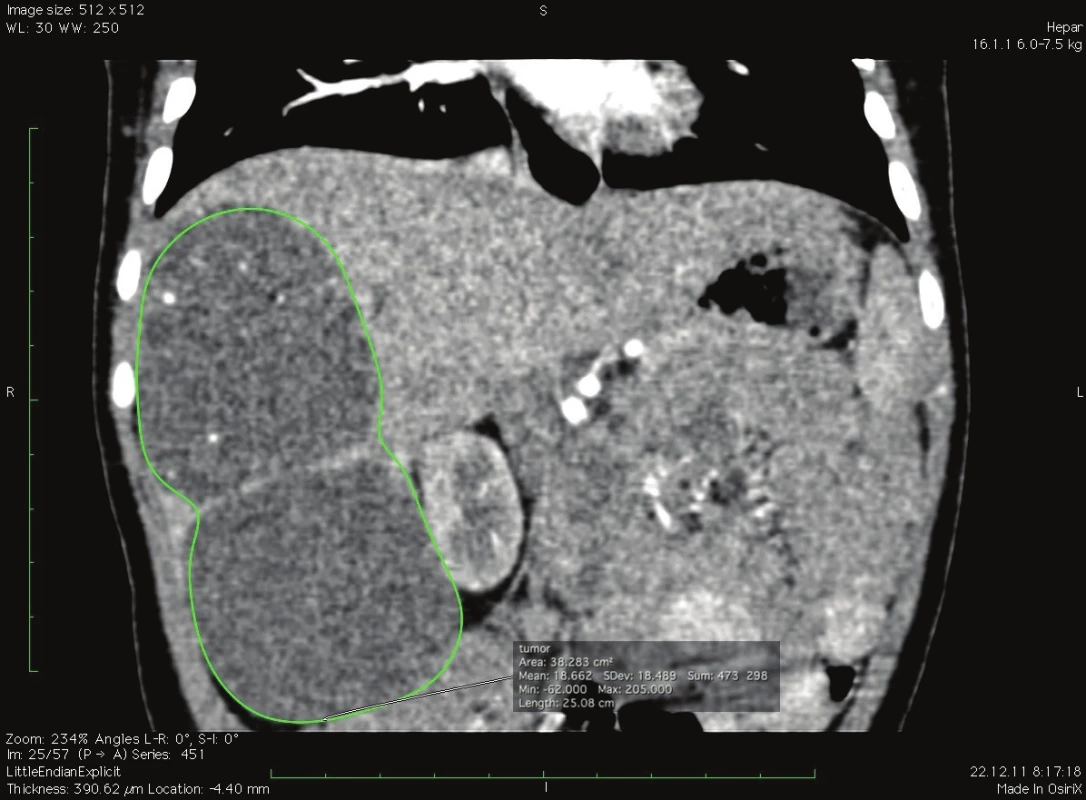
Techniky kontroly krvácania, krvné straty a prevody v našom súbore sú uvedené v Tab. 5. Pre úspešný výsledok chirurgickej liečby je esenciálny objem ponechaného zvyšku pečene tzv. remnantu. Kritický objem postresekčného zvyšku pečene – FRL (future remnant liver) v teréne bez poškodenia parenchýmu udávajú rôzni autori 20 %–30 % pôvodného objemu [18,19]. Vauthey udáva minimálny bezpečný objem FRL 25 % pre prípady rozšírenej pravostrannej hemihepatektómie [18].
Tab. 5. Peroperačné parametre (SVE − selektívna vaskulárna exklúzia) Fig. 5: Perioperative parameters (SVE − selective vascular exclusion) 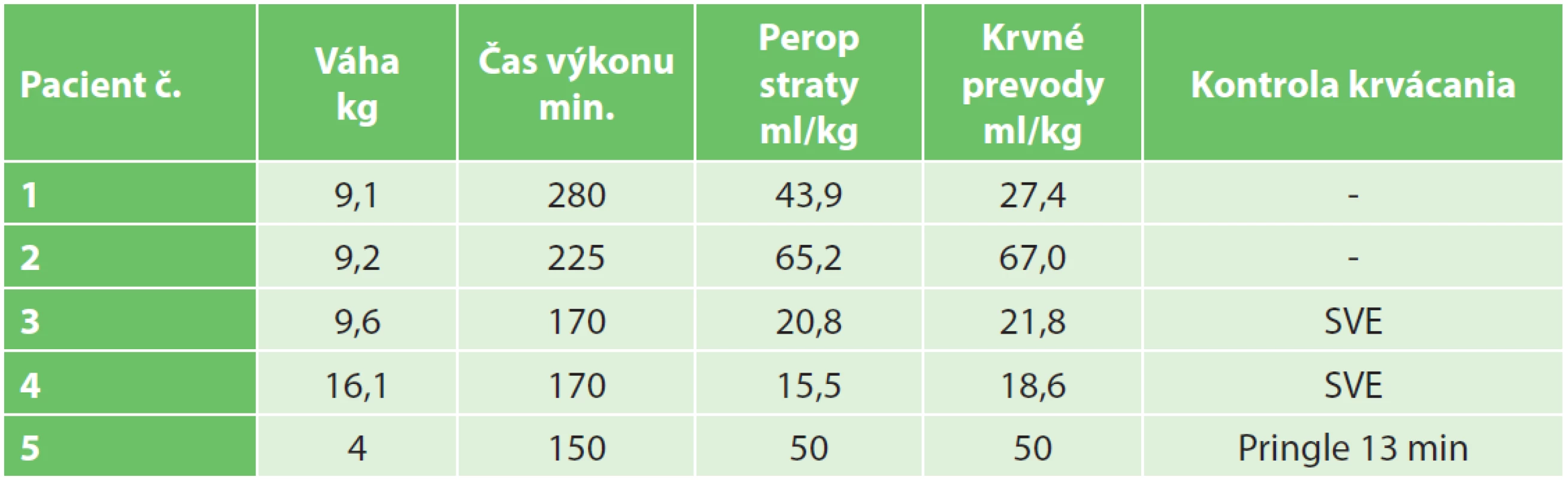
V prípade ponechaného objemu postresekčného zvyšku <25 % v normálnom parenchýme dochádza až u 90 % pacientov k závažnej pooperačnej dysfunkcii pečene. Ani u jedného z pacientov, ktorí sa podrobili rozšírenej pravostrannej hemihepatektomii a bol im ponechaný FRL >25 % nedošlo k rozvoju postresekčného zlyhania pečene [19]. V neskorších štúdiách bolo dokázané, že v prípade FRL <20 % sa viac ako u polovice pacientov rozvinú závažné pooperačné komplikácie, zatiaľ čo v prípade FRL >20 % je riziko zlyhania len 13 % [20]. Tieto literárne údaje sa potvrdili aj v našom súbore pacientov. Najnižší funkčný FRL predstavoval 28 % (pacient č. 2), ktorý bol dobre tolerovaný bez známok postresekčného zlyhávania. Výpočet FRL na našom pracovisku sme vykonali u pacienta č. 1. pomocou softvéru OsiriX [21]. Samotný výpočet FRL sme urobili na sérii CT koronárnych rezov venóznej fázy vyšetrenia pečene. Po vyznačení hraníc tumoru, pečene a budúceho postresekčného zvyšku sme pomocou počítačového programu vypočítali objem zadaných oblastí. Odpočítaním objemu nádoru od objemu pečene sme stanovili funkčný objem pečene. Voči nemu sme porovnávali objem postresekčného zvyšku. Vypočítali sme tak funkčný FRL – fFRL (Tab. 2, Obr. 5). U pacientov č. 2−5 sme už mali k dispozícii analýzy MeVis a tak prácna kalkulácia v OsiriX nebola potrebná. Ďalšou nespornou výhodou MeVis analýzy je kompletná 3D topograficko-anatomická vizualizácia, ktorá umožňuje chirurgovi presnú orientáciu v intraparenchýmových štruktúrach a ich vzdialenostiach (Obr. 6). Obsahuje analýzu rizika poškodenia jednotlivých štruktúr vo vzťahu k nádoru a štruktúram, ktoré musia ostať po resekcii nepoškodené (Obr. 7). Súčasťou sú aj resekčné návrhy s výpočtom celkového objemu pečene, výpočtom objemu nádoru a výpočtom ponechaného funkčného objemu po resekcii (Obr. 8). Výhodou je zobrazenie žlčových ciest pri súčasnom použití kontrastnej látky BiliscopinTM [22,23,24]. Zobrazenie žlčových ciest pomocou BiliskopinuTM sme využili len u pacienta č. 4 (Obr. 9) pre jeho obmedzenú dostupnosť v Slovenskej republike. U pacienta č. 5 (2,5 mesačné dievča) sa nám napriek opakovanému podaniu BiliskopinuTM nepodarilo žlčové cesty zobraziť. Vysvetľujeme si to jeho veľmi rýchlym vylúčením do duodena a preto problematickým načasovaním medzi podaním kontrastnej látky a CT vyšetrením. Spoločnosť MeVis robí analýzy na základe výsledkov vyšetrenia z bežného CT po upload dát na ich server. Dodané sú v PDF formáte mailom cca do 5 dní. Cena analýzy je 700−800 Eur. Po chirurgickej liečbe nadväzuje adjuvantná chemoterapia u pacientov so štandardným rizikom (standard risk, protokol SIOPEL6) 2 cykly Cisplatina, u pacientov s vysokým rizikom (high risk, protokol SIOPEL4) 3 cykly Carboplatina + Doxorubicin. Podľa týchto protokolov sme pokračovali aj na našom pracovisku. Pacienti s multifokálnym nádorom zasahujúcim do všetkých štyroch sekcií pečene s vysokým rizikom nekompletnej resekcie sú indikovaní na transplantáciu pečene. Idě o pacientov PRETEXT IV. Progresia ochorenia počas chemoterapie alebo vzdialené metastázy sú kontraindikáciou ku transplantácii. V prípade pochybností o vzdialených metastázach SIOPEL odporúča ich chirurgické odstránenie a histologizáciu. Transplantáciu, podobne ako resekčnú liečbu, je potrebné uskutočniť čo najskôr po poslednom cykle neoadjuvantnej liečby, hneď po úprave hematologických parametrov. Jednoročné prežívanie po transplantácii je 80 % a 5-ročné prežívanie 69 % [25,26]. Transplantácia pečene pre hepatoblastóm má lepšie výsledky v prípade, keď sa indikuje ako primárna procedúra, výsledky sú horšie v prípade ak nasleduje po resekčnej liečbe s rekurenciou ochorenia [27]. Nevýhodou transplantačnej liečby je nutnosť celoživotného užívania imunosupresív so svojimi nežiaducimi účinkami. Najčastejšou príčinou mortality po transplantácii je rekurencia ochorenia s metastázami. O transplantačnej liečbe sme uvažovali v prípade pacientky č. 1, kde boli nádorom postihnuté segmenty III, V, VI. Po neoadjuvantnej liečbe avšak došlo k objemovej regresii nádoru až o 82 % s takmer úplným vymiznutím ložiska v segmente III. Preto sme od indikácie na transplantáciu upustili a vykonali sme pravostrannú hemihepatektómiu so segmentektómiou III. Tento typ výkonu umožnil dostatočný funkčný objem ponechaného zvyšku pečene − fFRL 36 %. V prípade výskytu pľúcnych metastáz v čase diagnostikovania hepatoblastómu sa odporúča najskôr resekcia primárneho ložiska a následné chirurgické odstránenie metastáz. Určité množstvo pľúcnych metastáz vymizne počas chemoterapie, väčšie a perzistujúce ložiská vyžadujú pľúcnu metastazektómiu [28]. Podobný priebeh sme zaznamenali po neoadjuvantnej liečbe u našej pacientky č. 2, kedy došlo najskôr k úplnej regresii pľúcnej metastázy s jej relapsom 27 mesiacov po resekcii pečene, ktorá bola následne odstránená pľúcnou metastazektómiou a adjuvantnou liečbou irinotecanom. Publikované výsledky liečby hepatoblastómu sú povzbudzujúce. V prípade vykonania úspešnej resekcie bez ponechania zvyšku nádoru je 5-ročné prežívanie 83 %, v prípade ponechania mikroskopickej časti nádoru je 5-ročné prežívanie len 41 % [29]. Faktory nepriaznivej prognózy sú postihnutie viac sekcií pečene, neresekabilný nález, α-fetoproteín nižší ako 100 ng/ml alebo vyšší ako 105 ng/ml, prítomnosť vzdialených metastáz, angioinvázia a anaplastický histologický typ [30,31].
V našom súbore liečených detí sme dosiahli aktuálne kompletnú remisiu ochorenia u všetkých pacientov.
Záver
Hepatoblastóm je nádor pečene v detskom veku. Pri rýchlom záchyte a správnom manažmente sú výsledky liečby veľmi dobré. Pre úspech liečby sú nevyhnutné skúsenosti chirurga s resekčnou liečbou pečene. Ďalšou podmienkou je prítomnosť špecializovaného detského anesteziológa a onkológa, skúsenosti s rekonštrukčnou cievnou chirurgiou, použitie peroperačnej ultrasonografie pečene a ultrazvukového disektora - CUSA. Významnou pomocou pre plánovanie operácie je použitie 3D volumetrickej analýzy MeVis, čo sa nám osvedčilo v praxi. Limitom tejto práce je relatívne malý počet pacientov v súbore. Dôvodom je fakt, že pri incidencii hepatoblastómu v prepočte na počet obyvateľov je jeho výskyt na Slovensku približne jeden prípad ročne a súčasne neexistuje celoštátna centralizácia tejto diagnózy na jedno pracovisko, kde by sa kumulovali skúsenosti a zlepšovali výsledky liečby.
Konflikt záujmov
Autori článku vyhlasujú, že nie sú v súvislosti so vznikom tohto článku v konflikte záujmov a že tento článok nebol publikovaný v žiadnom inom časopise.
MUDr. Július Janek
Komenského 10/E
974 01 Banská Bystrica
e-mail: julius.janek.bb@gmail.com
Zdroje
1. Mikesková M, Kaiserová E. Nádory pečene u detí - prehľad a liečba. Onkológia 2009;4 : 19−20,22−4.
2. Darbari A, Sabin KM, Shapiro CN, et al. Epidemiology of primary hepatic malignancies in U.S. children. Hepatology 2003;38 : 560−6.
3. Giardiello FM, Petersen GM, Brensinger JD, et al. Hepatoblastoma and APC gene mutation in familial adenomatous polyposis. Gut 1996;39 : 867−9.
4. Hartley AL, Birch JM, Kelsey AM, et al. Epidemiological and familial aspects of hepatoblastoma. Med Pediatr Oncol 1990;18 : 103−9.
5. Taat F, Bosman DK, Aronson DC, et al. Hepatoblastoma in a girl with biliary atresia: coincidence or co-incidence. Pediatr Blood Cancer 2004;43 : 603−5.
6. Šípek J, Mališ J, Štěrba J, et al. Nádorová onemocnění u dětí s vrozenou vadou. Aktuální data v České republice. Čes Gynekol 2009;74 : 105−17.
7. Ohama K, Nagase H, Ogino K, et al. Alpha-fetoprotein (AFP) levels in normal children. Eur J Pediatr Surg 1997;7 : 267−9.
8. Aronson DC, Czauderna P, Maibach R, et al. The treatment of hepatoblastoma: its evolution and the current status as per the SIOPEL trials. J Indian Assoc Pediatr Surg 2014;19 : 201−17.
9. Roebuck DJ, Aronson D, Clayput P, et al. 2005 PRETEXT: a revised staging system for primary malignant liver tumours of childhood developed by the SIOPEL group. Pediatr Radiol 2007;37 : 123−32.
10. Aronson DC, Schnater JM, Staalman CR, et al. Predictive value of the pretreatment extent of disease system in hepatoblastoma: results from the International Society of Pediatric Oncology Liver Tumor Study Group SIOPEL-1 study. J Clin Oncol 2005;23 : 1245−52.
11. Superina RA, Bambini D, Filler RM, et al. A new technique for resecting ´unresectable´ liver tumors. J Pediatr Surg 2000;35 : 1294−9.
12. La Quaglia MP, Shorter NA, Blumgart LH. Central hepatic resection for pediatric tumors. J Pediatr 2002;37 : 986−9.
13. Melendez JA, Arslan V, Fischer ME, et al. Perioperative outcome of major hepatic resections under low central venous pressure anesthesia: blood loss, blood transfusion and the risk of post-operative renal dysfunction. J Am Coll Surg 1998;187 : 620−5.
14. Czauderna P, Otte JB, Aronson DC, et al. Guidelines for surgical treatment of hepatoblastoma in the modern era − recommendations from the Childhood Liver Tumour Strategy Group of the International Society of Paediatric Oncology (SIOPEL). Eur J Cancer 2005;41 : 1031−6.
15. Coté C, Lehrman J, Anderson B. A practice of anaesthesia for infants and children. 5th ed. Philadelphia, Elsevier/Saunders 2012.
16. Lentchener C, Ozier Y. Anaesthesia for elective liver resections: some points should be revisited. Eur J Anaesthesiol 2002;19 : 780−8.
17. Page A, Kooby D. Perioperative management of hepatic resection. J Gastrointest Oncol 2012;3 : 19−27.
18. Vauthey JN, Chaoui A, Do KA, et al. Standardized measurement of the future liver remnant prior to extended liver resection: methodology and clinical associations. Surgery 2000;127 : 512−9.
19. Shoup M, Gonen M, D’Angelica M, et al. Volumetric analysis predicts hepatic dysfunction in patients undergoing major liver resection. J Gastrointest Surg 2003;7 : 325−30.
20. Abdalla EK, Barnett CC, Doherty D, et al. Extended hepatectomy in patients with hepatobiliary malignancies with and without preoperative portal vein embolization. Arch Surg 2002;137 : 675−80; discussion680−1.
21. Vorst J, Dam R, Stiphout R, et al. Virtual liver resection and volumetric analysis of the future liver remnant using open source image processing software. World J Surg 2010;34 : 2426−33.
22. Hansen C, Zidowitz S, Ritter F, et al. Risk maps for liver surgery. Int J Computer Assist Radiol Surg 2013;8 : 419−28.
23. Hansen C, Zidowitz S, Preim B, et al. Impact of model-based risk analysis for liver surgery planning. Int J Computer Assist Radiol Surg 2014;9 : 473−80.
24. Banz VM, Baechtold M, Weber S, et al. Computer planned, image-guided combined resection and ablation for bilobar colorectal liver metastases. World J Gastroenterol 2014;20 : 14992−6.
25. Austin MT, Leys CM, Feurer ID, et al. Liver transplantation for childhood hepatic malignancy: a review of the United Network for Organ Sharing (UNOS) database. J Pediatr Surg 2006;41 : 182−6.
26. Oliverius M, Janoušek L, Adamec M, et al. Transplantace jater u dětí redukovaným štěpem. Rozhl Chir 2010;89 : 411−6.
27. D’Alessandro AM, Knechtle SJ, Chin LT, et al. Liver transplantation in paediatric patients: twenty years of experience at the University of Wisconsin. Pediatr Transplant 2007;11 : 661−70.
28. Meyers RL, Katzenstein HM, Krailo M, et al. Surgical resection of pulmonary metastatic lesions in children with hepatoblastoma. J Pediatr Surg 2007;42 : 2050−6.
29. Ortega JA, Douglass EC, Feusner JH, et al. Randomized comparison of cisplatin/ vincristine/fluorouracil and cisplatin/continuous infusion doxorubicin for treatment of paediatric hepatoblastoma: a report from the Children’s Cancer Group and the Paediatric Oncology Group. J Clin Oncol 2000;18 : 2665−75.
30. von Schweinitz D, Hecker H, Schmidt-von-Arndt G, et al. Prognostic factors and staging systems in childhood hepatoblastoma. Int J Cancer 1997;74 : 593−9.
31. Fuchs J, Cavdar S, Blumenstock G, et al. POST-TEXT III and IV hepatoblastoma: extended hepatic resection avoids liver transplantation in selected cases. Ann Surg 2016; A [ Epub ahead of print].
Štítky
Chirurgie všeobecná Ortopedie Urgentní medicína
Článek Dejiny slovenskej chirurgieČlánek Endokrinologie traumatu
Článek vyšel v časopiseRozhledy v chirurgii
Nejčtenější tento týden
2017 Číslo 1- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Nejlepší kůže je zdravá kůže: 3 úrovně ochrany v moderní péči o stomii
- Stillova choroba: vzácné a závažné systémové onemocnění
- Hojení análních fisur urychlí čípky a gel
-
Všechny články tohoto čísla
- Dejiny slovenskej chirurgie
- Použitie podtlakovej terapie pri fixácii meshovaných voľných kožných transplantátov
- Skúsenosti s liečbou hepatoblastómu u najmenších detí – využitie predoperačnej 3D virtuálnej analýzy MeVis pri resekciách pečene
- Rozhledy v chirurgii na začátku ročníku 96
- Endokrinologie traumatu
- Vnitřní kýla jako příčina ileu tenkého střeva
- Multiorgánová chirurgická resekce pro rozsáhlý lymfom dutiny břišní
- Kolorektální karcinom − význam lokalizace primárního nádoru
- Smíšený adenoneuroendokrinní karcinom (MANEC) gastrointestinálního traktu
- Iatrogénne lézie žlčových ciest vyžadujúce chirurgickú rekonštrukciu − prezentácia a klasifikácia poranení, spôsob rekonštrukcie, hodnotenie výsledkov
- Rozhledy v chirurgii
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Vnitřní kýla jako příčina ileu tenkého střeva
- Kolorektální karcinom − význam lokalizace primárního nádoru
- Iatrogénne lézie žlčových ciest vyžadujúce chirurgickú rekonštrukciu − prezentácia a klasifikácia poranení, spôsob rekonštrukcie, hodnotenie výsledkov
- Skúsenosti s liečbou hepatoblastómu u najmenších detí – využitie predoperačnej 3D virtuálnej analýzy MeVis pri resekciách pečene
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



