-
Články
Top novinky
Reklama- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
Top novinky
Reklama- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Top novinky
ReklamaMinimální uzlinové postižení u karcinomu žaludku – pilotní výsledky multicentrické studie
Minimal Node Affection in Gastric Carcinoma – Pilote Multicentric Study Results
Introduction:
Lymphadenectomy is an essential part of surgical treatment of gastric cancer. In the part of hematoxylin-eosin negative nodes, small foci of tumour cells (micrometastastasis and isolated tumour cells) can be found using immunostaing or RT-PCR. The aim of this study is to asses clinical and prognostic relevance of these findings.Material and methods:
Multicenter, prospective, non-randomised clinical trial running in four Czech centres. All lymphatic nodes from patients after radical resection are stained using standard hematoxylin-eosin technique, all negative nodes are further processed with immunostaining employing cytokeratin antibody.Results:
In the period of two years (1st January 2009 – 31st December 2010), 73 patients (100%) were included into the study from four Czech centers. All patients underwent radical resection for gastric cancer. Subtotal resection was performed in 33 patients (45%), total gastrectomy in the remaining 40 patients (55%). Total number of acquired lymphatic nodes (LN) reached 1245, average number of nodes per one patient was 17.3. H-E metastasis were disclosed in 364 LN (29%). All H-E negative nodes were further processed using immunohistochemical staining. Lymph node micrometastasis (MM) were discovered in 35 LN (3%), isolated tumour cells (ITC) in another 72 LN (6%). Clinical and prognostic relevance of lymph node MM and ITC was assessed based on the patients’ survival data.Conclusion:
Preliminary results of this study indicate that presence of the lymph node MM and ITC in gastric cancer patients is not linked to worse oncological outcome. Based on our results we can conclude, that expensive, time consuming and technically demanding immunostaining technique could not yet be recommended as a routine part of histological investigation of lymphatic nodes.Key words:
gastric cancer – lymphadenectomy – lymph node micrometastasis – isolated tumour cells
Autoři: J. Šimša; J. Hoch 1; J. Leffler 1; D. Umlaufová 1; J. Schwarz 1; F. Bělina 2; M. Ryska 2; R. Doležel 2; J. Gatěk 3
; J. Varga 4
Působiště autorů: Chirurgické oddělení Oblastní nemocnice Kolín, a. s., primář: doc. MUDr. Jaromír Šimša, Ph. D. ; Chirurgická klinika 2. LF UK a FN Motol, Praha, přednosta: prof. MUDr. Jiří Hoch, CSc. 1; Chirurgická klinika 2. LF UK a ÚVN, Praha, přednosta: prof. MUDr. Miroslav Ryska, CSc. 2; Chirurgické oddělení Nemocnice Atlas Zlín, a. s., primář: MUDr. Jiří Gatěk, Ph. D. 3; Chirurgická klinika 1. LF UK a FN Bulovka, Praha, přednosta: doc. MUDr. Jan Fanta, CSc. 4
Vyšlo v časopise: Rozhl. Chir., 2011, roč. 90, č. 6, s. 333-338.
Kategorie: Monotematický speciál - Původní práce
Souhrn
Úvod:
Lymfadenektomie je důležitou součástí chirurgické léčby karcinomu žaludku. V části lymfatických uzlin negativních po standardním vyšetření v hematoxylinu-eozinu (H-E) jsou při detailním zpracování s použitím immunohistochemie nebo RT-PCR nalézána drobná ložiska nádorových buněk, označovaná jako mikrometastázy (MM) a izolované nádorové buňky (ITC). Cílem studie je stanovení jejich klinického a prognostického významu.Materiál a metody:
Multicentrická, prospektivní, nerandomizovaná studie, probíhající ve čtyřech českých centrech. Do studie jsou zařazováni nemocní po radikální resekci pro karcinom žaludku. Všechny lymfatické uzliny jsou vyšetřeny standardně v barvení H-E, negativní uzliny jsou následně podrobně zpracovány s pomocí immunohistochemie (IHC) protilátkou proti buněčným cytokeratinům.Výsledky:
V období 1. 1. 2009–31. 12. 2010 bylo ze čtyř participujících center do studie zařazeno celkem 73 osob (100 %) po radikálním výkonu pro karcinom žaludku. Provedeno bylo 33 subtotálních resekcí (45 %) a 40 totálních gastrektomií (55 %). Nalezeno a vyšetřeno bylo celkem 1 245 lymfatických uzlin, průměrný počet uzlin na jednoho nemocného činil 17,3. Metastázy po barvení v H-E byly nalezeny v 364 uzlinách (29 %). Uzliny negativní po zpracování v H-E byly dále vyšetřeny s pomocí IHC. Uzlinové MM byly nalezeny v 35 uzlinách (3 %), ITC pak v 72 uzlinách (6 %). Klinický a prognostický význam uzlinových MM a ITC byl stanoven na základě údajů o délce přežívání nemocných v jednotlivých podskupinách.Závěr:
Předběžné výsledky studie ukazují, že výskyt uzlinových MM a ITC u karcinomu žaludku není spojen se zhoršením prognózy nemocných. Finančně, technicky i časově náročnou metodiku zpracování lymfatických uzlin s pomocí IHC nelze zatím na základě dosavadních výsledků této studie doporučit jako rutinní součást histologického šetření.Klíčová slova:
karcinom žaludku – lymfadenektomie – uzlinové mikrometastázy – izolované nádorové buňkyÚVOD
Karcinom žaludku je závažné maligní onemocnění, které v České republice každoročně postihuje okolo 1 800 osob obou pohlaví, o něco častěji muže. Přibližně 1 500 nemocných na tuto diagnózu každým rokem umírá. U mužů se tento typ nádoru v současnosti řadí na šesté místo v počtu nově zachycených zhoubných onemocnění, u žen je na místě osmém [1]. Pro přesný staging onemocnění je důležité při operaci odstranit co nejvyšší počet lymfatických uzlin a tyto následně histologicky vyšetřit. Standardem histopatologického vyšetření je barvení uzlin v hematoxylinu-eozinu a zhodnocení nálezu optickým mikroskopem. V části lymfatických uzlin s negativním nálezem po klasickém barvení hematoxylinem-eozinem však jsou při detailním zpracování s použitím immunohistochemie nebo metod molekulární biologie nalézána drobná ložiska nádorových buněk, která se v závislosti na své velikosti označují jako mikrometastázy (MM) nebo izolované nádorové buňky (ITC). Klinický a prognostický význam těchto nálezů je v poslední době u nemocných s karcinomem žaludku zkoumán a není dosud jednoznačně určen. Cílem studie je zmapování výskytu uzlinových mikrometastáz a izolovaných nádorových buněk u nemocných s karcinomem žaludku, a to v závislosti na rozsahu (TNM) a biologickém chování (grade) nádoru. Studie si dále klade za cíl stanovit klinický a prognostický význam těchto nálezů, a to zejména s ohledem na stanovení indikace podání adjuvantní léčby. Důležitým výstupem řešení projektu je také zodpovězení otázky, zda technicky, finančně i časově náročnou metodiku vyšetřování uzlinových MM a ITC s pomocí immunohistochemických technik zařadit do standardní klinické praxe jako rutinní součást patologického stagingu onemocnění.
MATERIÁL A METODA
Multicentrická, prospektivní, nerandomizovaná studie, probíhající ve čtyřech českých centrech – FN Motol Praha, UVN Praha, FN Bulovka Praha a Nemocnice Atlas Zlín. Do studie jsou zařazováni nemocní s karcinomem žaludku, u kterých byl proveden radikální resekční výkon s D2 lymfadenektomií, tedy odstraněním uzlin z oblastí 1-11 (I. a II. kompartment). Všechny lymfatické uzliny chirurgem odebrané a patologem následně v preparátu identifikované, jsou vyšetřeny standardním způsobem s barvením v hematoxylinu-eozinu (H-E). Podle velikosti je z každé lymfatické uzliny zhotoveno 3–5 řezů. Negativní uzliny (bez nádoru) jsou následně prokrájeny (1–3 řezy) a zpracovány s pomocí immunohistochemického barvení (protilátka proti buněčným cytokeratinům AE1/AE3, Immunotech, Francie) s cílem detekce uzlinových MM a ITC. Do studie nejsou zařazováni pacienti po předchozím resekčním výkonu na žaludku a nemocní po neoadjuvantní chemo - nebo radioterapii. Ze studie jsou vyloučeni také osoby s jiným maligním onemocněním s výjimkou izolovaných nádorů CNS a nemetastazujících kožních nádorů. Sběr dat ze všech čtyř participujících center probíhá přes společnou internetovou databázi (www.metnode.cz) zabezpečenou vstupem na heslo. Identifikační údaje pacientů (jméno, příjmení, rok narození a rodné číslo) nejsou z důvodu ochrany osobních údajů na webové stránce uváděny. Pro možnost zpětné identifikace nemocného jsou nahrazeny názvem pracoviště a pořadovým číslem pacienta. Klinický a prognostický význam uzlinových MM a ITC byl stanoven na základě odhadu délky přežívání nemocných s využitím modelu podle Kaplana-Meyerové, pro testování statistické významnosti byl použit Wilcoxonův-Gehanův test. Pro všechny testy navržené a provedené profesionálním statistikem byl použit software IBM SPSS Statistics, verze 19.0.0.
VÝSLEDKY
V období 1. 1. 2009–31. 12. 2010 bylo ze čtyř participujících center do studie zařazeno celkem 73 osob po radikálním výkonu pro karcinom žaludku. Průměrný věk nemocných činil 66,7 roku. Jednalo se o 33 subtotálních resekcí (45 %) a 40 totálních gastrektomií (55 %). Subtotální resekce byla prováděna u nádorů distální třetiny žaludku, kde bylo možné dodržet bezpečný odstup resekční linie od nádoru. Ve všech ostatních případech byla indikována totální gastrektomie. Typ rekonstrukce byl zvolen na základě operačního nálezu a zkušeností pracoviště s preferencí anastomózy na exkludovanou jejunální kličku podle Rouxe. Celkově bylo nalezeno a vyšetřeno 1245 lymfatických uzlin, průměrný počet uzlin na jednoho nemocného činil 17,3. Metastázy byly ve standardním barvení H-E nalezeny v 364 uzlinách (29 %) (Obr. 1). Uzliny negativní (bez nádoru) v H-E byly následně vyšetřeny s pomocí immunohistochemického barvení (IHC). Uzlinové mikrometastázy (MM) byly nalezeny v 35 uzlinách (3 %) (Obr. 2), izolované nádorové buňky (ITC) pak v 72 uzlinách (6 %) (Obr. 3). Průměrná délka hospitalizace činila 19,8 dne. Výsledky souboru shrnuje v přehledu tabulka 1. Pro zhodnocení klinického a prognostického významu uzlinových MM a ITC byla použita data o délce přežívání nemocných v závislosti na výskytu MM a ITC. Srovnání délky přežívání nemocných s negativním nálezem v uzlinách (H-E negativní, IHC negativní) a osob s minimálním uzlinovým postižením (H-E negativní, IHC pozitivní) ukazuje graf 1. Pozorovaný rozdíl v odhadu délky přežívání mezi oběma skupinami nebyl statisticky významný, p = 0,494. Porovnání délky přežití nemocných s minimálním uzlinovým postižením (IHC pozitivní) a všech osob ostatních (IHC negativní) demonstruje graf 2. Ani v tomto případě nebyl pozorovaný výsledek a rozdíl v přežívání nemocných v obou podskupinách statisticky významný, p = 0,224. Poslední analýza byla provedena s cílem stanovit, zda existuje rozdíl v prognóze nemocných s mikrometastázami (MM) a osob s izolovanými nádorovými buňkami (ITC). Odhad délky přežívání u obou podskupin ukazuje graf 3. Také v tomto případě nebyl pozorovaný rozdíl statisticky významný, p = 0,925. U všech tří provedených testů nebyly zjištěny statisticky významné rozdíly v zastoupení nemocných s jednotlivými stadii nádoru v rámci podskupin. Stejně tak nebyl v podskupinách statisticky významný rozdíl v zastoupení osob s adjuvantní léčbou, která by též mohla mít vliv na délku přežívání.
Obr. 1. Metastáza karcinomu žaludku v lymfatické uzlině (označena šipkou). Optická mikroskopie, zvětšení 200x, barvení hematoxylin-eosin. S laskavým svolením prof. MUDr. R. Kodeta, CSc., přednosty Ústavu patologie a molekulární medicíny 2. LF UK a FN Motol. Fig. 1. Gastric carcinoma mestastasis in a lymph node (arrow marked). Optic microscopy, enlargement 200x, hematoxylin-eosin staining. With kind approval by prof. MUDr. R. Kodet, CSc., Head of the Institute of Pathology and Molecular Medicine, 2nd Medical Faculty of the Charles University and Motol Faculty Hospital (LF UK and FN Motol). 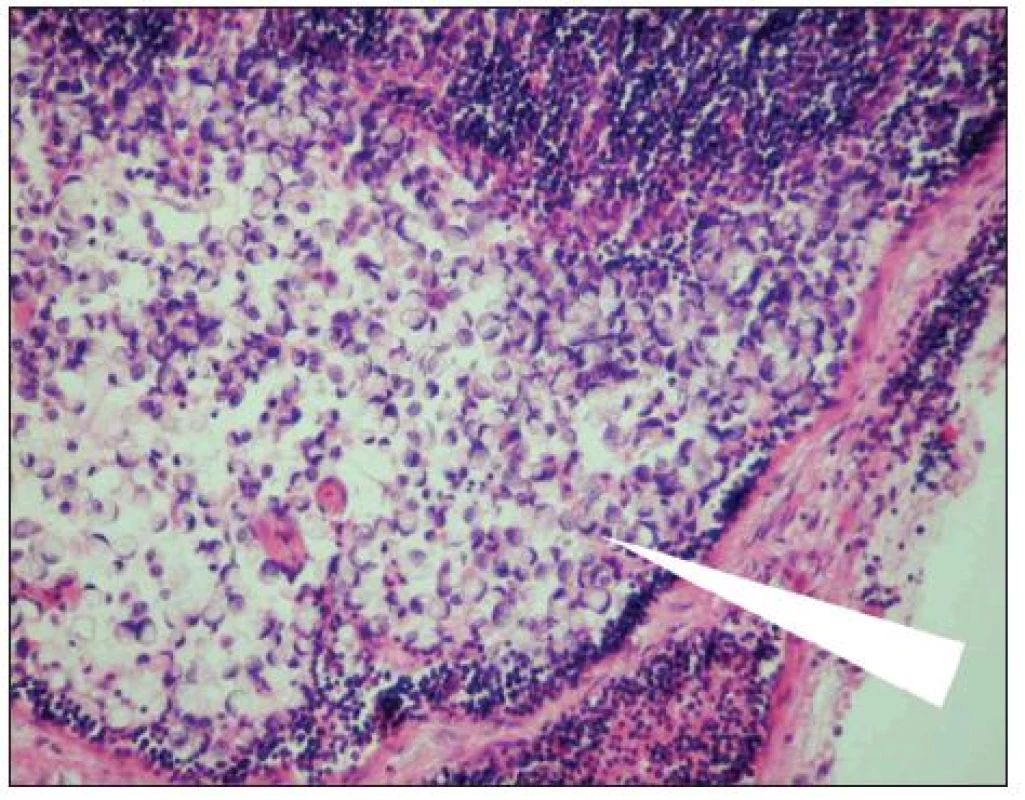
Obr. 2. Uzlinové mikrometastázy karcinomu žaludku (hnědě zbarvené buňky). Optická mikroskopie, zvětšení 400x, immunohistochemické barvení (směs protilátek proti buněčným cytokeratinům AE1/AE3). S laskavým svolením prof. MUDr. R. Kodeta, CSc., přednosty Ústavu patologie a molekulární medicíny 2. LF UK a FN Motol. Fig. 2. Gastric carcinoma lymph node micrometastases (brown stained cells). Optic microscopy, enlargement 400x, immunohistochemical staining (mixture of cytokeratin antibodies AE1/AE3). With kind approval by prof. MUDr. R. Kodet, CSc., Head of the Institute of Pathology and Molecular Medicine, 2nd Medical Faculty of the Charles University and Motol Faculty Hospital (LF UK and FN Motol). 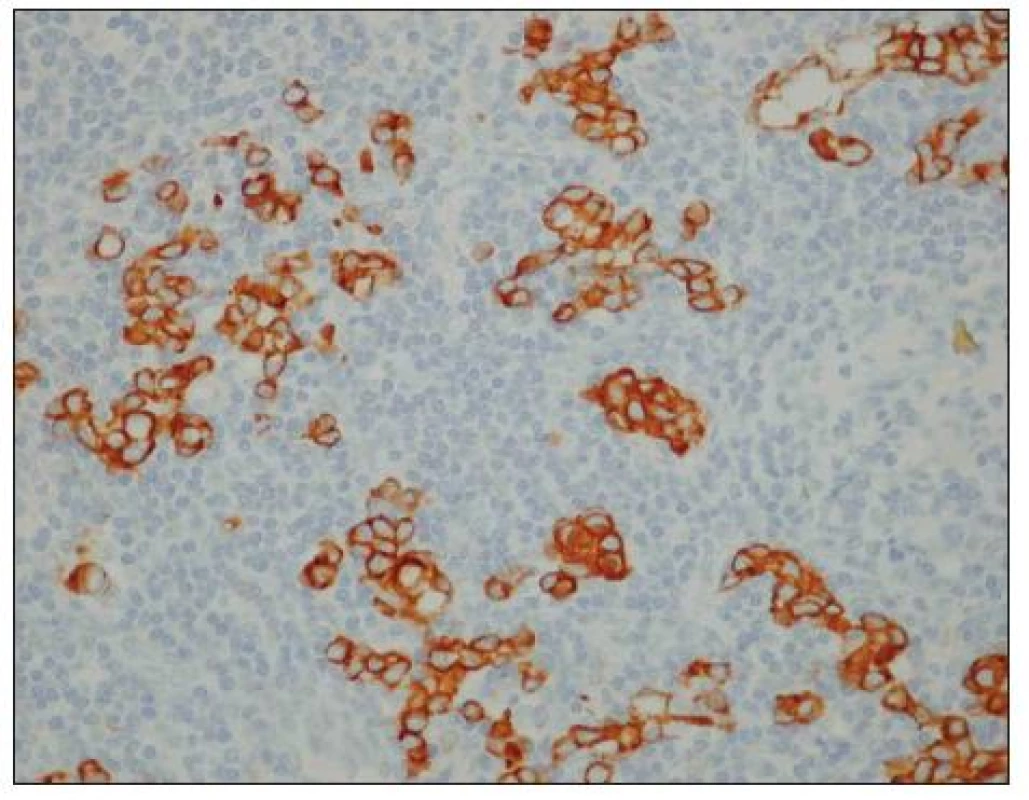
Obr. 3. Izolované nádorové buňky v lymfatické uzlině u karcinomu žaludku (hnědě zbarvené buňky). Optická mikroskopie, zvětšení 400x, immunohistochemické barvení (směs protilátek proti buněčným cytokeratinům AE1/AE3). S laskavým svolením prof. MUDr. R. Kodeta, CSc., přednosty Ústavu patologie a molekulární medicíny 2. LF UK a FN Motol. Fig. 3. Isolated tumor cells within a lymph node in a gastric carcinoma (brown stained cells). Optic microscopy, enlargement 400x, immunohistochemical staining (mixture of cytokeratin antibodies AE1/AE3). With kind approval by prof. MUDr. R. Kodet, CSc., Head of the Institute of Pathology and Molecular Medicine, 2nd Medical Faculty of the Charles University and Motol Faculty Hospital (LF UK and FN Motol) 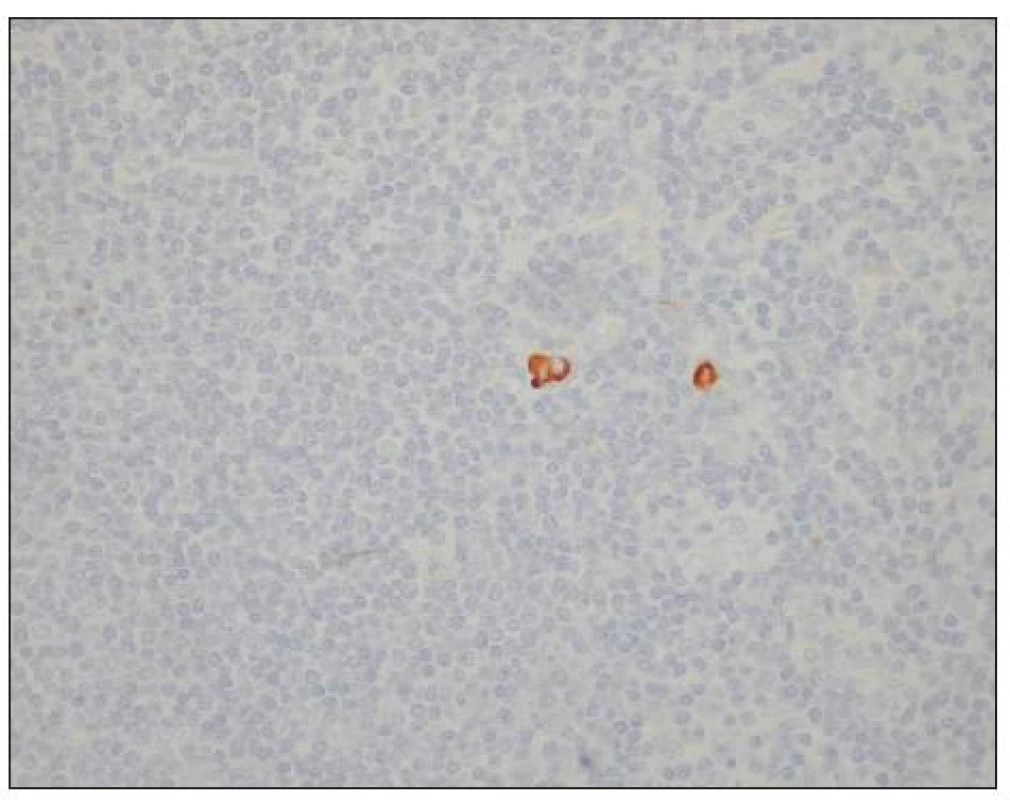
Tab. 1. Výsledky studie za první dva roky (1. 1. 2009–31. 12. 2010): počty nemocných, typy výkonů a nálezy v lymfatických uzlinách souhrnně za všechna čtyři participující pracoviště Tab. 1. Initial two-year study results (01-01-2009–31-12-2010): pooled data from all four participating clinics on the number of patients, types of procedures and lymph nodes findings 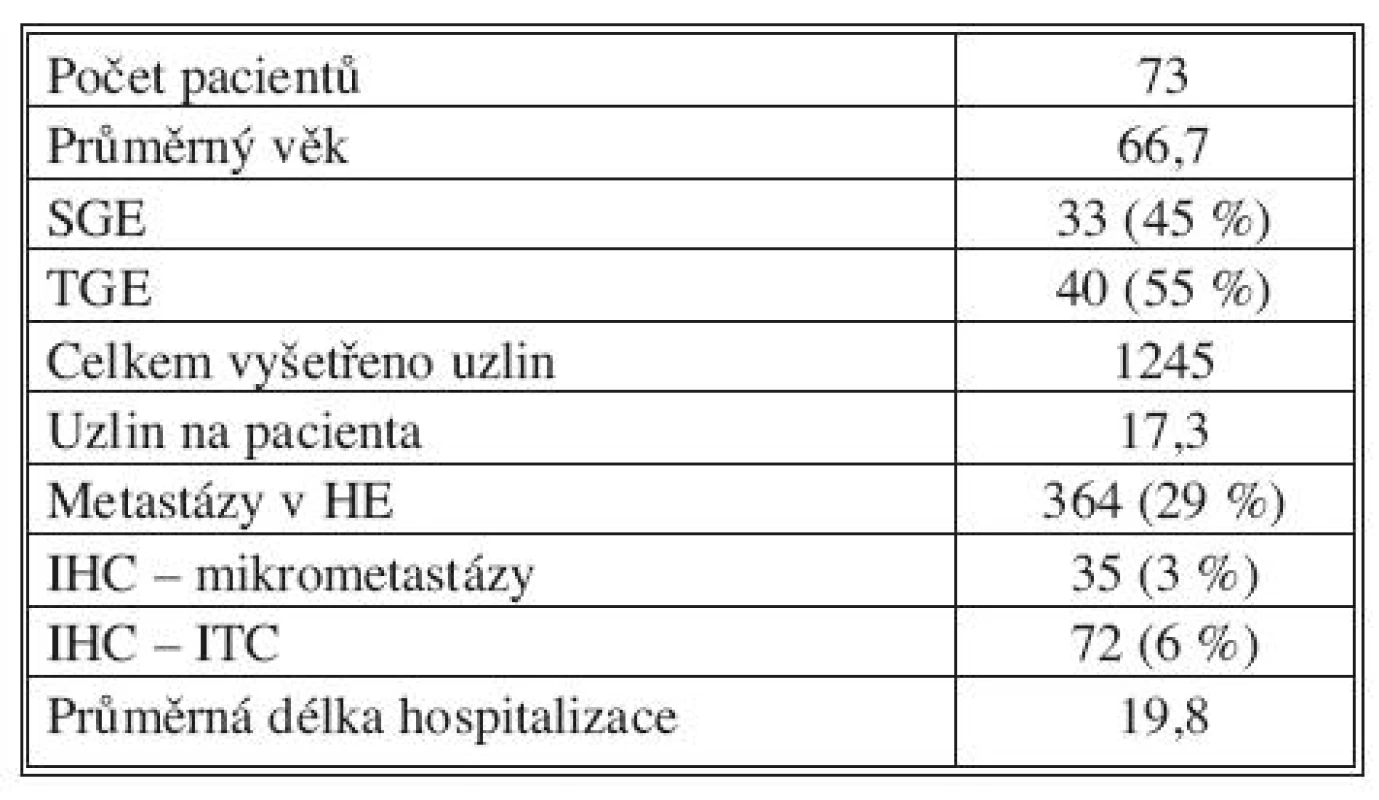
Graf 1. Srovnání délky přežívání nemocných s negativním nálezem v uzlinách a osob s minimálním uzlinovým postižením. Nemocní s negativním nálezem v uzlinách po standardním vyšetření v hematoxylinu-eozinu (HE) byli rozděleni do dvou skupin v závislosti na přítomnosti/absenci minimálního uzlinového postižení detekovaného immunohistochemicky (IHC). Skupina 1 (modrá křivka): n = 24, osoby s negativním nálezem v lymfatických uzlinách = HE negativní, IHC negativní. Skupina 2 (zelená křivka): n = 5, nemocní s nálezem uzlinových mikrometastáz (MM) a/nebo izolovaných nádorových buněk (ITC) = HE negativní, IHC pozitivní. Pro statistické porovnání a hodnocení křivek podle Kaplana-Meyerové byl použit Wilcoxonův-Gehanův test, p = 0,494. Graph. 1. Comparison of patient survival rates in patients with negative lymph node findings and in patients with minimum lymph node affection. Patients with negative lymph node findings after standard examination using HE (hematoxylin- eosin) staining were assigned to two groups depending on presence or absence of minimum lymph node affection, detected on immunohistochemical examination (IHC). Group 1 (blue curve): n = 24, subjects with negative lymph node findings = HE negative, IHC negative. Group 2 (green curve): n = 5, subjects with findings of lymph node micrometastases (MMs) and/or isolated tumor cells (ITCs) = HE negative, IHC positive. The Wilcoxon-Gehan test was used for statistical comparison and assessment the curves, according to Kaplan-Meyer, p = 0,494. 
Graf 2. Srovnání délky přežívání nemocných s minimálním uzlinovým postižením (IHC pozitivní) a ostatních osob (IHC negativní). Skupina 1 (modrá křivka): n = 41, osoby bez průkazu uzlinových MM nebo ITC (IHC negativní). Skupina 2 (zelená křivka): n = 31, nemocní s nálezem uzlinových MM nebo ITC (IHC pozitivní). Pro statistické porovnání a hodnocení křivek podle Kaplana-Meyerové byl použit Wilcoxonův-Gehanův test, p =0,224. Graph. 2. Comparison of patient survival rates in patients with minimum lymph node affection (IHC positive) and other subjects (IHC negative). Group 1 (blue curve): n = 41, subjects free of lymph node MMs or ITCs (IHC negative). Group 2 (green curve): n = 31, patients with lymp node MMs or ITCs (IHC positive). The Wilcoxon-Gehan test was used for statistical comparison and asessment the curves, according to Kaplan-Meyer, p = 0,224. 
Graf 3. Srovnání délky přežívání nemocných s mikrometastázami (MM) a osob s izolovanými nádorovými buňkami (ITC). Skupina 1 (modrá křivka): n = 14, osoby s nálezem uzlinových mikrometastáz (MM +). Skupina 2 (zelená křivka): n = 12, nemocní s nálezem izolovaných nádorových buněk (ITC +). Pro statistické porovnání a hodnocení křivek podle Kaplana-Meyerové byl použit Wilcoxonův-Gehanův test, p = 0,925. Graph. 3. Comparison of patient survival rates in patients with micrometastases (MMs) and in subjects with isolated tumor cells (ITCs). Group 1 (blue curve): n = 14, subjects with lymph node micrometastases findings (MM +). Group 2 (green curve): n = 12, patients with isolated tumor cells findings (ITC +). The Wilcoxon-Gehan test was used for statistical comparison and assessment the curves, according to Kaplan-Meyer, p = 0,925. 
DISKUSE
Přes veškerý pokrok současné medicíny, zejména onkologie, zůstává chirurgická léčba u karcinomu žaludku základní léčebnou metodou. Pouze radikální operace dává nemocným naději na dlouhodobé přežívání. Cílem operace je dosažení tzv. „R0 resekce“, tedy kompletního odstranění nádoru s bezpečným lemem zdravé tkáně. K docílení tohoto stavu přispívá kromě odstranění větší části nebo celého žaludku i resekce spádových lymfatických uzlin. Význam lymfadenektomie pro staging onemocnění je obecně uznáván, její terapeutický efekt s přímým ovlivněním prognózy nemocného však stále patří mezi živě diskutované otázky. S rostoucí radikalitou výkonu v oblasti lymfatického spádu a s prodlužováním operace navíc může docházet k nárůstu komplikací [2, 3]. V neposlední řadě zůstává problémem i vysoký věk a polymorbidita osob, které karcinom žaludku postihuje nejčastěji. Řada nemocných není z těchto důvodů schopna chirurgický výkon s rozsáhlou lymfadenektomií vůbec podstoupit [1–3]. Na druhou stranu již dnes existuje řada prací, které prezentují soubory s extenzivní lymfadenektomií, provedené bez nárůstu počtu komplikací [4, 5]. Přibývá také zkušeností s laparoskopickými výkony pro karcinom žaludku včetně totální gastrektomie [6].
Pro přesný uzlinový staging je zásadní odstranění co nejvyššího počtu lymfatických uzlin při operaci. Stejně důležitá však je i následná práce patologa se snahou o identifikaci maximálního počtu uzlin v preparátu. Standardem histologického vyšetření zůstává barvení uzlin v hematoxylinu-eozinu a jejich hodnocení optickým mikroskopem. V části lymfatických uzlin s negativním nálezem po klasickém barvení hematoxylinem-eozinem však jsou při detailním zpracování s využitím immunohistochemie nebo metod molekulární biologie (RT-PCR) nalézána drobná ložiska nádorových buněk, tzv. mikrometastázy. Klasifikací minimálního uzlinového postižení se podrobně zabývá i poslední vydání TNM klasifikace nádorů [7]. V tomto vydání jsou poprvé definovány tři základní kategorie uzlinového postižení metastazujícím nádorem. Metastáza ve spádové mízní uzlině je definována jako skupina nádorových buněk o průměru větším než 2,0 mm. Identifikace takového ložiska nebývá problémem, většina metastáz je zachycena již běžnou optickou mikroskopií s barvením v hematoxylinu-eozinu. Druhou, nově zavedenou kategorií, jsou mikrometastázy. Jedná se o skupinu buněk, jejíž velikost se nachází v intervalu 0,2–2,0 mm. Nová klasifikace doporučuje označovat tyto nálezy standardním způsobem (pN1, pN2,...). V závorce je však vhodné doplnit, že nález v uzlině má charakter mikrometastázy. Jako příklad lze uvést postižení jedné spádové lymfatické uzliny u karcinomu žaludku s nálezem jedné mikrometastázy – správné označení podle nové klasifikace je pN1(mi). Detekce mikrometastáz je někdy možná při klasickém zpracování v hematoxylinu-eozinu, často však na jejich přítomnost upozorní až metody s vyšší senzitivitou, zejména vyšetření immunohistochemické. Poslední nově zavedenou kategorií jsou izolované nádorové buňky – angl. „ITC – isolated tumour cells”. Jedná se o jednotlivé karcinomové buňky nebo jejich malé shluky, jejichž celková velikost nepřesahuje 0,2 mm. Pro detekci těchto nálezů jsou nutné metody immunohistochemické nebo molekulární. Jednotlivé nádorové buňky většinou nevykazují známky metastatické aktivity, jako je proliferace nebo stromální reakce, ani známky penetrace do stěn cévních a mízních splavů. Nově navržená klasifikace doporučuje proto hodnotit tyto nálezy jako pN0 s tím, že nález izolovaných nádorových buněk je uveden jen jako doplňující údaj v závorce – pN0(i+) [7].
Klinický a prognostický význam minimálního uzlinového postižení je v poslední době u nemocných s karcinomem žaludku zkoumán a není dosud jednoznačně určen. Málo informací je o frekvenci výskytu uzlinových mikrometastáz i o jejich distribuci v lymfatickém spádu [7, 8]. Mezi dosud nezodpovězené otázky patří také další osud těchto ložisek. Není jasné, zda jsou úspěšně zničena imunitním systémem nebo zda získávají vlastní cévní zásobení a vyrůstají v nové „plnohodnotné“ nádorové ložisko se všemi dalšími klinickými důsledky, jako je pokračující šíření nádoru, zdroj lokálních recidiv choroby a/nebo zakládání vzdálených metastáz. Technicky i časově náročná bývá pro patologa nejen detekce mikrometastáz, obtížné bývá i jejich odlišení od artefaktů vzniklých manipulací s preparátem a od epiteliálních buněčných detritů a další benigních inkluzí, pohlcených imunitním systémem lymfatické uzliny [8, 9]. Průkaz uzlinových mikrometastáz mění staging onemocnění a posouvá část nemocných do vyššího stádia choroby – fenomén „up-stage“ [10]. Přímý vliv těchto nálezů na prognózu onemocnění však zůstává nejasný. Také výsledky dosud publikovaných prací zůstávají jak u karcinomu žaludku tak i u dalších nádorů trávicího ústrojí rozporuplné. Někteří autoři prokázali negativní vliv přítomnosti uzlinových mikrometastáz na prognózu onemocnění [10–12]. Jiní naopak tento efekt ve svých sestavách nezaznamenali [13, 14]. Dosavadní výsledky našeho souboru ukazují, že výskyt minimálního uzlinového postižení není u nemocných s karcinomem žaludku spojen s horší prognózou resp. zkrácením délky přežití po radikálním výkonu – Graf 1 a Graf 2. Statistické hodnocení výsledků také neprokázalo rozdíl v prognóze mezi osobami s MM a ITC – Graf 3. Definitivní zodpovězení otázky klinického a prognostického významu minimálního uzlinového postižení bude důležité nejen z pohledu přesného stagingu onemocnění, ale i pro plán další léčby – podání adjuvantní terapie. Také z pohledu patologa je stanovení klinického významu uzlinových mikrometastáz a izolovaných nádorových buněk zásadní a v budoucnu bude rozhodovat o zařazení pracné a finančně i časově náročné techniky jejich vyšetřování do rutinní praxe [15]. Předběžné výsledky naší studie za první dva roky negativní vliv minimálního uzlinového postižení na prognózu nemocných neprokázaly. Výzkum zaměřený na problematiku uzlinových mikrometastáz a na minimální reziduální chorobu bude v následujících letech ovlivňovat strategii vedení multimodální léčby, a to nejen u karcinomu žaludku, ale i u řady další nádorů [16–18].
ZÁVĚR
Předběžné výsledky této studie ukazují, že výskyt uzlinových mikrometastáz a izolovaných nádorových buněk není u karcinomu žaludku spojen se zhoršením prognózy nemocných. Finančně i technicky náročnou metodu jejich stanovení s pomocí immunohistochemického barvení tak zatím nelze doporučit jako rutinní součást histologického zpracování lymfatických uzlin. Stejně tak není možné považovat izolovaný výskyt minimálního uzlinového postižení za indikační kritérium pro podání adjuvantní léčby.
Publikace vznikla za podpory grantu IGA 10550-3/2009.
Doc. MUDr. Jaromír Šimša, Ph.D.
Musilova 317
149 00 Praha 4
e-mail: jaromir.simsa@nemocnicekolin.cz
Zdroje
1. Zhoubné novotvary 2007, Národní onkologický registr ČR, ÚZIS, 2010.
2. Bonenkamp, J. J., Songun, I., Hermans, J., et al. Randomised comparison of morbidity after D1 and D2 dissection for gastric cancer in 996 Dutch patients. Lancet, 1995, 345 : 745–748.
3. Cuschieri, A., Fayers, P., Fielding, J., et al. Postoperative morbidity and mortality after D1 and D2 resections for gastric cancer: preliminary results of the MRC randomised controlled surgical trial. Lancet, 1996, 347 : 995–999.
4. Gatěk, J., Duben, J., Bakala, J., et al. Lymfadenektomie u časného karcinomu žaludku. Rozhl Chir, 2004, 83 (9): 428–435.
5. Maruyama, K., Sasako, M., Kinoshita, T., et al. Effectiveness of systematic lymph node dissection in gastric cancer surgery. European Surgery, 1995, 27(1): 23–27.
6. Dostalík, J., Martínek, L., Satinský, I., et al. Laparoskopická totální gastrektomie – naše první zkušenosti. Rozhl. Chir., 2003, 82 (7): 353–356.
7. Sobin, L. H., Wittekind, Ch. TNM Classification of Malignant Tumours. UICC 6th Edition, New York: John Wiley & Sons, Inc., 2002 (České vydání z r. 2004).
8. Kell, M. R., Winter, D. C., O’Sullivan, G. C., et al. Biological behaviour and clinical implications of micrometastases. Br. J. Surg., 2000, 87 : 1629–1639.
9. Calaluce, R., Miedema, B. W., Yesus, Y. W. Micrometastasis in colorectal carcinoma: A review. J. Surg. Oncol., 1998, 67(3): 194–202.
10. Lee, E., Chae, Y., Kim, I., et al. Prognostic relevance of immunohistochemically detected lymph node micrometastasis in patients with gastric carcinoma. Cancer, 2002, 94(11): 2867–2873.
11. Yasuda, K., Adachi, Y., Shiraishi, N., et al. Prognostic effect of lymph node micrometastasis in patients with histologically node-negative gastric cancer. Ann. Surg. Oncol., 2002, 9(8): 771–774.
12. Harrison, L. E., Choe, J. K., Goldstein, M., et al. Prognostic significance of immunohistochemical micrometastases in node negative gastric cancer patients. J. Surg. Oncol., 2000, 73(3): 153–157.
13. Öberg, A., Stenling, R., Tavelin, B., et al. Are lymph node micrometastases of any clinical significance in Dukes‘ stages A and B colorectal cancer? Dis. Colon Rectum, 1998, 41 : 1244–1249.
14. Isaka, N., Nozue, M., Doy, M., et al. Prognostic significance of perirectal lymph node micrometastases in Dukes‘ B rectal carcinoma: An immunohistochemical study by CAM 5.2. Clin. Cancer Res., 1999, 5 : 2065–2068.
15. Yasuda, K., Adachi, Y., Shiraishi, N., et al. Pattern of lymph node micrometastasis and prognosis of patients with colorectal cancer. Ann. Surg. Oncol., 2001, 8(4): 300–304.
16. Čapov, I., a kol. Diagnostika kostních mikrometastáz u nemalobuněčné formy plicního karcinomu – první výsledky. Rozhl. Chir., 2003, 82 (3): 145–148.
17. Hejna, M., Raderer, M., Zielinski, C. C. Multimodality treatment of gastric cancer European Surgery, 2002, 34(1): 29–31.
18. Roder, J. D., Bottcher, K., Etter, M., et al. Chirurgische und multimodale Behandlung des pT4-Magenkarzinoms. European Surgery, 1999, 31(1): 22–25.
Štítky
Chirurgie všeobecná Ortopedie Urgentní medicína
Článek vyšel v časopiseRozhledy v chirurgii
Nejčtenější tento týden
2011 Číslo 6- INFOGRAFIKA: Inovace v péči o kůži – síla regulace pH v reálné praxi
- Vliv regulace pH na snížení výskytu peristomálních komplikací a bolesti
- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- S doc. Martinem Vyhnálkem o Friedreichově ataxii v éře inovativní léčby – od symptomatické péče k ovlivnění průběhu nemoci a reálnému zlepšení kvality života
-
Všechny články tohoto čísla
- Přínos molekulární biologie v diagnostice a léčbě kolorektálního karcinomu – současnost a budoucnost
- Rozdílný dopad laparoskopického a laparotomického přístupu na imunitní odpověď navozenou chirurgickým zákrokem
- Cholecystoduodenálna fistula ako dôsledok kalkulóznej cholecystitídy pacientky vysokého veku (Kazuistika)
- Minimální uzlinové postižení u karcinomu žaludku – pilotní výsledky multicentrické studie
- Výsledky léčby nemocných s toxickým megakolon
- Prínos vyšetrenia sentinelovej uzliny pri včasnom karcinóme prsníka
- Prediktivní faktory postižení nonsentinelových uzlin u karcinomu prsu – závěry české multicentrické studie sentinelových uzlin
- DCIS a biopsia sentinelovej uzliny
- 55 laparoskopických cholecystektomií jednoincizním laparoskopickým přístupem – iniciální zkušenosti
- Zlomeniny členkovej kosti u detí
- Zápis z jednání schůze výboru ČCHS dne 14. 4. 2011
- Rozhledy v chirurgii
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Výsledky léčby nemocných s toxickým megakolon
- DCIS a biopsia sentinelovej uzliny
- Zlomeniny členkovej kosti u detí
- Prínos vyšetrenia sentinelovej uzliny pri včasnom karcinóme prsníka
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



