-
Medical journals
- Career
Aktivní sledování u karcinomu prostaty
: Milan Král; Vladimír Študent ml.; Michal Grepl; Aleš Vidlář; František Hruška; Vladimír Študent
: Urologická klinika LF UP a FN, Olomouc
: Ces Urol 2014; 18(3): 208-215
: Review article
Radikální prostatektomie a radioterapie jsou základní terapeutické možnosti lokalizovaného karcinomu prostaty s nezanedbatelnými možnými nežádoucími účinky léčby a socioekonomickou zátěží. Aktivní sledování je další z možností terapeutického přístupu k pacientům s nízce rizikovým karcinomem, která u důsledně selektovaných pacientů umožňuje oddálit aktivní léčbu. Cílem článku je objektivně informovat o indikačních kritériích a dosavadních výsledcích srovnávacích studií u aktivního sledování.
Klíčová slova:
karcinom prostaty, aktivní sledování, upgrading, upstaging, Gleasonovo skóre, PSA.EPIDEMIOLOGIE
S ohledem na jeho incidenci a prevalenci karcinom prostaty (KP) byl, je a bude klíčovou diagnózou v onkourologii. Podle údajů z roku 2008 je odhadována celosvětová incidence a mortalita pro KP 900 000 a 258 000 případů. V USA je předpokládaná incidence v roce 2014 233 000 při mortalitě 29,5 000 případů (1). Údaje v České republice dle portálu Uroweb udávají za rok 2010 incidenci 6771 a mortalitu 1467 (2) (předpoklady pro incidenci pro rok 2014 činí dle stejného zdroje dokonce 9072 případů). V horizontu několika posledních let sice evidujeme další strmý nárůst nových případů, ale již 2. rok po sobě je patrný mírný pokles mortality. Jedinečnost karcinomu prostaty oproti většině onkologických onemocnění spočívá v biologickém potenciálu, kdy úzce vybraná skupina pacientů s lokalizovaným onemocněním nemusí podstoupit standardní radikální léčbu včasně po stanovení diagnózy či dokonce vůbec v průběhu zbytku života. Oproti vysoce rizikovým karcinomům prostaty tyto nízce a velmi nízce rizikové karcinomy vykazují odlišné biologické chování, a umožňují tedy stratifikovaný přístup.
Dle údajů z USA je riziko odhalení karcinomu prostaty u běžného muže 17 %, ale úmrtí 3,4 % (3). Tato čísla jsou diametrálně odlišná od počtů karcinomů, prokázaných řadou autoptických studií u mužů zemřelých z jiných příčin. Výsledky autopsií provedených u Afroameričanů a bělochů jsou uvedeny v tabulce 1 (4) – po vztažení na věkové kategorie je evidentní nárůst prevalence karcinomů v obou skupinách, ale u Afroameričanů výraznější. Podstatná je nejen samotná prevalence, ale i charakter nádorů – incidentalomy KP v preparátech po cystoprostatektomiích (ve srovnání s nádory zjištěnými v rámci screeningu) byly méně často multifokální (37 % vs. 73 %) a častěji insignifikantní (81 % vs. 33 %) (5).
1. Prevalence karcinomů prostaty v autopsiích (upraveno dle (4)) Table 1. Prostate cancer prevalence on autopsy (according to (4)) 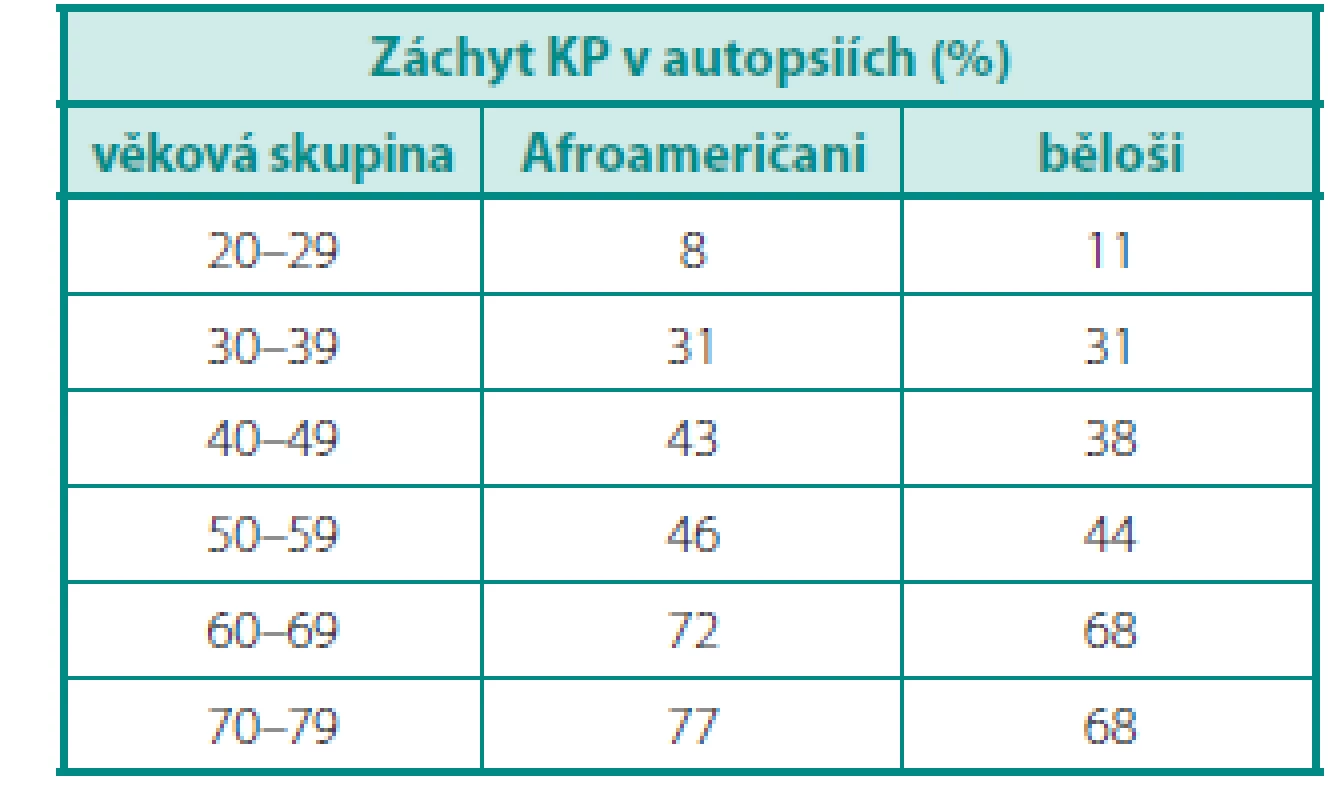
AKTIVNÍ SLEDOVÁNÍ (SURVEILLANCE)
Základními léčebnými modalitami u lokalizovaných a selektovaných lokálně pokročilých karcinomů prostaty je radikální prostatektomie a radioterapie. Již řadu let jsou v doporučeních Evropské (EAU) i Americké urologické společnosti (AUA) etablovány konzervativní postupy – aktivní sledování (surveillance, AS) a watchful waiting (WW). Zatímco dříve byly tyto postupy používány promiskue, rozdíly jsou zásadní. Principem aktivního sledování je pravidelné sledování pacienta s velmi nízce rizikovým karcinomem formou vyšetřování PSA, provádění digitálního rektálního vyšetření (DRE) a kontrolních biopsií prostaty za účelem odhalení agresivnější formy či většího rozsahu onemocnění (viz níže) – v takovém případě je totiž indikovaná radikální operační či radiační léčba s kurativním záměrem. Naproti tomu WW spočívá ve sledování pacienta do biochemické progrese a nástupu symptomů karcinomu prostaty a zahájení léčby až v této fázi – léčba je však pouze paliativní.
Důvody pro začlenění AS mezi další tera-peutické přístupy vycházejí z již zmíněných faktů. Od zavedení PSA do klinické praxe se dramaticky zvýšil počet detekovaných KP, aniž by se zásadně změnila mortalita. Řada nádorů totiž vykazuje velmi pomalý růst a nemusí svého nositele nikdy ohrozit na životě. Jsme svědky migrace stadií karcinomů od lokálně pokročilých či metastatických k lokalizovaným formám, a tím zlepšení prognózy onemocnění. Vysoký počet nově diagnostikovaných nádorů s sebou přináší značnou socioekonomickou zátěž léčebných procedur se současně nezanedbatelným rizikem nežádoucích účinků léčby. Hovoříme tak o nadměrné diagnostice karcinomů (které by vůbec nemusely být během života pacienta diagnostikovány, tzv. over-diagnosis) a nadměrně agresivní léčbě těchto nádorů (overtreatment). Za obojím stojí multidisciplinární přístup: někdy až neuvážené používání vyšetřování PSA (u velmi starých mužů s četnými a významnými komorbiditami), zdokonalení diagnostických možností ze strany urologa (navýšení počtu vzorků z původní sextantové biopsie na multiplikovanou, preciznější zobrazovací vyšetření – transrektální sonografie), radiologa (implementace magnetické rezonance, zejména multiparametrické MR) a patologa (modifikace histologického hodnocení Gleasonova skóre po roce 2005 lépe reflektující skutečný biologický potenciál nádoru). Díky tomu je možné v průběhu sledování reklasifikovat již diagnostikovaný karcinom z velmi nízkého či nízkého rizika na středně či vysoce rizikový a indikovat radikální léčbu, aniž by se zásadně zvýšilo riziko úniku onemocnění z kurabilní fáze.
DEFINOVÁNÍ VHODNÉHO PACIENTA PRO AKTIVNÍ SLEDOVÁNÍ
V souvislosti s agresivitou a biologickým potenciálem KP jsou používány termíny indolentní či insignifikantní karcinom. Zatímco indolentní KP neohrozí svého nositele a nebude klinicky manifestní v průběhu života bez ohledu na pacientův biologický stav, insignifikatní KP neohrozí svého nositele s přihlédnutím na věk muže a jeho komorbidity. Podstatné je volumometrické hodnocení objemu nádoru v prostatě. Zatímco Stamey z nálezů po cystoprostatektomiích definoval jako hraniční objem pro insignifikantní karcinom 0,5 cm3 (6), Epstein doporučil snížit tento objem na 0,2 cm3 s ohledem na fakt, že i při objemu karcinomu 0,2–0,5 cm3 byly nalezeny karcinomy se stagingem pT3 i vyšším (7).
Klíčovými parametry k posouzení agresivity karcinomu jsou klinický staging, Gleasonovo skóre a PSA. Neméně důležitý je počet pozitivních válečků v rámci multiplikované biopsie prostaty, procentuální zastoupení karcinomu v daném válečku, PSA denzita a dynamika nárůstu PSA. V detailech se jednotlivé studie mohou lišit, avšak nejrozšířenější protokoly AS přejímající Epsteinova kritéria zahrnují PSA ≤ 10 ng/ml, staging T1c-2a, Gleasonovo skóre ≤ 3+3, ≤ 2 pozitivní vzorky, ≤ 50 % pozitivity objemu daného válečku. Faktor, který zohledňují některá pracoviště, je i věk pacienta – při věku > 70 let jsou některými autory akceptovány liberálnější hodnoty PSA ≤ 15 ng/ml a tři pozitivní válečky v biopsii prostaty. Pacient je po podepsání informovaného souhlasu sledován v 3–6 měsíčních intervalech (PSA, digitální rektální vyšetření), přičemž v různých odstupech (dle protokolů dané studie) je prováděna konfirmační a kontrolní biopsie prostaty za účelem ověření ne/přítomnosti upgradingu či upstagingu. Indikačními kritérii k zahájení aktivní léčby je navýšení počtu pozitivních vzorků v biopsii na více než dva, navýšení objemu karcinomu v daném vzorku, Gleasonovo skóre ≥ 3 + 4 a vyšší, klinická progrese (velikost ložiska dle digitálního rektálního vyšetření/transrektální sonografie/MR), zdvojovací čas PSA (PSA DT) kratší než 3 roky, anxieta pacienta či nástup významných mikčních symptomů v souvislosti se subvezikální obstrukcí (8, 9).
DOPORUČENÍ UROLOGICKÝCH A ONKOLOGICKÝCH SPOLEČNOSTÍ
O tom, že AS již dávno není pouhým experimentálním přístupem ke karcinomu prostaty, svědčí fakt, že je AS začleněna do standardních postupů v doporučeních všech urologických/onkologických společností – EAU (European Association of Urology), AUA (American Urological Association), NCCN (National Comprehensive Cancer Network), NICE (National Institute for Health Care and Cancer Excellence) a další (8, 10, 11). Inkluzní kritéria nejvýznamnějších studií s AS, délky sledování pacientů, celkové přežití a přežití specifické pro karcinom jsou uvedeny v tabulce 2.
2. Přehled studií aktivního sledování, inkluzní kritéria (upraveno dle (8) Table 2. Overview of active surveillance studies, inclusion kriteria (according to (8) 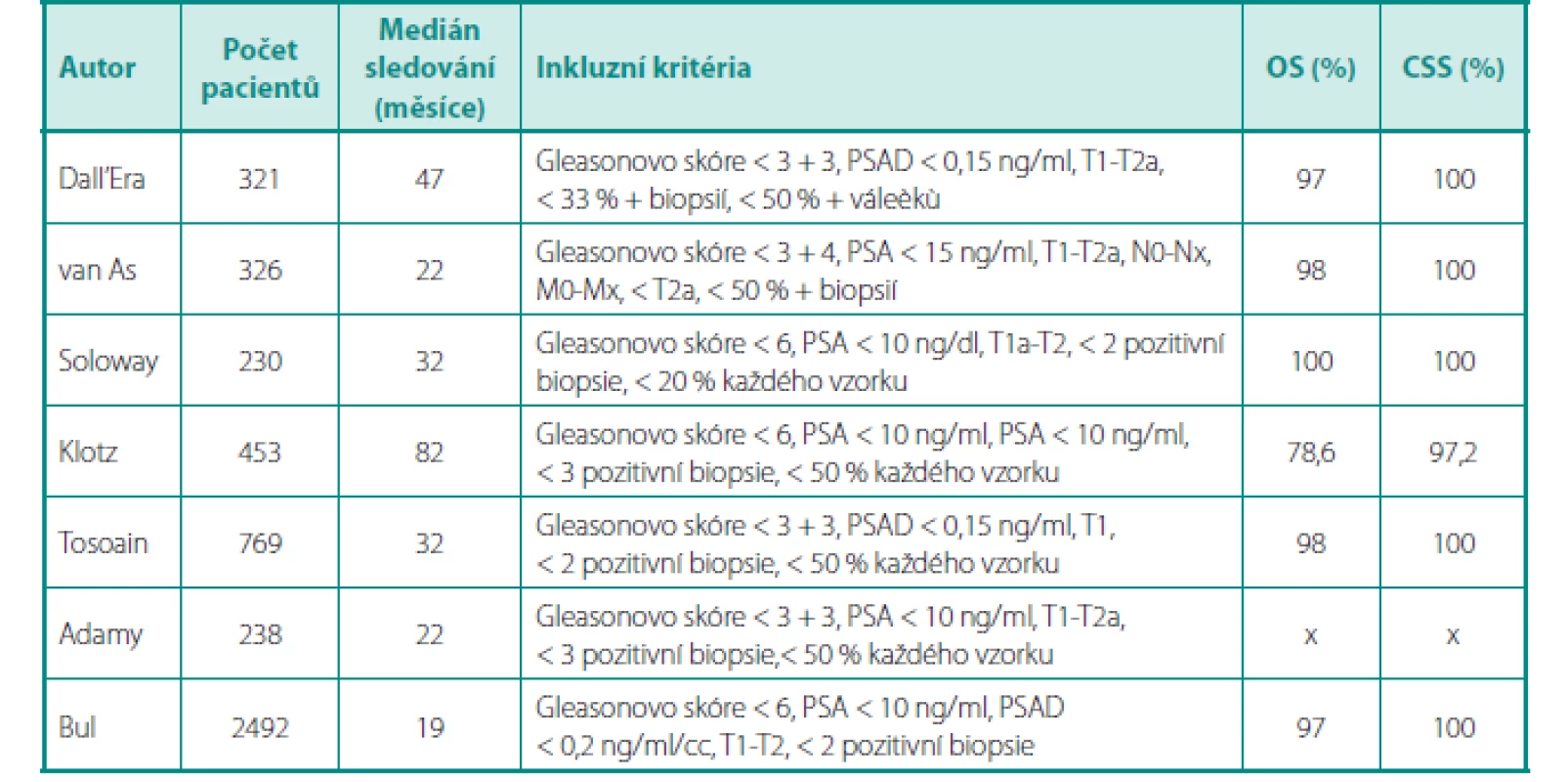
OS – celkové přežití, CSS – přežití specifi cké pro karcinom OS – overall survival, CSS – cancer specifi c survival VČASNĚ VS. ODLOŽENĚ INDIKOVANÁ RADIKÁLNÍ PROSTATEKTOMIE
Odpůrci aktivního sledování racionálně argumentují, že zatím nemáme k dispozici dostatečně přesný diagnostický nástroj, který by dokázal jednoznačně odlišit velmi nízce rizikový karcinom od karcinomu agresivního. Tento názor podporují výsledky retrospektivních analýz preparátů z prostatektomií u pacientů, jež by jinak splňovali inkluzní kritéria pro AS a podstoupili radikální prostatektomii. Např. skupina z Johns Hopkins Hospital na souboru čítajícím téměř 7500 mužů s předoperačně velmi nízce rizikovým (very low risk, VLR) a nízce rizikovým (low risk, LR) karcinomem posuzovala riziko upgradingu či upstagingu po RP. Pooperační upgrading (tj. GS ≥ 3 + 4) byl prokázán u 21,8 % LR vs. 13,1 % VLR pacientů a upstaging u 23,1 % vs. 8,5 % pacientů (12). Z tohoto vyplývá nezbytnost použití přísných inkluzních kritérií v indikaci AS k zajištění co nejvyšší bezpečnosti při selekci pacientů. K identickým závěrům dospěla obdobná multicentrická analýza dat posuzující pooperačních staging a grading při použití pěti různých inkluzních modelů pro AS (13). Autoři uvádějí, že při použití Hardieho inkluzních kritérií (PSA ≤ 20 ng/ml, staging ≤ T1–2 a GS ≤ 7) mohlo být zahrnuto až 88 % pacientů, ale 26,7 % karcinomů nesplňovalo pooperační parametry AS. Při použití kritérií dle Klotze (viz tabulka 2) mohlo být zahrnuto pouze 50 % kandidátů a nepříznivé pooperační parametry byly zjištěny u 15,4 % preparátů po prostatektomii. V autory modifikovaném, ještě více zpřísněném modelu (tj. Epsteinova kritéria + staging pouze T1c a PSA ≤ 4 ng/ml) splnilo inkluzní podmínky 6,9 % kandidátů s rizikem nepříznivé pooperační histologie v pouhých 7,2 % případů. Sice by tak došlo ke značné redukci potenciálních pacientů k AS, ale s vědomím vyšší bezpečnosti. Je však třeba si uvědomit, že neodmyslitelnou součástí každého protokolu aktivního sledování jsou konfirmační a kontrolní rebiopsie prostaty, čímž se zvyšuje pravděpodobnost záchytu agresivnějšího karcinomu, je-li v prostatě přítomen. Jiná práce (obdobný autorský tým) retrospektivně zohledňovala korelaci nepříznivé pooperační histologie vzhledem k věku. Při rozdělení do věkových kategorií (≤ 63 roků, 64 až 69 roků a > 69 roků) byly signifikantně více pozorovány nepříznivé pooperační parametry u nejvyšší věkové kategorie (14) a autoři v závěru doporučují zohlednit i tento faktor.
Další argument, který udávají odpůrci AS, je riziko lokální pokročilosti karcinomu, resp. úniku z kurativního stadia či biochemické selhání po primární radikální léčbě. Obdobně jako u jiných onkologických onemocnění může časová prodleva od stanovení diagnózy do zahájení aktivní léčby souviset s nálezem lokálně pokročilého stadia (pT3/4 či pN+), Gleasonova skóre ≥ 3 + 4, biochemického selhání či vzniku metastáz. Toto je bezpochyby největší riziko, které s sebou AS přináší. Je však nutné si uvědomit, že konkrétně průkaz mikrofokusu sekundárního či terciárního Gleasonova typu 4 po prostatektomii rozhodně nemusí znamenat biochemické či dokonce klinické selhání a úmrtí na karcinom s ohledem na jeho přirozený průběh (15). Navíc data posuzující výsledky pacientů podstoupivších okamžitou vs. odloženou radikální léčbu pro upgrading, upstaging, anxietu či symptomatologii při subvezikální obstrukci vychází pro obě skupiny srovnatelně: Analýzou dat 67 pacientů z Memorial Sloan Kettering Cancer Center (New York, USA), kteří byli indikováni k odložené radikální prostatektomii po „vyřazení“ z aktivního sledování (v 68,7% pro vyšší volum/grading karcinomu v rebiopsii, v 25,3 % z důvodu pacientovy preference/anxiety), bylo zjištěno, že 82,1 % pacientů mělo pooperační staging pT2 (16). Staging ≥ pT3 byl shledán v méně než 18 % a GS ≥ 4 + 3 bylo přítomno v 13,4 %. V souhrnu mělo 28,4 % pacientů pooperačně nepříznivou histologii (high grade/high stage), přičemž nejčastěji byla tato spojena s průkazem upgradingu v rebiopsii prostaty. Obdobná data byla analyzována od pacientů zařazených v evropské studii PRIAS (viz níže) – z 2079 mužů zařazených do studie do července 2011 bylo indikováno k některé formě léčby 446 mužů – z těchto byla k dispozici pooperační histologie u 167 pacientů; 75,7 % pacientů bylo indikováno k operaci pro upgrading/upstaging v rebiopsii, 12,7 % mužů z důvodu anxiety a 11,6 % z jiných příčin). Pooperační staging byl v 80,8 % pT2 vs. 19,2 % karcinom pT3/4 či pN+. Nepříznivá pooperační histologie (pT3–4 a/nebo GS ≥ 4 + 3) byla zjištěna u 29 % pacientů (17). Za rizikové faktory zvyšující pravděpodobnost nutnosti aktivní léčby jsou považovány afroamerická rasa, malý objem prostaty a s tím související vyšší PSA denzita (18). Z dalších uvedených studií vyplývají obdobná data: Pacienti léčeni prostatektomií včasně po stanovení diagnózy a po vyřazení z AS měli sice mírně vyšší četnost high grade či ≥ pT3 stadií karcinomů, rozdíl však nebyl statisticky signifikantní (19–21). Ačkoli švédská studie zahrnující 2344 včasně a 222 odloženě operovaných mužů taktéž prokázala častější upgrading u odloženě operovaných mužů, nebyl však rozdíl ani v četnosti pokročilých stadií ani pozitivních okrajů. Navíc srovnáním obou skupin při 8letém sledování nebyl prokázán signifikantní rozdíl v přežívání specifickém pro karcinom (22). Tím se nízce rizikové karcinomy liší od primárně diagnostikovaných agresivních forem, kde je horší prognóza při oddálení definitivní léčby jednoznačně prokázána (23). Vztažením na populaci českých mužů se dostáváme k obdobným závěrům – v souboru 402 pacientů indikovaných k včasné radikální prostatektomii byl prokázán staging pT2 72,9 % vs. pT3/4 v 27,1 %, obdobně v jiném souboru 156 mužů bylo stádium pT3/4 v 27,6 % (tedy srovnatelné s pooperačními stádii po odloženě indikované RP) (24, 25).
Shrnutím řady výše uvedených studií vychází, že procentuální zastoupení pokročilých karcinomů se výrazně neliší u pacientů indikovaných k včasné a odložené RP a není horší prognóza pacientů z hlediska přežití specifického pro karcinom. Tomu nasvědčují i výsledky jednoho z hlavních současných průkopníků AS, L. Klotze (Kanada), který na souboru 450 pacientů se střední dobou sledování 6,8 roků (1–13 let) udává 5leté a 10leté přežití specifické pro karcinom byly 99,7 % a 97,2 %. Tyto výsledky tak staví AS do velmi optimistického světla (26).
STUDIE SROVNÁVAJÍCÍ KONZERVATIVNÍ POSTUPY A AKTIVNÍ LÉČBU
Srovnání aktivní (RP) a konzervativní léčby (watchful waiting) u lokalizovaného karcinomu prostaty popisují dvě dostupné studie: Prostate cancer Intervention Versus Observation Trial (PIVOT) a studie Scandinavian Prostate Cancer Group 4 (SPCG 4). Zatímco PIVOT (27) při 12letém sledování prokázal benefit ve smyslu celkového přežití zcela minimální, studie SPCG 4 (28) při době sledování více než 23 roků zaznamenala jednoznačný benefit pro pacienty aktivně léčené (RP měla nižší mortalitu specifickou pro karcinom, celkovou mortalitu, ačkoliv rozdíl byl významný pouze ve věkové skupině do 65 let).
V případě AS sice studie probíhají, ale k dispozici máme jen kratší dobu sledování. Z již ukončených jmenujme prospektivní studii Klotze z Toronta (26) či Health Professionals Follow-up Study. Jedním z nejvýznamnějších projektů, kde stále probíhá nábor pacientů, je studie PRIAS (Prostate Cancer Research International: Active Surveillance). Jedná se o multicentrickou mezinárodní prospektivní studii (s centrem v Rotterdamu, Nizozemí), do níž stále probíhá nábor. Z dalších prospektivních jmenujme START (Standard Treatment Against Restricted Treatment, srovnání RT či RP vs. AS), ProtecT trial (Prostate Cancer Testing and Treatment Trial – náhodně AS, RP či RT), ASIST (Active Surveillance Magnetic Resonance Imaging Study – MR asistovaná TRUS biopsie), BIAS (Biological Investigations in Active Surveillance, srovnání 3 T MR, cholin PET a biomarkerů).
PREDIKCE UPGRADINGU/UPSTAGINGU KARCINOMU PROSTATY
V rámci diagnostiky – časování a provádění rebiopsií se dostává do popředí zobrazení multiparametrickou magnetickou rezonancí (mpMR). MR (konkrétně T2 MR a DWI MR) totiž umožňuje stanovit suspektní okrsky prostaty s možnými agresivnějšími ložisky. Samotné sledování již prokázaných ložisek totiž může posoudit případnou progresi velikosti ložiska, a tedy indikovat aktivní léčbu (29, 30). Další možností je použití prediktivních nomogramů. Pomocí multivariantní analýzy dat 750 pacientů po prostatektomii vstupně splňujících kritéria AS (až u 40,4 % pacientů byl shledán pooperačně upgrading či upstaging) byl zkonstruován nomogram predikce upgradingu/upstagingu (31) (obr. 1).
1. Nomogram predikce upgradingu u KP na aktivním sledování (převzato z (31)) Fig. 1. Upgrading nomogram in prostate cancer patients on active surveillance (according to (31)) 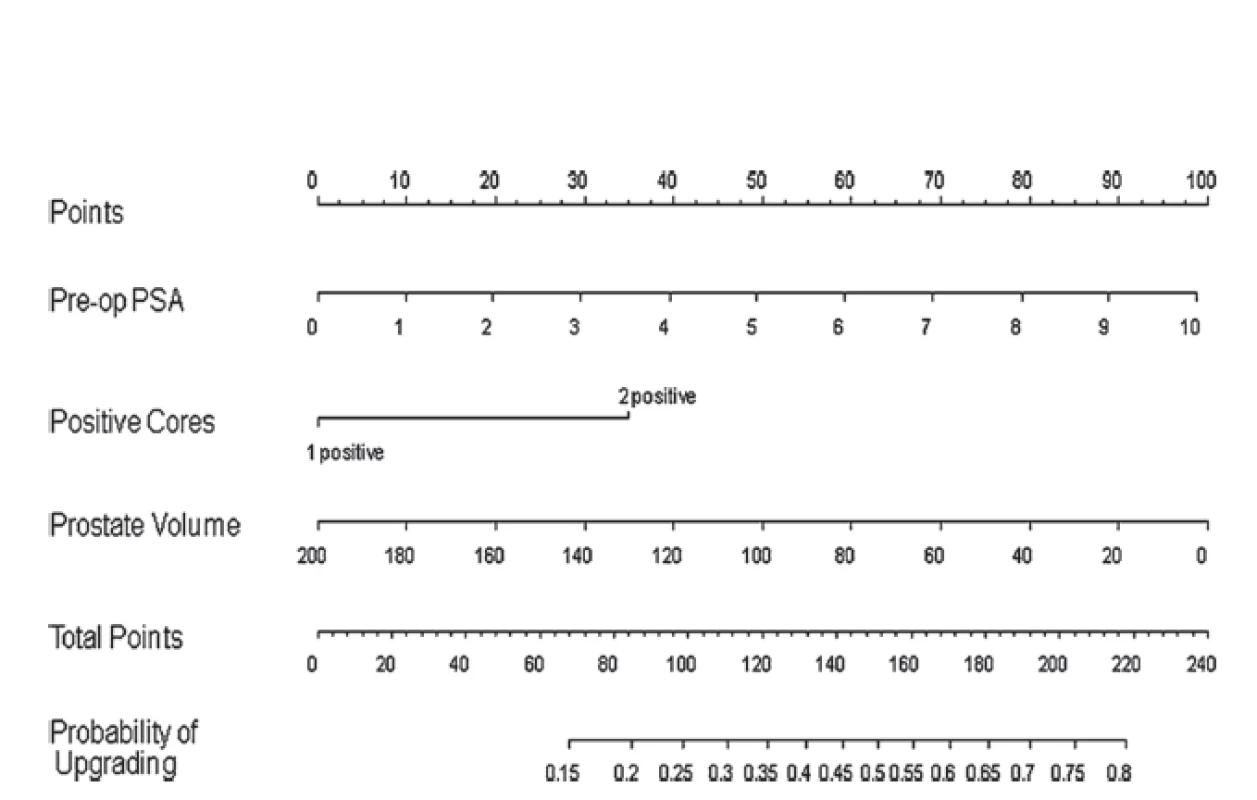
ZÁVĚR
Aktivní sledování je jednou z možností léčby lokalizovaného onemocnění prostaty u pacientů ve velmi nízkém a nízkém riziku. Jde o terapeutickou modalitu, o které by měl být pacient řádně a reálně informován lékařem, který sám by měl mít komplexní informace o výhodách i úskalích sledování (včetně možných konsekvencí plynoucích z nenabídnutí tohoto přístupu eventuálním kandidátům). Účelem AS není za každou cenu odvrátit aktivní léčbu karcinomu prostaty, ale dle možností a klinického vývoje onemocnění oddálit případnou léčbu (a tím potenciální nežádoucí účinky) na pozdější dobu.
Došlo: 5. 5. 2014.
Přijato: 1. 9. 2014.
Kontaktní adresa
MUDr. Milan Král, Ph.D.
Urologická klinika LF UP a FN
I. P. Pavlova 6, 775 20 Olomouc
e-mail: kral.milan@seznam.cz
Střet zájmů: žádný.
Sources
1. Siegel R, Ma J, Zou Z, Jemal A. Cancer statistics, 2014. CA Cancer J Clin 2014; 64(1): 9–29.
2. http://www.uroweb.cz/index.php?pg=dg-nadory-prostaty-epidemiologie-ceska-republika-vyvoj-incidence-mortalita
3. Center MM, Jemal A, Lortet-Tieulent J, et al. International variation in prostate cancer incidence and mortality rates. Eur Urol 2012; 61(6): 1079–1092.
4. Powell IJ, Bock CH, Ruterbusch JJ, et al. Evidence supports a faster growth rate and/or earlier transformation to clinically significant prostate cancer in black than in white American men, and influences racial progression and mortality disparity. J Urol 2010; 183(5): 1792–1796.
5. Wolters T, Montironi R, Mazzucchelli R, et al. Comparison of incidentally detected prostate cancer with screen–detected prostate cancer treated by prostatectomy. Prostate 2012; 72(1): 108–115.
6. Stamey TA, Freiha FS, McNeal JE, Redwine EA, Whittemore AS, Schmid HP. Localized prostate cancer. Relationship of tumor volume to clinical significance for treatment of prostate cancer. Cancer 1993; 71(3 Suppl): 933–938.
7. Epstein JI, Walsh PC, Carmichael M, Brendler CB. Pathologic and clinical findings to predict tumor extent of nonpalpable (stage T1c) prostate cancer. JAMA 1994; 271(5): 368–374.
8. http://www.uroweb.org/gls/pdf/09%20Prostate%20Cancer_LRLV2.pdf
9. van den Bergh RCN, Roemeling S, Roobol MJ, et al. Prostate-specific antigen kinetics in clinical decision-making during active surveillance for early prostate cancer – a review. Eur Urol 2008; 54 : 505–516.
10. http://www.baus.org.uk/Resources/BAUS/Documents/PDF%20Documents/BAUS%20in%20general/MDT%20Prostate%20Cancer%20Guidance.pdf
11. https://www.nccn.org/store/login/login.aspx?ReturnURL=http://www.nccn.org/professionals/physician_gls/pdf/prostate.pdf
12. Tosoian JJ, JohnBull E, Trock BJ, et al. Pathological outcomes in men with low risk and very low risk prostate cancer: implications on the practice ofactive surveillance. J Urol 2013; 190(4): 1218–1222.
13. Suardi N, Capitanio U, Chun FK, et al. Currently used criteria for active surveillance in men with low–risk prostate cancer: an analysis of pathologic features. Cancer 2008; 113(8): 2068–2072.
14. Suardi N, Gallina A, CapitanioU, et al. Age-adjusted validation of the most stringent criteria for active surveillance in low-risk prostate cancer patients. Cancer 2012; 118(4): 973–980.
15. Lu-Yao GL, Albertsen PC, Moore DF, et al. Outcomes of localized prostate cancer following conservative management. JAMA 2009; 302 : 1202–1209.
16. Hong SK, Sternberg IA, Keren Paz GE, et al. Definitive Pathology at Radical Prostatectomy Is Commonly Favorable in Men Following Initial Active Surveillance. Eur Urol 2014; 66(2): 214–219.
17. Bul M, Zhu X, Rannikko A, et al. Radical prostatectomy for low-risk prostate cancer following initial active surveillance:results from a prospective observational study. Eur Urol 2012; 62(2): 195–200.
18. Iremashvili V, Soloway MS, Rosenberg DL, Manoharan M. Clinical and demographic characteristics associated with prostate cancer progression in patients on active surveillance. J Urol 2012; 187(5): 1594–1599.
19. Warlick C, Trock BJ, Landis P, Epstein JI, Carter HB. Delayed versus immediate surgical intervention and prostate cancer outcome. J Natl Cancer Inst 2006; 98 : 355–357.
20. van den Bergh RC, Steyerberg EW, Khatami A, et al. Is delayed radical prostatectomy in men with low-risk screen-detected prostate cancer associated with a higher risk of unfavorable outcomes? Cancer 2010; 116 : 1281–1290.
21. Satkunasivam R, Kulkarni GS, Zlotta AR, et al. Pathological, oncologic and functional outcomes of radical prostatectomy following active surveillance. J Urol 2013; 190(1): 91–95.
22. Holmstrom B, Holmberg E, Egevad L, et al. Outcome of primary versus deferred radical prostatectomy in the National Prostate Cancer Register of Sweden Follow-Up Study. J Urol 2010; 184 : 1322–1327.
23. Vickers AJ, Bianco Jr FJ, Boorjian S, Scardino PT, Eastham JA. Does a delay between diagnosis and radical prostatectomy increase the risk of disease recurrence? Cancer 2006; 106 : 576–580.
24. Čapoun O, Babjuk M, Dvořáček J, Hanuš T, Šafařík L, Pavlík I. Predikce patologické klasifikace karcinomu prostaty. Ces Urol 2008; 12(1): 31–36.
25. Král M, Študent V, Vidlář A, Hrabec M, Marek D. Nomogram predikce up-gradingu Gleasonova skóre v biopsii prostaty. Čes Urol 2007; 11 : 159–163.
26. Klotz L, Zhang L, Lam A, Nam R, Mamedov A, Loblaw A. Clinical results of long–term follow–up of a large, active surveillance cohort with localized prostate cancer. J Clin Oncol 2010; 28(1): 126–131.
27. Wilt TJ, Brawer MK, Jones KM, et al. Radical prostatectomy versus observation for localized prostate cancer. N Engl J Med 2012; 367(3): 203–213.
28. Bill-Axelson A, Holmberg L, Garmo H, et al. Radical prostatectomy or watchful waiting in early prostate cancer. N Engl J Med 2014; 370(10): 932–942.
29. Flavell RR, Westphalen AC, Liang C, et al. Abnormal findings on multiparametric prostate magnetic resonance imaging predict subsequent biopsy upgrade in patients with low risk prostate cancer managed with active surveillance. Abdom Imaging 2014 Apr 17 [Epub ahead of print].
30. Kim JY, Kim SH, Kim YH, Lee HJ, Kim MJ, Choi MS. Low-risk prostate cancer: the accuracy of multiparametric mr imaging for detection. Radiology 2014; 271(2): 435–444.
31. Sooriakumaran P, Srivastava A, Christos P, Grover S, Shevchuk M, Tewari A. Predictive models for worsening prognosis in potential candidates for active surveillance of presumed low-risk prostate cancer. Int Urol Nephrol 2012; 44(2): 459–470.
Labels
Paediatric urologist Nephrology Urology
Article was published inCzech Urology

2014 Issue 3-
All articles in this issue
- Varicocele
- Penile tissue preserving methods in the treatment of lower T categories of penile cancer
- Active surveillance in prostate cancer
- Age specific PSA and PSA velocity – comparison on the basis of prostate biopsies
- Comparrison of multiparametric magnetic resonance immaging of the prostate with Tesla magnetic field, with transrectal ultrasound-guided prostate biopsy
- Extracorporeal shock-wave litothripsy – 4 year experience with electromagnetic litotripter Urontech URO-EMX
- Inflammatory pseudotumor of the urinary bladder presenting as a symptom of active vasculitis in a patient with granulomatosis with polyangiitis (Wegener’s) – an unusual manifestation of ANCA-associated vasculitis
- Czech Urology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Varicocele
- Age specific PSA and PSA velocity – comparison on the basis of prostate biopsies
- Active surveillance in prostate cancer
- Penile tissue preserving methods in the treatment of lower T categories of penile cancer
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

