-
Medical journals
- Career
Karcinoid z pohárkových buněk apendixu metastazovaný do orbity – klinická kazuistika a přehled literatury
Authors: V. M. Matějka 1; P. Mukenšnabl 2; R. Tupý 3; O. Fiala 1; J. Fínek 1
Authors‘ workplace: Onkologická a radioterapeutická klinika LF UK a FN Plzeň 1; Šiklův ústav patologie, LF UK a FN Plzeň 2; Klinika zobrazovacích metod LF UK a FN Plz 3
Published in: Klin Onkol 2016; 29(3): 220-223
Category: Case Reports
doi: https://doi.org/10.14735/amko2016220Overview
Karcinoid z pohárkových buněk (goblet cell carcinoid – GCC) apendixu je velmi vzácné nádorové onemocnění. V literatuře se udává, že se jedná asi o 5 % ze všech primárních malignit apendixu. Histologicky jsou definovány tři skupiny – skupina A (typický GCC), adenokarcinom ex GCC buněk tvaru pečetního prstenu (skupina B) a nejvíce agresivně se chovající skupina C, adenokarcinom ex GCC špatně diferencovaný typ. GCC metastazuje v 15 – 60 %, nejčastěji do ovarií, pánve, břišní dutiny, kostí a lymfatických uzlin. Velmi vzácně se objevuje i metastatické postižení jater a jiných parenchymatózních orgánů. Jiná místa metastatického šíření nebyla popsána. Primární léčbou tohoto onemocnění je chirurgické odstranění nebo alespoň cytoredukční operace následována systémovou léčbou. V případě neresekability nebo vzdálené diseminace onemocnění je indikována chemoterapie. V této kazuistice prezentujeme případ velmi agresivně rostoucího GCC se synchronním metastatickým postižením jater, s velmi netypickým místem dalšího metastatického šíření – orbitou.
Klíčová slova:
karcinoid – pohárková buňka – metastatický – apendix – orbitaÚvod
Karcinoid z pohárkových buněk (goblet cell carcinoid – GCC) apendixu je velmi vzácné onemocnění, které tvoří necelých 5 % všech primárních nádorů tohoto orgánu. Nejčastěji se objevuje v páté a šesté dekádě věku, ale z popsaných případů vyplývá, že se může manifestovat v rozsahu 20 – 89 [1,2]. Nejvýznamnějším prognostickým faktorem onemocnění je jeho stadium v době diagnózy. Pětileté celkové přežití (overall survival – OS) pro jednotlivá stadia: 100 % pro stadium I,76 % pro stadium II, 22 % pro stadium IIIa 14 % pro stadium IV. Medián OS je pro grade 1 – 119 měsíců, pro grade 2 – 43 měsíců a pro grade 3 – 31 měsíců [3]. GCC metastazuje v 15 – 60 % případů, častěji pak ve skupině starších pacientů. Místem šíření jsou pak nejčastěji ovaria, pánev, břišní dutina, kosti a lymfatické uzliny. Víceméně vzácně je popisováno metastatické postižení jater a jiných parenchymatických orgánů [4]. Základem léčby je chirurgické odstranění tumoru, event. následované systémovou léčbou. V případě neresekovatelného či recidivujícího onemocnění je pak jedinou možností systémová cytostatická léčba. Výběr chemoterapeutického schématu vychází z místa lokalizace primárního tumoru. Standardně se používají schémata založená na 5-fluorouracilu (5-FU) a leukovorinu (FOLFOX (oxaliplatina + 5-FU + + leukovorin)/FOLFIRI (irinotekan + 5-FU ++ leukovorin)). V 2. linii je pak možno použít v monoterapii či kombinaci např. etopozid, cisplatinu, streptozotocin či interferon α [3,4]. V našem sdělení prezentujeme případ velmi agresivního karcinoidu z pohárkových buněk apendixu se synchronním metastatickým postižením jater, který se dále šířil do orbity.
Kazuistika
V lednu 2013 byla tehdy 50letá žena hospitalizována na gynekologickém oddělení pro bolesti břicha. CT břicha odhalilo tumorózní útvar, jehož původ imponoval v levém ovariu, a čtyři jaterní metastázy. Pacientka podstoupila laparotomii, při které byla provedena hysterektomie, oboustranná adnexektomie, omentektomie a resekce céka s end-to-end ileocékalní anastomózou. Provedení resekce jaterních ložisek bylo naplánováno v druhé době.
Histologicky se jednalo o GCC, grade 2.V místech s největší mitotickou aktivitou bylo dosaženo až 50 % (MiB), v žádné z odebraných lymfatických uzlin nebyla nalezena metastáza onemocnění. Jednalo se tedy o stadium IV, T4 N0 M1. Nádorové buňky vykazovaly pozitivitu AE 1 – 3, chromogranin A a synaptophyzin. Ostatní testované markery byly negativní (vimentin, S100, inhibin, SAL 4) (obr. 1).
Image 1. HE (hematoxin-eozin) barvený vzorek GCC – pohárkové buňky s nálezem buněk tvaru pečetního prstenu a extracelulárními ostrůvky mucinu. 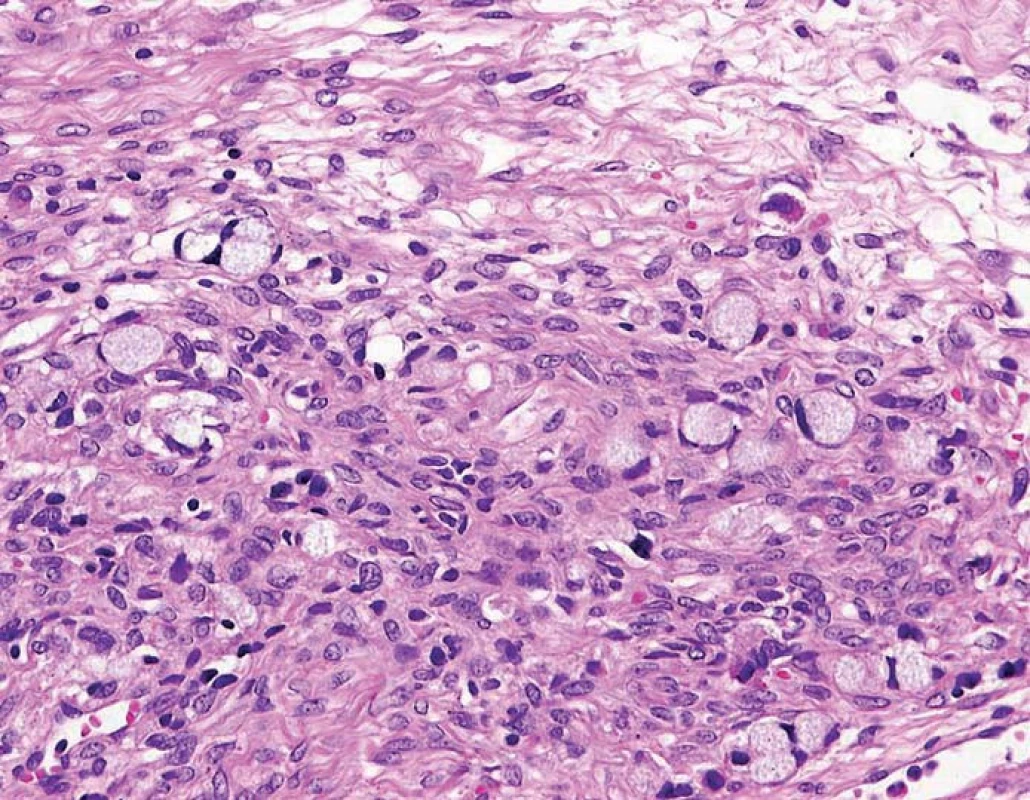
V únoru 2013 byla provedena operace jaterních metastáz, která zahrnovala pravostrannou hepatektomii s cholecystektomií. Všechna čtyři nalezená ložiska byla metastázami se stejným imunohistochemickým profilem jako nádor primární.
Začátkem dubna 2013 bylo v plánu zahájení adjuvantní systémové léčby, ale kontrolní CT odhalilo pravostranný megaureter. Následné potvrzení nefunkčnosti pravé ledviny vedlo k odložení chemoterapie a přípravě k pravostranné nefrektomii. V květnu téhož roku si však pacientka začala stěžovat na zhoršený vizus, diplopii a exoftalmus. Bylo provedeno kontrolní CT, které popsalo nejen mnohočetné postižení dutiny břišní (resekční plocha jater, vzestupný tračník a retroperitoneální lymfatické uzliny), ale i metastatické postižení levé orbity způsobující popsané potíže (obr. 2).
Image 2. CT hlavy s nálezem metastázy orbity způsobující exoftalmus, která destruuje kostní ohraničení orbity. 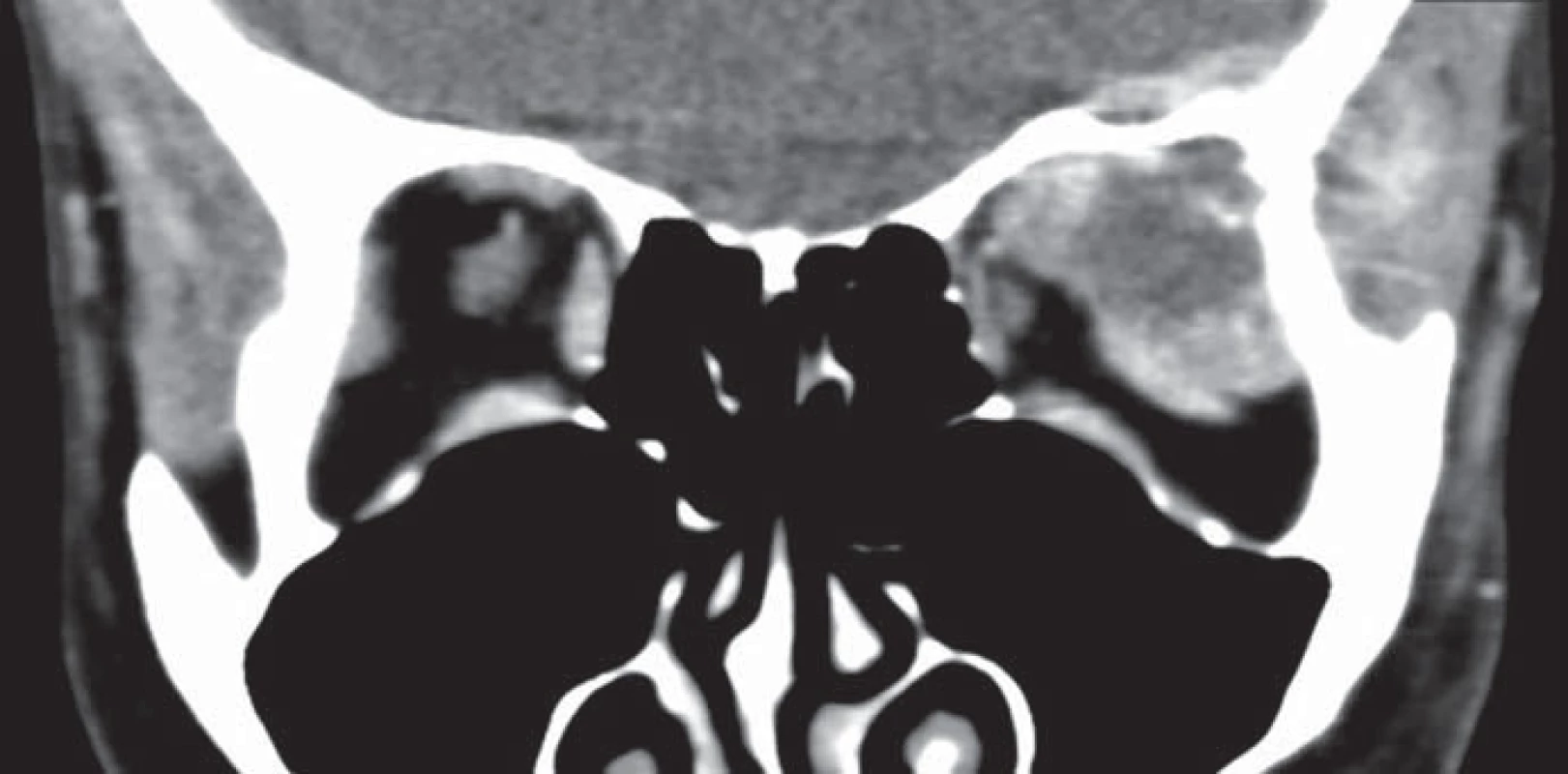
Z důvodu inoperability nálezu byla indikována systémová cytotoxická léčba. Pacientka podstoupila dva cykly monoterapie – kapecitabine (850 mg/ m2 2krát denně, 1. – 14. den, 21denní cyklus). Analog somatulinu byl nasazen pro opakované flushe (somatuline, 60 mg, 28denní cyklus). Jelikož největší tíha obtíží byla způsobena metastázou v orbitě, byla provedena paliativní radioterapie ložiska brzdným zářením 2,5 Gy/frakci do totální referenční dávky 25 Gy. (obr. 3). Systémová léčba byla ukončena v červenci 2013, kdy byla potvrzena progrese onemocnění. Symptomatická terapie byla doplněna pravidelnou aplikací somatulinu, a to až do smrti nemocné, která nastala 13. srpna 2013.
Image 3. CT hlavy s nálezem progrese metastázy orbity přes systémovou léčbu kapecitabinem a lokální paliativní radioterapii ložiska. 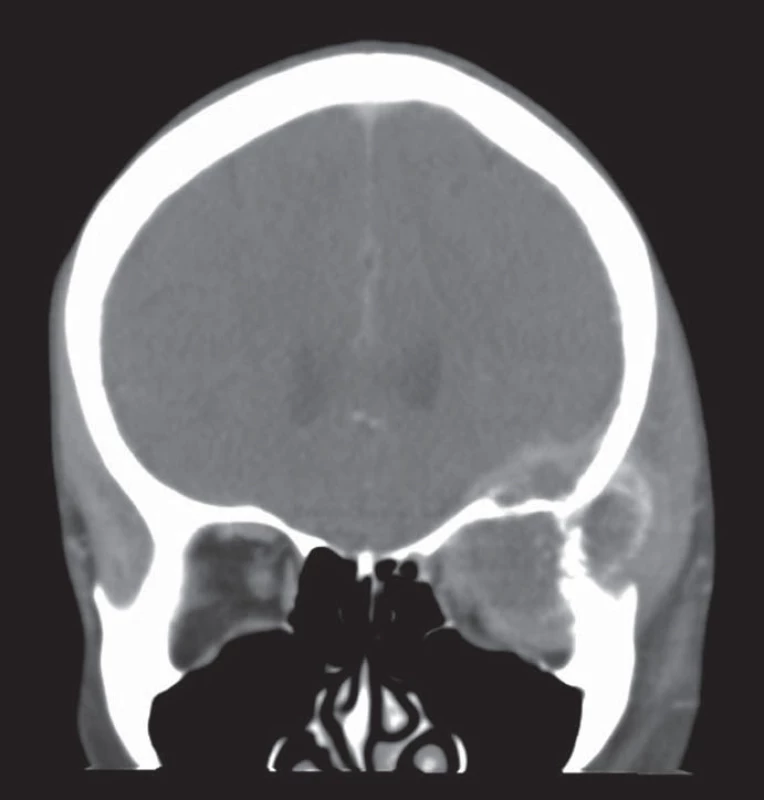
Diskuze
Primární nádory apendixu jsou vzácným onemocněním, kdy se udává, že v každém třístém preparátu po apendektomii je zachycen karcinoid. GCC je patologickou jednotkou odlišnou od adenokarcinomu a karcinoidu. V dostupné literatuře se udává méně než 5% zastoupení ze všech primárních neoplazií tohoto orgánu [1]. Průměrný věk při záchytu je 58,5 roku věku, s velmi širokým rozsahem od 20 do 89 let. To je ve velkém kontrastu s průměrným věkem prezentace karcinoidů (38 let), méně již pak adenokarcinomů (60 let). Vyšší incidence byla popsána v bílé rase, se stejným zastoupením u obou pohlaví [2]. Věk námi popisované pacientky byl 50 let, což je nižší než v literatuře udávaný průměr.
U naší pacientky byla prvním symptomem bolest břicha, která imponovala jako gynekologický problém. Nespecifické potíže jsou typické pro GCC, stejně jako pro jiná nádorová onemocnění. Nejčastěji se jedná o bolest břicha imponující jako projevy apendicitidy, žaludečních či gynekologických obtíží. První symptomy mohou být ale i jiného charakteru, např. zažívací obtíže, chronická bolest břicha, hmatatelná rezistence či potíže urogenitálního traktu. V případě, že nádorové buňky produkují aktivní molekuly, může být prvním příznakem i nějaká forma karcinoidového syndromu. Není ale vzácností zcela asymptomatický pacient, u něhož je patologická jednotka zjištěna až histologickým vyšetřením apendixu odebraného z jiné indikace [2,3].
Finální diagnóza je vždy v rukou patologa, a to na základě histologického vyšetření. Tang et al definovali tři základní skupiny GCC – skupina A, také nazývána typický GCC, je definována pohárkovými buňkami tvořícími shluky nebo dlouhé provazce, bez známek desmoplazie, s minimálními buněčnými atypiemi a absencí porušení architektoniky stěny apendixu. V případě adenokarcinomu ex GCC s buňkami tvaru pečetního prstenu (skupina B) jsou pohárkové buňky uspořádány v nepravidelných velkých shlucích. Dále je pro tuto skupinu typická infiltrace okolí jednotlivými buňkami s desmoplazií, buněčnými atypiemi a destrukcí stěny apendixu. V případě skupiny C (adenokarcinom ex GCC špatně diferencovaný) nacházíme ohniska pohárkových buněk v prostředí buněk špatně diferencovaných, které mohou vykazovat znaky buněk tvaru pečetního prstenu [4 – 6].
Histogeneticky se nyní předpokládá, že se GCC vyvíjí z typického karcinoidu. Pohárkové buňky se vyvíjejí z pluripotentní kmenové buňky APUD sytému (intestinal amine precursor uptake and decarboxylase system) z endodermu. Tyto nádory vykazují silnou pozitivitu pro cytokeratin 20 (CK20), CK 7, neuron-specifickou enolázu (NSE), chromogranin A, serotonin, lysozym a vimentin. Neuroendokrinní granula jsou také pozitivní na NSE, chromogranin A, synaptophysin, serotonin, substanci P a S-100 protein [4,6,7]. V případě naší pacientky byl tumor pozitivní na AE 1–3, chromogranin A a synaptophysin.
Stancu et al popsali v GCC ztrátu alel 11q, 16q a 18q (11 %, 11 % a 39 %). Tyto výsledky jsou velmi shodné s nálezy ve střevních karcinoidech (27 %, 37 % a 56 %), ale ne v karcinomech apendixu. Testovaly se i mutace KRAS, Smad4 a β-cateninu, které jsou častým nálezem v adenokarcinomu tlustého střeva, ale v GCC nebyly prokázány [8].
Hlavním prognostickým faktorem onemocnění je jeho stadium. Pětileté OS pro jednotlivá stadia: 100 % pro staduim I, 76 % pro stadium II, 22 % pro stadium III a 14 % pro stadium IV. Medián OS je pro grade 1 – 119 měsíců, pro grade 2 – 43 měsíců a pro grade 3 – 31 měsíců [3]. GCC je méně agresivního biologického chování než adenokarcinom, ale více než klasický karcinoid. Onemocnění metastazuje v 15 – 60 % případů, a to více u pacientů staršího věku (karcinoid jen 2 – 5 %) [4,7]. Nejčastěji se onemocnění šíří do ovarií, pánve, břišní dutiny, kostí a lymfatických uzlin. Hematogenní metastázy do jater a jiných parenchymatických orgánů jsou velmi vzácné [7]. Tento fakt je v ostrém kontrastu s naším případem, kde bylo metastatické postižení jater přítomno již v době diagnózy. Metachronní metastázy byly navíc diagnostikovány v břišní dutině, lymfatických uzlinách retroperitonea, jater a orbity již dva měsíce po primární operaci. Takto agresivní chování je pro tento druh onemocnění velmi netypické, a to i při nepříznivém histologickém nálezu.
Základem léčby GCC je dostatečně radikální chirurgická resekce. Při vzácnosti onemocnění a z toho vyplývajících omezených klinických zkušenostech jsou léčebná doporučení prakticky shodná s těmi pro adenokarcinomy dané oblasti. Stadium I a II GCC jsou léčeny samotnou chirurgickou operací. V případě stadia III je pak doporučeno podání adjuvantní chemoterapie na bázi 5-FU (FuFa/ FOLFOX). V případě diseminovaného či inoperabilního onemocnění je pak hlavní modalitou systémová léčba opět na bázi 5-FU (FOLFOX, FOLFIRI) [7,9]. V případě jejího selhání je možné v 2. linii použít monoterapii či kombinaci vybraných cytostatik. Určitý, byť velmi omezený efekt prokázala cytostatika: streptozotocin, cisplatina, etopozid a interferon α[7,9,10]. V našem případě jsme se pokusili ovlivnit onemocnění podáním kapecitabinu, který však selhal již po druhém cyklu.
V prezentované kazuistice popisujeme případ velmi agresivně se chovajícího GCC apendixu metastazujícího do jater a orbity, s velmi špatnou odpovědí na systémovou léčbu.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
MUDr. Vít M. Matějka
Onkologická a radioterapeutická klinika LF UK a FN Plzeň
alej Svobody 80
304 60 Plzeň
e-mail: matejkavm@fnplzen.cz
Obdrženo: 2. 2. 2016
Přijato: 25. 4. 2016
Sources
1. McGory ML, Maggard MA, Kang H et al. Malignancies of the appendix: beyond case series reports. Dis Colon Rectum 2005; 48(12): 2264 – 2271.
2. McCusaker ME, Coté TR, Clegg LX et al. Primary malignant neoplasms of the appendic: a population-based study from the surveillance, epidemiology and end results program 1973 – 1998. Cancer 2002; 94(12): 3307 – 3312.
3. Anderson NH, Somerville JE, Johnston CF et al. Appendiceal goblet cell carcinoids: a clinicopathological and immunohistochemical study. Histopathology 1991; 18(1): 61 – 65.
4. Tang LH, Shia J, Soslow RA et al. Pathologic classification and clinical behavior of the spectrum of goblet cell carcinoid tumors of the appendix. Am J Surg Pathol 2008; 32(10): 1429 – 1443.
5. Toumpanakis C, Standish RA, Baishnab E et al. Goblet cell carcinoid tumors (adenocarcinoid) of the appendix. Dis Colon Rectum 2007; 50(3): 315 – 322.
6. Mitra B, Pal M, Paul B et al. Goblet cell carcinoid of appendix: a rare case with literature review. Int J Surg Case Rep 2013; 4(3): 334 – 337. doi: 10.1016/ j.ijscr.2013.01.007.
7. Roy P, Chetty R. Goblet cell carcinoid tumors of the appendix: an overview. World J Gastrointest Oncol 2010; 2(6): 251 – 258. doi: 10.4251/ wjgo.v2.i6.251.
8. Stancu M, Wu TT, Wallace C et al. Genetic alterations in goblet cell carcinoids of the vermiform appendix and comparison with gastrointestinal carcinoid tumors. Mod Pathol 2003; 16(12): 1189 – 1198.
9. Pham TH, Wolff B, Abraham SC et al. Surgical and chemotherapy treatment outcomes of goblet cell carcinoid: a tertiary cancer center experience. Ann Surg Oncol 2006; 13(3): 370 – 376.
10. Butler JA, Houshiar A, Lin F et al. Goblet cell carcinoid of the appendix. Am J Surg 1994; 168(6): 685 – 687.
Labels
Paediatric clinical oncology Surgery Clinical oncology
Article was published inClinical Oncology

2016 Issue 3-
All articles in this issue
- História onkológie na Slovensku
- Diagnóza Lynchova syndromu od patologa
- Současné možnosti predikce odpovědi na cílenou anti-EGFR léčbu metastatického kolorektálního karcinomu
- Vliv předoperační radiochemoterapie na hustotu CD8+ tumor infiltrujících lymfocytů adenokarcinomu rekta
- Ložisková amyloidóza v dutině nosní
- Karcinoid z pohárkových buněk apendixu metastazovaný do orbity – klinická kazuistika a přehled literatury
- Vyhodnocení výživových zvyklostí ve studii karcinomu pankreatu
- Mapování psychologického distresu po 4,5 letech u pacientek s diagnózou karcinomu prsu v porovnání se zdravou populací
- Clinical Oncology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- História onkológie na Slovensku
- Diagnóza Lynchova syndromu od patologa
- Ložisková amyloidóza v dutině nosní
- Vyhodnocení výživových zvyklostí ve studii karcinomu pankreatu
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

