-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Celiakie – doporučený postup pro diagnostiku a terapii u dětí a dospívajících
Autoři: P. Frühauf 1,6; J. Bronský 1,3; P. Dědek 1,4; J. Nevoral 1,3; R. Kotalová 1,3; J. Sýkora 1,5; N. Szitányi 2,7; A. Šebková 2,8; L. Zahradníček 1,9
Působiště autorů: Pracovní skupina pro dětskou gastroenterologii a výživu České pediatrické společnosti ČLS J. E. Purkyně 1; Odborná společnost praktických lékařů pro děti a dorost 2; Pediatrická klinika 2. LF UK a FN Motol, Praha 3; Dětská klinika, FN a LF UK, Hradec Králové 4; Dětská klinika FN a LF UK, Plzeň 5; Klinika dětského a dorostového lékařství 1. LF UK a VFN, Praha 6; PLDD Praha 7; PLDD Plzeň 8; Dětská klinika Masarykovy nemocnice, Ústí nad Labem 9
Vyšlo v časopise: Čes-slov Pediat 2016; 71 (3): 175-183.
Kategorie: Doporučené postupy
1. DEFINICE
Celiakie (glutensenzitivní enteropatie) je celoživotní imunitně zprostředkované systémové onemocnění vyvolané konzumací lepku (glutenu) a příbuzných prolaminů u geneticky predisponovaných jedinců [1]. Onemocnění je charakterizované variabilní kombinací různých klinických projevů, pozitivitou protilátek specifických pro celiakii, přítomností HLA-DQ2 nebo HLA-DQ8 haplotypů a enteropatií. Imunitní reakce je příčinou léze sliznice tenkého střeva. Obsah lepku a příbuzných prolaminů je nejvyšší v pšenici a v sestupném pořadí následují žito, ječmen a oves. Frakce lepku rozpustná v alkoholu je gliadin.
2. EPIDEMIOLOGIE
Všeobecně je udáváno, že v současné době se manifestuje celiakie u 1 % populace na světě s převahou žen 2–3 : 1. Poměr diagnostikovaných a nediagnostikovaných je udáván 1 : 3–5 pro dětskou i dospělou populaci. V posledních letech se ukazuje, že prevalence i incidence narůstají nejen kvůli lepším znalostem a diagnostickým možnostem, ale také díky faktickému vzrůstu počtu onemocnění, především mimostřevních. Incidence v Evropě je udávána od 0,1 do 3,7/1000 živě narozených/rok a pro dospělou populaci 1,3–39/100 000/rok [2–6]. V České republice se předpokládá podle publikací ze začátku tisíciletí prevalence celiakie v rozmezí 1 : 200–1 : 250, tj. 40 000 až 50 000 celiaků [7–9]. Přesto je v současné době diagnostikováno a dispenzarizováno nejvýše 15 % z celkového počtu postižených [10].
3. FAKTORY, KTERÉ SE PODÍLEJÍ NA VZNIKU CELIAKIE
Celiakie je charakterizována [1]:
- a) genetickou predispozicí: HLA-DQ2 (cca 95 % nemocných) nebo HLA-DQ8 (cca 5 %) – v populaci je 35–40 % obyvatel s HLA-DQ2 nebo HLA-DQ8 – celiakií však onemocní pouze 1 % populace;
- b) vyvolávajícím faktorem – lepkem;
- c) vysoce specifickou a senzitivní protilátkou – proti rekombinantní humánní tkáňové transglutamináze 2. typu (anti-TG2), která hraje centrální roli v patogenezi celiakie, protože potencuje imunogenicitu lepkových peptidů v tenkém střevě cestou deaminace.
4. KLINICKÉ PROJEVY
Celiakie má několik forem (viz tab. 1).
Tab. 1. Klinické formy celiakie. 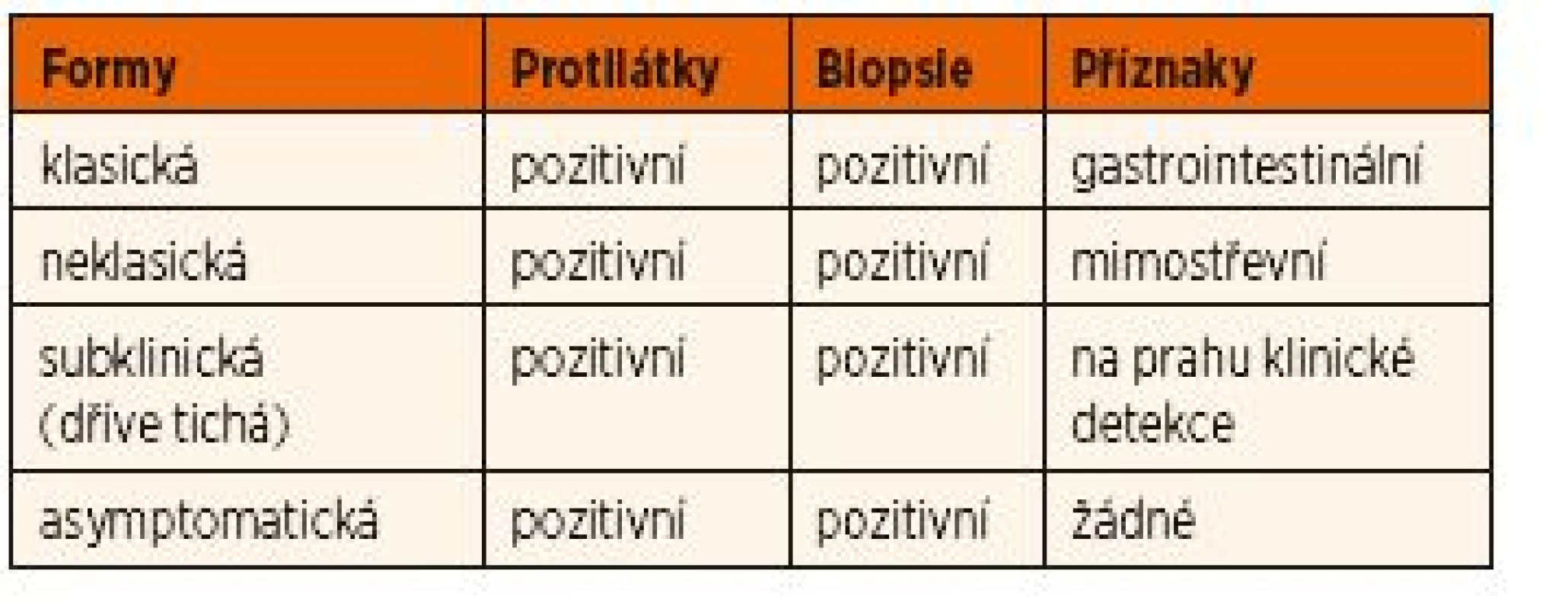
1. Klasická forma onemocnění
Pacienti s klasickou formou celiakie mají známky a symptomy malabsorpce – průjmové stolice, steatorheu, nechutenství (ev. zvracení), úbytek tělesné hmotnosti a poruchu růstu. Tato symptomatologie je častější u dětí.
2. Neklasická forma onemocnění
Pacienti s neklasickou formou onemocnění nemají gastrointestinální symptomy. K projevům patří:
- kostní a svalové projevy (u dětí především malý růst, osteoporóza)
- kožní a slizniční projevy (dermatitis herpetiformis Duhring)
- hematologické projevy (jediným příznakem celiakie může být hypochromní anémie nereagující na běžnou léčbu železem)
- projevy v oblasti reprodukce (pozdní menarche, amenorhea, spontánní potraty, infertilita)
- neurologické projevy (mozečková ataxie, periferní neuropatie)
- psychické (depresivní stavy, včetně endogenních depresí s těžkým průběhem a suicidálními tendencemi)
- různé (zvýšené jaterní enzymy, nevysvětlený úbytek tělesné hmotnosti, nevysvětlený únavový syndrom, dráždivý tračník).
3. Subklinická celiakie
Nevýrazné symptomy, které jsou na prahu klinické detekce.
4. Asymptomatická celiakie je nalézána většinou screeningem v rizikových skupinách, jedinci často mívají nevýrazné symptomy a ve skutečnosti patří do skupiny se subklinickou celiakií.
Potencionální celiakie nemá žádnou klinickou symp-tomatologii, má pozitivní protilátky a negativní biopsii (pozor na její adekvátnost). Tito pacienti nemají držet dietu, dokud není diagnóza biopticky potvrzena.
Refrakterní celiakie – malabsorpční symptomy přetrvávají nebo se vracejí spolu s atrofií klků navzdory přísné bezlepkové dietě trvající déle než 12 měsíců. Vyloučeny musí být jiné příčiny atrofie klků nebo maligní onemocnění. V případě pozitivity protilátek specifických pro celiakii je třeba vyloučit především porušování bezlepkové diety. U refrakterní celiakie se pravidelně jedná o dospělé pacienty.
5. PŘIDRUŽENÁ ONEMOCNĚNÍ
S celiakií se sdružují především autoimunitní onemocnění. Výskyt celiakie u některých autoimunitních onemocnění je i více než 10x vyšší než v běžné populaci. Celiakie je často asymptomatická nebo její projevy mohou být překryty jiným onemocněním. Prevalence asociovaných onemocnění je uváděna u dětí ve 20,7 % a u dospělých ve 30,1 % [11]. Vyšší počet asociovaných onemocnění u dospělých je vysvětlován delší expozicí lepku. Je rovněž udáváno, že mezi těmi, kteří dodržují dietu, je menší výskyt asociovaných chorob [12].
Podle současných doporučení ESPGHAN [1] je u dětí a adolescentů s některými onemocněními (viz tab. 2) spojeno zvýšené riziko výskytu celiakie. U ostatních onemocnění je prevalence výskytu celiakie mezi 0,5–1 %, tedy stejná jako pravděpodobná prevalence v běžné populaci.
Tab. 2. Onemocnění asociovaná s celiakií. 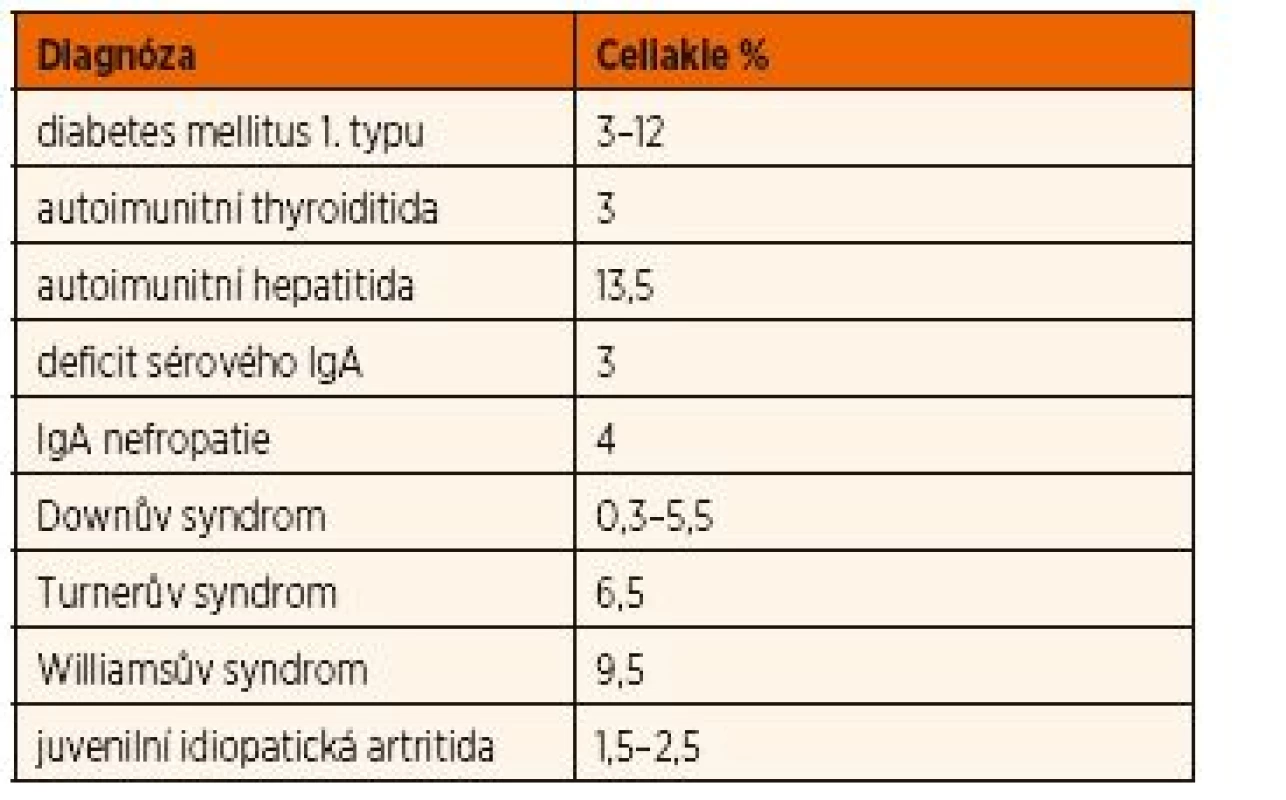
Maligní onemocnění a celiakie
Maligní lymfom, tj. T-lymfom sdružený s enteritidou (Enteritis Associated T-Cell Lymphoma, EATCL) je nejvýznamnější komplikací celiakie a tvoří polovinu všech malignit nalézaných u celiakie. Celková asociace všech nehodgkinských lymfomů s celiakií je však méně častá, než se dříve myslelo (relativní riziko je ≤10).
6. DIAGNOSTIKA
Diagnóza celiakie [1] je postavena na základních kritériích – enteropatie (nálezu atrofie klků, hyperplazie krypt a zvýšeného počtu intraepiteliálních lymfocytů v době, kdy pacient konzumuje stravu obsahující lepek) v přítomnosti protilátek anti-TG2 a úplné klinické remisi onemocnění a vymizení protilátek při bezlepkové dietě.
- Diagnostiku u symptomatických pacientů zahajujeme vyšetřením protilátek specifických pro celiakii (viz obr. 1).
- U vybraných asociovaných chorob (viz tab. 2) a u asymptomatických jedinců zahajujeme diagnostiku vyšetřením HLA-DQ2 a HLA-DQ8, je-li to možné (dostupné), jinak též vyšetřením protilátek. Vzhledem k vysoké prevalenci HLA-DQ2 a HLA-DQ8 u pacientů s diabetem 1. typu je vhodné jako screeningové vyšetření provádět vyšetření protilátek.
- Diagnóza je definitivně potvrzena z bioptického vzorku sliznice tenkého střeva vyjma jasně definované skupiny dětských pacientů, u nichž lze stanovit diagnózu bez biopsie.
Nová doporučení ESPGHAN [1] poprvé uvádějí možnost neprovedení biopsie u specifické skupiny pacientů – viz dále (odstavec „Kdy lze stanovit diagnózu celiakie bez biopsie?“, s. 179).
Protilátky specifické pro celiakii
Stanovení protilátek specifických pro celiakii je v současné době nejspecifičtější metodou k vyhledávání pacientů. Všechna ostatní vyšetření včetně biochemických, hematologických a zobrazovacích mohou poskytnout patologické nálezy, ale jejich specificita je nízká, neboť podobné odchylky mohou provázet i jiná onemocnění při malabsorpčním syndromu. Nezbytnou podmínkou diagnostického sérologického vyšetření protilátek je dostatečná konzumace lepku (alespoň 15 g/den) a vyšetření hladin imunoglobulinů.
- Největší přesnosti v diagnóze celiakie dosahují protilátky ve třídě IgA proti rekombinantní humánní tkáňové transglutamináze typ 2 (anti-TG2) a endomyziu (EMA), viz tabulka 3. Pozitivita protilátek může předcházet vývoj histologických změn v tenkém střevě.
- Vyšetření protilátek se provádí v séru. V jiných biologických materiálech není validováno.
- V době do vyšetření protilátek musí být pacient na dostatečné zátěži lepkem. Snížený příjem lepku může vést k falešně negativnímu nálezu. Proto je zahájení bezlepkové diety před definitivním stanovením diagnózy celiakie hrubou chybou. Důležitá je i anamnéza, neboť některé rodiny již dodržují bezlepkovou dietu jako součást svého životního stylu.
- Diagnostiku zahajujeme vyšetřením celkového IgA a anti-TG2 ve třídě IgA. Použití jiných protilátek nebo bloku „celiakálních protilátek“, zahrnujících protilátky ve třídě IgG proti TG2, EMA i deamidovanému gliadinu (DGP), není v primodiagnostice u pacientů bez IgA deficitu doporučeno a může být zavádějící.
- Při IgA deficitu (pod 0,2 g/L) je nutno vyšetřit EMA a anti-TG2 (případně protilátky proti DGP) ve třídě IgG.
- Při nálezu pozitivních protilátek má být pacient odeslán k dětskému gastroenterologovi.
- U symptomatických pacientů s nižšími hodnotami anti-TG2 (do 10násobku normy) a současné pozitivitě EMA je třeba provést biopsii. U nízkých titrů anti-TG2 a negativních EMA je třeba pacienta sledovat a s odstupem času anti-TG2 a EMA vyšetření opakovat.
- Mírná pozitivita anti-TG2 (přibližně do 3násobku normy) může být falešně pozitivní při autoimunitní hepatitidě, psoriáze, kardiologických onemocněních, některých infekcích (EBV), m. Down.
- Anti-TG2 může být také falešně negativní při malé konzumaci lepku, u enteropatií ztrácejících bílkoviny, léčbě imunosupresivy apod. Při přetrvávajícím důvodném podezření na celiakii je možné vyšetření protilátek opakovat v intervalu 3–6 měsíců. Při potvrzené negativitě je třeba pátrat po jiné příčině obtíží.
- egativita protilátek podle výše uvedeného postupu při normální zátěži lepkem diagnózu celiakie prakticky vylučuje. V takovém případě již není doporučeno podnikat žádné další diagnostické kroky (enterobiopsie, vyšetření HLA apod.).
- Dříve vyšetřované protilátky proti nativnímu gliadinu (AGA) nemají v algoritmu diagnostiky celiakie již žádné místo. Nedoporučuje se je vyšetřovat pro jejich nízkou specificitu a senzitivitu.
- Při orientačním zachycení pozitivity protilátek anti-TG v rychlém (bedside) testu je třeba potvrdit pozitivitu protilátek vyšetřením v laboratoři ze séra. Bedside test není diagnostickým vyšetřením, jeho negativita diagnózu nevylučuje a při přetrvávajícím podezření je třeba doplnit vyšetření ze séra.
Tab. 3. Senzitivita a specificita protilátek [13]. ![Senzitivita a specificita protilátek [13].](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/b76b1fa710c4c1c40598f763d9cd75ae.jpg)
Legenda: EMA – protilátky proti endomyziu anti-DGP – protilátky proti deamidovanému gliadinu anti-TG2 – protilátka proti rekombinantní humánní tkáňové transglutamináze 2. typu Genetické vyšetření – určení HLA-DQ2/DQ8 [1, 14]
HLA antigeny II. třídy jsou odpovědny asi za 40 % vnímavosti k celiakii. Zbytek (60 %) genetické vnímavosti je výsledkem neznámého počtu non-HLA genů, z nichž každý může přispívat ke vzniku onemocnění.
- HLA-DQ2 má 95 % pacientů s celiakií, většina ze zbývajících 5 % pacientů má heterodimer DQ8. Přibližně 35–40 % zdravých lidí má také stejné haplotypy, celiakií však onemocní pouze 1 % populace. Genetické vyšetření se proto nehodí k vyhledávání pacientů s celiakií v neselektované populaci a k jejich rutinní diagnostice!
- Stanovení HLA-DQ2 a HLA-DQ8 je užitečným vyšetřením k vyloučení celiakie nebo ke zjištění, že diagnóza celiakie je vysoce nepravděpodobná při nepřítomnosti obou markerů. Vyšetření by mělo být proto provedeno u nejistých diagnóz.
- U vybrané skupiny symptomatických pacientů, u kterých lze neprovést biopsii (viz dále), je doporučeno vyšetřit HLA k posílení diagnózy. Budoucnost však ukáže skutečný význam stanovení HLA v této situaci.
- Vyšetření HLA-DQ2 a HLA-DQ8 může být falešně negativní např. v důsledku laboratorní chyby. Při negativitě a přetrvávajícím podezření na celiakii je proto vhodné genetické vyšetření opakovat. Při potvrzené negativitě HLA je třeba pátrat po jiné příčině obtíží.
- U asymptomatických jedinců s přidruženými onemocněními (viz tab. 2) a u příbuzných 1. stupně pacientů s celiakií je v rámci selektivního screeningu doporučeno začít vyšetřením HLA. Při pozitivitě HLA pokračujeme nadále stanovením protilátek a při jejich pozitivitě diagnostický postup dokončuje dětský gastroenterolog.
Biopsie a histologický nález
Nález enteropatie (atrofie klků, hyperplazie krypt a zvýšeného počtu intraepiteliálních lymfocytů v době, kdy pacient konzumuje stravu obsahující lepek) je základním stavebním kamenem diagnostiky celiakie [1].
- Bioptické vyšetření k potvrzení/vyloučení celiakie je indikováno pouze v případě pozitivních protilátek.
- Pokud je z bioptického vzorku odebraného z jiného důvodu vysloveno podezření na celiakii, je nutné doplnit vyšetření protilátek. Pokud jsou protilátky negativní, je třeba pátrat po jiné příčině bioptického nálezu.
- Bioptický vzorek lze získat sací kapslí zavedenou pod rtg kontrolou, optimálně z místa duodenojejunálního přechodu, nebo endoskopicky s tím, že je doporučeno odebrat z postpapilárního duodena 4 vzorky a z bulbu minimálně 1 vzorek.
- Změny střevní sliznice mohou mít i jinou příčinu než lepek: alergii na bílkovinu kravského mléka, střevní infekce, imunodeficience [15], minimální změny odpovídající Marsh 1 mohou být u Crohnovy choroby, infekce Helicobacter pylori, bakteriálních a parazitárních infekcí, při užívání nesteroidních antirevmatik (tab. 4).
- V počátečních stadiích onemocnění nebo u velmi malých dětí může být slizniční léze okrskovitá a nemusí být biopticky plně zastižena.
- Také nedostatečně kvalitní bioptický vzorek může vést k falešně pozitivní i falešně negativní diagnóze. V případě pochybností je doporučeno biopsii opakovat.
Tab. 4. Klasifikace změn jejunální/duodenální sliznice podle Marshe/Oberhubera [1, 14, 16, 17]. ![Klasifikace změn jejunální/duodenální sliznice podle Marshe/Oberhubera [1, 14, 16, 17].](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/588dd233f33495f6bbd1db253ed44694.jpg)
*IEL = intraepiteliální lymfocyty – ESPGHAN [1] připouští jako dolní hranici pro infiltrativní typ léze počet >25/100 epiteliálních buněk v jejunu, Oberhuber [16] udává počet >40/100, Dickson [17] udává v tzv. modifikované Marshově-Oberhuberově klasifikaci hranici >30/100 – IEL je tedy nutno vždy posuzovat po dohodě s příslušnou laboratoří, v našich podmínkách je obvykle používána hranice >40/100. Expoziční test lepkem
Zátěžový test lepkem je prováděn při jakýchkoliv pochybnostech o původní diagnóze celiakie. Nemá se provádět u dětí do pěti let a v pubertálním růstovém spurtu. Před zahájením testu by měl být znám výsledek HLA typizace. Je třeba, aby pacient měl dostatečný příjem lepku (alespoň 15 g/den). Během expozice je třeba sledovat autoprotilátky specifické pro celiakii. V případě přetrvávající negativity autoprotilátek a nepřítomnosti symptomů lze považovat test za dokončený po dvou letech expozice lepkem. Sledování pacienta má však být delší, protože relaps onemocnění je možný v horizontu až několika let.
Algoritmus diagnostického postupu u pacienta se symptomy podezřelými z celiakie [1]
Na celiakii má být pomýšleno u dítěte a adolescenta především tehdy, pokud má některý ze symptomů uvedených v tabulce 5.
Tab. 5. Nejčastější symptomy celiakie u dětí. 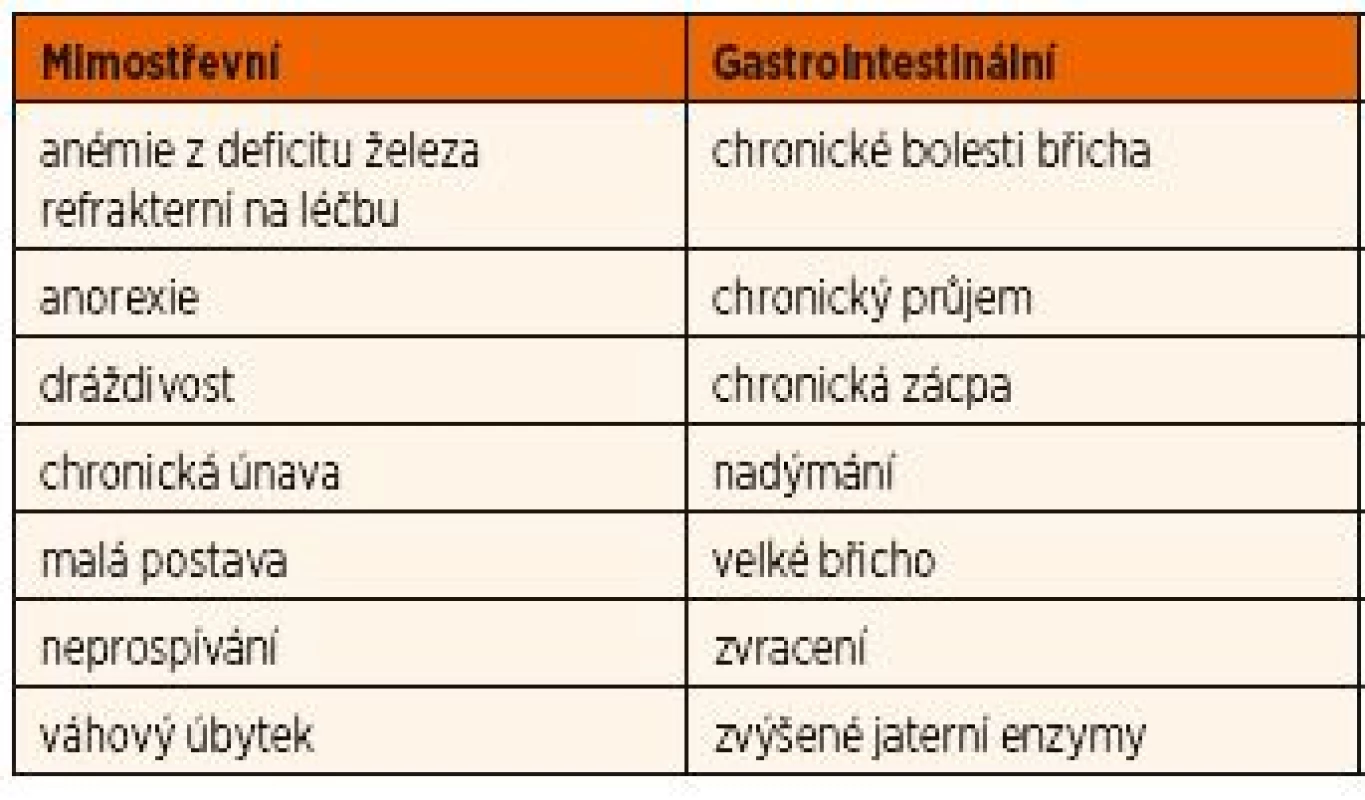
K rutinní diagnostice celiakie nejsou indikováni pacienti, jejichž příznaky jsou vysvětlitelné jinou diagnózou včetně např. pacientů, kteří splňují kritéria pro funkční recidivující bolesti břicha či funkční zácpu, kteří nemají varovné příznaky a/nebo dobře reagují na konvenční terapii. Prevalence těchto funkčních onemocnění v běžné dětské populaci je vysoká.
První krok k diagnostice celiakie u pacienta se symptomy je stanovení anti-TG2-IgA (za současného vyloučení deficitu sérového IgA) – viz obr. 1.
Obr. 1. Diagnostický algoritmus celiakie. 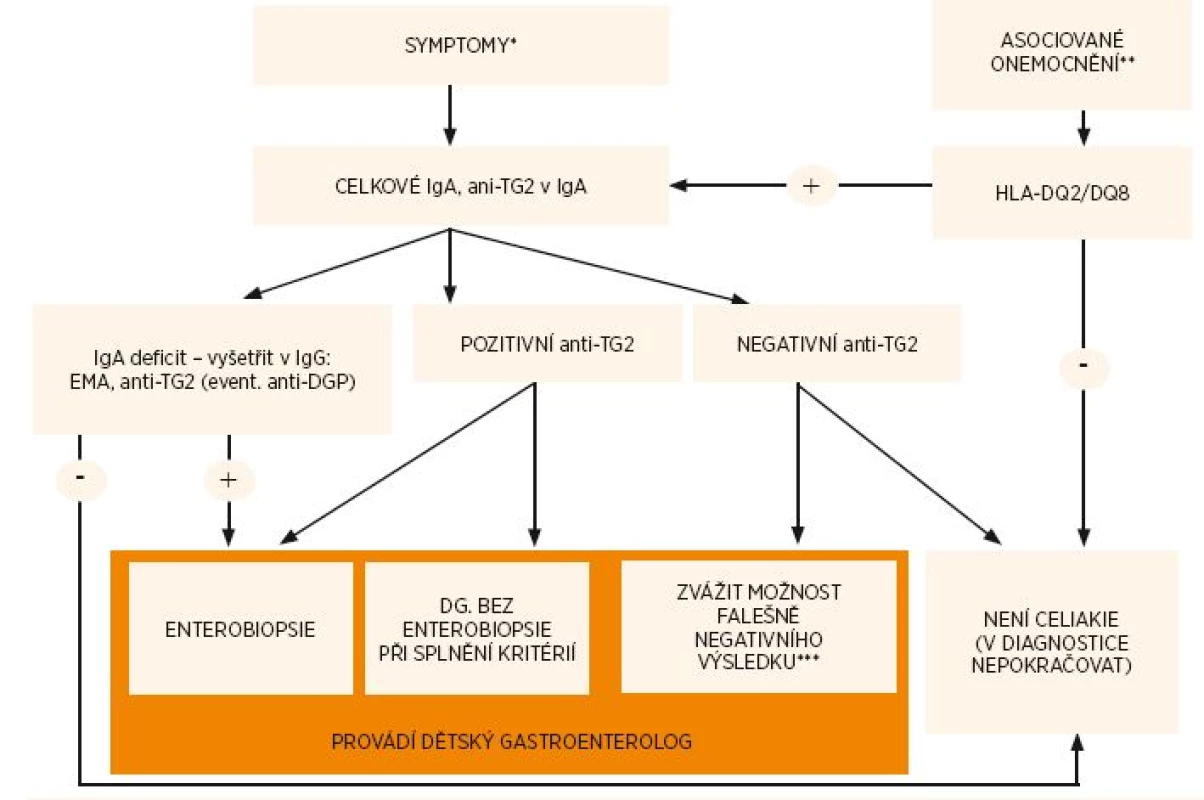
*Symptomy – viz tab. 5, **Asociovaná onemocnění – viz tab. 2. Vzhledem k vysoké prevalenci HLA-DQ2 nebo HLA-DQ8 u pacientů s diabetem 1. typu je vhodné jako screeningové vyšetření provádět anti-TG2, ***viz část věnovaná vyšetřování protilátek Kdy lze stanovit diagnózu celiakie bez biopsie?
U jasně definované skupiny dětských pacientů [1] lze stanovit diagnózu celiakie bez provedení biopsie. Toto rozhodnutí může učinit pouze lékař s příslušným vzděláním v oboru dětské gastroenterologie, a to na základě následujících kritérií:
- jsou přítomny klinické symptomy (viz tab. 5);
- není přítomen IgA deficit;
- pozitivita anti-TG2 nad 10násobek normy;
- pozitivita EMA z jiného vzorku a ověření 10násobné pozitivity anti-TG2;
- je vhodné doplnit vyšetření HLA-DQ2 a HLA-DQ8;
- symptomy onemocnění musí ustoupit po bezlepkové dietě.
Algoritmus diagnostického postupu u vyšetření asymptomatického jedince s genetickým rizikem celiakie [1]
Do této skupiny patří asymptomatičtí příbuzní 1. stupně pacientů s celiakií, pacienti s přidruženými autoimunitními onemocněními a rizikovými chorobami – viz tab. 2. U těchto jedinců se začíná stanovením HLA-DQ2 a HLA-DQ8 (obr. 1).
Pokud je průkaz HLA-DQ2 a HLA-DQ8 negativní, nemusí se rizikoví asymptomatičtí jedinci dále vyšetřovat. Pokud je HLA testování pozitivní (nebo nemůže být provedeno), vyšetřují se protilátky anti-TG2-IgA současně s vyšetřením celkového IgA. Jsou-li protilátky negativní a jedinec nemá deficit IgA, je diagnóza ce-liakie nepravděpodobná, nicméně onemocnění se může rozvinout později v dalších letech. Z těchto důvodů by se mělo testování protilátek provádět v pravidelných intervalech. Doporučuje se testovat děti v intervalech 1–3 let a tak předejít rozvoji nerozpoznané celiakie se škodlivým vlivem na růst a vývoj dítěte. U dítěte HLA-DQ2 nebo HLA-DQ8 pozitivního, u kterého je mezi příbuznými 1. stupně celiakie, se onemocnění může rozvinout až po řadě let, a proto je potřeba dítě sledovat minimálně do školních let. U diabetiků 1. typu [18, 19], i když je první sérologické vyšetření na celiakii v době diagnózy diabetu negativní, doporučuje se vyšetření opakovat v pravidelných intervalech (cca po 1–2 letech). U jedinců s genetickým rizikem celiakie (asociovaná onemocnění, příbuzní 1. stupně), kteří mají symptomy uvedené v tabulce 5, postupujeme podle algoritmu pro symptomatické pacienty.
7. MONITORACE PACIENTŮ S DIAGNOSTIKOVANOU CELIAKIÍ
Rodinám dětí s nově diagnostikovanou celiakií by měla být poskytnuta odborná konzultace týkající se problematiky bezlepkové diety. U prvostupňových příbuzných pacienta (sourozenci, rodiče) je doporučeno provést selektivní screening vyšetřením HLA-DQ2 a HLA-DQ8. Při nedostupnosti vyšetření HLA je doporučeno provést vyšetření anti-TG2 a celkového IgA.
Doporučení ESPGHAN [1], National Institute for Health and Care Excellence [20] a North American Society for Pediatric Gastroenterology Hepatology and Nutrition [21] jednoznačně neurčují, co při dispenzarizaci sledovat z hlediska možných nutričních deficiencí. Někteří doporučují v rámci dispenzarizace testovat i event. auto-imunitní thyreoiditidu, bez udání frekvence vyšetření [22]. Závěr práce, která se věnovala tomuto problému [23], je, že rutinní testování nutričních deficiencí a funkce štítné žlázy není efektivní, pokud nejsou při klinických kontrolách zjištěny poruchy růstu a udávány stížnosti na únavu.
Jako vhodné se zdá, po dosažení negativity autoprotilátek (mělo by nastat nejpozději do 12 měsíců od zahájení bezlepkové diety) jako projevu dodržování bezlepkové diety, jedenkrát ročně nemocného s celiakií vyšetřit v rámci dispenzarizace u pediatrického gastroenterologa, včetně podrobné anamnézy, posouzení dynamiky somatických parametrů a testovat dodržování diety prostřednictvím IgA anti-TG2 (v případě sníženého IgA i ve třídě IgG) s indikací dalších vyšetření až na základě subjektivních stesků a fyzikálního nálezu.
8. SCREENING CELIAKIE
Plošný screening celiakie není v současné době doporučován.
Cílený screening
Celiakie je nadále v české populaci nedostatečně diagnostikovaná. Příčinou je změna fenotypu choroby v posledních desetiletích. Střevní příznaky dominují jen u malých dětí. U starších dětí, mladistvých a zejména u dospělých převládají mimostřevní příznaky. Nejdůležitější opatření ke zlepšení současného stavu je cílený screening zaměřený na rizikové skupiny [1]. V dětském a adolescentním věku jsou k cílenému screeningu indikováni pacienti, u kterých jsou přítomny symptomy či onemocnění asociovaná s celiakií (viz tab. 2 a tab. 5),a příbuzní 1. stupně pacientů s celiakií. Dvoustupňový screening doporučuje u symptomatických pacientů v první etapě stanovení sérových protilátek anti-TG2-IgA a celkového IgA. Při selektivním deficitu IgA se stanoví anti-TG2-IgG. U asymptomatických pacientů (s asociovaným onemocněním nebo příbuzní 1. stupně) je doporučeno stanovit genotyp HLA-DQ2 a HLA-DQ8. Při jeho pozitivitě se pokračuje stanovením protilátek (podrobněji viz kapitola Diagnostika).
Rozšířené možnosti cíleného screeningu u dospělých pacientů upravuje věstník MZ ČR [24].
Vytipování možného nositele onemocnění provádějí: praktičtí lékaři, praktičtí lékaři pro děti a dorost, ambulantní specialisté.
9. ZAVÁDĚNÍ LEPKU DO VÝŽIVY KOJENCŮ [25]
Kojení a čas zavedení lepku do výživy kojenců nemají efekt na riziko rozvoje celiakie v dětském věku. V současné době se nicméně doporučuje zavádět lepek do stravy kojence v malém (2 lžičky pšeničné mouky do zeleninového příkrmu nebo dva piškoty do ovocného příkrmu) a postupně vzrůstajícím množství společně s ostatními nemléčnými příkrmy – obvykle mezi ukončeným 4. a ukončeným 7. měsícem věku.
Z praktického hlediska je tedy možno se držet v současnosti platných doporučení PSDG ČPS (viz www.gastroped.cz – v sekci „Doporučené postupy“) [26].
10. LÉČBA [10]
Celoživotní bezlepková dieta je jedinou kauzální terapií celiakie. Stanovení diagnózy celiakie a vyslovení požadavku bezlepkové diety znamená pro pacienta velkou psychickou zátěž. Úspěšné zavedení tohoto dietního režimu vyžaduje týmový přístup, který zahrnuje kromě pacienta jeho rodinu, lékaře, nutriční terapeutku a zájmovou organizaci celiaků, kterou má pacient s celiakií vždy vyhledat [27]. Účinnost bezlepkové diety předpokládá úplné vyloučení surovin, potravin a nápojů s obsahem obilovin (žita, pšenice, ječmene a ovsa).
Prolaminová frakce ovsa (aveniny) je menší a méně imunogenní než v ostatních obilovinách, ale oves je často kontaminován příměsí jiných obilovin (zejména ječmene) a k jeho kontaminaci může dojít také při výrobě. Přesto, že přibližně 95 % pacientů s celiakií může snášet oves, vždy u nového pacienta se začíná léčba bezlepkovou dietou i s vyloučením ovsa. Pokud pacient dosáhne remise onemocnění, je možné pod lékařským dohledem postupně zavádět i oves za pečlivého klinického a laboratorního sledování. Oves však nesmí být kontaminovaný jinými obilovinami obsahujícími lepek, což musí být ověřeno atestem. Běžný oves na trhu v ČR proto nelze doporučit jako součást bezlepkové diety.
Jako bezlepkové suroviny se používají rýže, kukuřice, sója, pohanka, loupané proso – jáhly, amarant a brambory. Sója může vyvolat vzácně alergickou reakci. Laik příměs lepku v řadě potravin i jiných výrobků nepředpokládá (uzeniny, kečup, hořčice, kypřící prášky do pečiva, zmrzlina, pomocné látky v lécích a mnoho dalších výrobků). Hlavní produkt používaný jako přísada do řady výrobků je pšeničný škrob, který ale obvykle obsahuje stopy lepku.
Množství lepku schopné vyvolat autoimunitní odpověď a zánětlivé změny střevní sliznice je velmi rozdílné u jednotlivých nemocných. Doporučuje se, aby denní příjem lepku u celiaka byl nižší než 50 mg [28]. U některých celia-ků však již 10 mg lepku může být provázeno slizničními změnami [29]. Proto je třeba, aby pacient omezil příjem lepku v maximální míře. Jsou pro to další důvody: Tíže infiltrativních změn sliznice tenkého střeva je úměrná zbytkovému množství lepku v potravě [30]. Obsah některých vitaminů (B1, B2, B12, D), minerálů (železa, vápníku, zinku, hořčíku) a vlákniny v potravinách bezlepkové diety může být nižší, než jsou doporučená množství, a podobně je tomu s celkovou energetickou hodnotou. Dodržování bezlepkové diety klade na pacienty velké finanční nároky. Příznivý účinek bezlepkové diety se dostavuje většinou v průběhu několika týdnů. Význam bezlepkové diety je třeba zvlášť vysvětlit celiakům s lehkou formou choroby a při malých nebo chybějících subjektivních obtížích. Nejčastější příčinou neúspěchu bezlepkové diety je její neúplné dodržování.
K dosažení vyvážené bezlepkové diety vedou tyto kroky [31]:
- Úvodní edukace zkušeným dietologem, kontakt s pacientským sdružením.
- Kontinuální sledování s cílem dosažení negativity protilátek a další dispenzarizací.
- Ovoce a zelenina denně, střídat druhy.
- Bezlepkové produkty s fortifikací železem a foláty.
- Pseudocereálie (pohanka, rebarbora, slzovka, laskavec – amarant, špenát, čirok, merlík, proso, milička), které nahrazují vlákninu obsaženou v lepkových cereálních produktech.
- Přirozeně bezlepková strava (sója, luštěniny, rýže, brambory, kukuřice, maso, ryby).
Legislativně je obsah lepku v potravinách řešen v Prováděcím nařízení komise (EU) č. 828/2014 ze dne 30. 7. 2014 o požadavcích na poskytování informací o nepřítomnosti či sníženém obsahu lepku v potravinách spotřebitelům [32]. Tvrzení „bez lepku“ lze použít pouze tehdy, neobsahuje-li potravina ve stavu, v němž je prodávána konečnému spotřebiteli, více lepku než 20 mg/kg potraviny. Potraviny označené údajem „velmi nízký obsah lepku“ mohou obsahovat lepek v maximálním množství 100 mg/kg. Oves obsažený v potravinách označovaných jako „bez lepku“ nebo „s velmi nízkým obsahem lepku“ musí být speciálně vyroben, připraven a/nebo zpracován tak, aby bylo zamezeno kontaminaci pšenicí, žitem, ječmenem nebo jejich kříženci, přičemž obsah lepku v ovsu nesmí být vyšší než 20 mg/kg.
Pacientská sdružení s celostátní působností
Sdružení celiaků České republiky (www.celiac.cz) a Společnost pro bezlepkovou dietu (www.celiak.cz) jsou organizacemi pacientů poskytující odborné a praktické informace a podávají rovněž kompletní přehled pomoci, kterou aktuálně poskytují zdravotní pojišťovny pacientům s celiakií. Podle údajů VZP byl v roce 2014 poskytnut příspěvek na bezlepkovou dietu 4360 pojištěncům ve věku do 18 let, což odpovídá 0,47 % pojištěnců VZP ve věku 0–18 let.
Podrobné informace pro pacienty s celiakií jsou také uvedeny na www.gastroped.cz v sekci „Pro pacienty“.
Compliance k bezlepkové dietě
Literární údaje uvádějí, že compliance je lepší, pokud je bezlepková dieta indikována ve věku pod čtyři roky [33], pacienti ve věku 12–14 let dodržují bezlepkovou dietu lépe než ve věku 15–17 let [34]. Biopsie v době diagnózy a další sledování zvyšuje compliance [35]. Pacienti zachycení na základě screeningu mají horší compliance než pacienti s klinickými obtížemi [36]. Prediktorem dobré compliance bezlepkové diety je výborná školní integrace a fungující sociální zázemí [37].
11. DIFERENCIÁLNÍ DIAGNOSTIKA [38]
Komplexní diferenciální diagnostika celiakie zahrnuje diferenciální diagnostiku jednotlivých symptomů onemocnění (průjem, anémie, porucha růstu, dermatitida apod.) a je nad rámec tohoto doporučení. Z praktického hlediska považujeme za vhodné zmínit některé diagnózy, které jsou v klinické praxi často s celiakií mylně zaměňovány:
Laktózová intolerance (intolerance laktózy můžebýt součástí manifestace celiakie, kdy v rámci poškození sliznice tenkého střeva je dočasně snížena aktivita enzymu laktázy, což je udáváno asi u poloviny pa-cientů s nově diagnostikovanou celiakií, takže zpočátku může být krátce nutná i dieta s omezením mléka), event. další poruchy absorpce mono - a disacharidů. Laktózová intolerance může být přítomna i u jiných gastrointestinálních onemocnění (akutní infekční gastroenteritida, idiopatické střevní záněty apod.) nebo v adolescenci jako první projev fyziologické hypolaktázie dospělých. Někdy je mylně nazývána „alergií na laktózu“.
Alergie na bílkovinu kravského mléka je one-mocnění typické pro kojence a malá batolata. Ob-vykle se tedy vyskytuje v jiném věkovém období než celiakie. Jen malé procento onemocnění (obvykle alergie časného typu) přetrvává do vyššího věku. Diagnostiku a léčbu provádíme podle doporučení PSDG ČPS (viz www.gastroped.cz – v sekci „Doporučené postupy“) [26].
Alergie na bílkovinu obilí (pšenice) a její diagnostika patří do rukou zkušeného alergologa. V zásadě je možno rozlišit alergii časného typu (IgE mediovanou), při níž dochází k okamžité (časné) reakci na potraviny s obsahem pšenice, a alergii opožděného typu (v řádu několika dnů). U časného typu alergie může být určitým přínosem vyšetření IgE protilátek proti lepku či bílkovině pšenice. Negativita protilátek však alergii nevylučuje, pozitivita ji jednoznačně neprokazuje. U obou typů alergií je k průkazu diagnózy nutný eliminačně-expoziční test. Před vyslovením podezření na tuto diagnózu musí být provedeno vyšetření anti-TG2 protilátek s negativním nálezem.
Neceliakální glutenová senzitivita je stav, který se projevuje u některých jedinců subjektivním ústupem nejrůznějších symptomů při vyřazení lepku ze stravy. Nejedná se o celiakii, kterou je potřeba před stanovením této diagnózy vždy vyloučit (stanovením anti-TG2 protilátek) stejně jako alergii na bílkovinu obilí. Neuvážené zavedení bezlepkové diety může zastřít skutečnou diagnózu celiakie. Na rozdíl od celiakie, která je celoživotní onemocnění, může být neceliakální glutenová senzitivita přechodným stavem. Není jasné, která z komponent obilných zrn spouští symptomy. Jedinou možností průkazu této diagnózy je dvojitě zaslepený eliminačně-expoziční test s lepkem, který je v podmínkách klinické praxe velmi obtížně proveditelný.
Použité zkratky
AGA – protilátky proti nativnímu gliadinu
anti-DGP – protilátky proti deamidovanému gliadinu
anti-TG2 – protilátka proti rekombinantní humánní tkáňové transglutamináze 2. typu
EBV – virus Epsteina-Barrové
EMA – endomyziální protilátky
ESPGHAN – Evropská společnost pro dětskou gastroen - terologii, hepatologii a výživu
EU – Evropská unie
HLA – hlavní histokompatibilní komplex
IEL – intraepiteliální lymfocyty
IgA, IgG – imunoglobulin A,G
PSDG ČPS – Pracovní skupina pro dětskou gastroentero - logii a výživu České pediatrické společnosti
VZP – Všeobecná zdravotní pojišťovna
Zdroje
1. Husby S, Koletzko S, Korponay-Szabó IR, et al.; ESPGHAN Working Group on Coeliac Disease Diagnosis; ESPGHAN Gastroenterology Committee; European Society for Pediatric Gastroenterology, Hepatology, and Nutrition. European Society for Pediatric Gastroenterology, Hepatology, and Nutrition guidelines for the diagnosis of coeliac disease. J Pediatr Gastroenterol Nutr 2012; 54 (1): 136–160.
2. Altobelli E, Paduano R, Petrocelli R, et al. Burden of celiac disease in Europe: a review of its childhood and adulthood prevalence and incidence as of September 2014. Ann Ig Med Prevent Comunita 2014; 26 : 485–498.
3. Whitacre CC. Sex differences in autoimmune disease. Nat Immunol 2001; 2 : 777–780.
4. Mustalahti K, Catassi C, Reunanen A, et al. The prevalence of celiac disease in Europe: results of a centralized, international mass screening project. Ann Med 2010; 42 : 587–595.
5. Kang JY, Kang AHY, Green A, et al. Systematic review: Worldwide variation in the frequency of coeliac disease and changes over time. Aliment Pharmacol Ther 2013; 38 : 226–245.
6. Mäki M, Mustalahti K, Kokkonen J, et al. Prevalence of celiac disease among children in Finland. N Engl J Med 2003; 348 : 2517–2524.
7. Kolek A, Vospělová J, Hermanová Z, et al. Celiac disease incidence in children and adolescents in Moravia, Czech Republic. J Pediatr Gastroenterol Nutr 2003; 36 : 506–507R.
8. Kotalová R, Nevoral J, Valtrová V, et al. Prevalence celiakie mezi rodiči a sourozenci dětí s celiakií. Čes-slov Pediat 2002; 57 : 415–418.
9. Vančíková Z, Chlumecký V, Sokol D, et al. The serologic screening for celiac disease in the general population (blood donors) and in some high-risk groups of adults (patients with autoimmune disease, osteoporosis and infertility) in the Czech Republic. Fol Microbiol 2001; 47 : 753–758.
10. Frič P, Keil R. Celiakie pro praxi. Med praxi 2011; 8 (9): 354–359.
11. Bottaro G, Cataldo F, Rotolo N, et al. The clinical pattern of subclinical/silent celiac disease: An analysis on 1026 consecutive cases. Am J Gastroenterol 1999; 94 : 691–696.
12. Cosnes J, Cellier C, Viol S, et al. Incidence of autoimmune diseases in celiac disease: Protective effect of the gluten-free diet. Clin Gastroenterol Hepatol 2008; 6 : 53–58.
13. Giersiepen K, Lelgemann M, Stuhldreher N, et al.; the ESPGHAN Working Group on Coeliac Disease Diagnosis. Accuracy of diagnostic antibody tests for coeliac disease in children: Summary of an evidence report. J Pediatr Gastroenterol Nutr 2012; 54 : 229–241.
14. Marsh MN. Gluten, major histocompatibility complex, and the small intestine: a molecular and immunobiologic approach to the spectrum of gluten sensitivity. Gastroenterology 1992; 102 : 330–354.
15. Walker-Smith JA, Guandalini S, Schmitz J, et al. Revised criteria for diagnosis of celiac disease. Arch Dis Child 1990; 65 : 909–911.
16. Oberhuber G, Granditsch G, Vogelsang H. The histopathology of coeliac disease: time for a standardized report scheme for pathologists. Eur J Gastroenterol Hepatol 1999 Oct; 11 (10): 1185–1894.
17. Dickson BC, Streutker CJ, Chetty R. Coeliac disease: an update for pathologists. J Clin Pathol 2006 Oct; 59 (10): 1008–1016.
18. Kordonouri O, Klingensmith G, Knip M, et al.; International Society for Pediatric and Adolescent Diabetes. ISPAD Clinical Practice Consensus Guidelines 2014. Other complications and diabetes-associated conditions in children and adolescents. Pediatr Diabetes 2014 Sep; 15 (Suppl 20): 270–278.
19. http://www.diab.cz/dokumenty/standard_dm1_12.pdf.
20. Downey L, Houten R, Murch S, Longson D; Guideline Development Group. Recognition, assessment, and management of coeliac disease: summary of updated NICE guidance. BMJ 2015 Sep 2; 351: h4513. doi: 10.1136/bmj.h4513.
21. Hill ID, Dirks MH, Liptak GS, et al. Guideline for the diagnosis and treatment of celiac disease in children: recommendations of the North American Society for Pediatric Gastroenterology, Hepatology and Nutrition. J Pediatr Gastroenterol Nutr 2005; 40 : 1–19.
22. Ventura A, Magazu G, Gerarduzzi T, Greco L. Coeliac disease and the risk of autoimmune disorders. Gut 2002; 51 : 897–898.
23. Wessels MM, van Veen II, Vriezinga SL, et al. Complementary serologic investigations in children with celiac disease is unnecessary during follow-up. J Pediatr 2015 Nov 4. pii: S0022-3476(15)01152-X. doi: 10.1016/j.jpeds.2015.09.078.
24. Cílený screening celiakie. Metodický pokyn MZ ČR. Věstník MZ ČR, částka 3, 2011.
25. Szajewska H, et al.; The PREVENTCD Study Group. Systematic review with meta-analysis: early infant feeding and coeliac disease-update 2015. Aliment Pharmacol Ther 2015; 41 : 1038–1054.
26. Pracovní skupina pro dětskou gastroenterologii a výživu ČPS – Doporučení pro výživu kojenců a batolat. Čes-slov Pediat duben 2014; 69 (Suppl): 1–47.
27. Case S. The gluten-free diet: how to provide eff ective education and resources. Gastroenterology 2005; 128 (Suppl 1): S128–S134.
28. Catassi C, Fabiani E, Lacono G, et al. A prospective, double-blind, placebo-controlled trial to establish a safe threshold for patients with celiac disease. Am J Clin Nutr 2007; 85 : 160–166.
29. Akobeng AK, Thomas AG. Systematic review: tolerable amount of gluten for people with celiac disease. Aliment Pharmacol Ther 2008; 27 : 1044–1052.
30. Catassi C, Rosini M, Ratsch IM, et al. Dose dependent effects of protracted ingestion of small amounts of gliadin in celiac disease children: a clinical and jejunal morphometrical study. Gut 1993; 34 : 1515–1519.
31. Penagini F, et al. Gluten-free diet in children: An approach to a nutritionally adequate and balanced diet. Nutrients 2013; 5 : 4553–4565.
32. http://eur-lex.europa.eu/legal-content/CS/TXT/?uri=CELEX%3A32014R0828.
33. Högberg L, Grodzinsky E, Stenhammar L. Better dietary compliance in patients with coeliac disease diagnosed in early childhood. Scand J Gastroenterol 2003; 38 : 751–754.
34. Ljungman G, Myrdal U. Compliance in teenagers with coeliac disease – a Swedish follow-up study. Acta Paediatr 1993; 82 : 235–238.
35. Bardella MT, Molteni N, Prampolini L, et al. Need for follow up in coeliac disease. Arch Dis Child 1994; 70 : 211–213.
36. Fabiani E, Corrao G, Barbato M, et al. Compliance with gluten-free diet in adolescents with screening-detected celiac disease: a 5-year follow-up study. J Pediatr 2000; 136 : 841–843.
37. Errichiello S, Esposito O, Di Mase R, et al. Celiac disease: predictors of compliance with a gluten-free diet in adolescents and young adults. J Pediatr Gastroenterol Nutr 2010; 50 : 54–60.
38. Kucek LS, Veenstra LD, Amnuychaeewa P, Sorrels ME. A Grounded Guide to Gluten: How modern genotypes and processing impact wheat sensitivity. Comprehensive Reviews in Food Science and Food Safety 2015; 15 : 285–302.
Štítky
Neonatologie Pediatrie Praktické lékařství pro děti a dorost
Článek Tehdy a teď
Článek vyšel v časopiseČesko-slovenská pediatrie
Nejčtenější tento týden
2016 Číslo 3- Horní limit denní dávky vitaminu D: Jaké množství je ještě bezpečné?
- Isoprinosin je bezpečný a účinný v léčbě pacientů s akutní respirační virovou infekcí
- Syndrom Noonanové: etiologie, diagnostika a terapie
-
Všechny články tohoto čísla
- 70 let časopisu českých a slovenských pediatrů
- Co pro mne znamená Česko-slovenská pediatrie
- Pohľad na nerovnomernú – diferencovanú cyanózu a jej vtedajší diagnostický význam pri niektorých komplexných chybách srdca kedysi a dnes
- Vychladnutie ako príčina smrti u nedonosených detí
- Barlowova choroba – deficit vitamínov a ich suplementácia
- Difterie/záškrt – historie a současnost
- Terapie průjmových onemocnění dětí (aneb co se změnilo v průběhu 70 let)
- Endokrinologie dětského věku očima prof. Čížkové-Písařovicové v roce 1946
- Poradna a ústav pro zdravotně preventivní tělocvik a jeho indikace
- Populačné problémy nášho štátu po 70-tich rokoch
- Tehdy a teď
- Povinná docházka do mateřské školy od 5 let?
- Celiakie – doporučený postup pro diagnostiku a terapii u dětí a dospívajících
- Česko-slovenská pediatrie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Difterie/záškrt – historie a současnost
- Celiakie – doporučený postup pro diagnostiku a terapii u dětí a dospívajících
- Terapie průjmových onemocnění dětí (aneb co se změnilo v průběhu 70 let)
- Barlowova choroba – deficit vitamínov a ich suplementácia
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání





