-
Články
Top novinky
Reklama- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
Top novinky
Reklama- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Top novinky
ReklamaCo nového v Ewing-like family aneb malobuněčné/kulatobuněčné sarkomy měkkých tkání a kostí s rearanží genů CIC a BCOR. Přehled problematiky a naše prvotní zkušenosti
What´s new in Ewing-like sarcoma family? Soft tissue and bone sarcomas with CIC/BCOR rearrangement. Review of the literature and first personal experience
The literature is reviewed regarding of a rare molecularly defined group of sarcomas with rearrangement of both CIC and BCOR genes, which were originally placed into the EWSR1wt Ewing-like category. Personal experience with three cases demonstrating difficulties of this issue is added. Both groups of lesions differ not only by age and topography, but also vary in both the prognostic and the predictive parameters. CIC-rearranged tumors are very aggressive and almost never occur in the skeleton; in contrary, the BCOR-rearranged ones are predominantly bone tumors in young males behaving even better than classical Ewing sarcoma. From the morphologic point of view, it turned out to be a salient finding that these types of neoplasm might leave canonical morphotype of small blue round cell sarcoma. Instead of it, they are not uncommonly characterized as a relatively uniform spindle cell proliferation with prevailing myxoid transformation deserving much broader differential diagnosis. Our three cases reports display difficulties in reaching the correct diagnosis even by implementing sophisticated molecular techniques in routine practice. Notwithstanding of exhaustive molecular assays used, one may still encounter a lesion where original descriptive term Ewing-lie sarcoma remains uncorrected.
Keywords:
Ewing-like sarcoma – undifferentiated small round cell sarcoma – soft tissue – bone – CIC-rearranged – BCOR-rearranged – CIC-DUX4 – BCOR-CCNB3
Autoři: Zdeněk Kinkor 1; Petr Grossmann 1; Magdaléna Dubová 2; David Bludovský 2; Andrea Černá 3; Lenka Krsková 4; Petr Lhoták 5
Působiště autorů: Bioptická laboratoř s. r. o., Šiklův ústav patologie, LF UK, Plzeň 1; Klinika zobrazovacích metod, FN a LF UK, Plzeň 2; Medicyt s. r. o., Medirex group, Bratislava 3; Ústav patologie a molekulární medicíny, 2. LF UK a FN Motol, Praha 4; Radiologické oddělení, Nemocnice České Budějovice 5
Vyšlo v časopise: Čes.-slov. Patol., 53, 2017, No. 4, p. 175-180
Kategorie: Původní práce
Souhrn
Předkládán je souhrn literárně dokumentovaných poznatků se vzácnou skupinou nediferencovaných sarkomů měkkých tkání a kostí definovaných přeskupením genů CIC resp. BCOR, který je ilustrován osobní zkušeností se třemi případy. Tato skupina nádorů se původně vyčlenila z tzv. Ewing-like family, kde nebyla prokázána rearanže EWSR1 genu. Sarkomy s rearanží CIC a BCOR se částečně liší věkovou i topografickou distribucí, ale i prognostickými a prediktivními parametry. První z nich jsou vysoce agresívní a prakticky nepostihují skelet, ty druhé jsou převážně kostní tumory mladých chlapců s příznivější biologií oproti klasickému Ewingově sarkomu. Zásadním zjištěním je variabilita histologického projevu, přesahující běžný obraz malobuněčného kulatobuněčného sarkomu. Mnohé tyto nádory charakterizuje naopak vřetenobuněčná a myxoidní úprava a relativně blandní vzhled, které posouvají spektrum diferenciální diagnostiky mimo Ewing-like family. Naše tři pozorování poukazují na obtížnost diagnostiky těchto lézí a nutnost implementace cílené molekulární analýzy i v rutinní praxi. Stále však existují případy, kde ani extenzívní genetické vyšetření prvotní označení Ewing-like sarkomu blíže neupřesní.
Klíčová slova:
Ewing-like sarkom – nediferencovaný sarkom – měkké tkáně – kosti – translokace/rearanže CIC – translokace/rearanže BCOR – CIC-DUX4 – BCOR-CCNB3
Diferenciální diagnostika malobuněčných kulatobuněčných tumorů (MKT), bez ohledu na věk a lokalizaci, zůstává i v současnosti obtížnou. Přesné zařazení nádorů, které morfologicky mohou vypadat totožně, vyžaduje nejen zkušenost a kvalifikovanou interpretaci efektivního panelu imunohistochemie (IHC), ale především racionální využití extenzívní molekulární biologie. Je již jasné, že některé léze určují konkrétní molekulární aberace, které však je paradoxně nutné vnímat právě v kontextu fenotypu a lokalizace. Ukazuje se totiž, že tatáž genetická alterace může být jednak společná celému spektru neoplastických proliferací s odlišnou morfologií a biologií, ale zároveň stejným potenciálním cílem biologické léčby. Příkladem budiž NTRK3-ETV6 rearanže společná pro sekretorický karcinom prsu a slinných žláz, infantilní fibrosarkom, kongenitální mezoblastický nefrom, papilární karcinom štítné žlázy, GIST či inflamatorní myofibroblastický tumor. Vysvětlení tohoto fenoménu není jasné; vedle dosud nepoznaných komplexních transkripčních a epigenetických regulací je totiž principiální i úroveň histogenetické diferenciace buňky cílové tkáně.
V kategorii MKT se diagnostika bez genetického vyšetření prostě neobejde. I po vyčerpávající sofistikované definitivní klasifikaci od sebe vzájemně neodlišitelných, špatně diferencovaných variant např. synoviálního sarkomu, kulatobuněčného liposarkomu, extraskeletálního myxoidního chondrosarkomu, širokého spektra Ewing/Ewing-like lézí, rhabdomyosarkomu, nediferencovaného karcinomu (myoepiteliálního/s mutací NUT1, resp. SMARCB1), dezmoplastického kulatobuněčného sarkomu, světlobuněčného sarkomu měkkých tkání atd. zbyde různorodá skupina nádorů „blíže neklasifikovatelných“. Nedávné molekulární analýzy ukazují, že významná menšina těchto tumorů, lokalizovaná především v měkkých tkáních a kostech, je definována specifickou rearanží genů CIC, resp. BCOR (1,2). Jde o sarkomy přesahující množinu blíže neurčitelné tzv. „Ewing-like family“ jak variační šíří histologického obrazu a fenotypem, tak i biologií/prognózou a citlivostí ke standardním terapeutickým režimům. V éře nastupující „next generation“ molekulární patologie v návaznosti na exponenciální narůst možností biologické terapie, je žádoucí tyto léze umět spolehlivě diagnostikovat. V přehledu podáváme výčet literárních i prvních osobních zkušeností s těmito geneticky vymezenými novými jednotkami se zaměřením na reálný potenciál rutinní praxe patologa alespoň při teoretické identifikaci těchto vzácných lézí.
Sarkomy s rearanží genu CIC (CIC-DUX4, CIC-FOXO4)
Sarkomy s rearanží genu CIC (CICS) představují přibližně 30-60 % nediferencovaných malobuněčných kulatobuněčných tumorů, které se nepodařilo blíže určit a zároveň EWSR1 gen byl intaktní (3,4). Predilekční lokalizací jsou hluboké měkké tkáně končetin a hrudníku, neméně však prostory nitrobřišní, malé pánve a retroperitonea. Vesměs se jedná o objemné, agresívně rostoucí léze značně dislokující místní anatomické struktury (3-9). Paradoxně, ve skeletu byl dosud popsán jediný případ (pánev) (9). Histologický projev většinově věrně napodobuje typický Ewingův/Ewing-like sarkom (ES), je však mnohem rozmanitější a zahrnuje i naprosto odlišné obrazy; zde pak převládá vřetenobuněčná populace s častým myxoidním prosáknutím až retikulární úpravou, vedoucích někdy až k nezvyklému mikrocystickému/pseudoalveolárnímu organoidnímu uspořádání. Celulární kompozice přesahuje rámec kompaktní masy „malých, modrých a kulatých“ elementů a nezřídka převažují oválné blastické buňky, včetně světlobuněčné, rhabdoidní až epiteloidní přeměny (3-9). Při malém zvětšení pak upoutá příznačná multinodularita s mnohdy širokými dělícími septy a impresívními geografickými nekrózami. Imunohistochemický profil se uvádí jako nespecifický, přesto relativně příznačný. Vedle ubikvitní, různě intenzívní exprese CD99 (MIC2) - často identické jako u ES, je pozitivita FLI1, resp. ERG proměnlivá; NKX2.2 je však vždy negativní. V této souvislosti je zajímavá poměrně konzistentní koexprese WT1 a calretininu, která může usměrnit diagnostickou rozvahu; pozornost je zde nutno věnovat odlišení nediferencovaného mezoteliomu při dominantním projevu na serózách (4). Slibným se ukazuje být marker ETV4 (z PEA3 podskupiny ETS transkripčních faktorů), jehož prakticky univerzální exprese je v kontextu konfigurace fenotypu CICS a jeho diferenciálně diagnostických alternativ jedinečná (10-11).
Molekulární podstata CICS je v naprosté většině určena patogenní translokací t(4;19) (CIC-DUX4), raritně též t(X;19) (CIC-FOXO4), které lze spolehlivě detekovat metodou FISH a RT-PCR resp. sekvenční analýzou výsledné fúzní chiméry (3-9). Podobně jako u některých nediferencovaných karcinomů, lymfomů a sarkomů není úplně překvapující popisovaná amplifikace genu MYC u většiny CICS, skýtající potenciál biologické terapie v této patogenní regulační kaskádě (např. anti VEGF strategie). Navíc, prokázaná odlišnost profilu MYC cílených transkripčních regulátorů (p21 vs. metadherin/MTDH) mezi CICS a ES/ES-like potvrzuje již dříve poznanou rozdílnost transkripční signatury/transkriptomu těchto skupin zdánlivě podobných neoplázií (12).
Kazuistika 1
U padesátišestileté ženy operované pro akutní ileus byla provedena resekce 16 cm dlouhé kličky ilea. V centru dilatovaného preparátu v rozsahu 5 cm byla stěna střeva zesílená na 20 mm bělavou infiltrací šířící se do přilehlého mezenteria. Klinické vyšetřování zjistilo dále mediastinální lymfadenopatii, osteolýzu obratlových těl C2-7 a mnohočetné metastatické postižení sleziny a plic. Mikroskopicky se jednalo o pokročile nekroticky změněný, solidní primitivní nediferencovaný tumor tvořený kompaktní masou oválných „modrých“ buněk s minimálním množstvím cytoplazmy, který difúzně prostupoval celou stěnu až těsně pod sliznici (obr. 1). Fokálně docházelo k tvorbě abortivních mikroalveolárních formací nebo mozaikovité úpravě se světlobuněčnou přeměnou (obr. 2, 3), jen ojediněle pak k myxoidnímu prosáknutí. Histologický obraz preferoval možný maligní lymfom. Nádor byl difúzně CD99 (Ventana, klon O13), ERG (Ventana, klon EPR3864), calretinin (Ventana, klon SP65) WT1(Dako, klon 6F-H2) pozitivní a NKX2.2 (DSHB, klon 74.5A5) negativní (obr. 4). Molekulární vyšetření (FISH break-apart oligo probe, SureFISH, Agilent) prokázalo rearanži genu CIC; gen EWSR1 byl intaktní (obr. 5). Topografická distribuce/staging nádoru favorizovaly viscerální origo.
Obr. 1. Kazuistika <b>1</b>. Solidní primitivní nediferencovaný tumor z oválných „modrých“ buněk prostupující stěnu tenkého střeva těsně pod sliznici (HE, 200x). 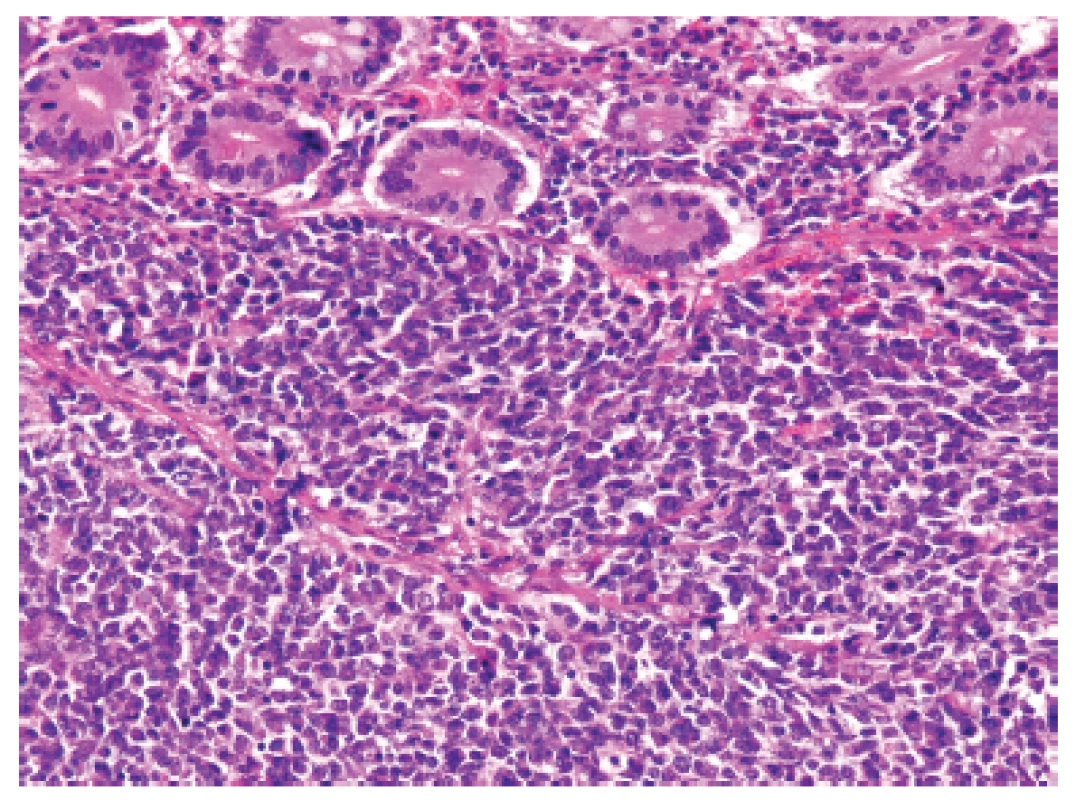
Obr. 2. Kazuistika <b>1</b>. Ložiskové rozvolnění původní struktury vytvářející nezvyklé organoidní mikrocystické resp. pseudoglandulární uspořádání (HE, 400x). 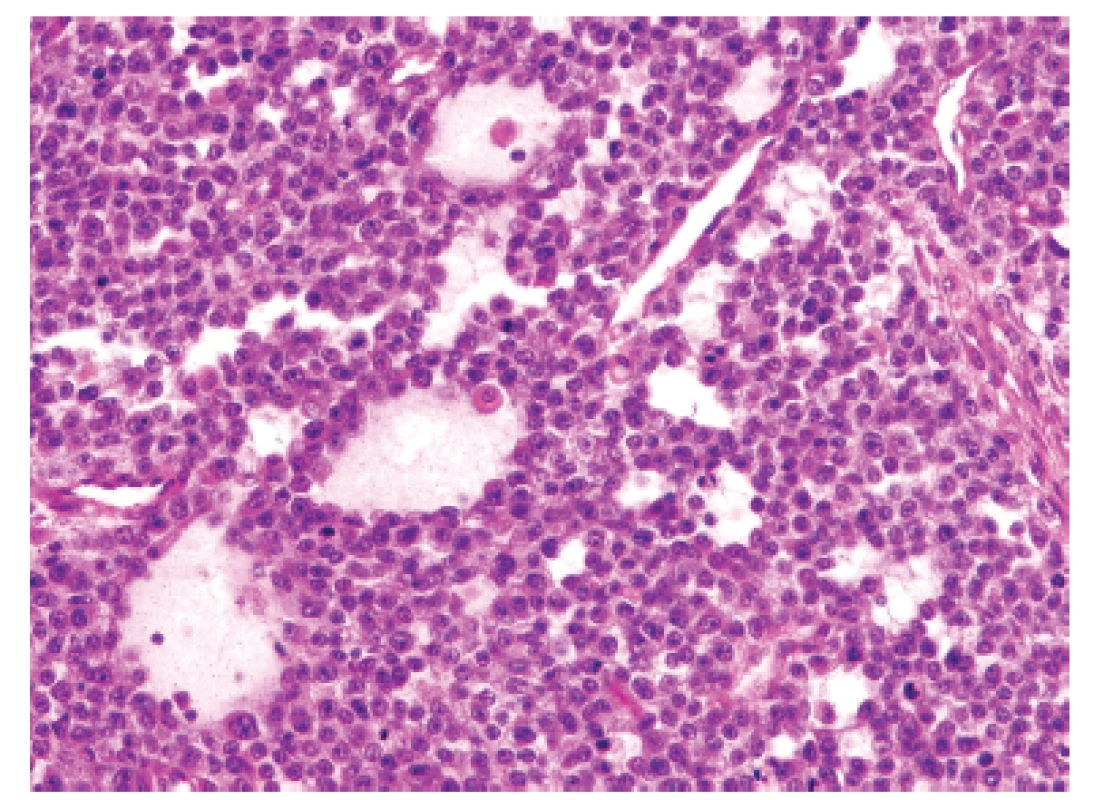
Obr. 3. Kazuistika <b>1</b>. Mozaiková úprava kulatých nádorových elementů s objemnější světlou cytoplazmou vymykající se převládajícímu vzhledu sarkomu z „modrých“ buněk (HE, 400x). 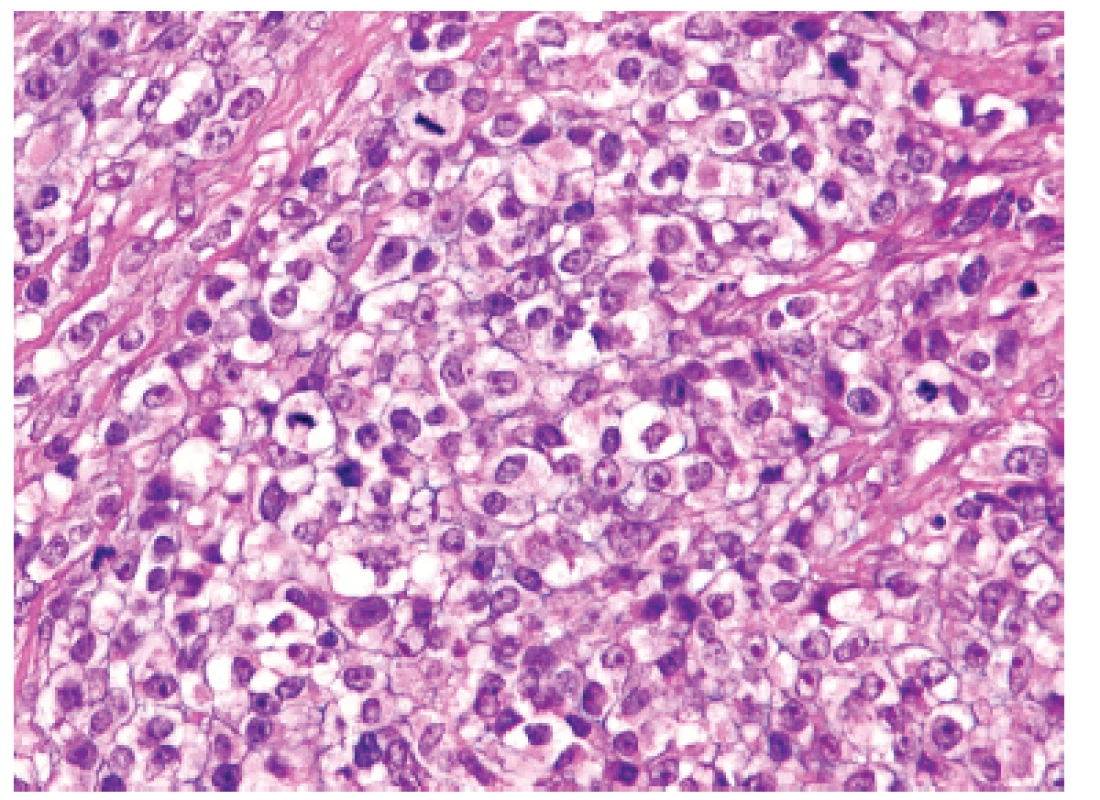
Obr. 4. Kazuistika <b>1</b>. Difúzní silná cytoplazmatická pozitivita calretininu <b>(A)</b> a nukleární exprese WT1 <b>(B)</b> v nádorových buňkách (IHC, 200x). 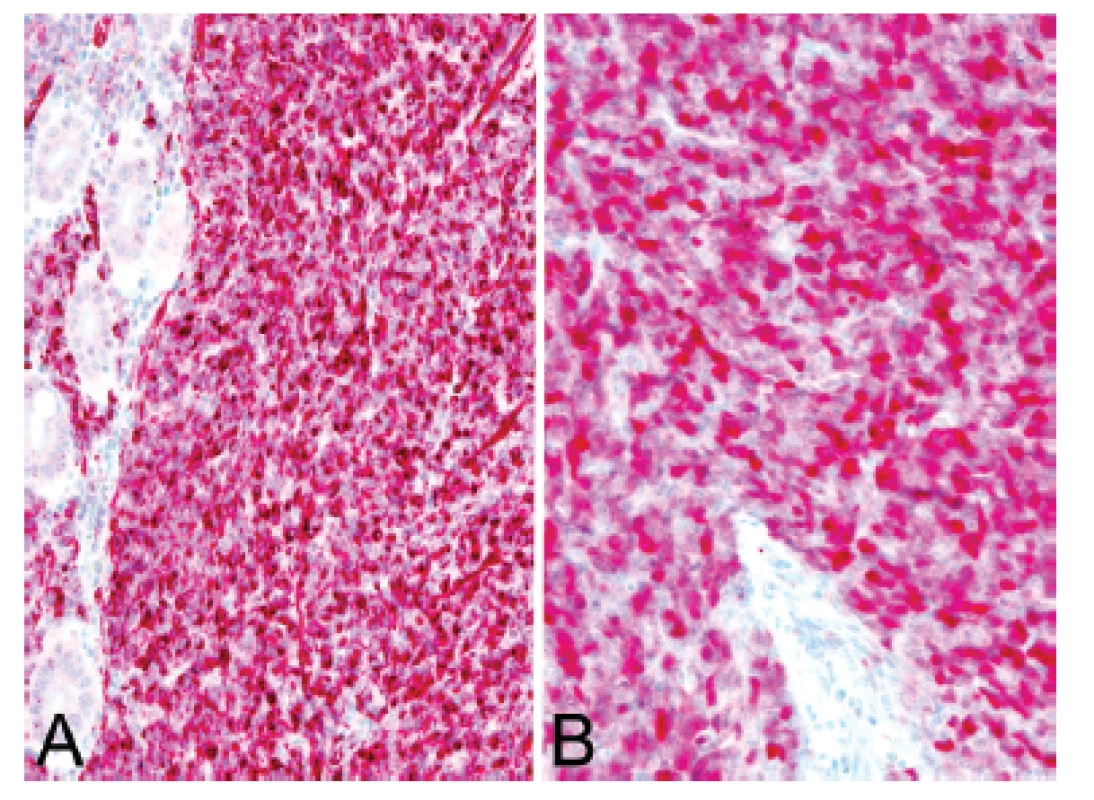
Obr. 5. Kazuistika <b>1</b>. FISH analýza interfázních jader s <i>break apart</i> sondou <i>CIC</i> (19q13). Žluté signály značí normální kopii genu bez přítomnosti zlomu, oddělené oranžové a zelené signály prokazují přeskupení/zlom genu. 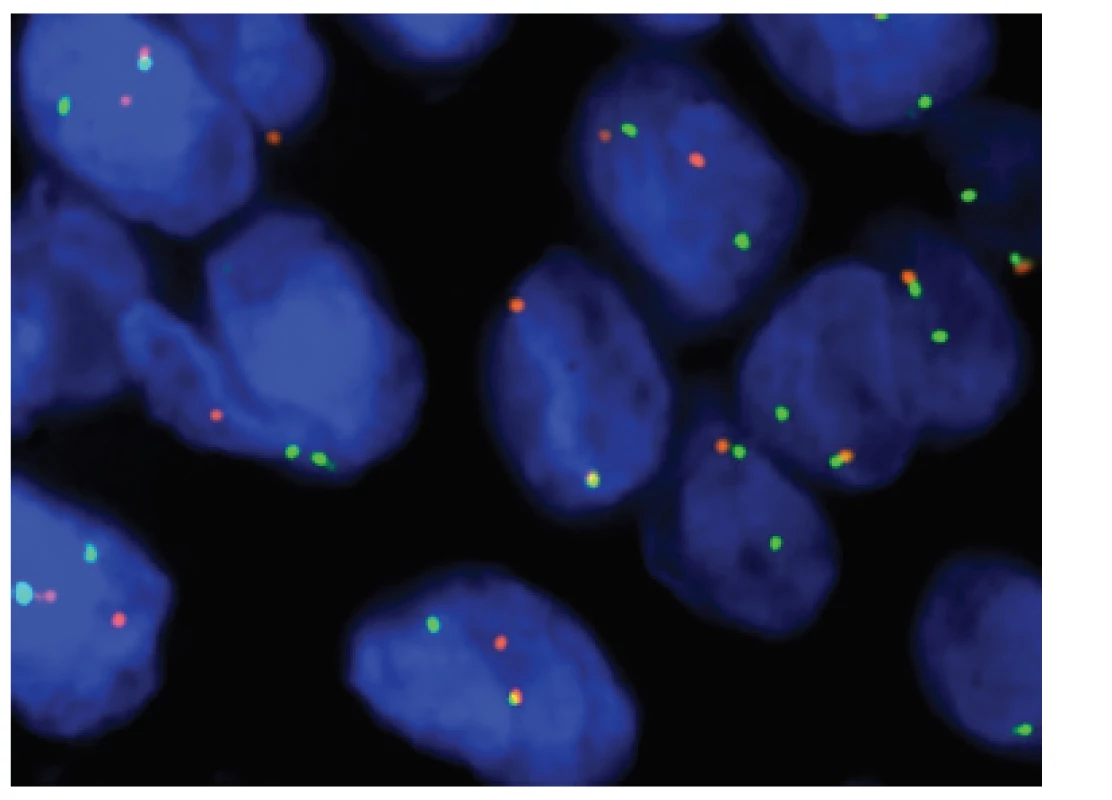
Sarkomy s rearanží genu BCOR (BCORS) a příbuzné léze (BCOR-CCNB3, BCOR-MAML3, ZC3H7B-BCOR, BCOR internal tandem duplication)
Jedná se o pestrou skupinu sarkomů odlišujících se od CICS, ale i navzájem, věkem/pohlavím postižených, lokalizací, biologií a genetickým pozadím, avšak jen minimálně svým histologickým projevem. Prototypem je sarkom s translokací BCOR-CCNB3 vyskytující se téměř výlučně u chlapců, mající srovnatelné zastoupení ve skeletu a měkkých tkáních a ve srovnání s ostatními BCORS, CICS resp. ES/ES-like podstatně lepší prognózu (2,13-19). Incidence se odhaduje kolem 5 % ve skupině nediferecovaných MKT s intaktním EWSR1/FUS (1,2,15). Podobně jako u CICS se vedle kanonického Ewing-like mikroskopického obrazu objevuje u nemalého počtu případů naprosto rozdílné uspořádání s převahou kompaktních vřetenobuněčných storiformních/fascikulárních/fibrosarkomatózních formací či naopak převládající málobuněčná myxoidní modifikace protkaná bohatou kapilární sítí. Výsledný dojem pak není nepodobný třeba synoviálnímu sarkomu (SySa), malignímu schwanomu (MPNST), ale např. i low-grade fibromyxoidnímu sarkomu (LGFMS), osifikujícímu fibromyxoidnímu tumoru (OFMT) či dermatofibrosarcoma protuberans (DFSP) (1,2,14,15,19). Alternativní partnerská fúzní spojení s MAML3 resp. ZC3H7B jsou pak představována typicky měkkotkáňovými tumory s rozličným končetinovým/axiálním, ale nezřídka i viscerálním rozmístěním (16). Fenotyp BCORS se pravidelnou CD99 pozitivitou opět částečně překrývá s ES/ES-like, resp. CICS, jedinečná v této kategorii neoplázií je však senzitivita protilátek CCNB3, resp. BCOR (2,13-15,18). Výjimku tvoří ojedinělé sarkomy s ZC3H7B-BCOR přeskupením, které podobně jako sdružené molekulární analogie high-grade endometrálního sarkomu (HG ESS) a osifikujícího fibromyxoidního tumoru jsou důsledně BCOR IHC negativní; důvodem je zde rozdílné napojení nestejně dlouhých kódujících sekvencí BCOR (3´vs 5´ resp. exony 15/16 vs exony 7/8) v chimérickém fúzním genu (17). Pro diferenciální diagnostiku vřetenobuněčného typu BCORS je důležitá, a matoucí zároveň, uváděná BCOR IHC pozitivita u synoviálního sarkomu, kterou kupodivu kopíruje i zvýšená hladina BCOR mRNA (18). Obráceně, exprese markeru TLE1 pak byla zjištěna asi u poloviny BCORS (18, 19). Taktéž nečekaná přítomnost SATB2 u většiny BCORS může v teritoriu nediferencovaných MKT kostí svést k mylné diagnóze malobuněčného osteosarkomu (18). Konečně, pro celé uskupení BCORS je typická NKX2.2, WT1, calretinin a ETV4 IHC negativita (1,2,13-19). Veškeré příslušné molekulární aberace celého komplexu BCORS lze opět spolehlivě doložit metodami FISH, RT-PCR a sekvenací vzniklého chimerického produktu. S tím korespondují zvýšené hladiny BCOR mRNA (opět s výjimkou ZC3H7B-BCOR fůze) a následně generovaný transkripční formát/profil BCORS je pak zcela odlišný od CICS resp. ES/ES-like (1,2,13-19). Doloženo je též několik obdobných lézí, kde při nesporné detekci průkazu zlomu BCOR odpovídající partnerský gen zůstává zatím neznámý (16).
Ve spojitosti s aberací genu BCOR je nutné zmínit neoplázie časně dětského/juvenilního období, kde ES-like/ES je poměrně vzácný (kolem 1 %). Jedná se o nádory výše uvedené morfologie nacházející se buď již kongenitálně či v řádech měsíců od narození a vedle kongenitálního fibrosarkomu a rhabdomyosarkomu se volně řadí do skupiny tzv. infantilních sarkomů (17). Molekulární profil a škála mikroskopických obrazů jsou zde prakticky totožné s tzv. světlobuněčným sarkomem ledviny (SSL) a někteří je dokonce vnímají jako jeho měkkotkáňovou analogii. Tyto léze se generují z okruhu MKT měkkých tkání, resp. tzv. primitivního myxoidního mezenchymálního tumoru ranně dětského věku. Proměnlivost histologické skladby je opět značná; vedle archetypální monomorfní kompozice nediferencovaného MKT (včetně epiteloidní proměny i rozetovitých formací) zde spíše převažují oválné/vřetenité elementy (jen vzácně světlobuněčné!) s fascikulární až storiformní úpravou, často zasazené do myxoidního, bohatě kapilarizovaného pozadí (někdy impresivně hemangiopericytárního formátu). Zde pak jakákoliv podobnost s MKT již končí a diferenciálně diagnostický algoritmus se vychyluje mimo sféru ES-like/ES. Predilekční topografií jsou hlava/krk, trup a viscerální oblasti; výskyt na končetinových partiích je raritou; postižení skeletu nebylo dosud popsáno. Jednotícím prvkem této skupiny nádorů je internal tandem duplication v exonu 16 genu BCOR u většiny případů, menšinově pak rearanže YWHAE-NUTM2 (vedle již zmíněné ZC3H7B-BCOR známá rovněž jako další onkogenní faktor HG ESS). Podobně jako v celé třídě BCOR defektních sarkomů u nich lze prokázat zvýšené hladiny BCOR mRNA a BCOR IHC overexpresi, včetně paralelní genové expresní signatury - lišící se však od ES-like/ES či CICS (1,2,13-19).
Kazuistika 2
Třináctiletý chlapec operován pro rozsáhlý osteolytický tumor lumbosakrální oblasti s propagací jak extradurálně (s klinickou míšní kompresí), tak do okolních měkkých tkání (obr. 6). Histologický projev s expresivním hemangiopericytoma-like uspořádáním připomínal např. synoviální sarkom či solitární fibrózní tumor (obr. 7). Uniformní buněčnou skladbu bez výraznějších jaderných atypií a jen ojedinělou mitotickou aktivitou, přerušovaly pouze rozptýlené partie pokročilého myxoidního rozvolnění, kde se původní dojem značně celulární léze úplně ztrácel (obr. 8). Extenzívní panelová IHC prokázala difúzní nukleární pozitivitu CCNB3 (Sigma Aldrich, polyklonální); veškeré ostatní markery včetně CD99, NKX2, WT1 a calretininu byly kompletně negativní (obr. 9) Rozsáhlé genetické vyšetření nakonec potvrdilo rearanži BCOR-CCNB3 (FISH custom break apart oligo probe, SureFISH, Agilent) (obr. 10).
Obr. 6. Kazuistika <b>2</b>. Objemná expanze v měkkých tkáních dorzálně za křížovou kostí v úrovni L5 až S3 s propagací do páteřního kanálu (MRI). 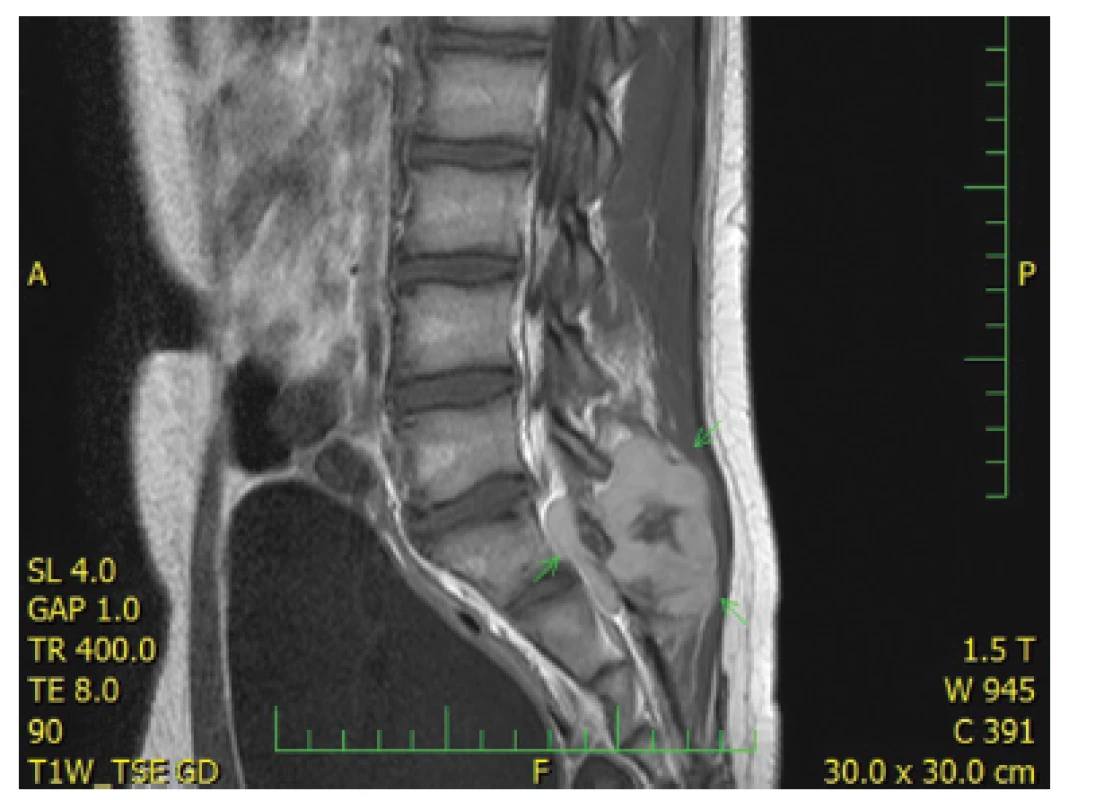
Obr. 7. Kazuistika <b>2</b>. Blandně vyhlížející vřetenobuněčný sarkom s bohatou kapilární sítí připomínající nespecifickou <i>HPC-like</i> úpravu např. synoviálního sarkomu či solitárního fibrózního tumoru (HE, 200x). 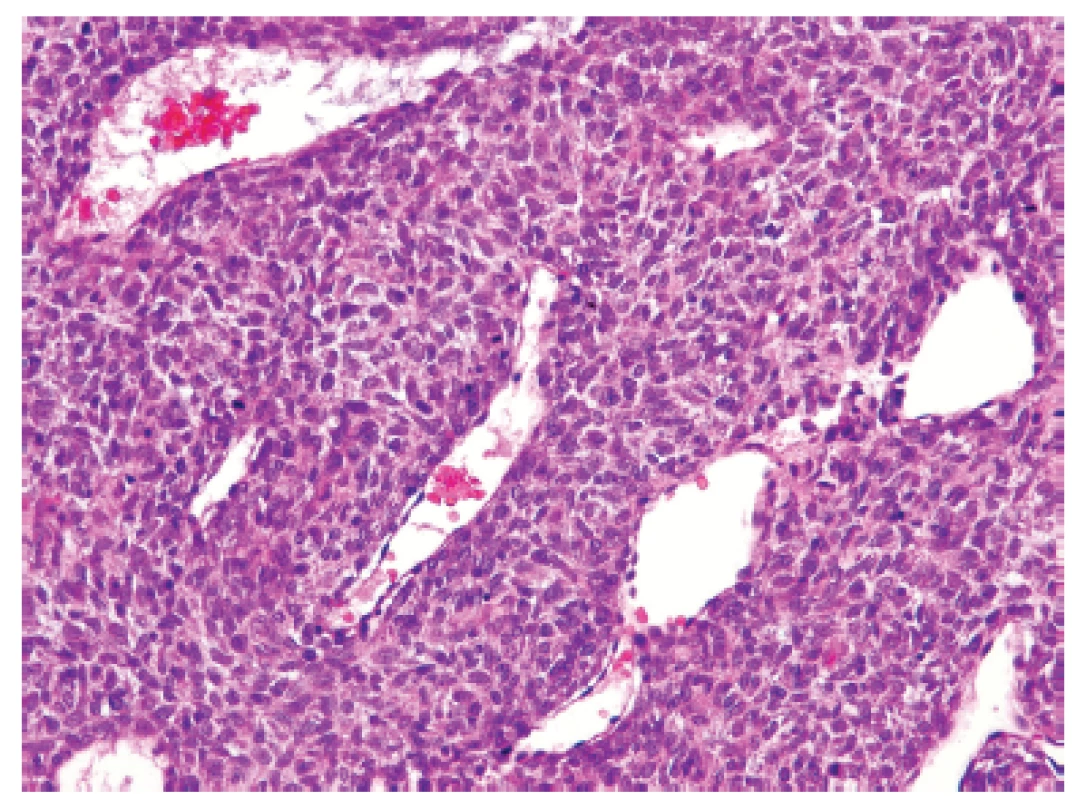
Obr. 8. Kazuistika <b>2</b>. Místní výrazná myxoidní přeměna nádoru vytvářela dojem nevinné hypocelulární léze s malými oválnými jádry bez pleomorfizmů (HE, 400x). 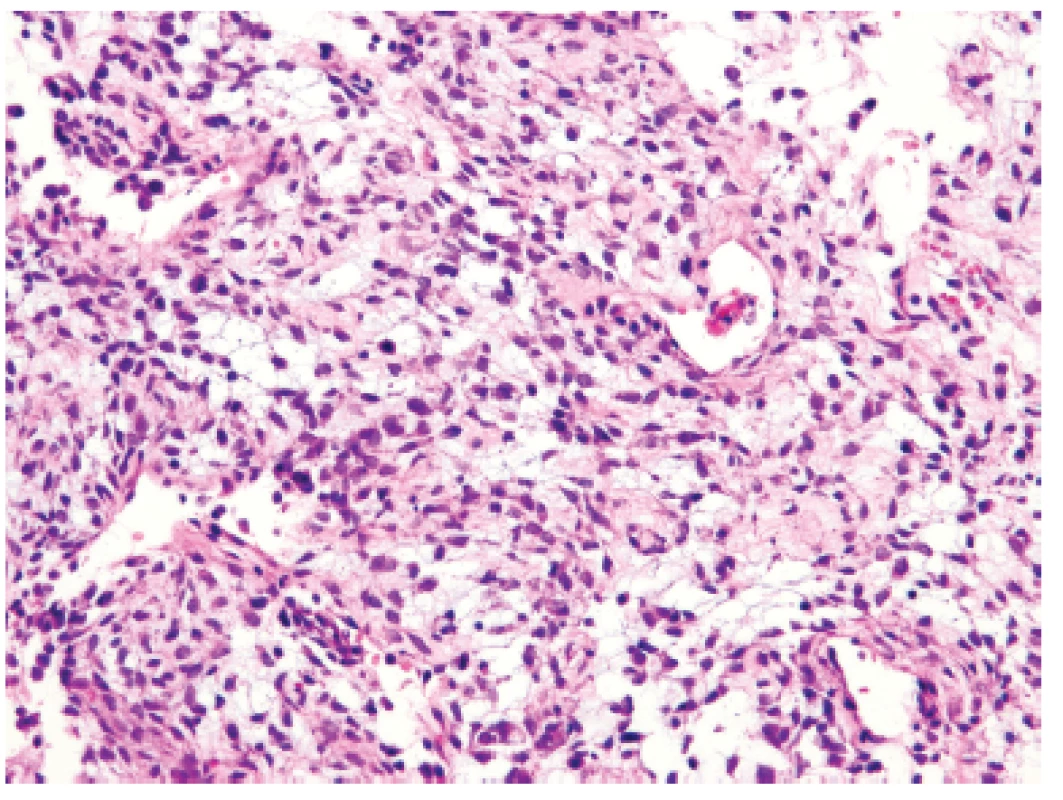
Obr. 9. Kazuistika <b>2</b>. Difúzní intenzívní jaderná pozitivita antigenu CCNB3 v nádorových elementech (IHC, 200x). 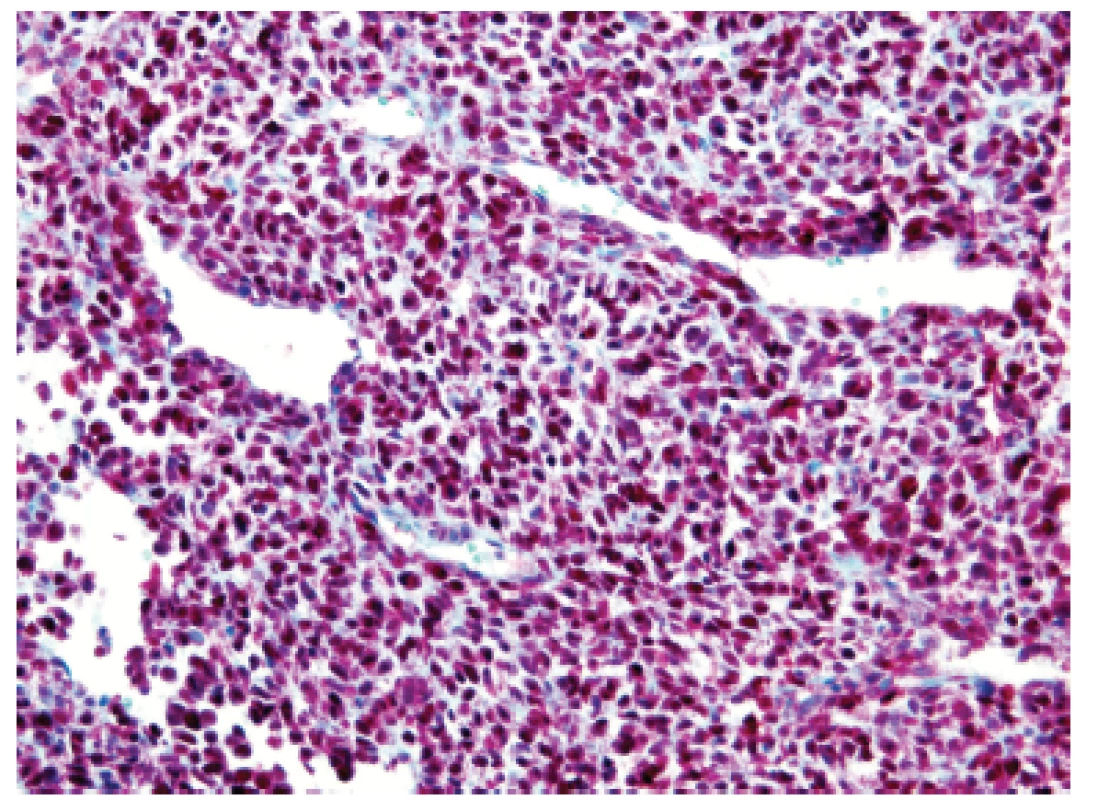
Obr. 10. Kazuistika <b>2</b>. FISH analýza interfázních jader s <i>break apart</i> sondami <i>BCOR</i> (Xp11.4) - <b>A;</b> <i>CCNB3</i> (Xp11.22) - <b>B.</b> Žluté signály značí normální kopii genu bez přítomnosti zlomu, oddělené oranžové a zelené signály prokazují rearanži/zlom genů. 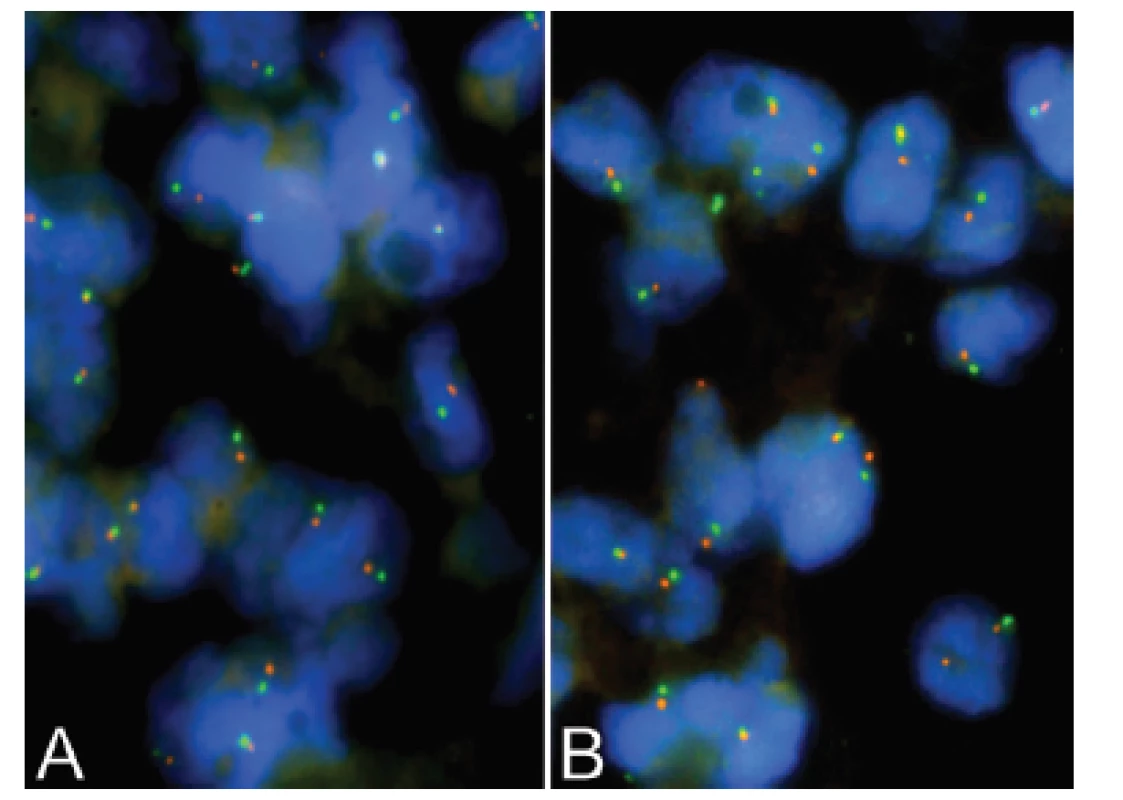
SHRNUTÍ
Spolehlivá diagnostika ES resp. širokého spektra MKT není v současnosti bez molekulární analýzy myslitelná. „Morfologická empirie“ patologa specialisty a relevantní interpretace konfigurace fenotypu slouží pouze jako základní skríning vedoucí k racionální volbě optimální genetické metodiky pro detekci konkrétní patogenní molekulární alterace. Náročnost problematiky dokumentují nejen histogenetická pestrost MKT v tom nejobecnějším slova smylu (naprosto stejně může vypadat synoviální sarkom, rhabdomyosarkom, lymfom, karcinom, mezenchymální chondrosarkom či estezioneuroblastom…), ale např. i to, že rearanže EWSR1 je společná celé škále nádorů, které jsou za určitých okolností (dediferenciace) též morfologicky nerozeznatelné (ES-like/ES, dezmoplastický malobuněčný kulatobuněčný tumor, myxoidní liposarkom, extraskeletální myxoidní chondrosarkom, světlobuněčný sarkom měkkých tkání, myoepiteliální karcinom….). Samotný důkaz zlomu genu EWSR1 metodou FISH je nespecifický a je nutné přesně určit konkrétního fúzního partnera vzniklého chimérického genu (u naprosté většiny případů klasického ES postačí průkaz FLI1 či ERG). Nelze opomenout, že možnou alternativou široce promiskuitních onkogenních EWSR1 spojení je gen FUS; sami jsme zažili úskalí tohoto fenoménu při diagnostice ES a kulatobuněčného liposarkomu. Rutinní molekulární vyšetřování MKT resp. ES-like/ES postupně ukázalo, že stále existuje skupina nádorů důsledně EWSR1/FUS wt, kterou i po extenzívním vyloučení dalších diferenciálně diagnostických možností nelze blíže určit. Využití metodiky masivního paralelního sekvenování (NGS) u těchto tumorů vedlo k nalezení dalších určujících onkogenních aberací - konkrétně opakujících se variantních přeskupení genů CIC resp. BCOR. Zkušenosti s těmito geneticky jedinečně definovanými sarkomy upozorňují mimo jiné na dvě základní odlišnosti oproti klasickým ES-like/ES, ale i vzájemně. Prvně, i přes rozdílnost topografie (axiální měkké tkáně, skelet, splanchnická oblast …), věkové a „genderové“ distribuce a biologie je evidentní, že jsou rezistentní na standardní léčebné režimy klasického ES. Postupné rozkrývání komplexních regulačních transkripčních (např. objevy řídících funkcí miRNA) a epigenetických mechanizmů zde pak skýtá potenciál možné cílené biologické terapie. Podruhé; je evidentní, že mikroskopický obraz CICS/BCORS je mnohem rozmanitější a přesahuje rámec typické solidní homogenní masy malých kulatých buněk konvenčního ES. Část těchto sarkomů totiž vůbec jako MKT nevypadá; naopak, jde o různě celulární vřetenobuněčné léze s často výrazným myxoidním prosakem a impresivní HPC-like vaskularizací, kde morfologická diferenciální diagnóza ES-like/ES prakticky nepřichází v úvahu. Zde pak v kontextu EWSR1 wt tumoru je potřebná zvýšená míra podezření na tento okruh nově vymezených nádorů, především při diferenciální diagnostice a priori problematických vřetenobuněčných lézí, jako např. SySa, MPNST, OFMS, LGFMS, DFSP atd. Pomyslí-li patolog na CICS/BCORS, určitým vodítkem pro indikaci cílené molekulární analýzy může být IHC; kromě variabilní pozitivity CD99, FLI1, ERG a negativity NKX2.2, exprimují tyto sarkomy některé nové, relativně specifické a senzitivní markery, jako např. ETV4, BCOR či CCNB3 (první dvě testované protilátky se nám bohužel nepodařilo zatím spolehlivě vytitrovat - pozn. autora). Nutno však podotknout, že v reálné praxi zůstává diagnostika CICS/BCORS stále obtížná (tyto tumory jsou relativně vzácné), vyžaduje zázemí sofistikované genetické laboratoře a především určitou míru alespoň teoretického povědomí o problematice. Plošnější aplikace zatím stále nákladné NGS a její integrace v komplexní diagnostice v blízké budoucnosti jistě nabídne zjednodušení diagnosticko-logistických algoritmů v této oblasti měkkotkáňové a kostní patologie. Poslední kazuistika dosvědčuje, že i dnes po vyčerpání veškerých nám dostupných laboratorních možností, zůstaneme někdy ve svém snažení pouze ante portas, a konečná diagnóza zní - MKT, blíže neurčený.
Kazuistika 3
U dvanáctiletého chlapce s anamnézou několika měsíčních bolestí v lumbosakrální oblasti (údajně po pádu na skateboardu) byla na CT vyšetření nalezena v páteřním kanále v oblasti L1 dorzálně extramedulární/epidurální hyperdenzní léze velikosti 36 x 21 x 11 mm (obr. 11). Radiolog vyjádřil podezření na možný meningeom, neurinom či hematom; v následné probatorní biopsii pak morfologie a fenotyp (CD99, NKX2.2 difúzně pozitivní) odpovídaly téměř učebnicovému příkladu ES (obr. 12, 13). Extenzívní panel IHC (včetně calretininu, WT1 a CCNB3) byl negativní a molekulární analýza pomocí FISH a RT-PCR neprokázala rearanži žádného z genů EWSR1(FISH break apart probe, Vysis, ABBOTT), FUS, CIC, DUX4, BCOR resp. CCNB3 (obr. 14). Uzavírali jsme jako ES-like resp. MKT, blíže neurčený.
Obr. 11. Kazuistika <b>3</b>. V oblasti L1 v páteřním kanále je přítomná extramedulární/extradurální hyperdenzní léze; okolní skelet je intaktní (CT vyšetření). 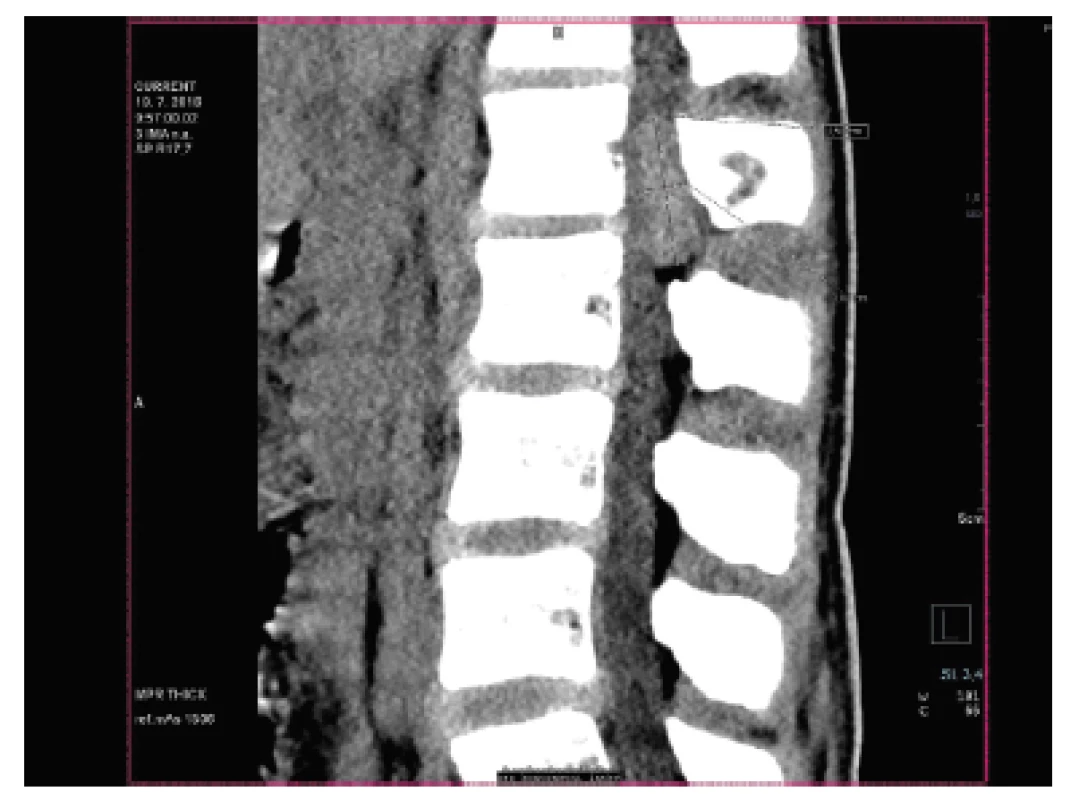
Obr. 12. Kazuistika <b>3</b>. Primitivní malobuněčný kulatobuněčný sarkom s homogenní populací uniformních nádorových elementů, neodlišitelný od klasického Ewingova sarkomu (HE, 200x). 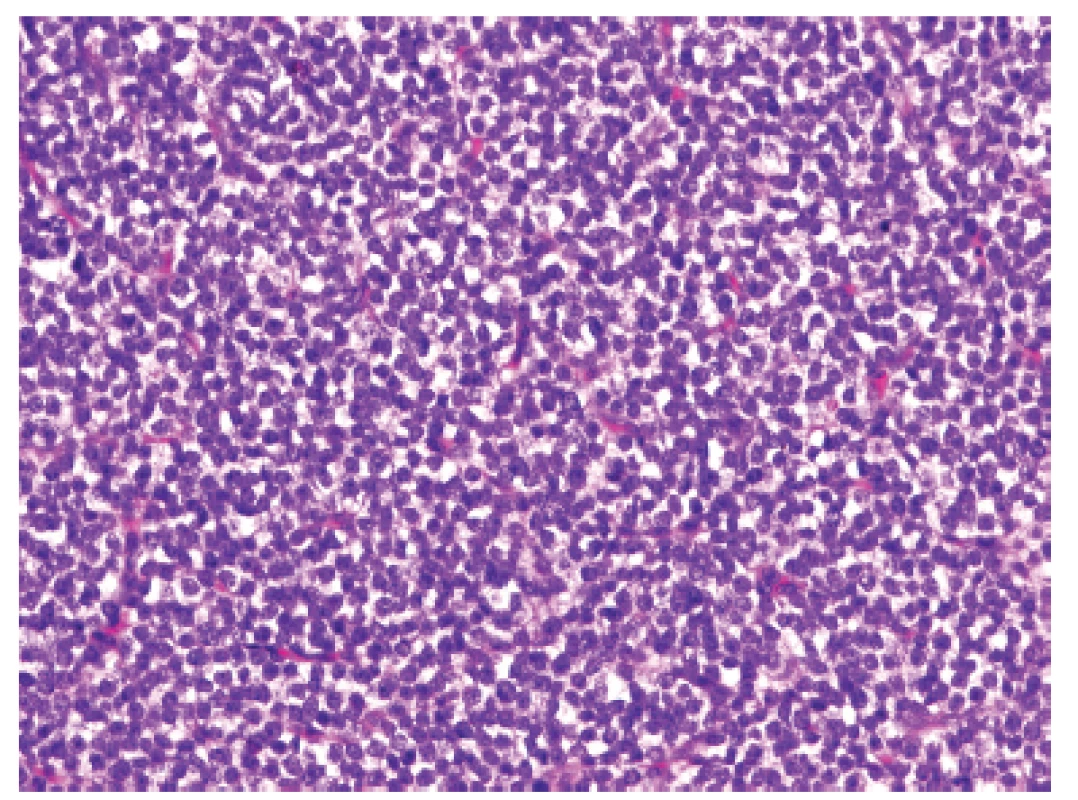
Obr. 13. Kazuistika <b>3</b>. Silná a difúzní pozitivita protilátek NKX2.2 (A) a CD99 (B) v kontextu histologického obrazu favorizovala diagnózu Ewingova sarkomu (IHC, 200x). 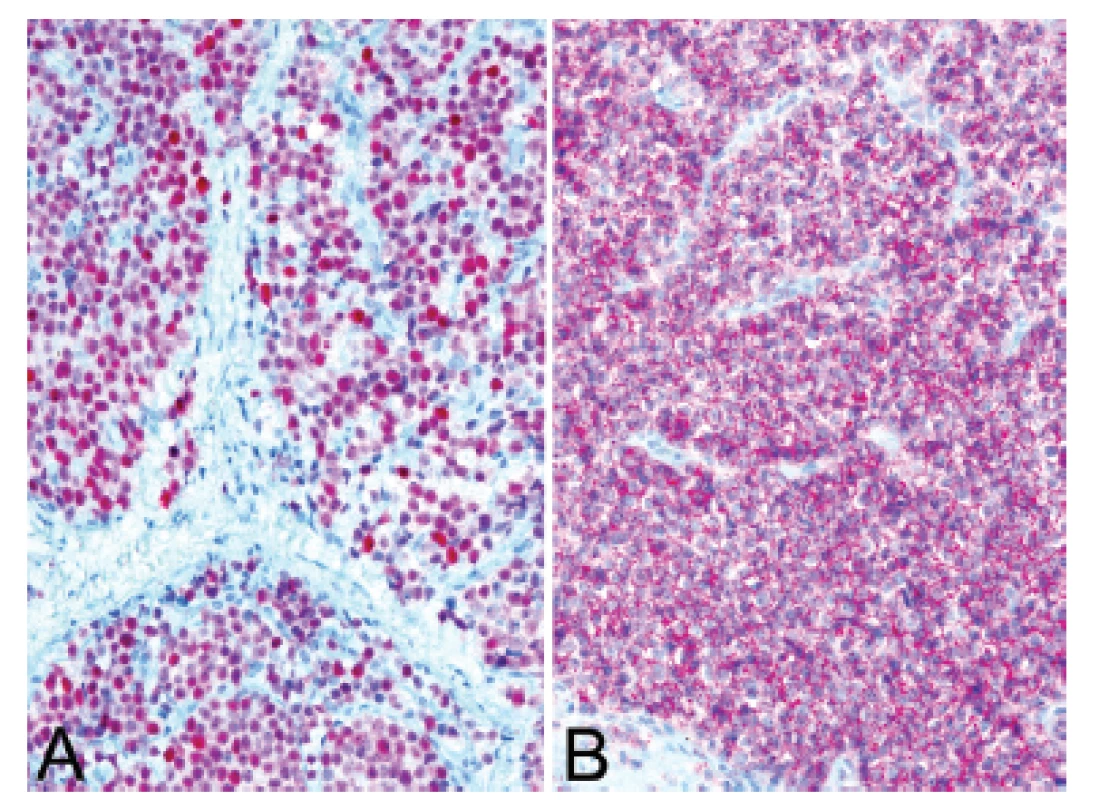
Obr. 14. Kazuistika <b>3</b>. FISH analýza interfázních jader s <i>break apart</i> sondou <i>EWSR1</i> (22q12.2) ukazuje pouze žluté signály značící normální kopii intaktního genu <i>EWSR1</i> bez přítomné rearanže. 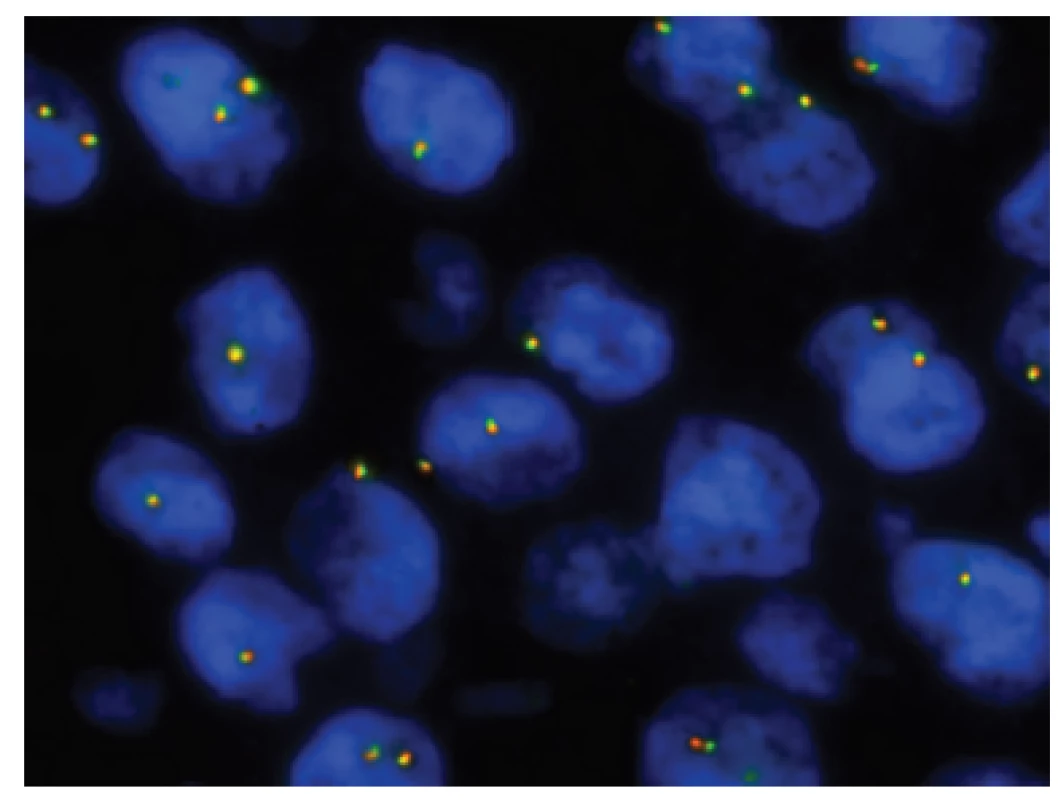
PODĚKOVÁNÍ
Autoři děkují prim. MUDr. Petrovi Mukenšnáblovi, Ph.D. za zhotovení kvalitní fotografie a Mgr. Vratislavu Šedivcovi za laboratorně technologickou a grafickou asistenci.
PROHLÁŠENÍ
Autor práce prohlašuje, že v souvislosti s tématem, vznikem a publikací tohoto článku není ve střetu zájmů a vznik ani publikace článku nebyly podpořeny žádnou farmaceutickou firmou. Toto prohlášení se týká i všech spoluautorů.
Adresa pro korespondenci:
doc. MUDr. Zdeněk Kinkor, Ph.D.
Bioptická laboratoř s.r.o.,
Mikulášské nám. 4
326 00 Plzeň
tel.: +420 737 220 449
email: kinkor@medima.cz
Zdroje
1. Machado I, Navarro L, Pellin A, Navaro, S et al. Defining Ewing and Ewing-like small round cell tumors (SRCT): the need for molecular techniques in their categorization and differential diagnosis: a study of 200 cases. Ann Diagn Pathol 2016; 22 : 25-32.
2. Machado I, Navarro S, Llombart-Bosch A. Ewing sarcoma and the new emerging Ewing-like sarcomas: (CIC and BCOR - rearranged sarcomas). A systematic review. Histol Histopathol 2016; 31 : 1169-1181.
3. Italiano A, Sung YS, Zhang L, et al. High prevalence of CIC fusion with double-homeobox (DUX4) transcription factors in EWSR1-negative undifferentiated small blue round cell sarcomas. Genes Chromosome Cancer 2012; 51 : 207-218.
4. Yoshida A, Goto K, Kodaira M, Kobaiashi E, et al. CIC-rearranged sarcomas. A study of 20 cases and comparison with Ewing sarcomas. Am J Surg Pathol 2016; 40 : 313-323.
5. Machado I, Cruz J, Rubio L, et al. Superficial EWSR1-negative undifferentiated small round cell sarcoma with CIC-DUX4 gene fusion: a new variant of Ewing-like tumors with locoregional lymph node metastasis. Virchows Archiv 2013; 463 : 837-842.
6. Choi EYK, Thomas DG, McHugh JB, Patel RM, et al. Undifferentiated small round cell sarcoma with t(14;19)(q35;q13.1) CIC-DUX4 fusion, A novel highly aggressive soft tissue tumor with distinctive histopathology. Am J Surg Pathol 2013; 37 : 1379-1386.
7. Solomon DA, Brohl AS, Khan J, Miettinen M. Clinicopathologic features of a second patient with Ewing-like sarcoma harboring CIC-FOXO4 gene fusion. Am J Surg Pathol 2014; 38 : 1724-1727.
8. Sugita S, Arai Y, Tonooka A, Hama N, et al. A novel CIC-FOXO4 gene fusion in undifferentiated small round cell sarcoma. A genetically distinct variant of Ewing-like sarcoma. Am J Surg Pathol 2014; 38 : 1571-1576.
9. Gambarotti M, Benini S, Gamberi G, Cocchi S, et al. CIC-DUX4 fusion-positive round cell sarcomas of soft tissue and bone: a single-institution morphological and molecular analysis of seven cases. Histopathology 2016; 69 : 624-634.
10. Le Guellec S, Velasco V, Perot G, Watson S, et al. ETV4 is a useful marker for the diagnosis of CIC-rearranged undifferentiated round cell sarcoma: a study of 127 cases including mimicking lesions. Modern Pathology 2016; 29 : 1523-1531.
11. Hung YP, Fletcher ChDM, Hornick JL. Evaluation of ETV4 and WT1 expression in CIC-rearranged sarcomas and histologic mimics. Modern Pathology 2016; 29 : 11324-1334.
12. Smith SCh, Buehler D, Choi EYK, McHugh JB, et al. CIC-DUX sarcomas demonstrate frequent MYC amplification and ETS-family transcription factor expression. Modern Pathology 2015; 28 : 57-68.
13. Pierron G, Tirode F, Lucchesi C, Reynaud S, et al. A new subtype of bone sarcoma defined by BCOR-CCNB3 gene fusion. Nature Genetics 2012; 44 : 461-466.
14. Puls F, Niblett A, Marland G, Gaston CLL, et al. BCOR-CCNB3 (Ewing-like) sarcoma. A clinicopathologic analysis of 10 cases, in comparison with conventional Ewing sarcoma. Am J Surg Pathol 2014; 38 : 1307-1318.
15. Peters TL, Kumar V, Polikepahad S, Lin FY, et al. BCOR-CCNB3 fusions are frequent in undifferentiated sarcomas of male children. Modern Pathology 2015; 28 : 575-586.
16. Specht K, Zhang L, Sung YS, Nucci M, et al. Novel BCOR-MAML3 and ZC3H7B-BCOR gene fusions in undifferentiated small blue round cell sarcomas. Am J Surg Pathol 2016; 40 : 433-442.
17. Kao YCh, Sung YS, Zhang L, Huang SCh, et al. Recurrent BCOR internal tandem duplication and YWHAE-NUTM2B fusion in soft tissue undifferentiated round cell sarcoma of infancy. Overlapping genetic features with clear cell sarcoma of kidney. Am J Surg Pathol 2016; 40 : 1009-1020.
18. Kao YCh, Sung YS, Zhang L, Jungbluth A, et al. BCOR overexpression is a highly sensitive marker in round cell sarcomas with BCOR genetic abnormalities. Am J Surg Pathol 2016; 40 : 1670-1678.
19. Li WS, Liao ICh, Wen MCh, Lan HHCh, et al. BCOR-CCNB-positive soft tissue sarcoma with round cell and spindle cell histology. A series of four cases highlighting the pitfall of mimicking poorly differentiated synovial sarcoma. Histopathology 2016; 69 : 972-801.
Štítky
Patologie Soudní lékařství Toxikologie
Článek vyšel v časopiseČesko-slovenská patologie

2017 Číslo 4-
Všechny články tohoto čísla
- Molekulární šachová partie s nádory – update terapeuticko-indikační patologie
- Tajemná role oligodendroglie v rozvoji neurodegenerací
- MONITOR aneb nemělo by Vám uniknout, že...
- Molekulární patologie plicních karcinomů pro rutinní praxi – update 2017
- Molekulární mechanizmy primární a sekundární rezistence, molekulárně-genetické znaky a vlastnosti KIT/PDGFRA nemutovaných GIST
- Jaká je Vaše diagnóza? (1)
- Co nového v Ewing-like family aneb malobuněčné/kulatobuněčné sarkomy měkkých tkání a kostí s rearanží genů CIC a BCOR. Přehled problematiky a naše prvotní zkušenosti
-
Jaká je Vaše diagnóza? (1)
Odpověď -
Vzpomínka na prim. MUDr. Josefa Mikuláštíka
(* 18.2. 1943 - † 20.7.2017) - Jaká je Vaše diagnóza? (2)
-
Hamartom ze zralých kardiomyocytů.
Pitevní kazuistika -
Jaká je Vaše diagnóza? (2)
Odpověď - JAK SE VÁM LÍBÍ
- Česko-slovenská patologie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Co nového v Ewing-like family aneb malobuněčné/kulatobuněčné sarkomy měkkých tkání a kostí s rearanží genů CIC a BCOR. Přehled problematiky a naše prvotní zkušenosti
- Molekulární patologie plicních karcinomů pro rutinní praxi – update 2017
- Molekulární mechanizmy primární a sekundární rezistence, molekulárně-genetické znaky a vlastnosti KIT/PDGFRA nemutovaných GIST
-
Jaká je Vaše diagnóza? (1)
Odpověď
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



