-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Srovnání akutní toxicity radioterapie technikou IMRT a IMRT + HDR BRT u pacientů s karcinomem prostaty vysokého rizika rekurence
Dose escalation with IMRT technique versus IMRT + HDR BRT in patients with high-risk carcinoma of the prostate – comparison of acute toxicity
Aim:
Radiotherapy (RT) in combination with hormonal therapy is standard treatment option in high-risk prostate cancer patients. Although trials of prostate plus whole pelvic RT have not improved prostate cancer outcomes in randomized trials relative to prostate RT alone in the setting of neoadjuvant and concurrent androgen suppression, elective treatment of the pelvic lymph nodes might improve diseasefree survival. A dose escalation to the prostate is possible to provide intensity-modulated RT (IMRT) or high-dose rate brachytherapy (HDR BRT) technique. We compared two subgroups of high-risk patients (T3, GS 8–10 or PSA > 20).Material and method:
The both groups underwent pelvic RT using IMRT technique (45–50.4 Gy in 25–28 fractions) and HT (goserelin + flutamid), neoadjuvant 3–4 months prior RT, concomitant HT together with RT and adjuvant HT (bicalutamid). The dose escalation was performed using IMRT 26 Gy in 13 fractions in the first subgroup or 16 Gy in 2 fractions to the reference isodose in HDR BRT subgroup. Acute toxicity scores were recorded weekly during RT and in 3 month interval post-RT using RTOG (Radiation Therapy Oncology Group) acute toxicity scales.Results:
125 patients with a histological diagnosis were enrolled, 83 in the group with IMRT, 42 in the group with HDR BRT. Follow-up median was 18 months. Patients in IMRT subgroup were older in general, median age 68 years versus 65 years in HDR BRT subgroup (p = 0.044). The prostate volume was larger in IMRT group (median 28.7 vs. 22.5 ccm, p = 0.0001). Input IPSS was higher in IMRT group (10 vs. 5). Acute GU toxicity was significantly higher in IMRT group (GU toxicity grade 0 30% vs. 37%, grade 1 56% vs. 60%, grade 2 13% vs. 3%, grade 3 1% vs. 0%, p = 0.002). The largest difference we found in grade 2 GU toxicity. The effect of pretreatment IPSS, prostate volume or the age wasn’t observed. Also acute GIT toxicity was finded as significantly higher in the group with IMRT (G0 30% vs. 60%, G1 41% vs. 37%, G2 27% vs. 3%, G3 2% vs. 0%, p < 0.01). Again the largest difference was recorded in grade 2 GIT toxicity. G3 toxicity wasn’t noted in HDR BRT arm at all, in IMRT arm was very low.Conclusion:
We recorded a very good therapy toleration in both study arms. Pelvic IMRT with boost to the prostate was well tolerated in this series, with low rates of grade 3 or greater acute toxicity. Pelvic lymphatic nodes RT in combination with HDR BRT dose escalation caused acute toxicity of minimal degree. Longer follow-up for outcome and late toxicity is required.Key words:
prostate carcinoma, elective irradiation pelvic nodes, technique intensity modulated radiotherapy, interstitial brachytherapy, acute toxicity.
Autoři: Renata Soumarová; Hana Perková; Luboš Homola; Martin Bulik; Markéta Jašková; Stanislav Machala; Halina Richterová
Působiště autorů: Nový Jičín ; Komplexní onkologické centrum
Vyšlo v časopise: Ces Urol 2010; 14(3): 164-172
Kategorie: Původní práce
Souhrn
Cíl:
Radioterapie (RT) v kombinaci s hormonální léčbou je základní metodou léčby pacientů s karcinomem prostaty vysokého rizika rekurence. Moderní radioterapie karcinomu prostaty využívá techniky intenzitně modulované RT (IMRT), která je vhodná i pro elektivní ozáření lymfatických uzlin pánve. K eskalaci dávky na oblast prostaty je opět možné použít techniku IMRT nebo intersticiální high-doserate brachyterapie (HDR BRT). Cílem práce je zhodnotit akutní toxicitu radioterapie u dvou skupin pacientů s vysokým rizikem rekurence (T3 nebo GS 8–10 nebo PSA > 20).Materiál a metoda:
Obě skupiny byly léčeny radioterapií na oblast pánve v dávce 45–50,4 Gy v 25–28 frakcích, před radioterapií absolvovaly neoadjuvantní hormonální léčbu (goserelin+flutamid) v délce 3–4 měsíců. Hormonální léčba (HT) pokračovala po dobu RT – konkomitantní HT a po skončení RT byla indikovaná adjuvantní HT (bicalutamid 150 mg denně). V první skupině pacientů byl boost na oblast prostaty proveden technikou IMRT v dávce 26 Gy (2 Gy/fr.), ve druhé skupině technikou intersticiální transrektálním ultrazvukem navigované vysokodávkové brachyterapie (HDR BRT) v dávce 2 × 8 Gy na referenční izodóze. Akutní toxicita byla hodnocena dle RTOG (Radiation Therapy Oncology Group) kritérií.Výsledky:
Ve skupině IMRT bylo zařazeno 83 pacientů, ve skupině HDR BRT 42 pacientů. Medián sledování byl 18 měsíců. Pacienti ve skupině IMRT byli starší s mediánem věku 68 let, ve skupině HDR BRT s mediánem 65 let (p = 0,044). Objem prostaty byl větší ve skupině IMRT (medián 28,7 ccm × 22,5 ccm, p = 0,0001). Vstupní skóre prostatických symptomů (IPSS) bylo vyšší taktéž ve skupině IMRT (10 vs. 5). Akutní genitourinární toxicita (GU) byla signifikantně vyšší v IMRT skupině (p = 0,002) (GU toxicita G0 byla 30 % vs. 37 %, G1 56 % vs. 60 %, G2 13 % vs. 3 %, G3 1 % vs. 0 %). Největší rozdíl byl mezi oběma skupinami zaznamenán u stupně 2. Nepodařilo se však prokázat vliv předléčebné hodnoty IPSS či objemu prostaty nebo věku na GU toxicitu. Ve skupině IMRT byla také prokázána signifikantně vyšší akutní GIT toxicita než ve skupině BRT (p < 0,01) (G0 30 % vs. 60 %, G1 41 % vs. 37 %, G2 27 % vs. 3 %, G3 2 % vs. 0 %). Opět největší rozdíl byl zaznamenán u stupně 2. GIT toxicitu stupně 3 jsme ve skupině s HDR BRT nezaznamenali, ve skupině IMRT byla velmi nízká. Vliv věku ani objemu prostaty na GIT toxicitu nebyl prokázán.Závěr:
Tolerance léčby v obou skupinách byla velmi dobrá, zvláště eskalace dávky technikou HDR BRT měla minimum akutních nežádoucích účinků. K hodnocení pozdní toxicity a biochemického selhání bude potřeba delší období.Klíčová slova:
karcinom prostaty, elektivní ozáření pánevních uzlin, technika intenzitně modulované radioterapie, intersticiální brachyterapie, akutní toxicita.Úvod
Pacienti s karcinomem prostaty vysokého rizika rekurence (T3a,T3b, nebo GS 8-10 nebo PSA > 20) představují výzvu pro radiační onkology a urology (1). Výsledky samostatné zevní radioterapie nebo radikální prostatektomie nejsou dobré. Proto je v současné době preferován spíše multimodalitní přístup. Ve strategii této skupiny nemocných se uplatňuje jednak dávková eskalace záření (2–5), jednak kombinace radioterapie (RT) s hormonální léčbou (HT), což přispělo ke zlepšení léčebných výsledků (6–12). V současné době je doporučeno v případě indikace radioterapie podat neoadjuvantní hormonální léčbu, která pokračuje po dobu RT a po skončení RT je indikována adjuvantní léčba (13, 14). Přínos vyšších dávek záření na biochemickou kontrolu onemocnění a specifické přežití byl již prokázán i ve studiích s delší dobou sledování (15). Účinnost vyšší dávky záření je patrný u všech kategorií rizika, nicméně nejvíce je vyznačen právě u pacientů se středním a vysokým rizikem. U vysokého rizika rekurence (T3, GS > 7, PSA > 20) je dle NCCN (16) doporučená dávka 78–80 Gy, které je možné při současném ozáření pánve dosáhnout bez překročení tolerance rekta pouze s použitím techniky IMRT.
Elektivní ozáření pánevních lymfatických uzlin však zůstává kontroverzní. Ačkoliv radioterapie na oblast pánevních uzlin ve srovnání s ozářením pouze prostaty nezlepšila léčebné výsledky (17, 18), kombinace pánevní radioterapie s hormonální supresí prodloužila přežívání bez známek nemoci (disease free survival – DFS) (19). Proto je ozáření pánevních uzlin v kombinaci s HT dle NCCN verze 1.2010 indikováno (kategorie 1).
Vedle lokální kontroly onemocnění a celkového přežití pacientů musíme však klást velký důraz i na možné akutní a pozdní nežádoucí účinky léčby zářením, které mohou výrazně ovlivnit kvalitu života. Při ozařování lymfatických uzlin pánve je více zatíženo rektum, a proto je dosažení vyšších dávek v prostatě bez překročení tolerančních dávek rekta obtížnější. Právě technika IMRT může pomoci šetřit i část stěny rekta. Vedle techniky IMRT je možné k dávkové eskalaci použít i techniku intersticiální brachyterapie. Její hlavní výhodou je možnost aplikace vysokých dávek záření v oblasti cílového objemu (nádoru) s prudkým poklesem dávky do okolí. Zejména zatížení právě stěny rekta je u této techniky relativně nízké. Brachyterapie neboli vnitřní ozáření je metoda radioterapie, kdy je zdroj záření umístěn přímo do nádoru nebo jeho lůžka. U karcinomu prostaty se dnes volí transperineální přístup. Intersticiální dočasná implantace (HDR brachyterapie) využívá radioizotop s vysokým dávkovým příkonem (HDR) – iridium Ir192 a je obvykle kombinována se zevní radioterapií. HDR BRT v kombinaci se zevní radioterapií je možné indikovat u pacientů s histologicky verifikovaným karcinomem prostaty T1b-T3b, jakéhokoliv Gleasonova skóre, PSA < 100 ng/ml, pokud je N0, M0 (20). Na rozdíl od permanentní brachyterapie zavedení radioizotopu je dočasné. Od permanentní brachyterapie se odlišuje i v modulaci dávkové distribuce, která je závislá na úpravě pozice zdroje a časů. Technika intersticiální HDR BRT také umožňuje přesnější rozložení dávky záření v cílovém objemu.
Materiál a metoda
Do nerandomizované, prospektivní studie, srovnávající akutní genitorurinární a gastrointestinální toxicitu pacientů ozařovaných pro karcinom prostaty vysokého rizika rekurence jsme zařadili 150 pacientů léčených v našem centru v období od ledna 2005 do prosince 2008. V jednom rameni léčby jsme u 83 pacientů použili samostatnou zevní radioterapii technikou IMRT. Ve druhém rameni léčby jsme použili kombinaci zevní radioterapie a HDR brachyterapie u 42 pacientů. Pouze zevně byli ozářeni pacienti, kteří měli kontraindikace k provedení brachyterapie (tzn. u nepříznivě uložené prostaty za stydkými kostmi, v případě používání antikoagulancií, kontraindikace anestezie apod.), anebo kteří brachyterapii odmítli. Všichni pacienti podstoupili zevní radioterapii na oblast lymfatických uzlin pánve v dávce 45,0–50,4 Gy. Brachyterapie byla provedena ve dvou frakcích ve 3. a 5. týdnu zevní radioterapie v dávce 8 Gy na referenční izodóze technikou intersticiální transperineální aplikace s použitím Iridia 192 (obr. 1). Ve spinální anestezii se pod kontrolou transrektální sonografie umístily dle předem připraveného plánu jehly do prostaty a dle trojrozměrné rekonstrukce cílového objemu (prostaty) se vypočítalo umístění zdroje a čas v jednotlivých jehlách (obr. 2). Po vlastním ozáření byly jehly z prostaty odstraněny.
Obr. 1. Transperineální aplikace jehel pod kontrolou transrektálního ultrazvuku Fig. 1. Transperineal insertion of needles into prostate using ultrasound guidance 
Obr. 2. Trojrozměnrná rekonstrukce rozmístění jehel (zeleně) v cílovém objemu – prostatě (červeně) a pokrytí cílového objemu 100% izodózou (modře) Fig. 2. 3D image of position of needles (green) in target volume – prostate (red), the coverage of target volume (100% isodose in blue) 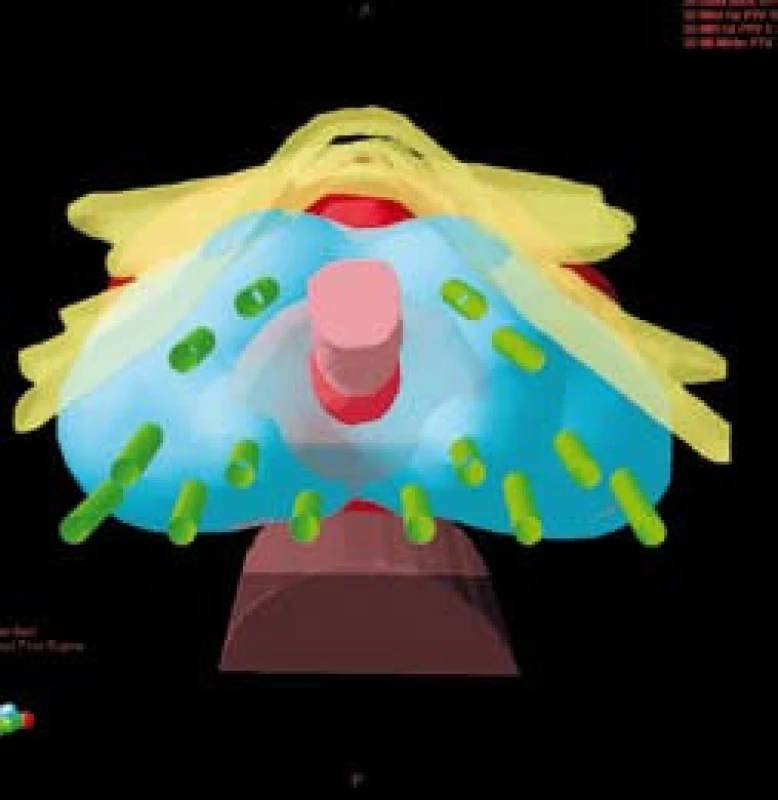
Technika IMRT umožnila ozáření pánevních lymfatických uzlin a prostaty s šetřením části rekta a aplikaci vysokých dávek záření (obr. 3). V případě kombinace IMRT s BRT byla aplikovaná ekvivalentní dávka 89,5 Gy (45 Gy + 2 × 8 Gy). Při použití techniky IMRT na oblast prostaty jsme aplikovali dávku 26 Gy ve 13 frakcích, čili celková dávka byla 76,4 Gy (50,4 Gy + boost 26,0 Gy). Dávková homogenita v plánovacím cílovém objemu (PTV) se pohybovala od 95 % do 107 % předepsané dávky. Léčba byla plánována pomocí CT. Pro techniku IMRT jsme použili tato omezení (constrains): 75 Gy < 5–10 % objemu rekta, 70 Gy < 15–20 % objemu rekta, 65 Gy < 30 % objemu rekta, 60 Gy < 50 % objemu rekta.
Obr. 3. Šetření části rekta při použití techniky IMRT – barevně znázorněna 95% izodóza Fig. 3. IMRT technique – sparing of posterioir rectal wall (95% isodoses in colors) 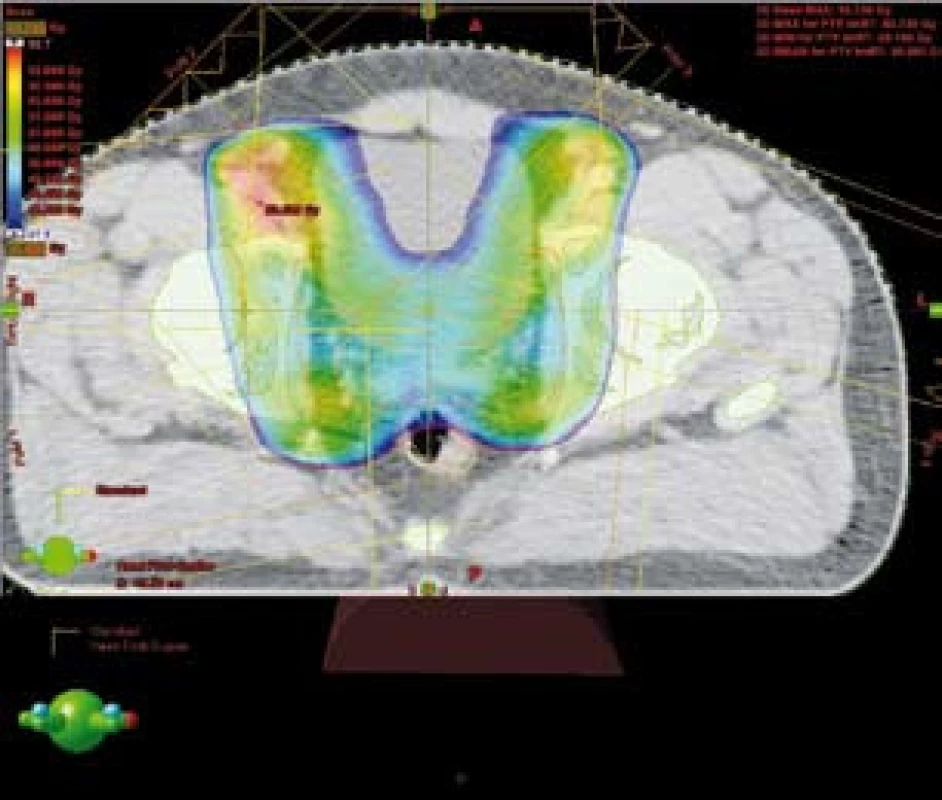
Hormonální léčba byla aplikována 3–4 měsíce před zahájením radioterapie, konkomitantně s RT (LHRH + flutamid) a po skončení RT (bicalutamid 150 mg) po dobu 2–3 let. Pacienti byli sledováni v intervalu jeden měsíc po skončení léčby a dále v tříměsíčních intervalech. Vstupně a při každé kontrole vyplnili IPSS dotazník, genitourinární a gastrointestinální toxicitu jsme hodnotili podle skórovacích kritérií pro akutní radiační toxicitu dle RTOG (Radiation Therapy Oncology Group) (21).
Statistické zpracování
Ke statistickému zpracování byly použity testy – SPSS, MATLAB. Testovali jsme nulovou hypotézu H0: „oba vzorky mají stejnou střední hodnotu“. Pokud byl prokázán statisticky významný rozdíl mezi rozptyly, byla použita Satterthwaiteova aproximace stupňů volnosti. V posledním sloupci je uvedena p-hodnota testu (tab. 1).
Tab. 1. Charakteristika souboru a statistické zpracování Table 1. Patient characteristics and statistical analysis 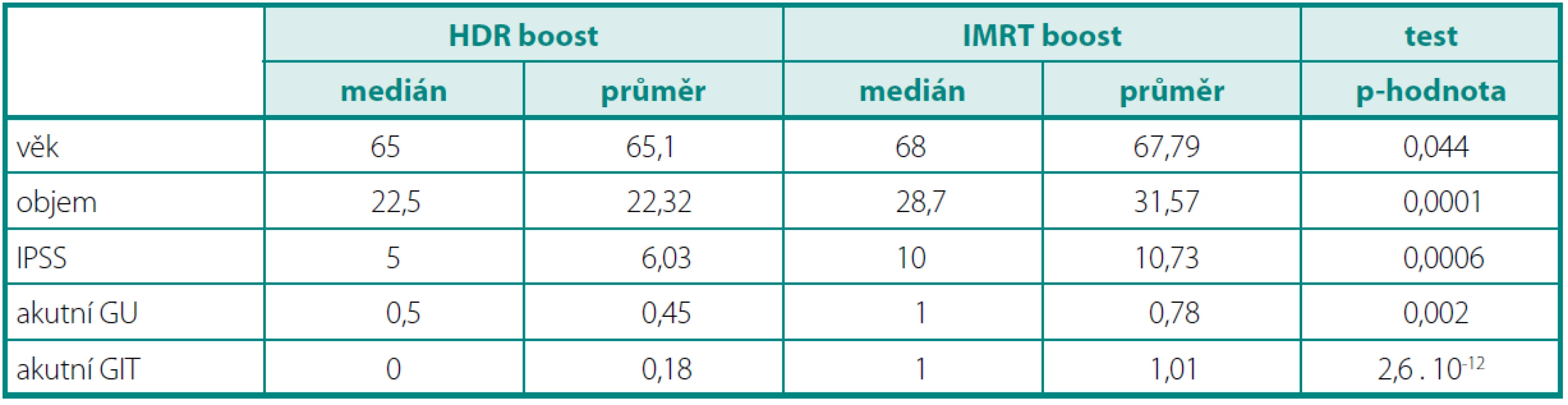
Výsledky
Ve skupině IMRT bylo zařazeno 83 pacientů, ve skupině HDR BRT 42 pacientů. Medián sledování byl 18 měsíců. Pacienti ve skupině IMRT byli starší s mediánem věku 68 let, ve skupině HDR BRT s mediánem 65 let (p = 0,044). U všech pacientů jsme hodnotili akutní toxicitu léčby dle RTOG kritérií (tab. 2). Všichni pacienti před a po léčbě vyplňovali IPSS dotazník mezinárodního skóre prostatických symptomů. Objem prostaty byl větší ve skupině IMRT (medián 28,7 ccm × 22,5 ccm, p = 0,0001). Vstupní IPSS bylo vyšší taktéž ve skupině IMRT (10 vs. 5). Obě skupiny jsme srovnali dle vstupního PSA, nebyl však nalezen statisticky významný rozdíl (p = 0,0751).
Tab. 2. Akutní toxicita dle RTOG Table 2. Acute toxicity according to RTOG 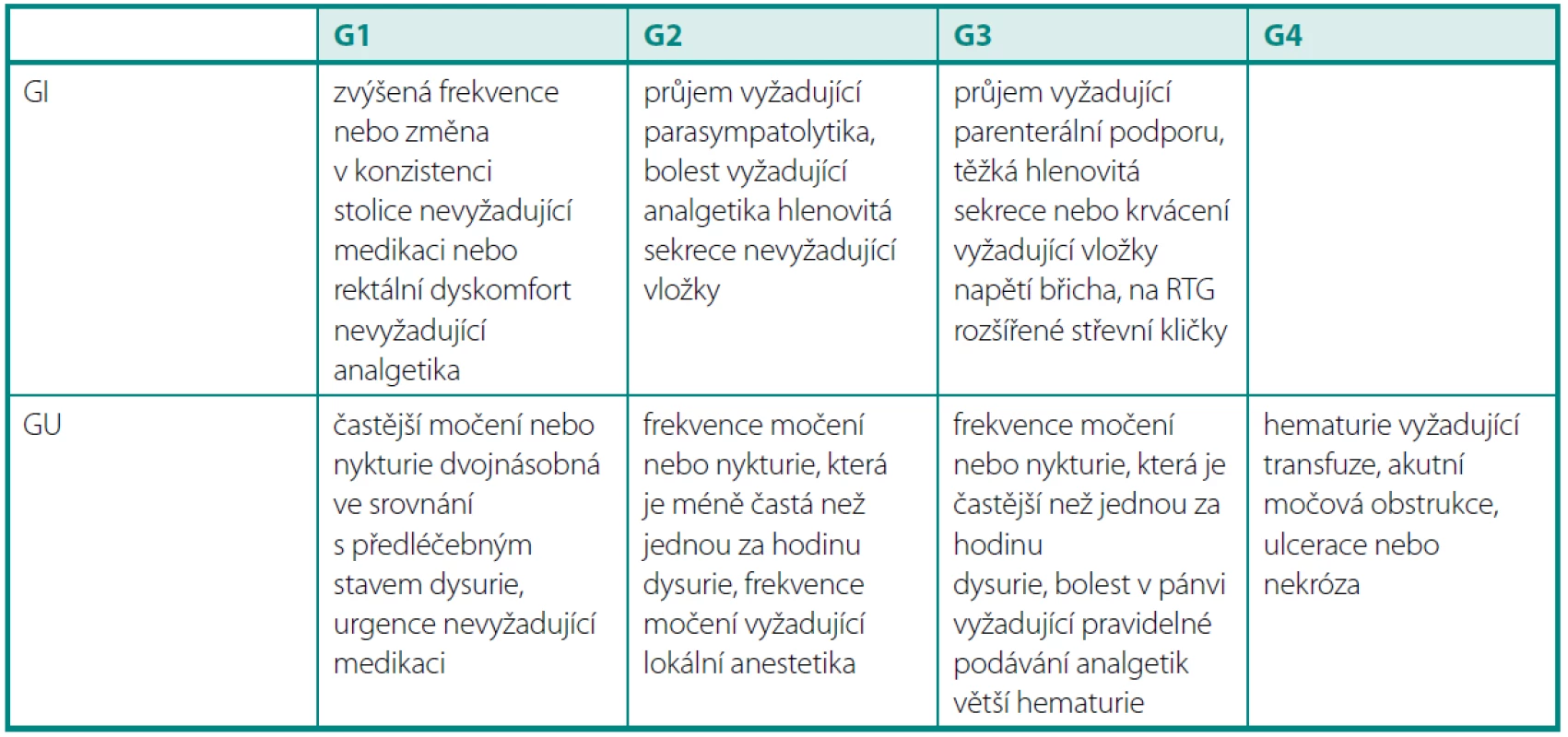
Grade 5 – fatální komplikace v důsledku léčby Akutní genitourinární toxicita (GU) byla vyšší ve skupině IMRT (obr. 4). Stupeň 1 byl v obou skupinách srovnatelný, stupeň 2 a 3 byl signifikantně vyšší (p = 0,002). Vliv předléčebné hodnoty IPSS, objemu prostaty nebo věku se však nepodařilo prokázat.
Obr. 4. Srovnání akutní GU toxicity Fig. 4. Comparison of acute GU toxicity 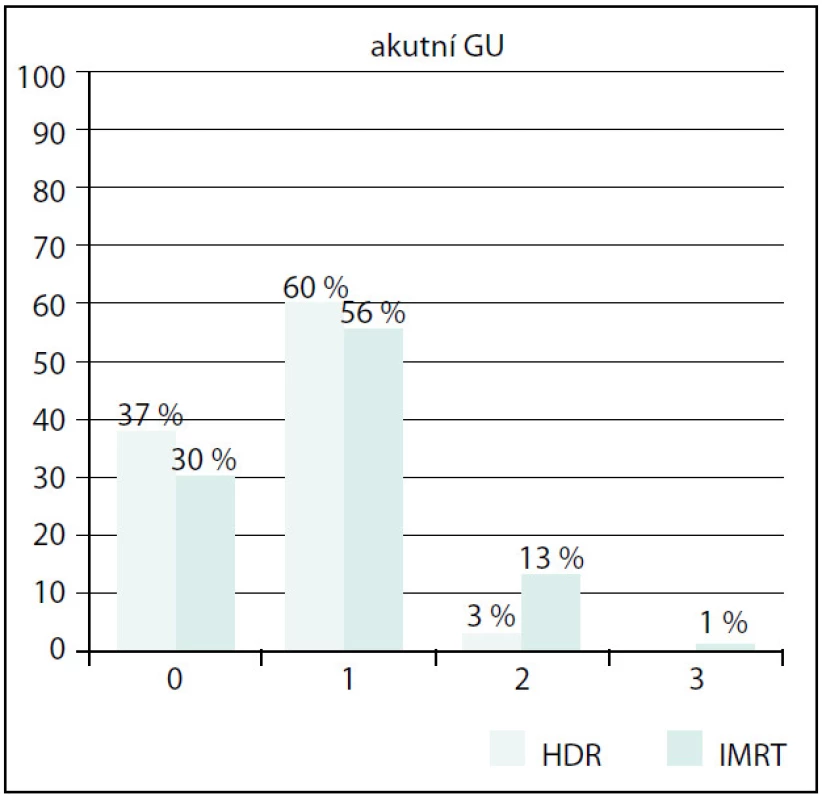
Ve skupině IMRT byla také prokázána signifikantně vyšší akutní gastrointestinální (GIT) toxicita než ve skupině BRT (p < 0,01) (G0 30 % vs. 60 %, G1 41 % vs. 37 %, G2 27 % vs. 3 %, G3 2 % vs. 0 %). Opět největší rozdíl byl zaznamenán u stupně 2 (obr. 5). Toxicitu stupně 3 jsme ve skupině s HDR BRT nezaznamenali, ve skupině IMRT byla velmi nízká. Vliv věku ani objemu prostaty na GIT toxicitu nebyl prokázán.
Obr. 5. Srovnání akutní GIT toxicity Fig. 5. Comparison of acute GIT toxicity 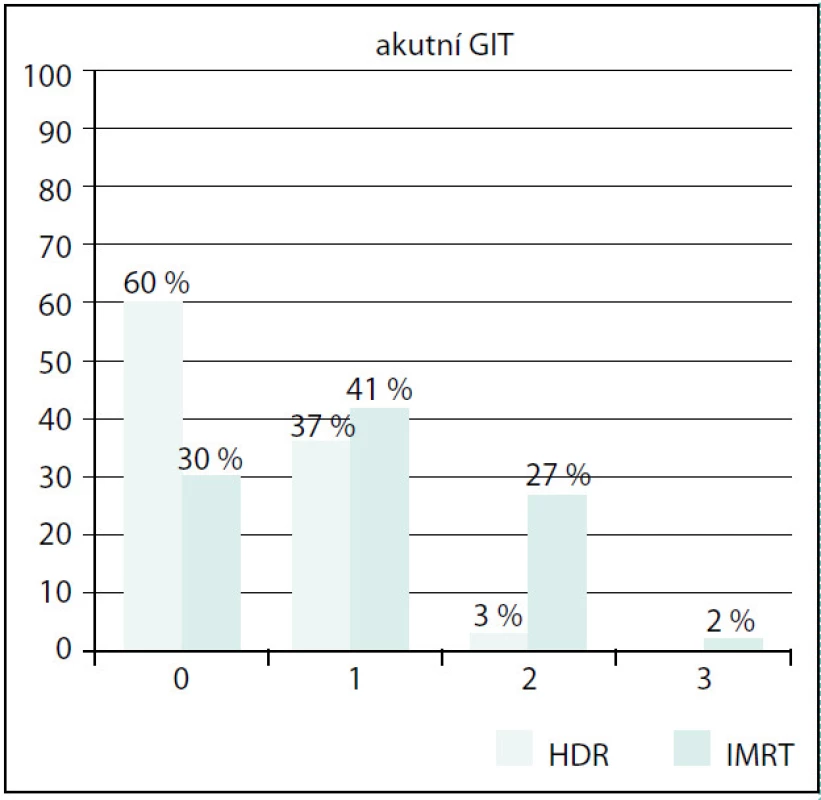
Charakteristika souboru a statistické zpracování je uvedeno v tabulce 1.
Diskuse
V léčbě pacientů s karcinomem prostaty vysokého rizika existuje řada kontroverzí – zda eskalovat dávku, nebo zda používat dávku do 74 Gy v kombinaci s hormonální léčbou, jak dlouho hormonální léčbu aplikovat apod. Review randomizovaných studií potvrdilo, že existují data pro kombinaci radioterapie v dávce 74–78 Gy s hormonální supresí. Optimální trvání a načasování HT však není zcela jasné (22). Další kontroverzí je, zda u této skupiny nemocných ozařovat celou pánev, nebo pouze prostatu a semenné váčky. Studie EORTC, RTOG a další potvrdily, že kombinace ozáření celé pánve s HT ve srovnání s ozářením pouze prostaty zlepšuje specifické přežití a biochemický progres free survival (bPFS) s nejasným vlivem na celkové přežití (9, 23, 24).
Standardně je zevní radioterapie provedena ve dvou fázích, v první je provedeno ozáření pánve v dávce 45,0–50,4 Gy, ve druhé fázi pak ozáření prostaty a proximální části semenných váčků. Ozáření pánve může však přinést větší zatížení rekta a větší toxicitu léčby. Technika IMRT je vhodná pro konkávní cílové objemy s nutností dosažení vyšších dávek záření v blízkosti senzitivních struktur, v tomto případě rekta. Dosáhla již v léčbě karcinomu prostaty širokého užití, nicméně je velmi náročná na správné provedení.
Eskalaci dávky do prostaty, která je u skupiny vysokého rizika rekurence doporučována, je možné dosáhnou právě technikou IMRT na oblast prostaty nebo s použitím HDR BRT. V případě kombinace zevní RT a BRT u high - -risk pacientů byl zaznamenán trend ke zlepšení biochemického intervalu, specifického přežití a celkového přežití, pokud byla ozářena celá pánev (25). Pro zařazení BRT do léčebného schématu také hovoří radiobiologie, u karcinomu prostaty je předpoklad vyšší účinnosti vyšší dávky na frakci. V naší studii je BRT provedena ve dvou frakcích, přičemž na frakci je aplikována dávka 8 Gy. V souvislosti s eskalací dávky pomocí HDR BRT se nabízí otázka, zda přidání HT může zlepšit výsledky léčby. Poměrně překvapující jsou závěry studie, kde přidání HT u vysoce rizikových pacientů léčených kombinací zevní RT a HDR BRT nezlepšuje biochemickou ani lokální kontrolu (26).
V léčbě karcinomu prostaty vedle léčebných výsledků je pečlivě sledována akutní a pozdní toxicita léčby. Publikované výsledky techniky IMRT ukazují nízkou toxicitu – akutní gastrointestinální (GI) toxicitu 3. stupně 0% a genitourinární (GU) 2–3 % (27). V další studii s IMRT technikou byla akutní GU toxicita G3 ve 3 %, GIT G3 0 %, G2 GU 47 %, GIT G2 30 % (28). Velké zkušenosti s technikou IMRT byly publikovány ve studii na 772 pacientech z Memorial Sloan-Kettering Cancer Centra. Akutní G2 rektální toxicitu mělo pouze 4,5 % pacientů, G3 toxicita nebyla zaznamenána. GU toxicita stupně 2 byla u 28 % mužů (29).
Podobně příznivé výsledky jsou publikovány v kombinaci s HDR BRT (1,5 % G3 GU) (30). V práci, která vyhodnocovala toxicitu protokolu IMRT techniky na oblast pánve a boostu ve formě HDR BRT, byla GU toxicita stupně 3 zaznamenána u 7,8 % pacientů, akutní GIT toxicita stupně 3 u 1,6 % pacientů. Vyšší GU toxicita dle závěrů může být spojena s objemem močové trubice, která obdrží dávku vyšší než 120 % dávky předepsané (31).
V naší studii GU toxicita stupně 3 byla pouze ve skupině IMRT, a to pouze u 1 % pacientů, GIT toxicita stupně 3 se objevila taktéž pouze ve skupině IMRT u 2 %. Podle EORTC 22991 studie je akutní GIT toxicita stupně 2 ovlivněna zejména dávkou, kterou obdrží 50 % objemu rekta – D 50 % (32). Tato dávka je samozřejmě vyšší ve skupině ozařované pouze zevní radioterapií, proto i v naší studii byla toxicita v uvedené skupině vyšší. Hormonální terapie dle uvedené studie akutní toxicitu neovlivnila.
Publikovaná data o akutní toxicitě radioterapie u karcinomu prostaty vychází z různých protokolů, přičemž pánev je většinou ozářena technikou konformní radioterapie (technika čtyř polí), případně je použita vyšší dávka na frakci u zevní radioterapie, eventuálně je kombinována zevní konformní radioterapie s jednou až dvěma frakcemi HDR brachyterapie (33). Studie, která by srovnávala toxicitu při použití techniky IMRT a současně HDR brachyterapie v jedné instituci, dosud publikována nebyla.
Závěr
V naší práci jsme prokázali velmi dobrou toleranci kombinace ozáření pánve a hormonální léčby při dosažení vysokých dávek záření v oblasti prostaty. Léčba byla velmi dobře akceptovatelná, s nízkou mírou akutních nežádoucích příznaků. Zvláště kombinace techniky IMRT na oblast pánve s HDR BRT prostaty je zatížena velmi nízkou toxicitou. HDR BRT je proto velmi vhodnou metodou k dosažení dávkové eskalace u pacientů s karcinomem prostaty vysokého rizika rekurence, u kterých je indikováno i ozáření pánve. K hodnocení pozdních nežádoucích účinků a léčebných výsledků je potřeba delší doby sledování.
Došlo: 16. 2. 2010
Přijato: 20. 4. 2010
Kontaktní adresa
doc. MUDr. Renata Soumarová, PhD.
Komplexní onkologické centrum
Máchova 30,
741 01 Nový Jičín
e-mail: renata.soumarova@onkologickecentrum.cz
Zdroje
1. D’Amico AV, Whittington R, Malkowitz SB, et al. Biochemical outcome after radical prostatectomy, external beam radioterapy, or intersticial radiation therapy for clinically localized prostate cancer. JAMA 1998; 28 : 969–974.
2. Pollack A, Zagars GK, Starkschall G, et al. Prostate cancer radiation dose response: Results of the M.D. Anderson phase III randomized trial. Int J Radiat Oncol Biol Phys 2002; 53 : 1097–1105.
3. Kuban DA, Tucker SL, Dong L, et al. Long-term results of the M.D. Anderson randomized dose-escalation trial for prostate cancer. Int J Radiat Oncol Biol Phys 2008; 70 : 67–74.
4. Dearnaley DP, Hall E, Lawrence D, et al. Phase III pilot study of dose escalation using conformal radiotherapy in prostate cancer: PSA control and side effects. Br J Cancer 2005; 92 : 488–498.
5. Zietman AL, DeSilvio ML, Slater JD, et al. Comparison of conventional-dose vs high-dose conformal radiation therapy in clinically localized adenocarcinoma of the prostate: A randomized controlled trial. JAMA 2005; 294 : 1233–1239.
6. Roach MIII, Bae K, Speight J, et al. Short-term neoadjuvant androgen deprivation therapy and external-beam radiotherapy for locally advanced prostate cancer: Long-term results of RTOG 8610. J Clin Oncol 2008; 26 : 585–589.
7. Pilepich MV, Winter K, Lawton C, et al. Androgen suppression adjuvant to definitive radiotherapy in prostate carcinoma – Long-term results of phase III RTOG 85-31. Int J Radiat Oncol Biol Phys 2005; 61 : 1285–1290.
8. Hanks GE, Pajak TF, Porter A, et al. Phase III trial of long-term adjuvant androgen deprivation after neoadjuvant hormonal cytoreduction and radiotherapy in locally advanced carcinoma of the prostate: The Radiation Therapy Oncology Group protokol 92-02. J Clin Oncol 2003; 21 : 3972–3978.
9. Bolla M, Collette L, Blank L, et al. Long-term results with immediate androgen suppression and external irradiation in patiens with locally advanced prostate cancer (an EORTC study): A phase III randomised trial. Lancet 2002; 360 : 103–106.
10. D’Amico AV, Manola J, Loffredo M, et al. 6-Month androgen suppression plus radiation therapy vs radiation therapy alone for patients with clinically localized prostate cancer: A randomized controlled trial. JAMA 2004; 292 : 821–827.
11. Denham JW, Steigler A, Lamb DS, et al. Short-term androgen deprivation and radiotherapy for locally advanced prostate cancer: Results from the Trans-Tasman Radiation Oncology Group 96.01 randomised controlled trial. Lancet Oncol 2005; 6 : 841–850.
12. Widmark A, Klepp O, Solberg A, Damber JE, Angelsen A, Fransson P, Lund JA, Tasdemir I, Hoyer M, Wiklund F, Fosså SD; Scandinavian Prostate Cancer Group Study 7; Swedish Association for Urological Oncology 3. Endocrine treatment, with or without radiotherapy, in locally advanced prostate cancer (SPCG-7/SFUO-3): an open randomised phase III trial. Lancet 2009; 373(9660): 301–308.
13. See WA, Tyrrell CJ. Casodex trade mark Early Prostate Cancer Trialists´ Group. The addition of bicalutamide 150 mg to radiotherapy significantly improves overall survival in men with locally advanced prostate cancer. J Cancer Res Clin Oncol 2006; 132 : 7–13.
14. Tyrrel CJ, Payne H, See WA, et al. Bicalutamide (Casodex) 150 mg as adjuvant to radiotherapy in patients with localised or locally advanced prostate cancer: results from the randomised Early Prostate Cancer Programme. Radiother Oncol 2005; 76 : 4–10.
15. Martinez AA, Gustafson G, Gonzalez J, et al. Dose escalation using conformal high dose rate brachytherapy improves outcome in unfavorable prostate cancer. Int J Radiat Oncol Biol Phys 2002; 53 : 316–327.
16. National Comprehensive Cancer Network®, verze 1.2010
17. Lawton C, DeSilvio ML, Roach M III, et al. An update of the phase III trial comparing whole pelvic to prostate only radiotherapy and neoadjuvant to adjuvant total androgen suppression: Updated analysis of RTOG 94–13, with emphasis on unexpected hormone/radiation interactions. Int J Radiat Oncol Biol Phys 2007; 69 : 646–655.
18. Pommier P, Chabaud S, Lagrange JL, et al. Is there a role for pelvic irradiation in localized prostate adenocarcinoma? Preliminary results of GETUG-01. J Clin Oncol 2007; 25 : 5366–5367.
19. Lawton C, DeSilvio ML, Roach M III, et al. An update of the phase III trial comparing whole pelvic to prostate only radiotherapy and neoadjuvant to adjuvant total androgen suppression: Updated analysis of RTOG 94-13, with emphasis on unexpected hormone/radiation interactions. Int J Radiat Oncol Biol Phys 2007; 69 : 646–655.
20. Kovacs G, Pötter R, Tillmann L, et al. GEC/ESTRO-EAU recommendations on temporary brachytherapy using stepping sources for localised prostate cancer. Radiother Oncol 2005; 74 : 137–148.
21. Trotti A, Byhardt R, Stetz J, et al. Common toxicity criteria: version 2.0. an improved reference for grading the acute effects of cancer treatment: impact on radiotherapy. Int J Radiat Oncol Biol Phys 2000; 47(1): 13–47.
22. Al-Mamgani A, Lebesque JV, Heemsbergen WD, Tans L, Kirkels WJ, Levendag PC, Incrocci L. Controversies in the treatment of high-risk prostate cancer – what is the optimal combination of hormonal therapy and radiotherapy: a review of literature. The prostate 2010; 70(7): 701–709.
23. Milecki P, Baczyk M, Skowronek J, Antczak A, Kwias Z, Martenka P. Benefit of whole pelvic radiotherapy combined with neoadjuvant androgen deprivation for the high-risk prostate cancer. J Biomed Biotechnol 2009; 2009 : 625394.
24. Roach M III, DeSilvio M, Valicenti R, et al. Whole-pelvis, ”mini-pelvis“, or prostate-only external beam radiotherapy after neoadjuvant and concurrent hormonal therapy in patiens treated in the Radiation Therapy Oncology Group 9413 trial. Int J Radiat Oncol Biol Phys 2006; 66(3): 647–653.
25. Bittner N, Merrick GS, Wallner KE, Butler WM, Galbreath R, Adamovich E. Whole-pelvis radiotherapy in combination with interstitial brachytherapy: Does coverage of the pelvic lymph nodes improve treatment outcome in high-risk prostate cancer? Int J Radiat Oncol Biol Phys 2010; 76(4): 1078–1084.
26. Demanes DJ, Brandt D, Schour L, Hill DR. Excellent results from high dose rate brachytherapy and external beam for prostate cancer are not improved by androgen deprivation. Am J Clin Oncol 2009; 32(4): 342–347.
27. Liauw SL, Weichselbaum RR, Rash C, Correa D, Al-Hallaq HA, Pelizzari CA, Jani AB. Biochemical control and toxicity after intensity-modulated radiation therapy for prostate cancer. Technol Cancer Res Treat 2009; 8(3): 201–206.
28. Lips IM, Dehnad H, van Gils CH, Boeken Kruger AE, van der Heide UA, van Vulpen M. High-dose intensity-modulated radiotherapy for prostate cancer using daily fiducial markerbased position verification: acute and late toxicity in 331 patients. Radiat Oncol 2008; 21(3): 15.
29. Zelefsky MJ, Fuks Z, Hunt M, Yamada Y, Marion C, Ling CC, Amols H, Venkatraman ES, Leibel SA. High dose intensity modulated radiation therapy for prostate cancer: early toxicity and biochemical outcome in 772 patients. Int J Radiat Oncol Biol Phys 2002; 53(5): 1111–1116.
30. Viani GA, Pellizzon AC, Guimarães FS, Jacinto AA, dos Santos Novaes PE, Salvajoli JV. High dose rate and external beam radiotherapy in locally advanced prostate cancer. Am J Clin Oncol 2009; 32(2): 187–190.
31. Ghadjar P, Matzinger O, Isaak B, Behrensmeier F, Stroux A, Rentsch CA, Thalmann GN, Aebersold DM. Association of urethral toxicity with dose exposure in combined high-doserate brachytherapy and intensity-modulated radiation therapy in intermediate – and high-risk prostate cancer. Radiother Oncol 2009; 91(2): 237–242.
32. Matzinger O, Duclos F, van den Bergh A, Carrie C, Villà S, Kitsios P, Poortmans P, Sundar S, van der Steen-Banasik EM, Gulyban A, Collette L, Bolla M; EORTC Radiation Oncology Group. Acute toxicity of curative radiotherapy for intermediate – and high-risk localised prostate cancer in the EORTC trial 22991. Eur J Cancer 2009; 45(16): 2825–2834.
33. Akimoto T, Katoh H, Noda SE, et al. Acute genitourinary toxicity after high dose rate (HDR) brachytherapy combined with hypofractionated external-beam radiation therapy for localized prostate cancer: Second analysis to determine the correlation between the urethral dose in HDR brachytherapy and the severity of acute genitourinary toxicity. Int J Radiat Oncol Biol Phys 2005; 63(2): 472–478.
Štítky
Dětská urologie Nefrologie Urologie
Článek vyšel v časopiseČeská urologie
Nejčtenější tento týden
2010 Číslo 3- Alergie na antibiotika u žen s infekcemi močových cest − poznatky z průřezové studie z USA
- Kterým pacientům se SLE nasadit biologickou léčbu?
- Nostiriazyn – spolehlivá 1. volba u nekomplikovaných infekcí močových cest
- Nitrofurantoin s řízeným uvolňováním: osvědčená účinnost, lepší snášenlivost a méně tablet při akutní cystitidě
- Jak souvisí časné zahájení biologické léčby SLE/LN s prevencí nevratného poškození?
-
Všechny články tohoto čísla
- Editorial
- Molekulární vlastnosti klinicky signifikantního karcinomu prostaty
- Genetické riziko karcinomu prostaty
- Mikrochirurgická operace varikokély u dětí a dospívajících – prospektivní srovnání laparoskopické a otevřené subingvinální operace
- Chronická urinární toxicita 3D-CRT a IMRT karcinomu prostaty
- Srovnání akutní toxicity radioterapie technikou IMRT a IMRT + HDR BRT u pacientů s karcinomem prostaty vysokého rizika rekurence
- Infekce močových cest po cystektomii s kontinentní ortotopickou derivací – Vesica ileale padovana (V.I.P.)
- Naše zkušenosti s aplikací rázové vlny u pacientů s induratio penis plastica (průměrná doba sledování 13 měsíců)
- Postavení magnetické rezonance a magnetické rezonanční spektroskopie při detekci karcinomu prostaty
- Představujeme nové české docenty urologie
- Central European Meeting EAU
- Česká urologie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Mikrochirurgická operace varikokély u dětí a dospívajících – prospektivní srovnání laparoskopické a otevřené subingvinální operace
- Naše zkušenosti s aplikací rázové vlny u pacientů s induratio penis plastica (průměrná doba sledování 13 měsíců)
- Postavení magnetické rezonance a magnetické rezonanční spektroskopie při detekci karcinomu prostaty
- Molekulární vlastnosti klinicky signifikantního karcinomu prostaty
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



