-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Doporučení České revmatologické společnosti pro diagnostiku systémové sklerodermie
Recommendations of the Czech Society for Rheumatology for the diagnosis of systemic sclerosis
Systemic sclerosis is a generalised connective tissue disease characterised by thickening and fibrosis of skin (scleroderma) and by typical multiorgan involvement. At the same time fibrotic changes occur in arterial vessel wall of all sizes. Capillaroscopy is an appropriate method to distinguish between primary and secondary Raynaud‘ phenomenon, while changes of macrovasculature can be proven using duplex or Doppler ultrasonography. Skin thickening can be evaluated by modified Rodnan skin score. The examination of locomotory systém is focused on joint contractures, range of joint movementi a detection tendon friction rubs. Radiographic examination can reveal thinning of distal falangi and acral osteolysis. The examination of gastrointestinal tract includes all methods used in gastroenterology. For esophagus additionally manometry and pH monitoring is performed. The examination of small intestine also comprises enteroclysis and abdominal CT. The involvement of lung parenchyma should be verified by pulmonary function tests (FVC, FEV1 and DLCO), further by chest radiography and HRCT. Bronchoscopy with lavage and cytology of the obtained fluid may contribute to diagnosis of alveolitis. Echocardiography is a key method on suspicion of pulmonary arterial hypertension. A positive finding should be verified by right heart catheterisation. Heart involvement can be proven using ECG and echocardiography, eventually perfusion scintigraphy is recommended. When renal manifestation is suspected blood pressure should be monitored and serum creatinine and urine analysis regularly performed. Permanent hypertension and proteinuria require examination of renal functions and renal biopsy. In juvenile form of SSc the spectrum of investigations is not different from that in adult form of the disease.
Key words:
Systemic sclerosis, Raynaud´s phenomenon, organ involvement, classification criteria, examination algorithms
Autoři: R. Bečvář 1; T. Soukup 2; J. Štork 3; D. Suchý 4; P. Němec 5; P. Jansa 6; Z. Fojtík 7; P. Horák 8; D. Němcová 9
Působiště autorů: Revmatologický ústav, Revmatologická klinika 1. LF UK, Praha 1; II. interní gastroenterologická klinika, Fakultní nemocnice, LF UK, Hradec Králové 2; Dermatovenerologická klinika, Všeobecná fakultní nemocnice, 1. LF UK, Praha 3; Oddělení klinické farmakologie, Fakultní nemocnice, LF UK, Plzeň 4; II. interní klinika Fakultní nemocnice u svaté Anny, LF MU, Brno 5; II. interní klinika – klinika kardiologie a angiologie, Všeobecná fakultní nemocnice, 1. LF UK, Praha 6; Interní hematologická a onkologická klinika Fakultní nemocnice, Brno 7; III. interní klinika – nefrologická, revmatologická a endokrinologická, Fakultní nemocnice, LF UP, Olomouc 8; Klinika dětí a dorostu, Všeobecná fakultní nemocnice, 1. LF UK, Praha 9
Vyšlo v časopise: Čes. Revmatol., 22, 2014, No. 2, p. 51-68.
Kategorie: Doporučení
Souhrn
Systémová sklerodermie je generalizované onemocnění pojivové tkáně projevující se ztluštěním a fibrózou kůže (sklerodermie) a typickým postižením řady orgánů. Současně dochází k fibrotickým změnám ve stěně arteriální části řečiště. Hlavním nástrojem k odlišení primárního a sekundárního Raynaudova fenoménu je kapilaroskopie, změny makrovaskulatury odhalí duplexní nebo dopplerovská ultrasonografie. Tuhnutí kůže se hodnotí pomocí modifikovaného kožního skóre dle Rodnana. Vyšetření: muskuloskeletálního aparátu zaměřujeme na odhalení kloubních kontraktur, rozsah kloubní pohyblivosti a detekci třecích šelestů šlachových pouzder. RTG diagnostika může ukázat ztenčení distálních falang rukou a akrální osteolýzy. Vyšetření trávicího traktu zahrnuje všechny metody užívané v gastroenterologii. U jícnu se navíc provádí manometrie, případně pH-metrie. Vyšetření tenkého střeva zahrnuje také enteroklýzu a CT. Postižení plicního parenchymu ověřujeme vyšetřením plicních funkcí (spirometrie a DLCO), dále skiagramem a HRCT hrudníku. Bronchoskopie s cytologií lavážní tekutiny přispívá k diagnostice alveolitidy. Echokardiografie je klíčovou metodou při podezření na plicní arteriální hypertenzi. Pozitivní nález je nutno ověřit pravostrannou srdeční katetrizací. Postižení srdce lze prokázat pomocí ekg záznamu a echokardiografickým vyšetření, případně se doplňuje perfúzní scintigrafie. Při podezření na renální manifestaci SSc se doporučují kontroly krevního tlaku, hladin kreatininu a močového sedimentu. Při trvalé hypertenzi a proteinurii je nutné vyšetření glomerulární filtrace a případně renální biopsie. U juvenilní formy SSc se spektrum vyšetřovacích metod a algoritmy vyšetření zásadně neliší od dospělé formy nemoci.
Klíčová slova:
Systémová sklerodermie, Raynaudův fenomén, orgánové manifestace, klasifikační kritéria, vyšetřovací algoritmyÚvod
Systémová sklerodermie (SSc), někdy také označovaná jako progresivní systémová skleróza, je chronické celkové onemocnění pojivové tkáně postihující kůži, pohybové ústrojí a některé vnitřní orgány. Je charakterizována fibrotickou sklerotizací periferních a viscerálních cév, fibroproduktivními změnami v pojivových tkáních, změnami mikrovaskularizace a poruchami humorální a celulární imunity. Postihuje třikrát až osmkrát častěji ženy než muže a manifestuje se častěji v mladším a středním věku, může se však vyskytnout v dětství i v pokročilém věku. Prevalence činí 30–253 případů na milión a roční incidence 3 až 19 nových případů na milión obyvatel (1, 2, 3).
V klinickém obraze dominuje Raynaudův fenomén (RF) s trofickými změnami, tuhnutí kůže a postižení gastrointestinálního traktu, plic, srdce a ledvin. Obtížná je časná diagnostika této choroby, pokud se prezentuje nespecifickými příznaky. Pro stanovení diagnózy je zásadní provést vyšetření jednotlivých orgánových systémů a u některých orgánových manifestací jsou nutné pravidelné kontroly. Pro diagnostiku SSc byla vypracována nová kritéria.
Ke stanovení diagnózy SSc a zařazení do studie nyní slouží nová klasifikační kritéria ACR/EULAR z roku 2013 (tab. 1) (4).
Tab. 1. Kritéria ACR/EULAR pro klasifikaci SSc (upraveno dle van Hoogena a spol.) (4). 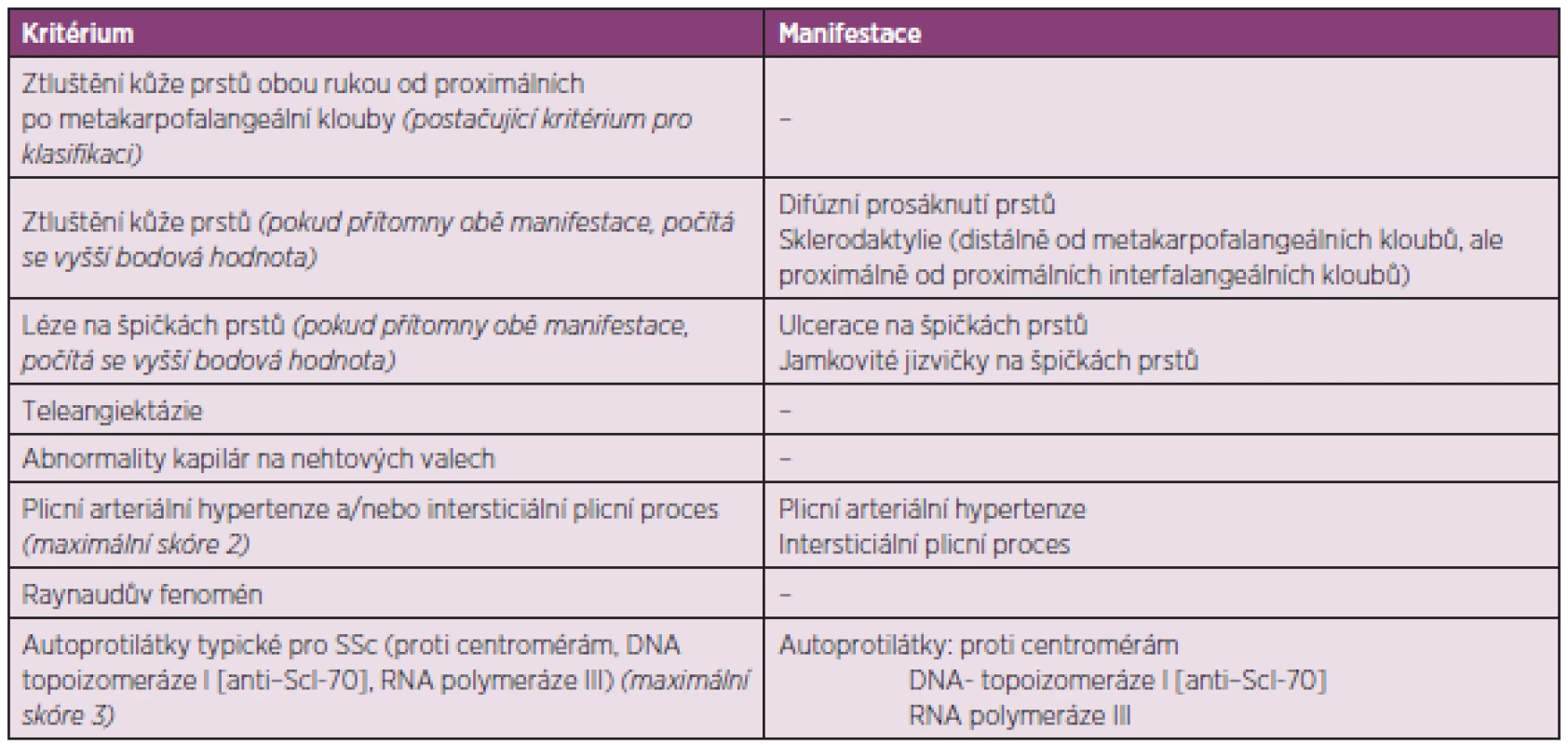
Tato kritéria mají dvě výjimky. Nelze je užít u jedinců se ztluštěním kůže, které nepostihuje prsty, a u těch, kteří mají onemocnění podobná sklerodermii, a ta lépe vystihují jejich stav. Jedná se například o nefrogenní sklerotizující fibrózu, generalizovanou morfeu, eozinofilní fasciitidu, scleredema diabeticorum, scleromyxedema, erythromyalgia, porphyria, lichen sclerosis, nemoc reakce štěpu vůči hostiteli, diabetická cheiroartropatie. Celkové skóre vznikne součtem maximálních bodových hodnot pro každé kritérium. Pacienti s celkovým skóre ≥ 9 splňují klasifikaci definitivní SSc.
U SSc se jedná o značně polymorfní onemocnění, a proto se třídí podle rozsahu kožního postižení a orgánové manifestace na několik forem (tab. 2) (3).
Tab. 2. Třídění systémové sklerodermie (upraveno dle Masiho a spol.) (5). 
Laboratorní vyšetření
V základních laboratorních vyšetřeních obvykle zjišťujeme mírnou normochromní normocytovou anémii, často trombocytopenii, vzácně hemolytickou anémii. Reaktanty akutní fáze bývají lehce zvýšené nebo normální. Přítomnost revmatoidních faktorů a kryoglobulinů se popisuje až u 40 % nemocných. Zvýšené hodnoty cirkulujících imunitních komplexů korelují s intersticiálním plicním postižením.
Průkaz autoprotilátek může pomoci k určení klinických projevů SSc a prognózy nemoci a autoprotilátky specifické pro SSc jsou považovány za významné prediktory průběhu nemoci (tab. 3) (6). Tři nejčastěji detekované autoprotilátky jsou namířené proti centromérám (ACA), DNA topoizomeráze-I (anti-Scl-70) a proti RNA polymeráze-III (RNAP).
Tab. 3. Autoprotilátky a s nimi související klinické obrazy systémové sklerodermie (upraveno podle Boina a Rosena) (6) 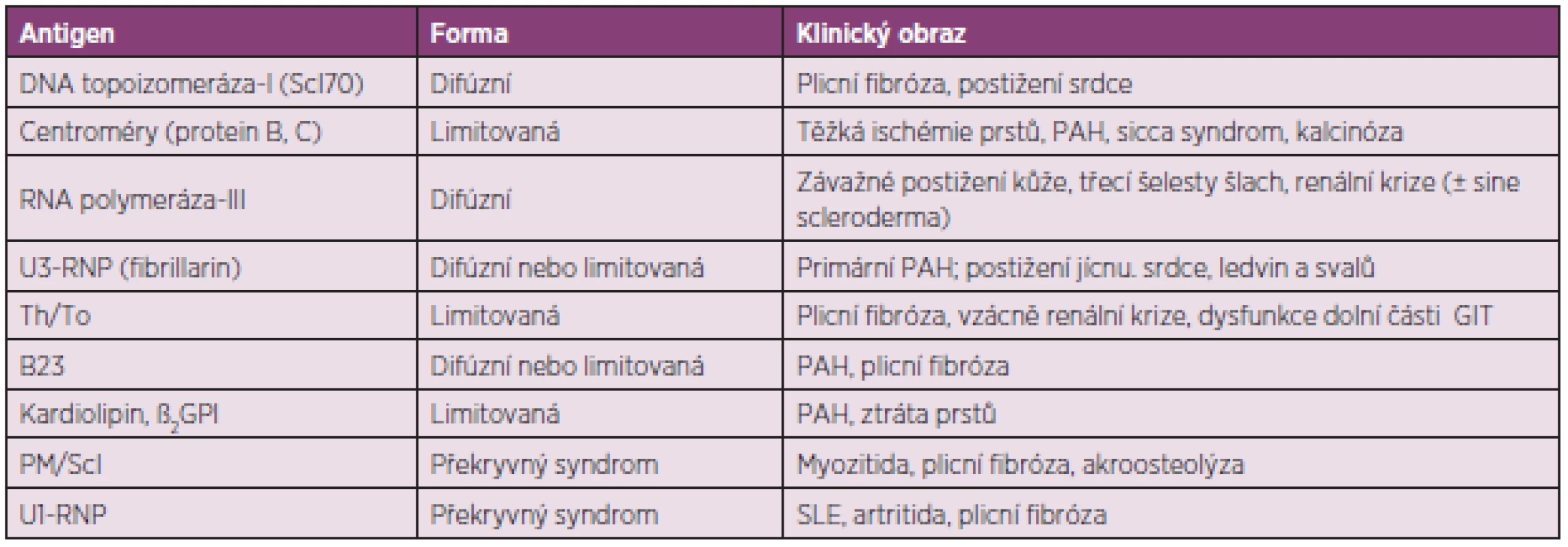
DNA – deoxyribonukleová kyselina, GIT – gastrointestinální trakt, GPI – glycoprotein, PAH – plicní arteriální hypertenze, RNA – ribonukleová kyselina, RNP – ribonukleoprotein; SLE – systémový lupus erythematodes. ACA obvykle zjišťujeme u nemocných u starších nemocných s limitovanou formou s postižením zejména prstů. Průběh nemoci bývá pomalý a orgánové postižení v pozdní fázi nemoci. Často se vyvíjí obraz CREST syndromu s podkožními kalcifikacemi na prstech horních končetin, předloktích a bércích. RF bývá závažný s rozvojem trofických změn – suché gangrény vyžadující amputace. Intersticiální postižení plic je méně časté, kdežto plicní hypertenze může vést k pravostrannému selhání.
Anti-Scl-70 se obvykle spojují se špatnou prognózou a vysokou mortalitou. Nemocné s touto autoprotilátkou mívají závažné postižením plicního intersticia, které nezávisí na rozsahu kožních projevů. Častější je však difúzní forma nemoci s rychlou progresí dermosklerózy a a vyšší frekvencí renální manifestace. RF trvá před vypuknutím choroby do 3 let a časně se také vyvíjejí kontraktury zejména na prstech a loktech. Ke ztluštění kůže obvykle dochází v prvním až třetím roce.
Autoprotilátky RNAP jsou také asociovány s rychlou progresí kožního postižení a renálním postižením. Fibróza postihuje i podkoží, šlachy a svaly a kontraktury se časně vyvíjejí na drobných a středních kloubech. Postižení trávicího traktu, plicního parenchymu a cév je u těchto nemocných méně časté, mají však významně zvýšené riziko (25–40 %) rozvoje sklerodermické renální krize. Tato manifestace je nejčastější v prvních letech nemoci, kdežto postižení srdce patří k pozdním projevům.
Další antinukleolární autoprotilátky jsou asociovány s jinými specifickými manifestacemi SSc. Autoprotilátky proti Th/To a anti PM/Scl bývají spojovány s limitovanou formou choroby, zatímco autoprotilátky proti U3-RNP (fibrilarinu) s difúzní formou SSc. Pozitivita autoprotilátek proti Th/To nese riziko postižení plicního parenchymu a cév, kdežto přítomnost anti-U3-RNP bývá asociována s celkově špatnou prognózou – postižením řady viscerálních orgánů. Kardiální postižení bývá až do pozdních stadií subklinické, kdy může dojít oboustrannému kardiálnímu selhání.
Autoprotilátky Anti-PM/Scl, anti-Ku a anti-U1-RNP se detekují zejména u nemocných s překryvnými syndromy. Anti-PM/Scl nacházíme při zánětlivé myopatii spolu s intersticiálním postižením plic, autoprotilátky anti-Ku bývají sdruženy se svalovým a kloubním postižením a anti-U1-RNP u smíšeného onemocnění pojiva.
Periferní cévy
RF postihuje přes 90 % případů SSc, je klasicky trifázický (záchvaty zbělení, zfialovění a zčervenání), může být i bifázický a jeho výskyt společně s prosáknutím prstů je považován za varovné příznaky velmi časné systémové sklerodermie (7). Standardizovaný provokační test s ochlazením pod 10°C (např. spojený s akrální oscilografií) je důležitá diagnostická metoda pro průkaz RF. Sekundární RF je odlišný od primárního. To je způsobeno přítomností vaskulopatie u difúzních onemocnění pojiva zejména u SSc (8). Rozdílnost RF při SSc od primárního RF spočívá v odpovědi na provokaci chladem nebo abnormální hyperemickou reakcí následující cévní okluzi v teplém prostředí. Hlavním nástrojem k odlišení je neinvazivní kapilární mikroskopie nebo kapilaroskopie nehtových valů (graf 1).
Graf 1. Schéma diagnostiky periferní vaskulopatie u SSc. 
RF – Raynaudův fenomén, ANA – antinukleární autoprotilátky, anti Scl 70 – protilátky proti DNA topoizomeráze I, USG – ultrasonografie. Abnormální vzhled kapilár (typické jsou zejména ektatické kapiláry, gigantické kapiláry, redukce počtu kapilár a avaskulární úseky, hemoragie) pomocí kapilaroskopu, stereomikroskopu, případně lupou, oftalmoskopem či dermatoskopem (9, 10, 11, 12). Prsty rukou, zejména bříška, vykazují často zmenšení objemu, dolíčkující, jamkovité jizvičky, Na prstech až u 50 % nemocných vznikají bolestivé ulcerace s krustami či černými escharami, které někdy postihují kostní a kloubní prominence rukou, nohou a loktů, kterým často předchází bolestivý červený edém daného okrsku kůže (13). Velkou výpovědní hodnotu mají tyto metody v kombinaci s laboratorním vyšetřením antinukleárních autoprotilátek (14). Častý je nález teleangiektazií, hlavně na obličeji a rukou. Při klinickém vyšetření nesmí být vynecháno vyšetření arteriálních pulzací končetin a odhalení klaudikačních obtíží v anamnéze. Důležité je registrovat možnou extenzi změn na cévy předloktí a bérce vyvolanou aterosklerózou (15, 16, 17). Nezbytné je pak vyšetření lipidového spektra. Vhodnou zobrazovací metodou za těchto okolností je duplexní nebo dopplerovská ultrasonografie (18), v některých případech i angiografie (19, 20).
Kůže
Typická je tuhá kůže prstů, sklerodaktylie, která vede k flekčnímu postavení prstů. Termín proximální sklerodermie představuje symetrická sklerodaktylie s tuhou kůží přesahující metakarpofalangeální klouby (21). V těchto místech je možné pozorovat i kalcifikace, hypo/hyperpigmentace nad klouby a kostními výčnělky, u nemocných dochází k celkovému difúznímu ztmavnutí kůže), nad klíčními kostmi bývá patrné bělavé, někdy mírně tužší, „náhrdelníkovité“ proužkování. Obličej může být hypomimický, s parestéziemi, s pocitem stahující se kůže se zmenšením schopnosti plně otevřít ústa, kůže bývá méně zřasitelná či posunlivá (nejčastěji nad zygomy), může být patrné periorální radiální rýhování, úzké rty, mikrostomie, zkrácené frenulum jazyka (22). Na přední straně krku, až u 90 % pacientů, bývají při maximálním záklonu zřejmé podélně prominující tužší kožní řasy (tzv. „neck sign“) (23). Biopsie kůže není k diagnóze vždy nutná, její provedení je však vhodné u ne zcela typických klinických obrazů. Histopatologický obraz postižené kůže u lokalizované i systémové sklerodermie je obdobný (1). Oproti lokalizované sklerodermii nejsou u SSc zánětlivé změny zpravidla zastiženy či jsou malé. Nález neodlišuje jednotlivé formy SSc. V časné fázi nacházíme v koriu perivaskulární infiltráty, které v přilehlém podkoží vyvolávají až obraz lymfocytární panikulitidy se ztluštěním a sklerotizací vazivových sept tukové tkáně. V pozdějších fázích, s ubývajícím infiltrátem, dochází ke zhrubění až homogenizaci kolagenu, rozšíření koria a k zániku kožních adnex, kromě potních žláz, které jsou těsně sevřené okolním vazivem. Odlišení od jiných stavů spojených se sklerotizací vaziva může být obtížné. V diferenciální diagnóze je nutné zvážit stavy spojené s indurací kůže. Je to především rozsáhlá morfea (většinou nepostihuje ruce, obličej, oblast velkých kloubů, nemá orgánové postižení), eozinofilní fasciitida (nepostihuje ruce a nohy, v místech s výraznější přítomností podkožní tukové tkáně, jako např. vnitřní strany paží, vnitřní a zadní strany stehen, postranní partie břicha, má kůže dolíčkovaný, hrbolatý povrch podmíněný tahem sklerotizovaných vazivových sept podkoží), scleroedema adultorum (je typický tuhou kůže horních partií hrudníku, přecházejících na šíji až ke lbi s depozity mucinu v kožní biopsii).
Nejdůležitějším kožním příznakem SSc je zatuhnutí kůže, které se projeví ztíženou zřasitelností kůže (při bodovém hodnocení kožní indurace podle Rodnana:
- 0 – normální;
- 1 – při uchopení prsty vytváří řasu, je však hůře uchopitelná, zdá se tužší;
- 2 – kůže vytváří řasu, ale nelze ji uchopit, je jednoznačně tužší;
- 3 – výrazně tuhá kůže, nelze vyzdvihnout řasu.
Modifikované Rodnanovo hodnocení („score“) zahrnuje 17 oblastí těla (obr. 2) (24).
Obr. 1. Formy systémové sklerodermie dle kožního postižení. 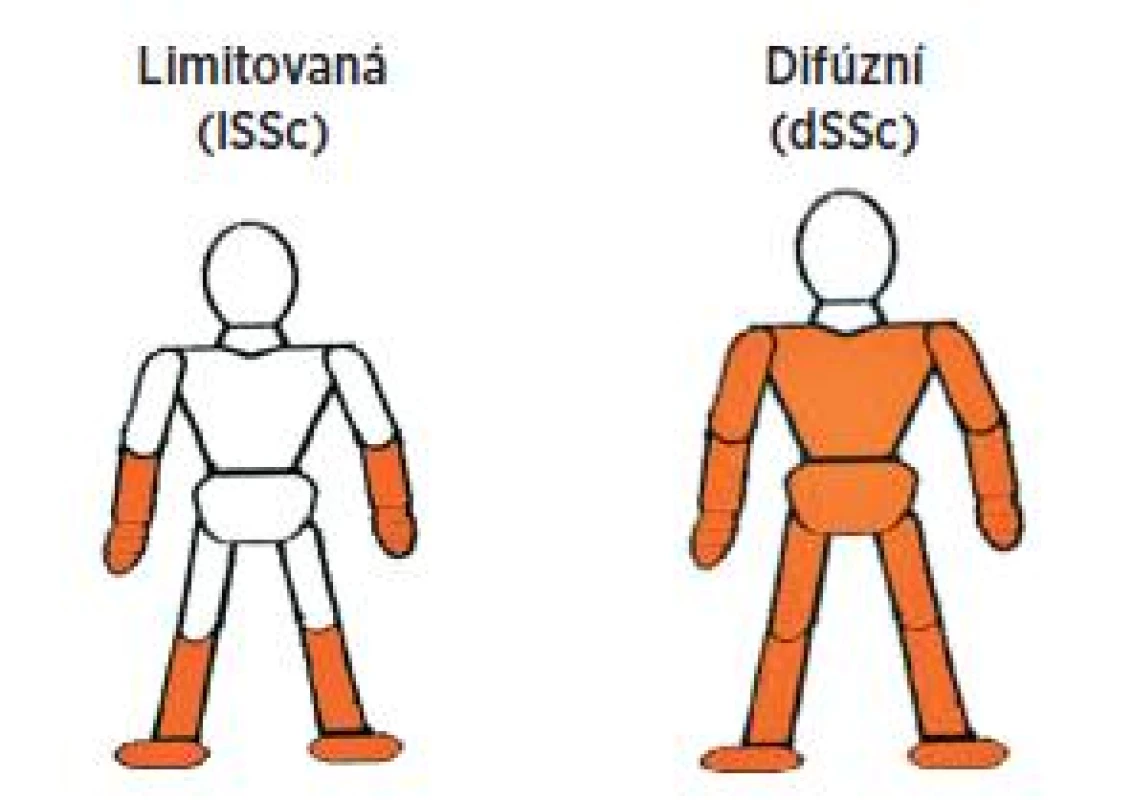
Obr. 2. Modifikované Rodnanovo hodnocení (skóre) (mRSS) (24) 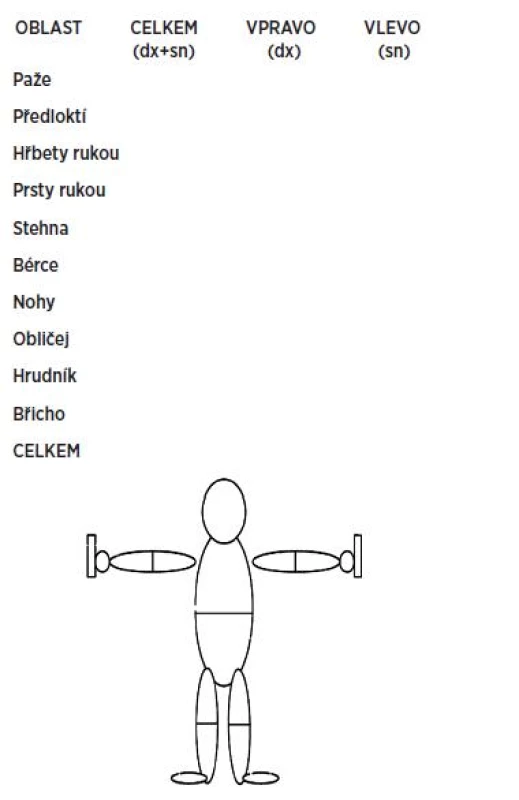
K hodnocení hloubky indurace kůže je možné využití vysokofrekvenční sonografie a přístrojů hodnotících biomechanické vlastnosti kůže např. durometrů (25).
Pohybové ústrojí
Postižení pohybového ústrojí se manifestuje u více než tři čtvrtiny nemocných a zahrnuje artralgie s ranní ztuhlostí (26). Pro SSc jsou typické třecí šelesty šlachových pouzder na flexorech prstů, loktech a ramenou Nejčastěji jsou postiženy šlachy svalů spojených s dorsoflexí v talokrurálním kloubu, extenzory prstů a kolene. V některých případech lze třecí šelesty detekovat i v oblasti ramenních kloubů, zápěstí a dalších (27). V méně vyvinutých případech lze detekovat pomocí stetoskopu. Artralgie jsou běžné zejména v časné fázi difúzní sklerodermie. V této fázi onemocnění lze zachytit i zánětlivé synovitidy periferních kloubů – symetrická artritida drobných ručních kloubů patří mezi méně časté projevy, bývá anti CCP negativní, neerozivní a nodulární. Zpravidla dobře odpovídá na chorobu modifikující léky včetně metotrexátu a ustupuje po několika měsících (28). U pacientů s překryvným syndromem mezi SSc a revmatoidní artritidou bývá pozorována i typická anti CCP pozitivní artritida s progresivním rozvojem kloubních erozí. Osteolýza nebo resorpce posledních článků prstů je popisována u 40–80 % pacientů s SSc, vzniká na podkladě nedostatečného prokrvení distálních článků prstů při vystupňovaném vazospazmu. Osteolytické změny mohou být vyjádřeny i na jiných kostech, v praxi ale v podstatně menším procentu případů. Jedná se o žebra, mandibulu, klavikulu, humerus a krční páteř (29). Často se objevuje akroosteolýza – resorpce distálních článků jako důsledek protrahované ischémie prstů. Svalové postižení se projevuje myalgiemi a slabostí proximálních svalových skupin. Určitý stupeň svalového postižení patří mezi běžné projevy onemocnění. Příčinou může být celkový pokles kondice pacientů nebo rozvoj atrofií v důsledku kloubních kontraktur či kortikoterapie. Svalové postižení vyskytuje častěji ve formě myopatie, řídce myozitidy. Sklerodermická myopatie je charakteristická relativně málo progresivním rozvojem, lehkou svalovou slabostí proximálních svalových skupin, normálními nebo lehce vyššími hodnotami svalových enzymů a špatnou odpovědí na kortikoidy. Svalová biopsie prokazuje fibrózu a nezánětlivé změny. Myozitické postižení je charakterizováno proximální svalovou slabostí a elevací svalových enzymů a typickými EMG a histologickými změnami. V případě překryvného syndromu s polymyozitidou lze detekovat i pozitivitu anti-PM-Scl protilátek (30).
Fyzikální vyšetření zaměřujeme na odhalení kloubních kontraktur, rozsah kloubní pohyblivosti a na detekci třecích šelestů šlachových pouzder palpačně případně za pomoci stetoskopu. Nacházíme je nejčastěji v těchto lokalizacích: ramenní kloub - lopatka, loket-olecranon, kolenní kloub-patela, radiokarpální klouby-flexory /extenzory, flexory a extenzory prstů, talokrurální kloub: šlachy musculus tibialis anterior/posterior, musculus peroneus a Achillova šlacha.
K průkazu svalového postižení je třeba provést tato vyšetření: svalový test, stanovit aminotransferázy, myoglobin, CK a LD. Při podezření na myozitidu je nutné elektromyografické vyšetření, případně MRI a svalová biopsie. Radiografické vyšetření může ukázat typické ztenčení akrálních částí prstů rukou – akrální osteolýzy. Dále se popisuje drobnoskvrnitá kalcinóza periartikulárně na distálních interfalangeálních kloubech rukou a akrálně (syndrom Thibiergeho-Weisenbacha). U 15–29 % pacientů se SSc se vyskytují erozivní změny často na karpometakarpálních kloubech (překryv s revmatoidní artritidou). Eroze bývají lehce asymetrické. Při podezření na úžinové syndromy je indikováno neurologické vyšetření včetně elektromyografického vyšetření.
Gastrointestinální trakt
Postižení trávicího traktu patří k nejčastějším projevům SSc a bývá přítomno přibližně u 82 % pacientů (31). Klinické příznaky jsou důsledkem narušené motility trávicího traktu způsobené porušenou nervovou inervací, defektním cévním zásobením, tkáňovou fibrózou a atrofií hladké svaloviny (32). V histologickém obraze dominuje fibróza v rozsahu lamina propria sliznice, submukózy, atrofie hladké svaloviny a zánětlivý buněčný infiltrát, tvořený zejména mononukleárními buňkami, lokalizovaný perivaskulárně. Není zcela jasné, zda jsou tyto změny příčinou nebo následkem poruch autonomní nervové inervace a cévního zásobení stěny trávicího traktu. V důsledku tkáňové fibrózy a atrofie hladké svaloviny dochází k narušení peristaltické aktivity. Postižena může být kterákoli část trávicího traktu, jehož stěna je tvořena hladkou svalovinou. Nejčastěji bývá přítomno postižení jícnu. Postižena může být i oblast orofaryngu, žaludku, tenkého a tlustého střeva a konečníku. Poruchami trávicího traktu jsou ohroženi pacienti jak s difúzní, tak i s limitovanou formou SSc. U pacientů s limitovanou formou SSc bývá postižení jícnu často součástí CREST syndromu. I přes prokazatelné funkční změny trávicího traktu, mohou být u řady pacientů tyto změny asymptomatické. Na druhou stranu mohou být příznaky postižení trávicího traktu spolu s RF jednou z prvních manifestací SSc.
Postižení úst ve formě mikrostomie, suchosti sliznic dutiny ústní a časté postižení periodontu vyvolává pacientům problémy s polykáním, nechutenství a zvýšenou kazivost a ztrátu zubů. Řada pacientů se SSc může mít projevy suchosti očí a dutiny ústní (suchý syndrom). Histologické vyšetření drobných slinných žláz obvykle prokazuje fibrózu bez přítomnosti lymfocytárního infiltrátu typického pro Sjögrenův syndrom. Rovněž autoprotilátky anti-Ro/SSA, anti-La/SSB nebývají přítomny. V důsledku méně častého postižení svaloviny horní části hltanu může být narušen posun potravy do jícnu a pacienti mohou mít potíže s polykáním tuhých soust i tekutin s rizikem aspirace.
Nejčastěji postiženou částí trávicího traktu bývá jícen. Postižení jícnu se objevuje u více než 80 % nemocných se SSc. Postižení se nejčastěji manifestuje dysfagickými obtížemi. Pacienti popisují pocit váznutí tuhého sousta v průběhu polykaní často doprovázený pálivou bolestí za hrudní kostí případně nauzeou. Tyto symptomy obvykle mizí po dodatečném zapití sousta tekutinou. Důsledkem narušené primární a sekundární peristaltické aktivity jícnu a sníženého tonu dolního jícnového svěrače může být vývoj gastroezofageálního refluxního onemocnění (GERD) s rozvojem ezofagitidy, která bývá přítomna až u 100 % pacientů se závažným kožním postižením (33). Pacienti mohou trpět příznaky předčasné sytosti, regurgitace stravy, rizikem uvíznutí sousta v jícnu, váhovým úbytkem a malnutricí. Příznaky GERD se typicky zhoršují po jídle, po fyzické zátěži a během spánku. Neléčená perzistující ezofagitida s erozemi či vředy může vést k okultnímu, ale i manifestnímu krvácení, k rozvoji pozánětlivé stenózy jícnu či k rozvoji slizniční metaplazie (Barettův jícen) postihující přibližně 38 % pacientů. Riziko rozvoje adenokarcinomu jícnu je poměrně malé. Funkční poruchy podobné achalázii jícnu byly u pacientů se SSc rovněž popsány (34). K méně typickým projevům postižení jícnu patří jinak nevysvětlitelný kašel, chrapot, pocit nadměrné produkce slin, aspirace, případně lokalizovaná kandidová infekce.
Důsledkem opožděného vyprazdňování žaludku a stagnace žaludečního obsahu může být zhoršení příznaků GERD. Často bývají přítomny projevy nechutenství, sytosti, nadýmání, nauzea a zvracení. Pacienti často omezují kalorický příjem, aby předešli podobným projevům, a v důsledku toho hubnou. Angiektatické rozšíření cév v oblasti žaludečního antra může být příčinou gastrointestinálního krvácení manifestujícího se hematemézou nebo melénou. Toto postižení bývá jednou s hlavních příčin sideropenické anémie postihující pacienty se SSc. Endoskopické vyšetření v tomto případě prokazuje známky antrální gastritidy a prominující longitudinální zvrásnění žaludeční sliznice připomínající povrch vodního melounu (watermelon stomach) (35).
Porucha motility tenkého střeva, která bývá přítomna přibližně u 88 % pacientů, může být asymptomatická, ale může být rovněž příčinou závažné intermitentní pseudoobstrukce tenkého střeva manifestující se bolestí břicha, distenzí kliček tenkého střeva a zvracením (36). V krajním případě stav vyžaduje dlouhodobou kompletní parenterální výživu. K dalším projevům porušené motility střevní patří adynamický ileus provázený opakovanými atakami bolestí břicha, zvracením, průjmem a steatoreou. Váhový úbytek a malnutrice se může vyvinout v důsledku malabsorpce zapříčiněné přerůstáním bakteriální střevní flóry ve stagnujícím střevním obsahu. Malabsorpce bývá přítomna až u 1/3 pacientů (36). Pokročilé postižení tenkého střeva může být příčinou cystoidní pneumatózy tenkého střeva (pneumatosis cystoides intestinalis), kdy střevní plyny pronikají do střevní stěny, případně do dutiny břišní a napodobují příznaky ruptury stěny tenkého střeva (benigní pneumoperitoneum) (37, 38). Vzácně se může vyvinout rozsáhlá nekróza tenkého střeva v důsledku trombózy mezenterických arterií (39). Pacienti se SSc mívají obvykle sníženou distenzibilitu tračníku, která však nemusí vždy být příčinou klinických projevů (40). K častým příznakům patří zácpa, k méně častým průjem, případně pseudoobstrukce tlustého střeva (41). Slizniční teleangiektazie mohou být zdrojem krvácení (42). V důsledku atrofie hladké svaloviny dochází často k vývoji divertiklů se širokým ústím typickým pro SSc postihujícím příčný a sestupný tračník. Ty mohou být asymptomatické, ale mohou být rovněž příčinou obstrukce případně perforace tlustého střeva. V důsledku redukované kapacity konečníku, snížené poddajnosti stěny a poklesu tonu análního svěrače může docházet k prolapsu konečníku, inkontinenci a zhoršení zácpy (41, 43).
Vzácně dochází u pacientů se SSc k postižení jater. Je popisována asociace mezi limitovanou formou SSc a primární biliární cirhózou (44). Toto onemocnění se manifestuje intrahepatální cholestázou se zvýšením hladiny alkalické fosfatázy, žloutenkou a bývá asociováno s pozitivitou antimitochondriálních autoprotilátek. Byl rovněž popsán výskyt autoimunitní hepatitidy u pacientů s limitovanou formou SSc. U třetiny pacientů se SSc bývá snížena produkce pankreatických šťáv. U pacientů se SSc byla popsána idiopatická kalcifikující pankreatitida a rovněž nekróza tkáně pankreatu v důsledku arteriitidy pankreatické tepny (45, 46).
V případě výskytu výše zmíněných symptomů a podezření na postižení trávicího traktu v rámci SSc by další vyšetřování pacienta mělo probíhat ve spolupráci s gastroenterologem (tab. 4). Jícnová manometrie prokáže funkční abnormality hladké svaloviny jícnu a snížení tonu dolního jícnového svěrače (47, 48). S těmito nálezy dobře korelují i nálezy ze scintigrafie jícnu. K dalším doporučeným vyšetřením jícnu, indikovaným zejména při podezření na přítomnost GERD, patří endoskopie a 24hodinová pH metrie.
Tab. 4. Přehled postižení jednotlivých úseků zažívacího traktu u SSc a jejich vyšetření. 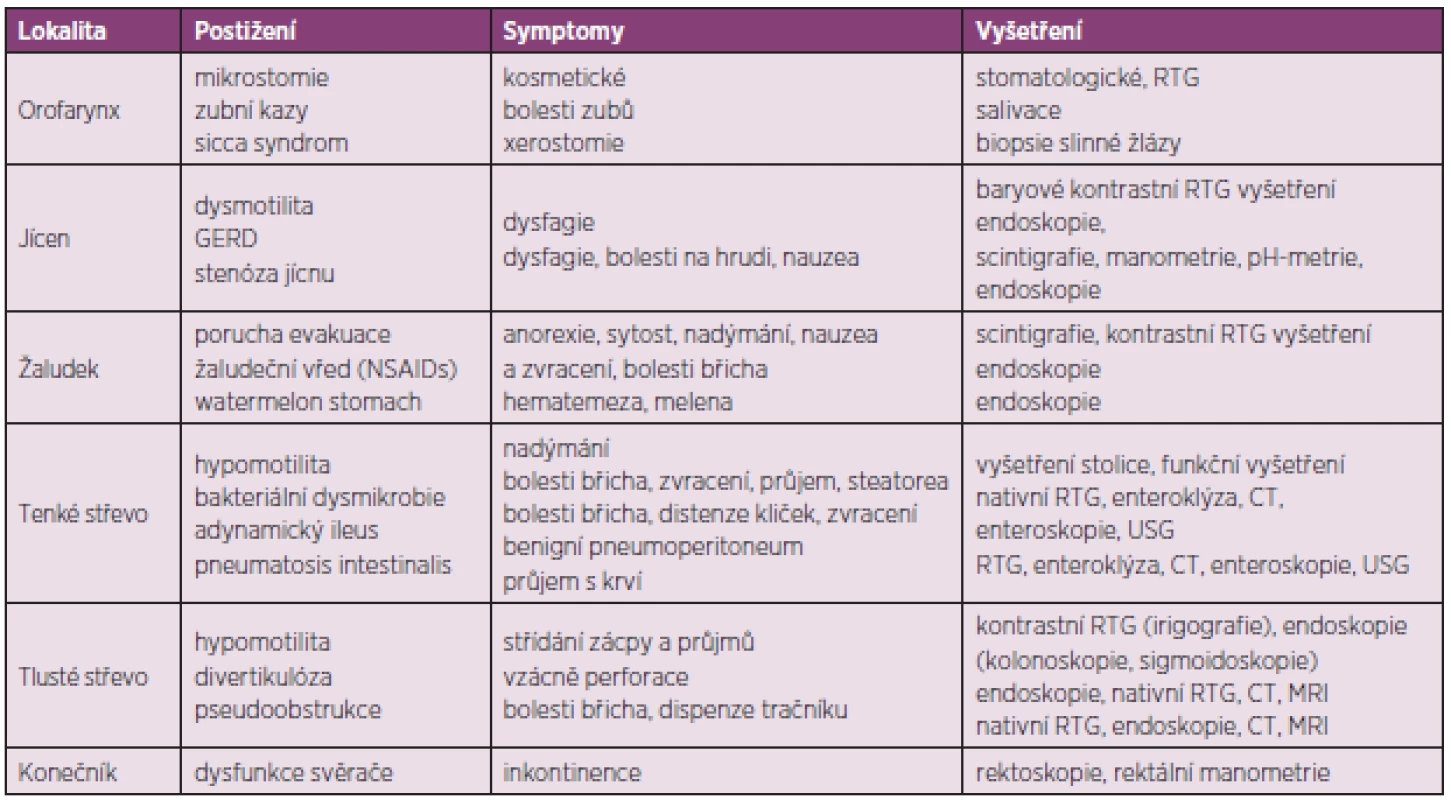
Metodou volby vyšetření žaludku je scintigrafie, kontrastní rentgenové vyšetření a zejména endoskopie, která může prokázat typické slizniční změny (watermelon stomach).
Vyšetření tenkého střeva zahrnuje nativní rentgenové vyšetření břicha, které může prokázat distenzi střevních kliček z důvodu adynamického ileu, případně pneumatosis intestinalis nebo benigní pneumoperitoneum. Přibližně u 20 % symptomatických pacientů je vyšetření negativní. V tomto případě je indikováno vyšetření enteroklýzou se zobrazením střeva pomocí RTG nebo výpočetní tomografie (CT). Toto vyšetření prokazuje abnormality tenkého střeva u 60 % pacientů se SSc, jejichž tíže však vždy nemusí korelovat s klinickou symptomatologií. Duodenum bývá obvykle rozšířené, zejména ve druhé a třetí části, často s protrahovanou retencí kontrastní látky (49). Jejunum bývá rovněž rozšířené a zdeformované v důsledku fibrózy střevní stěny. Další metody vyšetření tenkého střeva zahrnují ultrasonografii střev a endoskopické vyšetření (enteroskopii). V diferenciální diagnostice příčin malabsorpčního syndromu je indikováno biochemické a mikroskopické vyšetření stolice, funkční vyšetření tenkého střeva, které zahrnuje zátěžové, toleranční testy s perorálním podáním D-xylózy nebo vitamínu A, testy střevní permeability s podáním laktózy nebo manitolu, histochemické vyšetření vzorků sliznice odebrané enterobiopsií a testy sekreční funkce se značeným albuminem (51Cr-albuminový test). Variantou funkčních testů jsou i dechové testy s izotopově značenou (13C, 14C) xylózou, laktózou nebo dalšími substráty. K funkčním testům může být použito i jiných látek, např. železo a vitamin B12 (Schillingův test). Další metodou vyšetření tenkého střeva je anaerobní kultivace aspirátu odebraného v proximálním úseku tenkého střeva. Tato metoda je však zdlouhavá a vyžaduje speciálně vybavenou laboratoř. Vyšetření tlustého střeva zahrnuje endoskopii (kolonoskopie nebo flexibilní sigmoidoskopie), případně kontrastní rentgenové vyšetření (irigografie). Alternativou může být i vyšetření pomocí CT nebo magnetické rezonance (virtuální kolonoskopie). K vyšetření konečníku se používá endoskopické vyšetření (rigidní rektoskopie), případně rektální manometrické vyšetření.
Plíce
Nejčastějším postižením plic při SSc je intersticiální proces probíhající obvykle pod obrazem fibrotizující alveolitidy. Intersticiální plicní onemocnění (IPO) se vyskytuje u nemocných s kožně limitovanou formou onemocnění zejména při tzv. CREST syndromu. Vyskytuje se také při kožní difúzní formě, kdy bývá poněkud častější (50). IPO u nemocných SSc může však kromě fibrotizující alveolitidy zahrnovat několik jednotek, jak je uvedeno v tab. 5 (51).
Tab. 5. Formy intersticiálního plicního onemocnění při systémové sklerodermii (upraveno dle Veeraraghavana a spol.) (51). 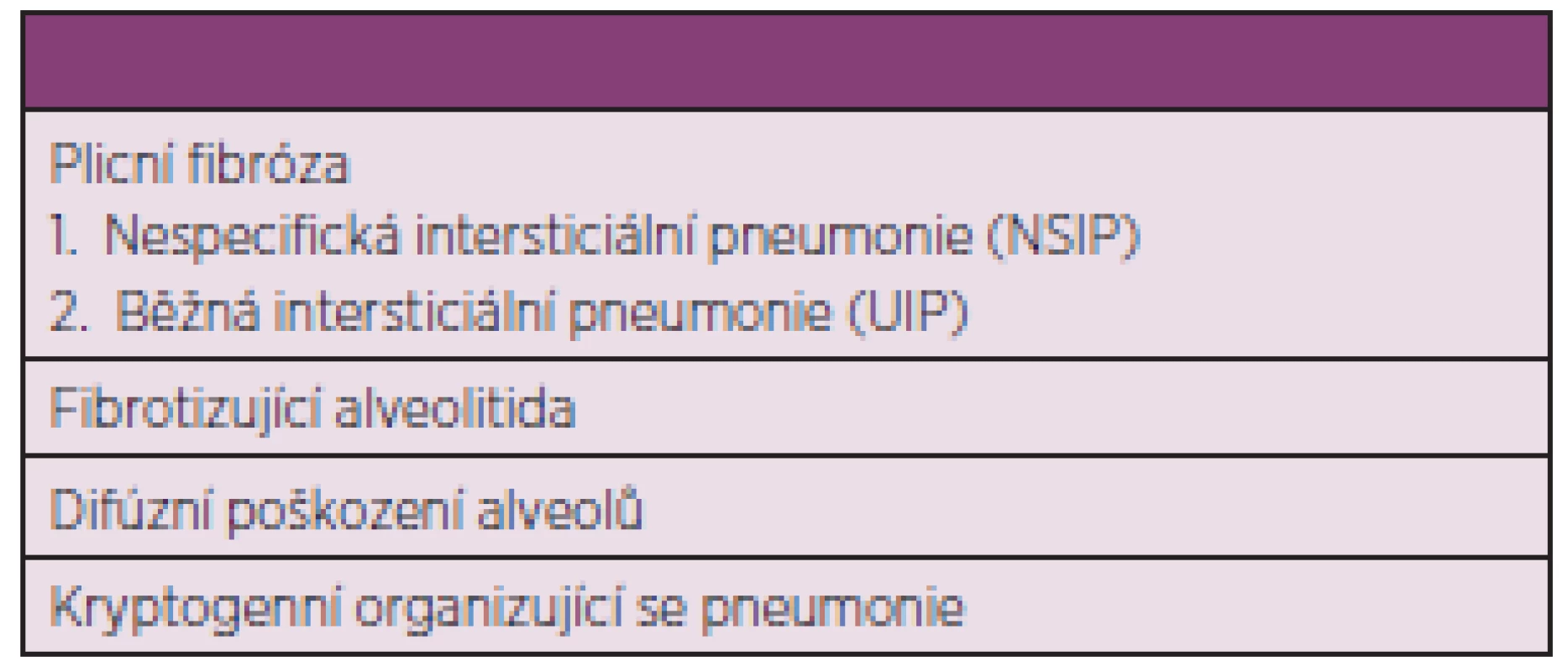
Prevalence IPO kolísá mezi 25 % a 90 % v závislosti na etniku nemocných a použitých vyšetřovacích metodách. Nejčasnější intersticiální změny probíhají v subpleurálních oblastech zadních částí bazí obou plicních křídel (52, 53, 54). U nemocných, u nichž se rozvíjí střední až těžká restrikční porucha, postupují změny až do horních plicních polí. U nemocných SSc při rozvoji IPO dochází k časnému poklesu plicních funkcí (zejména FVC). Byl zjištěn pokles FVC až o 32 % ročně během prvních dvou let. I když většina fibrotických změn bývá zjištěna post mortem, je IPO spojeno se zvýšenou mortalitou a vysoká frekvence úmrtí na IPO při SSc byla pozorována ve druhých 5 letech od začátku choroby (5). Pacienti se závažným plicním postižením, definovaným jako FVC < 55 % a DLCO < 40 % náležitých hodnot mají horší prognózu s mortalitou až 42 % během 10 let od začátku nemoci (55).
Ačkoli je jasné, že při IPO provázejícím SSc probíhá zánět v intersticiu a alveolech a změny v plicních cévách s rozvojem intersticiální fibrózy, dosud není známo, který proces je prvotní. Na samotném počátku může být ještě jiná událost, která spustí uvedené děje.
V klinickém obraze je u nemocných IPO nejčastějším subjektivním příznakem dušnost. Pokud je závažná, bývá značně vysilující. Při fibróze malého rozsahu se obvykle dušnost objeví až při námaze. V době, kdy se dušnost objeví v klidu, je to známkou, že plicní onemocnění je již střední nebo závažné (vyvolané buď IPO, nebo postižením plicních cév). Řada dalších příznaků SSc, jako je únava, bolesti a slabost pohybového ústrojí a omezená hybnost kloubů, mohou bránit nemocným SSc ve cvičení a zátěži a tedy zjistit, zda trpí dušností. V takových případech je zjištění stupně dušnosti obtížné, až nemožné. Tak bývá zapotřebí jiný přístup ke zjištění progresivního restrikčního onemocnění. Nemocní podstoupí vyšetření plicních funkcí – plicní funkční testy (PFT). Obvykle stačí měřit FVC a difúzní kapacita pro oxid uhelnatý (DLCO) každých 6 měsíců v prvních 6 letech nemoci (graf 2). Takový skrínink dobře vystihuje pokles plicních funkcí a měl by být podnětem k dalším vyšetřením. Kašel je dalším běžným příznakem plicní fibrózy. Bývá dráždivý, neproduktivní a zhoršuje se při zátěži. Produktivní kašel vyžaduje další vyšetření k vyloučení zánětu, aspirační pneumonie nebo nádoru.
Graf 2. Algoritmus vyšetření plic při systémové sklerodermii. 
Vyšetření plicních funkcí patří k nejsnazším a nejméně invazivním způsobům měření plicních funkcí a slouží jako ukazatel morbidity a přežití u většiny plicních onemocnění včetně SSc. Vzácně může zmenšení ústního otvoru být překážkou provedení těchto testů. V těchto případech lze použít flexibilní dětský náustek. Nejčastější změny u SSc zjišťujeme při měření DLCO. Bohužel k poklesu může docházet při celé řadě procesů – obstrukčních, restrikčních a při postižení plicních cév. Při SSc bývá obstrukční choroba méně častá. FVC je spolehlivějším ukazatelem restrikční poruchy, když vyloučíme malé úsilí pacienta a slabost dýchacího svalstva. U SSc hodnotíme u IPO změny %FVC a %DLCO, které klesají současně u restrikční poruchy, kdežto u postižení plicních tepen bývá disproporce v poklesu těchto ukazatelů. Poměr %FVC a %DLCO může naznačit, zda se jedná o postižení intersticia, plicních tepen, nebo směs obojího. Mohou nastat tři situace (56):
- Jestliže %FVC je nižší než 75 % náležité hodnoty a poměr %FVC a %DLCO menší než 1,4, trpí nemocný převážně restrikční poruchou.
- Jestliže %FVC je vyšší než 75 % a poměr %FVC a %DLCO vyšší než 1,4, je pravděpodobné, že nemocný má onemocnění plicních tepen.
- Jestliže %FVC je nižší než 75 % a poměr %FVC a %DLCO vyšší než 1,4, je pravděpodobné, že nemocný má restriktivní poruchu a současně onemocnění plicních tepen. Obecně platí, že u nemocného, kde se uvažuje pouze o primární IPO, je vždy třeba myslet na postižení plicních tepen a naopak, jako příčinách dušnosti.
Ze zobrazovacích metod se obvykle indikuje HRCT hrudníku, protože je mnohem senzitivnější než prostý radiogram. Může ukázat určité změny i při normálním předozadním snímku, a tak je vhodnou metodou v časné diagnostice. Změny na HRCT byly zjištěny asi u 90 % nemocných, tedy v podobném procentu jako při autopsiích (57). Při použití 1mm řezů je HRCT užitečným nástrojem pro průkaz IPO. Oblasti „mléčného skla“ korelují s celulární infiltrací – aktivní alveolitidou, kdežto subpleurální linie, pruhy v parenchymu a obraz „medové plástve“ odpovídají oblastem ireverzibilní fibrózy. Zatímco obraz retikulace jasně znamená fibrotické změny, obraz „mléčného skla“ znamená zhruba ekvivalentně alveolitidu a fibrózu. V nejasných případech je nutno provést skeny v pronační i supinační poloze k vyloučení vlivu gravitace, která vyvolává cévní i intersticiální stázu ve sledovaných oblastech. Nálezy z posledních let ukazují, že HRCT nemůže rozlišit nespecifickou intersticiální pneumonii a obvyklou intersticiální pneumonii. Obvyklá intersticiální pneumonie vede k rozvoji fibrózy.
Bronchoalveolární laváž (BAL) se provádí při bronchoskopickém vyšetření. Výplach se obvykle provádí ze středního laloku. Celkový počet buněk byl vyjádřen jako počet buněk celkem získaný ve všech třech porcích. V závěru bylo vyjádřeno zastoupení alveolárních makrofágů, lymfocytů, neutrofilních a eozinofilních leukocytů procentuálně (58, 59).
Speciální metodou je epiteliální clearance 99mTc dietylentriaminu, kdy měříme přestup nebulizovaných partikulí do alveolů. Z normálních podmínek přestup přes alveolokapilární membránu trvá 40–50 minut, při porušení integrity epitelu a při intersticiálních plicních procesech je urychlen. Test má význam pro detekci časné IPO a pro určení nemocných, kteří zůstanou ve stabilním stavu (60, 61).
Měření vydechovaného NO je další metodou k detekci nemocných se zánětlivým procesem v plicním intersticiu. Zvýšené hodnoty NO korelují se zmnoženými lymfocyty v lavážní tekutině (62) a novější studie ukázala zvýšené množství NO u nemocných SSc bez radiologicky prokázaného postižení plic ve srovnání se zdravými jedinci a pacienty s „idiopatickým“ IPO (63). Proto by se tato metoda mohla stát citlivým ukazatelem plicního zánětu u nemocných bez manifestního IPO.
Otevřená plicní biopsie je stále považována za „zlatý standard“ pro stanovení diagnózy IPO, neboť jednoznačně ukáže typ a aktivitu zánětu a stupeň fibrózy. Může také ukázat přítomnost jiných procesů, které IPO napodobují, nebo připomínají, jako jsou bronchiolitis obliterans s organizující se pneumonií, nebo aspirační pneumonie z gastroezofageálního refluxu. Klasifikace a histopatologické obrazy se při IPO průběžně mění, čímž zřejmě vyjadřují naše neúplné porozumění patogeneze různých typů IPO. Navíc není jasné, zda tato klasifikace může předpovídat vývoj a účinnost léčby. Jedná se o invazivní vyšetření často provázené komplikacemi, i když se provádí při thorakoskopii a nález značně závisí na bioptované oblasti. Z těchto důvodů se indikuje omezeně při neurčitých nálezech z předchozích neinvazivních vyšetření (64).
Nemocní s kožně difúzní i limitovanou formou SSc mají riziko vzniku IPO. Všichni tito pacienti by měli absolvovat kontrolní vyšetření za 3–6 měsíců. Musí být získána anamnéza, provedeno fyzikální vyšetření a PFT a DLCO každých 6 měsíců po dobu 5–6 let od stanovení diagnózy. Vyšetření plicních funkcí se musí zaměřit zejména na progresivní pokles funkce plic zejména %FVC – viz graf 2. Pokud pacienti popírají dušnost a mají stabilně normální hodnoty PFT, mohou se pravidelná kontrolní klinického vyšetření provádět po 6 měsících.
Manifestní i asymptomatický gastroezofageální reflux je u SSc velmi častý, pacienti s tímto projevem by měli být velmi agresivně léčeni, i když nemají respirační příznaky. U nemocných s dušností, kašlem a/nebo poklesem PFT je agresivní léčba refluxu zvláště důležitá.
Pokud si nemocní stěžují na dušnost a zejména když dochází k jejímu zhoršení, nebo klesá %FVC, je nutné podrobnější vyšetření. Zásadní vyšetření jsou HRCT a BAL a pokud nacházíme patologické nálezy u obou vyšetření, zřejmě se jedná o alveolitidu, která vyžaduje léčbu. Pokud HRCT a BAL nevykazují změny typické pro alveolitidu, je tato manifestace nepravděpodobná. Pak musíme uvažovat o jiných příčinách dušnost a poklesu plicních funkcí, jako jsou reflux, infekce, plicní hypertenze, skryté srdeční vady (zejména diastolická dysfunkce jako projev kardiomyopatie při SSc) a myozitida/myopatie s postižením dýchacích svalů.
Plicní arteriální hypertenze
Plicní arteriální hypertenze (PAH) je primární onemocnění plicních arteriol, které se vyskytuje u systémových onemocnění pojiva, a to nejčastěji u SSc, zejména u její varianty CREST (65). U nemocných se SSc může PAH provázet IPO nebo se vyskytovat samostatně. Hemodynamicky je PAH asociovaná se SSc definována jako prekapilární plicní hypertenze (zvýšení středního tlaku v plicnici na 25 mm Hg a více, normální tlak v zaklínění) (66). Podle stupně závažnosti dělíme plicní hypertenzi na lehkou, středně těžkou a těžkou (tab. 6).
Tab. 6. Stupně závažnosti plicní hypertenze. 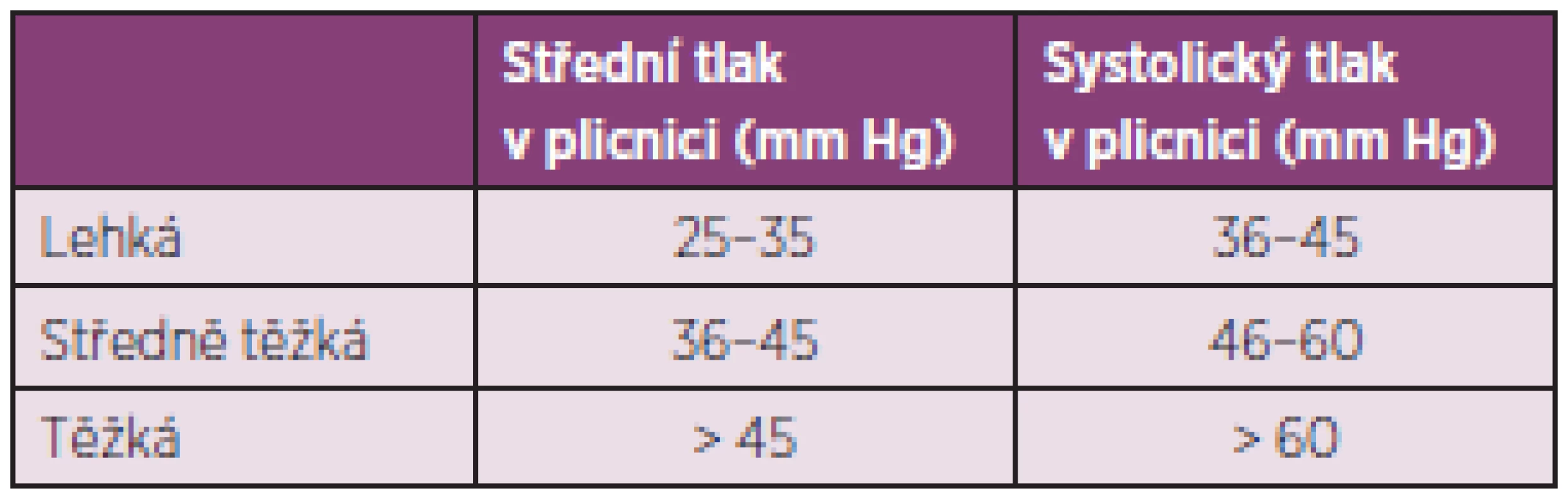
Publikované údaje o prevalenci však kolísají v širokém rozmezí mezi 4,9 % a 26,7 % díky rozdílnému metodickému přístupu při stanovení nebo odhadu tlaku v plicnici. K rizikovým faktorům rozvoje PAH u SSc patří limitovaná forma onemocnění, trvání choroby 10–15 let, manifestace základního onemocnění ve vyšším věku. Medián přežití u neléčené PAH při SSc se uvádí 1 rok (67). Nejčastějším symptomem u PAH je postupně progredující námahová dušnost a únavnost. Anginózní bolesti na hrudi jsou důsledkem ischémie pravé komory, synkopy a presynkopy jsou projevem nízkého srdečního výdeje. Mezi vzácnější projevy onemocnění patří chrapot způsobený útlakem levého vratného nervu dilatovaným kmenem plicnice, kašel a hemoptýza. Ke kvantifikaci symptomů u nemocných s PAH se používá modifikovaná NYHA klasifikace (tab. 7) (68).
Tab. 7. Modifikovaná funkční klasifikace podle NYHA u plicní hypertenze (tzv. WHO klasifikace). 
Ve fyzikálním nálezu souvisí manifestace jednotlivých nálezů s tíží plicní hypertenze. Často bývá akcentace druhé srdeční ozvy nad plicnicí, přítomnost čtvrté ozvy a cvalového rytmu. Třetí ozva bývá přítomna v pokročilých stadiích onemocnění. Může být slyšitelný šelest trikuspidální a pulmonální regurgitace. U většiny nemocných je zvýšená náplň krčních žil. Známkou pokročilého onemocnění je přítomnost periferních otoků a cyanóza (69).
Echokardiografie je klíčovou neinvazivní vyšetřovací metodou indikovanou při podezření na PAH (70). Slouží k posouzení velikosti, tvaru, hypertrofie, funkce pravé komory a k odhadu tlaku v plicnici. Dále je echokardiografické vyšetření nezbytné k vyloučení zkratové vady a postižení chlopenního aparátu a myokardu levého srdce jako příčiny plicní hypertenze. Pro odhad stupně plicní hypertenze je rozhodující dopplerovské echokardiografické vyšetření.
Echokardiografický screening PAH je indikován u všech nemocných se SSc v intervalu 1 roku. U symptomatických nemocných i s lehkou plicní hypertenzí je indikováno invazivní hemodynamické vyšetření. Asymptomatické nemocné (třída NYHA I) klinicky sledujeme a indikujeme kontrolní echokardiografické vyšetření za 6 měsíců (graf 3).
Graf 3. Algoritmus vyšetření při podezření na plicní arteriální hypertenzi při systémové sklerodermii. 
Přítomnost EKG známek hypertrofie pravé síně a pravé komory, stejně jako vyšší klidová frekvence, se považuje za nezávislý negativní prognostický faktor.
Na RTG snímku hrudníku bývá většinou přítomna dilatace kmenů plicnice a prořídlá cévní kresba na periferii plicních polí.
Ventilační a perfúzní scintigrafie plic je zásadní v odlišení chronické tromboembolické plicní hypertenze jako příčiny plicní hypertenze. Funkční vyšetření plic je nezbytné k průkazu podílu hypoxické složky plicní hypertenze jak popsáno výše.
Pravostranná srdeční katetrizace s hemodynamickým vyšetřením slouží k definitivnímu průkazu plicní hypertenze, k její přesné kvantifikaci, k určení srdečního výdeje, plicního cévního odporu a k měření vazodilatační odpovědi při testu akutní plicní vazodilatace. U nemocných s PAH zjišťujeme prekapilární plicní hypertenzi, většinou těžkou. Tlaky v plicnici nezřídka dosahují systémových tlaků nebo je i překračují. Minutový srdeční výdej bývá nízký a plicní cévní rezistence vysoká. Cílem testu akutní plicní vazodilatace je určit nemocné odpovídající na vazodilatační léčbu (respondéry), kteří mohou být dlouhodobě léčeni perorálními vazodilatancii, zejména blokátory kalciových kanálů. U nemocných s PAH asociovanou se SSc nalézáme respondérů minimum (71).
Z laboratorních vyšetření má smysl monitorovat vývoj onemocnění a odpověď na léčbu pomocí tzv. biomarkerů (hladina kyselina močové, troponin, natriuretické peptidy). Nejjednodušším, levným a snadno opakovatelným zátěžovým testem je test šestiminutovou chůzí. Výsledky testu dobře korelují s tíží plicní hypertenze a s prognózou onemocnění (72).
Srdce
Kardiální manifestace SSc zahrnuje postižení endokardu, myokardu i perikardu, které se může vyskytovat samostatně nebo v kombinaci a manifestuje se přítomností fibrózy a ischémie myokardu, hypertrofií myokardu, perikardiálním výpotkem, supraventrikulárními nebo komorovými arytmiemi, převodními poruchami, chlopenními vadami a konečně srdečním selháním (73). Přítomnost kardiálního postižení u SSc je spojena s nepříznivou prognózou. Pětileté přežití v případě klinicky manifestního kardiálního postižení se pohybuje kolem 30 % (74).
Typické postižení myokardu u SSc představuje myokardiální fibróza (75, 76). Postihuje obě srdeční komory a často se vyskytuje současně s hypertrofií myokardu. Systolická a/nebo diastolická dysfunkce levé srdeční komory není u SSc výjimečná. Její rozvoj je nepochybně spjat s myokardiální fibrózou. Systolická dysfunkce levé komory se u nemocných se SSc bez známek srdečního selhání vyskytuje v klidu u 10–15 % pacientů (77). Diastolická dysfunkce se naopak může vyskytovat u více než poloviny nemocných se SSc. Precipitujícím faktorem rozvoje diastolické dysfunkce je současně přítomná arteriální hypertenze, obstrukční spánková apnoe, renální insuficience a hypertrofie levé komory.
Při SSc bývají typicky postiženy malé koronární cévy. Proto je také koronarogram epikardiálních věnčitých tepen angiograficky mnohdy normální, ale jsou přítomny zátěží indukované perfúzní defekty. U CREST varianty SSc bývají věnčité cévy ektaticky změněny. Myokardiální RF je označení pro chladem provokovaný koronární vazospazmus.
Přítomnost perikardiálního výpotku u SSc je relativně častá (78) a klinicky se manifestuje zhruba u 5–16 % nemocných a může vést až k srdeční tamponádě nebo konstriktivní perikarditidě. Přítomnost perikardiálního výpotku také nezřídka provází plicní hypertenzi a srdeční selhání. V sekčních nálezech bývá postižení perikardu nalézáno u 33–72 % nemocných (79).
Arytmie a převodní poruchy jsou zřejmě důsledkem fibrózy a ischémie převodního systému. Nejčastější je postižení sinoatriálního uzlu. Typická je vyšší přítomnost komorových extrasystol a běhů komorových tachykardií. Nález blokády pravého raménka Tawarova se považuje za negativní prognostický faktor (80).
Postižení chlopenního aparátu dosahuje v sekčních nálezech až 38 % případů, je popisováno uzlíčkovité ztluštění cípů mitrální chlopně a zkrácení šlašinek. Důsledkem může být prolaps cípu mitrální chlopně nebo nedomykavost chlopní.
Základní vyšetřovací postupy při podezření na kardiální manifestaci jsou uvedeny v grafu 4 (81). V praxi zahrnují tyto metody: klidové EKG a EKG Holterovo monitorování, rtg srdce a plic, echokardiografické vyšetření, radionuklidové metody, laboratorní vyšetření a zátěžové testy (82).
Graf 4. Algoritmus vyšetření při podezření na kardiální manifestaci systémové sklerodermie. 
Klidové EKG může ukázat supraventrikulární i komorové arytmie, blokády na všech úrovních, přetížení síní, hypertrofie a přetížení pravé komory, změny úseku ST-T. Známky hypertrofie pravé komory jsou pro plicní hypertenzi specifické, ale málo senzitivní.
Vyšetření RTG srdce a plic při chronickém srdečním selhání ukazuje vždy zvětšení srdečního stínu (nemusí být u diastolického srdečního selhání). Toto zvětšení bývá spojeno i se změnami jeho kontury. Pro posouzení velikosti udáváme poměr šířky srdečního stínu k šířce hrudníku – kardiothorakální index, kdy za patologickou se považuje hodnota větší než 0,5.
Echokardiografie hraje při vyšetření nemocného s podezřením na srdeční selhání klíčovou úlohu. Je základní metodou pro neinvazivní posouzení velikosti levé komory a určení hodnoty ejekční frakce jako základního ukazatele systolické funkce. Ve spojení s dopplerovským vyšetřením transmitrálního krevního průtoku a průtoku v plicních žilách umožňuje posoudit orientačně i funkci diastolickou. Je nejcitlivější metodou pro průkaz hypertrofie levé komory, umožňuje posoudit velikost a funkci pravostranných srdečních oddílů, odhalit perikardiální výpotek, aneuryzma levé komory atd. Tlak v pravé síni posuzujeme podle průměru a respirační variace dolní duté žíly. Systolickou funkci pravé komory určujeme na základě ejekční frakce pravé komory, podle systolického pohybu plochy anulu trikuspidální chlopně nebo pomocí tkáňové dopplerovské echokardiografie. Diastolickou funkci pravé komory posuzujeme podle charakteru průtoku přes trikuspidální ústí a rovněž tkáňovou dopplerovskou echokardiografií. K prognosticky nepříznivým echokardiografickým známkám patří dilatace pravé síně a přítomnost perikardiálního výpotku (79).
Perfúzní scintigrafie myokardu pomocí thalia-201 nebo látek značených techneciem 99m (99m Tc-sestamibi) dovoluje posouzení relativního prokrvení jednotlivých oblastí myokardu v klidu a při zátěži. Radionuklidová ventrikulografie představuje alternativní metodu k neinvazivnímu posouzení funkce levé i pravé komory. Pokles ejekční frakce při zátěži vypovídá o ischémii myokardu (82).
Laboratorní vyšetření jsou uvedena výše v části o plicní hypertenzi. Zátěžové testy slouží k posouzení funkční kapacity, sledování účinku léčby a odhadu prognózy onemocnění.
Ledviny
Postižení ledvin je u SSc časté, většinou se projevuje pouze jako mírná ledvinná dysfunkce, která je v naprosté většině případů spojená s dobrou prognózou (83). Naproti tomu sklerodermická renální krize představuje akutní, těžkou a život ohrožující formu renální choroby. Postihuje 8–10 % nemocných SSc, avšak 10–20 % nemocných s difúzní formou choroby ve většině případů během prvních pěti let trvání nemoci (84). Renální krize je trombotická mikroangiopatie postihující ledviny a je podobná trombotické trombocytopenické purpuře/hemolyticko uremickému syndrom či antifosfolipidovému syndromu (85). Histologickým korelátem je proliferace a zesílení intimy arkuátních a interlobulárních renálních arteriol a glomerulů vedoucí k zúžení až obliteraci cév se vznikem typické koncentrické hypertrofie. Prognóza tohoto stavu je velmi závažná, před zavedením ACE inhibitorů zemřeli během jednoho roku takřka všichni nemocní s významnou renální nedostatečností. Základními klinickými nálezy u renální krize jsou: akutní renální selhání většinou bez předcházejících známek ledvinné choroby, náhlý vznik středně a významně vysoké hypertenze často doprovázené známkami maligní hypertenze (encefalopatie, retinopatie a selhání levé komory). Ve většině případů zjišťujeme pouze nenápadné změny v močovém sedimentu (mírná proteinurie a/nebo hematurie). Mezi rizikové faktory renální krize patří rychle progredující difúzní forma SSc, užívání glukokortikoidů ve vysokých dávkách, užívání cyklosporinu A a přítomnost protilátek proti RNA polymeráze (86, 87, 88). Přídatnými nálezy mohou být nový vznik proteinurie či hematurie, plicní edém, progrese anurie či oligurie a charakteristické histologické změny při ledvinné biopsii (89).
Základem přístupu k rizikovému pacientovi je prevence rozvoje renální krize, zavedení určitých opatření – viz tabulka 8 (90).
Tab. 8. Preventivní opatření při zvýšeném riziku rozvoje sklerodermické renální krize 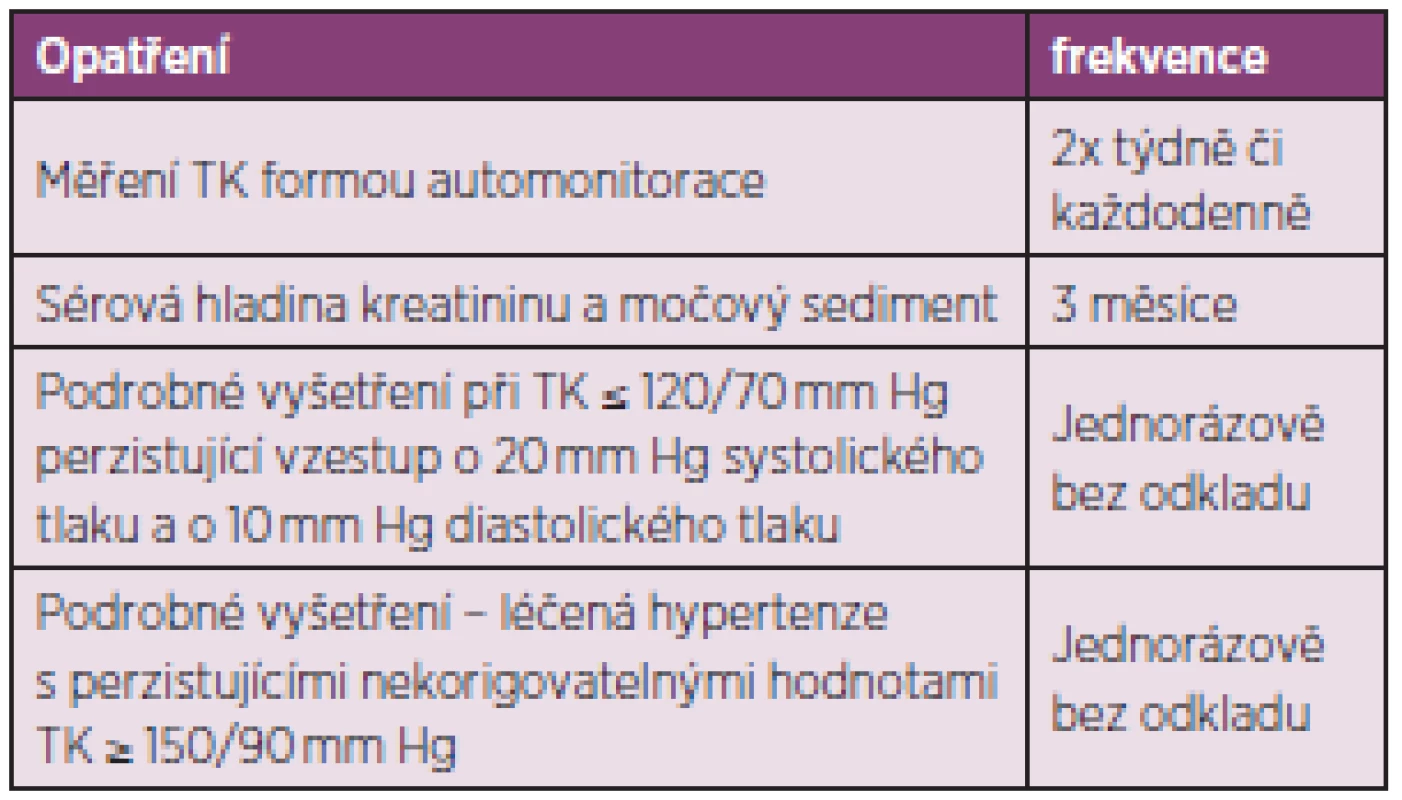
Systémová sklerodermie v dětském věku
V dětském věku je sklerodermie vzácné onemocnění – incidence SSc v dětství je 0,05/100 000 dětí (91). Mezi základní klinické projevy podobně jako u dospělé formy patří RF, kožní změny a poruchy činnosti vnitřních orgánů v důsledku cévních změn a nadměrného ukládání složek mezibuněčné hmoty. Průběh SSc u dětí má lepší prognózu než u dospělých pacientů a také menší prevalenci výskytu ACA. Mezi časné manifestace juvenilní SSc patří RF, nález autoprotilátek a kapilaroskopické změny na nehtových valech. Podle dosud publikovaných studií tato forma SSc začíná kolem 8. roku života (92).
Diagnóza dětské formy SSc se zakládá na příznacích, klinickém obraze a nálezech z postižených orgánů. Z velkých kohort nemocných vyšlo, že 75–97 % nemocných má pozitivní antinukleární protilátky, anti-Scl70 33 %, ACA méně než 10 %, RF do 20 % a výskyt autoprotilátek typických pro překryvné syndromy (anti-PMScl, anti-U1-RNP, anti-Ro) je velmi variabilní (93). Kožní biopsie se provádí jen zřídka. V histologickém obraze nacházíme hustou síť kolagenních vláken, ztrátu adnex a v časné fázi zánětlivý infiltrát složený z mononukleárů a mastocytů.
Orgánové vyšetření zahrnuje metody používané u dospělé formy nemoci (94). Základem je skiagram hrudníku, spirometrie a DLCO, dále ekg a echokardiogram. U pacientů neschopných spirometrie, nebo s již prokázanou ventilační poruchou, je indikováno HRCT hrudníku. Jelikož většina nemocných má postižení horní části trávicího traktu, všechna vyšetření této části ukazují patologické nálezy. Při podezření na malabsorpci se provádějí speciální testy. Radiogramy rukou mohou prokázat akroosteolýzu u jedinců se závažným RF a někdy také podkožní kalcifikace.
Pokud u nemocných zjišťujeme pouze RF a pozitivitu ANA, pak musíme odlišit juvenilní formy systémového lupus erythematodes, smíšeného onemocnění pojiva, dermatomyozitidy a různých překryvných syndromů (95, 96).
Pediatrická revmatologická evropská společnost vytvořila předběžná klasifikační kritéria pro juvenilní SSc (tab. 9) (97). Přítomnost velkého a dvou malých kritérií u pacienta mladšího 16 let stačí k určení diagnózy juvenilní SSc se senzitivitou 90 % a specificitou 96 %.
Tab. 9. Předběžná klasifikační kritéria pro juvenilní systémovou sklerodermii (upraveno dle Zuliana a spol.) (96). 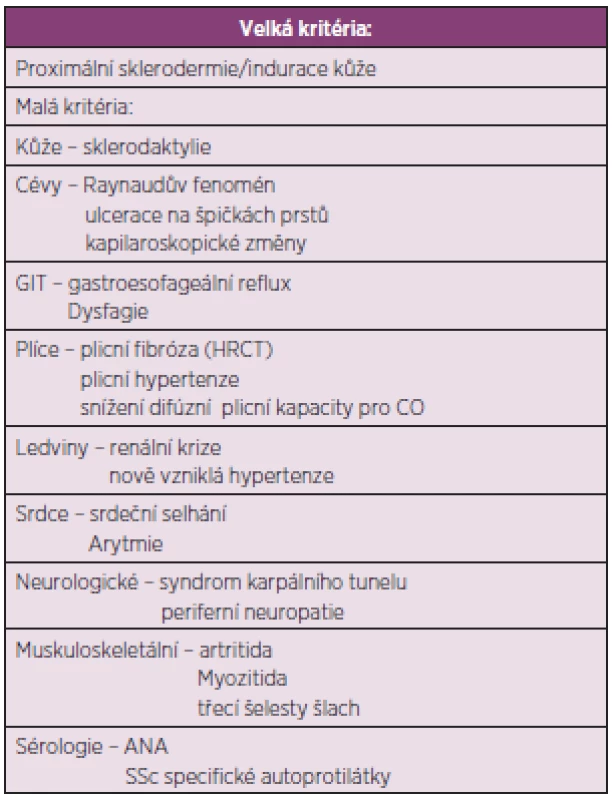
Diagnóza juvenilní lokalizované sklerodermie se obvykle stanovuje na základě typických kožních změn. Předběžná kritéria pro lokalizovanou formu sklerodermie jsou uvedena v tabulce 10 (98).
Tab. 10. Předběžná kritéria pro lokalizovanou formu sklerodermie (upraveno dle Zuliana a spol.) (93). 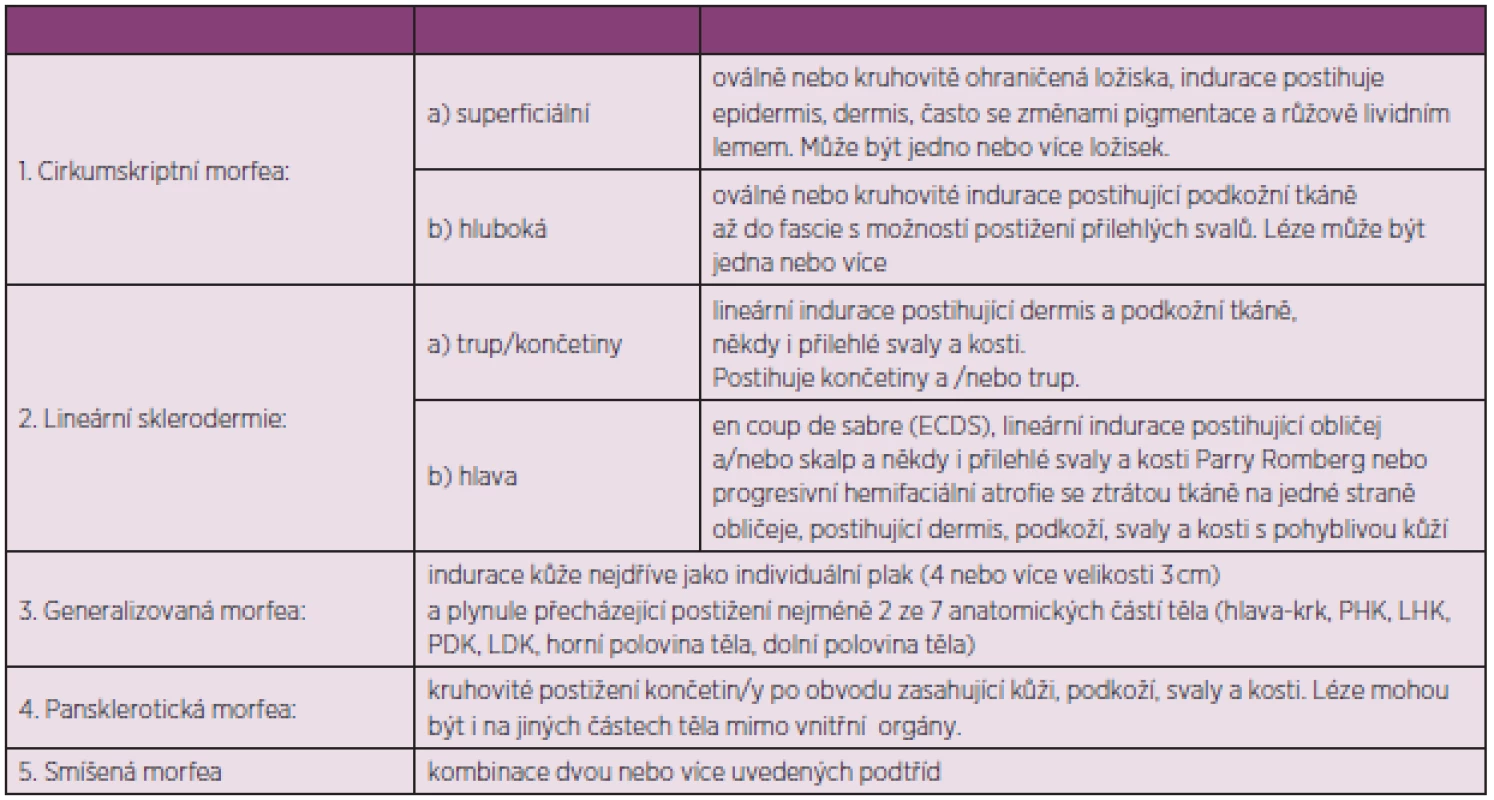
Kožní biopsie se provádí pouze v nejasných případech. Histologické změny se neliší od nálezů při SSc Jiná kožní onemocnění mohou mít podobný obraz, jak uvedeno v části o kožních změnách u SSc. I když se jedná převážně o kožní onemocnění, velká nadnárodní studie prokázala, že pacienti s juvenilní lokalizovanou sklerodermií mohou mít v nízkém procentu postižení kloubů a vnitřních orgánů (nervy, cévy, plíce, trávicí trakt a oči). Laboratorní vyšetření jsou obvykle nespecifická, zjišťujeme někdy lehké zvýšení FW a CRP (94). Někdy při aktivních lézích zachytíme eozinofilii a hypergamaglobulinémie. Revmatoidní faktory bývají přítomny u 10–25 % a celkové ANA asi u 50 % případů, pozitivita anti-Scl-70 a ACA je neobvyklá.
Tato doporučení byla vypracována za podpory projektu Ministerstva zdravotnictví ČR koncepčního rozvoje výzkumné organizace č. 023728 (Revmatologický ústav).
Adresa pro korespondenci:
Doc. MUDr. Radim Bečvář, CSc.,
Revmatologický ústav
Na Slupi 4
128 50 Praha 2
tel. +420 234 075 101
e-mail: becvar@revma.cz
Zdroje
1. Štork J: Sklerodemie. Galen, Praha, 1996, 8–10.
2. D´Angelo W, Fries JF, Masi AR, Schulman LE. Pathologic observations in systemic sclerosis. Am J Med 1969; 46 : 428–39.
3. Ferri C, Valentini G, Cozzi F, et al. Systemic sclerosis: demographic, clinical, and serologic features and survival in 1,012 Italian patients Medicine (Baltimore) 2002; 81 : 139–53.
4. Van den Hoogen FH, Khanna D, Fransen J, et al. 2013 classification criteria for systemic sclerosis: an American College of Rheumatology/European League Against Rheumatism collaborative initiative. Arthritis Rheum 2013; 65 : 2737–47.
5. Masi, AT., Rodnan, GP., Medsger, jr, TA. et al. Subcommittee for scleroderma criteria of American Rheumatism Association diagnostic and therapeutic criteria committee. Preliminary criteria for the classification of systemic sclerosis (scleroderma). Arthritis Rheum 1980; 23 : 581-590.
6. Boin F, Rosen A. Autoimmunity in systemic sclerosis: current concepts, Curr Rheumatol Rep 2007; 9 : 165–172.
7. Minier T, Guiducci S, Bellando-Randone S, and the EUSTAR co-workers. Preliminary analysis of the Very Early Diagnosis of Systemic Sclerosis (VEDOSS) EUSTAR multicentre study: evidence for puffy fingers as a pivotal sign for suspicion of systemic sclerosis. Ann Rheum Dis published online August 12, 2013.
8. Korn JH. Raynaud’s phenomenon, scleroderma, overlap syndromes, and other fibrosing syndromes. Curr Opin Rheumatol 2000; 12 : 509–10.
9. Cutolo M, Grassi W, Matucci-Cerinic M. Raynaud´s phenomenon and the role of capillaroscopy. Arthritis Rheum 2003; 48 : 3023–30.
10. Bergman R, Sharony R, Schapira D, et al. The hand-held dermatoscope as a nailfold capillaroscopic instrument. Arch Dermatol 2003; 139 : 1027–30.
11. Herrick A. Diagnosis and management of scleroderma peripheral vascular disease. Rheum Dis Clin N Am 2008; 34 : 89–114.
12. Matucci-Cerinic M, Allanore Y, Czirják L, et al. The challenge of early systemic sclerosis for the the EULAR Scleroderma Trial and research group (EUSTAR) community. It is time to cut the gordian knot and develop a prevention er rescue strategy. Ann Rheum Dis 2009; 68 : 1377–80.
13. Chung L, Fiorentino D. Digital ulcers in patients with systemic sclerosis. Autoimmun Rev 2006; 5 : 125–8.
14. Hunzelmann N, Genth E, Krieg T, et al. The registry of the German Network for Systemic Scleroderma. frequency of disease subsets and patterns of organ involvement. Rheumatology (Oxford) 2008; 47 : 1185–92.
15. Szücz G, Tinar O, Szekanecz Z, et al. Endotelial dysfunction precedes atherosclerosis in systemic sclerosis-relevance for prevention of vascular complications. Rheumatology 2007; 46 : 759–62.
16. Veale DJ, Collidge TA, Belch JJF. Increased prevalence of symptomatic macrovascular disease in systemic sclerosis. Ann Rheum Dis 1995;5 4 : 853–5.
17. Stucker M, Quinna S, Memmel U, et al. Macroangiopathy of the upper extremities in progressive systemic sclerosis. Eur J Med Res 2000; 5 : 295–302.
18. Jenwski B. Arteries of the hand in patients with scleroderma. Diagn Imaging Clin Med 1986;5 5 : 262–5.
19. Dabich L, Bookstein JJ, Zweifler A, Zarafonetis CJ. Digital arteries with scleroderma arteriographic and plethysmographic study. Arch Intern Med 1972; 130 : 708–14.
20. Hasegawa M, Nagai Y, Tamura A, et al. Arteriographic evaluation of vascular changes of the extremities in patients with systemic sclerosis. Br J Dermatol 2006; 155 : 1159–64.
21. Štork J, Bečvář R: Systémová sklerodermie. Postgrad Med 1999;1 : 91-5.
22. Štork J., Bečvář R.: Hodnocení závažnosti a aktivity systémové sklerodermie. Čes slov Derm 2004; 79 : 213–7.
23. Weinstein CL, Miller MH, Kossard S, Littlejohn GO. The scleroderma neck sign. J Rheumatol 1989; 16 : 1533–5.
24. Hunzelmann N, Genth E, Krieg T, et al. Organspezifische Diagnostik von Patienten mit systemischer Sklerodermie. Z Rheumatol 2008; 67 : 334–40.
25. Kissin EY, Schiller AM, Gelbard RB, et al. Durometry for the assessment of skin disease in systemic sclerosis. Arthritis Rheum 2006; 55 : 603–9.
26. Randone SB, Guiducci S, Definic MM. Musculosceletal involvement in systemic sclerosis. Best Practice &Research 2008; 22 : 339–50.
27. Steen VD, Medsger TA Jr. The palpable tendon fiction rub: Important physical examination findings in patiens with systemic sclerosis. Arthritis Rheum 1997; 40 : 1146–51.
28. Doran M, Wodswort P, Bresnihan B, et al. A distinct syndrome including features of systemic sclerosis, erosive rheumatoid arthritis, antitopoisomerase antibody, and rheumatoid factor. J Rheumatol 2001; 28 : 921–2.
29. Boutry N, Hachulla E, Zanetti-Musielak C, et al. Imaging features of musculoskeletal involvement in systemic sclerosis. Eur radiol 2007; 17 : 1172–80.
30. Firestein GS, Budd RC, Harris D et al: Kellys Textbook of Rheumatology. 8th edition.Saunders Elsevier, Philadelphia 2009; 861–75.
31. Abu-Shakra M, Guillemin F, Lee P: Gastrointestinal manifestations of systemic sclerosis. Semin Arthritis Rheum 1994; 24 : 29–39.
32. Marie I. Gastrointestinal involvement in systemic sclerosis. Presse Med 2006; 35 : 1952–65.
33. Bassotti G, Battaglia E, Debernardi V et al. Esophageal dysfunction in scleroderma: Relationship with disease subsets. Arthritis Rheum 1997; 40 : 2252–94.
34. Park RH, McKillop JH, Belch JJ, Faichney A, MacKenzie JF. Achalasia-like syndrome in systemic sclerosis. Br J Surg 1990; 77 : 46–9.
35. Marie I, Ducrotte P, Antonietti M, Herve S, Levesque H. Watermelon stomach in systemic sclerosis: its incidence and management. Aliment Pharmacol Ther 2008; 28 : 412–21.
36. Greydanus MP, Camilieri M. Abnormal postcibal antral and small bowel motility due to neuropathy or myopathy in systemic sclerosis. Gastroenterology 1989; 96 : 110–5.
37. Rohrman CA Jr, Ricci MT, Krishnamurthy S, Shuffler MD. Radiologic and histologic differentiation of neuromuscular disorders of the gastrointestinal tract: visceral myopathies, visceral neuropathies, and progressive systemic sclerosis. Am J Roentgenol 1984; 143 : 933–41.
38. Netscher DT, Richardson JD. Complications requiring operative intervention in scleroderma. Surg Gynecol Obstet 1984; 158 : 507–12.
39. Akesson A, Akesson B, Gustafson T, Wollheim F. Gastrointestinal function in patients with progressive systemic sclerosis. Clin Rheumatol 1985; 4 : 441–8.
40. Witchead WE, Taitelbaum G, Wigley FM, Schuster MM. Rectosigmoid motility and myoelectric activity in progressive systemic sclerosis. Gastroenterology 1989; 96 : 428–32.
41. Basilisco G, Berbera R, Vanoli M, Bianchi P. Anorectal dysfunction and delayed colonic transit in patients with progressive systemic sclerosis. Dig Dis Sci 1993; 38 : 1525–9.
42. Baron M, Srolovitz H. Colonic telangiectasias in a patient with progressive systemic sclerosis. Arthriti Rheum 1986; 29 : 282–5.
43. Leighton JA, Valdovinos MA, Pemberton JH, Rath DM, Camilieri M. Anorectal dysfunction and rectal prolapse in progressive systemic sclerosis. Dis Colon Rectum 1993; 36 : 182–5.
44. Rose S, Young MA, Reynolds JC. Gastrointestinal manifestation of scleroderma. Gastroenterol Clin North Am 1998; 27 : 563–94.
45. Greif JM, Wolff WI. Idiopathic calcific pancreatitis, CREST syndrome and progressive systemic sclerosis. Am J Gastroenterol 1979; 71 : 177–82.
46. Abraham AA, Joos A. Pancreatic necrosis in progressive systemic sclerosis. Ann Rheum Dis 1980; 39 : 396–8.
47. Fuller L,Huprich JE, Theisen J, et al. Abnormal esophageal body function: Radiographic manometric correlation. Am Surg 1999; 65 : 911–4.
48. Clouse RE, Staiano A. Contraction abnormalities of the esophageal body in patients referred for manometry. A new approach to manometric classification. Dig Dis Sci 1983; 28 : 784–91.
49. Khurana RK, Schuster MM. Autonomic dysfunction in chronic intestinal pseudo-obstruction. Clin Auton Res 1998; 8 : 335–40.
50. Clements PJ. Systemic sclerosis (scleroderma) and related disorders: Clinical aspects. Bailliers Best Pract Res Clin Rheumatol 2000; 1–16.
51. Veeraraghavan S, Nicholson AG, Nells AV. Lung fibrosis: New classification and therapy. Curr Opinion Rheumatol 2001; 13 : 500–4.
52. Schurawitzki H, Stiglbauer R, Graninger W et al. Interstitial lung disease in progressive systemic sclerosis: High-resolution CT versus radiography. Radiology 1990; 176 : 755–9.
53. Warrick JH, Bhalla M, Schabel SI, Silver RM. High-resolution computed tomography in early scleroderma lung disease. J Rheumatol 1991; 18 : 1520–8.
54. Wells AU, Hansell DM, Corrin B et al. High resolution computed tomography as a predictor of lung histology in systemic sclerosis. Thorax 1992; 47 : 738–42.
55. Diot E, Boissinot E, Asquier E et al. Relationship between abnormalities on high-resolution CT and pulmonary function in systemic sclerosis. Chest 1998; 114 : 1623–9.
56. Steen VD, Conte C, Owens GR, Medsger TA. Severe restrictive lung disease in systemic sclerosis. Arthritis Rheum 1994; 37 : 1283–9.
57. Wells AU, Hansell DM, Rubens MB, Cullinan P, Black CM, du Bois RM. The predictive value of appearances on thin-section computed tomography in fibrosing alveolitis. Am Rev Respir Dis 1993; 148 : 1076–82.
58. Silver RM, Miller KS, Kinsella MB, Smith EA, Schabel SI. Evaluation and management of scleroderma lung disease using bronchoalveolar lavage. Am J Med 1990; 88 : 470–6.
59. Behr J, Vogelmeier C, Beinert T, Meuerer M, Krombach F, Konig G, Fruhmann G. BAL evaluation and management of scleroderma disease of the lung. Am J Resp Crit Care Med 1996; 154 : 400–6.
60. Wells AU, Hansell DM, Harisson NK, Lawrence R, Black CM, du Bois RM. Clearance of inhaled 99 mTc DTPA predicts the clinical course of fibrosing alveolitis. Eur Resp J 1993; 6 : 797–802.
61. Kon OM, Daniil Z, Black CM, du Bois RM. Clearance of inhaled technetium-99m-DTPA as a clinical index of pulmonary vascular disease in systemic sclerosis. Eur Respir J 1999; 13 : 133–6.
62. Paredi P, Kharitonov SA, loukides s, Pantelidis P, du Bois RM, Barnes PJ. Exhaled nitric oxide is increased in active fibrosing alveolitis. Chest 1999; 115 : 1352–6.
63. Moodley YP, Lalloo UG. Exhaled nitric oxide is elevated in patients with systemic sclerosis without interstitial lung disease. Chest 2001; 119 : 1449–54.
64. Bouros D, Wells AU, Nicholson AG, et al. Histopathologic subsets of fibrosing alveolitis in patients with systemic sclerosis and their relationship to outcome. Am J Resp Crit Care Med 2002; 165 : 1581–6.
65. Simonneau G, Galie N, Rubin LJ et al. Clinical classification of pulmonary hypertension. J Am Coll Cardiol 2004; 43 : 5S–12S.
66. Farber HW, Loscalzo J. Pulmonary arterial hypertension – mechanism of disease. N Engl J Med 2004; 351 : 1655–65.
67. Mukerjee D, St George D, Coleiro B, et al.: Prevalence and outcome in systemic sclerosis associated pulmonary arterial hypertension: application of a registry approach. Ann Rheum Dis 2003; 62 : 1088–93.
68. Galie N, Manes A, Farahani KV, et al. Pulmonary arterial hypertension associated to connective tissue diseases. Lupus 2005; 14 : 713–7.
69. Rubin LJ. Primary pulmonary hypertension. Chest 1993; 104 : 236–50.
70. Daniels LB, Krummen DE, Blanchard DG. Echocardiography in pulmonary vascular disease. Cardiol Clin 2004; 22 : 383–99.
71. McGoon M, Gutterman D, Steen V, et al. Screening, early detection, and diagnosis of pulmonary arterial hypertension. Chest 2004; 126 : 14S–34S.
72. Humbert M, Sitbon O, Chaouat A, et al. Pulmonary arterial hypertension in France. Results from a national registry. Am J Respir Crit Care Med 2006; 173 : 1023–30.
73. Champion HC. The heart in scleroderma. Rheum Dis Clin North Am 2008; 34 : 181–8.
74. Steen V. The heart in systemic sclerosis. Curr Rheumatol Rep 2004; 6 : 137–140.
75. Follansbee WP, Miller TR, Curtiss EI, et al. A controlled clinicopathologic study of myocardial fibrosis in systemic sclerosis (scleroderma). J Rheumatol 1990; 17 : 656–62.
76. Overbeek MJ, Mouchaers KT, Niessen HM, et al. Characteristics of interstitial fibrosis and inflammatory cell infiltration in right ventricles of systemic sclerosis-associated pulmonary arterial hypertension. Int J Rheumatol 2010. Epub 2010 Sep 30.
77. Bouciz A, Mathai SC, Hummers LK, et al. Cardiac complications of systemic sclerosis: recent progress in diagnosis. Curr Opin Rheumatol 2010; 22 : 696–703.
78. Fröhlich GM, Keller P, Schmid F, et al. Haemodynamically irrelevant pericardial effusion is associated with increased mortality in patients with chronic heart failure. Eur Heart J 2013; 34 : 1414–23.
79. Smith J, Clements P, Levisman J, et al. Echocardiographic features of progressive systemic sclerosis (PSS). Correlation with hemodynamic and postmortem studies. Am J Med 1979; 66 : 28–33.
80. Draeger HT, Assassi S, Sharif R, et al. Right bundle branch block: a predictor of mortality in early systemic sclerosis. PLoS One 2013 Oct 31; 8(10): e78808.
81. Špinar J, Hradec J, Meluzín J, Páč J, et al. Doporučení pro diagnostiku a léčbu chronického srdečního selhání ČKS 2006. Cor Vasa 2004; 46 : 24–34.
82. Ferri C, Emdin M, Nielsen H, et al. Assessment of heart involvement. Clin Exp Rheumatol 2003; Suppl 21 : 24–8.
83. Steen VD, Syzd A, Johnson JP, et al. Kidney disease other than renal crisis in patients with diffuse scleroderma. J Rheumatol 2005; 32 : 649–55.
84. Traub YM, Shapiro AP, Rodnan GP, et al. Hypertension and renal failure (scleroderma renal crisis) in progressive systemic sclerosis. Review of a 25-year experience with 68 cases. Medicine (Baltimore) 1983; 62 : 335–52.
85. Shapiro AP, Medsger TA Jr. Renal involvement in systemic sclerosis. In: Diseases of Kidney, 4th ed, Schrier, R,Gottschalk, C (Eds), Little, Brown, Boston, 1988, 2272–81.
86. Steen VD, Medsger TA Jr. Case-control study of corticosteroids and other drugs that either precipitate or protect from the development of scleroderma renal crisis. Arthritis Rheum 1998; 41 : 1613–9.
87. DeMarco PJ, Weisman MH, Seibold JR, et al. Predictors and outcomes of scleroderma renal crisis: the high dose versus low dose D-penicillamine in early diffuse systemic sclerosis trial. Arthritis Rheum 2002; 46 : 2983–9.
88. Denton CP, Abdullah A, Black CM. Acute renal failure occurring in scleroderma treatment with cyclosporin A: A report of three cases. Br J Rheumatol 1994; 33 : 90–92
89. Teixeira L, Mouthon, L, Mahr A, et al. Mortality and risk factors of scleroderma renal crisis: a French retrospective study of 50 patients. Ann Rheum Dis 2008; 67 : 110–6.
90. Steen VD, Medsger TA, Osial TA, et al. Factors predicting development of renal involvement in progressive systemic sclerosis. Am J Med 1984; 76 : 759–62.
91. Zulian F, Martini G. Childhood systemic sclerosis. Curr Opin Rheumatol 2007; 19 : 592–7.
92. Martini G, Foeldvari I, Russo R, Cuttica R, et al. (Juvenile Scleroderma Working Group of the Pediatric Rheumatology European Society). Systemic sclerosisin childhood: clinical and immunological features of 153 patients in an international database. Arthritis Rheum 2006; 54 : 3971–8.
93. Zulian F, Woo P, Athreya BH, et al. The Pediatric Rheumatology European Society/American College of Rheumatology/European League against Rheumatism provisional classification criteria for juvenile systemic sclerosis. Arthritis Rheum 2007;57 : 203–12.
94. Zulian F. Systemic and localized scleroderma in childhood.. Rheum Dis Clin North Am 2008; 34 : 239–55.
95. Girschick HJ. Scleroderma in childhood and adolescence. New aspects on classification, etiology and therapy. Z Rheumatol 2008; 67 : 128–36.
96. Foeldvari I. Update on pediatric systemic sclerosis: similarities and differences from adult disease. Curr Opin Rheumatol 2008; 20 : 608–12.
97. Zulian F, Vallongo C, Woo P, et al (Juvenile Scleroderma Working Group of the Pediatric Rheumatology European Society) - (PRES). Localized scleroderma in childhood is not just a skin disease. Arthritis Rheum 2005; 52 : 2873–81.
Foeldvari I. Current developments in pediatric systemic sclerosis. Curr Rheumatol Rep 2009; 11 : 97–102.
Štítky
Dermatologie Dětská revmatologie Revmatologie
Článek vyšel v časopiseČeská revmatologie
Nejčtenější tento týden
2014 Číslo 2- Isoprinosin je bezpečný a účinný v léčbě pacientů s akutní respirační virovou infekcí
- Kterým pacientům se SLE nasadit biologickou léčbu?
- Stillova choroba: vzácné a závažné systémové onemocnění
- Jak souvisí časné zahájení biologické léčby SLE/LN s prevencí nevratného poškození?
-
Všechny články tohoto čísla
- Periferní ulcerózní keratitida – závažná komplikace revmatoidní artritidy
- Myozitida s inkluzními tělísky asociovaná s revmatoidní artritidou – kazuistika
- Doporučení České revmatologické společnosti pro diagnostiku systémové sklerodermie
- Doporučení EULAR pro léčbu revmatoidní artritidy - rozdíly mezi verzí 2013 a 2010
- Metatarzalgie u pacientů s revmatoidní artritidou
- 18F-FDG PET a PET/CT vyšetření u pacientů s obrovskobuněčnou arteritidou – praktický pohled z PET centra
- Česká revmatologie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Metatarzalgie u pacientů s revmatoidní artritidou
- Periferní ulcerózní keratitida – závažná komplikace revmatoidní artritidy
- Doporučení České revmatologické společnosti pro diagnostiku systémové sklerodermie
- 18F-FDG PET a PET/CT vyšetření u pacientů s obrovskobuněčnou arteritidou – praktický pohled z PET centra
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



